JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
개방형 협업 학습의 뇌 간 싱크로니: fNIRS 하이퍼스캐닝 연구
요약
자연주의 학습 환경에서 협업 학습 dyads에 대한 fNIRS 하이퍼스캐닝 실험을 수행하기 위한 프로토콜이 설명되어 있습니다. 또한, 산소헤모글로빈(Oxy-Hb) 신호의 뇌 간 싱크로니(IBS)를 분석하는 파이프라인이 제시된다.
초록
fNIRS 과초 스캐닝은 사회적 상호 작용의 신경 생물학적 기초를 검출하기 위하여 널리 이용됩니다. 이 기술을 사용하여, 연구원은 뇌 간 동기화 (IBS)에게 불린 새로운 색인을 가진 2 개 이상의 대화 형 개별의 동시 두뇌 활동을 자격 (즉, 단계 및/또는 시간에 걸쳐 신경 또는 혈역학 신호의 진폭 정렬). 자연주의 학습 환경에서 협업 학습 다이드에 대한 fNIRS 하이퍼스캐닝 실험을 수행하기 위한 프로토콜이 여기에 제시되어 있습니다. 또한, 산소헤모글로빈(Oxy-Hb) 신호의 IBS를 분석하는 파이프라인이 설명된다. 구체적으로는 실험 설계, NIRS 데이터 기록 프로세스, 데이터 분석 방법 및 향후 방향에 대해 모두 설명합니다. 전반적으로 표준화된 fNIRS 하이퍼스캐닝 파이프라인을 구현하는 것은 2인칭 신경 과학의 근본적인 부분입니다. 또한, 이것은 연구의 재현성을 돕기 위해 오픈 사이언스에 대한 요구와 일치합니다.
서문
최근에는 대화형 다이드 또는 그룹의 구성원에 걸쳐 동시 뇌 활동을 밝히기 위해 연구자들은 하이퍼스캐닝 접근법1,2를사용합니다. 구체적으로, 뇌전도(EEG), 기능성 자기 공명 영상(fMRI), 및 기능적인 근적외선 분광법(fNIRS)은 2개 이상의 피험자로부터 신경 및 뇌 활동을 동시에 기록하는 데 사용된다3,4,5. 연구원은 이 기술에 근거를 둔 동시 두뇌 결합을 수반하는 신경 색인을 추출합니다, 이는 뇌 간 동기화를 지칭합니다 (IBS) (즉, 단계 및/또는 시간에 걸친 신경 또는 혈역학 신호의 진폭 정렬). 다양한 하이퍼스캐닝 연구는 여러 개인(예: 플레이어-청중, 강사-학습자 및 리더-추종자) 간의 사회적 상호 작용 중에IBS를발견6,7,8. 또한 IBS는 효과적인 학습 및 교육9,10,11,12,13,14의구체적인 의미를 갖는다. 자연주의 학습 시나리오에서 하이퍼스캐닝 연구가 급증하면서 하이퍼스캐닝 실험의 표준 프로토콜과 이 분야의 데이터 분석 파이프라인을 수립하는 것이 필요합니다.
따라서 이 백서는 협업 학습 dyads의 fNIRS 기반 하이퍼스캐닝을 수행하기 위한 프로토콜과 IBS 분석을 위한 파이프라인을 제공합니다. fNIRS는 헤모글로빈의 스펙트럼 흡수를 간접적으로 평가하기 위해 근적외선을 방사하는 광학 이미징 도구이며, 그 후 혈역학/산소 화 활성은15,16,17로측정된다. fMRI와 비교하여 fNIRS는 모션 아티팩트에 덜 걸리며 실제 실험(예: 모방, 말하기 및 비언어적 의사 소통)을 수행하는 피사체로부터 측정할 수 있습니다(예: 모조, 말하기 및 비언어적 의사 소통)18,7,19. EEG와 비교하여 fNIRS는 더 높은 공간 해상도를 보유하여 연구원이 뇌 활동20의위치를 감지할 수 있도록 합니다. 따라서, 공간 해상도, 물류 및 타당성에서 이러한 장점은 하이퍼스캐닝 측정1을수행하기 위해 fNIRS를 받을 자격이 있다. 이 기술을 사용하여, 신흥 연구 기관은 IBS-2 (또는 그 이상의) 사람들의 뇌 활동의 신경 정렬로 인덱스 용어를검출 - 자연주의 사회 설정의 다른 형태의 자연주의 사회 설정9,10,11,12,13,14. 이러한 연구에서는 다양한 방법(즉, 상관 관계 분석 및 웨이브렛 변환 일관성(WTC) 분석)이 이 인덱스를 계산하기 위해 적용됩니다. 한편, 이러한 분석에 대한 표준 파이프라인은 필수적이지만 부족합니다. 그 결과, FNIRS 기반 하이퍼캐닝을 수행하기 위한 프로토콜과 WTC 분석을 사용하여 IBS를 식별하는 파이프라인이 이 작업에 제시됩니다.
이 연구는 fNIRS 하이퍼스캐닝 기술을 사용하여 협업 학습 다이드에서 IBS를 평가하는 것을 목표로 합니다. 첫째, 혈역학적 반응은 협업 학습 작업 중에 각 다이드의 전두엽 및 왼쪽 템포로파리탈 영역에서 동시에 기록됩니다. 이들 지역은 대화형 교육 및 학습9,10,11,12,13,14와연관된 것으로 확인되었다. 둘째, IBS는 각 해당 채널에서 계산됩니다. fNIRS 데이터 레코딩 프로세스는 휴식 상태 세션과 공동 작업 세션의 두 부분으로 구성됩니다. 휴식 상태 세션은 5 분 동안 지속되며, 두 참가자 (테이블 (0.8 m)로 서로 떨어져 대면하는 동안 여전히 유지되고 휴식을 취해야합니다. 이 휴쉬 상태 세션은 기준선으로 제공됩니다. 그런 다음, 공동 세션에서 참가자들은 전체 학습 자료를 함께 연구하고 이해를 유도하고 규칙을 요약하며 모든 학습 자료를 마스터하도록 하라는 말을 들었습니다. 여기서, 실험 및 fNIRS 데이터 분석을 수행하는 구체적인 단계가 제시된다.
프로토콜
모든 모집 참가자 (40 dyads, 평균 연령 22.1 ± 1.2 년, 100 % 오른손잡이; 정상 또는 정상 시현)은 건강했습니다. 실험 전에 참가자들은 정보에 입각한 동의를 했습니다. 참가자들은 그들의 참여에 대해 재정적으로 보상을 받았습니다. 연구 결과는 인간 연구 보호의 대학 위원회에 의해 승인되었습니다 (HR-0053-2021), 동중국 사범 대학.
1. 데이터를 채택하기 전에 준비 단계
- 수제 NIRS 캡
- 탄성 수영 캡을 채택하여 광엽 홀더 그리드를 배치합니다.
참고: 참가자의 머리 크기가 다르다는 점을 고려하면 두 가지 크기의 캡이 사용됩니다. 작은 캡은 55.4 ± 1.1cm의 머리 둘레를 가진 참가자를 위해 준비되어 있으며, 큰 모자는 57.9 ± 1.2cm의 머리 둘레를 가진 참가자를위한 것입니다. - EEG 전극(이온, Cz, T3, T4, Fpz 및 P5)의 위치를 탄성 수영 캡의 표준 국제 10-10 시스템에 따라 참조 검소장치로 고정합니다(재료표참조).
- 먼저, 표준 10-10 EEG 캡(재료표참조)을 헤드 몰드에 놓고, EEG 캡에 탄성 수영 캡을 놓습니다. 둘째, 각 캡에 분필이 있는 참조 검소(이온, Cz, T3, T4, Fpz 및 P5)를 표시합니다. 마지막으로, 직경 약 15mm의 두 개의 구멍을 잘라 두 개의 참조 검소(즉, Fpz 및 P5, 도 1)를배치합니다.
참고: 구체적으로, 3 x 5 검안 프로브 세트와 4 x 4 검소 프로브 세트는 전두엽 영역(참조 검소는 Fpz, 도 1B에배치) 및 왼쪽 템포로 파리탈 영역(참조 검소한 검정은 P5, 도 1B에배치)에 별도로 배치된다.
- 먼저, 표준 10-10 EEG 캡(재료표참조)을 헤드 몰드에 놓고, EEG 캡에 탄성 수영 캡을 놓습니다. 둘째, 각 캡에 분필이 있는 참조 검소(이온, Cz, T3, T4, Fpz 및 P5)를 표시합니다. 마지막으로, 직경 약 15mm의 두 개의 구멍을 잘라 두 개의 참조 검소(즉, Fpz 및 P5, 도 1)를배치합니다.
- 다른 검소를 배치구멍을 잘라. 헤드 몰드에 직접 두 개의 그리드 홀더가 있는 수영 캡을 정렬합니다. 그런 다음 다른 검안의 위치를 분필로 표시합니다. 그 후, 그리드 홀더가 맞는지 확인하기 위해 나머지 구멍을 잘라.
- 수영 대수에 두 개의 프로브 세트(예: 3 x 5 및 4 x 4)를 마운트합니다(재료 표참조).
참고: NIRS 측정 시스템(재료 표참조)은 30mm 광차 분리를 보장하는 표준 홀더 소켓이 있는 표준 프로브 세트(예: 3 x 5 및 4 x 4)를 제공합니다. - NIRS 측정 시스템에서 프로브 세트 모니터 창을 열고 각 사람에 대해 3 x 5 및 4 x 4로 배열된 4개의 프로브 세트를 별도로 선택합니다.
참고: 두 캡의 프로브 배열은 프로브 세트 창(즉, 수신기 프로브 번호 및 각 방출기의 정확한 위치)의 구조와 일치해야 합니다.
- 탄성 수영 캡을 채택하여 광엽 홀더 그리드를 배치합니다.
- 실험 준비
- 데이터를 기록하기 전에 NIRS 시스템이 최소 30분 동안 시스템을 시작하여 안정적인 작동 온도를 유지하도록 합니다.
참고: 안정적인 작동 온도는 5°C에서 35°C사이입니다. - 측정 모드를 이벤트 관련 측정으로 설정합니다. 트리거 수신기가 활성화되어 있는지 확인합니다(예: RS232 직렬 입력).
참고: 실험은 시판되는 심리학 소프트웨어로 프로그래밍됩니다(재료표참조). 근적외선의 흡수(파장 2개: 695 및 830 nm)는 10Hz의 샘플링 속도로 측정됩니다. - 머리를 옆으로 움직이는 데 사용할 수있는 조명 광섬유 프로브를 준비하십시오.
- 두 개의 의자가 있는 테이블 한 개로 실험 환경을 설정하여 참가자의 좌석을 대면하게 합니다.
- 데이터를 기록하기 전에 NIRS 시스템이 최소 30분 동안 시스템을 시작하여 안정적인 작동 온도를 유지하도록 합니다.
2. 참가자에게 지시하여 데이터 채택
- 참가자 준비
- 참가자에게 NIRS 측정 방법의 세부 정보를 포함하여 지시합니다.
참고: 모든 참가자는 건강했으며 참여에 대한 재정적 보상을 받았습니다. 어떤 참가자도 실험을 중간에 철회하지 않았습니다. NIRS의 레이저 빔은 참가자의 눈에 해로울 수 있으며, 그 레이저 빔을 직접 조사하지 말라고 지시받았습니다. - 참가자들이 직접 서로를 볼 수 있도록(테이블(0.8m 제외)을 직접 대면하도록 합니다. 의자 대 테이블 거리(예: 거의 0.3m)를 조정하여 참가자들이 편안하게 앉을 수 있도록 합니다.
- 레이저 버튼을 켜고 프로브가 참가자의 머리에 놓는 캡을 놓습니다.
참고: 3 x 5 프로브 세트는 참가자의 이마를 덮습니다(아래 줄의 중간 프로브는 Fpz에 배치됨) 4 x 4 프로브 세트는 왼쪽 템포로 파리탈 피질을 덮습니다(세 번째 행의 세 번째 프로브는 P5에 배치됩니다). - 참가자 나 의자와 접촉하지 않고 홀더의 팔에 느슨하게 네 개의 광섬유 번들을 넣어.
참고: NIRS 측정 시스템에는 4개의 광섬유 번들이 있습니다. 또한 참가자가 너무 무거워서 모자를 벗지 않도록 하십시오. - 프로브 팁은 각 스프링 하중 프로브를 소켓에 더 밀어 참가자들의 두피를 만지게 하십시오.
- 신호 보정을 수행합니다.
- 먼저 fNIRS 기계의 프로브 세트 모니터 창에서 자동 게인을 클릭하여 신호의 품질을 확인합니다. 그런 다음 채널의 잘못된 신호와 충분한 신호가 프로브 세트 모니터 창에서 노란색과 녹색으로 표시됩니다.
참고: 신호가 부족한 채널의 경우 조명광섬유 프로브를 사용하여 프로브의 끝 아래머리카락을 한쪽으로 이동합니다. - 그런 다음 프로브를 소켓에 더 밀어 넣고 충분한 신호를 가져옵니다. 모든 채널이 NIRS 측정 시스템의 프로브 세트 모니터 창에 녹색으로 표시될 때까지 이 프로세스를 반복하여 신호 품질에 액세스할 수 있음을 나타냅니다.
- 먼저 fNIRS 기계의 프로브 세트 모니터 창에서 자동 게인을 클릭하여 신호의 품질을 확인합니다. 그런 다음 채널의 잘못된 신호와 충분한 신호가 프로브 세트 모니터 창에서 노란색과 녹색으로 표시됩니다.
- 참가자에게 NIRS 측정 방법의 세부 정보를 포함하여 지시합니다.
- 실험 실행
- 기준선 역할을 하는 5분 휴식 상태로 실험을 시작합니다. 그런 다음 두 명의 참가자가 학습 자료를 공동 학습해야 합니다.
- 실험 후 텍스트 파일 아웃을 클릭하여 원시 광 강도 데이터를 내보내고 데이터를 텍스트 파일로 저장합니다.
참고: NIRS 측정 시스템에는 필터가 적용되지 않습니다. - 3차원(3D) 디지타이저(재료 표참조)를 사용하여 각 참가자에 대해 이미터, 수신기 및 기타 참조(예: 이온, nasion, Cz 및 왼쪽 및 오른쪽 귀)의 위치를 결정합니다.
- 상용 숫자 컴퓨팅플랫폼(21)을 사용하여 기록 채널에 대한 MNI 좌표를 가져옵니다(자료표참조). 보충 표 S1은 각 채널의 해당 해부학 적 위치를 나타낸다.
- 에탄올로 프로브와 프로브 홀더를 청소하십시오. 가벼운 세제로 캡을 씻고 캡을 공기 건조시키십시오.
3. 데이터 분석
- 데이터 전처리
참고: 이전 연구는 가변 비상업적 소프트웨어 패키지를 채택했습니다(예: Homer222, 분석IR23또는 니르 랩24숫자 컴퓨팅 플랫폼이 있는 경우(참조) 재료 테이블) fNIRS 데이터 분석에, 그들은 모두 웹 사이트에서 사용할 수 있습니다. 여기에 Homer2는 NIRS 데이터의 전처리를 수행하는 데 사용되었다. 또한 나머지에서 수집된 데이터를 기록하고 공동 학습 단계는 모두 동일한 전처리 및 분석 파이프라인을 공유합니다.- fNIRS 컴퓨터에서 데이터 집합을 복사합니다. 원래 데이터 형성을 적절한 형성으로 변환합니다(예: cvs 파일을 nirs 파일로 변환).
- 숫자 컴퓨팅 플랫폼에 제공된 "hmrIntensity2OD" 함수를 사용하여 원시 데이터를 광학 밀도(OD) 데이터로 변환합니다(재료 표참조).
- 잘못된 채널을 삭제합니다. 그런 다음 각 채널의 각 참가자에 대한 OD 값과 전체 샘플 포인트를 각각 평균값으로 평가합니다.
참고: 여기서평균 46개의 OD 값이 얻어진다.- 각 참가자에 대한 표준 편차(SD)를 계산합니다.
- 사용할 수 없는 것으로 표시하고 각 참가자에 대한 분석에서 매우 낮거나 높은 OD(5S를 초과한)로 채널을 제거합니다.
참고: 이 단계는 fNIRS 데이터 전처리 전후에 수행할 수 있습니다. 이 데이터 분석 파이프라인에서는 fNIRS 데이터 전처리 전에 잘못된 채널이 검색됩니다.
- OD 시간 데이터를 Oxy-Hb, DeOxy-Hb로 변환하고 수정된 맥주-램버트 법25에따라 결합된 신호로 변환합니다.
참고:참조(25)는 "모든 데이터 분석 단계는 Oxy-Hb 데이터에서 수행되며, 이는 지역 대뇌 혈류의 변화를 나타내는 지표로 신호 대 잡음비(26)가더 높다. 또한,이전 연구는 주로 Oxy-Hb 농도11, 12,13,14에초점을 맞춘 교육 및 학습 시나리오에서 fNIRS 하이퍼스캐닝을 사용했습니다." - 채널별 웨이블릿 기반 방법으로 모션 아티팩트에서 Oxy-Hb 타임 시리즈를 보정합니다.
참고: 구체적으로, 튜닝 매개변수가 있는 Daubechies 5(db5) 웨이블릿(Homer2 매뉴얼의 세부 정보 참조)27,28은 모션 아티팩트 제거에 채택된다. - 보정된 Oxy-Hb 데이터에 대역 통과 필터(예: 0.01-1Hz)를 적용하여 고주파 노이즈와 느린 드리프트를 줄입니다.
- 비신경 글로벌 성분(예를 들어, 혈압, 호흡 및 혈류 변이)을 제거하기 위해 OxyHb 신호상에 대한 주요 성분 분석(PCA)을실시한다.
참고: 장씨와동료(29)가 제안한 PCA 분석이 여기에 채택됩니다.- 먼저 신호를 분해합니다.
참고: fNIRS 신호의 분해의 특정 공식은: H = UΣVT. 여기서 fNIRS 데이터의 시간적 및 공간 패턴은 두 개의 행렬(예: 귀하 및 V)으로 표시됩니다. U는 2D(샘플 점 x 주성분) 행렬입니다. V는 또한 2D(주 성분 x 주성분) 행렬이다. V의 열은 하나의 주 구성 요소(PC)를 나타내며 특정 채널에 대한 해당 PC의 강도는 열의 각 항목에서 추정됩니다. 각 PC의 상대적 중요성은 대각선 매트릭스 Σ의 값으로 표현됩니다. - 둘째, 공간 스무딩을 수행합니다.
참고: 가우시안 커널 컨볼루션은 지역화된 신호를 제거하고 글로벌 구성 요소를 얻기 위해 사용됩니다. - 셋째, 신호를 재구성합니다.
참고: fNIRS 데이터의 전역 구성 요소를 계산하려면 부드러운 공간 패턴 매트릭스 V*가분해 수식에 다시 연결됩니다: H글로벌 = UΣ(V*)T. 이어서, 국소화된 유래 뉴런 신호는 H글로벌: H뉴런 = H- H글로벌을빼기 위해 원래 데이터 H를 사용하여 얻을 수 있다.
- 먼저 신호를 분해합니다.
- 뇌 간 동기화
참고: 2인칭 신경과학에서 뇌 커플링을 밝히기 위해, 웨이브릿 변환 일관성(WTC)은 여기에서 채택된다. 간단히, WTC는 주파수와 시간의 함수로서 두 시간 시리즈 사이의 상관 관계를 측정합니다. 2회 시리즈 x 및 y의 웨이블렛 일관성의 특정 공식은 다음과 같은 것입니다.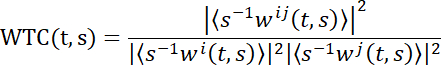
T및 s는 시간과 웨이블렛 스케일을 별도로 나타내며, ‹··›는 스케일과 시간의 스무딩 작업을 나타냅니다. W는 연속 웨이블릿 변환을 나타냅니다. 이어서, 2D(시간 x 주파수) WTC 매트릭스가30을생성한다. WTC 값을 계산하는 데 여러 도구 상자가 사용됩니다. 여기에 Grinsted에 의해 만들어진 도구 상자와 동료가사용되었다 30.- 숫자 컴퓨팅 플랫폼의 WTC 기능을 채택합니다(재료 표참조).
참고: 여기에, 어머니 물결의 기본 설정 (즉, 매개 변수 베타 및 감마일반화 된 모스 웨이블렛)이 사용됩니다. 마더 웨이블렛은 각 타임 시리즈를 주파수 및 시간 도메인으로 변환합니다. - 다른 매개 변수(예: 중요한 계산에서 대리 데이터 집합 수를 나타내는 MonteCarloCount)의 기본 설정을 설정합니다.
- 숫자 컴퓨팅 플랫폼에서 두 개의 해당 채널(두 참가자의 동일한 채널)에 대해 WTC 값을 계산합니다(재료 표참조). 동일한 절차에 따라 46개의 WTC 행렬이 46개 채널에서 생성됩니다.
- 협업 학습에 민감한 주파수 대역(FOI)을 결정합니다.
참고: 여기서 클러스터 기반 순열 접근 방식은 다중 채널 및 다중 주파수 데이터에서 여러 비교에 대한 솔루션을 제공하는 FOI31을감지하기 위해 채택됩니다.- 각 채널 조합에 대해 휴식 및 공동 학습 단계에서 WTC 값의 시간 평균을 수행합니다. 그런 다음, 전체 주파수와 함께 쌍을 이루는 샘플 t-테스트를수행(주파수 범위: 0.01-1Hz32)이시간 평균 WTC 값(협업 학습 대 휴식)에 대해 수행합니다. 다음으로 작업 효과가 중요한 주파수 저장소를 식별합니다(공동 학습 > 휴식, p < 0.05).
- 관찰된 클러스터 및 해당 T 값과 같이 상당한 주파수 인접 점(≥2)을 가져옵니다.
- 1000회 3.2.4.2단계로 자격을 갖춘 각 클러스터에 대한 T 값을 생성하기 위해 변류 된 데이터에 대한 일련의 쌍된 샘플 t-테스트를수행합니다.
참고: 왜곡된 데이터를 형성하기 위해 참가자는 무작위로 할당되어 새로운 2멤버 쌍을 형성합니다. 데이터 집합의 길이가 각 임의 쌍에 대한 다이드에 따라 다양하므로 더 긴 데이터 집합은 짧은33과동일한 길이로 트리밍됩니다. - 원래 쌍의 평균 클러스터 기반 T 값을 1000순열의 T 값과 비교합니다.
참고: 이 수식34에서평가한 p 값: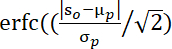 s0이 관찰된 평균 클러스터 t-값을 나타내는 μ p 및 σp는 순열 값의 평균 및 표준 편차를 나타냅니다.
s0이 관찰된 평균 클러스터 t-값을 나타내는 μ p 및 σp는 순열 값의 평균 및 표준 편차를 나타냅니다. - 각 다이드의 각 채널에서 식별된 FOI의 평균 WTC 값입니다. 그런 다음 WTC 값에 피셔 z 변환을 적용하여 WTC 값의 정상적인 분포를 가져옵니다. 이 값을 사용하여 추가 통계 분석을 위해 IBS를 인덱싱합니다.
- 숫자 컴퓨팅 플랫폼의 WTC 기능을 채택합니다(재료 표참조).
결과
도 1은 실험 프로토콜 및 프로브 위치를 보여 줍니다. fNIRS 데이터 기록 프로세스는 휴식 상태 세션(5분)과 공동 작업 세션(15-20분)의 두 부분으로 구성됩니다. 협업 학습 dyads는 휴식을 취하고 휴식 상태 세션에서 계속 유지해야합니다. 그 후, 참가자는 학습 자료(그림 1A)를공동 학습하라는 말을들었다. 이들의 전두엽 및 좌측 템포로파리탈 영역은 해당 ?...
토론
첫째, 본 프로토콜에서 공동 학습 시나리오에서 fNIRS 하이퍼스캐닝 실험을 수행하는 구체적인 단계가 명시되어 있다. 둘째, 협업 학습 다이드에서 혈역학 신호의 IBS를 평가하는 데이터 분석 파이프라인도 제시됩니다. fNIRS 하이퍼스캐닝 실험 수행에 대한 상세한 작업은 개방형 과학의 개발을 촉진할 것입니다. 또한, 분석 파이프라인은 하이퍼스캐닝 연구의 재현성을 높이기 위해 여기에 제공됩니?...
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 우수한 박사 과정 학생들을위한 ECNU 학술 혁신 진흥 프로그램 (YBNLTS2019-025)과 중국 국립 자연 과학 재단 (31872783 및 71942001)에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| EEG caps | Compumedics Neuroscan,Charlotte,USA | 64-channel Quik-Cap | We choose two sizes of cap(i.e.medium and large). |
| NIRS measurement system with probe sets and probe holder grids | Hitachi Medical Corporation, Tokyo, Japan | ETG-7100 Optical Topography System | The current study protocol requires an optional second adult probe set for 92 channels of measurement in total. |
| Numeric computing platform | The MathWorks, Inc., Natick, MA | MATLAB R2020a | Serves as base for Psychophysics Toolbox extensions (stimulus presentation), Homer2 (fNIRS preprocess analysis), and "wtc" function(WTC computation). |
| Psychology software | psychology software tools,Sharpsburg, PA,USA | E-prime 2.0 | We apply E-prime to start the fNIRS measurement system and send triggers which marking the rest phase and collaborative learning phase for fNIRS recording data. |
| Swimming caps | Zoke corporation,Shanghai,China | 611503314 | We first placed the standard 10-20 EEG cap on the head mold, and placed the swimming cap on the EEG cap. Second, we marked (inion, Cz, T3, T4, PFC and P5) with chalk. |
| Three-dimensional (3-D) digitizer | Polhemus, Colchester, VT, USA; | Three-dimensional (3-D) digitizer | Anatomical locations of optodes in relation to standard head landmarks were determined for each participant using a Patriot 3D Digitizer |
참고문헌
- Babiloni, F., Astolfi, L. Social neuroscience and hyperscanning techniques: past, present and future. Neuroscience & Biobehavioral Reviews. 44, 76-93 (2014).
- Schilbach, L., et al. Toward a second-person neuroscience. Behavior Brain Science. 36, 393-414 (2013).
- Montague, P. Hyperscanning: simultaneous fMRI during linked social interactions. NeuroImage. 16, 1159-1164 (2002).
- Cui, X., Bryant, D. M., Reiss, A. L. NIRS-based hyperscanning reveals increased interpersonal coherence in superior frontal cortex during cooperation. NeuroImage. 59 (3), 2430-2437 (2012).
- Dikker, S., et al. Brain-to-brain synchrony tracks real-world dynamic group interactions in the classroom. Current Biology. 27 (9), 1375-1380 (2017).
- Abrams, D. A., et al. Inter-subject synchronization of brain responses during natural music listening. European Journal of Neuroscience. 37 (9), 1458-1469 (2013).
- Pan, Y., et al. Instructor-learner brain coupling discriminates between instructional approaches and predicts learning. NeuroImage. 211, 116657 (2020).
- Jiang, J., et al. Leader emergence through interpersonal neural synchronization. Proceedings of the National Academy of Sciences of the United States of America. 112 (14), 4274-4279 (2015).
- Bevilacqua, D., et al. Brain-to-brain synchrony and learning outcomes vary by student-teacher dynamics: Evidence from a real-world classroom electroencephalography study. Journal of Cognitive Neuroscience. 31 (3), 401-411 (2019).
- Dikker, S., et al. Morning brain: real-world neural evidence that high school class times matter. Social Cognitive and Affective Neuroscience. 15 (11), 1193-1202 (2020).
- Pan, Y., Guyon, C., Borragán, G., Hu, Y., Peigneux, P. Interpersonal brain synchronization with instructor compensates for learner's sleep deprivation in interactive learning. Biochemical Pharmacology. , 114111 (2020).
- Pan, Y., Novembre, G., Song, B., Li, X., Hu, Y. Interpersonal synchronization of inferior frontal cortices tracks social interactive learning of a song. NeuroImage. 183, 280-290 (2018).
- Zheng, L., et al. Enhancement of teaching outcome through neural prediction of the students' knowledge state. Human Brain Mapping. 39 (7), 3046-3057 (2018).
- Zheng, L., et al. Affiliative bonding between teachers and students through interpersonal synchronisation in brain activity. Social Cognitive and Affective Neuroscience. 15 (1), 97-109 (2020).
- Kleinschmidt, A., et al. Simultaneous recording of cerebral blood oxygenation changes during human brain activation by magnetic resonance imaging and near-infrared spectroscopy. Journal of Cerebral Blood Flow & Metabolism. 16 (5), 817-826 (1996).
- Strangman, G., Culver, J. P., Thompson, J. H., Boas, D. A. A quantitative comparison of simultaneous BOLD fMRI and NIRS recordings during functional brain activation. NeuroImage. 17 (2), 719-731 (2002).
- Huppert, T. J., Hoge, R. D., Diamond, S. G., Franceschini, M. A., Boas, D. A. A temporal comparison of BOLD, ASL, and NIRS hemodynamic responses to motor stimuli in adult humans. NeuroImage. 29 (2), 368-382 (2006).
- Holper, L., Scholkmann, F., Wolf, M. Between-brain connectivity during imitation measured by fNIRS. NeuroImage. 63, 212-222 (2012).
- Hirsch, J., Zhang, X., Noah, J. A., Ono, Y. Frontal temporal and parietal systems synchronize within and across brains during live eye-to-eye contact. NeuroImage. 157, 314-330 (2017).
- Wilcox, T., Biondi, M. fNIRS in the developmental sciences. Wiley Interdisciplinary Reviews: Cognitive Science. 6 (3), 263-283 (2015).
- Ye, J. C., Tak, S., Jang, K. E., Jung, J., Jang, J. NIRS-SPM: statistical parametric mapping for nearinfrared spectroscopy. NeuroImage. 44 (2), 428-447 (2009).
- Huppert, T. J., Diamond, S. G., Franceschini, M. A., Boas, D. A. HomER: A review of time-series analysis methods for near-infrared spectroscopy of the brain. Applied Optics. 48 (10), 280-298 (2009).
- Santosa, H., Zhai, X., Fishburn, F., Huppert, T. The NIRS Brain AnalyzIR toolbox. Algorithms. 11 (5), 73 (2018).
- Xu, Y., Graber, H. L., Barbour, R. L. nirsLAB: a computing environment for fNIRS neuroimaging data analysis. Biomedical Optics. , (2014).
- Cope, M., Delpy, D. T. System for long-term measurement of cerebral blood and tissue oxygenation on newborn infants by near infra-red transillumination. Medical and Biological Engineering and Computing. 26 (3), 289-294 (1988).
- Hoshi, Y. Functional near-infrared spectroscopy: current status and future prospects. Journal of Biomedical Optics. 12 (6), 062106 (2007).
- Molavi, B., Dumont, G. A. Wavelet-based motion artifact removal for functional near-infrared spectroscopy. Physiological Measurement. 33 (2), 259 (2012).
- Cooper, R., et al. A systematic comparison of motion artifact correction techniques for functional near-infrared spectroscopy. Frontiers in Neuroscience. 6, 147 (2012).
- Zhang, X., Noah, J. A., Hirsch, J. Separation of the global and local components in functional near-infrared spectroscopy signals using principal component spatial filtering. Neurophotonics. 3 (1), 015004 (2016).
- Grinsted, A., Moore, J. C., Jevrejeva, S. Application of the cross wavelet transform and wavelet coherence to geophysical time series. Nonlinear Processes in Geophysics. 11, 561-566 (2004).
- Maris, E., Oostenveld, R. Nonparametric statistical testing of EEG-and MEG-data. Journal of Neuroscience Methods. 164 (1), 177-190 (2007).
- Nozawa, T., Sasaki, Y., Sakaki, K., Yokoyama, R., Kawashima, R. Interpersonal frontopolar neural synchronization in group communication: an exploration toward fNIRS hyperscanning of natural interactions. NeuroImage. 133, 484-497 (2016).
- Reindl, V., Gerloff, C., Scharke, W., Konrad, K. Brain-to-brain synchrony in parent-child dyads and the relationship with emotion regulation revealed by fNIRS-based hyperscanning. NeuroImage. 178, 493-502 (2018).
- Theiler, J., Eubank, S., Longtin, A., Galdrikian, B., Farmer, J. D. Testing for nonlinearity in time series: the method of surrogate data. Physica D: Nonlinear Phenomena. 58 (1-4), 77-94 (1992).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. NeuroImage. 15 (4), 870-878 (2002).
- Nichols, T., Hayasaka, S. Controlling the familywise error rate in functional neuroimaging: a comparative review. Statistical Methods in Medical Research. 12 (5), 419-446 (2003).
- Tsuzuki, D., et al. Virtual spatial registration of stand-alone fNIRS data to MNI space. NeuroImage. 34 (4), 1506-1518 (2007).
- Singh, A. K., Okamoto, M., Dan, H., Jurcak, V., Dan, I. Spatial registration of multi-channel multi-subject fNIRS data to MNI space without MRI. NeuroImage. 27 (4), 842-851 (2005).
- Noah, J. A., et al. Comparison of short-channel separation and spatial domain filtering for removal of non-neural components in functional near-infrared spectroscopy signals. Neurophotonics. 8 (1), 015004 (2021).
- Noah, J. A., et al. Real-time eye-to-eye contact is associated with cross-brain neural coupling in angular gyrus. Frontiers in Human Neuroscience. 14 (19), (2020).
- Torrence, C., Compo, G. P. A practical guide to wavelet analysis. Bulletin of the American Meteorological Society. 79 (1), 61-78 (1998).
- Osaka, N., Minamoto, T., Yaoi, K., Azuma, M., Osaka, M. Neural synchronization during cooperated humming: a hyperscanning study using fNIRS. Procedia-Social and Behavioral Sciences. 126, 241-243 (2014).
- Dommer, L., Jäger, N., Scholkmann, F., Wolf, M., Holper, L. Between-brain coherence during joint n-back task performance: a two-person functional near-infrared spectroscopy study. Behavioural Brain Research. 234 (2), 212-222 (2012).
- Holper, L., Scholkmann, F., Wolf, M. Between-brain connectivity during imitation measured by fNIRS. Neuroimage. 63, 212-222 (2012).
- Nguyen, T., et al. The effects of interaction quality on neural synchrony during mother-child problem solving. Cortex. 124, 235-249 (2020).
- Seth, A. K., Barrett, A. B., Barnett, L. Granger causality analysis in neuroscience and neuroimaging. Journal of Neuroscience. 35 (8), 3293-3297 (2015).
- Funane, T., et al. Synchronous activity of two people's prefrontal cortices during a cooperative task measured by simultaneous near-infrared spectroscopy. Journal of Biomedical Optics. 16 (7), 077011 (2011).
- Liu, T., Saito, H., Oi, M. Role of the right inferior frontal gyrus in turn-based cooperation and competition: a near-infrared spectroscopy study. Brain and Cognition. 99, 17-23 (2015).
- Lachaux, J. P., Rodriguez, E., Martinerie, J., Varela, F. J. Measuring phase synchrony in brain signals. Human Brain Mapping. 8 (4), 194-208 (1999).
- Burgess, A. P. On the interpretation of synchronization in EEG hyperscanning studies: a cautionary note. Frontiers in Human Neuroscience. 7, 881 (2013).
- Burgos-Robles, A., et al. Amygdala inputs to prefrontal cortex guide behavior amid conflicting cues of reward and punishment. Nature Neuroscience. 20 (6), 824-835 (2017).
- Mende, S., Proske, A., Narciss, S. Individual preparation for collaborative learning: Systematic review and synthesis. Educational Psychologist. , 1-25 (2020).
- Hamilton, A. F. D. C. Hyperscanning: Beyond the hype. Neuron. 109 (3), 404-407 (2021).
- Novembre, G., Iannetti, G. D. Hyperscanning alone cannot prove causality. Multibrain stimulation can. Trends in Cognitive Sciences. 25 (2), 96-99 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유