Method Article
免疫肽组学:分离小鼠和人MHC I类和II类相关肽用于质谱分析
摘要
在这里,我们提出了一种从小鼠和人细胞系纯化MHC I类和II类肽复合物的方案,提供高质量的免疫肽组学数据。该协议侧重于使用市售抗体进行样品制备。
摘要
免疫肽组学是一个新兴领域,推动和指导疫苗和免疫疗法的开发。更具体地说,它指的是使用质谱(MS)技术平台研究主要组织相容性复合物(MHC)I类和II类分子所呈现的肽组成的科学。在基于MS的免疫肽组学工作流程的所有步骤中,样品制备对于捕获具有治疗相关性的高质量数据至关重要。在这里,描述了通过免疫亲和纯化从质控样品,小鼠(EL4和A20)和人(JY)细胞系中更具体地分离MHC I类和II类相关肽的分步说明。对各种试剂和特异性抗体进行了全面描述,以从这些细胞系中分离出MHC相关肽,包括验证抗体的磁珠结合效率和磁珠中MHC肽复合物的洗脱效率的步骤。该协议可用于建立和标准化免疫肽组学工作流程,以及对新方案进行基准测试。此外,除了促进免疫肽组学中样品制备程序的实验室内和实验室间可重复性之外,该协议还代表了任何非专家的良好起点。
引言
在过去十年中,对研究MHC相关肽库的兴趣已经超过了学术界,并达到了生物技术和制药行业。事实上,在癌症中,可操作的肿瘤特异性新抗原的发现代表了工业领域的主要研究重点,以开发导致个性化肿瘤学的临床免疫疗法1,2,3。从根本上说,MHC相关肽在整个身体中呈递,反映细胞的细胞内阶段,并且在各种疾病条件下具有显着性,例如自身免疫,移植,传染病,炎症,癌症和过敏1,4。因此,MHC相关肽或人白细胞抗原(HLA)配体具有重大的医学意义,统称为免疫肽组5。
MS是表征免疫肽组的强大分析方法6,7,包括发现肿瘤特异性新抗原8,9,10,11。执行免疫肽组学实验的典型工作流程包括三个主要步骤:1)用于分离MHC相关肽的样品制备,2)通过MS进行数据采集,以及3)使用各种计算软件工具进行数据分析12。这种可视化方案中描述的高质量样品的产生对于任何基于MS的免疫肽组学项目的成功都至关重要。下面描述的方案侧重于从适合生成高质量免疫肽组学数据的成熟细胞系中分离MHC I类和II类相关肽。这些细胞系的代表性结果显示在当前方案中。
研究方案
此处提供的协议改编自已建立的协议13,14,15,16,17,18,19,20。MHC I类和II类肽的免疫亲和纯化(IP)的总体程序 如图1所示。有关所用细胞系和抗体的详细信息,请参见 材料表 。
1. 磁珠与抗体偶联(第1天):将抗体偶联至琼脂糖CNBr活化微球
注意:为每个新实验准备新的溶液。有关试剂和溶液配方的列表,请参阅材料表和补充表1。所有步骤均在室温(RT)下进行。使用新抗体时,通过收集关键等分试样(参见适应症可选)并进行考马斯蓝染色SDS-PAGE来检查结合效率(图2)。
- 活化琼脂糖 CNBr 珠
- 每个样品称量80mg琼脂糖CNBr活化珠,并将其转移到15mL锥形管中。
- 为了便于重悬干燥的磁珠,首先,加入5毫升1mM HCl,并上下移液5次。然后,用额外的8.5 mL 1 mM HCl填充锥形管。
- 使用旋转器装置在室温下以20 rpm(每分钟转数)旋转30分钟。在室温下以200× g 离心珠子2分钟,并通过抽吸除去上清液。
- 向微珠沉淀中加入500μL偶联缓冲液,并转移到新的2.0mL离心管中,并留待步骤1.2.2。
- 抗体与CNBr活化微球的偶联
- 通过添加2mg抗体(根据制造商指定的浓度),在新的2.0 mL微量离心管中制备选择用于分离MHC I类或II类肽的抗体。用偶联缓冲液完成体积至1mL,以获得2mg / mL的最终浓度。
- 在室温下以200× g 离心步骤1.1.4中的珠子2分钟,然后通过抽吸除去上清液。
- 将抗体溶液加入含有活化微珠的2.0 mL微量离心管中。
- (可选)取18μL(INPUT)等分试样,加入6μL4x SDS-PAGE缓冲液,并立即冷冻。
- 使用旋转器装置将微量离心管从步骤1.2.3以20rpm旋转120分钟。将珠子以200× g 离心2分钟,然后除去上清液。
- (可选)取18μL上清液(未结合抗体)的等分试样,加入6μL4x SDS-PAGE缓冲液并立即冷冻。
- 阻断和洗涤抗体偶联微球
- 将1mL0.2M甘氨酸加入含有步骤1.2.5中抗体偶联微球的微量离心管中。使用旋转器装置在室温下以20 rpm旋转60分钟。
- 将珠子以200× g 离心2分钟,然后除去上清液。加入1毫升PBS(磷酸盐缓冲盐水)。
- 将珠子以200× g 离心2分钟,然后除去上清液。
- (可选)取18μL上清液的等分试样(未结合的抗体,最后一次洗涤),加入6μL4x SDS-PAGE缓冲液并立即冷冻。
- 在步骤1.3.3中将1 mL PBS加入珠中。
- (可选)取等分试样18μL微球混合物(微球与抗体偶联),加入6μL4x SDS-PAGE缓冲液,并立即冷冻。
- 保持在4°C,直到在步骤2.5的同一天使用。
注意:磁珠可以在免疫捕获前一天制备,但尚未测试更长的储存时间。
2. 抗体偶联珠细胞裂解和免疫捕获(第1天)
注意:MHC分子的水平因细胞类型而异,建议对每个细胞的MHC / HLA分子进行定量21(图4A)。我们建议每个 IP 至少使用 1 x 108 个电池。该细胞数对应于来自JY,EL4和A20细胞的6-10mg蛋白质,用0.5%Chaps缓冲液溶解。为了制备用于IP的细胞沉淀,应收获细胞,离心并用5mL PBS洗涤两次。然后,细胞沉淀可以储存在-80°C的1.5mL微量离心管或15mL锥形管中,直到IP的时间。请注意,IP可以在新鲜收获或冷冻的细胞颗粒上进行。
- 为了分离MHC I类或II类肽,通过用手掌加热管的底部来解冻1×10 8 个细胞的冷冻沉淀。向沉淀中加入500μLPBS,并上下移液,直到悬浮液均匀。
注意:根据细胞类型,细胞沉淀体积可能会有很大差异。如果500μLPBS不足以溶解细胞沉淀,则使用更多的PBS,直到细胞在上下移液时容易分解。 - 测量重悬于PBS中的沉淀的总体积,并转移到新的管2mL微量离心管中。如果需要,分成更多管子。
- 加入一体积的细胞裂解缓冲液(1%chaps缓冲液在含有蛋白酶抑制剂的PBS中,1沉淀/ 10mL缓冲液)相当于前一步中测量的PBS中重悬的细胞沉淀的体积。裂解缓冲液的最终浓度为0.5%Chaps。
- 使用旋转器装置在4°C下以10rpm旋转60分钟。在4°C下以18,000× g 离心细胞裂解物20分钟,并完全制动,并将上清液(含有MHC肽复合物)转移到新的2.0mL微量离心管中。
- 通过以200× g 离心2分钟并从步骤1.3.7中回收抗体偶联微球并除去上清液。
- 将步骤2.4中的细胞裂解物上清液转移到抗体偶联的磁珠中,并使用旋转装置在4°C下旋转(10rpm)孵育14-18小时(过夜)。
3. MHC肽的洗脱(第2天)
注意:聚丙烯色谱柱允许洗脱MHC肽复合物,同时将微珠保留到色谱柱中。为了评估在用1%TFA(三氟乙酸)酸性洗脱之前和之后与珠子结合的MHC肽复合物的比例,可以在方案期间的关键步骤处使用等分试样进行蛋白质印迹(参见适应症可选)。 图3 所示的蛋白质印迹显示,在酸性洗脱1%TFA后,MHC肽复合物的富集。该分数中缺少信号将表明洗脱步骤不成功。请注意,未结合的MHC肽复合物与磁珠的比例也可以通过使用步骤3.1.6中描述的等分试样的蛋白质印迹来并行评估。
- 从抗体偶联珠中洗脱MHC肽复合物
- 取下聚丙烯柱的底盖,将柱子放在聚丙烯柱架上,并在下方安装一个空容器以收集流经的流量。
注意:每个样品需要一个色谱柱。 - 用10 mL缓冲液A冲洗聚丙烯色谱柱,并通过重力将其排出。如果液体洗脱的流速太慢,进一步切割聚丙烯柱的底端。
- 测量并收集步骤2.5中的珠裂解物混合物(〜2mL),并将其转移到聚丙烯柱中。
- (可选)取20μL(或总体积的1/100)等分试样进行蛋白质印迹并立即冷冻。该部分对应于与磁珠一起孵育的总MHC肽复合物。
- 让液体混合物通过重力洗脱。
- (可选)收集并测量流出物,取20μL等分试样(或总体积的1/100)进行蛋白质印迹并立即冷冻。该部分代表残留的未结合MHC肽复合物。
- 为了尽可能多地回收微珠 - 裂解物混合物,请用1mL缓冲液A冲洗步骤3.1.3中的管并将其转移到聚丙烯柱中。
- 通过加入10mL缓冲液A洗涤保留在聚丙烯柱中的珠子。让洗涤缓冲液通过重力洗脱。
- 用10 mL缓冲液B,10 mL缓冲液A和10mL缓冲液C重复洗涤步骤。
- 从机架上取下聚丙烯色谱柱,并将其放在新的2.0 mL微量离心管的顶部。用手握住立柱和管子。
- 向聚丙烯柱中加入300μL1%TFA,并通过上下移液5次来混合磁珠。
注意:磁珠将保留在聚丙烯柱中,MHC结合的肽将在2.0 mL微量离心管中洗脱。 - 将洗脱液转移到新的2.0 mL微量离心管中。重复步骤3.1.11并将2个洗脱液池化(含有MHC肽复合物的洗脱液应对应于总共600μL,并将在步骤3.2.4中使用)。
- (可选)收集6μL(或总体积的1/100)等分试样进行蛋白质印迹并立即冷冻。该部分对应于从磁珠中洗脱的MHC肽复合物。
- 取下聚丙烯柱的底盖,将柱子放在聚丙烯柱架上,并在下方安装一个空容器以收集流经的流量。
- MHC肽的脱盐和洗脱
注意:MHC肽的脱盐和洗脱步骤可以通过将C18柱安装到2.0 mL微量离心管上来完成。为了更好地配合,请在 C18 色谱柱和 2.0 mL 微量离心管之间安装制造商提供的退火剂。在该协议中,C18色谱柱的体积容量为5-200μL(6-60μg)。所有步骤都在RT进行。- 在C18柱顶部加入200μL甲醇,然后以1546× g 离心3分钟。丢弃流出。
- 在C18柱顶部加入200μL80%ACN(乙腈)/ 0.1%TFA,然后以1546× g 离心3分钟。丢弃流出。
- 在C18色谱柱顶部加入200μL0.1%TFA,然后以1546× g 离心3分钟。丢弃流出。
- 将步骤3.1.12中的200μLMHC肽复合物加载到C18柱的顶部。以1546× g 离心3分钟,丢弃流经。
- 重复步骤 3.2.4 两次,直到加载完整个卷。请注意,MHC肽保留在C18柱中。
- 向C18柱中加入200μL0.1%TFA,然后以1546× g 离心3分钟。丢弃流出。
- 将 C18 色谱柱转移到新的 2.0 mL 微量离心管中。通过加入150μL的28%ACN / 0.1%TFA从C18柱中洗脱MHC肽。
- 以1546× g 离心3分钟。
- 将流出物转移到新的1.5 mL微量离心管中。注意不要丢弃流出物;它含有分离的MHC I类或II类肽。
- 重复步骤3.2.7-3.2.9两次,总体积为450μL。
- 将450μL洗脱液(纯化的MHC I类或II类肽)冷冻在-20°C,直到通过LC-MSMS分析样品。
- 在LC-MS / MS分析之前,使用预设为45°C的真空浓缩器蒸发步骤3.2.11中纯化的MHC I类或II类肽2小时,真空度:100 mTorr和真空斜坡:5。
注:冷冻样品的蒸发效率很高。干燥的肽可以重新冷冻直至分析。
4. 通过LC-MS/MS鉴定MHC I类和II类肽
注:使用高性能 Orbitrap 和高分辨率四极杆飞行时间质谱仪分析 MHC I 类和 II 类免疫肽组6。以下信息仅作为指示,考虑到各种现有的串联质谱仪器根据不同的操作标准运行。下面简要介绍这些步骤:
- 将干燥的样品(从步骤3.2.12开始)溶解在50μL的4%甲酸(FA)中。
- 为每个样品上样三次进样16μL,并在自制的反相柱(150μm内径,长度为250 mm,Jupiter 3μm C18 300 Å)上分离,梯度为5%-30%ACN-0.1%FA,连接到MS的纳米流UHPLC上的流速为600 nL / min。
- 以120000的分辨率采集每个完整的MS光谱,AGC为4 x 105 ,注射时间为自动模式,并使用串联MS(MS-MS)在最丰富的带倍电荷的前体离子上获取光谱,最长可达3秒。
注意:串联-MS实验使用高能碰撞解离(HCD)进行,碰撞能量为30%,分辨率为30,000,AGC为1.5 x 105,注射时间为300 ms。 - 使用蛋白质组学LC-MS / MS分析软件(例如,PEAKS X)处理来自三个注射/样品的数据文件,该软件使用鼠标和人类数据库(UniProtKB / Swiss-Prot (2019_09))。
- 选择"未指定的酶消化"作为酶参数,选择10 ppm和0.01 Da分别对前体和片段离子的质量耐受性。
注:可变修饰是脱酰胺(NQ)和氧化(M)。所有其他搜索参数都是默认值。使用蛋白质组学LC-MS / MS分析软件使用80%的ALC过滤最终肽列表,错误发现率(FDR)为1%。
5. 免疫肽组学数据的可视化
注意:MS生成的免疫肽组学数据的质量可以通过多种方式进行评估,如最近描述的那样22,23。为了可视化数据并评估其整体质量,组成和MHC特异性,可以使用MhcVizPipe(MVP)软件工具。
- 按照所有说明和相关文档安装并运行 Caron Lab GitHub 网站上提供的 MVP 软件24。
注:MVP 提供了样品质量、成分和 MHC 特异性的快速综合视图。MVP 并行使用成熟的免疫肽组学算法(NetMHCpan25、NetMHCIIpan26 和 GibbsCluster27),并以 HTML(超文本标记语言)格式生成有组织且易于理解的报告。这些报告是完全可移植的,可以在任何具有现代Web浏览器的计算机上查看。有关 HTML 报告的示例,请参阅补充数据 1-4。
结果
分离MHC肽复合物的一般工作流程通过MS分析免疫肽组如图1所示。显示了验证抗体的磁珠结合效率(图2)(使用Y3抗H2Kb抗体)和来自微球的MHC肽复合物的洗脱效率(图3)(使用W6 / 32抗HLA-ABC抗体)的代表性结果。基于流式细胞术的定量测定法21还用于测量每个EL4细胞(H2Kb和H2Db)和JY细胞(HLA-ABC)的MHC I类分子的绝对数量,如图4A所示。
使用当前方案的结果的个体内和个体间可重复性如图4B-E所示。显示了从1 x 108个EL4细胞和1 x 108个JY细胞鉴定的MHC I类肽的代表性结果。结果由两个不同的实验室成员(用户 1 和用户 2)生成。对于用户1,从EL4和JY细胞检测到的MHCI特异性肽的平均数量分别为1341和6361;分别为用户 2、1933 和 7238(图 4B,D)。在三个不同的生物重复/实验中检测到的肽数量的平均变异系数(CV)从1.9%-11%不等(图4B,D)。尽管在三个不同实验中检测到的肽数量的CV相对较小,但肽的特性差异很大(图4C,E)。事实上,具有代表性的维恩图显示,在三个生物重复中可重复检测到的肽的比例从39%(用户2,EL4细胞)到63%(用户1,JY细胞)不等(图4C,E和补充表2)。
由MVP软件生成的热图显示使用NetMHCpan套件工具预测的已鉴定肽的MHC结合强度25,26,28。两个GibbsCluster常规选项,称为"无监督GibbsCluster"和"等位基因特异性GibbsCluster",也由MVP执行以提取MHC肽结合基序。请注意,MVP有局限性;其主要目标不是以高度准确的方式提取等位基因特异性基序和注释肽,而是提供样品的整体质量,组成和MHC特异性的鸟瞰图。
对于EL4细胞中的小鼠MHC I类(H2Db和H2Kb)肽(图5A;上图和补充数据1),代表性热图显示,对于H2Db或H2Kb分子,所有检测到的8-12-mer肽中有89%被预测为强结合剂(SB:NetMHCpan %Rank <0.5)或弱结合剂(WB:NetMHCpan %Rank <2)。 从8-12-mer肽生成的序列簇与H2Db(P5处的天冬酰胺和P9处的亮氨酸)和H2Kb(P5处的苯丙氨酸和P8处的亮氨酸)的报告徽标一致(图5)29。值得一提的是,使用M1抗体可以观察到第三个主要基序(组氨酸在P7处,亮氨酸在P9处)以及其他"人造"基序(补充数据1)。事实上,已知M1抗体与非经典Qa2分子发生交叉反应,因此,QA2相关肽也被MS检测到(补充数据1)。在这里,为简单起见,图5侧重于显示EL4细胞中表达的两个经典H2b等位基因(即H2Db或H2Kb)的成熟肽结合基序。
对于JY细胞中的人HLA I类(HLA-ABC)肽(图5A;下图和 补充数据2),代表性热图显示,所有检测到的8-12-mer肽中有97%被预测为HLA-A *0201,-B * 0702或-C * 0702的SB或WB。将肽聚集在一起以可视化HLA-A * 0201和-B * 0702的肽结合基序。HLA-C*0702的结合基序未显示在 图5A 中,因为C*0702等位基因的表达水平相对较低。因此,分离和鉴定的C*0702肽太少,以产生具有代表性的C*0702基序。请注意,C*0702基序可以在其他研究中可视化30,31,32 或从NetMHCpan 4.1基序查看器网站33。
对于JY细胞中的人HLA II类(HLA-DR)肽(图5B;上图和 补充数据S3),代表性热图显示,对于HLA-DRB1 * 0404和-DRB1 * 1301,所有检测到的9-22-mer肽中有70%被预测为SB或WB。图中显示了这两个等位基因的肽结合基序(图5B)。请注意,此处显示的肽结合基序可能与最近报道的HLA-DRB1 * 0404和-DRB1 * 130134的徽标不完全一致。这种差异凸显了MVP / NetMHCpan目前无法精确地将肽注释为特征较少的HLA II类等位基因,例如JY细胞中表达的HLA-DRB1 * 0404和-DRB1 * 1301。有关II类肽结合基序的更多信息可以在其他研究中找到34,35 和NetMHCIIpan 4.0基序查看器网站36。
最后,对于A20细胞中的小鼠MHC II类(H2-IAD和H2-IEd)肽(图5B;下图和补充数据4),代表性热图显示,所有检测到的9-22-mer肽中有87%被预测为H2-IAd或H2-IED的SB或WB。 这两个等位基因的肽结合基序与报告的徽标一致37。
由 MVP 软件生成的完整 HTML 报告,用于评估样本的整体质量和 MHC 特异性,请参阅补充数据 1-4。
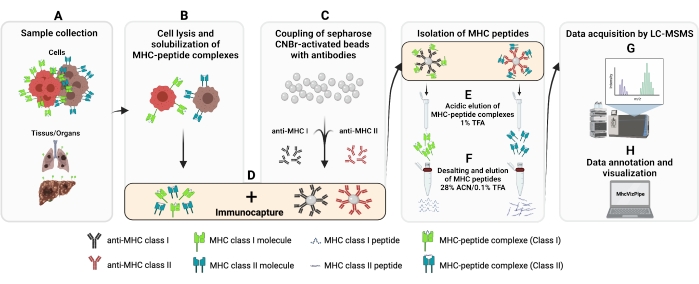
图1:MHC I类和II类肽分离的完整程序示意图。 (A-B)1亿个细胞被沉淀并用0.5%Chaps缓冲液裂解。(C)离心细胞裂解物,并将上清液加入到CNBr-sepharose珠中,事先与所需的抗体偶联,并在4°C下孵育14-18小时。(F)肽脱盐并使用C18柱洗脱。(G)随后,肽被高速真空干燥并通过串联质谱分析。(H)分离的MHC I类和II类肽的质量可以使用免费提供的MhcVizPipe软件根据HLA亚型进行评估。使用 BioRender.com(NT22ZL8QSL)创建的图。请点击此处查看此图的放大版本。
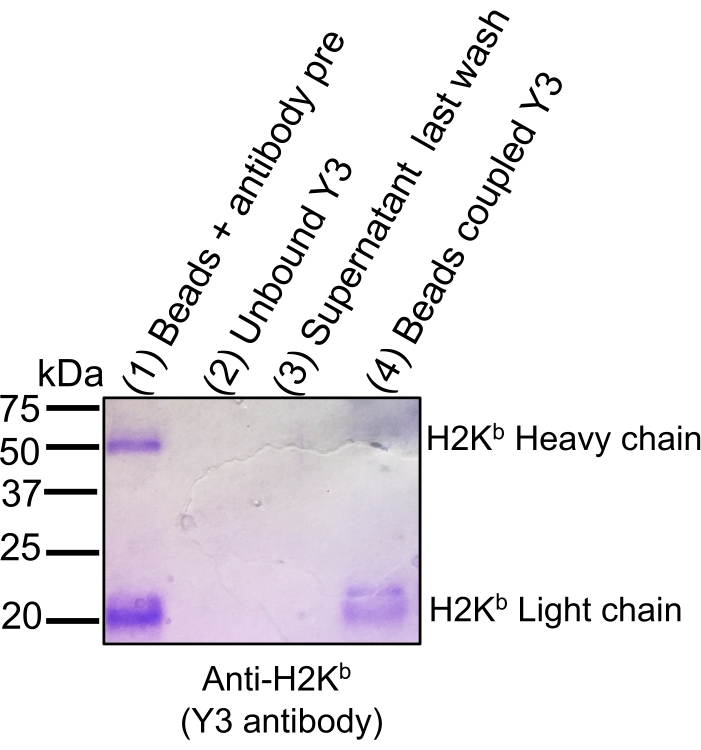
图2:考马斯凝胶染色,以跟踪抗体与壳腩纤维素CNBr活化微球的结合效率。 将等量的等分试样加载到12%SDS-PAGE凝胶上,然后进行考马斯蓝染色:珠子+抗体预偶联(1),偶联步骤(2)后未结合的抗体,偶联后最后一次洗涤后的上清液(3)和珠子与抗体偶联(4)。与偶联前的抗体相比,当磁珠(泳道4)与CNBr微球共价结合时,H2Kb 轻链和重链的信号染色强度显着降低说明了结合效率。该图已转载并改编自bioRxiv38。 请点击此处查看此图的放大版本。

图3:蛋白质印迹,用于从抗体偶联CNBr活化的微球中酸洗脱后跟踪MHC肽复合物。 从方案中指示的步骤(总测量体积的1/100)中取的等分试样被加载到12%SDS-PAGE凝胶上并转移到硝酸纤维素膜上:免疫捕获和最后洗涤后的珠子+裂解物(A);从珠子(C)中洗脱的上清液(B)和MHC肽复合物的上清液。使用抗HLA-ABC重链抗体(Abcam,#ab 70328,1:5000)(C)中MHC肽复合物的强检测信号证实了酸性洗脱后MHC肽复合物的分离。请注意,可以通过收集步骤3.1.6中的流出来评估未被抗体偶联微球捕获的MHC肽复合物的比例。可以将等分试样添加到蛋白质印迹中(此凝胶上未显示)。 请点击此处查看此图的放大版本。
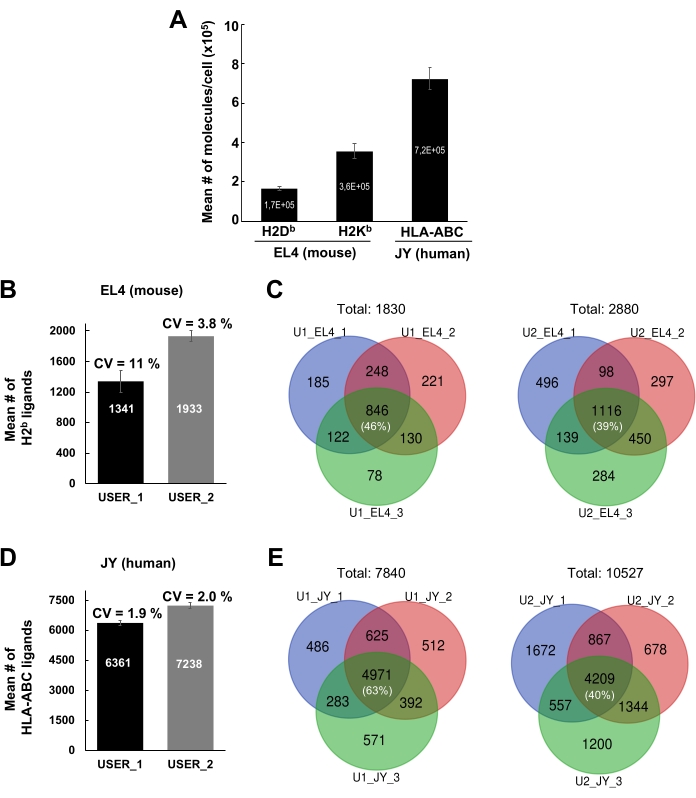
图4:从JY和EL4细胞鉴定MHC I类肽。 (A)直方图显示每个EL4细胞的细胞表面H2Db和H2Kb分子的绝对数量以及每个JY细胞的HLA-ABC分子的绝对数量。 通过流式细胞术进行定量。均值和标准误差均值来自三个生物重复。(乙、四) 直方图显示由两个独立用户(USER_1[U1]和USER_2[U2])鉴定的MHC I类肽平均值和标准偏差的直方图。显示了从小鼠EL4细胞(B)和人JY细胞(D)检测到的MHC I类肽的平均数和标准差。指出了三个独立生物重复的变异系数(CV)。(C, E) 维恩图显示了两个独立用户(U1和U2)在三个独立生物重复中在EL4(C)和JY细胞(E)中可重复检测到的肽数量。图4A已转载并改编自bioRxiv38。请点击此处查看此图的放大版本。
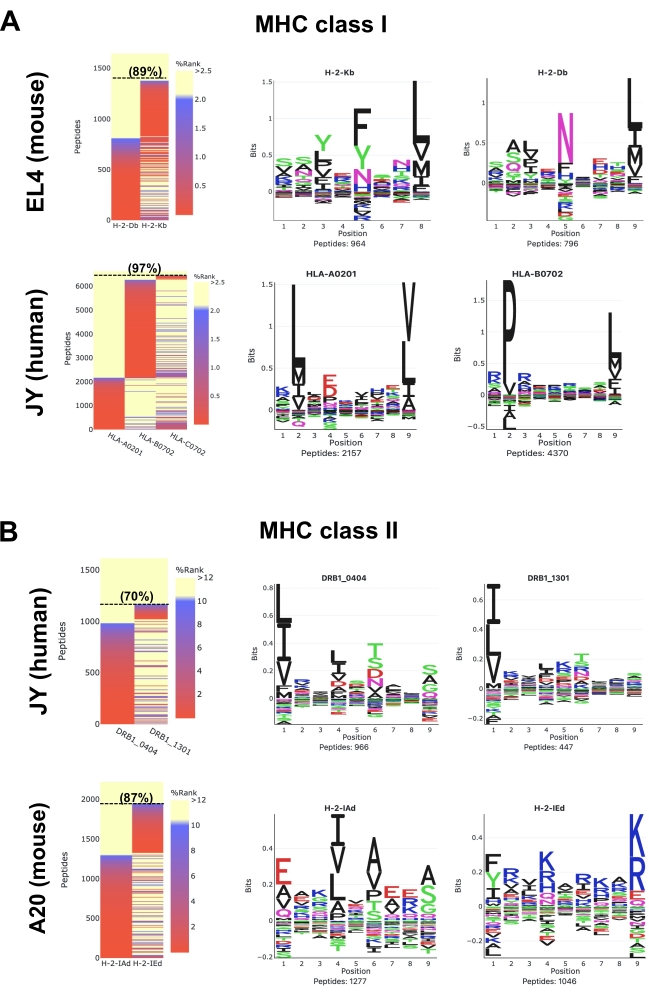
图 5:使用 MVP 软件工具可视化免疫肽组学数据。小鼠和人(A)MHC I类和(B)MHC II类肽的数据分析。图中显示了代表性结合亲和力热图(左图)和肽结合基序(右图)。热图颜色表示 NetMHCpan 4.1(%rank)预测的 MHC 结合亲和力。强粘合剂为红色(%等级<0.5),弱粘合剂为蓝色(%等级为<2),非粘合剂为黄色(%等级为>2)。8-12聚肽(A)和9-22聚肽(B)的比例(%)为SB或WB,在括号中表示。肽结合基序由MVP使用"等位基因特异性Gibbscluster"选项生成。这些代表性结果来自1×108个细胞,并使用以下抗体和细胞系:M1抗体和用于小鼠MHC I类肽的EL4细胞;W6/32抗体和JY细胞用于人MHC I类肽;用于小鼠MHC II类肽的M5抗体和A20细胞;用于人MHC II类肽的L243抗体和JY细胞。请参阅补充数据 1-4 以访问 MVP 软件生成的完整 HTML 报告。请点击此处查看此图的放大版本。
补充资料1-4:请按此下载此档案。
补充数据1:MVP软件从使用M1抗体从1 x 108EL4细胞中分离的肽生成的HTML报告。显示了三个生物重复。该报告与图4和图5相关,代表性肽列在补充表2中。
补充数据2:MVP软件从使用W6 / 32抗体从1 x 108JY细胞中分离的肽生成的HTML报告。图中显示了三个生物爬行动物。该报告与图4相关,图5和具有代表性的肽列于补充表2中。
补充数据3:由MVP软件从使用L243抗体从1 x 108JY细胞中分离的肽生成的HTML报告。该报告与图5相关,代表性肽列于补充表2中。
补充数据4:MVP软件从使用M5抗体从1 x 108A20细胞中分离的肽生成的HTML报告。该报告与图5相关,代表性肽列于补充表2中。
补充表1:缓冲液列表。 描述了协议中使用的所有缓冲液的配方。 请点击此处下载此表格。
补充表2:与H2Db / Kb,HLA-ABC,HLA-DR和H2-IAD / IED相关的肽的代表性列表。该表包含分别从小鼠EL4和A20细胞系中分离的具有代表性的MHC I类和II类肽以及从人JY细胞系中分离的HLA I类和II类肽的列表。这些数据已存放在蛋白质组交换(PXD028633)上。请点击此处下载此表格。
数据可用性:
本手稿中使用的数据集存放在ProteomeXchange(http://proteomecentral.proteomexchange.org/cgi/GetDataset):PXD028633上。
讨论
在该协议的背景下测试和验证了两种小鼠细胞系(EL4和A20),一种人细胞系(JY)和五种市售抗体[M1(抗H2Db / Kb),Y3(抗H2Kb),M5(抗H2-IAd / IEd),W6 / 32(抗HLA-ABC)和L243(抗HLA-DR)],并提供高质量的免疫肽组学数据。其他抗 HLA 抗体可用(例如,抗 HLA-A2 BB7.2),但未在此处进行测试。请注意,W6/32抗体应用广泛,是该领域最成熟的抗体;它能够分离出人类中所有HLA-ABC分子呈现的肽,并且先前由专家实验室报告从各种生物来源工作,例如新鲜或冷冻组织8,39,外周血单核细胞和骨髓单核细胞40,活检41,异种移植物41,42,尸检43和血浆样品44,45。
准备在整个方案中使用的新鲜溶液至关重要。特别是,在玻璃瓶中使用新鲜的酸性溶液对于避免MS分析的样品随后受到污染至关重要。此外,当首次使用新抗体和/或使用新抗体进行方案时,重要的是要使用蓝色考马斯凝胶评估抗体是否确实偶联到CNBr Sepharose珠。MHC肽复合物免疫捕获后抗体偶联微球的洗涤步骤对于避免非MHC肽的污染也至关重要。最后,在洗脱具有1%TFA的MHC肽复合物并用ACN28%/ 0.1%FA从C18柱洗脱肽之后,需要特别注意不要丢弃洗脱物。
文献中可用的现有方案描述了在分离程序结束时进一步纯化肽的附加步骤,例如,通过不同的方法进行肽分离14,46 或使用10-30 kDa过滤器进行超滤13,47。目前的方案没有提供这些额外步骤的细节,足以提供高质量的免疫肽组学数据。然而,非专家可以考虑这些步骤来修改和排除故障,以进一步优化肽分离程序。
用于从磁珠中洗脱MHC配合物的微珠类型和酸性洗脱缓冲液的类型也可以进行修改以进行故障排除13,14,15,16,17,18,19。在这方面,琼脂糖CNBr活化微球通常是一个很好的起点,因为它们除了在与各种类型的抗体结合方面表现出灵活性外,还相对便宜。在目前的方案中,使用五种不同的市售抗体(即M1,Y3,W6 / 32,L243和M5)显示琼脂糖CNBr活化珠表现出相对良好的性能。除了琼脂糖CNBr活化珠子外,蛋白A或G或A / G枸杞素4快速流动珠子也易于处理,虽然相对昂贵,但可以产生类似的结果。另一个需要考虑的因素是抗体对蛋白A或G的亲和力。此外,棕褐色磁珠也非常易于使用,但相对昂贵。与非专家选择的微球类型无关,鼓励在方案的关键步骤收集等分试样,并进行蓝色考马斯染色的SDS-PAGE凝胶,以跟踪抗体与微球的结合效率,如图 2所示。
影响MHC肽分离成功的另一个重要因素是指用于从磁珠中分离MHC肽复合物的酸性洗脱缓冲液的类型。已经报道了不同的缓冲液,包括0.1%,1%或10%TFA,0.2%FA和10%乙酸。1%TFA是用于所有测试抗体的洗脱缓冲液。该步骤也可以通过对用于捕获MHC肽的MHC分子进行蛋白质印迹来追踪,如图 3所示。
所有含有乙腈(ACN)和/或三氟乙酸(TFA)的缓冲液都是腐蚀性的,如果与塑料接触,可能导致样品被小分子和聚合物物质(如增塑剂)污染。为避免此类问题,所有含有有机溶剂和/或TFA的溶液均每天新鲜制备,并储存在玻璃瓶中直至使用。大多数步骤都是在蛋白质LoBind塑料管中进行的。这些管子专为蛋白质组学设计,由最高质量的原始聚丙烯制成,不含杀菌剂,增塑剂和乳胶。它们还采用优化的高度抛光的模具生产,不使用滑移剂。这些预防措施对于生成高质量的免疫肽组学数据非常重要。
抗体是分离MHC结合肽的重要限制。W6/32抗体能够分离出人类所有HLA-ABC I类分子所呈现的肽,是该领域使用最广泛和最成熟的抗体。在应用W6/32抗体时,未表征的人细胞系或生物标本的高分辨率HLA分型不是必需的,但仍然建议用于某些应用,以促进数据解释48。HLA/ MHC分型信息也可以在多个细胞系和小鼠模型的公共资源中找到49。除了W6/32抗体外,在该协议范围内进行测试和验证的其他四种抗体(M1,M5,Y3和L243)都是市售的。另一方面,在以前的免疫肽组学研究中报道的许多其他抗体尚未被社区广泛采用,并且无法商业化或通过杂交瘤细胞系的培养获得,这相对昂贵。
分离MHC结合肽的另一个重要限制是所需的起始物质的量。所需的量与细胞表面MHC分子的表达水平成反比,可以通过流式细胞术进行定量(图4A)。显示高表达水平的MHC分子的细胞(例如,树突状细胞和一般的造血细胞)通常产生高质量的免疫肽组学数据。专家实验室使用低至5000万个细胞50,但建议非专家使用1亿至10亿个细胞。还报告了使用组织活检(<13 mg)41,异种移植物42,43,尸检44和血浆45,46样本,但对于非专家实验室来说仍然具有挑战性。此外,对于已建立的细胞系,预期的MHC相关肽的总数已得到充分记录(在这里,根据所使用的细胞系和抗体,在〜2000至〜10000肽之间),但是由该技术有效拉低的天然呈现肽的绝对量仍然存在争议。事实上,以前的研究估计,分离程序的效率是肽依赖性的,可以低至0.5%-2%51。免疫肽组学的其他局限性是方法的可重复性以及NetMHCpan套件工具无法将肽正确注释为特征较少的MHC等位基因。在这方面,进一步开发和应用相对较新的独立于数据的采集MS方法7,32,52,以及新的肽聚类和MHC肽结合预测算法31,34,53,54 有望提高肽注释在免疫肽组学中的再现性和准确性。免疫肽组学在MHC相关肽的MS获取和计算分析方面面临其他限制,并在其他地方介绍1,6,55。
使用W6/32抗体从人样品中分离HLA-ABC相关肽已被许多研究小组广泛建立和广泛应用,小鼠MHC I类和II类相关肽的分离相对较少。因此,需要用于分离小鼠MHC配体的稳健方案。在这里,我们提供了一种优化方案,分别从C57BL / 6和BALB / c来源的两个小鼠细胞系中分离MHC I类肽和MHC II类肽。具体而言,该协议能够使用M1抗体分离I类H2Kb和H2Db相关肽,以及使用M5抗体分离II类H2-IAD和H2-IEd相关肽。因此,当前方案的传播和应用应促进各种小鼠模型中的基础和转化免疫肽组学研究。
该协议可用于建立和标准化免疫肽组学工作流程,以及对新方案进行基准测试。例如,它可以进行调整和进一步优化,以在从血液/血浆到新鲜或冷冻组织再到FFPE(福尔马林固定石蜡包埋)的各种生物基质中进行免疫肽组学筛选。此外,该协议将促进免疫肽组学中样品制备程序的实验室内和实验室间可重复性,因此有望在基础和临床研究中得到广泛应用。
披露声明
作者声明他们没有相互竞争的经济利益。
致谢
我们感谢Pierre Thibault,Eric Bonneil,Joël Lanoix,Caroline Côté(蒙特利尔大学免疫学和癌症研究所)和Anthony Purcell(莫纳什大学)的深刻评论。这项工作得到了魁北克研究基金会-桑特基金会(FRQS),科尔基金会,CHU Sainte-Justine和Charles-Bruneau基金会,加拿大创新基金会,国家科学与工程研究委员会(NSERC)(#RGPIN-2020-05232)和加拿大卫生研究院(CIHR)(#174924)的资助。
材料
| Name | Company | Catalog Number | Comments |
| A20 cell line | ATCC | TIB-208 | mouse B lymphoblast |
| Acetonitrile, LC/MS Grade | FisherScientific | A955-4 | |
| anti-Human HLA A, B, C (W6/32) - MHC class I | BioXcell | BE0079 | |
| anti-Human/Monkey HLA-DR (L243) - MHC class II | BioXcell | BE0308 | |
| anti-Mouse H2 (M1/42.3.9.8) - MHC class I | BioXcell | BE0077 | |
| anti-Mouse H2-IAd/IEd (M5/114) - MHC class II | BioXcell | BE00108 | |
| anti-Mouse H2Kb (Y3) - MHC class I | BioXcell | BE0172 | |
| BupH Phosphate Buffered Saline Packs (PBS) | ThermoFisher | 28372 | Pouch contents dissolved in a final volume of 500 mL deionized water (FisherScientific, W64) |
| CHAPS (3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate) | EMDMilipore | 220201-10MG | |
| CNBr-activated Sepharose | Cytivia | # 17-0430-01 | |
| EL4 cell line | ATCC | TIB-39 | mouse T lymphoblast |
| epTIPS LoRetention Tips, 1000 µL/Eppendorf | FisherScientific | 02-717-352 | Better results with low retention material |
| epTIPS LoRetention Tips, 200 µL/Eppendorf | FisherScientific | 02-717-351 | Better results with low retention material |
| Formic Acid, LC/MS Grade | FisherScientific | A117-50 | |
| Glycine | FisherScientific | RDCG0250500 | |
| Hydrochloric acid solution | FisherScientific | 60-007-11 | |
| JY cell line | Sigma Aldrich | 94022533-1VL | EBV-immortalised B cell lymphoblastoid line |
| Methanol, LC/MS Grade | FisherScientific | A456-4 | |
| Poly prep chromatography columns (polypropylene column) | Bio-Rad | 731-1550 | referred as polypropylene column in the protocol |
| Proteases inhibitor | ThermoFisher | A32963 | 1 pellet per 10 mL of cell lysis buffer |
| Qifikit | Dako | K007811-8 | |
| Sodium Bicarbonate | Amresco | # 0865-1kg | |
| Sodium Chloride | FisherScientific | MSX04201 | |
| Solid phase extraction disk, ultramicrospin column C18 | The nest group | SEMSS18V | capacity of 6–60 µg, max volume of 200 µL |
| Trifluoroacetic Acid (TFA), LC-MS Grade | FisherScientific | PI85183 | |
| Tris | FisherScientific | T395-500 | |
| Tris-HCl | FisherScientific | #10812846001 | |
| Tube LoBind 1.5 mL/Eppendorf | FisherScientific | E925000090 | Better results with low retention material |
| Tube LoBind 2 mL/Eppendorf | FisherScientific | 13-698-795 | Better results with low retention material |
| Water, LC/MS Grade | FisherScientific | W64 |
参考文献
- Vizcaíno, J. A., et al. The human immunopeptidome project: A roadmap to predict and treat immune diseases. Molecular & Cellular Proteomics. 19 (1), 31-49 (2019).
- Caron, E., Aebersold, R., Banaei-Esfahani, A., Chong, C., Bassani-Sternberg, M. A case for a human immuno-peptidome project consortium. Immunity. 47 (2), 203-208 (2017).
- Arnaud, M., Duchamp, M., Bobisse, S., Renaud, P., Coukos, G., Harari, A. Biotechnologies to tackle the challenge of neoantigen identification. Current Opinion in Biotechnology. 65, 52-59 (2020).
- Caron, E., et al. The MHC I immunopeptidome conveys to the cell surface an integrative view of cellular regulation. Molecular Systems Biology. 7 (1), 533(2011).
- Istrail, S., et al. Comparative immunopeptidomics of humans and their pathogens. Proceedings of the National Academy of Sciences of the United States of America. 101 (36), 13268-13272 (2004).
- Caron, E., Kowalewski, D. J., Koh, C. C., Sturm, T., Schuster, H., Aebersold, R. Analysis of major histocompatibility complex (MHC) immunopeptidomes using mass spectrometry. Molecular & Cellular Proteomics. 14 (12), 3105-3117 (2015).
- Caron, E., et al. An open-source computational and data resource to analyze digital maps of immunopeptidomes. eLife. 4, 07661(2015).
- Bassani-Sternberg, M., et al. Direct identification of clinically relevant neoepitopes presented on native human melanoma tissue by mass spectrometry. Nature Communications. 7 (1), 13404(2016).
- Gubin, M. M., et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens. Nature. 515 (7528), 577(2014).
- Yadav, M., et al. Predicting immunogenic tumour mutations by combining mass spectrometry and exome sequencing. Nature. 515 (7528), 572-576 (2015).
- Laumont, C. M., et al. Noncoding regions are the main source of targetable tumor-specific antigens. Science Translational Medicine. 10 (470), 5516(2018).
- Lill, J. R., et al. Minimal information about an immuno-peptidomics experiment (MIAIPE). Proteomics. 18 (12), 1800110(2018).
- Nelde, A., Kowalewski, D. J., Stevanović, S. Antigen processing, methods and protocols. Methods in molecular biology. 1988, Clifton, N.J. 123-136 (2019).
- Purcell, A. W., Ramarathinam, S. H., Ternette, N. Mass spectrometry-based identification of MHC-bound peptides for immunopeptidomics. Nature Protocols. 14 (6), 1687-1707 (2019).
- Ebrahimi-Nik, H., et al. Mass spectrometry driven exploration reveals nuances of neoepitope-driven tumor rejection. JCI Insight. 5 (14), 129152(2019).
- Schuster, H., et al. A tissue-based draft map of the murine MHC class I immunopeptidome. Scientific Data. 5, 180157(2018).
- Ritz, D., Gloger, A., Weide, B., Garbe, C., Neri, D., Fugmann, T. High-sensitivity HLA class I peptidome analysis enables a precise definition of peptide motifs and the identification of peptides from cell lines and patients sera. PROTEOMICS. 16 (10), 1570-1580 (2016).
- Bassani-Sternberg, M. Mass spectrometry based immunopeptidomics for the discovery of cancer neoantigens. Methods Mol Biol. 1719, 209-221 (2018).
- Lanoix, J., et al. Comparison of the MHC I Immunopeptidome Repertoire of B-Cell Lymphoblasts Using Two Isolation Methods. Proteomics. 18 (12), 1700251(2018).
- Kuznetsov, A., Voronina, A., Govorun, V., Arapidi, G. Critical review of existing MHC I immunopeptidome isolation methods. Molecules. 25 (22), 5409(2020).
- Urlaub, D., Watzl, C. Coated latex beads as artificial cells for quantitative investigations of receptor/ligand interactions. Current Protocols in Immunology. 131 (1), 111(2020).
- Ghosh, M., et al. Guidance document: Validation of a high-performance liquid chromatography-tandem mass spectrometry immunopeptidomics assay for the identification of HLA class I ligands suitable for pharmaceutical therapies*. Molecular & Cellular Proteomics. 19 (3), 432-443 (2020).
- Fritsche, J., et al. Pitfalls in HLA ligandomics - How to catch a li(e)gand. Molecular & Cellular Proteomics. 20, 100110(2021).
- Caron Lab. GitHub. , Available from: https://github.com/CaronLab/MhcVizPipe (2021).
- Jurtz, V., Paul, S., Andreatta, M., Marcatili, P., Peters, B., Nielsen, M. NetMHCpan-4.0: Improved peptide-MHC Class I interaction predictions integrating eluted ligand and peptide binding affinity data. The Journal of Immunology. 199 (9), 3360-3368 (2017).
- Reynisson, B., Alvarez, B., Paul, S., Peters, B., Nielsen, M. NetMHCpan-4.1 and NetMHCIIpan-4.0: improved predictions of MHC antigen presentation by concurrent motif deconvolution and integration of MS MHC eluted ligand data. Nucleic Acids Research. 48, 449-454 (2020).
- Andreatta, M., Alvarez, B., Nielsen, M. GibbsCluster: unsupervised clustering and alignment of peptide sequences. Nucleic Acids Research. 45 (1), 458-463 (2017).
- Nielsen, M., et al. NetMHCpan, a method for quantitative predictions of peptide binding to any HLA-A and -B Locus protein of known sequence. PLoS ONE. 2 (8), 796(2007).
- Fortier, M. -H., et al. The MHC class I peptide repertoire is molded by the transcriptome. The Journal of Experimental Medicine. 205 (3), 595-610 (2008).
- Marco, M. D., Schuster, H., Backert, L., Ghosh, M., Rammensee, H. -G., Stevanovic, S. Unveiling the peptide motifs of HLA-C and HLA-G from naturally presented peptides and generation of binding prediction matrices. The Journal of Immunology. 199 (8), 2639-2651 (2017).
- Sarkizova, S., et al. A large peptidome dataset improves HLA class I epitope prediction across most of the human population. Nature Biotechnology. 38 (2), 199-209 (2019).
- Pak, H., et al. Sensitive immunopeptidomics by leveraging available large-scale multi-HLA spectral libraries, data-independent acquisition and MS/MS prediction. 20, 100080(2021).
- Nielson, M. NetMHNetMHCpan 4.1 Motif Viewer. , Available from: http://www.cbs.dtu.dk/services/NetMHCpan/logos_ps.php (2021).
- Racle, J., et al. Robust prediction of HLA class II epitopes by deep motif deconvolution of immunopeptidomes. Nature Biotechnology. 37 (11), 1283-1286 (2019).
- Abelin, J. G., et al. Defining HLA-II ligand processing and binding rules with mass spectrometry enhances cancer epitope prediction. Immunity. 51 (4), 766-779 (2019).
- Nielson, M. NetMHCIIpan 4.0 Motif Viewer. , Available from: http://www.cbs.dtu.dk/services/NetMHCIIpan/logos.php (2021).
- Sofron, A., Ritz, D., Neri, D., Fugmann, T. High-resolution analysis of the murine MHC class II immunopeptidome. European Journal of Immunology. 46 (2), 319-328 (2015).
- Kovalchik, K. A., et al. Immunopeptidomics for Dummies: Detailed Experimental Protocols and Rapid, User-Friendly Visualization of MHC I and II Ligand Datasets with MhcVizPipe. bioRxiv. , (2020).
- Schuster, H., et al. The immunopeptidomic landscape of ovarian carcinomas. Proceedings of the National Academy of Sciences. 114 (46), 9942-9951 (2017).
- Berlin, C., et al. Mapping the HLA ligandome landscape of acute myeloid leukemia: a targeted approach toward peptide-based immunotherapy. Leukemia. 29 (3), 1-13 (2014).
- Rijensky, N. M., et al. Identification of tumor antigens in the HLA peptidome of patient-derived xenograft tumors in mouse. Molecular & Cellular Proteomics. 19 (8), 1360-1374 (2020).
- Heather, J. M., et al. Murine xenograft bioreactors for human immunopeptidome discovery. Scientific Reports. 9 (1), 18558(2019).
- Marcu, A., et al. HLA ligand atlas: A benign reference of HLA-presented peptides to improve T-cell-based cancer immunotherapy. Journal for Immunotherapy of Cancer. 9 (4), 002071(2021).
- Shraibman, B., et al. Identification of tumor antigens among the HLA peptidomes of glioblastoma tumors and plasma. Molecular & Cellular Proteomics. 18 (6), 1255-1268 (2019).
- Bassani-Sternberg, M., Barnea, E., Beer, I., Avivi, I., Katz, T., Admon, A. Soluble plasma HLA peptidome as a potential source for cancer biomarkers. Proceedings of the National Academy of Sciences. 107 (44), 18769-18776 (2010).
- Demmers, L. C., Heck, A. J. R., Wu, W. Pre-fractionation extends, but also creates a bias in the detectable HLA class Ι ligandome. Journal of Proteome Research. 18 (4), 1634-1643 (2019).
- Kowalewski, D. J., Stevanović, S. Antigen processing,. Methods and Protocols. 960, 145-157 (2013).
- Bentley, G., et al. High-resolution, high-throughput HLA genotyping by next-generation sequencing. Tissue Antigens. 74 (5), 393-403 (2009).
- Boegel, S., Löwer, M., Bukur, T., Sahin, U., Castle, J. C. A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines. OncoImmunology. 3 (8), 954893(2014).
- Klaeger, S., et al. Optimized liquid and gas phase fractionation increases HLA-peptidome coverage for primary cell and tissue samples. Molecular & Cellular Proteomics. 20, 100133(2021).
- Hassan, C., et al. Accurate quantitation of MHC-bound peptides by application of isotopically labeled peptide MHC complexes. Journal of Proteomics. 109, 240-244 (2014).
- Ritz, D., Kinzi, J., Neri, D., Fugmann, T. Data-independent acquisition of HLA Class I peptidomes on the Q exactive mass spectrometer platform. Proteomics. 17 (19), (2017).
- O'Donnell, T. J., Rubinsteyn, A., Laserson, U. MHCflurry 2.0: Improved pan-allele prediction of MHC Class I-presented peptides by incorporating antigen processing. Cell Systems. 11 (1), 42-48 (2020).
- O'Donnell, T. J., Rubinsteyn, A., Bonsack, M., Riemer, A. B., Laserson, U., Hammerbacher, J. MHCflurry: Open-source Class I MHC binding affinity prediction. Cell Systems. 7 (1), 129-132 (2018).
- Faridi, P., Purcell, A. W., Croft, N. P. In immunopeptidomics we need a sniper instead of a shotgun. Proteomics. 18 (12), 1700464(2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。