Method Article
免疫ペプチドミクス:マウスとヒトMHCクラスI-およびII関連ペプチドの分離による質量分析
要約
ここでは、高品質な免疫ペプチド化データを提供するマウスおよびヒト細胞株からのMHCクラスIおよびクラスIIペプチド複合体の精製プロトコルを提示する。プロトコルは、市販の抗体を使用したサンプル調製に焦点を当てています。
要約
免疫ペプチドミクスは、ワクチンや免疫療法の開発を促進し、導く新しい分野です。具体的には、質量分析(MS)技術プラットフォームを用いて、主要組織適合性複合体(MHC)クラスIおよびクラスII分子によって提示されるペプチドの組成を調べたい。MSベースの免疫ペプチドミクスワークフローのすべてのステップの中で、サンプル調製は治療関連性の高品質なデータをキャプチャするために非常に重要です。ここでは、免疫親和性精製によってMHCクラスIおよびII関連ペプチドを、マウス(EL4およびA20)から、ヒト(JY)細胞株より具体的に分離する手順が記載されている。種々の試薬および特異的抗体は、抗体のビーズ結合効率およびビーズからのMHCペプチド複合体の溶出効率を検証するステップを含む、これらの細胞株からMHC関連ペプチドを単離するために十分に記述されている。このプロトコルは、免疫ペプチドミクスワークフローを確立および標準化し、新しいプロトコルのベンチマークにも使用できます。さらに、このプロトコルは、免疫ペプチドミクスにおけるサンプル調製手順の実験室内および実験室間再現性を促進することに加えて、非専門家にとって素晴らしい出発点となる。
概要
過去10年間で、MHC関連ペプチドのレパートリーの調査への関心は学術部門を超え、バイオテクノロジーおよび製薬業界に達しました。実際、がんでは、腫瘍特異的な腫瘍特異的な新抗原の発見は、個別化腫瘍学につながる臨床免疫療法を開発するための産業分野における主要な研究の焦点を表しています1,2,3。基本的に、MHC関連ペプチドは、全身に提示され、細胞内の段階を反映し、自己免疫、移植、感染症、炎症、癌、およびアレルギーなどの様々な疾患状態において重要である1,4。したがって、ヒトにおけるMHC関連ペプチド、またはヒト白血球抗原(HLA)リガンドは、医学的に大きな関心事であり、総称して免疫ペプチドーム5と呼ばれる。
MSは、腫瘍特異的な新抗原8,9,10,11の発見を含む免疫ペプチドーム6,7を特徴付ける強力な分析アプローチである。免疫ペプチドミクス実験を行う典型的なワークフローには、MHC関連ペプチドの単離のためのサンプル調製、2)MSによるデータ取得、および3)様々な計算ソフトウエアツールを用いたデータ分析の3つの主要なステップが含まれる。この可視化されたプロトコルで説明されている高品質のサンプルの生成は、MSベースの免疫ペプチドミクスにおけるあらゆるプロジェクトの成功のために重要です。以下に説明するプロトコルは、高品質の免疫ペプチドミクスデータを生成するのに適した確立された細胞株からMHCクラスI-およびII関連ペプチドを単離することに焦点を当てています。これらの細胞株からの代表的な結果は、現在のプロトコルに示されている。
プロトコル
ここで提供されるプロトコルは確立されたプロトコル13,14,15,16,17,18,19,20から適応された。MHCクラスIおよびIIペプチドの免疫親和性精製(IP)の全体的な手順を図1に示す。使用する細胞株と抗体の詳細については、資料表を参照してください。
1. 抗体と結合するビーズ(1日目):抗体をセファロースCNBr活性化ビーズに結合
注: 新しい実験ごとに新しいソリューションを準備します。試薬とソリューションのレシピのリストについては、 材料表 および 補足表1 を参照してください。すべてのステップは室温(RT)で行われる。新しい抗体を使用する場合は、キーアリコートを収集し(OPTIONALの指示を参照)、クーマシーブルー染色SDS-PAGE(図2)を行うことにより、結合効率を確認してください。
- セファロースCNBrビーズの活性化
- セファローズCNBr活性ビーズの重量を80mg、15 mL円錐管に移します。
- 乾燥ビーズの再懸濁を容易にするために、まず、1 mM HClの5 mLとピペットを5回上下に加える。次に、1 mM HCl の追加 8.5 mL で円錐管を充填します。
- ローテーターデバイスを使用してRTで30分間、20 rpm(1分あたりの回転数)で回転させます。200 x g で 200 g で 2 分間の遠心分離機 RT で 2 分間、吸引によって上清を除去します。
- 500 μL のカップリングバッファーをビーズペレットに加え、新しい 2.0 mL 遠心管に移し、ステップ 1.2.2 を維持します。
- CNBr活性化ビーズへの抗体の結合
- MHCクラスIまたはIIペプチドの単離のために選択した抗体を新しい2.0 mLマイクロ遠心分離管に2mgの抗体を加えて調製します(メーカーが指定した濃度に従います)。カップリングバッファー溶液で体積を 1 mL に完了し、2 mg/mL の最終濃度を得ます。
- ステップ1.1.4から200 x g の2分間RTで2分間のビーズを遠心分離し、吸引によって上清を取り除きます。
- 活性化ビーズを含む2.0 mLマイクロ遠心分離管に抗体溶液を加えます。
- (オプション)18 μL (INPUT) のアリコートを取り、6 μL の 4x SDS-PAGE バッファを追加し、すぐに凍結します。
- 回転装置を使用して、ステップ1.2.3から20rpmで120分間マイクロ遠心管を120分間回転させます。200 x g で 200 g でビーズを遠心分離し、上清を取り除きます。
- (オプション)上清(非結合抗体)の18 μLのアリコートを取り、6 μLの4x SDS-PAGEバッファーを加え、すぐに凍結します。
- 抗体結合ビーズの遮断および洗浄
- ステップ1.2.5から抗体結合ビーズを含むマイクロ遠心分離チューブに0.2 Mグリシンの1 mLを加えます。ローテーターデバイスを使用して、RTで60分間20rpmで回転させます。
- 200 x g でビーズを 2 分間遠心し、上清を取り除きます。PBS(リン酸緩衝生理食塩分)を1 mL加えます。
- 200 x g でビーズを 2 分間遠心し、上清を取り除きます。
- (オプション)上清(非結合抗体、最後の洗浄)の18 μLのアリコートを取り、6 μLの4倍のSDS-PAGEバッファを加え、すぐに凍結します。
- ステップ 1.3.3 のビーズに PBS の 1 mL を追加します。
- (オプション)18 μL のビーズ混合物(ビーズと抗体を結合)のアリコートを取り、4x SDS-PAGE バッファーの 6 μL を加え、すぐに凍結します。
- ステップ2.5で同じ日に使用するまで4°Cに保ちます。
注:ビーズは免疫キャプチャの前日に準備することができますが、より長いストレージはテストされていません。
2. 抗体結合ビーズによる細胞のリシスと免疫の取り込み(1日目)
注:MHC分子のレベルは、ある細胞タイプによって異なり、細胞当たりのMHC/HLA分子の定量化が推奨される21(図4A)。IP ごとに、最低 1 x 108 個のセルを使用することをお勧めします。この細胞数は、JY、EL4、およびA20細胞から6〜10mgのタンパク質に相当し、0.5%のチャップスバッファーで可溶化した。IP用の細胞ペレットを調製するために、細胞を採取し、遠心し、5mLのPBSで2回洗浄する必要があります。次いで、細胞ペレットは、IPの時間まで-80°Cで1.5 mLマイクロ遠心チューブまたは15 mL円錐管に保存することができる。IP は、新鮮な収穫または凍結した細胞ペレットに対して実行できることに注意してください。
- MHCクラスIまたはIIペプチドを単離するために、1 x 108 細胞の凍結ペレットを、手のひらでチューブの底部を温めることにより解凍する。500 μLのPBSをペレットに加え、ピペットを上下に加え、懸濁液が均質になるまで加えます。
注:細胞の種類によって、細胞ペレットの容積は大きく異なる場合があります。500 μLのPBSが細胞ペレットを溶解するのに十分でない場合は、細胞が上下にピペッティングしながら容易に分解されるまで、より多くのPBSを使用してください。 - PBSで再懸濁されたペレットの総体積を測定し、新しいチューブ2 mLマイクロ遠心チューブに移します。必要に応じて、より多くのチューブに分割します。
- 細胞溶菌緩衝液の体積(プロテアーゼ阻害剤を含有するPBS中の1%チャップスバッファー、1ペレット/10mLの緩衝液)を加え、前工程で測定したPBS中で再懸濁した細胞ペレットの体積と同等である。リシスバッファーの最終的な濃度は、チャップスの 0.5% です。
- 回転装置を使用して、4°Cで60分間10 rpmで回転させます。フルブレーキで4°Cで20分間18,000 x g で細胞リセートを遠心分離し、新しい2.0 mLマイクロ遠心チューブに上清(MHCペプチド複合体を含む)を移管します。
- 200 x g で 200 x g の遠心分離により、ステップ 1.3.7 から抗体結合ビーズを 2 分間回収し、上清を除去します。
- ステップ2.4の細胞ライセート上清を抗体結合ビーズに移し、回転装置を使用して4°Cで14〜18時間(一晩)回転(10rpm)でインキュベートします。
3. MHCペプチドの溶出(2日目)
注:ポリプロピレンカラムは、カラムにビーズを保持しながら、MHCペプチド複合体の溶出を可能にします。1%TFA(トリフルオロ酢酸)と酸性溶出前後のビーズに結合したMHCペプチド複合体の割合を評価するために、プロトコル中に重要なステップで取られたアリコートを用いてウェスタンブロットを実行することができる(省略可能な指標を参照)。 図3 に示すウェスタンブロッティングは、1%TFAでの酸性溶出後のMHCペプチド複合体の濃縮を明らかにする。この分数にシグナルが存在しない場合、溶出ステップが成功しなかったということを示します。なお、ビーズに対する非結合MHCペプチド複合体の割合は、ステップ3.1.6に記載されたアリコートを用いたウェスタンブロッティングにより並行して評価することもできる。
- 抗体結合ビーズからのMHCペプチド複合体の溶出
- ポリプロピレンカラムの底蓋を取り外し、カラムをポリプロピレンカラムラックの上に置き、その下に空の容器を取り付けて流れを通します。
注: 1 つのサンプルにつき 1 列が必要です。 - ポリプロピレンカラムを10 mLの緩衝Aでリンスし、重力で排水します。液溶出の流速が遅すぎる場合は、ポリプロピレンカラムの下端をさらに切る。
- ステップ2.5からビーズ-ライセート混合物(〜2mL)を測定し、回収し、ポリプロピレンカラムに移します。
- (オプション)ウェスタンブロッティングと凍結のための20 μL(または総体積から1/100)のアリコートを取ります。この画分は、ビーズと共にインキュベートされた全MHCペプチド複合体に相当する。
- 液体混合物を重力で溶かしましょう。
- (オプション)フロースルーを収集して測定し、ウェスタンブロッティングと凍結のために20 μL(または全容量のうち1/100)のアリコートを取ります。この分数は、残留非結合MHCペプチド複合体を表す。
- ビーズ-ライセート混合物を可能な限り回収するには、ステップ3.1.3から1mLのバッファーAでチューブをすすぎ、ポリプロピレンカラムに移します。
- 10 mLのバッファーAを加えて、ポリプロピレンカラムに保持されているビーズを洗浄します。洗浄バッファーを重力で溶かしましょう。
- 洗浄工程をバッファーBの10mL、バッファAの10mL、そして10mLの緩衝液Cで繰り返します。
- ラックからポリプロピレンカラムを取り外し、新しい2.0 mLマイクロ遠心チューブの上部に置きます。柱とチューブを手で一緒に持ちます。
- ポリプロピレンカラムに1%TFAの300 μLを加え、上下に5回ピペットしてビーズを混ぜます。
注:ビーズはポリプロピレンカラムに保持され、MHC結合ペプチドは2.0 mLマイクロ遠心分離管で溶出します。 - 新しい2.0 mLマイクロ遠心チューブで溶出液を移します。ステップ3.1.11を繰り返し、2つの溶出液をプールします(MHCペプチド複合体を含む溶出液は合計600 μLに対応する必要があり、ステップ3.2.4で使用されます)。
- (オプション)ウェスタンブロッティングと凍結のための6 μL(または総体積の1/100)のアリコートを収集します。この分数は、ビーズから溶出したMHCペプチド複合体に相当する。
- ポリプロピレンカラムの底蓋を取り外し、カラムをポリプロピレンカラムラックの上に置き、その下に空の容器を取り付けて流れを通します。
- MHCペプチドの脱塩と溶出
注:MHCペプチドの脱塩と溶出ステップは、C18カラムを2.0 mLマイクロ遠心分離チューブに取り付けることによって行うことができます。より良い適合のために、C18カラムと2.0 mLマイクロ遠心チューブの間に製造業者が提供するアニールを取り付けます。このプロトコルでは、C18カラムが5~200 μL(6~60 μg)の容量で使用されます。すべてのステップはRTで行われます。- C18カラムの上に200μLのメタノールを加え、1546 x g で遠心分離機を3分間加えます。フロースルーを破棄します。
- C18カラムの上に80%ACN(アセトニトリル)/0.1%TFAの200 μLを加え、1546 x g で遠心分離機を3分間加えます。フロースルーを破棄します。
- C18カラムの上に0.1%TFAの200 μLを加え、遠心分離機を1546 x g で3分間加えます。フロースルーを破棄します。
- ステップ3.1.12からC18カラムの上にMHCペプチド複合体の200 μLをロードします。遠心分離機は1546 x g で3分間、流れを捨てます。
- ボリューム全体がロードされるまで、ステップ 3.2.4 を 2 回繰り返します。なお、MHCペプチドはC18カラムに保持されている。
- 0.1%TFAの200 μLをC18カラムに加え、遠心分離機を1546 x g で3分間追加します。フロースルーを破棄します。
- C18カラムを新しい2.0 mLマイクロ遠心分離チューブに移します。28%ACN/0.1%TFAの150 μLを加えることによってC18カラムからMHCペプチドをエルテ。
- 遠心分離機 1546 x g で 3 分間
- フロースルーを新しい1.5 mLマイクロ遠心分離チューブに移します。フロースルーを破棄しないように注意してください。それは、単離されたMHCクラスIまたはIIペプチドを含む。
- 合計体積450μLの場合は、ステップ3.2.7~3.2.9を2回繰り返します。
- LC-MSMSでサンプルを分析するまで、450 μLの溶出液(精製MHCクラスIまたはIIペプチド)を-20 °Cで凍結します。
- LC-MS/MS分析の前に、ステップ3.2.11から精製されたMHCクラスIまたはIIペプチドは、2時間45°Cの真空濃縮器、真空レベル:100 mTorrおよび真空ランプを使用して乾燥に蒸発する: 5.
注:凍結したサンプルの蒸発は非常に効率的です。乾燥したペプチドは、分析まで再凍結することができる。
4. LC-MS/MSによるMHCクラスIおよびIIペプチドの同定
注:高性能オービトラップと高分解能の四重極時間質量分析計6を使用して、MHCクラスIおよびII免疫ペプチドームを分析します。以下の情報は、既存の様々なタンデム質量分析計装置が異なる運用基準に従って動作することを考慮して、唯一の指標として与えられる。手順の簡単な概要を以下に説明します。
- 乾燥したサンプル(ステップ3.2.12から)を4%のギ酸(FA)の50 μLで可溶化します。
- 各サンプルに16 μLの3回の注入をロードし、自家製の逆相カラム(150-μm i.d.×250 mm長、木星3 μm C18 300 Å)で、5%-30%ACN-0.1%FAの勾配と600 nL/min流量をナノフローUHPLCに接続したMSに接続したMSにロードします。
- 最大3秒の最大の120000の解像度で各完全なMSスペクトルを取得し、射出時間の自動モードとスペクトルを持つ4 x 105 のAGCを取得し、最大3秒の最も豊富な乗算前駆体イオンにタンデムMS(MS-MS)を使用してスペクトルを生成します。
注: タンデム-MS実験は、衝突エネルギー 30%、分解率 30,000、AGC 1.5 x 105、射出時間 300 ms で高エネルギー衝突解離(HCD)を使用して行われます。 - マウスおよびヒトデータベース(UniProtKB/Swiss-Prot(2019_09))を使用して、プロテオミクスLC-MS/MS解析ソフトウェア(PEAKS Xなど)を使用して、3つの注射/サンプルからのデータファイルを処理します。
- 酵素パラメータには「不特定酵素消化」を、前駆体イオンとフラグメントイオンの質量許容度としては10ppmと0.01 Daをそれぞれ選択します。
注:可変的な変更は、脱アミド(NQ)および酸化(M)です。その他の検索パラメータはすべてデフォルト値です。最終的なペプチドリストは、プロテオミクスLC-MS/MS解析ソフトウェアを使用して、80%のALCと1%の偽発見率(FDR)を使用してフィルタリングされます。
5. 免疫ペプチドミクスデータの可視化
注:MSによって生成された免疫ペプチドミクスデータの品質は、最近説明したように、複数の方法で評価することができます22,23。データを視覚化し、その全体的な品質、組成、および MHC 特異性を評価するために、MhcVizPipe (MVP) ソフトウェア ツールを使用できます。
- すべての手順と関連ドキュメントに従って、Caron Lab GitHub Web サイト 24 で利用可能な MVP ソフトウェアをインストールして実行します。
注: MVP は、サンプルの品質、構成、および MHC 特異性を迅速かつ統合したビューを提供します。MVP は、確立された免疫ペプチドミクス アルゴリズム (NetMHCpan25、NetMHCIIpan26、および GibbsCluster27) の使用を並列化し、HTML (ハイパーテキスト マークアップ言語) 形式で整理されたわかりやすいレポートを生成します。レポートは完全にポータブルで、最新のWebブラウザを使用して任意のコンピュータで表示できます。HTML レポートの例については、補足データ 1-4 を参照してください。
結果
MSによる免疫ペプチドを分析するためのMHCペプチド複合体を単離する一般的なワークフローを図1に示す。抗体のビーズ結合効率の検証に関する代表的な結果(図2)(Y3抗H2Kb抗体を使用)およびビーズからのMHCペプチド複合体の溶出効率(図3)(W6/32抗HLA-ABC抗体を用いた)が示されている。また、図4Aに示すように、フローサイトメトリーベース定量アッセイ21を適用し、EL4細胞(H2KbおよびH2Db)およびJY細胞(HLA-ABC)当たりのMHCクラスI分子の絶対数を測定した。
現在のプロトコルを用いた結果のイントラおよび相互の再現性を図4B-Eに示す。1 x 108 EL4細胞および1 x 108 JY細胞から同定されたMHCクラスIペプチドに対する代表的な結果が示されている。結果は、2 つの異なるラボ メンバー (ユーザー 1 とユーザー 2) から生成されました。ユーザ1の場合、EL4およびJY細胞から検出されたMHCI特異的ペプチドの平均数はそれぞれ1341および6361であった。ユーザー 2、1933、7238 にそれぞれ対して(図 4B,D)。3つの異なる生物学的複製/実験で検出されたペプチドの数の平均変動係数(CV)は、1.9%から11%まで変化します(図4B,D)。3つの異なる実験で検出されたペプチドの数に対するCVは比較的少なかったが、ペプチドの同一性はかなり異なっていた(図4C、E)。実際、代表的なベン図は、3つの生物学的複製物にわたって再現的に検出されたペプチドの割合が39%(ユーザ2、EL4細胞)から63%(ユーザ1、JY細胞)に及ぶ(図4C、Eおよび補足表2) ことを示している。
MVPソフトウェアによって生成されたヒートマップは、NetMHCpanスイートツール25,26,28を使用して同定されたペプチドのMHC結合強度を予測した。「教師なしギブスクラスター」と「アレール特異的ギブスクラスター」と呼ばれた2つのGibbsClusterルーチンオプションも、MHCペプチド結合モチーフを抽出するためにMVPによって実行されます。MVP には制限があることに注意してください。その主な目標は、アリール特有のモチーフを抽出し、ペプチドに非常に正確な方法でアノールをアポイントし、むしろサンプルの全体的な品質、組成、およびMHC特異性に関する鳥瞰図を提供することです。
EL4細胞のマウスMHCクラスI(H2DbおよびH2Kb)ペプチド(図5A;上部パネルおよび補足データ1)の場合、代表的なヒートマップは、検出されたすべての8-12-merペプチドの89%が強結合剤(SB:NetMHCpan %Rank <0.5)またはHB分子の弱結合剤(WB:NetMHCpan < %5)またはHB分子の弱い結合剤(WB:NetMHCpan %22)であると予測されることを示しています。 8-12-merペプチドから生成された配列クラスターは、報告されたH2Db(P5のアスパラギン、P9のロイシン)およびH2Kb(P5のフェニルアラニンおよびP8のロイシン)と一緒に、報告されている(図5)29。M1抗体を用いて、第3の支配的モチーフ(P7ではヒスチジン、P9ではロイシン)、さらに「アーテファラク」モチーフを観察できることは言及しておく価値がある(補足データ1)。実際、M1抗体は非古典的なQa2分子と交差反応することが知られており、したがって、Qa2関連ペプチドもMS(補足データ1)によって検出される。ここで、簡単にするために、図5は、EL4細胞で発現される2つの古典的なH2b対立素(すなわち、H2DbまたはH2Kb)に対する確立されたペプチド結合モチーフを示すことを目的とする。
JY細胞におけるヒトHLAクラスI(HLA-ABC)ペプチド(図5A;下部パネルおよび補足データ2)の場合、代表的なヒートマップは、検出されたすべての8-12-merペプチドの97%がHLA-A*0201、-B*0702または-C*0702のSBまたはWBであると予測されていることを示しています。ペプチドをクラスター化して、HLA-A*0201および-B*0702のペプチド結合モチーフを可視化した。C*0702 アレルの発現レベルが比較的低いため、HLA-C*0702 のバインドモチーフは図 5A に示されていません。したがって、C*0702ペプチドが単離され、代表的なC*0702モチーフを生成するために同定されたのが少なすぎます。C*0702モチーフは、他の研究30,31,32またはNetMHCpan 4.1モチーフビューアウェブサイト33から視覚化できることに注意してください。
JY細胞におけるヒトHLAクラスII(HLA-DR)ペプチド(図5B;上部パネルおよび補助データS3)の場合、代表的なヒートマップは、検出されたすべての9-22-merペプチドの70%がHLA-DRB1*0404および-DRB1*1301のSBまたはWBであると予測されることを示しています。これら2つの対立素に対するペプチド結合モチーフが示されている(図5B)。ここで示したペプチド結合モチーフは、HLA-DRB1*0404および-DRB1*130134の最近報告されたロゴと完全に一緒に入っていない可能性があることに注意してください。この不一致は、JY細胞で発現するHLA-DRB1*0404および-DRB1*1301のような、あまり特徴のないHLAクラスII対立体にペプチドを正確にアノールト化するMVP/NetMHCpanの現在の能力を強調する。クラスIIペプチド結合モチーフに関する追加情報は、他の研究34,35およびNetMHCIIpan 4.0モチーフビューアウェブサイト36から見つけることができます。
最後に、A20細胞におけるマウスMHCクラスII(H2-IAdおよびH2-IED)ペプチド(図5B;下部パネルおよび補足データ4)については、代表的なヒートマップは、検出されたすべての9-22-merペプチドの87%がH2-IAdまたはH2-IEdのSBまたはWBであると予測されることを示しています。これら2つの対立遺伝子のペプチド結合モチーフは報告されたロゴ37と一緒に入っている。
サンプルの全体的な品質と MHC 特異性を評価するために MVP ソフトウェアによって生成された完全な HTML レポートは、補足データ 1-4 で利用できます。
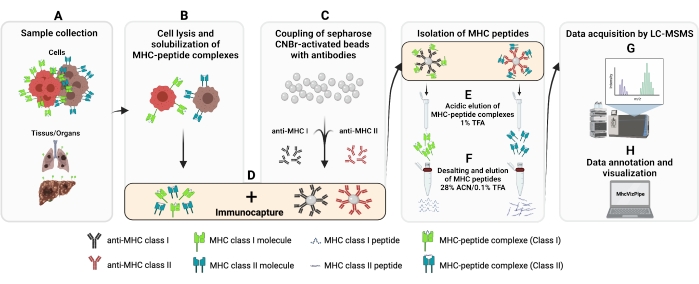
図1:MHCクラスIおよびIIペプチドの単離のための完全な手順の概略図。 (A-B)1億個の細胞をペレット化し、0.5%のチャップスバッファーでリセリングする。(C)細胞溶解液は遠心分離され、上清はCNBr-セファローズビーズにあらかじめ必要な抗体に結合し、(D)4°Cで14〜18時間インキュベートした(E)免疫キャプチャの後、ビーズをポリプロピレンカラムに移し、洗浄し、MHCペプチド複合体はTFA溶液を含むeluted1%(F)ペプチドを脱塩し、C18カラムを使用して溶出する。(G)続いて、ペプチドは、速度真空乾燥し、タンデム質量分析法によって分析される。(H) 分離された MHC クラス I および II ペプチドの品質は、自由に入手可能な MhcVizPipe ソフトウェアを使用して HLA サブタイプに基づいて評価できます。BioRender.com (NT22ZL8QSL) で作成された図。この図の大きなバージョンを表示するには、ここをクリックしてください。
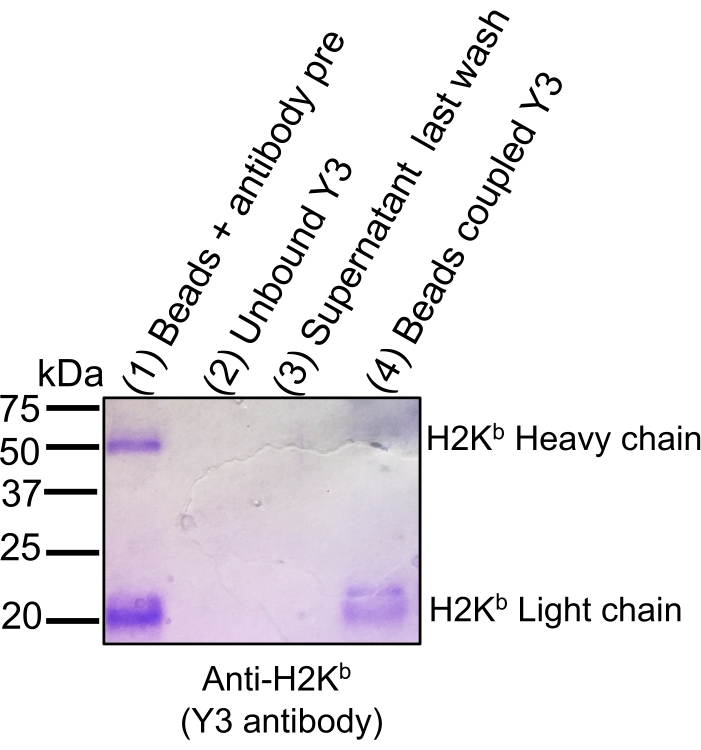
図2:セファロースCNBr活性化ビーズへの抗体結合効率を追跡するクマシーゲル染色。等価体積のアリコートは、12%SDS-PAGEゲルにロードされ、続いてクーマッシーブルー染色:ビーズ+抗体プリカップリング(1)、結合後の抗体(2)、カップリング後の上清(3)、およびビーズと結合した抗体(4)が続いた。結合の効率は、結合前の抗体と比較して、ビードがCNBrビーズに共有結合する場合のH2Kbの軽鎖および重鎖のシグナル染色強度の有意な減少(Lane1)によって示される。この図は、bioRxiv38から転載され、適応されています。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:抗体結合CNBr活性化ビーズからの酸性溶出後のMHCペプチド複合体を追跡するためのウェスタンブロッティング。 プロトコルで示されたステップ(測定された総体積の1/100)から取られたアリコートは、12%SDS-PAGEゲルにロードされ、ニトロセルロース膜に移された:ビーズ+免疫捕捉後のリセートと最後の洗浄(A);最後の洗浄の上清(B)およびMHC-ペプチド複合体は、ビーズ(C)から溶出した。抗HLA-ABC重鎖抗体を用いた(C)中のMHCペプチド複合体の強力な検出シグナル(Abcam, #ab 70328, 1:5000)は、酸性溶出後のMHCペプチド複合体の単離を確認した。なお、ステップ3.1.6からフロースルーを収集することにより、抗体結合ビーズによって捕捉されなかったMHCペプチド複合体の割合を評価することができる。アリコートは、ウェスタンブロットに添加することができます(このゲルには示されていません)。 この図の大きなバージョンを表示するには、ここをクリックしてください。
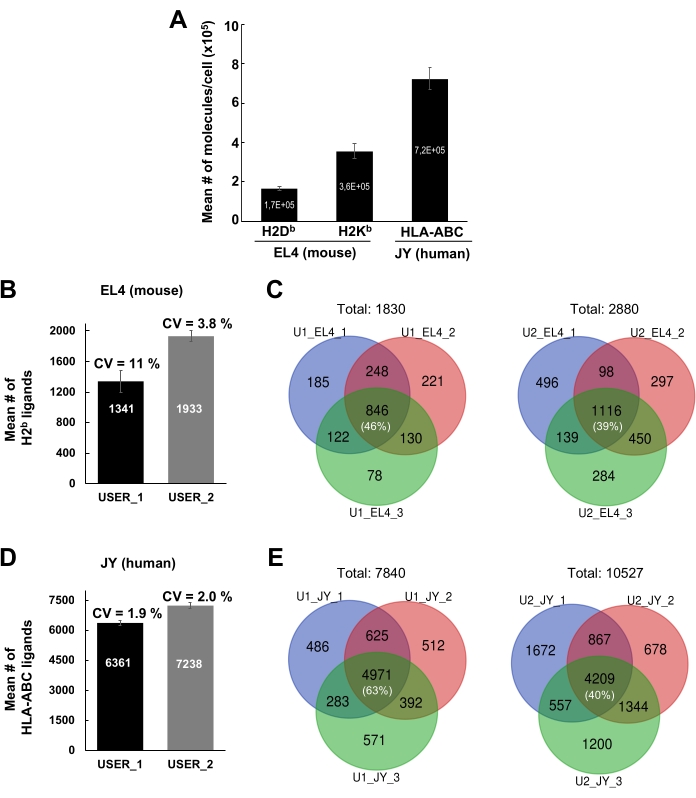
図4:JY細胞およびEL4細胞からのMHCクラスIペプチドの同定 (A)細胞表面H2DbおよびH2Kb分子の絶対数をEL4細胞ごと及びHLA-ABC分子当たりのJY細胞の絶対数を示すヒストグラム。定量はフローサイトメトリーにより行った。平均の平均および標準誤差は、3つの生物学的複製から得られた。(B、D) 2人の独立したユーザ(USER_1[U1]およびUSER_2[U2])によって同定されたMHCクラスIペプチドの平均の平均数および標準偏差を示すヒストグラム。マウスEL4細胞(B)およびヒトJY細胞(D)から検出されたMHCクラスIペプチドの平均数および標準偏差が示されている。3つの独立した生物学的複製における変動係数(CV)が示されている。(C、E) 3つの独立した生物学的複製物にわたって2人の独立したユーザ(U1およびU2)によってEL4(C)およびJY細胞(E)で再現的に検出されたペプチドの数を示すベン図。図4Aは、bioRxiv38から転載および適合されています。この図の大きなバージョンを表示するには、ここをクリックしてください。
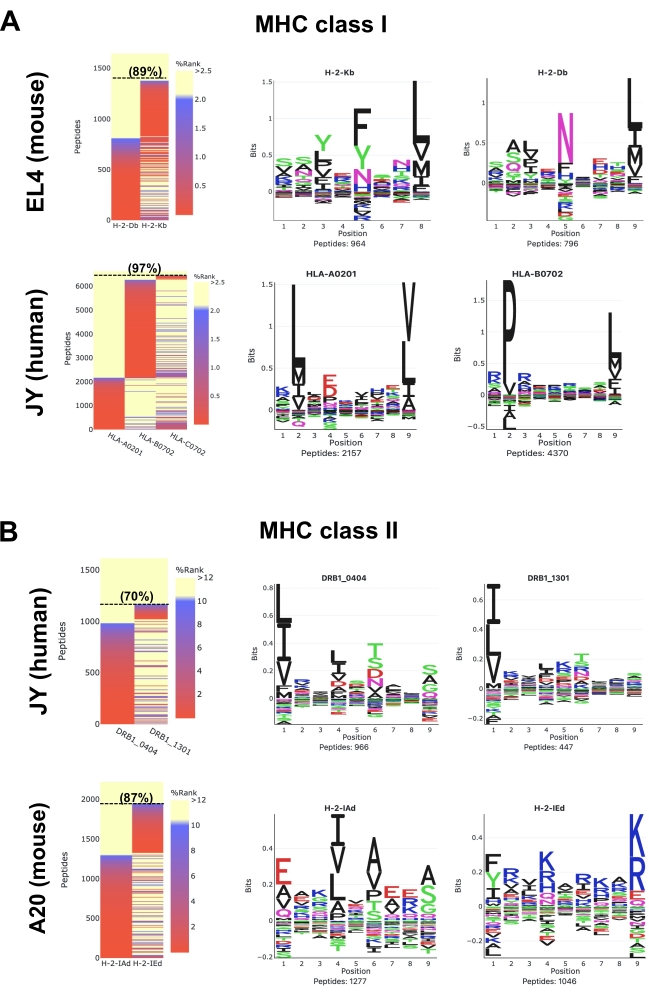
図5: MVP ソフトウェアツールを用いた免疫ペプチドミクスデータの可視化マウスおよびヒト(A)MHCクラスIおよび(B)MHCクラスIIペプチドのデータ分析。代表的な結合親和性ヒートマップ(左パネル)およびペプチド結合モチーフ(右パネル)を示す。ヒートマップカラーは、NetMHCpan 4.1(%ランク)によって予測されるMHC結合アフィニティーを表します。強いバインダーは赤(%ランク<0.5)、弱バインダーは青(%ランク<2)、非バインダーは黄色(%ランク>2)です。SBまたはWBである8-12merペプチド(A)および9〜22merペプチド(B)の割合(%)が括弧内に示されている。ペプチド結合モチーフは、MVPによって生成された'アレール特異的ギブスクラスター'オプションを使用した。これらの代表結果は、1 x 108細胞から得られ、以下の抗体および細胞株を用いて得られた:M1抗体およびEL4細胞はマウスMHCクラスIペプチド;ヒトMHCクラスIペプチドのW6/32抗体およびJY細胞;マウスMHCクラスIIペプチド用M5抗体およびA20細胞;ヒトMHCクラスIIペプチドに対するL243抗体およびJY細胞。MVP ソフトウェアによって生成された完全な HTML レポートにアクセスするには、補足データ 1-4 を参照してください。この図の大きなバージョンを表示するには、ここをクリックしてください。
補足データ 1-4: このファイルをダウンロードするには、ここをクリックしてください。
補足データ1:M1抗体を用いて1x108EL4細胞から単離したペプチドからMVPソフトウェアによって生成されたHTMLレポート。3つの生物学的複製が示される。この報告書は、図4および図5および代表的なペプチドに関連する補足表2に記載されている。
補足データ2:W6/32抗体を用いて1x108JY細胞から単離したペプチドからMVPソフトウェアによって生成されたHTMLレポート。3つの生物学的再プレートが示されている。この報告書は図4と図5に関連しており、代表的なペプチドは補足表2に記載されている。
補足データ3:L243抗体を用いて1x108JY細胞から単離したペプチドからMVPソフトウェアによって生成されたHTMLレポート。この報告書は図5に関連しており、代表的なペプチドは補足表2に記載されている。
補足データ4:M5抗体を用いて1x108A20細胞から単離したペプチドからMVPソフトウェアによって生成されたHTMLレポート。この報告書は図5に関連しており、代表的なペプチドは補足表2に記載されている。
補足表 1: バッファーのリスト。 プロトコルで使用されるすべてのバッファのレシピについて説明します。 このテーブルをダウンロードするには、ここをクリックしてください。
補足表2:H2Db/Kb、HLA-ABC、HLA-DR、およびH2-IAd/IDに関連するペプチドの代表的なリスト。この表には、マウスEL4およびA20細胞株からそれぞれ分離された代表的なMHCクラスIおよびIIペプチド、およびヒトJY細胞株からのHLAクラスIおよびIIのリストが含まれています。これらのデータは、プロテオメックスチェンジ(PXD028633)に預け入れされています。このテーブルをダウンロードするには、ここをクリックしてください。
データの可用性:
本稿で使用されたデータセットは、プロテオームエクスチェンジ(http://proteomecentral.proteomexchange.org/cgi/GetDataset)に寄託されました:PXD028633.
ディスカッション
2つのマウス細胞株(EL4およびA20)、1つのヒト細胞株(JY)、および5つの市販抗体[M1(抗H2Db/Kb)、Y3(抗H2Kb)、M5(抗H2-) IAd/IEd、W6/32(抗HLA-ABC)、L243(抗HLA-DR)は、このプロトコルのコンテキストでテストおよび検証され、高品質の免疫ペプチドミクスデータを提供しました。他の抗HLA抗体は利用可能である(例えば、抗HLA-A2 BB7.2)が、ここでテストされなかった。なお、W6/32抗体は、この分野で最も確立された抗体として広く使用されています。これは、ヒトのすべてのHLA-ABC分子によって提示されたペプチドの単離を可能にし、以前は専門家の研究室によって、新鮮または凍結組織8,39、末梢血単核細胞および骨髄単核細胞40、生検41、異種移植片41,42、検死43およびプラズマサンプルなどの様々な生物学的源から働くことを報告した。
プロトコル全体で使用される新しいソリューションの準備は非常に重要です。特に、ガラス瓶に新鮮な酸性溶液を使用することは、MSによって分析されたサンプルのその後の汚染を避けるために重要です。さらに、プロトコルが初めて、または新しい抗体で行われる場合、抗体が実際に青色のクマシーゲルを使用してCNBrセファローズビーズに結合されていることを評価することが重要です。MHCペプチド複合体の免疫的な捕捉に続く抗体結合ビーズの洗浄ステップは、非MHCペプチドの汚染を避けるためにも重要である。最後に、1%TFAを有するMHCペプチド複合体の溶出およびACN28%/0.1%FAを有するC18カラムからのペプチドの溶出に続く溶出物を廃棄しないように特別な注意が必要である。
文献で利用可能な既存のプロトコルは、分離手順の最後にペプチドをさらに精製するための追加のステップ、例えば、10〜30 kDa filter13,47を用いた異なる方法によるペプチド分別または限外ろ過を記述する。現在のプロトコルは、これらの追加のステップの詳細を提供していないし、高品質の免疫ペプチドミクスデータを提供するのに十分です.しかし、このようなステップは、ペプチド単離手順をさらに最適化するために、非専門家が修正およびトラブルシューティングを行うことを検討することができます。
ビーズの種類とビーズからMHC錯体を溶出するために使用される酸性溶出バッファーの種類も、トラブルシューティングのために13,14,15,16,17,18,19に変更することができます。この点に関して、セファロースCNBr活性化ビーズは、様々なタイプの抗体との結合の点で柔軟性を示す点に加えて比較的安価であるため、一般的に良い出発点である。現在のプロトコルにおいて、セファロースCNBr活性化ビーズは、5つの市販抗体(すなわち、M1、Y3、W6/32、L243、およびM5)を用いて比較的良好に作用することが示された。セファローズCNBr活性化ビーズに加えて、プロテインAまたはGまたはA / Gセファロース4ファストフロービーズも取り扱いやすく、比較的高価ですが、同様の結果を生成することができます。もう一つの考慮すべき要因は、プロテインAまたはGに対する抗体の親和性である。さらに、セファロースの磁性ビーズも非常に使いやすいが、比較的高価である。非専門家によって選択されたビーズの種類とは無関係に、図2に示すように、プロトコルの重要なステップでアリコートを収集し、青色のクマシー染色SDS-PAGEゲルを実行してビーズに対する抗体の結合効率を追跡することが奨励される。
MHCペプチド単離の成功に影響を与えるもう一つの重要な因子は、ビーズからMHCペプチド複合体を単離するために使用される酸性溶出緩衝液の種類を指す。異なる緩衝液は、0.1%、1%または10%のTFA、0.2%FAおよび10%の酢酸を含む報告されている。1%TFAは、試験したすべての抗体に対して働く溶出緩衝液であった。このステップは、 図3に示すように、MHCペプチドを捕捉するために使用されるMHC分子に対するウェスタンブロット法によっても追跡することができる。
アセトニトリル(ACN)および/またはトリフルオロ酢酸(TFA)を含むすべてのバッファーは攻撃的であり、プラスチックと接触した場合、可塑剤などの小さな分子および高分子物質でサンプルの汚染につながる可能性があります。このような問題を回避するために、有機溶剤および/またはTFAを含むすべてのソリューションを毎日新鮮に調製し、使用するまでガラス瓶に保管されます。ステップの大部分はプロテインLoBindプラスチック管で行われる。これらの管は、特にプロテオミクスのために設計されており、最高品質、殺生物剤、可塑剤、およびラテックスを含まないバージンポリプロピレン製です。また、スリップ剤を使用することなく、最適化された高度に研磨された金型で製造されています。これらの予防措置は、高品質の免疫ペプチドミクスデータの生成を可能にするために考慮することが重要です。
抗体は、MHC結合ペプチドの単離に対する重要な制限である。W6/32抗体は、ヒトにおけるHLA-ABCクラスI分子の全てによって提示されるペプチドの単離を可能にし、この分野で最も広く使用され、確立された抗体である。W6/32抗体の適用時に、特徴のないヒト細胞株または生体検体の高解像度HLAタイピングは必要ではないが、データ解釈を容易にするために特定のアプリケーションに推奨される。HLA/MHC タイピング情報は、複数のセルラインおよびマウス model49 のパブリック リソースでも見つけることができます。W6/32抗体以外にも、このプロトコルのコンテキストでテストおよび検証された4つの他の抗体(M1、M5、Y3、およびL243)はすべて市販されています。一方、以前の免疫ペプチドミクス研究で報告された他の多くの抗体は、コミュニティではほとんど採用されておらず、商業的に入手可能でないか、または比較的高価であるハイブリドーマ細胞株の培養を通じて入手可能である。
MHC結合ペプチドの単離に関するもう一つの重要な制限は、必要な出発物質の量である。必要量は、細胞表面上のMHC分子の発現量に反比例し、フローサイトメトリーによって定量することができる(図4A)。MHC分子の高発現レベルを示す細胞(例えば、樹状細胞および造血細胞全般)は、一般に、高品質の免疫ペプチド化データを得る。専門家のラボは5000万個のCells50を使用していますが、非専門家には1億〜10億個の細胞が推奨されています。組織生検(<13mg)41、異種移植片42、43、剖検44、および血漿45,46サンプルの使用も報告されたが、非専門の実験室では依然として困難である。また、推定されるMHC関連ペプチドの総数は、確立された細胞株(ここでは、使用される細胞株および抗体に応じて〜2000〜10000ペプチドの間)について十分に文書化されているが、この技術によって効率的に引き出される天然提示ペプチドの絶対量は議論されたままである。実際、これまでの研究では、単離手順の効率はペプチド依存性であり、0.5%〜2%51と低く可能であると推定された。免疫ペプチドミクスの他の制限は、あまり特徴のないMHC対立原にペプチドに正しくアノタネートするNetMHCpanスイートツールの方法と不備の再現性である。この点に関して、比較的新しいデータ非依存的な取得MSメソッド7、32、52、ならびに新しいペプチドクラスタリングおよびMHCペプチド結合予測アルゴリズム31,34,53,54のさらなる開発と応用 免疫ペプチドミクスにおけるペプチドアノテーションの再現性と精度の向上が期待されます。免疫ペプチドミクスは、MHC関連ペプチドのMS取得および計算分析に関する他の制限に直面しており、他の場所でカバーされています 1,6,55.
W6/32抗体を用いたヒト試料からのHLA-ABC関連ペプチドの単離は、多くの研究グループによって十分に確立され広く適用されており、マウスMHCクラスI-およびII関連ペプチドの単離は比較的確立されていない。したがって、マウスMHCリガンドの分離のための堅牢なプロトコルが必要です。ここでは、C57BL/6およびBALB/c起源の2つのマウス細胞株からのMHCクラスIペプチドおよびMHCクラスIIペプチドの分離に最適化されたプロトコルを提供します。具体的には、M1抗体を用いたクラスI H2Kb-およびH2Db関連ペプチド、ならびにM5抗体を用いたクラスII H2-IAdおよびH2-IEd関連ペプチドの単離を可能にする。したがって、現在のプロトコルの普及と応用は、様々なマウスモデルにおける基礎的および翻訳的免疫ペプチドミクス研究を促進すべきである。
このプロトコルは、免疫ペプチドミクスワークフローを確立および標準化し、新しいプロトコルのベンチマークにも使用できます。例えば、血液/血漿から新鮮または凍結組織、FFPE(ホルマリン固定パラフィン-埋め込み)に至るまで、様々な生物学的マトリックスで免疫ペプチドミクススクリーニングを行うために適応し、さらに最適化することができます。さらに、このプロトコルは、免疫ペプチドミクスにおけるサンプル調製手順の実験室内および検査間再現性を促進し、したがって、基礎および臨床研究における広い応用を見つけることが期待される。
開示事項
著者らは、競合する財政的利益はないと宣言している。
謝辞
ピエール・ティボー、エリック・ボニール、ジョエル・ラノワ、キャロライン・コテ(モントリオール大学免疫学・がん研究所)、アンソニー・パーセル(モナッシュ大学)の洞察に満ちたコメントに感謝します。この研究は、ケベック・フォンド・レシェルシュ・デュ・ケベック-サンテ(FRQS)、コール財団、CHUサントジャスティン、チャールズ・ブルノー財団、カナダイノベーション財団、国立科学工学研究評議会(NSERC)(#RGPIN-2020-05232)、カナダ保健研究所 174924(CIHR)からの資金援助によって支えられました。
資料
| Name | Company | Catalog Number | Comments |
| A20 cell line | ATCC | TIB-208 | mouse B lymphoblast |
| Acetonitrile, LC/MS Grade | FisherScientific | A955-4 | |
| anti-Human HLA A, B, C (W6/32) - MHC class I | BioXcell | BE0079 | |
| anti-Human/Monkey HLA-DR (L243) - MHC class II | BioXcell | BE0308 | |
| anti-Mouse H2 (M1/42.3.9.8) - MHC class I | BioXcell | BE0077 | |
| anti-Mouse H2-IAd/IEd (M5/114) - MHC class II | BioXcell | BE00108 | |
| anti-Mouse H2Kb (Y3) - MHC class I | BioXcell | BE0172 | |
| BupH Phosphate Buffered Saline Packs (PBS) | ThermoFisher | 28372 | Pouch contents dissolved in a final volume of 500 mL deionized water (FisherScientific, W64) |
| CHAPS (3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate) | EMDMilipore | 220201-10MG | |
| CNBr-activated Sepharose | Cytivia | # 17-0430-01 | |
| EL4 cell line | ATCC | TIB-39 | mouse T lymphoblast |
| epTIPS LoRetention Tips, 1000 µL/Eppendorf | FisherScientific | 02-717-352 | Better results with low retention material |
| epTIPS LoRetention Tips, 200 µL/Eppendorf | FisherScientific | 02-717-351 | Better results with low retention material |
| Formic Acid, LC/MS Grade | FisherScientific | A117-50 | |
| Glycine | FisherScientific | RDCG0250500 | |
| Hydrochloric acid solution | FisherScientific | 60-007-11 | |
| JY cell line | Sigma Aldrich | 94022533-1VL | EBV-immortalised B cell lymphoblastoid line |
| Methanol, LC/MS Grade | FisherScientific | A456-4 | |
| Poly prep chromatography columns (polypropylene column) | Bio-Rad | 731-1550 | referred as polypropylene column in the protocol |
| Proteases inhibitor | ThermoFisher | A32963 | 1 pellet per 10 mL of cell lysis buffer |
| Qifikit | Dako | K007811-8 | |
| Sodium Bicarbonate | Amresco | # 0865-1kg | |
| Sodium Chloride | FisherScientific | MSX04201 | |
| Solid phase extraction disk, ultramicrospin column C18 | The nest group | SEMSS18V | capacity of 6–60 µg, max volume of 200 µL |
| Trifluoroacetic Acid (TFA), LC-MS Grade | FisherScientific | PI85183 | |
| Tris | FisherScientific | T395-500 | |
| Tris-HCl | FisherScientific | #10812846001 | |
| Tube LoBind 1.5 mL/Eppendorf | FisherScientific | E925000090 | Better results with low retention material |
| Tube LoBind 2 mL/Eppendorf | FisherScientific | 13-698-795 | Better results with low retention material |
| Water, LC/MS Grade | FisherScientific | W64 |
参考文献
- Vizcaíno, J. A., et al. The human immunopeptidome project: A roadmap to predict and treat immune diseases. Molecular & Cellular Proteomics. 19 (1), 31-49 (2019).
- Caron, E., Aebersold, R., Banaei-Esfahani, A., Chong, C., Bassani-Sternberg, M. A case for a human immuno-peptidome project consortium. Immunity. 47 (2), 203-208 (2017).
- Arnaud, M., Duchamp, M., Bobisse, S., Renaud, P., Coukos, G., Harari, A. Biotechnologies to tackle the challenge of neoantigen identification. Current Opinion in Biotechnology. 65, 52-59 (2020).
- Caron, E., et al. The MHC I immunopeptidome conveys to the cell surface an integrative view of cellular regulation. Molecular Systems Biology. 7 (1), 533 (2011).
- Istrail, S., et al. Comparative immunopeptidomics of humans and their pathogens. Proceedings of the National Academy of Sciences of the United States of America. 101 (36), 13268-13272 (2004).
- Caron, E., Kowalewski, D. J., Koh, C. C., Sturm, T., Schuster, H., Aebersold, R. Analysis of major histocompatibility complex (MHC) immunopeptidomes using mass spectrometry. Molecular & Cellular Proteomics. 14 (12), 3105-3117 (2015).
- Caron, E., et al. An open-source computational and data resource to analyze digital maps of immunopeptidomes. eLife. 4, 07661 (2015).
- Bassani-Sternberg, M., et al. Direct identification of clinically relevant neoepitopes presented on native human melanoma tissue by mass spectrometry. Nature Communications. 7 (1), 13404 (2016).
- Gubin, M. M., et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens. Nature. 515 (7528), 577 (2014).
- Yadav, M., et al. Predicting immunogenic tumour mutations by combining mass spectrometry and exome sequencing. Nature. 515 (7528), 572-576 (2015).
- Laumont, C. M., et al. Noncoding regions are the main source of targetable tumor-specific antigens. Science Translational Medicine. 10 (470), 5516 (2018).
- Lill, J. R., et al. Minimal information about an immuno-peptidomics experiment (MIAIPE). Proteomics. 18 (12), 1800110 (2018).
- Nelde, A., Kowalewski, D. J., Stevanović, S. Antigen processing, methods and protocols. Methods in molecular biology. 1988, 123-136 (2019).
- Purcell, A. W., Ramarathinam, S. H., Ternette, N. Mass spectrometry-based identification of MHC-bound peptides for immunopeptidomics. Nature Protocols. 14 (6), 1687-1707 (2019).
- Ebrahimi-Nik, H., et al. Mass spectrometry driven exploration reveals nuances of neoepitope-driven tumor rejection. JCI Insight. 5 (14), 129152 (2019).
- Schuster, H., et al. A tissue-based draft map of the murine MHC class I immunopeptidome. Scientific Data. 5, 180157 (2018).
- Ritz, D., Gloger, A., Weide, B., Garbe, C., Neri, D., Fugmann, T. High-sensitivity HLA class I peptidome analysis enables a precise definition of peptide motifs and the identification of peptides from cell lines and patients sera. PROTEOMICS. 16 (10), 1570-1580 (2016).
- Bassani-Sternberg, M. Mass spectrometry based immunopeptidomics for the discovery of cancer neoantigens. Methods Mol Biol. 1719, 209-221 (2018).
- Lanoix, J., et al. Comparison of the MHC I Immunopeptidome Repertoire of B-Cell Lymphoblasts Using Two Isolation Methods. Proteomics. 18 (12), 1700251 (2018).
- Kuznetsov, A., Voronina, A., Govorun, V., Arapidi, G. Critical review of existing MHC I immunopeptidome isolation methods. Molecules. 25 (22), 5409 (2020).
- Urlaub, D., Watzl, C. Coated latex beads as artificial cells for quantitative investigations of receptor/ligand interactions. Current Protocols in Immunology. 131 (1), 111 (2020).
- Ghosh, M., et al. Guidance document: Validation of a high-performance liquid chromatography-tandem mass spectrometry immunopeptidomics assay for the identification of HLA class I ligands suitable for pharmaceutical therapies*. Molecular & Cellular Proteomics. 19 (3), 432-443 (2020).
- Fritsche, J., et al. Pitfalls in HLA ligandomics - How to catch a li(e)gand. Molecular & Cellular Proteomics. 20, 100110 (2021).
- Caron Lab. GitHub Available from: https://github.com/CaronLab/MhcVizPipe (2021)
- Jurtz, V., Paul, S., Andreatta, M., Marcatili, P., Peters, B., Nielsen, M. NetMHCpan-4.0: Improved peptide-MHC Class I interaction predictions integrating eluted ligand and peptide binding affinity data. The Journal of Immunology. 199 (9), 3360-3368 (2017).
- Reynisson, B., Alvarez, B., Paul, S., Peters, B., Nielsen, M. NetMHCpan-4.1 and NetMHCIIpan-4.0: improved predictions of MHC antigen presentation by concurrent motif deconvolution and integration of MS MHC eluted ligand data. Nucleic Acids Research. 48, 449-454 (2020).
- Andreatta, M., Alvarez, B., Nielsen, M. GibbsCluster: unsupervised clustering and alignment of peptide sequences. Nucleic Acids Research. 45 (1), 458-463 (2017).
- Nielsen, M., et al. NetMHCpan, a method for quantitative predictions of peptide binding to any HLA-A and -B Locus protein of known sequence. PLoS ONE. 2 (8), 796 (2007).
- Fortier, M. -. H., et al. The MHC class I peptide repertoire is molded by the transcriptome. The Journal of Experimental Medicine. 205 (3), 595-610 (2008).
- Marco, M. D., Schuster, H., Backert, L., Ghosh, M., Rammensee, H. -. G., Stevanovic, S. Unveiling the peptide motifs of HLA-C and HLA-G from naturally presented peptides and generation of binding prediction matrices. The Journal of Immunology. 199 (8), 2639-2651 (2017).
- Sarkizova, S., et al. A large peptidome dataset improves HLA class I epitope prediction across most of the human population. Nature Biotechnology. 38 (2), 199-209 (2019).
- Pak, H., et al. . Sensitive immunopeptidomics by leveraging available large-scale multi-HLA spectral libraries, data-independent acquisition and MS/MS prediction. 20, 100080 (2021).
- Racle, J., et al. Robust prediction of HLA class II epitopes by deep motif deconvolution of immunopeptidomes. Nature Biotechnology. 37 (11), 1283-1286 (2019).
- Abelin, J. G., et al. Defining HLA-II ligand processing and binding rules with mass spectrometry enhances cancer epitope prediction. Immunity. 51 (4), 766-779 (2019).
- Sofron, A., Ritz, D., Neri, D., Fugmann, T. High-resolution analysis of the murine MHC class II immunopeptidome. European Journal of Immunology. 46 (2), 319-328 (2015).
- Kovalchik, K. A., et al. Immunopeptidomics for Dummies: Detailed Experimental Protocols and Rapid, User-Friendly Visualization of MHC I and II Ligand Datasets with MhcVizPipe. bioRxiv. , (2020).
- Schuster, H., et al. The immunopeptidomic landscape of ovarian carcinomas. Proceedings of the National Academy of Sciences. 114 (46), 9942-9951 (2017).
- Berlin, C., et al. Mapping the HLA ligandome landscape of acute myeloid leukemia: a targeted approach toward peptide-based immunotherapy. Leukemia. 29 (3), 1-13 (2014).
- Rijensky, N. M., et al. Identification of tumor antigens in the HLA peptidome of patient-derived xenograft tumors in mouse. Molecular & Cellular Proteomics. 19 (8), 1360-1374 (2020).
- Heather, J. M., et al. Murine xenograft bioreactors for human immunopeptidome discovery. Scientific Reports. 9 (1), 18558 (2019).
- Marcu, A., et al. HLA ligand atlas: A benign reference of HLA-presented peptides to improve T-cell-based cancer immunotherapy. Journal for Immunotherapy of Cancer. 9 (4), 002071 (2021).
- Shraibman, B., et al. Identification of tumor antigens among the HLA peptidomes of glioblastoma tumors and plasma. Molecular & Cellular Proteomics. 18 (6), 1255-1268 (2019).
- Bassani-Sternberg, M., Barnea, E., Beer, I., Avivi, I., Katz, T., Admon, A. Soluble plasma HLA peptidome as a potential source for cancer biomarkers. Proceedings of the National Academy of Sciences. 107 (44), 18769-18776 (2010).
- Demmers, L. C., Heck, A. J. R., Wu, W. Pre-fractionation extends, but also creates a bias in the detectable HLA class Ι ligandome. Journal of Proteome Research. 18 (4), 1634-1643 (2019).
- Kowalewski, D. J., Stevanović, S. Antigen processing,. Methods and Protocols. 960, 145-157 (2013).
- Bentley, G., et al. High-resolution, high-throughput HLA genotyping by next-generation sequencing. Tissue Antigens. 74 (5), 393-403 (2009).
- Boegel, S., Löwer, M., Bukur, T., Sahin, U., Castle, J. C. A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines. OncoImmunology. 3 (8), 954893 (2014).
- Klaeger, S., et al. Optimized liquid and gas phase fractionation increases HLA-peptidome coverage for primary cell and tissue samples. Molecular & Cellular Proteomics. 20, 100133 (2021).
- Hassan, C., et al. Accurate quantitation of MHC-bound peptides by application of isotopically labeled peptide MHC complexes. Journal of Proteomics. 109, 240-244 (2014).
- Ritz, D., Kinzi, J., Neri, D., Fugmann, T. Data-independent acquisition of HLA Class I peptidomes on the Q exactive mass spectrometer platform. Proteomics. 17 (19), (2017).
- O'Donnell, T. J., Rubinsteyn, A., Laserson, U. MHCflurry 2.0: Improved pan-allele prediction of MHC Class I-presented peptides by incorporating antigen processing. Cell Systems. 11 (1), 42-48 (2020).
- O'Donnell, T. J., Rubinsteyn, A., Bonsack, M., Riemer, A. B., Laserson, U., Hammerbacher, J. MHCflurry: Open-source Class I MHC binding affinity prediction. Cell Systems. 7 (1), 129-132 (2018).
- Faridi, P., Purcell, A. W., Croft, N. P. In immunopeptidomics we need a sniper instead of a shotgun. Proteomics. 18 (12), 1700464 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved