Method Article
אימונופטידומיקה: בידוד של עכבר ו- MHC אנושי Class I- ופפטידים הקשורים II לניתוח ספקטרומטריית מסה
In This Article
Summary
כאן, אנו מציגים פרוטוקול לטיהור של MHC class I ומתחמי פפטיד מדרגה II מקווי עכבר ותא אנושי המספקים נתוני אימונופטידומיקה באיכות גבוהה. הפרוטוקול מתמקד בהכנת דגימה באמצעות נוגדנים זמינים מסחרית.
Abstract
אימונופטידומיקה היא תחום מתפתח המתדלק ומנחה את פיתוח החיסונים והאימונותרפיות. ליתר דיוק, הוא מתייחס למדע של חקירת הרכב הפפטידים המוצגים על ידי קומפלקס היסטו-תאימות גדול (MHC) מולקולות מדרגה I ומולקולות מדרגה II באמצעות פלטפורמות טכנולוגיות ספקטרומטריית מסה (MS). בין כל השלבים בזרימת עבודה חיסונית מבוססת MS, הכנה לדוגמה חשובה ביותר ללכידת נתונים באיכות גבוהה של רלוונטיות טיפולית. כאן, הוראות שלב אחר שלב מתוארות כדי לבודד MHC class I ופפטידים הקשורים II על ידי טיהור immunoaffinity מדגימות בקרת איכות, מעכבר (EL4 ו- A20) וקווי תאים אנושיים (JY) באופן ספציפי יותר. הריאגנטים השונים והנוגדנים הספציפיים מתוארים ביסודיות כדי לבודד פפטידים הקשורים ל- MHC מקווי תאים אלה, כולל השלבים לאימות היעילות מחייבת החרוזים של הנוגדנים ויעילות ההמלטה של מתחמי הפפטיד MHC-פפטיד מהחרוזים. ניתן להשתמש בפרוטוקול כדי להקים ולתקן זרימת עבודה של אימונופטידומיקה, וכן כדי לסמן פרוטוקולים חדשים. יתר על כן, הפרוטוקול מהווה נקודת התחלה נהדרת עבור כל מי שאינו מומחה בנוסף לטפח את הרבייה התוך-מעבדתית של תהליך הכנת המדגם באימונופפטידומיקה.
Introduction
במהלך העשור האחרון, העניין בחקירת הרפרטואר של פפטידים הקשורים ל- MHC חרג מהמגזר האקדמי והגיע לתעשיות הביוטכנולוגיה והתרופות. ואכן, בסרטן, גילוי של neoantigens ספציפי לגידולים מעשיים מייצג מוקד מחקר מרכזי במגזר התעשייתי לפתח אימונותרפיות קליניות המובילות לאונקולוגיה מותאמת אישית1,2,3. ביסודו של דבר, פפטידים הקשורים ל- MHC מוצגים בכל הגוף, משקפים את השלב התאי של התא, והם משמעותיים בתנאי מחלה שונים כגון אוטואימוניות, השתלה, מחלות זיהומיות, דלקת, סרטן ואלרגיות1,4. לכן, פפטידים הקשורים ל- MHC, או ליגנדים אנטיגן לויקוציטים אנושיים (HLA) בבני אדם, הם בעלי עניין רפואי רב והם מכונים באופן קולקטיבי אימונופטידום5.
טרשת נפוצה היא גישה אנליטית רבת עוצמה לאפיון את האימונופטידום6,7, כולל גילוי של גידול ספציפי neoantigens8,9,10,11. זרימת עבודה טיפוסית לביצוע ניסוי חיסוני כוללת שלושה שלבים עיקריים: 1) הכנה מדגמית לבידוד פפטידים הקשורים ל- MHC, 2) רכישת נתונים על ידי MS ו- 3) ניתוח נתונים באמצעות כלי תוכנה חישוביים שונים12. יצירת דגימות באיכות גבוהה המתוארות בפרוטוקול חזותי זה היא קריטית להצלחתו של כל פרויקט באימונופפטידומיקה מבוססת MS. הפרוטוקול המתואר להלן מתמקד בבידוד פפטידים הקשורים ל- MHC class I ו- II מקווי תאים מבוססים היטב המתאימים ליצירת נתוני אימונופטידומיקה באיכות גבוהה. תוצאות מייצגות מקווי תא אלה מוצגות בפרוטוקול הנוכחי.
Protocol
הפרוטוקול שסופק כאן הותאם מפרוטוקולים שנקבעו13,14,15,16,17,18,19,20. ההליך הכולל לטיהור חיסונים (IP) של פפטידים מסוג MHC I ו- II מומחש באיור 1. עיין בטבלת החומרים לקבלת פרטים אודות קווי התאים והנוגדנים בהם נעשה שימוש.
1. צימוד חרוזים עם הנוגדנים (יום 1): זיווג נוגדנים לחרוזים המופעלים על ידי CNBr
הערה: הכינו פתרונות חדשים לכל ניסוי חדש. עיין בטבלת החומרים וטבלה משלימה 1 לרשימת המתכונים של ריאגנטים ופתרונות. כל השלבים מתבצעים בטמפרטורת החדר (RT). בעת שימוש בנוגדן חדש, בדקו את יעילות האיגוד על-ידי איסוף aliquots מפתח (ראו אינדיקציה OPTIONAL) וביצוע SDS-PAGE מכתים כחולים של Coomassie (איור 2).
- הפעלה של חרוזי CNBr sepharose
- שוקלים 80 מ"ג של חרוזים המופעלים על ידי CNBr לכל דגימה ומעבירים אותם לצינור חרוטי של 15 מ"ל.
- כדי להקל על resuspension של חרוזים מיובשים, הראשון, להוסיף 5 מ"ל של 1 מ"מ M HCl ו pipette למעלה ולמטה 5 פעמים. לאחר מכן, למלא את הצינור החרוטי עם 8.5 מ"ל נוספים של 1 מ"מ HCl.
- יש לסובב במהירות של 20 סל"ד (סיבובים לדקה) למשך 30 דקות ב-RT באמצעות התקן סיבוב. צנטריפוגה החרוזים ב 200 x g במשך 2 דקות ב RT ולהסיר את supernatant על ידי שאיפה.
- מוסיפים 500 μL של חיץ צימוד לכדור החרוזים ומעבירים לצינור צנטריפוגה חדש של 2.0 מ"ל ושומרים בצד לשלב 1.2.2.
- צימוד נוגדנים לחרוזים המופעלים על ידי CNBr
- הכן את הנוגדן שנבחר לבידוד של פפטידים מסוג MHC I או II בצינור מיקרוצנטריפוגה חדש של 2.0 מ"ל על ידי הוספת 2 מ"ג של הנוגדן (על פי הריכוז שצוין על ידי היצרן). השלם את הנפח ל 1 מ"ל עם פתרון חיץ צימוד כדי לקבל ריכוז סופי של 2 מ"ג / מ"ל.
- צנטריפוגה החרוזים משלב 1.1.4 ב 200 x g במשך 2 דקות ב RT ולאחר מכן להסיר את supernatant על ידי שאיפה.
- הוסף את תמיסת הנוגדנים לצינור המיקרו-צנטריפוגה 2.0 מ"ל המכיל את החרוזים הפעילים.
- (אופציונלי) קח aliquot של 18 μL (קלט), להוסיף 6 μL של מאגר SDS-PAGE 4x, ולהקפיא מיד.
- סובב את שפופרת המיקרו-צנטריפוגה משלב 1.2.3 ב-20 סל"ד למשך 120 דקות באמצעות התקן סיבוב. צנטריפוגה החרוזים ב 200 x g במשך 2 דקות ולאחר מכן להסיר את supernatant.
- (אופציונלי) קח aliquot של 18 μL של supernatant (נוגדן לא מאוגד), להוסיף 6 μL של 4x SDS-PAGE חוצץ ולהקפיא מיד.
- חסימה ושטיפה של נוגדנים עם חרוזים
- הוסף 1 מ"ל של 0.2 M גליצין לצינור microcentrifuge המכיל את החרוזים מצמידי הנוגדנים משלב 1.2.5. סובב במהירות של 20 סל"ד למשך 60 דקות ב- RT באמצעות התקן סיבוב.
- צנטריפוגה החרוזים ב 200 x g במשך 2 דקות, ולאחר מכן להסיר את supernatant. יש להוסיף מ"ל אחד של PBS (תמיסת מלח חוצצת פוספט).
- צנטריפוגה החרוזים ב 200 x g במשך 2 דקות, ולאחר מכן להסיר את supernatant.
- (אופציונלי) קח aliquot של 18 μL של supernatant (נוגדן מאוגד, לשטוף האחרון), להוסיף 6 μL של 4x SDS-PAGE חיץ ולהקפיא מיד.
- הוסף 1 מ"ל של PBS לחרוזים בשלב 1.3.3.
- (אופציונלי) קח aliquot של 18 μL של תערובת חרוזים (חרוזים בשילוב עם נוגדן), להוסיף 6 μL של 4x SDS-PAGE חיץ, ולהקפיא מיד.
- יש לשמור בטמפרטורה של 4 מעלות צלזיוס עד לשימוש באותו יום בשלב 2.5.
הערה: ניתן להכין חרוזים יום לפני האימונו-כיפה, אך אחסון ארוך יותר לא נבדק.
2. תמוגה תאית ואימונוכיטור עם נוגדנים עם חרוזים משולבים (יום 1)
הערה: רמת מולקולות ה-MHC משתנה מסוג תא אחד לאחר, ומוצע לכימות של מולקולות MHC/HLA לכל תא21 (איור 4A). אנו ממליצים על מינימום של 1 x 108 תאים עבור כל IP. מספר זה של תאים מתאים 6-10 מ"ג של חלבון מתאי JY, EL4, ו- A20 solubilized עם 0.5% חיץ Chaps. כדי להכין כדורי תאים עבור כתובות IP, תאים צריכים להיות נקצרים, צנטריפוגה, ושטוף פעמיים עם 5 מ"ל של PBS. לאחר מכן, כדורי תא ניתן לאחסן בצינור microcentrifuge 1.5 מ"ל או צינור חרוטי 15 מ"ל ב -80 °C (80 °F) עד הזמן של IP. שים לב שניתן לבצע כתובות IP על כדורי תאים טריים שנקטפו או קפואים.
- כדי לבודד פפטידים מסוג MHC I או II, להפשיר גלולה קפואה של 1 x 108 תאים על ידי חימום החלק התחתון של הצינור עם כף היד. מוסיפים 500 μL של PBS לכדור ופיפטה למעלה ולמטה עד ההשעיה הומוגנית.
הערה: בהתאם לסוג התא, נפח גלולה התא יכול להשתנות באופן משמעותי. אם 500 μL של PBS אינו מספיק כדי להמיס את גלולה התא, להשתמש יותר PBS עד התאים להתפרק בקלות תוך צנרת למעלה ולמטה. - למדוד את הנפח הכולל של הכדור resuspended ב- PBS ולהעביר לתוך צינור חדש 2 מ"ל צינור microcentrifuge צינור. לפצל לצינורות נוספים במידת הצורך.
- הוסף נפח של מאגר תמוגה תא (1% chaps חוצץ PBS המכיל מעכבי פרוטאז, 1 גלולה / 10 מ"ל של חוצץ) שווה ערך לנפח של גלולה תא resuspended ב PBS נמדד בשלב הקודם. הריכוז הסופי של מאגר תמוגה הוא 0.5% בחורים.
- סובב ב-10 סל"ד למשך 60 דקות ב-4 °C (4 °F) באמצעות התקן סיבוב. צנטריפוגה lysate התא ב 18,000 x g במשך 20 דקות ב 4 °C (4 °F ) עם בלם מלא ולהעביר את supernatant (המכיל את מתחמי MHC-פפטידים) בצינור מיקרוצנטריפוגה חדש 2.0 מ"ל.
- לשחזר את החרוזים מצמידים נוגדנים משלב 1.3.7 על ידי צנטריפוגה ב 200 x גרם במשך 2 דקות ולהסיר את supernatant.
- העבר את תא lysate supernatant בשלב 2.4 לחרוזים מצמידי הנוגדנים ודגר עם סיבוב (10 סל"ד) במשך 14-18 שעות (לילה) ב 4 °C (4 °C (65 °F) באמצעות מכשיר סיבוב.
3. הברחה של פפטידים MHC (יום 2)
הערה: עמודת פוליפרופילן מאפשרת התפעלות של מתחמי MHC-פפטיד תוך שמירה על החרוזים בעמודה. על מנת להעריך את היחס היחסי של מתחמי MHC-פפטידים התחום לחרוזים לפני ואחרי ההמלטות החומצית עם 1% TFA (חומצה משולשת), ניתן לבצע כתם מערבי עם aliquots שננקטו בשלבים מרכזיים במהלך הפרוטוקול (ראה אינדיקציה אופציונלית). סופג מערבי המוצג באיור 3 חושף את ההעשרה של מתחמי MHC-פפטידים בעקבות ההרחבה החומצית עם 1% TFA. היעדר האות בשבר זה יצביע על כך ששלב ההמלטה לא הצליח. שים לב כי חלקם של מתחמי MHC-פפטידים מאוגדים לחרוזים ניתן להעריך גם במקביל על ידי סופג מערבי באמצעות aliquot המתואר בשלב 3.1.6.
- התרחבות של מתחמי MHC-פפטיד מהנוגדנים החרוזים
- הסר את המכסה התחתון של עמודת הפוליפרופילן, הנח את העמודה על ארון העמודות פוליפרופילן והתקין מיכל ריק מתחת כדי לאסוף זרימה דרכו.
הערה: נדרשת עמודה אחת לכל דגימה. - לשטוף את עמודת פוליפרופילן עם 10 מ"ל של חוצץ A ולתת לו לנקז על ידי כוח המשיכה. אם מהירות הזרימה של ההמלטות הנוזלית איטית מדי, חתוך עוד יותר את הקצה התחתון של עמודת הפוליפרופילן.
- למדוד ולאסוף את תערובת חרוזים-lysate (~ 2 מ"ל) משלב 2.5 ולהעביר אותו לתוך עמודת פוליפרופילן.
- (אופציונלי) קח aliquot של 20 μL (או 1/100 מתוך הנפח הכולל) עבור סופג מערבי להקפיא מיד. שבר זה מתאים לתרכובות MHC-פפטידים הכוללות המדגרות עם החרוזים.
- תן לתערובת הנוזלית לברוח על ידי כוח המשיכה.
- (אופציונלי) לאסוף ולמדוד את הזרימה דרך ולקחת aliquot של 20 μL (או 1/100 מתוך הנפח הכולל) עבור סופג מערבי להקפיא מיד. שבר זה מייצג את שאריות תסביכי MHC-פפטידים לא מאוגדים.
- כדי לשחזר את תערובת החרוזים-lysate ככל האפשר, לשטוף את הצינור משלב 3.1.3 עם 1 מ"ל של חוצץ A ולהעביר אותו לעמודת פוליפרופילן.
- לשטוף את החרוזים שנשמרו בעמודה פוליפרופילן על ידי הוספת 10 מ"ל של חוצץ A. תן למאגר הכביסה לברוח על ידי כוח המשיכה.
- חזור על שלב הכביסה עם 10 מ"ל של חיץ B, 10 מ"ל של חוצץ A ולאחר מכן 10 מ"ל של חיץ C.
- הסר את עמודת הפוליפרופילן מהמדף והנח אותה על גבי צינור מיקרוצנטריפוגה חדש של 2.0 מ"ל. החזק את העמוד ואת הצינור יחד עם היד.
- הוסף 300 μL של 1% TFA לעמודת פוליפרופילן ולערבב את החרוזים על ידי צנרת למעלה ולמטה 5 פעמים.
הערה: החרוזים יישמרו בעמודת הפוליפרופילן, והפפטידים הקשורים ל- MHC יתעלמו בצינור המיקרו-צנטריפוגה של 2.0 מ"ל. - מעבירים את ההמלטה בצינור מיקרוצנטריפוגה חדש של 2.0 מ"ל. חזור על שלב 3.1.11 ובריכה את 2 eluates (eluates המכיל את מתחמי MHC-פפטיד צריך להתאים סך של 600 μL וישמש בשלב 3.2.4).
- (אופציונלי) לאסוף aliquot של 6 μL (או 1/100 של הנפח הכולל) עבור סופג מערבי להקפיא מיד. שבר זה מתאים למתחמי MHC-פפטידים שנמלטו מהחרוזים.
- הסר את המכסה התחתון של עמודת הפוליפרופילן, הנח את העמודה על ארון העמודות פוליפרופילן והתקין מיכל ריק מתחת כדי לאסוף זרימה דרכו.
- התפלה והרחבה של פפטידים MHC
הערה: התפלה והרחקה של שלבי פפטידים MHC יכול להיעשות על ידי התקנת העמודה C18 על צינור מיקרוצנטריפוגה 2.0 מ"ל. להתאמה טובה יותר, התקן את החישולים המסופקים על ידי היצרן בין העמודה C18 לבין צינור מיקרוצנטריפוגה 2.0 מ"ל. בפרוטוקול זה, נעשה שימוש בעמודת C18 עם קיבולת עוצמת קול של 5-200 μL (6-60 מיקרוגרם). כל השלבים מתבצעים ב- RT.- הוסף 200 μL של מתנול על גבי עמודה C18, ולאחר מכן צנטריפוגה ב 1546 x g במשך 3 דקות. להשליך את הזרימה דרך.
- הוסף 200 μL של 80% ACN (acetonitrile)/0.1%TFA מעל העמודה C18, ולאחר מכן צנטריפוגה ב 1546 x g במשך 3 דקות. להשליך את הזרימה דרך.
- הוסף 200 μL של 0.1%TFA על גבי העמודה C18, ולאחר מכן צנטריפוגה ב 1546 x g במשך 3 דקות. להשליך את הזרימה דרך.
- טען 200 μL של מתחמי MHC-פפטיד משלב 3.1.12 מעל העמודה C18. צנטריפוגה ב 1546 x g במשך 3 דקות ולהשליך את הזרימה דרך.
- חזור על שלב 3.2.4 פעמיים עד לטעינת אמצעי האחסון המלא. שים לב שפפטידים של MHC נשמרים בעמודה C18.
- הוסף 200 μL של 0.1%TFA לעמודה C18, ולאחר מכן צנטריפוגה ב 1546 x g במשך 3 דקות. להשליך את הזרימה דרך.
- העבר את עמודת C18 לצינור מיקרו-צנטריפוגה חדש של 2.0 מ"ל. הפחת פפטידים MHC מהעמודה C18 על-ידי הוספת 150 μL של 28%ACN/0.1%TFA.
- צנטריפוגה ב 1546 x g במשך 3 דקות.
- העבר את הזרימה דרך בצינור מיקרוצנטריפוגה חדש 1.5 מ"ל. היזהר לא להשליך את הזרימה דרך; הוא מכיל את הפפטידים המבודדים מסוג MHC I או II.
- חזור על שלבים 3.2.7-3.2.9 פעמיים עבור נפח כולל של 450 μL.
- להקפיא את 450 μL של eluate (מטוהר MHC class I או II פפטידים) ב -20 °C (20 °F) עד דגימות מנותחות על ידי LC-MSMS.
- לפני ניתוח LC-MS/MS, פפטידים מטוהרים מסוג MHC I או II משלב 3.2.11 מתאדים ליובש באמצעות רכז ואקום עם הגדרות קבועות מראש של 45 °C (45 °F) עבור 2 שעות, רמת ואקום: 100 mTorr ורמפה ואקום: 5.
הערה: האידוי של דגימות קפואות הוא יעיל מאוד. פפטידים מיובשים ניתן להקפיא מחדש עד ניתוח.
4. זיהוי פפטידים מסוג MHC I ו- II על ידי LC-MS / MS
הערה: נתח את החיסון MHC Class I ו- II באמצעות Orbitrap בעל ביצועים גבוהים וספקטרומטרים של מסה של זמן טיסה מרובע ברזולוציה גבוהה6. המידע הבא ניתן כאינדיקציה בלבד, תוך התחשבות בכך שכלי הספקטרומטריה השונים הקיימים של מסת טנדם פועלים על פי סטנדרטים תפעוליים שונים. מתווה קצר של השלבים נדון להלן :
- Solubilize את הדגימות היבשות (משלב 3.2.12) ב 50 μL של 4% חומצה פורמית (FA).
- טען שלוש זריקות של 16 μL עבור כל מדגם ונפרד בעמודה הפוכה תוצרת בית (150-μm i.d. על ידי 250 מ"מ אורך, יופיטר 3 מיקרומטר C18 300 Å) עם שיפוע מ 5%-30% ACN-0.1% FA וקצב זרימה של 600 nL / min על UHPLC ננו-זרימה מחובר MS.
- רכש כל ספקטרום MS מלא ברזולוציה של 120000, AGC של 4 x 105 עם מצב אוטומטי לזמן ההזרקה וספקטרה באמצעות טנדם-MS (MS-MS) על יונים קודמים טעונים כפולים הנפוצים ביותר עבור מקסימום של 3 s.
הערה: ניסויי טנדם-MS מבוצעים באמצעות דיסוציאציה מתנגשת באנרגיה גבוהה יותר (HCD) באנרגיית התנגשות של 30%, רזולוציה של 30,000, AGC של 1.5 x 105 וזמן הזרקה של 300 אלפיות השנייה. - לעבד את קבצי הנתונים משלוש הזריקות / מדגם באמצעות תוכנת ניתוח פרוטאומיקה LC-MS / MS (למשל, PEAKS X) באמצעות העכבר ומאגרי מידע אנושיים (UniProtKB / Swiss-Prot (2019_09)).
- בחרו 'עיכול אנזימים שלא צוין' לפרמטר האנזים, ו-10 עמודים לדקה ו-0.01 Da לטולרנסים המוניים על יונים מבשרים ורסיסים, בהתאמה.
הערה: שינויים משתנים הם deamidation (NQ) וחמצון (ז). כל פרמטרי החיפוש האחרים הם ערכי ברירת המחדל. רשימות פפטיד סופיות מסוננות באמצעות ALC של 80% ועם שיעור גילוי כוזב (FDR) של 1% באמצעות תוכנת ניתוח LC-MS/MS של proteomics.
5. הדמיה של נתוני אימונופטידומיקה
הערה: ניתן להעריך את איכות נתוני האימונופטידומיקה הנוצרים על ידי MS בדרכים מרובות, כפי שתואר לאחרונה 22,23. כדי להמחיש את הנתונים ולהעריך את האיכות הכוללת שלהם, הרכב וספציפיות MHC, ניתן להשתמש בכלי התוכנה MhcVizPipe (MVP).
- בצע את כל ההוראות והתיעודים הקשורים כדי להתקין ולהפעיל את תוכנת ה- MVP הזמינה באתר האינטרנט של מעבדת קארון GitHub24.
הערה: ה-MVP מספק תצוגה מהירה ומאוחדת של איכות הדגימה, הרכב וספציפיות MHC. MVP מקביל לשימוש באלגוריתמים אימונופטידומיים מבוססים היטב (NetMHCpan25, NetMHCIIpan26 ו- GibbsCluster27) ומפיק דוחות מאורגנים וקלים להבנה בתבנית HTML (שפת סימון היפר-טקסט). הדוחות ניידים לחלוטין וניתן לצפות בהם בכל מחשב עם דפדפן אינטרנט מודרני. ראה נתונים משלימים 1-4 לקבלת דוגמאות של דוחות HTML.
תוצאות
זרימת העבודה הכללית לבידוד מתחמי MHC-פפטיד לניתוח חיסונים על ידי טרשת נפוצה מודגמת באיור 1. מוצגות תוצאות מייצגות לאימות היעילות המחייבת של הנוגדן (איור 2) (באמצעות נוגדן Y3 נגד H2Kb) ויעילות ההרחבה של מתחמי MHC-פפטיד מהחרוזים (איור 3) (באמצעות נוגדן W6/32 נגד HLA-ABC). בדיקות כימות מבוססות ציטומטריות זרימה21 הוחלו גם כדי למדוד את המספר המוחלט של מולקולות MHC class I לכל תא EL4 (H2Kb ו- H2Db) ותא JY (HLA-ABC), כפי שמוצג באיור 4A.
השכפול הפנימי הבין-פרטני של התוצאות באמצעות הפרוטוקול הנוכחי מוצג באיור 4B-E. תוצאות מייצגות מוצגות עבור פפטידים מסוג MHC I שזוהו מ-1 x 108 תאי EL4 ו-1 x 108 תאי JY. התוצאות נוצרו משני חברי מעבדה שונים (משתמש 1 ומשתמש 2). עבור משתמש 1, המספר הממוצע של פפטידים ספציפיים ל- MHCI שזוהו מתאי EL4 ו- JY היה 1341 ו- 6361, בהתאמה; עבור משתמש 2, 1933 ו- 7238, בהתאמה (איור 4B, D). מקדם הווריאציה הממוצע (CV) עבור מספר הפפטידים שזוהו בשלושה שכפולים/ניסויים ביולוגיים שונים נע בין 1.9%-11% (איור 4B,D). למרות שקורות החיים של מספר הפפטידים שזוהו בשלושת הניסויים השונים היו קטנים יחסית, זהות הפפטידים השתנתה במידה ניכרת (איור 4C,E). ואכן, דיאגרמות Venn מייצגות מראות כי שיעור הפפטידים שזוהו באופן רבייה על פני שלושה שכפולים ביולוגיים נע בין 39% (משתמש 2, תאי EL4) ל -63% (משתמש 1, תאי JY) (איור 4C, E וטבלה משלימה 2).
מפות חום שנוצרו על ידי תוכנת MVP מציגות חוזק מחייב MHC חזוי של הפפטידים המזוהים באמצעות כלי חבילת NetMHCpan25,26,28. שתי אפשרויות שגרה GibbsCluster, אשר מכונים "GibbsCluster ללא פיקוח" ו "אלל ספציפי GibbsCluster", מבוצעים גם על ידי MVP כדי לחלץ מוטיבים מחייב פפטיד MHC. שים לב של-MVP יש מגבלות; מטרתו העיקרית היא לא לחלץ מוטיבים ספציפיים לאלל ולציין פפטידים בצורה מדויקת ביותר, אלא לספק מבט ממעוף הציפור על האיכות הכוללת, ההרכב והספציפיות של MHC של הדגימות.
עבור פפטידים מסוג עכבר MHC I (H2Db ו- H2Kb) בתאי EL4 (איור 5A; לוחות עליונים ונתונים משלימים 1), מפת חום מייצגת מראה כי 89% מכל הפפטידים שזוהו ב-8-12 מ"ר צפויים להיות קלסרים חזקים (SB: NetMHCpan %Rank <0.5) או קלסרים חלשים (WB: NetMHCpan %Rank <2) עבור מולקולות H2Db או H2Kb. אשכולות רצף שנוצרו מהפפטידים של 8-12 mer נמצאים בקונקורדנציה עם סמלי לוגו מדווחים עבור H2Db (אספרגין ב-P5 ולאוצין ב-P9) ו-H2Kb (פנילאלנין ב-P5 ולאוצין ב-P8) (איור 5)29. ראוי להזכיר כי מוטיב דומיננטי שלישי (היסטידין ב P7 ולאוצין ב P9) כמו גם מוטיבים 'חפצים' נוספים ניתן לראות באמצעות נוגדן M1 (נתונים משלימים 1). למעשה, ידוע כי נוגדן M1 מגיב באופן צולב עם מולקולת ה-Qa2 הלא-קלאסית, ולכן, פפטידים הקשורים ל-Qa2 מזוהים גם על ידי MS (נתונים משלימים 1). כאן, לפשטות, איור 5 מתמקד בהצגת מוטיבים מחייבים פפטיד מבוססים היטב עבור שני אללי H2b הקלאסיים (כלומר H2Db או H2Kb) המתבטאים בתאי EL4.
עבור פפטידים אנושיים מסוג HLA Class I (HLA-ABC) בתאי JY (איור 5A; לוחות נמוכים יותר ונתונים משלימים 2), מפת חום מייצגת מראה כי 97% מכל הפפטידים שזוהו ב-8-12 מ"ר צפויים להיות SB או WB עבור HLA-A*0201, -B*0702 או -C*0702. פפטידים היו מקובצים כדי לדמיין מוטיבים מחייבים פפטיד עבור HLA-A *0201 ו--B*0702. מוטיב איגוד עבור HLA-C*0702 אינו מוצג באיור 5A מכיוון שלאלל C*0702 יש רמת ביטוי נמוכה יחסית. לכן מעט מדי פפטידים C *0702 היו מבודדים וזוהו כדי ליצור מוטיב C *0702 נציג. שים לב שניתן לדמיין את המוטיב C*0702 במחקרים אחרים30,31,32 או מאתר האינטרנט של מציג המוטיבים NetMHCpan 4.133.
עבור פפטידים אנושיים מסוג HLA II (HLA-DR) בתאי JY (איור 5B; לוחות עליונים ונתונים משלימים S3), מפת חום מייצגת מראה כי 70% מכל הפפטידים שזוהו ב-9-22 מ"ר צפויים להיות SB או WB עבור HLA-DRB1*0404 ו-DRB1*1301. מוטיבים מחייבים פפטידים עבור שני אללים אלה מוצגים (איור 5B). שים לב שהמוטיבים המחייבים פפטיד המוצגים כאן עשויים שלא להיות בקונצנזורה מלאה עם הלוגואים שדווחו לאחרונה עבור HLA-DRB1*0404 ו- -DRB1*130134. אי התאמה זו מדגישה את חוסר היכולת הנוכחי של MVP/NetMHCpan להוסיף ביאור מדויק של פפטידים לאללים מסוג HLA II המאופיינים פחות, כגון HLA-DRB1*0404 ו-DRB1*1301 המתבטאים בתאי JY. מידע נוסף על מוטיבים מחייבים פפטיד מדרגה II ניתן למצוא במחקרים אחרים34,35 ומאתר NetMHCIIpan 4.0 מוטיב Viewer36.
לבסוף, עבור פפטידים מסוג MHC CLASS II (H2-IAd ו-H2-IEd) בתאי A20 (איור 5B; לוחות נמוכים יותר ונתונים משלימים 4), מפת חום מייצגת מראה כי 87% מכל הפפטידים שזוהו ב-9-22 מ"ר צפויים להיות SB או WB עבור H2-IAd או H2-IEd. מוטיבים מחייבים פפטיד עבור שני אללים אלה נמצאים בקונקורדנציה עם לוגו שדווח37.
דוחות HTML מלאים שנוצרו על ידי תוכנת MVP כדי להעריך את האיכות הכוללת ואת הספציפיות MHC של הדגימות זמינים בנתונים משלימים 1-4.
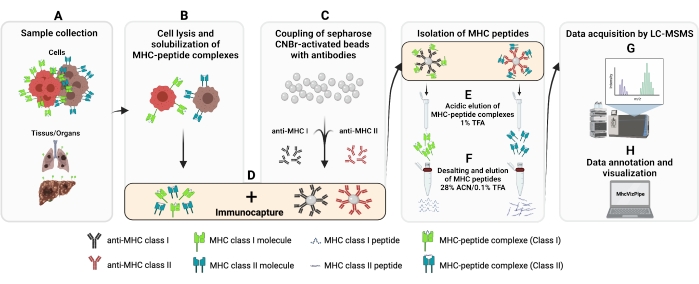
איור 1: סכמטי של ההליך המלא לבידוד של פפטידים מסוג MHC I ו- II. (A-B)100 מיליון תאים הם גלולה וlysed עם 0.5% חוצץ Chaps. (ג) lysate התא הוא צנטריפוגה, ואת supernatant מתווסף חרוזים CNBr-sepharose יחד עם הנוגדן הרצוי מראש (D) דגירה 14-18 שעות ב 4 °C (6 °F) (ה) בעקבות immunocapture, החרוזים מועברים לתוך עמוד פוליפרופילן נשטף, ואת מתחמי MHC-פפטיד הם eluted עם פתרון TFA 1%. (ו) הפפטידים מותפלים ומטוהרים באמצעות עמודה C18. (ז) לאחר מכן, פפטידים הם במהירות פנויה מיובשת ומנותחת על ידי ספקטרומטריית מסה דו-מושבית. (H) ניתן להעריך את איכות הפפטידים המבודדים מסוג MHC I ו- II בהתבסס על תת-הסוגים של HLA באמצעות תוכנת MhcVizPipe הזמינה בחופשיות. איור שנוצר באמצעות BioRender.com (NT22ZL8QSL). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
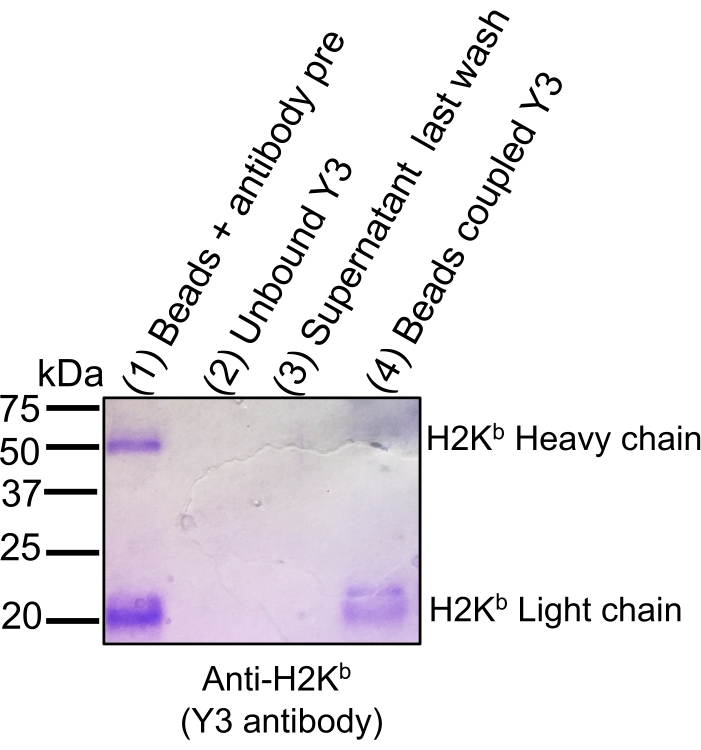
איור 2: כתמי ג'ל Coomassie כדי לעקוב אחר יעילות איגוד הנוגדנים לחרוזים המופעלים על ידי Sepharose CNBr. Aliquots של כרכים שווים הועמסו על 12% SDS-PAGE ג'ל ואחריו כתמים כחולים Coomassie: חרוזים + נוגדנים טרום צימוד (1), נוגדן לא מאוגד בעקבות שלב צימוד (2), supernatant בעקבות הכביסה האחרונה לאחר צימוד (3), וחרוזים בשילוב עם נוגדן (4). היעילות של הכריכה מודגמת על ידי ירידה משמעותית בעוצמת כתמי האות של השרשראות הקלות והכבדות של H2Kb כאשר חרוזים קשורים באופן קוולנטי (נתיב 4) לחרוזי CNBr בהשוואה לנוגדן לפני צימוד (נתיב 1). הדמות הודפסה מחדש והותאמה מ-bioRxiv38. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: סופג מערבי למעקב אחר מתחמי MHC-פפטידים בעקבות ההרחבה החומצית מחרוזים המופעלים על-ידי CNBr עם נוגדנים. Aliquots שנלקחו מהצעדים המצוינים בפרוטוקול (1/100 מהנפח הנמדד הכולל) הועמסו על ג'ל SDS-PAGE של 12% והועברו על קרום ניטרוצלולוז: חרוזים + ליסאט בעקבות אימונוכדה ושטיפה אחרונה (A); supernatant של הכביסה האחרונה (B) ומתחמי MHC-פפטיד התרומם מן החרוזים (C). אות הזיהוי החזק של מתחמי MHC-פפטיד ב(C) באמצעות נוגדן שרשרת כבדה נגד HLA-ABC (Abcam, #ab 70328, 1:5000) אישר את הבידוד של מתחמי MHC-פפטיד בעקבות ההמלטה החומצית. שים לב כי ניתן להעריך את היחס של מתחמי MHC-פפטיד שלא נתפסו על ידי החרוזים מצמידים נוגדנים על ידי איסוף הזרימה דרך משלב 3.1.6. ניתן להוסיף aliquot לכתם המערבי (לא מוצג על ג'ל זה). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
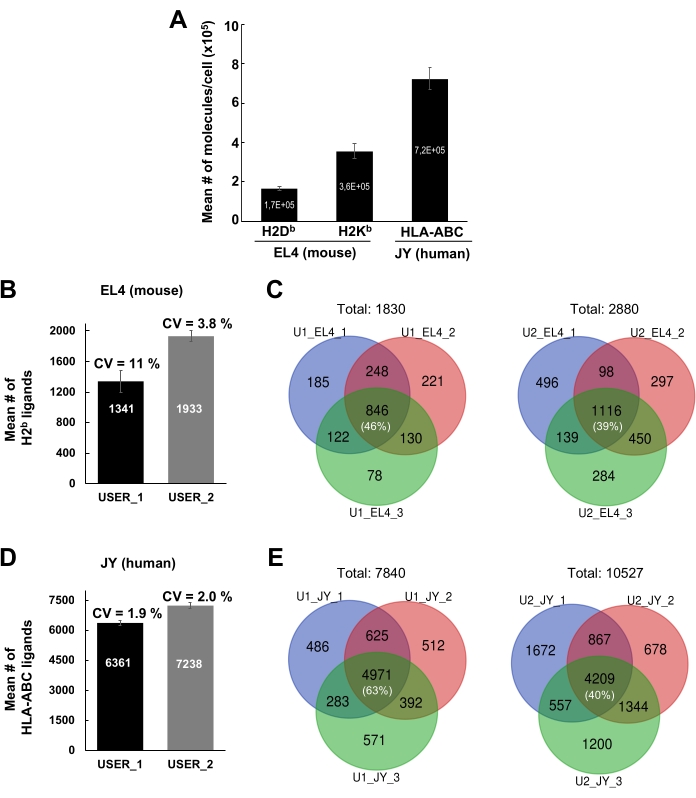
איור 4: זיהוי של פפטידים מסוג MHC מסוג I מתאי JY ו- EL4. (A) היסטוגרמה המציגה את המספר המוחלט של מולקולות משטח התא H2Db ו- H2Kb לכל תא EL4 ושל מולקולות HLA-ABC לכל תא JY. הכימות בוצע על ידי ציטומטריית זרימה. טעות ממוצעת וסטנדרטית של הממוצע התקבלו משלושה משוכפלים ביולוגיים. (ב, ד) היסטוגרמה המציגה את המספר הממוצע ואת סטיית התקן של הממוצע של פפטידים מסוג MHC I שזוהו על ידי שני משתמשים עצמאיים (USER_1 [U1] ו- USER_2 [U2]). מספר ממוצע וסטיית תקן של הממוצע של פפטידים מסוג MHC I שזוהו מתאי EL4 עכבר (B) ותאי JY אנושיים (D) מוצגים. מקדמי וריאציה (קורות חיים) על פני שלושה שכפולים ביולוגיים עצמאיים מסומנים. (ג, ה) דיאגרמות Venn המציגות את מספר הפפטידים שזוהו באופן רבייה בתאי EL4 (C) ו- JY (E) על-ידי שני משתמשים עצמאיים (U1 ו- U2) בשלושה עותקים משוכפלים ביולוגיים עצמאיים. איור 4A הודפס מחדש והותאם מ-bioRxiv38. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
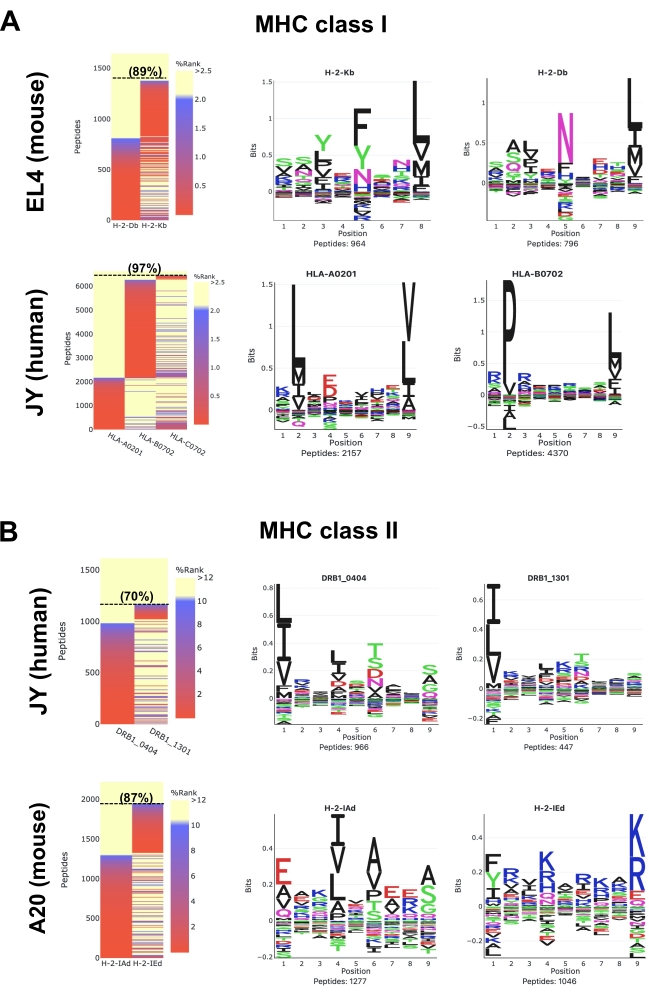
איור 5: הדמיה של נתוני אימונופטידומיקה באמצעות כלי התוכנה MVP. ניתוח נתונים של עכבר ואנושי (A) MHC class I ו-(B) פפטידים מסוג MHC II. מוצגות מפות חום מחייבות של זיקה מייצגת (לוחות שמאליים) ומוטיבים מחייבים פפטידים (לוחות ימניים). צבעי מפות חום מייצגים את הזיקה לאיגוד MHC החזויה על-ידי NetMHCpan 4.1 (דירוג%). קלסרים חזקים הם אדומים (%rank <0.5), קלסרים חלשים הם כחולים (%rank <2) ו- Non-Binders הם צהובים (%Rank >2). פרופורציה (%) של פפטידים 8-12mer (A) ו 9-22mer פפטידים (B) כי הם SB או WB מצוין בסוגריים. מוטיבים מחייבים פפטיד נוצרו על ידי MVP באמצעות האפשרות 'Gibbscluster ספציפית לאלל'. תוצאות מייצגות אלה התקבלו מ 1 x 108 תאים ובאמצעות הנוגדנים הבאים וקווי התא: נוגדן M1 ותאי EL4 עבור עכבר MHC class I פפטידים; נוגדן W6/32 ותאי JY עבור פפטידים אנושיים מסוג MHC I; נוגדן M5 ותאי A20 לפפטידים MHC class II של העכבר; נוגדן L243 ותאי JY לפפטידים אנושיים מסוג MHC II. עיין בנתונים המשלימים 1-4 כדי לגשת לדוחות HTML המלאים שנוצרו על ידי תוכנת ה- MVP. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
נתונים משלימים 1-4: אנא לחץ כאן כדי להוריד קובץ זה.
נתונים משלימים 1: דוח HTML שנוצר על ידי תוכנת MVP מפפטידים שבודדו מתאי 1 x 108EL4 באמצעות נוגדן M1. שלושה משכפלים ביולוגיים מוצגים. דוח זה קשור לאיור 4 ולאיור 5 ופפטידים מייצגים מפורטים בטבלה משלימה 2.
נתונים משלימים 2: דוח HTML שנוצר על ידי תוכנת ה-MVP מפפטידים שבודדו מתאי 1 x 108JY באמצעות נוגדן W6/32. שלושה לוחות ביולוגיים מוצגים. דו"ח זה קשור לאיור 4 ולאיור 5, ופפטידים מייצגים מפורטים בטבלה משלימה 2.
נתונים משלימים 3: דוח HTML שנוצר על ידי תוכנת ה-MVP מפפטידים שבודדו מתאי 1 x 108JY באמצעות נוגדן L243. דוח זה קשור לאיור 5, ופפטידים מייצגים מפורטים בטבלה משלימה 2.
נתונים משלימים 4: דוח HTML שנוצר על ידי תוכנת MVP מפפטידים שבודדו מתאי 1 x 108A20 באמצעות נוגדן M5. דוח זה קשור לאיור 5, ופפטידים מייצגים מפורטים בטבלה משלימה 2.
טבלה משלימה 1: רשימת מאגרים. מתכונים לכל המאגרים המשמשים בפרוטוקול מתוארים. לחץ כאן כדי להוריד טבלה זו.
טבלה משלימה 2: רשימות מייצגות של פפטידים המשויכים ל- H2Db / Kb, HLA-ABC, HLA-DR ו- H2-IAd / IEd. טבלה זו מכילה את הרשימות של פפטידים מייצגים מסוג MHC I ו- II המבודדים מקווי התא EL4 ו- A20 של העכבר, בהתאמה, ו- HLA class I ו- II מקו התא האנושי JY. נתונים אלה הופקדו על ProteomeXchange (PXD028633). לחץ כאן כדי להוריד טבלה זו.
זמינות נתונים:
ערכות נתונים המשמשות בכתב יד זה הופקדו על ProteomeXchange (http://proteomecentral.proteomexchange.org/cgi/GetDataset): PXD028633.
Discussion
שני קווי תא עכבר (EL4 ו- A20), קו תא אנושי אחד (JY) וחמישה נוגדנים זמינים מסחרית [M1 (אנטי H2Db / Kb), Y3 (אנטי H2Kb), M5 (אנטי H2-IAd / IEd), W6/32 (אנטי HLA-ABC) ו- L243 (anti-HLA-DR)] נבדקו ואומתו בהקשר של פרוטוקול זה ומספקים נתוני אימונופטידומיקה באיכות גבוהה. נוגדנים אחרים נגד HLA זמינים (למשל, אנטי HLA-A2 BB7.2) אך לא נבדקו כאן. שים לב כי נוגדן W6/32 נמצא בשימוש נרחב ואת הנוגדן המבוסס ביותר בתחום; זה מאפשר בידוד של פפטידים שהוצגו על ידי כל מולקולות HLA-ABC בבני אדם ודווח בעבר על ידי מעבדות מומחים לעבוד ממקורות ביולוגיים שונים כגון רקמות טריות או קפואות8,39, תאים חד גרעיניים דם היקפיים ותא מונו-גרעיני מח עצם40, ביופסיות41, xenografts41,42, נתיחות שלאחר המוות43 ודגימות פלזמה44,45.
הכנת פתרונות טריים המשמשים לאורך הפרוטוקול היא קריטית. בפרט, השימוש בפתרונות חומציים טריים בבקבוקי זכוכית הוא קריטי כדי למנוע זיהום עוקב של הדגימות שניתחו על ידי MS. בנוסף, כאשר הפרוטוקול נעשה בפעם הראשונה ו / או עם נוגדן חדש, חשוב להעריך כי הנוגדן הוא אכן מצמיד לחרוזי Sepharose CNBr באמצעות ג'ל Coomassie כחול. שלבי הכביסה של החרוזים המשולבים עם הנוגדנים בעקבות אימונוכד של מתחמי MHC-פפטידים הם גם קריטיים כדי למנוע זיהום של פפטידים שאינם MHC. לבסוף, טיפול מיוחד נדרש כדי לא להיפטר eluates בעקבות ההתרוממות של מתחמי MHC-פפטיד עם 1% TFA ואת ההשתחצנות של פפטידים מן הטור C18 עם ACN28%/0.1% FA.
הפרוטוקולים הקיימים הזמינים בספרות מתארים צעדים נוספים לטיהור נוסף של הפפטידים בסוף הליך הבידוד, למשל, פיצול פפטיד בשיטות שונות14,46 או סינון אולטרה באמצעות מסנני 10-30 kDa13,47. הפרוטוקול הנוכחי אינו מספק פרטים על שלבים נוספים אלה ומספיק כדי לספק נתוני אימונופטידומיקה באיכות גבוהה. עם זאת, צעדים כאלה יכולים להיחשב על ידי לא מומחים כדי לשנות ולפתור בעיות כדי לייעל עוד יותר את הליך בידוד פפטיד.
סוג החרוזים וסוג מאגר ההמלטה החומצי המשמשים להמלטת מתחמי MHC מהחרוזים ניתן לשנות גם לפתרון בעיות13,14,15,16,17,18,19. בהקשר זה, חרוזים המופעלים על ידי CNBr הם בדרך כלל נקודת התחלה טובה שכן הם זולים יחסית בנוסף להראות גמישות במונחים של כריכה עם סוגים שונים של נוגדנים. בפרוטוקול הנוכחי, חרוזים המופעלים על-ידי CNBr הוצגו כבעלי ביצועים טובים יחסית באמצעות חמישה נוגדנים שונים הזמינים מסחרית (כלומר, M1, Y3, W6/32, L243 ו- M5). מלבד חרוזי CNBr המופעלים על ידי sepharose, חלבון A או G או A / G sepharose 4 חרוזי זרימה מהירה קלים גם הם לטיפול, ולמרות שהם יקרים יחסית, יכולים לייצר תוצאות דומות. גורם נוסף שיש לקחת בחשבון הוא הזיקה של הנוגדן לחלבון A או G. יתר על כן, חרוזים מגנטיים sepharose הם גם קל מאוד לשימוש אבל הם יקרים יחסית. ללא תלות בסוג החרוזים שנבחרו על ידי אנשים שאינם מומחים, מומלץ לאסוף aliquots בשלבים קריטיים של הפרוטוקול ולבצע ג'ל SDS-PAGE מוכתם קומאסי כחול כדי לעקוב אחר היעילות המחייבת של הנוגדן לחרוזים, כפי שמוצג באיור 2.
גורם חשוב נוסף המשפיע על ההצלחה של בידוד פפטידים MHC מתייחס לסוג של חיץ ההמלטה החומצית המשמש לבודד את מתחמי MHC-פפטיד מהחרוזים. מאגרים שונים דווחו כולל 0.1%, 1% או 10% TFA, 0.2% FA ו 10% חומצה אצטית. 1% TFA היה חיץ ההמלטה עובד עבור כל הנוגדנים שנבדקו. ניתן לעקוב אחר שלב זה גם על ידי סופג מערבי כנגד מולקולות ה-MHC המשמשות ללכידת פפטידים של MHC, כפי שמוצג באיור 3.
כל המאגרים המכילים אצטוניטריל (ACN) ו/או חומצה משולשת (TFA) הם אגרסיביים ויכולים להוביל לזיהום המדגם בחומרים מולקולריים ופולימריים קטנים כגון פלסטיקאים אם במגע עם פלסטיק. כדי להימנע מבעיות כאלה, כל הפתרונות המכילים ממס אורגני ו/או TFA מוכנים טריים מדי יום ומאוחסנים בבקבוק זכוכית עד לשימוש. רוב השלבים מבוצעים בצינור פלסטיק חלבון LoBind. צינורות אלה תוכננו במיוחד עבור פרוטאומיקה ועשויים באיכות הגבוהה ביותר, פוליפרופילן בתולי ללא ביוצידים, plasticizers, ולטקס. הם מיוצרים גם עם תבניות ממוטבות ומלוטשות מאוד ללא שימוש בחומרי החלקה. אמצעי זהירות אלה חשובים לשקול כדי לאפשר את הדור של נתונים חיסוניים באיכות גבוהה.
הנוגדן הוא מגבלה חשובה לבידוד של פפטידים הקשורים ל- MHC. נוגדן W6/32 מאפשר בידוד של פפטידים המוצגים על ידי כל מולקולות HLA-ABC class I בבני אדם והוא הנוגדן הנפוץ והמבוסס ביותר בתחום. הקלדת HLA ברזולוציה גבוהה של קווי תאים אנושיים לא ממופים או biospecimens אינו הכרח על יישום של נוגדן W6/32, אבל בכל זאת מומלץ עבור יישומים מסוימים כדי להקל על פרשנות נתונים48. מידע הקלדה של HLA/MHC ניתן למצוא גם במשאבים ציבוריים עבור קווי תאים מרובים ומודלים של עכבר49. מלבד נוגדן W6/32, ארבעת הנוגדנים האחרים (M1, M5, Y3 ו- L243) שנבדקו ואומתו בהקשר של פרוטוקול זה זמינים כולם מסחרית. מצד שני, נוגדנים רבים אחרים שדווחו במחקרים חיסוניים קודמים לא אומצו במידה רבה על ידי הקהילה ואינם זמינים מסחרית או זמינים באמצעות התרבות של קווי תאים היברידיים, וזה יקר יחסית.
מגבלה חשובה נוספת לבידוד של פפטידים הקשורים ל- MHC היא כמות החומר ההתחלתי הנדרש. הכמות הנדרשת היא ביחס הפוך לרמת הביטוי של מולקולות MHC על פני התא, שניתן לכמת על ידי ציטומטריית זרימה (איור 4A). תאים המציגים רמות ביטוי גבוהות של מולקולות MHC (למשל, תאים דנדריטיים ותאים המטופויאטיים באופן כללי) מניבים בדרך כלל נתוני אימונופטידומיקה באיכות גבוהה. מעבדות מומחים להשתמש מ נמוך ככל 50 מיליון תאים50, אבל 100 מיליון עד 1 מיליארד תאים מומלצים עבור שאינם מומחים. שימוש בביופסיה של רקמות (<13 מ"ג)41, קסנוגרפט42,43, נתיחה שלאחר המוות44, ופלזמה45,46 דגימות דווחו גם הם, אך נותרו מאתגרים עבור מעבדות שאינן מומחים. כמו כן, המספר הכולל של פפטידים הקשורים ל- MHC הצפוי מתועד היטב עבור קווי תאים מבוססים (כאן, בין ~ 2000 ל - 10000 פפטידים בהתאם לקו התא ולנוגדנים המשמשים), אך הכמויות המוחלטות של פפטידים המוצגים באופן טבעי שנמשכים ביעילות על ידי הטכניקה נשארים שנויים במחלוקת. ואכן, מחקרים קודמים העריכו כי היעילות של הליך הבידוד תלויה פפטיד והוא יכול להיות נמוך ככל 0.5%-2%51. מגבלות אחרות במערכת החיסונית הן רבייה של השיטות וחוסר היכולת של כלי חבילת NetMHCpan להוסיף ביאור נכון לפפטידים לאללים MHC שפחות מאופיינים. בהקשר זה, פיתוח ויישום נוספים של שיטות MS רכישה עצמאיות יחסית לנתונים7,32,52, כמו גם קיבוץ פפטיד חדש ואלגוריתמי חיזוי מחייבים של פפטיד MHC31,34,53,54 צפויים לשפר את הרבייה ואת הדיוק של ביאור פפטיד באימונופטידומיקה. אימונופטידומיקה עומדת בפני מגבלות אחרות בנוגע לרכישת טרשת נפוצה וניתוח חישובי של פפטידים הקשורים ל- MHC ומכוסים במקומות אחרים 1,6,55.
While הבידוד של פפטידים הקשורים HLA-ABC מדגימות אנושיות באמצעות נוגדן W6/32 מבוסס היטב ומיושם באופן נרחב על ידי קבוצות מחקר רבות, הבידוד של עכבר MHC class I- ופפטידים הקשורים II הוא יחסית פחות מבוסס. לפיכך, פרוטוקולים חזקים לבידוד של ליגנדים MHC עכבר נדרשים. כאן, אנו מספקים פרוטוקול ממוטב לבידוד של פפטידים מסוג MHC I ופפטידים מסוג MHC II משני קווי תאי עכבר ממקור C57BL/6 ו- BALB/ c, בהתאמה. באופן ספציפי, הפרוטוקול מאפשר בידוד של פפטידים הקשורים ל- H2Kb ו- H2Db הקשורים באמצעות נוגדן M1, כמו גם פפטידים מסוג H2-IAd ו- H2-IEd הקשורים באמצעות נוגדן M5. לכן, הפצה ויישום של הפרוטוקול הנוכחי צריך להקל על מחקר חיסוני בסיסי ותרגומי במודלים שונים של עכבר.
ניתן להשתמש בפרוטוקול כדי להקים ולתקן זרימת עבודה של אימונופטידומיקה, וכן כדי לסמן פרוטוקולים חדשים. לדוגמה, זה יכול להיות מותאם ואופטימיזציה נוספת לבצע הקרנה חיסונית במטריצות ביולוגיות שונות החל דם / פלזמה לרקמה טרייה או קפואה ל- FFPE (פורמלין קבוע פרפין מוטבע). יתר על כן, הפרוטוקול יטפח את הרבייה התוך-מעבדתית והבין-מעבדתית של הליך הכנת הדגימה באימונונפפטידומיקה ולכן צפוי למצוא יישום רחב במחקר בסיסי וקליני.
Disclosures
המחברים מצהירים כי אין להם אינטרסים פיננסיים מתחרים.
Acknowledgements
אנו מודים לפייר טיבאלט, אריק בוניל, ז'ול לנואה, קרוליין קוט (המכון למחקר באימונולוגיה וסרטן, אוניברסיטת מונטריאל) ואנתוני פרסל (אוניברסיטת מונאש) על הערותיהם התובנות. עבודה זו נתמכה במימון פונדס דה רשצ'ה דו קוויבק - סנטה (FRQS), קרן קול, צ'ו סנטה-ג'סטין, וקרנות צ'ארלס-ברונו, קרן קנדה לחדשנות, המועצה הלאומית למדעים ומחקר הנדסה (NSERC) (#RGPIN-2020-05232) והמכונים הקנדיים לחקר הבריאות (CIHR) (#174924).
Materials
| Name | Company | Catalog Number | Comments |
| A20 cell line | ATCC | TIB-208 | mouse B lymphoblast |
| Acetonitrile, LC/MS Grade | FisherScientific | A955-4 | |
| anti-Human HLA A, B, C (W6/32) - MHC class I | BioXcell | BE0079 | |
| anti-Human/Monkey HLA-DR (L243) - MHC class II | BioXcell | BE0308 | |
| anti-Mouse H2 (M1/42.3.9.8) - MHC class I | BioXcell | BE0077 | |
| anti-Mouse H2-IAd/IEd (M5/114) - MHC class II | BioXcell | BE00108 | |
| anti-Mouse H2Kb (Y3) - MHC class I | BioXcell | BE0172 | |
| BupH Phosphate Buffered Saline Packs (PBS) | ThermoFisher | 28372 | Pouch contents dissolved in a final volume of 500 mL deionized water (FisherScientific, W64) |
| CHAPS (3-[(3-cholamidopropyl)dimethylammonio]-1-propanesulfonate) | EMDMilipore | 220201-10MG | |
| CNBr-activated Sepharose | Cytivia | # 17-0430-01 | |
| EL4 cell line | ATCC | TIB-39 | mouse T lymphoblast |
| epTIPS LoRetention Tips, 1000 µL/Eppendorf | FisherScientific | 02-717-352 | Better results with low retention material |
| epTIPS LoRetention Tips, 200 µL/Eppendorf | FisherScientific | 02-717-351 | Better results with low retention material |
| Formic Acid, LC/MS Grade | FisherScientific | A117-50 | |
| Glycine | FisherScientific | RDCG0250500 | |
| Hydrochloric acid solution | FisherScientific | 60-007-11 | |
| JY cell line | Sigma Aldrich | 94022533-1VL | EBV-immortalised B cell lymphoblastoid line |
| Methanol, LC/MS Grade | FisherScientific | A456-4 | |
| Poly prep chromatography columns (polypropylene column) | Bio-Rad | 731-1550 | referred as polypropylene column in the protocol |
| Proteases inhibitor | ThermoFisher | A32963 | 1 pellet per 10 mL of cell lysis buffer |
| Qifikit | Dako | K007811-8 | |
| Sodium Bicarbonate | Amresco | # 0865-1kg | |
| Sodium Chloride | FisherScientific | MSX04201 | |
| Solid phase extraction disk, ultramicrospin column C18 | The nest group | SEMSS18V | capacity of 6–60 µg, max volume of 200 µL |
| Trifluoroacetic Acid (TFA), LC-MS Grade | FisherScientific | PI85183 | |
| Tris | FisherScientific | T395-500 | |
| Tris-HCl | FisherScientific | #10812846001 | |
| Tube LoBind 1.5 mL/Eppendorf | FisherScientific | E925000090 | Better results with low retention material |
| Tube LoBind 2 mL/Eppendorf | FisherScientific | 13-698-795 | Better results with low retention material |
| Water, LC/MS Grade | FisherScientific | W64 |
References
- Vizcaíno, J. A., et al. The human immunopeptidome project: A roadmap to predict and treat immune diseases. Molecular & Cellular Proteomics. 19 (1), 31-49 (2019).
- Caron, E., Aebersold, R., Banaei-Esfahani, A., Chong, C., Bassani-Sternberg, M. A case for a human immuno-peptidome project consortium. Immunity. 47 (2), 203-208 (2017).
- Arnaud, M., Duchamp, M., Bobisse, S., Renaud, P., Coukos, G., Harari, A. Biotechnologies to tackle the challenge of neoantigen identification. Current Opinion in Biotechnology. 65, 52-59 (2020).
- Caron, E., et al. The MHC I immunopeptidome conveys to the cell surface an integrative view of cellular regulation. Molecular Systems Biology. 7 (1), 533 (2011).
- Istrail, S., et al. Comparative immunopeptidomics of humans and their pathogens. Proceedings of the National Academy of Sciences of the United States of America. 101 (36), 13268-13272 (2004).
- Caron, E., Kowalewski, D. J., Koh, C. C., Sturm, T., Schuster, H., Aebersold, R. Analysis of major histocompatibility complex (MHC) immunopeptidomes using mass spectrometry. Molecular & Cellular Proteomics. 14 (12), 3105-3117 (2015).
- Caron, E., et al. An open-source computational and data resource to analyze digital maps of immunopeptidomes. eLife. 4, 07661 (2015).
- Bassani-Sternberg, M., et al. Direct identification of clinically relevant neoepitopes presented on native human melanoma tissue by mass spectrometry. Nature Communications. 7 (1), 13404 (2016).
- Gubin, M. M., et al. Checkpoint blockade cancer immunotherapy targets tumour-specific mutant antigens. Nature. 515 (7528), 577 (2014).
- Yadav, M., et al. Predicting immunogenic tumour mutations by combining mass spectrometry and exome sequencing. Nature. 515 (7528), 572-576 (2015).
- Laumont, C. M., et al. Noncoding regions are the main source of targetable tumor-specific antigens. Science Translational Medicine. 10 (470), 5516 (2018).
- Lill, J. R., et al. Minimal information about an immuno-peptidomics experiment (MIAIPE). Proteomics. 18 (12), 1800110 (2018).
- Nelde, A., Kowalewski, D. J., Stevanović, S. Antigen processing, methods and protocols. Methods in molecular biology. 1988, 123-136 (2019).
- Purcell, A. W., Ramarathinam, S. H., Ternette, N. Mass spectrometry-based identification of MHC-bound peptides for immunopeptidomics. Nature Protocols. 14 (6), 1687-1707 (2019).
- Ebrahimi-Nik, H., et al. Mass spectrometry driven exploration reveals nuances of neoepitope-driven tumor rejection. JCI Insight. 5 (14), 129152 (2019).
- Schuster, H., et al. A tissue-based draft map of the murine MHC class I immunopeptidome. Scientific Data. 5, 180157 (2018).
- Ritz, D., Gloger, A., Weide, B., Garbe, C., Neri, D., Fugmann, T. High-sensitivity HLA class I peptidome analysis enables a precise definition of peptide motifs and the identification of peptides from cell lines and patients sera. PROTEOMICS. 16 (10), 1570-1580 (2016).
- Bassani-Sternberg, M. Mass spectrometry based immunopeptidomics for the discovery of cancer neoantigens. Methods Mol Biol. 1719, 209-221 (2018).
- Lanoix, J., et al. Comparison of the MHC I Immunopeptidome Repertoire of B-Cell Lymphoblasts Using Two Isolation Methods. Proteomics. 18 (12), 1700251 (2018).
- Kuznetsov, A., Voronina, A., Govorun, V., Arapidi, G. Critical review of existing MHC I immunopeptidome isolation methods. Molecules. 25 (22), 5409 (2020).
- Urlaub, D., Watzl, C. Coated latex beads as artificial cells for quantitative investigations of receptor/ligand interactions. Current Protocols in Immunology. 131 (1), 111 (2020).
- Ghosh, M., et al. Guidance document: Validation of a high-performance liquid chromatography-tandem mass spectrometry immunopeptidomics assay for the identification of HLA class I ligands suitable for pharmaceutical therapies*. Molecular & Cellular Proteomics. 19 (3), 432-443 (2020).
- Fritsche, J., et al. Pitfalls in HLA ligandomics - How to catch a li(e)gand. Molecular & Cellular Proteomics. 20, 100110 (2021).
- Caron Lab. GitHub Available from: https://github.com/CaronLab/MhcVizPipe (2021)
- Jurtz, V., Paul, S., Andreatta, M., Marcatili, P., Peters, B., Nielsen, M. NetMHCpan-4.0: Improved peptide-MHC Class I interaction predictions integrating eluted ligand and peptide binding affinity data. The Journal of Immunology. 199 (9), 3360-3368 (2017).
- Reynisson, B., Alvarez, B., Paul, S., Peters, B., Nielsen, M. NetMHCpan-4.1 and NetMHCIIpan-4.0: improved predictions of MHC antigen presentation by concurrent motif deconvolution and integration of MS MHC eluted ligand data. Nucleic Acids Research. 48, 449-454 (2020).
- Andreatta, M., Alvarez, B., Nielsen, M. GibbsCluster: unsupervised clustering and alignment of peptide sequences. Nucleic Acids Research. 45 (1), 458-463 (2017).
- Nielsen, M., et al. NetMHCpan, a method for quantitative predictions of peptide binding to any HLA-A and -B Locus protein of known sequence. PLoS ONE. 2 (8), 796 (2007).
- Fortier, M. -. H., et al. The MHC class I peptide repertoire is molded by the transcriptome. The Journal of Experimental Medicine. 205 (3), 595-610 (2008).
- Marco, M. D., Schuster, H., Backert, L., Ghosh, M., Rammensee, H. -. G., Stevanovic, S. Unveiling the peptide motifs of HLA-C and HLA-G from naturally presented peptides and generation of binding prediction matrices. The Journal of Immunology. 199 (8), 2639-2651 (2017).
- Sarkizova, S., et al. A large peptidome dataset improves HLA class I epitope prediction across most of the human population. Nature Biotechnology. 38 (2), 199-209 (2019).
- Pak, H., et al. . Sensitive immunopeptidomics by leveraging available large-scale multi-HLA spectral libraries, data-independent acquisition and MS/MS prediction. 20, 100080 (2021).
- Racle, J., et al. Robust prediction of HLA class II epitopes by deep motif deconvolution of immunopeptidomes. Nature Biotechnology. 37 (11), 1283-1286 (2019).
- Abelin, J. G., et al. Defining HLA-II ligand processing and binding rules with mass spectrometry enhances cancer epitope prediction. Immunity. 51 (4), 766-779 (2019).
- Sofron, A., Ritz, D., Neri, D., Fugmann, T. High-resolution analysis of the murine MHC class II immunopeptidome. European Journal of Immunology. 46 (2), 319-328 (2015).
- Kovalchik, K. A., et al. Immunopeptidomics for Dummies: Detailed Experimental Protocols and Rapid, User-Friendly Visualization of MHC I and II Ligand Datasets with MhcVizPipe. bioRxiv. , (2020).
- Schuster, H., et al. The immunopeptidomic landscape of ovarian carcinomas. Proceedings of the National Academy of Sciences. 114 (46), 9942-9951 (2017).
- Berlin, C., et al. Mapping the HLA ligandome landscape of acute myeloid leukemia: a targeted approach toward peptide-based immunotherapy. Leukemia. 29 (3), 1-13 (2014).
- Rijensky, N. M., et al. Identification of tumor antigens in the HLA peptidome of patient-derived xenograft tumors in mouse. Molecular & Cellular Proteomics. 19 (8), 1360-1374 (2020).
- Heather, J. M., et al. Murine xenograft bioreactors for human immunopeptidome discovery. Scientific Reports. 9 (1), 18558 (2019).
- Marcu, A., et al. HLA ligand atlas: A benign reference of HLA-presented peptides to improve T-cell-based cancer immunotherapy. Journal for Immunotherapy of Cancer. 9 (4), 002071 (2021).
- Shraibman, B., et al. Identification of tumor antigens among the HLA peptidomes of glioblastoma tumors and plasma. Molecular & Cellular Proteomics. 18 (6), 1255-1268 (2019).
- Bassani-Sternberg, M., Barnea, E., Beer, I., Avivi, I., Katz, T., Admon, A. Soluble plasma HLA peptidome as a potential source for cancer biomarkers. Proceedings of the National Academy of Sciences. 107 (44), 18769-18776 (2010).
- Demmers, L. C., Heck, A. J. R., Wu, W. Pre-fractionation extends, but also creates a bias in the detectable HLA class Ι ligandome. Journal of Proteome Research. 18 (4), 1634-1643 (2019).
- Kowalewski, D. J., Stevanović, S. Antigen processing,. Methods and Protocols. 960, 145-157 (2013).
- Bentley, G., et al. High-resolution, high-throughput HLA genotyping by next-generation sequencing. Tissue Antigens. 74 (5), 393-403 (2009).
- Boegel, S., Löwer, M., Bukur, T., Sahin, U., Castle, J. C. A catalog of HLA type, HLA expression, and neo-epitope candidates in human cancer cell lines. OncoImmunology. 3 (8), 954893 (2014).
- Klaeger, S., et al. Optimized liquid and gas phase fractionation increases HLA-peptidome coverage for primary cell and tissue samples. Molecular & Cellular Proteomics. 20, 100133 (2021).
- Hassan, C., et al. Accurate quantitation of MHC-bound peptides by application of isotopically labeled peptide MHC complexes. Journal of Proteomics. 109, 240-244 (2014).
- Ritz, D., Kinzi, J., Neri, D., Fugmann, T. Data-independent acquisition of HLA Class I peptidomes on the Q exactive mass spectrometer platform. Proteomics. 17 (19), (2017).
- O'Donnell, T. J., Rubinsteyn, A., Laserson, U. MHCflurry 2.0: Improved pan-allele prediction of MHC Class I-presented peptides by incorporating antigen processing. Cell Systems. 11 (1), 42-48 (2020).
- O'Donnell, T. J., Rubinsteyn, A., Bonsack, M., Riemer, A. B., Laserson, U., Hammerbacher, J. MHCflurry: Open-source Class I MHC binding affinity prediction. Cell Systems. 7 (1), 129-132 (2018).
- Faridi, P., Purcell, A. W., Croft, N. P. In immunopeptidomics we need a sniper instead of a shotgun. Proteomics. 18 (12), 1700464 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved