Method Article
可视化 果蝇 胚胎中含脂质细胞器的细胞骨架依赖性运输
摘要
在早期的 果蝇 胚胎中,许多细胞器是运动的。原则上,它们 可以通过特定的荧光 探针进行现场成像,但蛋壳会阻止直接应用于胚胎。该协议描述了如何 通过 显微注射引入这种探针,然后 通过 粒子图像测速分析本体细胞器运动。
摘要
早期的 果蝇 胚胎是含有大量常规和胚胎特异性细胞器的大细胞。在胚胎发生的前三个小时,这些细胞器经历戏剧性的运动,由基于肌动蛋白的细胞质流和沿微管的运动驱动运输提供动力。大量小型细胞器特异性荧光探针(FPs)的开发使得在任何基因型中可视化各种不同的含脂质结构成为可能,从而可以在不需要遗传编码荧光团的情况下进行实时成像。该协议显示了如何将重要染料和分子探针注入 果蝇 胚胎中,以通过实时成像监测特定细胞器的运输。通过标记脂滴(LD)并通过颗粒图像测速法(PIV)跟踪其本体运动来证明这种方法。该方案提供了一种适合于研究其他细胞器的策略,包括溶酶体,线粒体,卵黄囊泡和ER,以及用于跟踪单个LD沿微管的运动。使用市售染料可分离到光谱的紫色/蓝色和远红色区域。通过 显微 注射对细胞器和/或细胞骨架元件进行多重共标记, 果蝇 的所有遗传资源都可用于运输研究,而无需引入荧光标记的蛋白质。与具有低量子产率且易于漂白的遗传编码荧光团不同,许多可用的染料允许快速和同时捕获具有高光子产率的多个通道。
引言
重要染料和分子探针是实时成像特定细胞结构和细胞器的有力工具。在 果蝇 胚胎中,许多不同的细胞器显示细胞骨架驱动的定位1,2,3,4,但这些小分子的应用具有挑战性,因为蛋壳对其中许多人是不渗透的。该协议描述了一种 通过 显微注射在活胚胎中使用荧光探针(FPs)的方法,以检测细胞器的大规模运输。该程序包括注射液的制备,卵子收集和胚胎的制备,显微注射,成像和图像分析。
细胞器的戏剧性空间重排在许多动物卵母细胞,卵子和胚胎中很常见,部分原因是这些细胞的尺寸很大。例如,在 果蝇 胚胎中,脂质液滴(LD)和卵黄囊泡在细胞化5之前向胚胎中心移动。这种运动取决于微管,并在两个细胞器耗尽的胚胎外围周围留下一个~40μm的区域。在早期的裂解阶段,许多细胞器由细胞质流运输,这些细胞质流由胚胎表面6处基于肌动蛋白的收缩驱动。尽管许多物种的胚胎表现出相似的重排, 但果蝇 胚胎特别适合通过成像遵循这些过程,因为它在标准实验室"室温"下外部发育,相对透明,足够小以适合大多数显微镜设置,并且可以使用强大的遗传工具进行操纵。
对于某些细胞器,可以使用荧光标记的蛋白质来特异性标记这些结构。例如,LSD-2(也称为dPLIN2)是一种在胚胎中特异性靶向LD7的蛋白质。苍蝇系携带编码绿色荧光蛋白( GFP )和 LSD - 28 之间融合的可诱导转基因,或者携带基因陷阱,其中黄色荧光蛋白( YFP )入内源性 LSD - 2 基因 9 , 10 的编码区域。然而,这种方法有局限性,包括这些融合蛋白具有低量子产率并且容易漂白。此外,同时标记多个不同结构可能具有挑战性:对于许多细胞器,目前只有一种类型的荧光标记(通常是GFP或mCherry)可用,因此同时对两个细胞器进行成像可能需要新的转基因或插入;此外,即使有兼容的标签可用,将它们引入单个菌株中也可能需要耗时的杂交。这也使得使用许多强大的遗传资源变得不那么方便,例如,如果两个细胞器标记,一个Gal4驱动器和一个可诱导的RNAi构建体都必须存在于同一个母亲中。
原则上,这些限制可以通过使用FP来克服,包括重要的染料(例如,用于标记溶酶体的LysoTracker),分子探针(例如,用于标记微管的SiR-微管蛋白)和荧光标记的生物分子(例如,用于探针脂肪酸代谢的C12 BODIPY11)。从用于培养的细胞中,它们通常被充分验证为探测细胞生物学的强大工具。FP用途广泛,具有优异的光性能,并与荧光蛋白相容。多种染料可以同时混合和应用,通常具有分离到光谱的紫色/蓝色和远红色区域以及小斯托克斯位移的好处,防止通道渗漏。小斯托克斯位移允许同时捕获多个成像通道,从而能够同时跟踪多个细胞器。最后,它们同样可以应用于标记其他 果蝇 物种胚胎中的细胞器,甚至是没有荧光标记蛋白质的其他昆虫。
然而,这些FP中的大多数不能穿越 果蝇 胚胎的复杂蛋壳。它由五层组成:三层防止机械损伤的外绒毛膜层(绒毛膜),以及围绕卵黄素膜的蜡质层,形成化学屏障12。为简单起见,蜡质层和卵黄素膜的组合将在下面称为"卵黄素膜"。为了绕过蛋壳,该协议采用已建立的胚胎显微注射方法将FP引入 果蝇 胚胎中。该协议描述了如何监测裂解期胚胎中LD的细胞质流动。它包括注射针和卵子收集笼的制备,卵子收集的过程以及脉络膜的机械去除。它介绍了如何显微注射和成像胚胎,以及如何使用粒子图像测速法(PIV,改编自6)分析LD的体积流。它提供了故障排除的建议,以确保胚胎存活并创建最佳的成像系统。还讨论了如何修改方案以同时对LD和微管进行成像,或将其应用于其他细胞器的研究,包括溶酶体,线粒体,卵黄囊泡和内质网(ER)。
研究方案
1. 准备必要的材料
注意:这些准备工作最好提前几天或几周完成。
- 准备注射针。
注意:针头可以无限期地储存在有盖的容器中。针必须足够细,以提供约700 fL,同时足够坚固以刺穿玻璃钢膜。- 将毛细管放入拔针器上的毛细管支架中。用翼形螺母固定毛细管。将毛细管的中心与加热元件对齐,以便产生两个对称的针。
- 根据制造商的说明在拔针机上选择适当的设置。
- 使用解剖示波器进行质量控制。
注意:针尖应尽可能细。开裂、锯齿状或大口径针尖被丢弃。 - 一次准备10针(价值5个毛细血管)的批次。
- 将已卷成圆柱体的可变形腻子放在带有盖子的容器底部的中心。小心地将针头压入腻子中,使其水平固定,针尖安全地悬挂在空气中以防止损坏。盖上盖子,储存直至使用。
- 准备鸡蛋收集盘。储存在4°C。
注意:收集鸡蛋的盘子是小琼脂盘子,辅以果汁,以促进产卵。如何制备它们在许多协议中都有描述,包括13。 - 准备庚烷胶。
注意:这种胶水是从双面胶带中提取的,用于将胚胎牢固地附着在盖玻片上。它可以阻止胚胎在注射和成像过程中漂浮失焦。胶水可以提前几天或几周准备。- 将双面胶带卷起比高尔夫球更大的尺寸,并将其放在带有紧密密封盖的约50 mL玻璃容器的底部。紧紧地包装胶带,以便有足够的粘合剂。
- 在通风橱中,用庚烷填充玻璃容器以覆盖所有胶带。不使用时,请保持容器密闭。
注意:庚烷是易燃的液体和蒸气。可引起眼睛、皮肤和呼吸道刺激。呼吸蒸气可能导致嗜睡、头晕和肺损伤。使庚烷远离火源,并将其存放在通风良好的易燃物区域,远离不相容物质。 - 让庚烷胶放置过夜或更长时间。为获得最佳效果,将容器放在摇摇杯或其他搅拌器上过夜,以帮助溶解粘合剂。
注意:胶带本身将保留,但粘合剂将溶解在庚烷中。在步骤5.1.2中,将胶水施加到盖玻片上;庚烷蒸发,留下胶水。 - 通过将庚烷胶水制备液滴在载玻片上进行测试,并确保在庚烷蒸发后仍然存在粘性残留物。如果之后看不到粘合剂残留物,请在玻璃容器中加入更多胶带,然后重复上一步。
注意:一旦准备好,胶水可以使用数月甚至数年。
- 通过在纯无水DMSO中稀释商业获得的制剂来制备1mg / mL(3.8mM)BODIPY493 / 503储备溶液。保持覆盖,以保护它免受光和水的影响。在-20°C下无限期储存或在4°C下短期储存。
2. 准备鸡蛋收集笼
注意:在计划注射前至少一天(最好是2或3天)这样做。
- 准备酵母糊。
注意:酵母糊补充苹果汁盘中未提供的蛋白质和其他重要营养素。它促进产蛋和产蛋。- 加入2-10克干面包酵母,然后将1毫升自来水加入小烧杯中。用刮刀混合。
- 继续以 1 mL 的增量添加自来水,直到达到所需的牙膏状稠度。
- 盖上混合物并将其储存在4°C。
- 设置用于收集鸡蛋的苍蝇笼。
注意:需要所需基因型的雄蝇和雌蝇:10-50只小于2周龄的雌性和相似数量的雄性。苍蝇笼有许多不同的选择,包括自制选项14,13。重要的是,苹果汁盘的大小与苍蝇笼的大小相匹配。- 在苹果汁盘上放一小片酵母糊。保持覆盖并让它达到室温,因为如果太冷,苍蝇不会在盘子上产卵。
- 将苍蝇转移到胚胎收集笼中,用酵母苹果汁盘密封,然后将盘子固定在胚胎收集笼中。
- 让新转移的苍蝇适应笼子1-2天,每天用新鲜的盘子代替盘子。如果第二天吃完了所有酵母,请增加酵母糊的量,以备将来收集。
注意:这是提高产卵量的重要一步,因为喂养良好的雌性会产下更多的卵。
3.注射当天,准备注射液并将其装入针头中
- 使用BODIPY 493/503(DMSO中为3.8 mM)的储备溶液作为注射溶液。
- 使用针头加载1μL注射溶液,使用针头加载单针。
注意:努力使液体一直到达尖端,而不会捕获气泡。准备好快速更换装载的针头,以防意外破损。- 将加载尖端连接到微量移液管上,并将1μL注射溶液吸入尖端。使用手套,一只手握住针头,尖端指向,以尽量减少破损的风险。
- 小心地将加载尖端插入针中,并将其推近针尖。将液体分配在针尖附近。取出移液器后,垂直握住针头,尖端向下,直到液体流向尖端。
- 如上所述,将装载的针头存放在装有腻子的单独容器中(见步骤1.1.5)。
注意:针头应提前(最多几个小时)准备注射,但不应在超过一天后使用。 - 将针头置于环境光之外,以防止染料漂白。用铝箔覆盖存储容器,而不会损坏针尖。确保所有光线都被遮挡。
4. 收集注射胚胎
注意:收集的时间取决于注射需要在哪个阶段进行胚胎。按照下面的时间方案,准备注射时的胚胎将是0-90分钟,这对应于切割阶段15。
- 在注射当天,用酵母制备苹果汁盘,如步骤2.2.1所示。如果计划进行N轮注射,请准备N + 2个板。将这些板保存在室温下。
注意:除了用于收集胚胎注射的N板外,还需要一个板作为预收集板,另一个板用于在收集完成后在笼子中喂养苍蝇。 - 用新鲜的酵母板(预收集板)替换笼子上的板,并将其放在笼子上1-2小时。
- 用新的板(收集板)替换笼子上的板。丢弃预收集板,因为它将包含比预期年龄大的胚胎。然后,让苍蝇产卵1.5小时。
注意:由于喂养良好的苍蝇通常在卵受精后不久产卵,因此1.5小时的收集时间可确保在收集结束时,平板上的大多数胚胎都是0-90分钟的年龄,即处于切割阶段。自前一天以来没有喂食新鲜酵母的雌性苍蝇在产卵前往往会保留受精卵一些不确定的时间。因此,预收集板可能具有在收集开始之前受精的胚胎,因此年龄超过60分钟,有时要老得多。 - 用新鲜的酵母板替换笼子上的板。盖上收集板,使流浪苍蝇不会在它们身上产卵。
5. 准备胚胎进行显微注射
- 组装所需的材料。
- 将一块双面胶带贴在载玻片上。避免用手指触摸胶带,因为这会降低其粘性。
注意:本幻灯片将用于移除绒毛膜,不用于成像。 - 使用转印移液器或微量移液管(p200或p1000),将一小滴(200μL或更少)庚烷胶水大致放在矩形盖玻片(60 x 25 mm)的中心。让庚烷蒸发(这需要不到一分钟的时间)。
注意:此盖玻片将用于安装用于注射和成像的胚胎。选择尺寸以适合共聚焦显微镜上的可调节金属支架。 - 组装一个干燥室,一个包含干燥珠的密封室(例如,特百惠三明治盒)。仅使用未水合的干燥珠。
注意:为了确保胚胎吸收注射溶液,胚胎必须略微干燥以降低内部压力。这是通过将盖玻片与去壳,空气暴露的胚胎放入干燥室来完成的。
- 将一块双面胶带贴在载玻片上。避免用手指触摸胶带,因为这会降低其粘性。
- 机械地去除绒毛膜。
- 用一层薄薄的Halocarbon油27覆盖适当老化的胚胎板,使蛋壳透明。
注意:胚胎在几十秒内变得半透明15.如果此步骤没有有效发生,则苹果汁盘可能太湿,需要在使用前干燥。 - 在具有透射发光的解剖镜下查看板(即,光线穿过板进入目镜)以确认胚胎的阶段。
- 选择处于裂解阶段的胚胎。
注意:裂解期胚胎是完全不透明的;随后的胚芽阶段可以被不透明中心15周围的透明细胞质带识别。关于如何识别各种胚胎阶段的良好介绍可以在发育生物学学会维护的网站(参考文献16中给出)上找到。 - 使用细镊子,通过其背侧附件抓住所需阶段的胚胎,并将其转移到覆盖有一块双面胶带的准备好的载玻片上。将胚胎放在胶带上。尽量减少油的转移。
- 尽可能轻轻地将胚胎滚动到胶带表面,用镊子尖端的一侧轻轻地推动胚胎。不要用锋利的镊子尖端直接戳胚胎。
注意:如果施加的力太低,胚胎将不会滚动。如果太高,就会爆裂。找到合适的中间力量需要经验,因此,这一步应该事先练习。 - 继续滚动胚胎,直到绒毛膜短暂粘附在胶带上并开裂。
- 一旦绒毛膜破裂,继续滚动以将胚胎(仍在卵母膜内)与绒毛膜分开,因为绒毛膜仍然粘在胶带上。
- 通过观察胚胎背侧附属物的损失,确认绒毛膜被完全移除。
- 将胚胎滚回脉络膜上,其粘性比胶带少。用镊子轻轻摩擦胚胎,直到它附着在镊子上进行移植。
- 用庚烷胶将胚胎转移到盖玻片上,并使其与胶水接触,胶水通常将其与镊子分离。
- 调整盖玻片上胚胎的方向。
- 将胚胎的侧表面嵌入胶水中。
注意:嵌入胶水的胚胎表面是将要成像的表面。嵌入侧表面是最简单的,但这可以根据个人喜好或要回答的生物学问题进行调整。 - 将胚胎的长轴垂直于盖玻片的长轴定向。
- 如果胚胎没有以首选方向放置,请清洁镊子以除去任何会使胚胎从胶水中分离的油。然后,轻轻地尝试将胚胎滚动到位。
- 将胚胎的侧表面嵌入胶水中。
- 以上述方式制备所需数量的胚胎进行注射。
注意:随着去除绒毛膜后的时间流逝,环境空气将开始使胚胎干燥,因此步骤5.3对盖玻片上的胚胎的影响将不均匀,盖玻片在不同时间被去皮。通常,1-3个胚胎是最容易管理的。
- 用一层薄薄的Halocarbon油27覆盖适当老化的胚胎板,使蛋壳透明。
- 干燥胚胎。
- 将带有胚胎的盖玻片放入准备好的干燥室中并将其密封。
- 让胚胎干燥5-12分钟。
注意:此步骤的时间取决于环境温度和湿度,因此需要根据经验确定。 - 从腔室中取出盖玻片,并在其上滴一滴Halocarbon油700,完全覆盖胚胎,以防止进一步干燥。
- 在解剖范围内检查胚胎,以判断是否干燥。
- 如果胚胎只是略微萎缩,但没有放气,请继续显微注射(步骤6)。
- 如果胚胎没有充分或过度干燥,请返回步骤5.2并准备一批新胚胎,因为Halocarbon Oil 700无法去除。如果胚胎过度干燥,则将下一批胚胎的干燥时间缩短3分钟;如果干燥不足,则将干燥时间增加3分钟。
6. 显微注射胚胎
注意:确保显微注射装置包括倒置显微镜、用于固定和定位注射针的显微操作器以及用于提供受控体积的商用显微注射器。
- 打开显微注射器电源并输入首选设置。
注意:对于此协议,建议使用线性运动输出和快速设置,但许多其他协议将起作用。操作员应确定个人偏好。 - 将针头装入显微操作器。为了防止针头在装载含有胚胎的盖玻片时被损坏,请将其移出到安全位置。
- 将盖玻片放在载物台上,将胚胎放在顶部,朝向针头。然后,小心地将针头移回注射位置,其尖端仍远高于载物台。
- 将4x物镜放入光路中。使用显微镜上的聚焦旋钮,将胚胎聚焦。
注意:这将是用于注射的焦平面,并且只会在以后进行最小的调整。 - 使用载物台控制,将胚胎水平移动到视野的中心。
- 平移远离胚胎,将它们保持在视野的边缘,为降低针头做准备。保持在同一焦平面上,以确保将指针降低到正确的位置。
- 将针尖降低到正确的焦平面,并确保它与胚胎一起在视野中可见。
- 使用显微操纵器控制并从上方(尚未通过目镜)观察,将针尖慢慢放入油中,瞄准物镜指向的区域。由于油很粘稠,请慢慢走,以免损坏针头。
- 一旦通过目镜可以看到针头,继续使用显微操纵器控件,直到针尖聚焦并位于视野的中心。
- 通过移动载物台,将胚胎带回视野的中心。使用载物台控制、显微操纵器控制和对焦旋钮来微调胚胎和针尖相对于彼此的位置,同时两者都在对焦中。旨在尽可能靠近盖玻片进行注射。
- 执行针质量控制。
- 为了确保针头的功能,将一些注射溶液分配到胚胎周围的Halocarbon Oil 700中,在油中可见气泡。
- 如果没有任何东西从针头流出,请逐渐增加注射器处的压力。如果这不起作用,请换一针。
- 注射胚胎。
注意:可接受的进样量范围为~0.06-1 pL。下限是由可以可视化进入胚胎的内容设置的。上限由注射对胚胎施加的创伤设定。- 沿着胚胎的侧缘注射,因为这是侵入性最小的。
- 使用分阶段对照,将胚胎向针尖移动,直到后者轻轻刺穿胚胎并进入它。
- 同时,开始注射溶液的流动,并观察针尖部位出现瞬时透明斑点,这表明液体成功转移到胚胎中。
- 监测胚胎。如果胚胎在进入时抵抗针头并破裂(细胞质喷出),请返回步骤5并增加干燥时间。如果胚胎与盖玻片平起并且在注射过程中出现松弛,请返回到步骤5,并缩短干燥时间。
- 如果没有染料进入胚胎,确认染料仍然可以像步骤6.7那样从针头中自由流动。如果染料不流动,请更换针头。如果染料确实流动,注射一个新的胚胎,并在针刺穿胚胎之前开始释放染料。
注意:不建议重复注射相同的胚胎,因为它会破坏先前的伤口/注射部位。
- 重复此步骤,直到所有胚胎都注射完毕。
7. 图像胚胎
注:该协议使用激光扫描共聚焦显微镜。
- 将盖玻片放入共聚焦显微镜上的金属支架中,以便通过盖玻片直接从下方对胚胎进行成像;在盖玻片上方,只有油,没有其他屏障。
- 作为质量控制步骤,首先使用共聚焦显微镜上的落射荧光功能进行成像,使用40倍物镜。在继续之前,请确保荧光团在胚胎中可见。
- 如果所需的成像平面与注射部位不同,请留出足够的时间让染料扩散到目标区域。
注意:对于 BOPIPY 493/503,此时间通常为 30-60 分钟。由于扩散时间在很大程度上取决于染料,其他染料可能需要优化注射部位和等待时间。 - 使用不同的物镜在不同尺度上进行成像。使用40x物镜对所有胚胎进行成像,使用63x物镜对较小尺度的子部分进行成像。
- 对于细胞化前的合体阶段的实时成像,首先使用以下条件:图像大小为512 x 512像素,线平均值为3,帧速率为每秒0.1帧(即每10秒获取1帧)。根据所用显微镜的功能调整条件。
注意:这些条件允许从BOPIPY 493/503获取约500多张图像并捕获大部分运动。
8. 首先使用FIFIF准备时间序列图像,然后python进行PIV分析,从而分析LD流
- 优化图像采集。
- 在适当的阶段注射所需的染料。重复此步骤,直到日常变化可以忽略不计。
- 优化图像采集设置,包括放大倍率、变焦、分辨率和帧速率。
注意:高质量图像(分辨率+ 线平均)和采集速度(帧速率)之间存在权衡。
- 在斐济准备数据。
- 获取要分析的高质量时间序列。
- 打开 时间序列的一帧以生成带有斐济的蒙版。 复制 图像。 将图像 的类型转换为 8 位。
- 使用 多边形 或 手绘选择工具定义胚胎的边界。使用 "清除外部" 将所选内容外部的像素值设置为 0。 清除 选区,然后在选区内 反转 ,以将选区内像素的值设置为最大值 (255)。
- 取消选择,然后使用直 方图 命令确保仅存在 0 和 255 的像素值。
- 为特定时间序列保存此新图像蒙版。
- 打开 感兴趣的时间序列。选择哪十帧最能捕捉感兴趣的时间,例如,皮质收缩开始时的核循环9。 复制 十个感兴趣的帧,形成一个子堆栈。
- 使用 "堆叠到图像" 功能生成 10 张图像以使用 PIV 进行分析。
- 以保留其顺序的方式保存各个文件(SeriesX_1、SeriesX_2 SeriesX_3等)。
- 使用准备好的掩码和单个帧进行PIV分析,使用提供的示例python脚本(补充数据)或用户生成的自定义脚本。
注意:提供的脚本基于OpenPIV17的python应用程序。它以像素为单位输出距离,可以使用像素宽度和帧速率进行转换以生成速度或速度。 - 通过完成其他胚胎的上述步骤并编译输出值来生成重复。
结果
注射后,染料将仅定位在针尖插入的部位。然后,染料将根据其扩散特性扩散远离注射部位。 图1 显示了注射后不久(图 A)和24分钟后(图 B)注射BODPY 493/503。24分钟后,染料已经到达胚胎长轴的中点。
分析细胞器运动可以通过染料注射和延时成像来实现。在图2中,胚胎与BODPY 493 / 503(图2A)和LysoTracker Red(图2B)共同注射,并分别在488和596nm处使用激光激发成像。然后将该胚胎进行延时成像(每30秒一帧,持续30分钟,分析5分钟)。然后通过PIV分析运行时间序列,其输出通过图2A,B中的流线显示。请注意,流线不代表单个颗粒的轨迹,但通过分析细胞质该区域中的所有颗粒来推断细胞质流动。通过标记两个独立的细胞结构(LD和酸性细胞器),PIV分析发现了类似的流动,两个标记都收敛于胚胎的中心区域,细胞质流入胚胎的内部6。
目前可用的FP允许标记许多其他细胞器和细胞结构。 图3 显示了 通过 ER跟踪器Green标记ER。ER跟踪器提供了核包膜的良好分辨率,允许主要细胞周期阶段的可视化。ER跟踪器格林使用488 nm激发成像。
线粒体的标记是棘手的,因为大多数测试的染料似乎被困在它们进入的第一个线粒体中。另一方面,没有检测到染料毒性的迹象,使得可以通过细胞化和外胚层核循环15跟踪标记的线粒体。 图4 显示了注射后几个小时的外胚层细胞与Mitoview 633(激发波长633nm)。
BODIPY,Lysotracker和LipidSpot是强大的,可用于在512 x 512,线平均3,帧速率从1 / s到0.1 / s下采集约500 +图像。
从胚层阶段开始,LD沿微管双向移动,由相反极性的电机kinesin-1和细胞质动力蛋白5提供动力。这种运动可以通过注射BODPY 493/503和SiR-微管蛋白 来 共同标记LD和微管来可视化(图5)。由于LD经常反转其运动方向(当它们在激动蛋白-1和细胞质动力蛋白之间切换时),因此在采集过程中更高的帧速率可以更好地捕获LD运动的关键细节。
无需任何形式的染料注射即可实现自发荧光蛋黄囊泡的实时成像(图6)。然而,自发荧光是昏暗的,激发激光是光毒性的。因此,自发荧光蛋黄的实时成像相对于染料注入的信噪比较差。
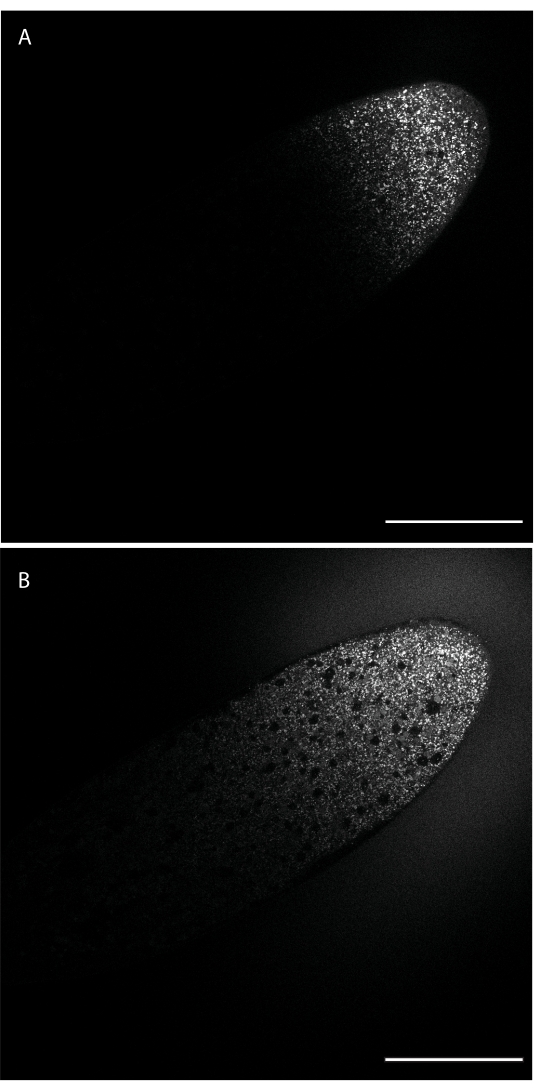
图1:BODIPY 493/503通过胚胎的扩散。染料沿着侧缘向前端(右上)注入,并从该注射部位扩散到胚胎中,标记LD。(B)大约24分钟/ 2核循环后,染料已经扩散到胚胎的中点。比例尺:100 μm。每 30 秒采集一个 1024 x 1024 帧(线平均 4)。请单击此处查看此图的放大版本。

图 2:LD 和酸性细胞器的颗粒图像测速 (PIV)。 胚胎注射了BODIPY 493 / 503和LysoTracker Red。(A) BODIPY频道。(B) LysoTracker Red Channel。(A',B')通过对从 10 个连续帧(包括 A 和 B 中所示的帧)生成的两个通道进行 PIV 分析生成的简化图。 A' 对应于LD的流动, B' 对应于酸性细胞器的流动。请注意, A' 和 B' 都显示出中心偏左的汇合处,其中胚胎内容物从视野平面流出,进入胚胎的中心。另外,请注意,BODIPY的扩散率高于LysoTracker,因为不同的染料具有不同的扩散特性。比例尺:100 μm。每 30 秒采集一个 1024 x 1024 帧(线平均 4)。 请单击此处查看此图的放大版本。
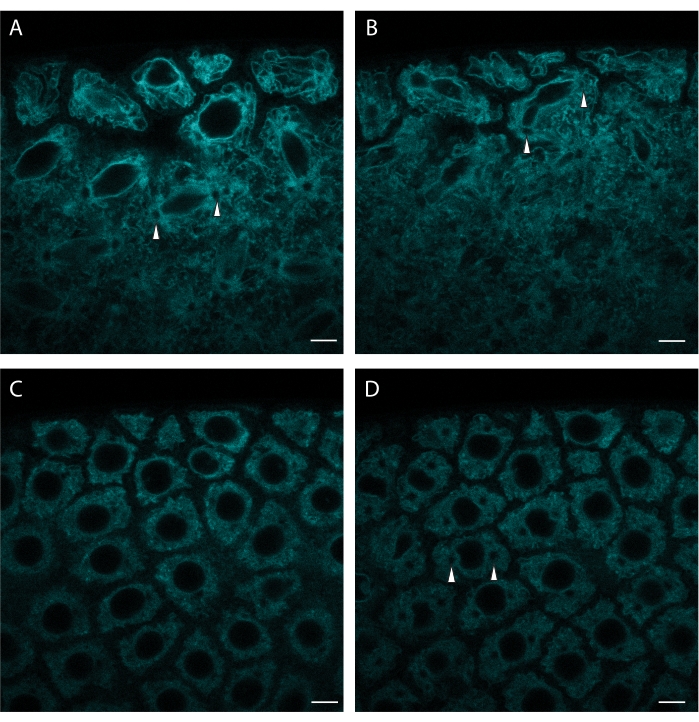
图3:ER跟踪器标记合胞体核分裂。 用ER跟踪器显微注射合胞胚胚,并随着时间的推移对其表面的一部分进行成像。(A) 核分工期间的主轴装配。(B) 在同一分割过程中核包膜脱落。(C) 随后的阶段间期。(D)下一次分裂的开始由中心体外观(出现圆形无ER区域,用箭头标记)表示。注意逐渐染料漂白。激发波长:488 nm。比例尺:5 μm。 A:初始帧, B:3 分钟已用, C:10 分钟已用, D:13 分钟已用。每 30 秒采集一个 1024 x 1024 帧(线平均 4)。 请单击此处查看此图的放大版本。
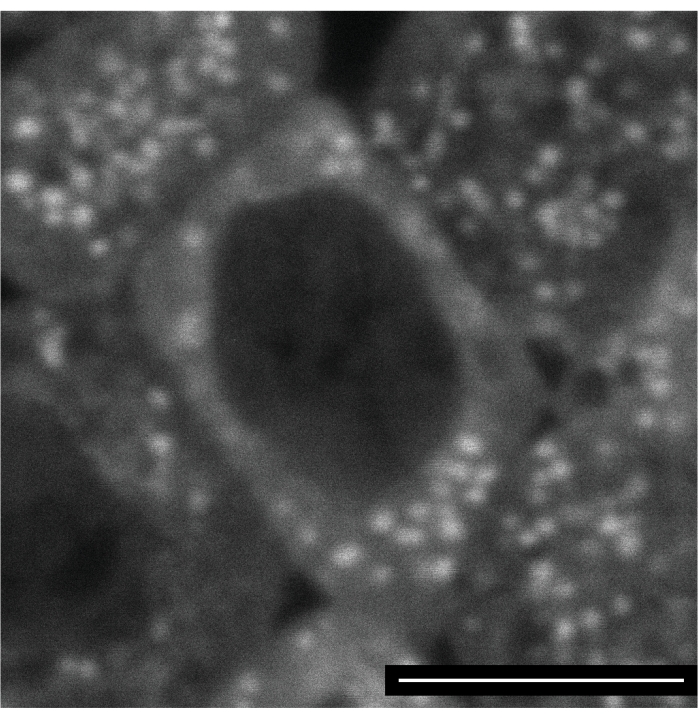
图4:线粒体的Mitoview 633标记。 在合胞胚层阶段向胚胎注射Mitoview 633,并在细胞化后4小时后成像。该图像显示了胚带延伸的胚胎的神经外胚层细胞。比例尺:5 μm。每 30 秒采集一个 1024 x 1024 帧(线平均 4)。 请单击此处查看此图的放大版本。
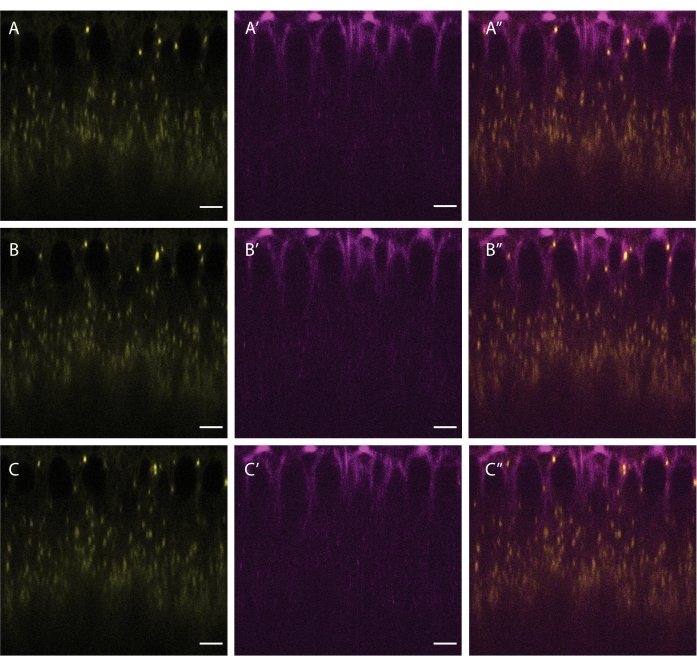
图5:LD和微管的共同标记。 向细胞化胚胎注射BODIPY 493/503(黄色 A,B,C)和SiR微管蛋白(洋红色 A',B',C')的混合物。 A'', B'', C'' 显示合并的频道。面板 A、 A' 和 A'' 显示初始帧,面板 B、 B' 和 B''' 显示 5 秒后的帧,面板 C、 C' 和 C'' 显示 10 秒后的帧。比例尺:5 μm。每 2.5 秒采集一个 512 x 512 帧(线平均 3)。 请单击此处查看此图的放大版本。
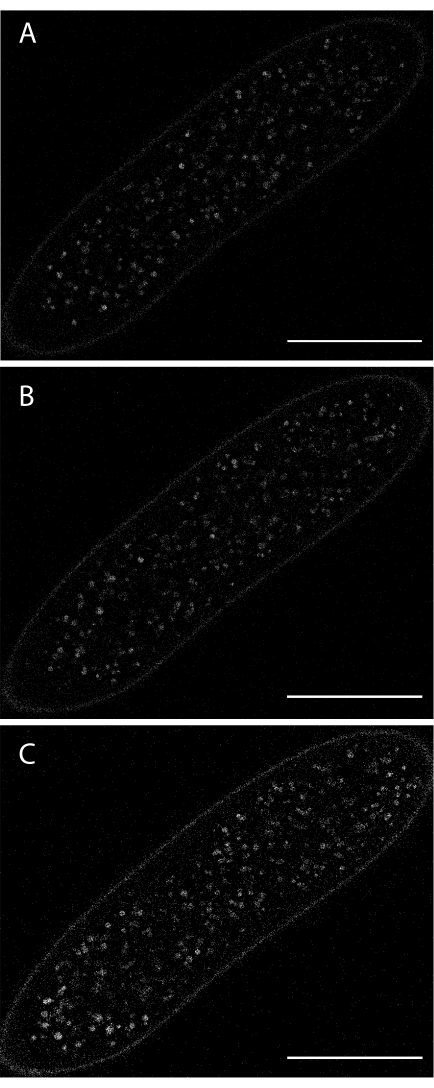
图6:在合胞体裂解阶段对卵黄囊泡自发荧光进行成像。 (A)在采集开始时。(B)8分钟后 (C)16分钟后激发波长:405 nm。使用低激发强度来保持胚胎存活。比例尺:100 μm。每 30 秒采集一个 1024 x 1024 帧(线平均 4)。 请单击此处查看此图的放大版本。
补充数据。请点击此处下载此文件。
讨论
果蝇胚胎是研究细胞和有机生物学基本问题的强大而方便的模型。它的相对简单性,强大的遗传学和小尺寸使其成为细胞过程和发育成像的优秀系统。在这里,标准显微注射方案被调整为能够在胚胎中使用FP。这种方法允许对特定细胞结构进行荧光成像,而无需遗传编码的荧光团,从而为成像打开了许多遗传背景。将多种染料与战略选择的荧光标记蛋白质相结合,可以打开跨越整个可见光光谱的多通道实时成像。
协议中的关键步骤:
该协议使用BODIPY 493/503来标记LD。这种方法可以很容易地适应于标记其他细胞结构。对于随后的图像分析,最重要的因素之一是信噪比,即染料与背景信号相比的亮度。溶酶体已成功成像(LysoTracker Red,1 mM),以及线粒体(Mitoview 633,200μM),ER(ER跟踪器Green,10μM)和微管(SiR微管蛋白,DMSO中200 nM),如图 2, 图3, 图4, 图5所示。此外,蛋黄囊泡是自发荧光的,并在紫外激发时发出蓝光(使用405nm作为激发波长的图像(图6))。对于其他染料,目标是染料浓度是染色活细胞所需浓度的100-1,000倍;这类似于将稀释到细胞培养基中的储备溶液的浓度。由于该协议要求注射100 fL,并且 果蝇 胚胎在第18卷中约为9 nL,因此这些染料浓度将平均为细胞培养基中存在的1/100以下的内部胚胎浓度。暂时,注射部位的局部浓度会更高,这与扩散性不好的FP(即线粒体染料和SiR-微管蛋白)最相关。对于这些FP,从推荐的高浓度开始;如果观察到意外死亡,应连续稀释两倍,直到在生存和信号强度之间达到可接受的折衷方案。
当共注入多种染料时,两种染料应位于同一溶剂中,或者溶剂和染料应与混合物相容(不建议酒精浓度超过〜10%)。
针的质量对于该过程的成功至关重要,因为尖端需要尽可能细。否则,注射伤口的损伤会损害胚胎的后续发育。由于商用拉针器不同,因此遵循制造商的建议并尝试多个拉拔参数非常重要,直到达到所需的形状。执行质量控制步骤1.1.3至关重要,因为使用开裂,锯齿状或大孔径针尖将使成功的注射更加困难甚至不可能。
胚胎需要部分干燥,以便在注射过程中可以添加额外体积的液体。如果胚胎干燥不足,针头将不容易进入,并且当针头穿透或注射溶液时,细胞质会喷出。如果胚胎过度干燥,它看起来会放气,不会正常发育。确切的干燥时间取决于当地条件,例如空气湿度,并且可能每天都在变化。它必须根据经验为每届会议确定。
显微注射后胚胎存活的能力主要取决于针的质量,适当的干燥以及将注射量限制在小于1 pL(理想情况下为100 fL)。只要优化这些参数,当所述染料以推荐浓度注入时,没有明显的毒性。如果胚胎在干燥和注射步骤中幸存下来,它们通常会成功地发育成胚带延伸,一个例外是微管和ER探针,它们导致高水平的细胞化缺陷(100 fL注射每个原液浓度)。测试发现,当DMSO,水和两者的混合物以推荐体积注射时,没有明显的发育缺陷,通过胚带延伸的胚胎存活率约为75%或更高。注射体积超过1 pL会导致缺陷,注射约4 pL体积的胚胎发育不到1小时。因此,进样量需要保持在较低水平,这意味着染料浓度必须很高。
通常,建议沿着胚胎的侧缘注射,因为这些注射造成的损害最小。然而,注射位点可能需要根据所采用的FP的扩散特性进行调整。BODIPY 493/503和LysoTracker在整个胚胎中的扩散速度比Lipid Spot 610(另一种标记LD的染料)更快,而SiR-Tubulin和Mitoview 633从未在整个胚胎上完全扩散(成像直到注射后7小时)。因此,在感兴趣的部位或附近注射可能是必要的。在前部或后部区域注射时,建议使用特别细的针头。
图像采集依靠共聚焦显微镜对小细胞器和所有细胞骨架成分进行光学切片和分辨。需要分析许多图像(例如STORM或PALM)的技术将不起作用,因为胚胎内容物处于运动状态,并且荧光团未针对光开关进行优化。落射荧光显微镜缺乏横向和轴向分辨率,无法分辨出大多数细胞器和较小的细胞结构。出于这些原因,强烈建议使用共聚焦显微镜或采用光片技术。
图像分析的再现性在很大程度上依赖于一致的成像数据。为了获得最大的成功机会,需要优化注射技术和图像采集。建立和实践一种技术,其中感兴趣的染料,注射部位,胚胎年龄,注射量和采集设置都是一致的,将为图像分析生成最可靠的数据。
方法的修改和故障排除
该协议演示了一种使用粒子图像测速法分析裂解期胚胎中LD体积流的方法。相同的方法可用于其他细胞器,其他发育阶段和其他分析方法。例如, 图2 显示了在胚胎发生合胞体阶段流动的LD和酸性细胞器的分析,通过共同注射BODPY 493/503和LysoTracker Red可视化。在受精后7小时内,已经实现了胚胎中LD运动的进一步成功成像;这些胚胎确实保留了注射伤口,但能够发育几个小时。
使用该协议收集的数据已用于粒子图像测速,但还有许多其他分析技术可用。例如,像ImageJ,Imaris或手动跟踪中发现的粒子跟踪程序可用于获得移动结构的速度和方向性。请注意,大多数此类跟踪软件都是为处理来自平面细胞培养系统的数据而构建的,并且并不总是很好地适应像 果蝇 胚胎这样的3D结构。此外,为了生成最高质量的粒子跟踪数据,需要对多个Z平面进行成像;如果图像堆栈采集时间小于~2 s,这应该是可行的。该基准应该在旋转圆盘共聚焦,晶格光片和最近的激光扫描共聚焦系统上达到。然而,对于LD,线粒体和溶酶体等丰富的细胞器,颗粒跟踪的可行性很低,因为视野中的正信号量对于当前的跟踪方法来说太高了。跟踪较少丰富的结构,如细胞核或卵黄囊泡可能是可能的。用于流动分析的PIV对于裂解阶段的LD和酸性细胞器效果很好,因为两个细胞器都可以自由移动。细胞核,ER和线粒体等细胞器被束缚在其他细胞结构上,因此不能自由移动,也不适合假设自由运动的软件分析。研究者应选择最适合感兴趣细胞器的技术。
在合胞体和细胞胚层阶段,LD(以及其他一些细胞器)沿着径向定向的微管移动5。因此,可以找到横截面视图(如图 5所示),其中单个微管在长距离聚焦中,从而允许以2D形式跟踪颗粒。由于这些光学平面位于胚胎深处,因此整体信号强度降低,信噪比降低。
对于跟踪分析,尽可能快的成像可以揭示运动的关键细节,从而揭示运动机械的关键细节。例如,脂滴运动是两种运动状态的混合物,慢-短运动(〜200 nm / s;平均行程距离〜100 nm)和快速 - 长运动(〜450 nm / s;平均移动距离〜1,000 nm)19;因此,如果每秒拍摄一次图像,甚至更不频繁地拍摄图像,则无法检测到慢速短路状态。然而,频繁的成像也会诱导荧光团漂白和光毒性。因此,必须根据要解决的确切问题调整成像条件。
方法的局限性
根据所需的染料,该方法可以受到染料溶解度和注射液毒性之间的相容性的限制。异丙醇和乙醇等醇由于其粘度较低而难以在针头内处理,并且似乎会破坏细胞成分并杀死胚胎。
该方法也不太适合可视化胚胎发生的最早步骤,因为准备注射胚胎需要30 +分钟。在室温下,胚胎的初始细胞周期仅为每个约10分钟长;因此,即使人们在步骤5.2.3中挑选一个新受精卵,当胚胎准备好进行成像时,前几个细胞周期也已经完成。
与长波长相比,使用UV/蓝色范围内的光的照明更具光毒性。在这样的条件下(例如,跟随自发荧光蛋黄囊泡; 图6),必须限制成像时间(导致更短的时间序列)或使用较低的激光功率(导致信噪比降低)。
细胞化后,注射到特定位置的染料往往扩散不良,因为它们必须穿过许多细胞膜。这限制了后期发育阶段的观察区域。
该方法相对于现有/替代方法的重要性
早期胚胎中LD和其他含脂质细胞器的运动可以通过遗传编码的荧光团,无标记技术和FP的引入来可视化。后者可以通过维特尔林膜12 的透化或这里讨论的显微注射方法来实现。
遗传编码的荧光团是多功能标记物,其水平通常从胚胎到胚胎具有高度可重复性。通常,它们只有一两个标记版本(例如,GFP或mCherry),限制了可以同时成像的结构的选择。另一方面,FP通常存在多种类型;例如,各种脂滴特异性染料具有从紫外/蓝色光谱中的Autodot到远红色光谱中的LipidTox和LipidSpot 610的发射光谱。FP也可以直接应用于任何感兴趣的菌株,因此不需要菌株构建来,例如,将所需的细胞器标记物引入感兴趣的突变菌株中。当同时标记多个结构时,这种优势尤其明显;而不是耗时的跨越多代的杂交,这可以通过混合相关染料并同时引入它们来实现。最后,如果要用药理学抑制来探测细胞过程,则可以将药物和染料一起引入。
无标记方法是检测特定细胞结构的非常强大的方法。例如,LD可以通过三次谐波生成显微镜20 或飞秒刺激拉曼损失显微镜21在早期胚胎中特异性检测。与FP一样,这些方法可以应用于任何遗传背景,并且由于它们不会导致漂白,因此它们可能允许更快的图像采集。然而,它们通常仅限于特定的细胞器,因此本身不支持多重成像;他们还需要专门的显微镜。
将小分子引入胚胎有两种一般策略。一个是这里采用的显微注射方法;另一种是化学(萜烯)处理,以透化卵黄素膜。后一种方法12 的参与程度低于显微注射,但从胚胎到胚胎的可变性也更大。此外,在透化后,卵黄素膜提供的保护受到损害,胚胎本身可以被外部培养基访问,这使得保持其存活更具挑战性。显微注射比透化更不可能破坏胚胎发育。然而,如果需要同时监测许多胚胎,例如,出于药物筛选目的,建议进行透化。为了跟踪细胞结构的运动并获得适合图像分析的可重复图像系列,显微注射是首选方法。
该方法在特定研究领域的重要性和潜在应用
果蝇胚胎是研究许多细胞生物学和发育过程的重要模型系统1,5,6。用荧光蛋白标记细胞器对理解早期胚胎如何发育,各种细胞器如何运输以及如何在发育和遗传上调节这种运输做出了重大贡献。然而,它们的漂白倾向以及产生菌株的挑战,其中多个细胞器用不同的颜色标记,限制了这种方法的应用。通过显微注射引入的FP的使用解决了许多这些挑战,甚至可以与荧光标记的蛋白质结合使用。该技术允许在任何遗传背景中对多个细胞器,细胞结构和细胞骨架成分进行成像。因此,可以通过实时成像比较几种基因型,从而可以确定突变对多个细胞器运输的影响。
该协议展示了 黑腹果蝇胚胎的FP注射方法,但原则上,这种方法适用于已经建立了显微注射技术的任何昆虫卵,包括其他种类的 果蝇,蟋蟀22和蚜虫23。
披露声明
作者没有利益冲突需要披露。
致谢
我们感谢Pakinee Phromsiri,Brian Jencik,Jinghong (James) Tang和Roger White对手稿的评论。我们感谢Patrick Oakes,Stefano Di Talia和Victoria Deneke分享他们关于如何进行PIV分析的专业知识。这项工作得到了美国国立卫生研究院F31 HD100127(M.D.K.)和R01 GM102155(M.A.W.)的支持。
材料
| Name | Company | Catalog Number | Comments |
| AUTODO | abcepta | SM1000a | Stains lipid droplets in violet/blue |
| BODIPY 493/503 | ThermoFisher | D3922 | Stains lipid droplets in green |
| Desiccant Beads –Desiccant-Anhydrous Indicating Drierite | W.A. Hammond Drierite Company | 21001 | |
| Dissecting microscope SteREO DiscoveryV20 with transillumination base | Zeiss | 4350030000000000 | |
| Double sided tape-Permanent Double-Sided Tape | Scotch (3M) | - | Sold by many vendors |
| ER-Tracker Green (BODIPY FL Glibenclamide) | ThermoFisher | E34251 | Stains the ER/nuclear envelope |
| Femptotip II | Eppendorf | H129354N | Ready to use |
| Glass capillaries -Glass Thinw w/fil 1.0mm 4in | World Precision Instruments | TW100F-4 | Must be pulled |
| Glass coverslip | - | - | Buy the appropriate refractive index for your objective lens |
| Glass slides -Double Frosted Microscope Slides precleaned | FisherBrand | 12-550-343 | |
| Halocarbon oil 27 | Sigma-Aldrich | H8773-100ML | |
| Halocarbon oil 700 | Sigma-Aldrich | H8898-50ML | |
| Heptane greener alternative anhydrous, 99% | Sigma-Aldrich | 246654-1L | Heptane is considered toxic by the USA's OSHA |
| Confocal microscope | Leica | Sp5 | Many different types of confocal microscopes will work. |
| LipidSpot 610 | Biotium | #70069 | Stains lipid droplets in far red |
| LysoTracker Red | ThermoFisher | L7528 | Stains lysosomes in red |
| MitoView 633 | Biotium | #70055 | Stains mitochondria |
| Needle loading pipette tips - 20uL microloader tips | Eppendorf | # 5242956.003 | |
| P-1000, Next Generation Micropipette Puller | Sutter Instruments | P-1000 | The settings used are heat-470, pull-70, velocity-60, delay-90, pressure-200, ramp-479 at 1x1. They refer to the intensity and length of the heating, the timing of pulling force and whether the force is applied linearly. Using these conditions, one capillary generates two usable needles with fine openings at the tip. |
| SiR-Tubulin | Cytosketon Inc | CY-SC014 | Made by Spirochrome; Cytoskeleton Inc. is the North American distributor. Stains microtubules in far red |
| TransferMan | Eppendorf | 5178 NK | |
| ViaFluor 405 | Biotium | #70064 | Stains microtubules in violet/blue |
参考文献
- Chowdhary, S., Tomer, D., Dubal, D., Sambre, D., Rikhy, R. Analysis of mitochondrial organization and function in the Drosophila blastoderm embryo. Scientific Reports. 7 (1), 5502 (2017).
- Mavor, L. M., et al. Rab8 directs furrow ingression and membrane addition during epithelial formation in Drosophila melanogaster. Development. 143 (5), 892-903 (2016).
- Riggs, B., et al. Actin cytoskeleton remodeling during early Drosophila furrow formation requires recycling endosomal components Nuclear-fallout and Rab11. Journal of Cell Biology. 163 (1), 143-154 (2003).
- Welte, M. A., Gross, S. P., Postner, M., Block, S. M., Wieschaus, E. F. Developmental regulation of vesicle transport in Drosophila embryos: forces and kinetics. Cell. 92 (4), 547-557 (1998).
- Welte, M. A. As the fat flies: The dynamic lipid droplets of Drosophila embryos. Biochimica et Biophysica Acta. 1851 (9), 1156-1185 (2015).
- Deneke, V. E., et al. Self-organized nuclear positioning synchronizes the cell cycle in Drosophila embryos. Cell. 177 (4), 925-941 (2019).
- Welte, M. A., et al. Regulation of lipid-droplet transport by the perilipin homolog LSD2. Current Biology. 15 (14), 1266-1275 (2005).
- Bailey, A. P., et al. Antioxidant role for lipid droplets in a stem cell niche of Drosophila. Cell. 163 (2), 340-353 (2015).
- Johnson, M. R., et al. H2Av buffering via dynamic sequestration to lipid droplets in Drosophila embryos. Elife. 7, 36021 (2018).
- Lowe, N., et al. Analysis of the expression patterns, subcellular localisations and interaction partners of Drosophila proteins using a pigP protein trap library. Development. 141 (20), 3994-4005 (2014).
- Rambold, A. S., Cohen, S., Lippincott-Schwartz, J. Fatty acid trafficking in starved cells: regulation by lipid droplet lipolysis, autophagy, and mitochondrial fusion dynamics. Developmental Cell. 32 (6), 678-692 (2015).
- Rand, M. D., Kearney, A. L., Dao, J., Clason, T. Permeabilization of Drosophila embryos for introduction of small molecules. Insect Biochemistry and Molecular Biology. 40 (11), 792-804 (2010).
- Tran, S. L., Welte, M. A. In-vivo centrifugation of Drosophila embryos. Journal of Visualized Experiments. (40), (2010).
- Rothwell, W. F., Sullivan, W. Drosophila embryo collection. CSH Protocols. 2007, (2007).
- Wieschaus, E., Nüsslein-Volhard, C., Roberts, D. B. . Drosophila: A Practical Approach. , 179-214 (1998).
- . The Interactive Fly: Stages of Development and Mitotic Domains Available from: https://www.sdbonline.org/sites/fly/aimain/2stages.htm (1999)
- Liberzon, A., et al. . OpenPIV/openpiv-python: OpenPIV - Python (v0.22.2) with a new extended search PIV grid option. , (2020).
- Markow, T. A., Beall, S., Matzkin, L. M. Egg size, embryonic development time and ovoviviparity in Drosophila species. Journal of Evolutionary Biology. 22 (2), 430-434 (2009).
- Gross, S. P., Welte, M. A., Block, S. M., Wieschaus, E. F. Dynein-mediated cargo transport in vivo. A switch controls travel distance. Journal of Cell Biology. 148 (5), 945-956 (2000).
- Debarre, D., et al. Imaging lipid bodies in cells and tissues using third-harmonic generation microscopy. Nature Methods. 3 (1), 47-53 (2006).
- Dou, W., Zhang, D., Jung, Y., Cheng, J. X., Umulis, D. M. Label-free imaging of lipid-droplet intracellular motion in early Drosophila embryos using femtosecond-stimulated Raman loss microscopy. Biophysical Journal. 102 (7), 1666-1675 (2012).
- Barry, S. K., et al. Injecting Gryllus bimaculatus Eggs. Journal of Visualized Experiments. (150), (2019).
- Le Trionnaire, G., et al. An integrated protocol for targeted mutagenesis with CRISPR-Cas9 system in the pea aphid. Insect Biochemistry and Molecular Biology. 110, 34-44 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。