Method Article
用于体外评估药物诱导肝毒性的人肝脏微生理系统
摘要
药物性肝损伤(DILI)是药物失败的主要原因。已经开发了一种协议来使用肝脏微生理系统(MPS)准确预测化合物的DILI责任。肝脏模型使用原代肝细胞的共培养和翻译相关终点来评估细胞对治疗的反应。
摘要
DILI是药物开发中损耗的主要原因,已知有1000多种FDA批准的药物可能导致人类DILI。不幸的是,DILI往往在药物达到临床阶段时才被发现,危及患者的安全,并给制药行业带来重大损失。考虑到标准2D模型在检测DILI方面存在局限性,因此必须开发更具预测性的体外模型以提高数据可转换性。为了详细了解DILI的因果关系和机制方面,已经开发了一种由人原代肝实质和非实质细胞(NPC)组成并在灌注下在工程支架上的3D微组织中培养的人肝脏MPS。将冷冻保存的原代人肝细胞(PHHs)和Kupffer细胞(HKCs)作为微组织在MPS平台中共培养长达两周,并且每种感兴趣的化合物以七种测试浓度重复加样到肝脏微组织中长达四天。分析功能性肝脏特异性终点(包括临床生物标志物,如丙氨酸氨基转移酶,ALT)以评估肝功能。通过比较对单剂量和多剂量微组织的反应,可以评估急性和慢性暴露于各种严重程度的DILI化合物。该方法已通过广泛的严重和轻度肝毒性化合物进行了验证。在这里,我们显示了吡格列酮和曲格列酮的数据,这些众所周知的肝毒性化合物因导致肝功能衰竭而从市场上撤出。总体而言,肝脏MPS模型可以成为评估DILI及其与肝功能变化关联的有用工具。该模型还可用于评估新化合物在不同患者亚群中的行为以及毒性特征如何受到肝病状态(例如病毒性肝炎,脂肪肝)的影响。
引言
DILI仍然是美国和欧洲急性肝衰竭的最常见原因,也是药物开发过程中化合物损耗的主要原因1。几乎所有类别的药物都会引起肝毒性,中枢神经系统药物和抗生素是迄今为止导致患者DILI的最常见治疗方法2。药物诱导的肝毒性是由遗传、非遗传和环境因素的复杂相互作用引起的,导致肝细胞和其他肝细胞类型(包括胆管细胞和内皮细胞)死亡1,3。
DILI致病因子可以分为两种方式:引起可预测剂量依赖性肝损伤的药物或引起特异质性DILI的药物,这种药物很少见,并且独立于药物剂量、途径或给药持续时间而发展,但在美国,高达六分之一的急性肝衰竭仅占4。不幸的是,在药物进入药物开发过程的临床阶段之前,DILI通常不会被检测到。药物性肝损伤等级(或DILIrank)由一千多种FDA批准的药物组成,根据其引起DILI的可能性分为四类,并且必须密切监测其在患者中的使用5。
研究药物肝毒性的机制仍然非常具有挑战性,因此,已经开发了许多临床前模型来探索DILI的机制。目前用于预测临床前开发中DILI的体外和体内模型在提供对活体人体中复杂,多方面相互作用的见解方面存在一些局限性。在2D中培养的癌性肝细胞系(即HepG2,HepaRG)仍然用于药物开发的早期阶段,以评估候选化合物的毒性6。即便如此,这些细胞系来自单个供体,肝功能水平异常,并且并不总是对检测DILI7,8表现出高灵敏度。作为癌性肝细胞系的替代品,如果在体外适当培养,PHHs可以更好地代表人类肝脏生理学,尽管它们的培养存在一些局限性,例如药物孵育时间短,寿命相对较短,肝基因表达丧失以及药物代谢功能改变9,10,11.PHHs可以在标准2D细胞培养板中的细胞外基质蛋白上培养,但缺点是其功能的快速下降意味着它们对DILI预测的灵敏度较低(<50%)12。
另一方面,对动物模型的测试缓慢,昂贵,并且需要跨物种翻译才能将预测推断到人类。大多数新开发的药物未能获得批准,这使得这一过程成本高昂且风险很大5。此外,为了测试新的人类特异性模式,由于基因序列或免疫反应与人类的差异,动物模型不太合适13。
因此,对更先进的三维(3D)体 外 肝脏模型的兴趣呈指数级增长。将PHHs培养为由悬挂液滴或超低附着表面上的重力聚集产生的球状结构,代表了评估复合负债的高通量方法14。PHH 球状体已用于评估疾病背景下的 DILI(例如脂肪变性和胆汁淤积)15。已经开发了各种各样的模型,包括肝细胞与基质成纤维细胞的电镀微图案共培养16,3D生物打印肝组织17,有或没有肝非实质细胞的3D球状体培养物15。然而,所有这些方法仍然存在缺点,在更具生理相关性的微环境中培养PHH可以长时间为它们提供更高水平的功能,以便能够长期暴露于潜在的肝毒物。此外,为了提高任何先进的 体外 PHH培养物的翻译相关性,必须利用临床相关的功能终点或毒性输出生物标志物来比较 体内 或临床场景的数据18。
在这项研究中,我们评估了MPS,也称为器官芯片(OOC)体外肝脏模型是否可用于了解肝毒性的详细机制方面。MPS先前已被证明可以在流动下维持功能强大的3D肝脏微组织长达4周19。该系统最近经过FDA测试,并显示出在进行药物毒性,代谢和细胞内积累时具有高可重复性20。此外,与球状体和夹心培养物相比,该系统在检测几种药物的毒性方面具有更稳定的功能和更高的灵敏度20。迄今为止,MPS已被广泛用于ADME 21,疾病建模(HBV22,NAFLD 23,24,25)和药物相互作用26,可能使其非常适合评估急性和慢性DILI。这里介绍的技术提供了一种替代方案,可以缩小更传统的细胞培养和动物模型与人体临床试验之间的差距,朝着模拟人类生物学条件的方向发展,以支持在药物开发过程的临床前阶段评估候选化合物的肝毒性。
研究方案
所有工作均在实验室按照严格的健康和安全程序进行,并按照其自己的实验室风险评估和SOP。所有使用的设备均根据制造商的指南进行维修。微生物安全柜(MBSC)每年进行一次维修,Ki-Discus(碘化钾)按照英国标准进行测试。该协议遵循英国人体组织管理局(HTA)的行为准则和指令,并使用完全符合知情同意(45 CFR §46.116和§46.117)和良好临床实践(GLP)(ICH E6)以及监管和伦理委员会的一般要求的供应商提供的道德来源的原代人类细胞。
1. 制备细胞培养基
注意:在第-1天准备播种高级DMEM培养基,并储存在4°C。 在第1天准备维护高级DMEM培养基,并在4°C下储存长达1周。
- 接种用于PHH和HKC共培养的高级DMEM培养基:用18 mL鸡尾酒A(终浓度为3.6%)和25 mLFBS(终浓度5%)补充一瓶500 mL高级DMEM培养基(材料表)。
- 用于PHH和HKC共培养的维护高级DMEM培养基:用20 mL鸡尾酒B(终浓度为4%)和500 nM氢化可的松补充一瓶500 mL高级DMEM培养基(材料表)。
注意:氢化可的松将在使用当天新鲜制作,下面提到了如何制备储备溶液和所需稀释液的步骤。 - 在维持高级DMEM培养基中制备500 nM氢化可的松
- 起始储备溶液(20mM)的制备:称取7.24mg氢化可的松(材料表)到1mL玻璃小瓶中。记录称出的氢化可的松的确切量,并使用以下计算确定二甲基亚砜(DMSO)的体积:
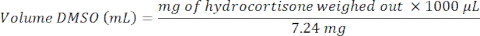
- 制备有效的 100 μM 氢化可的松储备溶液:将 5 μL 起始 20 mM 储备溶液加入 995 μL 高级 DMEM 中。
注意:在水或培养基中稀释步骤 1 中的 25 μL DMSO 溶液会导致 0.5% DMSO 浓度。在最终溶液中,DMSO浓度将为0.0025%。在这种情况下,5 μL的额外体积会导致总体积的微小变化。 - 在高级DMEM中制备有效的500 nM氢化可的松溶液:要在高级DMEM中制备1 mL 500 nM氢化可的松溶液,请将5 μL的100 μM氢化可的松储备溶液添加到995 μL维持高级DMEM培养基中。
- 起始储备溶液(20mM)的制备:称取7.24mg氢化可的松(材料表)到1mL玻璃小瓶中。记录称出的氢化可的松的确切量,并使用以下计算确定二甲基亚砜(DMSO)的体积:
2. MPS 设置和启动(第 -1 天)
- 将控制器连接到细胞培养箱中的扩展坞室,并确保将新鲜干燥剂(材料表)添加到位于控制器背面的干燥剂罐中。
注意:控制器单元随着时间的推移从培养箱中吸取水分,并使用新鲜干燥剂保持干燥。 - 通过按下位于控制器后面的船摇杆开关来打开控制器,等待 5 分钟,以使系统稳定并达到压力。然后检查屏幕上的气动报告,以确保:(i) 压力储罐输出达到 ~2000 mBar,(ii) 真空储罐输出达到 ~850 mBar。
- 从包装中取出每个板,目视检查每个孔以检查可能的缺陷(缺少支架,裂缝等)。
- 将驱动程序(带板)插入坞站,以检查坞站和控制器是否识别驱动程序。检查压力储罐输出是否下降小于 100 mBar,并且真空储罐输出是否增加小于 500 mBar。
- 通过向储液器侧添加 500 μL 种子高级 DMEM 培养基(预热至 37 °C)来灌注每个孔。
- 在控制器屏幕上选择 Prime 程序(以2.5μL/s的速度向上流动3分钟),直到流体通过过滤器支架。注意:"上流"是控制器上的设置,允许介质从储液罐向上流经LC12板中的支架。
- 用另外 1.1 mL 接种高级 DMEM 培养基填充所有孔以覆盖表面通道。然后,所有孔将处于其1.6 mL的全部工作体积。
- 将带有板的驱动器放入37°C和5%CO2 培养箱中,连接到扩展坞并运行 孵育 程序。
注意:实验中使用的所有程序(Prime,孵化,种子,培养基更改)都在MPS系统中预先设置。将培养箱中的板灌注,直到准备好播种。
3. 将肝细胞接种到 MPS 中(第 0 天)
- 预先验证所有PHHS和HKC。所有PHH和HKC批次在进行细胞培养实验之前均在内部预先验证(见 补充材料)。
- 通过将小瓶稳定地保持在37°C水浴中直到只剩下一小块冰来解冻PHHs和HKCs细胞的小瓶(材料表)。
- 将PHH直接移入预热(37°C)冷冻保存的肝细胞回收培养基CHRM培养基中(每管最多两个小瓶)。
- 轻轻移取细胞,然后使用 1 mL CHRM 从冷冻管中洗涤任何剩余的细胞。解冻并转移到锥形管中时,对细胞要非常温和。
注意 解冻期间不要搅拌小瓶,也不要上下移液其内容物。 - 将HKCs细胞从冷冻管中轻轻移液到15 mL离心管中的10 mL冰冷接种高级DMEM培养基中。
注意:最多可以组合2瓶HKC。 - 在室温(RT)下以100× g 离心两种细胞类型10分钟。除去上清液。
- 将PHH重悬于温热的接种高级DMEM培养基中,将HKC重悬于冰冷的接种高级DMEM培养基中(以帮助减少细胞聚集),每瓶添加到试管中的细胞使用1 mL,并将细胞放在冰上。使用轻柔的摇晃动作重悬细胞。
注意:不要通过移液器操作重悬PHH,因为它会导致细胞死亡。 - 合并来自多个管的细胞悬液(如果适用 - 即,如果所有PHH都来自同一供体),但不要混合细胞类型。
- 计数单元格。记录活力(两种细胞类型,PHH和HKC必须高于85%)和细胞总数。如果细胞活力低于85%,解冻一瓶新的细胞,并重新评估细胞活力。
- 使用以下公式计算细胞活力:
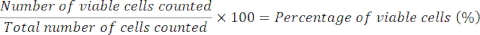
- 计算要接种到每个孔中的细胞悬液的所需体积,以及使总接种体积达到 400 μL 所需的额外接种高级 DMEM 培养基体积。 每孔细胞数:每孔 0.4 x 106 PHH 和 0.04 x 10 6 HKC,细胞密度为 0.25 x 106 PHH/mL, 分别为 0.025 x 106 HKCs/mL。
- 断开驱动程序与坞站的连接,然后将其放入 MBSC。
- 将介质从上述支架吸到停止点(沿着挡圈上的深槽口向下)、通道和储液器。在培养孔中留下 0.2 mL 的"死体积",刚好到达支架上方。必须注意不要从支架上方去除总介质,以避免形成气泡。
- 将 400 μL 接种高级 DMEM 培养基加入孔室,将驱动器放回培养箱中的扩展坞上,然后运行 培养基更换 程序 3 分钟。程序将在 3 分钟后自动暂停。
- 完成后,断开驱动程序与坞站的连接,然后将其放回 MBSC。
- 将介质从上述支架向下吸到停止点和每口井的储层端。
- 通过轻轻摇动管小心地重悬PHH,然后将所需体积的细胞悬液添加到每个培养孔中。小心地移液细胞悬浮液,确保细胞均匀地分散在板的支架上。
注意:为确保整个支架的良好覆盖,请使用缓慢的旋转运动将细胞移液到支架上。 - 同样,小心地重悬HKCs并将细胞悬浮液添加到每个培养孔中。
注意:使用缓慢的旋转动作播种HKC,以确保整个脚手架的良好覆盖。两个接种子步骤可以分离,或者两种细胞类型可以以适当的密度预混合并同时接种。 - 一旦所有孔都包含两种细胞类型,将MPS驱动器放在培养箱中的扩展坞上,而无需物理连接,并静置1小时。
- 1 小时后,用所需体积的额外接种高级 DMEM 培养基填充每个孔,使其达到 400 μL 并运行 种子 程序。
- 2 分钟后,程序将自动暂停,从培养箱中取出驱动程序,然后缓慢地将 1000 μL 接种高级 DMEM 培养基添加到通道中(比孔室更靠近储液库端),以获得 1.4 mL 的总体积(通道中还有 200 μL 死体积)。
- 将板移动到培养箱中,并运行 种子 程序的其余部分8小时。
注意:流将在 8 小时后自动切换到孵化程序。
4. 媒体变更(第一天)
- 断开驱动程序与坞站的连接,然后将其放入 MBSC。
- 通过将孔室中的种子高级DMEM培养基移至停止点来执行 培养基更换 。
- 将 400 μL 维护高级 DMEM 培养基加入孔室,将驱动器放回培养箱中的扩展坞上,然后运行培养基更换程序 3 分钟。程序将在 3 分钟后自动暂停。
- 断开驱动器与扩展坞的连接,并在 MBSC 中从脚手架上方的储液室、通道和停止点吸走介质。此时,培养井将返回到死体积。
- 在储液室中加入 1.4 mL 新鲜预热 (37 °C) 维护高级 DMEM 培养基。
- 将驱动程序返回到孵化器中的扩展坞并运行 孵化 器程序。
5. 肝脏微组织质量控制 (QC)、培养基收集、培养基更换和药物给药(第 4 天)
- 在第 4 天,使用维护高级 DMEM 培养基和 QC 检查执行 培养基更换 ,以确保种子设定成功。
注意:QC是通过测量乳酸脱氢酶(LDH)和尿素来检查形成的微组织的健康状况的过程。 - 在运行QC之前,为每种要测试的化合物准备新鲜的储备溶液(在维护高级DMEM培养基或含有0.1%DMSO的维护高级DMEM培养基中,具体取决于每种化合物的溶解度)。相应地制备稀释液以产生每种化合物的测试浓度。
- 断开驱动器和板与坞站的连接,然后转移到MBSC。
- 使用移液器将 50 μL 培养基从每个孔转移到 96 孔板中,在采样前进行 LDH 测定(材料表),将 25 μL 用于尿素测定(材料表)。
注意:LDH和尿素测定将按照制造商的说明进行。 - 如果LDH读数低于2 AU / 10 6细胞并且尿素高于40μg / 天/ 106细胞,则在QC后继续实验。
注意:白蛋白不用作QC,因为它是在当天运行的冗长测定,一旦实验完成从第4天提取的样品中取出,将在以后进行测定。 - 如果任何孔未通过QC,请将其从实验设计中删除。
- 确认实验布局后,从每个孔中取样剩余的培养基,确保不会通过触摸支架来干扰细胞培养。将收集的培养基(标记为给药前样品)储存在-80°C下以供以后测定。
- 按照步骤 4.3-4.5 在 MBSC 中执行 介质更改 。根据实验设计,将孔更改为具有正确药物浓度的维护高级DMEM培养基。
- 完成后,将驱动程序返回到孵化器中的扩展坞并运行 孵化 器程序。
6. 培养基收集、培养基更换和药物剂量(第 6 天)
- 为每种要测试的化合物准备新鲜储备溶液(在维护高级DMEM培养基或含有0.1%DMSO的维护高级DMEM培养基中,具体取决于每种化合物的溶解度)。根据板计划相应地准备稀释液以产生每种化合物的测试浓度。
- 断开驱动器和板与坞站的连接,然后转移到MBSC。
- 用移液管手动从每个孔(~1 mL)收集培养基,确保不会通过触摸支架来干扰细胞培养物,测定LDH和尿素。将其余收集的培养基储存在-80°C下以供以后测定,并在给药后48小时标记样品。
- 按照步骤4.3-4.5进行 培养基更换 ,根据平板计划,用与第4天相同的药物浓度重新给药每个孔。
- 完成后,将驱动程序返回到孵化器中的扩展坞并运行 孵化 器程序。
7. 结束实验(第 8 天)
- 断开驱动器和板与坞站的连接,然后转移到MBSC。
- 使用移液器手动从每个孔中采样培养基,确保不会通过触摸支架来干扰细胞培养。
- 测定取出的LDH和尿素培养基,并将其余收集的培养基储存在-80°C下以供以后测定。
- 运行 CYP3A4-glo 测定。
- 使用该测定法在实验结束时测量测试的药物对PHHs中细胞色素P450 CYP3A4活性的影响。
- 按照制造商的说明重新配制检测试剂(对于CYP3A4测定,参见 材料表)。如果检测试剂先前已复溶并冷冻,请将其从-20°C冰箱中取出,并在室温下解冻。
- 按照制造商的说明准备20 mM储备D-荧光素标准品。
- 在维持高级DMEM培养基(每孔2 mL致光底物培养基)中用1:1000稀释的荧光素IPA制备工作致光底物培养基。
- 使用发光底物介质执行步骤4.3-4.5中所述的 介质更换 。将 500 μL 发光基底培养基保存在 1.5 mL 玻璃小瓶(材料表)中作为输入材料。
- 将驱动程序放回培养箱中的扩展坞上,并运行 孵化 程序1.5小时。
- 按照制造商的说明在 1.5 mL 管中的培养基中制备 D-荧光素标准曲线,并使用培养基作为空白或 0 μM,将每种标准品的 50 μL 一式两份移液到白色不透明的 96 孔板上(参见 材料表)。
- 时间过后,按照步骤7.4.9-7.4.13从扩展坞和样品培养基中取出驱动器以进行CYP3A4测定。
- 孵育后,将每个孔和进样材料的 50 μL 样品培养基转移到含有标准的 96 孔不透明白色发光计板中。注意在不透明板上的标准品和样品之间留出至少两行空行,以避免顶级标准品和样品读数之间出现轻微残留。
- 向每个孔中加入 50 μL 荧光素检测试剂以引发发光反应。
- 将板在室温下在平板振荡器上在黑暗中孵育20分钟以稳定发光信号。
- 使用光度计或CCD相机记录发光。
- 通过取每个点的平均值,然后减去空白的平均值来绘制标准曲线。使用该线的方程计算其余样品中的代谢率(pmol/min/106 个细胞),记住包括所做的任何稀释。
- 使用一对镊子从板上取出支架,并将它们放入每个孔中含有 500 μL D-PBS(不含 Ca++ 和 Mg++)的 24 孔板中,注意不要干扰微组织。
- 使用倒置光学显微镜以放大10倍拍摄每个支架的快照。
- 按照制造商的说明运行ATP测定(见 材料表):
- 在室温下解冻试剂。
- 在每个洗涤步骤中,用 500 μL D-PBS(不含 Ca++ 和 Mg++)清洗支架两次。
- 向每个支架中加入 120 μL 试剂和 120 μL PBS,并将相同体积的溶液添加到空孔中(这将作为空白)。将覆盖有铝箔的板放在摇床上,剧烈摇动(500rpm)5分钟,然后孵育30分钟以稳定发光信号。
- 将 100 μL 裂解样品一式两份转移到透明平底 96 孔测定板中进行测量。确保空白孔未放置在其他高发光测量孔旁边。
- 使用酶标仪记录发光。
- 将样品的发光度与标准品的发光度进行比较,以确定样品中试剂检测到的ATP。
结果
手稿描述了用于评估DILI的肝脏MPS模型。MPS 有助于生成 3D 肝微组织,这些微组织在流动下可保持高度功能性长达 4 周。将PHH / HKCs接种到涂有胶原蛋白的支架上以形成肝微组织,这些微组织注入生长培养基,并在通过QC检查后加入化合物。在这里,我们显示了曲格列酮和吡格列酮的数据,这两种化合物结构相似,但DILI严重程度不同。
在第4天,在药物给药之前,评估形成的肝微组织的QC检查,包括LDH释放和尿素合成(图1A)。QC旨在确认肝脏MPS产生高度一致和功能性的肝脏微组织。这里提供的数据是从三个实验中生成的,显示出良好的重现性水平,研究内和研究间的变异性较低。培养8天后,评估多种健康和肝脏指标(白蛋白,尿素,CYP3A4,ATP),对照微组织显示出高水平的肝功能和可重复性(图1B,C)。肝微组织的对比相位显微镜和IF染色(见 补充材料)在整个支架的微通道中显示出高播种一致性,并揭示了HKC在PHH微组织中的分布(图1D)
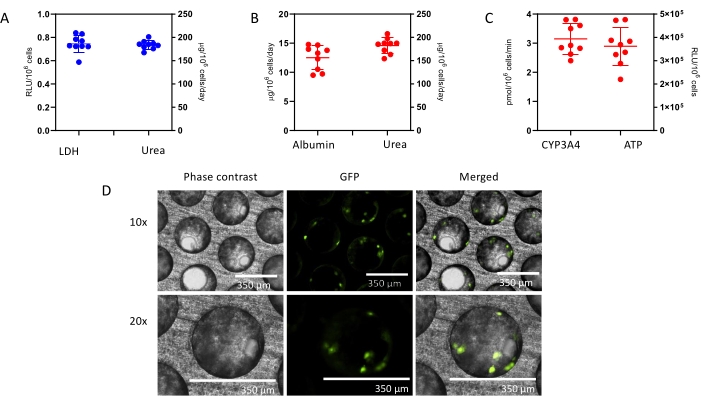
图 1:肝脏 MPS 产生高度可重复的数据和一致的 微组织。 (A) 第 4 天的 3D 肝脏微组织 QC 指标,以及研究结束时第 8 天的功能评估 -(B) 白蛋白和尿素,(C) CY3A4 和 ATP)。数据从3个实验中收集;在每个实验中,有3个车辆对照重复。显示的数据是标准偏差±平均值,N = 9。(D)在肝脏MPS平台中共培养PHH和HKCs产生的3D肝微组织的相差显微镜(10x和20x)和IF,用于评估DILI。为了可视化HKC,在接种HKC之前,用表达eGFP的腺病毒载体转导HKC(见 补充材料)。显示了代表性的显微照片。转导和成像作为独立实验进行,以证明细胞定位,而不是使用描述的DILI方案完成。HKCs细胞在用于实验性细胞培养之前在内部进行了预先验证,并且解冻后的活化水平必须较低;这是通过测量生物标志物IL-6和TNF-α来评估的。 请点击此处查看此图的大图。
已知曲格列酮可引起严重的DILI;在获得治疗2型糖尿病的许可后,由于与其使用相关的肝损伤频率,它在上市3年后被FDA撤回。迄今为止,已发表的动物研究未能预测曲格列酮可能导致严重肝损伤。在标准的 体外 2D肝脏测定中也没有检测到该化合物的毒性14。
MPS中的肝脏微组织给予曲格列酮96小时,并引起急性毒性反应,Cmax驱动,通过ALT和LDH释放以及白蛋白和尿素产量的快速减少检测到,在急性暴露于曲格列酮后,最大约为15 x C(图2A)。暴露96小时后采样的细胞终点(ATP含量)和CYP3A4活性(用于评估代谢生物转化),进一步证实曲格列酮引起的毒性和EC:50值与其他终点高度相当(图2B)。在MPS中培养8天后拍摄的明场显微镜图像显示健康的肝脏微组织,均匀地接种在整个支架(载体对照)中,与用阳性对照和曲格列酮处理的重复中观察到的广义组织死亡/降解相反,在前两个测试浓度下(图2C)。
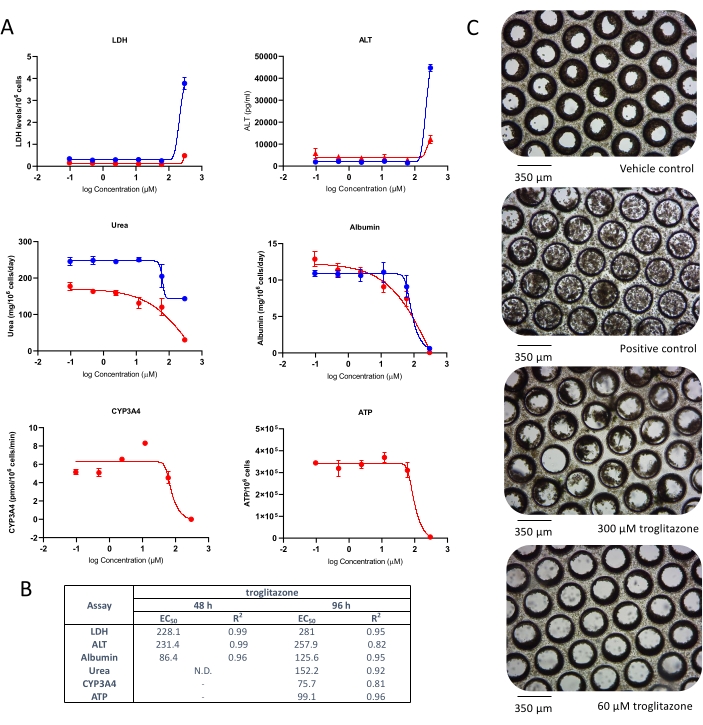
图 2:使用多个肝毒性终点确定曲格列酮的 DILI 风险。 将肝脏微组织暴露于七种测试浓度的曲格列酮96小时,并比较(A)LDH释放,ALT释放,白蛋白产生,尿素合成,CYP3A4活性和ATP含量。蓝线 - 48小时曝光(仅限媒体终点),红线 - 96小时曝光。阳性对照为100μM氯丙嗪。所有终点均从相同的肝脏MPS培养物中测量。显示的数据是标准偏差±平均值,N = 3。(B) 根据数据生成的E:50数字摘要。N.D. = 数据不可绘制。线=未测定。(C)培养8天后肝脏微组织的代表性明场显微镜检查(放大10倍)。 请点击此处查看此图的大图。
还研究了暴露于吡格列酮后的肝毒性。吡格列酮是一种已知低DILI关注的化合物4 ,在经典的2D原代肝细胞培养物中甚至一些更先进的3D模型中都没有肝毒性10,11。在两个测试时间点都观察到轻微的肝毒性作用(图3)。未检测到LDH或ALT释放;然而,48小时后,观察到白蛋白和尿素产量的轻度减少,最大 约25x C(图3A)。在高吡格列酮浓度下也观察到ATP含量的非常轻微的降低,但这并不显着。从剂量反应曲线生成的EC:50值如图 3B所示。显微镜检查显示,在两种最高测试浓度下暴露于吡格列酮96小时后,微组织发生了轻微的改变(图3C)。结果表明,肝脏MPS能够检测轻度DILI化合物的毒性。
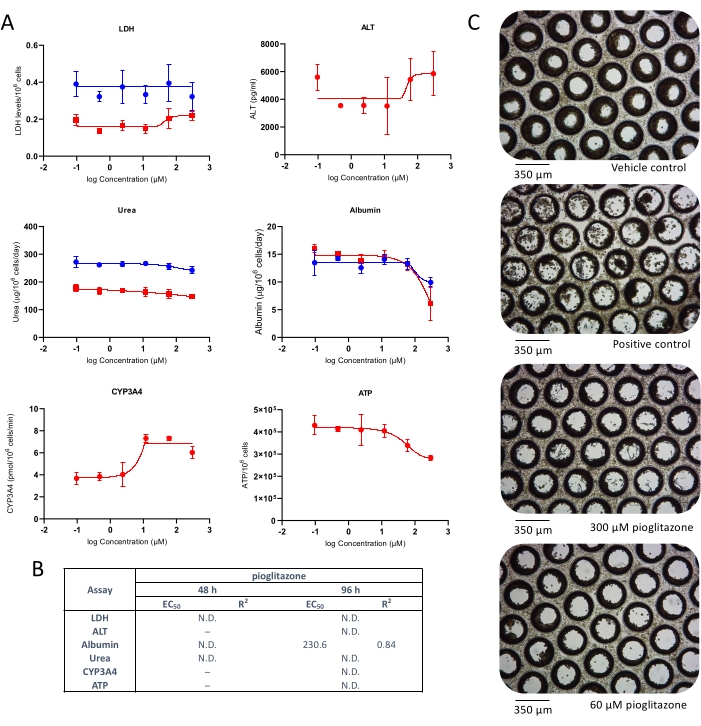
图 3:使用多个肝毒性终点确定吡格列酮的 DILI 风险。 将肝脏微组织暴露于七种测试浓度的吡格列酮96小时,并比较(A)LDH释放,ALT释放,白蛋白产生,尿素合成,CYP3A4活性和ATP含量。蓝线 - 48小时曝光(仅限媒体终点),红线 - 96小时曝光。阳性对照为100μM氯丙嗪。所有终点均从相同的肝脏MPS培养物中测量。显示的数据是标准偏差±平均值,N = 3。(B) 根据数据生成的EC:50数字摘要。N.D. = 数据不可绘制。线=未测定。(C)培养8天后肝脏微组织的代表性明场显微镜检查(放大10倍)。 请点击此处查看此图的大图。
通过评估可能代表 体内 或临床场景(LDH释素合成,白蛋白产生,CYP3A4活性,ATP含量,ALT释放)的所有功能终点和毒性输出生物标志物,并证实在7点剂量范围内给药48小时和96小时的两种测试化合物生成的数据,已经生成了热图以产生"肝毒性特征", 帮助鉴定具有不同程度DILI关注的化合物(图4)。
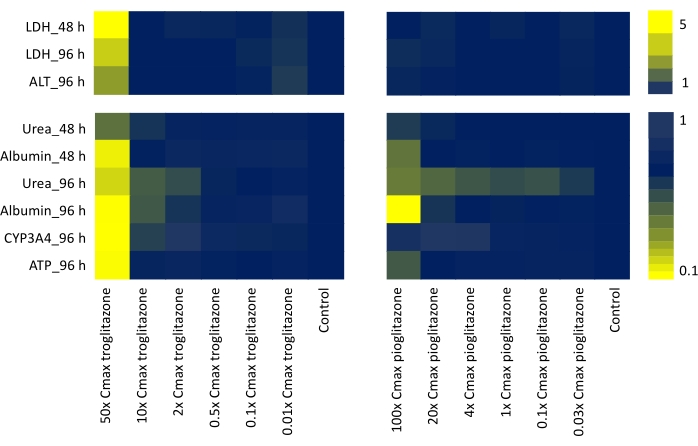
图 4:用肝脏 MPS 确定"毒性特征"。 热图显示了曲格列酮和吡格列酮在暴露于七点剂量范围 48 小时和 96 小时后来自六个功能性肝脏特异性终点(LDH 释放、尿素合成、白蛋白产生、ALT 释放、CYP3A4 活性和 ATP 含量)。每个值生成为平均值,N = 3,并归一化为对照样本。颜色条上的值表示基线控件的倍数增加。 请点击此处查看此图的大图。
补充材料:微组织的荧光显微镜成像和细胞的资格预评估。请点击此处下载此文件。
讨论
MPS旨在在 体外重现 人体器官的功能单位,并已开发用于解决传统3D细胞培养模型的局限性27。肝脏是使用MPS建模最多的器官之一,并且已经开发了各种各样的系统。人肝负责药物代谢和有毒药物代谢物的产生,其功能是药物开发模型的关键要素,包括评估化合物28的DILI责任。在这里,我们介绍了一种使用肝脏MPS评估DILI的新方法;该方案能够为每种化合物寻求机理见解,以确定其如何引起DILI,并且是一种高度灵敏和稳健的测定。肝脏微组织在MPS板中形成,MPS板是PHH和HKCs的共培养物,与标准 体外 肝脏模型20相比,具有高水平的白蛋白和尿素产生以及高CYP3A4活性。
虽然这里描述的DILI模型可以作为药物开发过程中临床前测试后期的有用工具,但它也有一些局限性。作为目前市场上的大多数MPS,它是一个低通量平台,因此更难用于大规模的药物筛选活动。DILI模型由通过共培养PHH和HKC形成的微组织组成,也不能完全捕获人类肝脏的复杂性,通过结合不同类型的细胞(例如免疫细胞)进行进一步优化将有利于为现有模型增加价值。这种单器官MPS还可以与其他器官平台相结合,这些平台可以共享一个共同的介质,并允许细胞或内分泌水平的器官串扰,这有助于更好地理解毒性的机制见解,而不仅仅是肝脏本身。此外,与任何相对较新的技术一样,它可能被认为是昂贵的,因此可及性有限。
MPS是一个用于开发单个或多个人体组织的器官型模型的平台。该系统由控制器、脐带电缆和插入板的 MPS 驱动器组成(图 5A)。每个肝脏MPS板都有12个独立的开放孔,用于在工程支架上以3D方式培养原代肝细胞。总之,该系统经过QC检查,并在第-1天启动板,在第0天将PHH和HKC接种在平板上(图5B,见1)。嵌入式微泵促进细胞培养基通过支架的循环,以促进3D微组织的形成(图5B,见2)。形成的微组织在第4天进行QC处理,每48小时给药一次不同浓度的每种化合物,持续4天,并在第8天测定终点生物标志物(图5C)。MPS板中DILI测定的实验时间表如图 5D所示。
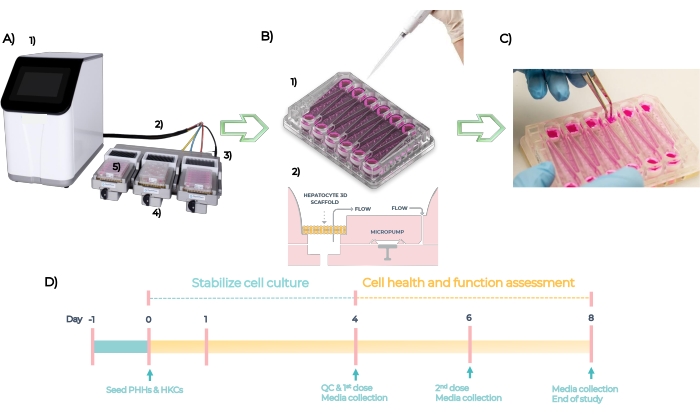
图5:标准DILI测定的微生理系统和实验时间表。 (A)微生理系统及其组件:控制器(1),脐带电缆(2),扩展坞(3),MPS驱动器(4)和LC12板(5)。(B)在第1天(1)将PHH和HKCs接种在LC12板上,嵌入式微泵促进细胞培养基以可调流速通过接种在支架上的3D微组织循环(2)。(C)在研究结束时取下脚手架。(四)实验时间表。 请点击此处查看此图的大图。
执行实验方案时,重要的是在启动之前进行可靠的系统质量控制检查,检查系统是否气动运行正常,并且对耗材板进行目视检查和有效底漆,以确保所有孔的功能均匀。拥有高质量的原代人细胞对于该协议至关重要,已知肝细胞在细胞培养实验中始终如一地粘附并形成3D相互作用。解冻这些细胞也是一个关键步骤,因为原代肝细胞不应通过移液作用重悬,因为这会迅速导致细胞死亡。细胞活力高于85%对于成功接种至关重要,因为大量的细胞碎片会干扰3D微组织的形成。在第4天对形成的肝脏微组织进行QC检查也很重要,用户需要确保测量可接受的LDH和尿素水平,因为超出范围的参数可能表明组织形成质量差,并允许直接排除故障。最后,细胞培养基中使用的氢化可的松必须在使用当天新鲜制备,以防止任何可能影响细胞培养功能的不必要的降解,因为它是维持肝细胞代谢功能所必需的。
尽管具有显着的复杂性,但肝脏MPS并不包含人类肝脏的所有细胞类型。可以向模型24,29添加更多细胞类型以增加生理相关性,但这些细胞类型只能在使用上下文的明确理由下添加。对于研究帝力PHH是关键细胞类型,在该模型中掺入HKCs可以确定一些免疫反应。还应该注意的是,从人肝脏中分离的PHHs和市售的冷冻保存PHHs往往在批次之间表现出一些差异。我们在这里已经证明,当与高质量的细胞制剂一起使用时,该协议会产生可重复的结果。然而,预计会有一些批次间的变化,这可以通过使用多个捐赠者的合并批次来进一步克服。这些限制可以通过使用与iPSC分化的肝细胞样细胞来克服,这些细胞概括了PHH的许多功能特性,并已用于药物开发过程30。HKC还显示出很大的批次间变异性和解冻后高水平的活化;因此,HKC供体在用于实验细胞培养(与经过验证的PHHs共培养)之前,在内部进行了预先验证,并且解冻后的活化水平必须较低;这是通过测量生物标志物IL-6和TNF-α来评估的(见补充材料)。
此处提供的数据证实,该测定可以准确检测DILI,有助于识别2D10,11甚至某些3D模型可能无法检测到的肝毒物。由于缺乏过程标准化和协调性,包括站点间重现性,MPS生成的数据仍未被制药行业用作监管提交或药物筛选目的的标准20。这里展示的数据和实验方法解决了这个问题,表明肝脏模型可以在DILI筛查中常规和稳健地使用,以准确预测新化合物的责任。
通过测量一系列终点以产生"肝毒性特征",帮助识别具有不同程度的DILI关注的化合物(包括其他体外方法无法检测到的化合物)及其毒性机制。该技术可以缩小传统细胞培养和动物模型与人体临床试验之间的差距,作为药物开发过程的一部分,朝着模拟人类生物学条件的方向发展,以进行肝毒性的临床前评估。
披露声明
所有作者均为CN Bio Innovations Limited的员工。
致谢
CN Bio Innovations Ltd.资助了这项研究。
材料
| Name | Company | Catalog Number | Comments |
| 24 well cell culture cluster plates flat bottom | Corning | 3524 | |
| 96 well clear assay plates, flat bottom clear plastic | Greiner | 655101 | |
| 96 well plates black flat bottom | Corning | 3915 | |
| 96 Well White/Clear Bottom Plate, TC Surface | ThermoScientific | 165306 | |
| Advanced DMEM (1x) | Gibco | 12491015 | Cell culture media. |
| AssayMax Albumin ELISA Kit | AssayPro | EA3201-1 | Dilution 1:250. Time point Day 4, 6, and 8. |
| Cell Maintenance Cocktail B, (Primary Hepatocyte Maintenance Supplements) | Gibco | CM4000 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | Dilution 1:1. Time point Day 8. |
| Chlorpromazine HCl | Sigma Aldrich | C8138 | |
| Chromacol blue lids, 9 mm Autosampler Vial Screw Thread Caps | ThermoScientific | 9-SCK(B)-ST1 | glass vial |
| Chromacol vials, 9 mm Clear Glass Screw Thread Vials | ThermoScientific | 2-SVW | |
| Class 2 Microbiological Safety Cabinets - Trimat2 1500 exhaust | Contained Air Solutions | ||
| Conical tubes 50 mL | Greiner | 227261 | |
| Cryopreserved Hepatocyte Recovery Medium (CHRM) | ThermoFisher Scientific | Gibco CM7000 | |
| Cryopreserved primary human hepatocytes | BioIVT Europe | Lot. RAS | |
| CytoTox 96 Cytotoxicty (LDH) Assay Kit | Promega | G1781 | Dilution - none. Time point Day 4, 6 and 8 |
| >Data analysis model used to generate the graph and EC:50 curves was nonlinear regression (curve fit) asymmetric sigmoidal, 5PL, where X is log(concentration | GraphPad Prism 9 | ||
| Disposable PES Filter Units 500mL | Fisher Scientific | 15913307 | |
| Disposable Pipette Basins 50ml | Fisher Scientific | 12369175 | |
| DMSO (Dimethyl sulfoxide) | Sigma-Aldrich | Sigma D2650 | |
| Dulbeco’s Phosphate Buffered Saline without Ca2+ and Mg2+ (D-PBS) | ThermoFisher Scientific | 14190-144 | |
| Easy Reader Conical Polypropylene Centrifuge Tubes 15 mL | Fisher Scientific | 11889640 | |
| Foetal bovine serum | Gibco | 10500064 | |
| Human ALT ELISA Kit | Abcam | ab 234578 | Dilution 1:5. Time point Day 6 and 8. |
| Human Cryopreserved Kupffer Cells | Lonza Europe | Lot. 190088KC | |
| hydrocortisone | Merck | H0888-1G | |
| Incubators models: New Brunswick Galaxy 170 S, New Brunswick Galaxy 170 R and CellXpert® C170. | Eppendorf | All serviced yearly; paperwork available upon request. | |
| Inverted Microscope | Leica DMIL LED | ||
| MPS know as Organ-on-a-Chip (OOC) | CN Bio Innovations Ltd. | ||
| MPS LC-12 plate | CN Bio Innovations Ltd. | ||
| Neubauer Improved C-Chip Disposable Haemocytometer (2 channel) | Cambridge Bioscience | DHC-N01-50 | |
| P450-Glo CYP3A4 Assay and Screening System | Promega | V9002 | Dilution - none. Time point Day 8 |
| PhysioMimix MPS platform | CN Bio Innovations Ltd. | ||
| Pioglitazone | MedChemExpress Tocris | HY-13956/CS-1700 | |
| Quantichrom Urea Assay Kit – Bioassay systems | Bioassay Systems | DY970-05 | Dilution 1:2 if initial reading is too high. Time point Day 4, 6 and 8. |
| Silica gel | Sigma-Aldrich | S7625 | |
| Software used to analyse and generate all the graphs was | GraphPad Prism 9 | ||
| Stripettes 10 mL | Fisher Scientific | 11839660 | |
| Stripettes 25 mL | Fisher Scientific | 11839181 | |
| Thawing plate Cocktail A, (Primary Hepatocyte Thawing and Plating Supplements) | Gibco | CM3000 | |
| Troglitazone | MedChemExpress Tocris | 97322-87-7 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Tubes 1.5 mL | Greiner | 616201 | |
| Weighing balance - model PA214C and AV213C | Ohaus Corp |
参考文献
- Lisi, D. M. Drug-induced liver injury: An overview. US Pharmacist. 41 (12), 30-34 (2016).
- Kuna, L., et al. Models of drug induced liver injury (DILI)-current issues and future perspectives. Current Drug Metabolism. 19 (10), 830-838 (2018).
- Katarey, D., Verma, S. Drug-induced liver injury. Clinical Medicine. 16 (6), 104-109 (2016).
- Kullak-Ublick, G. A., et al. Drug-induced liver injury: recent advances in diagnosis and risk assessment Recent advances in clinical practice. Gut. 66, 1154-1164 (2017).
- Dirven, H., et al. Performance of pre-clinical models in predicting drug-induced liver injury in humans: a systematic review. Scientific Reports. 11 (1), 6403 (2021).
- Donato, M. T., Lahoz, A., Castell, J. V., Gomez-Lechon, M. J. Cell lines: a tool for in vitro drug metabolism studies. Current Drug Metabolism. 9 (1), 1-11 (2008).
- Wilkening, S., Stahl, F., Bader, A. Comparison of primary human hepatocytes and hepatoma cell line HepG2 with regard to their biotransformation properties. Drug Metabolism and Disposition. 31 (8), 1035-1042 (2003).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28 (2), 69-87 (2012).
- Grainger, C. I., Greenwell, L. L., Lockley, D. J., Martin, G. P., Forbes, B. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier. Pharmaceutical Research. 23 (7), 1482-1490 (2006).
- Li, F., Cao, L., Parikh, S., Zuo, R. Three-dimensional spheroids with primary human liver cells and differential roles of kupffer cells in drug-induced liver injury. Journal of Pharmaceutical Sciences. 109 (6), 1912-1923 (2020).
- Proctor, W. R., et al. Utility of spherical human liver microtissues for prediction of clinical drug-induced liver injury. Archives of Toxicology. 91 (8), 2849-2863 (2017).
- Lin, C., Khetani, S. R. Advances in engineered liver models for investigating drug-induced liver injury. BioMed Research International. 2016, 1829148 (2016).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regulatory Toxicology and Pharmacology. 32 (1), 56-67 (2000).
- Bell, C. C., et al. Comparison of hepatic 2D sandwich cultures and 3D spheroids for long-term toxicity applications: A multicenter study. Toxicological Sciences. 162 (2), 655-666 (2018).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Khetani, S. R., et al. Use of micropatterned co-cultures to detect compounds that cause drug-induced liver injury in humans. Toxicological Sciences. 132 (1), 107-117 (2013).
- Ma, X., et al. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting. Proceedings of the National Academy of Sciences of the united States of America. 113 (8), 2206-2211 (2016).
- Dieterle, P. Y. M., Dieterle, F. Tissue-specific, non-invasive toxicity biomarkers: translation from pre-clinical safety assessment to clinical safety monitoring. Expert Opinion on Drug Metabolism & Toxicology. 5 (9), 1023-1038 (2009).
- Rowe, C., et al. Perfused human hepatocyte microtissues identify reactive metabolite-forming and mitochondria-perturbing hepatotoxins. Toxicology in Vitro. 46, 29-38 (2018).
- Rubiano, A., et al. Characterizing the reproducibility in using a liver microphysiological system for assaying drug toxicity, metabolism, and accumulation. Clinical and Translational Science. 14 (3), 1049-1061 (2021).
- Tsamandouras, N., Kostrzewski, T., Stokes, C. L., Griffith, L. G., Hughes, D. J., Cirit, M. Quantitative assessment of population variability in hepatic drug metabolism using a perfused three-dimensional human liver microphysiological system. Journal of Pharmacology and Experimental Therapeutics. 360 (1), 95-105 (2017).
- Ortega-Prieto, A. M., et al. 3D microfluidic liver cultures as a physiological pre-clinical tool for hepatitis B virus infection. Nature Communications. 9 (1), 682 (2018).
- Kostrzewski, T., et al. Three-dimensional perfused human in vitro model of non-alcoholic fatty liver disease. World Journal of Gastroenterology. 23 (2), 204-215 (2017).
- Kostrzewski, T., et al. A microphysiological system for studying nonalcoholic steatohepatitis. Hepatology Communications. 4 (1), 77-91 (2020).
- Vacca, M., et al. Bone morphogenetic protein 8B promotes the progression of non-alcoholic steatohepatitis. Nature Metabolism. 2 (6), 514-531 (2020).
- Long, T. J., et al. Modeling therapeutic antibody-small molecule drug-drug interactions using a three-dimensional perfusable human liver co-culture platforms. Drug Metabolism and Disposition. 44, 1940-1948 (2016).
- Bai, J., Wang, C. Organoids and microphysiological systems: New tools for ophthalmic drug discovery. Frontiers in Pharmacology. 11, 407 (2020).
- Ribeiro, A. J. S., Yang, X., Patel, V., Madabushi, R., Strauss, D. G. Liver microphysiological systems for predicting and evaluating drug effects. Clinical Pharmacology & Therapeutics. 106 (1), 139-147 (2019).
- Clark, A. M., et al. A microphysiological system model of therapy for liver micrometastases hhs public access. Experimental Biology and Medicine (Maywood). 239 (9), 1170-1179 (2014).
- Qosa, H., Ribeiro, A. J. S., Hartman, N. R., Volpe, D. A. Characterization of a commercially available line of iPSC hepatocytes as models of hepatocyte function and toxicity for regulatory purposes. Journal of Pharmacological and Toxicological Methods. 110, 107083 (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。