Method Article
Sistema microfisiológico hepático humano para evaluar la toxicidad hepática inducida por fármacos in vitro
En este artículo
Resumen
La lesión hepática inducida por fármacos (DILI) es una causa importante de fracaso farmacológico. Se ha desarrollado un protocolo para predecir con precisión la responsabilidad DILI de un compuesto utilizando un sistema microfisiológico hepático (MPS). El modelo hepático utiliza el cocultivo de células hepáticas primarias y criterios de valoración traslacionalmente relevantes para evaluar las respuestas celulares al tratamiento.
Resumen
DILI es una causa importante de desgaste en el desarrollo de medicamentos con más de 1000 medicamentos aprobados por la FDA que se sabe que potencialmente causan DILI en humanos. Desafortunadamente, DILI a menudo no se detecta hasta que los medicamentos han alcanzado etapas clínicas, poniendo en riesgo la seguridad de los pacientes y provocando pérdidas sustanciales para la industria farmacéutica. Teniendo en cuenta que los modelos 2D estándar tienen limitaciones en la detección de DILI es esencial desarrollar modelos in vitro que sean más predictivos para mejorar la traducibilidad de los datos. Para comprender la causalidad y los aspectos mecanicistas de DILI en detalle, se ha desarrollado un MPS hepático humano que consiste en células hepáticas primarias del parénquima y no parénquima (NPC) del hígado humano y cultivadas en microtejidos 3D en un andamio diseñado bajo perfusión. Los hepatocitos humanos primarios criopreservados (PHH) y las células de Kupffer (HKC) se cocultivaron como microtejidos en la plataforma MPS durante un máximo de dos semanas, y cada compuesto de interés se dosificó repetidamente en microtejidos hepáticos a siete concentraciones de prueba durante un máximo de cuatro días. Se analizaron los criterios de valoración funcionales específicos del hígado (incluidos los biomarcadores clínicos como la alanina aminotransferasa, la ALT) para evaluar la función hepática. La exposición aguda y crónica a compuestos de diversas gravedades DILI se puede evaluar comparando las respuestas a microtejidos de dosis únicas y múltiples. La metodología ha sido validada con un amplio conjunto de compuestos graves y levemente hepatotóxicos. Aquí mostramos los datos de pioglitazona y troglitazona, conocidos compuestos hepatotóxicos retirados del mercado por causar fallas hepáticas. En general, se ha demostrado que el modelo de MPS hepático puede ser una herramienta útil para evaluar el DILI y su asociación con cambios en la función hepática. El modelo también se puede utilizar para evaluar cómo se comportan los nuevos compuestos en distintos subconjuntos de pacientes y cómo los perfiles de toxicidad pueden verse afectados por los estados de enfermedad hepática (por ejemplo, hepatitis viral, enfermedad del hígado graso).
Introducción
DILI sigue siendo la causa más común de insuficiencia hepática aguda en los EE.UU. y Europa y es una de las principales causas de desgaste de compuestos en el proceso de desarrollo de fármacos1. Casi todas las clases de medicamentos pueden causar hepatotoxicidad, siendo los agentes del sistema nervioso central y los antibióticos los tratamientos más comunes que causan DILI en pacientes2. La hepatotoxicidad inducida por fármacos es causada por una compleja interacción de factores genéticos, no genéticos y ambientales, que conduce a la muerte de los hepatocitos y otros tipos de células hepáticas, incluidos los colangiocitos y las células endoteliales 1,3.
Los agentes causantes de DILI se pueden clasificar de dos maneras: aquellos que causan daño hepático predecible dependiente de la dosis o aquellos que causan DILI idiosincrásico que es raro y se desarrolla independientemente de la dosis del fármaco, o la vía, o la duración de la administración, pero es responsable de hasta una sexta parte de todas las fallas hepáticas agudas en los EE.UU. sólo4. Desafortunadamente, DILI a menudo no se detecta hasta que los medicamentos han alcanzado las etapas clínicas del proceso de desarrollo del fármaco. El rango de lesión hepática inducida por fármacos (o DILIrank) consiste en más de mil medicamentos aprobados por la FDA que se dividen en cuatro clases de acuerdo con su potencial para causar DILI, y su uso en pacientes debe ser monitoreado de cerca5.
El estudio de los mecanismos de hepatotoxicidad del fármaco sigue siendo muy difícil y, por lo tanto, se han desarrollado muchos modelos preclínicos para explorar los mecanismos del DILI. Los modelos actuales in vitro e in vivo utilizados para predecir DILI en el desarrollo preclínico tienen varias limitaciones para proporcionar información sobre las interacciones complejas y multifacéticas en un cuerpo humano vivo. Las líneas celulares hepáticas cancerosas (es decir, HepG2, HepaRG) cultivadas en 2D todavía se utilizan en las primeras etapas del desarrollo de fármacos para evaluar la toxicidad de los compuestos candidatos6. Aun así, estas líneas celulares provienen de donantes individuales y muestran niveles anormales de función hepática, y no siempre presentan una alta sensibilidad para la detección de DILI 7,8. Como alternativa a las líneas celulares hepáticas cancerosas, los PHH representan mejor la fisiología del hígado humano si se cultivan adecuadamente in vitro, aunque existen varias limitaciones con su cultivo, como el corto tiempo de incubación con medicamentos, la vida relativamente corta, la pérdida de la expresión génica hepática y los cambios en las funciones metabólicas de los fármacos 9,10,11 . Los PHH se pueden cultivar en proteínas de la matriz extracelular en placas de cultivo celular 2D estándar, pero como inconveniente, la rápida disminución de su función significa que tienen baja sensibilidad (<50%) para la predicción DILI12.
Por otro lado, las pruebas en modelos animales son lentas, costosas y necesitan una traducción entre especies para extrapolar la predicción a los humanos. La mayoría de los medicamentos recientemente desarrollados no logran obtener aprobación, lo que hace que este proceso sea costoso y arriesgado5. Además, para probar nuevas modalidades específicas para humanos, los modelos animales son menos adecuados debido a la secuencia de genes o las diferencias de respuesta inmunológica en comparación con los humanos13.
En consecuencia, el interés en modelos hepáticos in vitro tridimensionales (3D) más avanzados ha crecido exponencialmente. El cultivo de PHH como estructuras esferoidales generadas por agregación gravitacional en gotas colgantes o en superficies de fijación ultra bajas representa un método de alto rendimiento para evaluar pasivos compuestos14. Los esferoides de PHH se han utilizado para evaluar DILI en un fondo enfermo (por ejemplo, esteatosis y colestasis)15. Se ha desarrollado una amplia variedad de modelos para incluir cocultivos micropatronados en placas de hepatocitos con fibroblastos estromales16, tejidos hepáticos bioimpresos en 3D 17, cultivos esferoides 3D con o sin células hepáticas no parenquimatosas15. Sin embargo, todos estos métodos todavía tienen inconvenientes, y el cultivo de PHH en un microambiente fisiológicamente más relevante podría proporcionarles niveles más altos de funcionalidad durante largos períodos de tiempo para permitir la investigación de la exposición prolongada a posibles hepatotóxicos. Además, para mejorar la relevancia traslacional de cualquier cultivo avanzado de PHH in vitro, se deben utilizar criterios de valoración funcionales clínicamente relevantes o biomarcadores de salida de toxicidad para permitir que los datos se comparen in vivo o en escenarios clínicos18.
En este estudio, evaluamos si un MPS, también conocido como modelo hepático in vitro de Organ-on-a-Chip (OOC), podría usarse para comprender los aspectos mecanicistas detallados de la toxicidad hepática. Se ha demostrado previamente que el MPS mantiene microtejidos hepáticos 3D altamente funcionales, bajo flujo, hasta por 4 semanas19. El sistema ha sido probado recientemente por la FDA y ha demostrado tener una alta reproducibilidad al realizar toxicidad de medicamentos, metabolismo y acumulación intracelular20. Además, en comparación con los esferoides y los cultivos sándwich, el sistema tuvo una función más estable y una mayor sensibilidad en la detección de la toxicidad de varios fármacos20. Hasta la fecha, el MPS se ha utilizado en una amplia gama de aplicaciones que cubren ADME21, modelado de enfermedades (VHB22, NAFLD 23,24,25) e interacciones farmacológicas 26, lo que lo hace potencialmente muy adecuado para evaluar el DILI agudo y crónico. La tecnología aquí presentada ofrece una alternativa para cerrar la brecha entre los cultivos celulares más tradicionales y los modelos animales y los ensayos clínicos en humanos, avanzando hacia la simulación de las condiciones biológicas humanas para apoyar la evaluación de la toxicidad hepática de los compuestos candidatos en las etapas preclínicas del proceso de desarrollo de fármacos.
Protocolo
Todo el trabajo se llevó a cabo en el laboratorio siguiendo estrictos procedimientos de salud y seguridad y de acuerdo con sus propias evaluaciones de riesgos de laboratorio y SOP. Todo el equipo utilizado se revisa de acuerdo con las directrices del fabricante. Los gabinetes de seguridad microbiológica (MBSC) se revisan anualmente, y el Ki-Discus (yoduro de potasio) se prueba según los estándares británicos. El protocolo sigue el Código de Prácticas y las directivas de la Autoridad de Tejidos Humanos (HTA) del Reino Unido y utiliza células humanas primarias de origen ético suministradas por proveedores que cumplen plenamente con los requisitos generales para el consentimiento informado (45 CFR §46.116 y §46.117) y las Buenas Prácticas Clínicas (GLP), (ICH E6), y los comités reguladores y éticos.
1. Preparación de medios de cultivo celular
NOTA: Prepare Seeding Advanced DMEM medium el día -1 y guárdelo a 4 °C. Prepare Maintenance Advanced DMEM medium el día 1 y guárdelo a 4 °C durante un máximo de 1 semana.
- Siembra de medio DMEM avanzado para cocultivo de PHHs y HKCs: Complemente una botella de 500 mL de medio DMEM avanzado (Tabla de materiales) con 18 mL de Cóctel A (concentración final de 3.6%) y con 25 mL de FBS (concentración final 5%).
- Mantenimiento Medio DMEM avanzado para PHHs y cocultivo HKCs: Complemente un frasco de 500 mL de medio DMEM avanzado (Tabla de materiales) con 20 mL de Cocktail B (concentración final de 4%) y 500 nM de hidrocortisona.
NOTA: La hidrocortisona se hará fresca el día de su uso, y los pasos sobre cómo preparar la solución madre y las diluciones requeridas se mencionan a continuación. - Preparación de hidrocortisona de 500 nM en Mantenimiento Medio DMEM Avanzado
- Preparación de la solución madre inicial (20 mM): Pesar 7,24 mg de hidrocortisona (tabla de materiales) en un vial de vidrio de 1 ml. Registre la cantidad exacta de hidrocortisona pesada y determine el volumen de dimetilsulfóxido (DMSO) utilizando el siguiente cálculo:
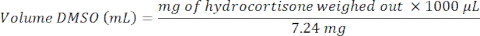
- Preparación de la solución madre de hidrocortisona de 100 μM de trabajo: Añadir 5 μL de la solución madre inicial de 20 mM a 995 μL de DMEM avanzado.
NOTA: La dilución de 25 μL de la solución de DMSO del paso 1 en agua o medios da como resultado una concentración de DMSO al 0,5%. En la solución final, la concentración de DMSO será de 0.0025%. En este caso, el volumen adicional de 5 μL da como resultado un cambio insignificante en el volumen total. - Preparación de la solución de trabajo de hidrocortisona de 500 nM en DMEM avanzado: Para preparar 1 ml de solución de hidrocortisona de 500 nM en DMEM avanzado, agregue 5 μL de la solución madre de hidrocortisona de 100 μM a 995 μL del medio DMEM avanzado de mantenimiento.
- Preparación de la solución madre inicial (20 mM): Pesar 7,24 mg de hidrocortisona (tabla de materiales) en un vial de vidrio de 1 ml. Registre la cantidad exacta de hidrocortisona pesada y determine el volumen de dimetilsulfóxido (DMSO) utilizando el siguiente cálculo:
2. Configuración y cebado de MPS (Día -1)
- Conecte el controlador a su casa de la estación de acoplamiento en una incubadora de cultivo celular y asegúrese de que se agregue desecante fresco (Tabla de materiales) al frasco de desecante ubicado en la parte posterior del controlador.
NOTA: La unidad controladora extrae la humedad de la incubadora con el tiempo y se mantiene seca con un desecante fresco. - Encienda el controlador presionando el interruptor basculante del barco ubicado detrás de él y espere 5 minutos para que el sistema se estabilice y alcance la presión. Luego verifique la pantalla para el informe neumático para asegurar: (i) La salida del depósito de presión alcanzó ~ 2000 mBar y (ii) la salida del depósito de vacío alcanzó ~ 850 mBar.
- Retire cada placa del embalaje e inspeccione visualmente cada pozo para verificar posibles defectos (andamios faltantes, grietas, etc.).
- Inserte un controlador (con una placa puesta) en la estación de acoplamiento para verificar que el controlador sea reconocido por la estación de acoplamiento y el controlador. Compruebe que la salida del depósito de presión ha disminuido en menos de 100 mBar, y la salida del depósito de vacío ha aumentado en menos de 500 mBar.
- Prepare cada pocillo agregando 500 μL de medio DMEM avanzado de siembra (precalentado a 37 ° C) al lado del reservorio.
- Seleccione el programa Prime en la pantalla del controlador (flujo ascendente durante 3 minutos a 2,5 μL/s) hasta que el fluido pase por los soportes del filtro. NOTA: 'Flujo ascendente' es un ajuste en el controlador que permite que los medios fluyan desde el depósito hacia arriba a través de los andamios de la placa LC12.
- Llene todos los pozos con 1,1 ml adicionales de medio DMEM avanzado de siembra para cubrir el canal de superficie. Todos los pozos estarán entonces en su volumen de trabajo completo de 1.6 ml.
- Coloque los controladores con placas en una incubadora de 37 °C y 5% deCO2 , conéctelos a la estación de acoplamiento y ejecute el programa Incubate .
NOTA: Todos los programas utilizados en el experimento (Prime, Incubate, Seed, Media Change) están preestablecidos en el sistema MPS. Prepare las placas en la incubadora hasta que estén listas para sembrar.
3. Siembra de células hepáticas en MPS (Día 0)
- Prevalidar todos los PHHS y HKC. Todos los lotes PHH y HKC se validan previamente internamente antes de realizar el experimento de cultivo celular (consulte Material suplementario).
- Descongele los viales de células PHH y HKC (Tabla de materiales) manteniendo los viales de forma constante en un baño de agua a 37 °C hasta que solo quede una pequeña astilla de hielo.
- Pipetear PHH directamente en un tubo de medio CHRM de recuperación de hepatocitos criopreservados (37 °C) precalentado (dos viales como máximo por tubo).
- Pipetear las células suavemente, luego use 1 ml de CHRM para lavar las células restantes del criotubo. Sea muy cuidadoso con las células al descongelar y transferir a un tubo cónico.
PRECAUCIÓN No agite los viales durante la descongelación y no canalice su contenido hacia arriba y hacia abajo. - Pipetear las células HKC suavemente desde el criotubo a 10 ml de medio Seeding Advanced DMEM helado en un tubo de centrífuga de 15 ml.
NOTA: Se pueden combinar hasta 2 viales de HKC. - Centrifugar ambos tipos de células a temperatura ambiente (RT) a 100 x g durante 10 min. Retire el sobrenadante.
- Resuspenda los PHH en medio DMEM avanzado de siembra en caliente y HKC en medio DMEM avanzado de siembra helada (para ayudar a reducir la aglutinación celular), utilizando 1 ml por vial de células agregadas al tubo y coloque las células en hielo. Use una acción de balanceo suave para resuspender las células.
PRECAUCIÓN: No resuspender los PHH por acción de pipeta, ya que puede conducir a la muerte celular. - Combine las suspensiones celulares de múltiples tubos (si corresponde, es decir, si todos los PHH son del mismo donante), pero no mezcle los tipos de células.
- Contar celdas. Registre la viabilidad (debe ser superior al 85% para ambos tipos de células, PHHs y HKCs) y el número total de células. Si la viabilidad celular cae por debajo del 85%, descongele un nuevo vial de células y vuelva a evaluar la viabilidad celular.
- Calcule la viabilidad celular utilizando la siguiente fórmula:
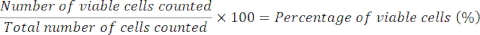
- Calcular el volumen deseado de la suspensión celular a sembrar en cada pocillo y el volumen adicional de medio DMEM avanzado de siembra necesario para llevar el volumen total de siembra a 400 μL. Número de células por pocillo: 0,4 x 10 6 PHH y 0,04 x 10 6 HKC por poclor, y densidad celular de 0,25 x 106 PHH/mL, respectivamente 0,025 x 106 HKC/ml.
- Desconecte el controlador de la estación de acoplamiento y colóquelo en el MBSC.
- Aspire el medio desde el andamio anterior hasta el punto de parada (bajando por la muesca profunda en el anillo de retención), el canal y el depósito. Dejar un "volumen muerto" de 0,2 mL en el pozo de cultivo, llegando justo por encima del andamio. Se debe tener cuidado de no quitar el medio total de la parte superior del andamio para evitar que se formen burbujas de aire.
- Agregue 400 μL de medio Seeding Advanced DMEM en la cámara del pozo, devuelva el controlador a la estación de acoplamiento en la incubadora y ejecute el programa Media Change durante 3 minutos. El programa se detendrá automáticamente después de 3 minutos.
- Una vez completado, desconecte el controlador de la estación de acoplamiento y vuelva a colocarlo en el MBSC.
- Aspire los medios desde el andamio anterior hasta el punto de parada y en el extremo del depósito de cada pozo.
- Resuspenda cuidadosamente los PHH balanceando suavemente el tubo, luego agregue el volumen requerido de la suspensión celular a cada pocillo de cultivo. Pipetea cuidadosamente la suspensión celular, asegúrate de que las células se dispersen uniformemente a través del andamio de la placa.
NOTA: Para garantizar una buena cobertura en todo el andamio, utilice un movimiento de giro lento para pipetear las células hacia abajo en el andamio. - Del mismo modo, resuspenda cuidadosamente los HKC y agregue bien las suspensiones celulares a cada cultivo.
NOTA: Utilice un movimiento de giro lento para sembrar HKC para garantizar una buena cobertura en todo el andamio. Los dos subpasos de siembra se pueden separar, o los dos tipos de células se pueden mezclar previamente a una densidad adecuada y sembrar concomitantemente. - Una vez que todos los pocillos contengan ambos tipos de células, coloque el controlador MPS en la estación de acoplamiento en la incubadora sin conectarlo físicamente y déjelo reposar durante 1 h.
- Después de 1 h, llene cada pocillo con el volumen requerido de medio DMEM avanzado de siembra adicional para alcanzar los 400 μL y ejecute el programa de semillas .
- Después de 2 minutos, el programa se detendrá automáticamente, retirará el controlador de la incubadora y agregará lentamente 1000 μL del medio DMEM avanzado de siembra al canal (más cerca del extremo del depósito que de la cámara del pozo) para lograr un volumen total de 1.4 ml (con un volumen muerto adicional de 200 μL en los canales).
- Mueva las placas a la incubadora y ejecute el resto del programa de semillas durante 8 h.
NOTA: Flow cambiará automáticamente al programa Incubar después de 8 h.
4. Cambio de medios (Día 1)
- Desconecte el controlador de la estación de acoplamiento y colóquelo en el MBSC.
- Realice el cambio de medios retirando el medio DMEM avanzado de siembra en la cámara del pozo hasta el punto de parada.
- Agregue 400 μL del medio DMEM avanzado de mantenimiento en la cámara del pozo, devuelva el controlador a la estación de acoplamiento en la incubadora y ejecute el programa Media Change durante 3 minutos. El programa se detendrá automáticamente después de 3 minutos.
- Desconecte el controlador de la estación de acoplamiento y, en el MBSC, aspire los medios de la cámara del depósito, el canal y el punto de parada por encima del andamio. En este punto, el pozo de cultivo será devuelto al volumen muerto.
- Rellene la cámara del depósito con 1,4 ml de medio DMEM avanzado de mantenimiento precalentado (37 °C) fresco.
- Devuelva el controlador a la estación de acoplamiento de la incubadora y ejecute el programa Incubate .
5. Control de calidad (QC) de microtejidos hepáticos, recolección de medios, cambio de medios y dosificación de medicamentos (Día 4)
- El día 4, realice un cambio de medios utilizando el medio DMEM avanzado de mantenimiento y las comprobaciones de control de calidad para asegurarse de que la siembra se haya realizado correctamente.
NOTA: El control de calidad es un proceso utilizado para verificar la salud de los microtejidos formados midiendo la lactato deshidrogenasa (LDH) y la urea. - Antes de ejecutar el control de calidad, prepare nuevas soluciones madre para cada compuesto a probar (ya sea en medio DMEM avanzado de mantenimiento o en medio DMEM avanzado de mantenimiento que contenga 0,1% de DMSO, dependiendo de la solubilidad de cada compuesto). Prepare las diluciones en consecuencia para producir concentraciones de prueba para cada compuesto.
- Desconecte el controlador y la placa de la estación de acoplamiento y transfiéralos a un MBSC.
- Transfiera 50 μL de medios de cada pocillo usando una pipeta a una placa de 96 pocillos para realizar un ensayo de LDH (Tabla de materiales) antes del muestreo y 25 μL para un ensayo de urea (Tabla de materiales).
NOTA: Los ensayos de LDH y urea se realizarán siguiendo las instrucciones del fabricante. - Continuar el experimento después del control de calidad si las lecturas de LDH son inferiores a 2 UA/10 6 células y la urea está por encima de 40 μg/día/106 células.
NOTA: La albúmina no se usa como control de calidad porque es un ensayo largo para ejecutar en el día y se analizará más tarde una vez que se complete el experimento a partir de las muestras retiradas el día 4. - Si algún pozo falla QC, retírelo del diseño experimental.
- Una vez que se confirme el diseño experimental, muestree los medios restantes de cada pozo, asegurándose de no perturbar el cultivo celular tocando el andamio. Conservar los medios recogidos (etiquetados como muestras previas a la dosis) a -80 °C para ensayos posteriores.
- Realice el cambio de medios en un MBSC siguiendo los pasos 4.3-4.5. Cambie los pocillos a un medio DMEM avanzado de mantenimiento con la concentración correcta del fármaco de acuerdo con el diseño experimental.
- Una vez completado, devuelva el controlador a la estación de acoplamiento en la incubadora y ejecute el programa Incubate .
6. Recolección de medios, cambio de medios y dosificación de medicamentos (Día 6)
- Prepare soluciones madre frescas para cada compuesto a probar (ya sea en medio DMEM avanzado de mantenimiento o en medio DMEM avanzado de mantenimiento que contenga 0,1% de DMSO, dependiendo de la solubilidad de cada compuesto). Prepare las diluciones en consecuencia para obtener concentraciones de prueba para cada compuesto de acuerdo con el plan de la placa.
- Desconecte el controlador y la placa de la estación de acoplamiento y transfiéralos a un MBSC.
- Recoja los medios de cada pocillo (~ 1 ml) manualmente con una pipeta asegurándose de no perturbar el cultivo celular tocando el andamio, el ensayo de LDH y urea. Almacenar el resto de los medios recolectados a -80 °C para ensayos posteriores, y etiquetarlos 48 h después de la dosis.
- Vuelva a dosificar cada pocillo con la misma concentración de fármaco que en el día 4 y de acuerdo con el plan de la placa realizando el cambio de medios siguiendo los pasos 4.3-4.5.
- Una vez completado, devuelva el controlador a la estación de acoplamiento en la incubadora y ejecute el programa Incubate .
7. Finalización del experimento (Día 8)
- Desconecte el controlador y la placa de la estación de acoplamiento y transfiéralos a un MBSC.
- Muestree los medios de cada pocillo manualmente con una pipeta, asegurándose de no perturbar el cultivo celular tocando el andamio.
- Analizar los medios retirados para LDH y urea y almacenar el resto de los medios recogidos a -80 °C para ensayos posteriores.
- Ejecución del ensayo CYP3A4-glo.
- Mida los efectos de los fármacos probados sobre la actividad del citocromo P450 CYP3A4 en PHH al final del experimento utilizando este ensayo.
- Reconstituya el reactivo de detección (para el ensayo CYP3A4, consulte la Tabla de materiales) siguiendo las instrucciones del fabricante. Si el reactivo de detección ha sido previamente reconstituido y congelado, retírelo del congelador a -20 °C y deje que se descongele a RT.
- Prepare 20 mM de stock D-luciferina estándar siguiendo las instrucciones del fabricante.
- Preparar el medio de sustrato luminogénico de trabajo con una dilución 1:1000 de Luciferin IPA en medio DMEM avanzado de mantenimiento (2 ml de medio de sustrato luminogénico por pocillo).
- Realice un cambio de medios como se describe en los pasos 4.3-4.5 con medio de sustrato luminogénico. Guardar 500 μL del medio sustrato luminogénico en un vial de vidrio de 1,5 ml (Tabla de materiales) como material de entrada.
- Devuelva el controlador a la estación de acoplamiento en la incubadora y ejecute el programa Incubate durante 1,5 h.
- Preparar la curva estándar de D-luciferina en medio de cultivo en tubos de 1,5 ml siguiendo las instrucciones del fabricante y pipetear 50 μL de cada patrón por duplicado en una placa blanca opaca de 96 pocillos (ver Tabla de materiales), utilizando medio de cultivo como blanco o 0 μM.
- Una vez transcurrido el tiempo, retire el controlador de la estación de acoplamiento y muestree el medio para el ensayo CYP3A4 siguiendo los pasos 7.4.9-7.4.13.
- Después de la incubación, transfiera 50 μL del medio de muestra de cada pocillo y material de entrada a la placa del luminómetro blanco opaco de 96 pocillos que contiene los estándares. Tenga cuidado de dejar al menos dos filas vacías en la placa opaca entre los patrones y las muestras para evitar un ligero arrastre entre los estándares superiores y las lecturas de las muestras.
- Agregue 50 μL de reactivo de detección de luciferina a cada pocillo para iniciar una reacción luminiscente.
- Incubar la placa en RT en un agitador de placas durante 20 minutos en la oscuridad para estabilizar la señal luminiscente.
- Registre la luminiscencia utilizando un luminómetro o una cámara CCD.
- Trazar la curva estándar tomando el promedio de cada punto y luego restando el promedio de los espacios en blanco. Utilice la ecuación de la línea para calcular la tasa metabólica (pmol/min/106 células) en el resto de las muestras, recordando incluir las diluciones realizadas.
- Retirar los andamios de las placas con un par de pinzas y colocarlos en una placa de 24 pocillos que contenga 500 μL de D-PBS (sin Ca++ y Mg++) en cada pocillo, teniendo cuidado de no perturbar el microtejido.
- Tome instantáneas de cada andamio con un microscopio de luz invertida con un aumento de 10x.
- Ejecución del ensayo de ATP (consulte la Tabla de materiales) siguiendo las instrucciones del fabricante:
- Descongelar el reactivo en RT.
- Lave los andamios dos veces con 500 μL de D-PBS (sin Ca++ y Mg++) para cada paso de lavado.
- Agregue 120 μL de reactivo y 120 μL de PBS a cada andamio y los mismos volúmenes a un pozo vacío (esto servirá como espacio en blanco). Coloque la placa cubierta con papel de aluminio en un agitador y agite vigorosamente (500 rpm) durante 5 minutos seguido de 30 minutos de incubación para estabilizar la señal de luminiscencia.
- Transfiera 100 μL de las muestras lisadas por duplicado a una placa de ensayo transparente de fondo plano de 96 pocillos para su medición. Asegúrese de que los pocillos en blanco no se coloquen junto a los otros pocillos de medición de alta luminiscencia.
- Registre la luminiscencia utilizando un lector de microplacas.
- Comparar la luminiscencia de las muestras con la luminiscencia de los patrones para determinar el ATP detectado por el reactivo en las muestras.
Resultados
El manuscrito describe un modelo de MPS hepático utilizado para evaluar DILI. El MPS facilita la generación de microtejidos hepáticos 3D que se mantienen altamente funcionales bajo flujo durante un máximo de 4 semanas. Los PHH/HKC se siembran en andamios recubiertos de colágeno para formar microtejidos hepáticos que se perfunden con un medio de crecimiento y, después de pasar el control de calidad, se dosifican con compuestos. Aquí, mostramos datos para troglitazona y pioglitazona, dos compuestos estructuralmente similares pero con diferentes gravedades DILI.
En el día 4, antes de la dosificación del fármaco, se evalúa un control de calidad de los microtejidos hepáticos formados y consiste en la liberación de LDH y la síntesis de urea (Figura 1A). El QC tiene como objetivo confirmar que el MPS hepático produce microtejidos hepáticos altamente consistentes y funcionales. Los datos presentados aquí se generan a partir de tres experimentos y muestran buenos niveles de reproducibilidad con baja variabilidad intra e inter-estudio. Después de un cultivo de 8 días, se evalúan múltiples métricas hepáticas y de salud (albúmina, urea, CYP3A4, ATP) y los microtejidos de control muestran altos niveles de funcionalidad hepática y reproducibilidad (Figura 1B, C). La microscopía de fase de contraste y la tinción IF de los microtejidos hepáticos (Ver Material Suplementario) muestran una alta consistencia de siembra en todos los microcanales del andamio y revelan la distribución de HKC en los microtejidos PHH (Figura 1D)
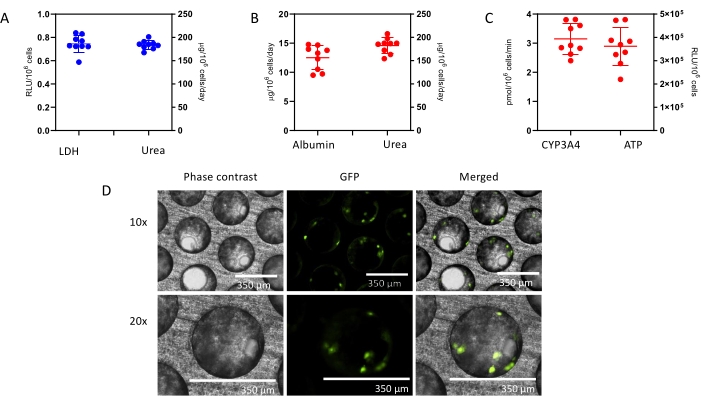
Figura 1: MPS hepático produce datos altamente reproducibles y microtejidos consistentes. (A) Métricas 3D de control de calidad de microtejidos hepáticos en el día 4 y evaluación de funcionalidad al final del estudio en el día 8 -(B) Albúmina y urea, (C) CY3A4 y ATP). Los datos se recopilan de 3 experimentos; En cada experimento, hubo 3 réplicas de control de vehículos. Los datos mostrados son Media ± DE, N = 9. (D) Microscopía de contraste de fase (10x y 20x) e IF de microtejidos hepáticos 3D generados por cocultivo de PHHs y HKCs en plataforma MPS hepática para evaluar DILI. Para visualizar los HKCs, antes de la siembra los HKCs fueron transducidos con un vector adenoviral que expresa eGFP (ver Material Suplementario). Se muestran fotomicrografías representativas. La transducción y la obtención de imágenes se realizaron como un experimento independiente para demostrar la localización celular y no se realizaron con el protocolo DILI descrito. Las células HKC se validan previamente internamente antes de su uso en cultivos celulares experimentales y deben tener bajos niveles de activación posterior al deshielo; esto se evalúa midiendo los biomarcadores IL-6 y TNF-alfa. Haga clic aquí para ver una versión más grande de esta figura.
Se sabe que la troglitazona causa DILI grave; después de su licencia para el tratamiento de la diabetes tipo 2, fue retirado por la FDA después de 3 años en el mercado debido a la frecuencia de lesión hepática asociada con su uso. Hasta la fecha, los estudios publicados en animales no pudieron predecir el potencial de la troglitazona para causar lesión hepática grave. La toxicidad de este compuesto tampoco se detectó en ensayos hepáticos 2D estándar in vitro 14.
Los microtejidos hepáticos en el MPS se dosificaron con troglitazona durante 96 h, y causó una respuesta tóxica aguda, impulsada por C max, que se detectó por liberación de ALT y LDH y una rápida reducción en la producción de albúmina y urea, a alrededor de 15 x Cmax, después de la exposición aguda a troglitazona (Figura 2A). El criterio de valoración celular (contenido de ATP) y la actividad del CYP3A4 (para evaluar la biotransformación metabólica), muestreados después de 96 h de exposición, confirmaron además la toxicidad causada por troglitazona y los valores de EC:50 fueron muy comparables a otros criterios de valoración (Figura 2B). Las imágenes de microscopía de campo claro tomadas después de un cultivo de 8 días en el MPS revelan un microtejido hepático sano, sembrado uniformemente en todo el andamio (control del vehículo) en contraste con la muerte/degradación generalizada del tejido como se ve en las réplicas tratadas con control positivo y troglitazona en las dos concentraciones superiores de prueba (Figura 2C).
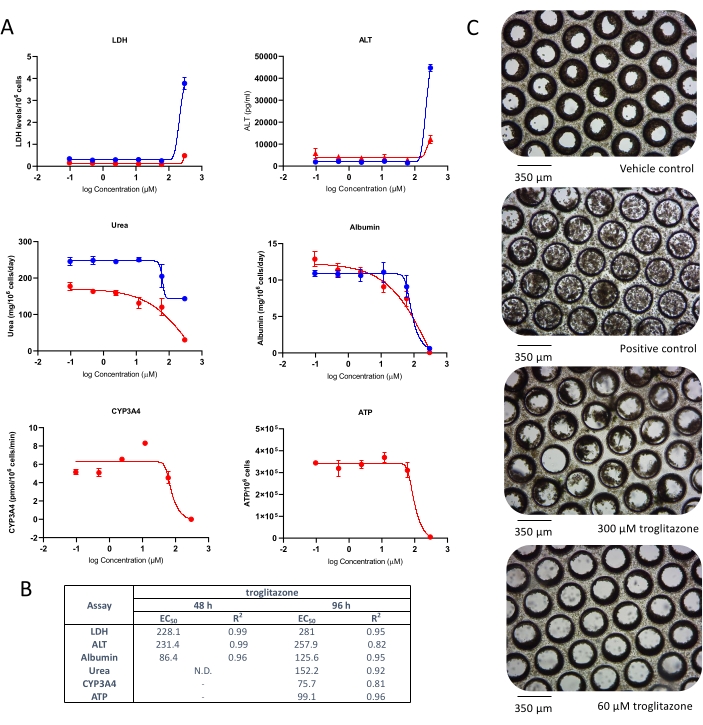
Figura 2: Determinación del riesgo DILI de troglitazona utilizando múltiples criterios de valoración hepatotóxicos. Los microtejidos hepáticos se expusieron a siete concentraciones de prueba de troglitazona durante 96 h y se compararon para (A) liberación de LDH, liberación de ALT, producción de albúmina, síntesis de urea, actividad de CYP3A4 y contenido de ATP. Líneas azules - 48 h de exposición (solo puntos finales de medios), líneas rojas - 96 h de exposición. El control positivo fue clorpromazina de 100 μM. Todos los criterios de valoración se miden a partir de los mismos cultivos de MPS hepáticos. Los datos mostrados son medias ± DE, N = 3. (B) Resumen de los números E:50 generados a partir de datos. N.D. = datos no trazables. Línea = no ensayado. (C) Microscopía representativa de campo claro de microtejidos hepáticos después de un cultivo de 8 días (aumento 10x). Haga clic aquí para ver una versión más grande de esta figura.
También se investigó la toxicidad hepática tras la exposición a pioglitazona. La pioglitazona es un compuesto conocido por ser de bajo problema DILI4 y no ejerció hepatotoxicidad en cultivos clásicos de hepatocitos primarios 2D e incluso en algunos modelos 3D más avanzados10,11. Se observaron efectos hepatotóxicos leves en ambos puntos temporales probados (Figura 3). No se detectó ninguna liberación de LDH o ALT; sin embargo, después de 48 h, se observó una leve reducción en la producción de albúmina y urea, a aprox. 25x Cmax (Figura 3A). También se observó una reducción muy pequeña en el contenido de ATP a altas concentraciones de pioglitazona, pero esto no fue significativo. Los valores EC:50 generados a partir de curvas dosis-respuesta se presentan en la figura 3B. La microscopía reveló una ligera alteración microtisular después de 96 h de exposición a pioglitazona en las dos concentraciones más altas ensayadas (Figura 3C). Los resultados demuestran la capacidad del MPS hepático para detectar la toxicidad de compuestos con preocupación DILI leve.
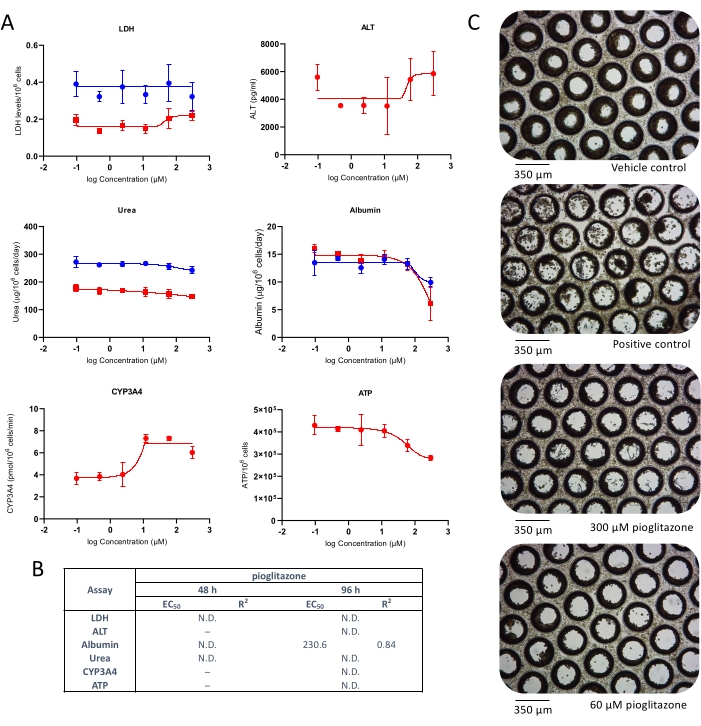
Figura 3: Determinación del riesgo DILI de pioglitazona utilizando múltiples criterios de valoración hepatotóxicos. Los microtejidos hepáticos se expusieron a siete concentraciones de prueba de pioglitazona durante 96 h y se compararon para (A) liberación de LDH, liberación de ALT, producción de albúmina, síntesis de urea, actividad de CYP3A4 y contenido de ATP. Líneas azules - 48 h de exposición (solo puntos finales de medios), líneas rojas - 96 h de exposición. El control positivo fue clorpromazina de 100 μM. Todos los criterios de valoración se miden a partir de los mismos cultivos de MPS hepáticos. Los datos mostrados son medias ± DE, N = 3. B) Resumen de los números CE:50 generados a partir de datos. N.D. = datos no trazables. Línea = no ensayado. (C) Microscopía representativa de campo claro de microtejidos hepáticos después de un cultivo de 8 días (aumento 10x). Haga clic aquí para ver una versión más grande de esta figura.
Al evaluar todos los criterios de valoración funcionales y biomarcadores de producción de toxicidad que podrían representar escenarios in vivo o clínicos (liberación de LDH, síntesis de urea, producción de albúmina, actividad de CYP3A4, contenido de ATP, liberación de ALT) y corroborar los datos generados para ambos compuestos probados dosificados en un rango de dosis de siete puntos durante 48 h y 96 h, se ha generado un mapa de calor para obtener una "firma de hepatotoxicidad", ayudar a identificar compuestos con un nivel variable de preocupación DILI (Figura 4).
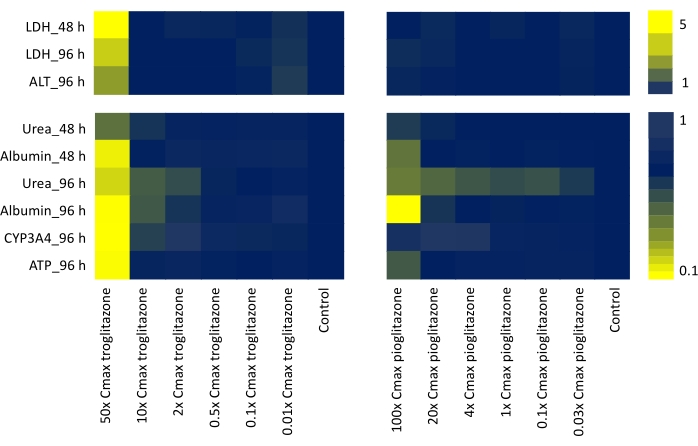
Figura 4: Determinación de la "firma de toxicidad" con MPS hepático. Mapa de calor que muestra troglitazona y pioglitazona de seis criterios de valoración funcionales específicos del hígado (liberación de LDH, síntesis de urea, producción de albúmina, liberación de ALT, actividad de CYP3A4 y contenido de ATP) después de una exposición de 48 h y 96 h a un rango de dosis de siete puntos. Cada valor se genera como Media, N = 3, y se normaliza para controlar las muestras. Los valores de las barras de color representan un aumento de pliegue sobre los controles de línea base. Haga clic aquí para ver una versión más grande de esta figura.
Material suplementario: Imágenes de microscopio fluorescente de microtejidos y evaluación previa de calificación de células. Haga clic aquí para descargar este archivo.
Discusión
Los MPS están diseñados para recapitular unidades funcionales de órganos humanos in vitro y han sido desarrollados para abordar las limitaciones de los modelos convencionales de cultivo celular 3D27. El hígado es uno de los órganos más modelados que utilizan MPS, y se ha desarrollado una amplia variedad de sistemas. El hígado humano es responsable del metabolismo de los fármacos y de la generación de metabolitos tóxicos de los fármacos, y su función es un elemento clave para modelar el desarrollo de fármacos, incluyendo la evaluación de la responsabilidad DILI de los compuestos28. Aquí hemos introducido un nuevo método para evaluar DILI utilizando un MPS hepático; el protocolo permite buscar conocimientos mecanicistas para cada compuesto ensayado para determinar cómo puede causar DILI, además de ser un ensayo altamente sensible y robusto. Los microtejidos hepáticos se forman en las placas MPS, que son un cocultivo de PHH y HKCs y son altamente funcionales con altos niveles de producción de albúmina y urea, así como alta actividad de CYP3A4 en comparación con los modelos hepáticos in vitro estándar20.
Aunque el modelo DILI descrito aquí puede servir como una herramienta útil en etapas posteriores de las pruebas preclínicas en el proceso de desarrollo de fármacos, también tiene varias limitaciones. Como la mayoría de MPS actualmente disponibles en el mercado, es una plataforma de bajo rendimiento y, por lo tanto, más difícil de usar para actividades de detección de drogas a gran escala. Al consistir en microtejidos formados por el cocultivo de PHH y HKC, el modelo DILI tampoco puede capturar completamente la complejidad del hígado humano, y una mayor optimización mediante la incorporación de diferentes tipos de células (por ejemplo, células inmunes) sería beneficiosa para agregar valor al modelo existente. Este MPS de un solo órgano también podría combinarse con otras plataformas de órganos que pueden compartir un medio común y permitir la diafonía de órganos a nivel celular o endocrino, y que pueden ayudar a comprender mejor los conocimientos mecanicistas de la toxicidad que no se limitan solo al hígado mismo. Además, como cualquier tecnología relativamente nueva, podría considerarse costosa y, por lo tanto, de accesibilidad limitada.
MPS es una plataforma utilizada para desarrollar modelos organotípicos de tejidos humanos individuales o múltiples. El sistema está compuesto por un controlador, un cable umbilical y un controlador MPS en el que se inserta la placa (Figura 5A). Cada placa MPS hepática tiene 12 pocillos abiertos independientes para cultivar células hepáticas primarias en 3D en andamios diseñados. En resumen, el sistema se verifica con control de calidad, y las placas se impriman en el día -1, los PHH y HKC se siembran en las placas en el día cero (Figura 5B, ver 1). Las microbombas integradas facilitan la circulación de los medios de cultivo celular a través de los andamios para facilitar la formación de microtejidos 3D (Figura 5B, ver 2). Los microtejidos formados se QC en el día 4, se dosifican con diferentes concentraciones de cada compuesto cada 48 h durante 4 días y se analizan para biomarcadores de punto final en el día 8 (Figura 5C). La línea de tiempo experimental del ensayo DILI en la placa MPS se representa en la Figura 5D.
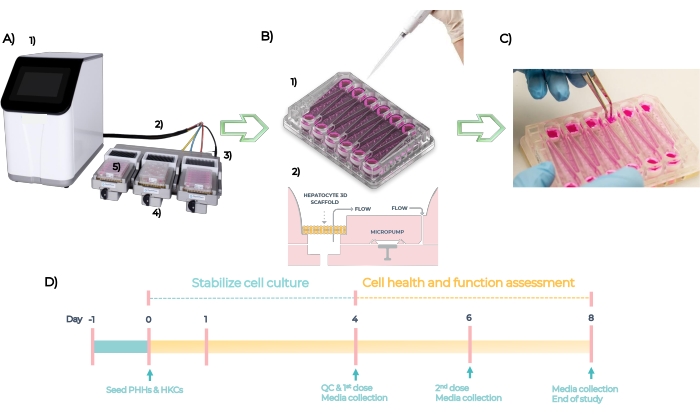
Figura 5: El sistema microfisiológico y la línea de tiempo experimental de un ensayo DILI estándar. (A) El sistema microfisiológico con sus componentes: controlador (1), cable umbilical (2), estación de acoplamiento (3), controlador MPS (4) y placa LC12 (5). (B) La siembra de PHH y HKC en la placa LC12 en el Día 1 (1) y las microbombas integradas facilitan la circulación de medios de cultivo celular con caudales sintonizables a través de los microtejidos 3D sembrados en los andamios (2). (C) Derribar los andamios al final del estudio. (D) Cronología experimental. Haga clic aquí para ver una versión más grande de esta figura.
Al realizar el protocolo, es importante que se realice una verificación de control de calidad robusta del sistema antes de comenzar, verificando que el sistema funcione neumáticamente correctamente y que las placas consumibles se inspeccionen visualmente y se imprimen de manera eficiente para garantizar una funcionalidad uniforme en todos los pozos. Tener células humanas primarias de alta calidad es esencial para este protocolo, ya que se sabe que los hepatocitos se adhieren constantemente en experimentos de cultivo celular y forman interacciones 3D. La descongelación de estas células también es un paso crítico, ya que los hepatocitos primarios no deben resuspenderse mediante la acción del pipeteo, ya que esto puede conducir rápidamente a la muerte celular. Tener una viabilidad celular superior al 85% es fundamental para una siembra exitosa, ya que grandes cantidades de desechos celulares interferirán con la formación de microtejidos 3D. El control de calidad de los microtejidos hepáticos formados en el día 4 también es importante, y el usuario debe asegurarse de que se midan los niveles aceptables de LDH y urea, ya que los parámetros fuera de rango pueden ser indicativos de la formación de tejido de mala calidad y permitir una resolución directa de problemas. Finalmente, la hidrocortisona utilizada en los medios de cultivo celular debe prepararse fresca el día de su uso para evitar cualquier degradación no deseada que pueda afectar la funcionalidad del cultivo celular, ya que es necesaria para mantener la funcionalidad metabólica de los hepatocitos.
A pesar de tener una complejidad significativa, el MPS hepático no contiene todos los tipos de células del hígado humano. Es posible agregar más tipos de células al modelo24,29 para aumentar la relevancia fisiológica, pero estas solo deben agregarse con una justificación clara para el contexto de uso. Para el estudio de DILI PHH son el tipo de célula clave, y la incorporación de HKCs en este modelo permite determinar algunas respuestas inmunológicas. También debe tenerse en cuenta que los PHH aislados de hígados humanos y los PHH criopreservados disponibles comercialmente tienden a demostrar algunas variaciones de un lote a otro. Hemos demostrado aquí que este protocolo produce resultados reproducibles cuando se utiliza con preparaciones de células de alta calidad. Sin embargo, se esperaría alguna variación de lote-lote, y esto podría superarse aún más mediante el uso de lotes agrupados de donantes múltiples. Estas limitaciones podrían ser superadas mediante el uso de células similares a los hepatocitos diferenciadas de iPSC que recapitulan muchas propiedades funcionales de los PHH y que han sido utilizadas en el proceso de desarrollo de fármacos30. Los HKC también muestran mucha variabilidad y un alto nivel de activación al descongelarse; por lo tanto, los donantes de HKC se validan previamente internamente antes de su uso en cultivo celular experimental (cocultivo con PHH validados) y deben tener bajos niveles de activación posterior al deshielo; esto se evalúa midiendo los biomarcadores IL-6 y TNF-alfa (ver Material Suplementario).
Los datos presentados aquí confirman que el ensayo puede detectar DILI con precisión, ayudando a identificar hepatotóxicos que podrían no ser detectados por 2D10,11 e incluso algunos modelos 3D. Los datos generados a partir de MPS todavía no son utilizados como estándar por la industria farmacéutica para presentaciones regulatorias o fines de detección de medicamentos debido a la falta de estandarización y armonización de procesos, incluida la reproducibilidad entre sitios20. Los datos y los enfoques experimentales demostrados aquí abordan esto, mostrando que el modelo hepático se puede usar de forma rutinaria y robusta en las pantallas DILI para predecir con precisión la responsabilidad de los nuevos compuestos.
Al medir una serie de criterios de valoración para producir una "firma de hepatotoxicidad", ayudando a identificar compuestos con diferentes niveles de preocupación DILI (incluidos compuestos no detectables por otros métodos in vitro) y sus mecanismos de toxicidad revelados. Esta tecnología puede cerrar la brecha entre el cultivo celular tradicional y los modelos animales por un lado y los ensayos clínicos en humanos, avanzando hacia la simulación de las condiciones biológicas humanas para la evaluación preclínica de la toxicidad hepática como parte del proceso de desarrollo de fármacos.
Divulgaciones
Todos los autores son empleados de CN Bio Innovations Limited.
Agradecimientos
CN Bio Innovations Ltd. financió este estudio.
Materiales
| Name | Company | Catalog Number | Comments |
| 24 well cell culture cluster plates flat bottom | Corning | 3524 | |
| 96 well clear assay plates, flat bottom clear plastic | Greiner | 655101 | |
| 96 well plates black flat bottom | Corning | 3915 | |
| 96 Well White/Clear Bottom Plate, TC Surface | ThermoScientific | 165306 | |
| Advanced DMEM (1x) | Gibco | 12491015 | Cell culture media. |
| AssayMax Albumin ELISA Kit | AssayPro | EA3201-1 | Dilution 1:250. Time point Day 4, 6, and 8. |
| Cell Maintenance Cocktail B, (Primary Hepatocyte Maintenance Supplements) | Gibco | CM4000 | |
| CellTiter-Glo 3D Cell Viability Assay | Promega | G9682 | Dilution 1:1. Time point Day 8. |
| Chlorpromazine HCl | Sigma Aldrich | C8138 | |
| Chromacol blue lids, 9 mm Autosampler Vial Screw Thread Caps | ThermoScientific | 9-SCK(B)-ST1 | glass vial |
| Chromacol vials, 9 mm Clear Glass Screw Thread Vials | ThermoScientific | 2-SVW | |
| Class 2 Microbiological Safety Cabinets - Trimat2 1500 exhaust | Contained Air Solutions | ||
| Conical tubes 50 mL | Greiner | 227261 | |
| Cryopreserved Hepatocyte Recovery Medium (CHRM) | ThermoFisher Scientific | Gibco CM7000 | |
| Cryopreserved primary human hepatocytes | BioIVT Europe | Lot. RAS | |
| CytoTox 96 Cytotoxicty (LDH) Assay Kit | Promega | G1781 | Dilution - none. Time point Day 4, 6 and 8 |
| >Data analysis model used to generate the graph and EC:50 curves was nonlinear regression (curve fit) asymmetric sigmoidal, 5PL, where X is log(concentration | GraphPad Prism 9 | ||
| Disposable PES Filter Units 500mL | Fisher Scientific | 15913307 | |
| Disposable Pipette Basins 50ml | Fisher Scientific | 12369175 | |
| DMSO (Dimethyl sulfoxide) | Sigma-Aldrich | Sigma D2650 | |
| Dulbeco’s Phosphate Buffered Saline without Ca2+ and Mg2+ (D-PBS) | ThermoFisher Scientific | 14190-144 | |
| Easy Reader Conical Polypropylene Centrifuge Tubes 15 mL | Fisher Scientific | 11889640 | |
| Foetal bovine serum | Gibco | 10500064 | |
| Human ALT ELISA Kit | Abcam | ab 234578 | Dilution 1:5. Time point Day 6 and 8. |
| Human Cryopreserved Kupffer Cells | Lonza Europe | Lot. 190088KC | |
| hydrocortisone | Merck | H0888-1G | |
| Incubators models: New Brunswick Galaxy 170 S, New Brunswick Galaxy 170 R and CellXpert® C170. | Eppendorf | All serviced yearly; paperwork available upon request. | |
| Inverted Microscope | Leica DMIL LED | ||
| MPS know as Organ-on-a-Chip (OOC) | CN Bio Innovations Ltd. | ||
| MPS LC-12 plate | CN Bio Innovations Ltd. | ||
| Neubauer Improved C-Chip Disposable Haemocytometer (2 channel) | Cambridge Bioscience | DHC-N01-50 | |
| P450-Glo CYP3A4 Assay and Screening System | Promega | V9002 | Dilution - none. Time point Day 8 |
| PhysioMimix MPS platform | CN Bio Innovations Ltd. | ||
| Pioglitazone | MedChemExpress Tocris | HY-13956/CS-1700 | |
| Quantichrom Urea Assay Kit – Bioassay systems | Bioassay Systems | DY970-05 | Dilution 1:2 if initial reading is too high. Time point Day 4, 6 and 8. |
| Silica gel | Sigma-Aldrich | S7625 | |
| Software used to analyse and generate all the graphs was | GraphPad Prism 9 | ||
| Stripettes 10 mL | Fisher Scientific | 11839660 | |
| Stripettes 25 mL | Fisher Scientific | 11839181 | |
| Thawing plate Cocktail A, (Primary Hepatocyte Thawing and Plating Supplements) | Gibco | CM3000 | |
| Troglitazone | MedChemExpress Tocris | 97322-87-7 | |
| Trypan Blue Solution, 0.4% | Gibco | 15250061 | |
| Tubes 1.5 mL | Greiner | 616201 | |
| Weighing balance - model PA214C and AV213C | Ohaus Corp |
Referencias
- Lisi, D. M. Drug-induced liver injury: An overview. US Pharmacist. 41 (12), 30-34 (2016).
- Kuna, L., et al. Models of drug induced liver injury (DILI)-current issues and future perspectives. Current Drug Metabolism. 19 (10), 830-838 (2018).
- Katarey, D., Verma, S. Drug-induced liver injury. Clinical Medicine. 16 (6), 104-109 (2016).
- Kullak-Ublick, G. A., et al. Drug-induced liver injury: recent advances in diagnosis and risk assessment Recent advances in clinical practice. Gut. 66, 1154-1164 (2017).
- Dirven, H., et al. Performance of pre-clinical models in predicting drug-induced liver injury in humans: a systematic review. Scientific Reports. 11 (1), 6403 (2021).
- Donato, M. T., Lahoz, A., Castell, J. V., Gomez-Lechon, M. J. Cell lines: a tool for in vitro drug metabolism studies. Current Drug Metabolism. 9 (1), 1-11 (2008).
- Wilkening, S., Stahl, F., Bader, A. Comparison of primary human hepatocytes and hepatoma cell line HepG2 with regard to their biotransformation properties. Drug Metabolism and Disposition. 31 (8), 1035-1042 (2003).
- Gerets, H. H. J., et al. Characterization of primary human hepatocytes, HepG2 cells, and HepaRG cells at the mRNA level and CYP activity in response to inducers and their predictivity for the detection of human hepatotoxins. Cell Biology and Toxicology. 28 (2), 69-87 (2012).
- Grainger, C. I., Greenwell, L. L., Lockley, D. J., Martin, G. P., Forbes, B. Culture of Calu-3 cells at the air interface provides a representative model of the airway epithelial barrier. Pharmaceutical Research. 23 (7), 1482-1490 (2006).
- Li, F., Cao, L., Parikh, S., Zuo, R. Three-dimensional spheroids with primary human liver cells and differential roles of kupffer cells in drug-induced liver injury. Journal of Pharmaceutical Sciences. 109 (6), 1912-1923 (2020).
- Proctor, W. R., et al. Utility of spherical human liver microtissues for prediction of clinical drug-induced liver injury. Archives of Toxicology. 91 (8), 2849-2863 (2017).
- Lin, C., Khetani, S. R. Advances in engineered liver models for investigating drug-induced liver injury. BioMed Research International. 2016, 1829148 (2016).
- Olson, H., et al. Concordance of the toxicity of pharmaceuticals in humans and in animals. Regulatory Toxicology and Pharmacology. 32 (1), 56-67 (2000).
- Bell, C. C., et al. Comparison of hepatic 2D sandwich cultures and 3D spheroids for long-term toxicity applications: A multicenter study. Toxicological Sciences. 162 (2), 655-666 (2018).
- Bell, C. C., et al. Characterization of primary human hepatocyte spheroids as a model system for drug-induced liver injury, liver function and disease. Scientific Reports. 6, 25187 (2016).
- Khetani, S. R., et al. Use of micropatterned co-cultures to detect compounds that cause drug-induced liver injury in humans. Toxicological Sciences. 132 (1), 107-117 (2013).
- Ma, X., et al. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting. Proceedings of the National Academy of Sciences of the united States of America. 113 (8), 2206-2211 (2016).
- Dieterle, P. Y. M., Dieterle, F. Tissue-specific, non-invasive toxicity biomarkers: translation from pre-clinical safety assessment to clinical safety monitoring. Expert Opinion on Drug Metabolism & Toxicology. 5 (9), 1023-1038 (2009).
- Rowe, C., et al. Perfused human hepatocyte microtissues identify reactive metabolite-forming and mitochondria-perturbing hepatotoxins. Toxicology in Vitro. 46, 29-38 (2018).
- Rubiano, A., et al. Characterizing the reproducibility in using a liver microphysiological system for assaying drug toxicity, metabolism, and accumulation. Clinical and Translational Science. 14 (3), 1049-1061 (2021).
- Tsamandouras, N., Kostrzewski, T., Stokes, C. L., Griffith, L. G., Hughes, D. J., Cirit, M. Quantitative assessment of population variability in hepatic drug metabolism using a perfused three-dimensional human liver microphysiological system. Journal of Pharmacology and Experimental Therapeutics. 360 (1), 95-105 (2017).
- Ortega-Prieto, A. M., et al. 3D microfluidic liver cultures as a physiological pre-clinical tool for hepatitis B virus infection. Nature Communications. 9 (1), 682 (2018).
- Kostrzewski, T., et al. Three-dimensional perfused human in vitro model of non-alcoholic fatty liver disease. World Journal of Gastroenterology. 23 (2), 204-215 (2017).
- Kostrzewski, T., et al. A microphysiological system for studying nonalcoholic steatohepatitis. Hepatology Communications. 4 (1), 77-91 (2020).
- Vacca, M., et al. Bone morphogenetic protein 8B promotes the progression of non-alcoholic steatohepatitis. Nature Metabolism. 2 (6), 514-531 (2020).
- Long, T. J., et al. Modeling therapeutic antibody-small molecule drug-drug interactions using a three-dimensional perfusable human liver co-culture platforms. Drug Metabolism and Disposition. 44, 1940-1948 (2016).
- Bai, J., Wang, C. Organoids and microphysiological systems: New tools for ophthalmic drug discovery. Frontiers in Pharmacology. 11, 407 (2020).
- Ribeiro, A. J. S., Yang, X., Patel, V., Madabushi, R., Strauss, D. G. Liver microphysiological systems for predicting and evaluating drug effects. Clinical Pharmacology & Therapeutics. 106 (1), 139-147 (2019).
- Clark, A. M., et al. A microphysiological system model of therapy for liver micrometastases hhs public access. Experimental Biology and Medicine (Maywood). 239 (9), 1170-1179 (2014).
- Qosa, H., Ribeiro, A. J. S., Hartman, N. R., Volpe, D. A. Characterization of a commercially available line of iPSC hepatocytes as models of hepatocyte function and toxicity for regulatory purposes. Journal of Pharmacological and Toxicological Methods. 110, 107083 (2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados