Method Article
测量 秀丽隐杆线虫 对乙酰胆碱受体激动剂左旋咪唑的敏感性
摘要
本方案描述了一种测定以确定对左旋咪唑的反应,左旋咪唑是一类 秀丽隐杆线虫乙酰 胆碱受体的药理激动剂。在这种液体左旋咪唑游泳测定中,研究人员目视观察和定量在24孔板中培养的动物的时间依赖性麻痹。
摘要
在神经肌肉接头(NMJ)处,兴奋性神经递质乙酰胆碱(ACh)与突触后受体的结合导致肌肉收缩。与脊椎动物骨骼肌一样,运动需要模型生物 秀丽隐杆线虫 的体壁肌肉中的胆碱能信号传导。暴露于左旋咪唑,一种体壁肌肉上一类ACh受体的药理激动剂,导致野生型动物的时间依赖性麻痹。对左旋咪唑的敏感性改变提示 NMJ 信号传导或肌肉功能存在缺陷。这里,提出了在24孔板中生长的 秀丽隐杆线虫 上进行液体左旋咪唑测定的方案。动物在液体中剧烈游泳,可以在一小时内评估和定量数百种蠕虫的左旋咪唑诱导的麻痹,而无需进行物理操作。该程序可用于改变对左旋咪唑敏感性的野生型和突变体,以证明NMJ信号改变的功能后果。
引言
突触后乙酰胆碱受体(AChR)在骨骼肌上的激活导致电信号,导致肌肉收缩。神经肌肉功能的破坏导致人类肌无力综合征和肌肉萎缩症1,2,3,4。线虫 秀丽隐杆线虫 已被广泛用于了解进化保守的基本生物学过程和疾病机制。脊椎动物骨骼肌和 秀丽隐杆线虫 体壁肌肉在运动控制5中在功能上是等效的。这里提出了一个简单的测定方法,可用于比较野生 型秀丽隐杆线虫 与改变神经肌肉信号传导或肌肉功能的突变体。
分别从胆碱能和GABA能运动神经元接收到的兴奋性和抑制性输入导致秀丽隐杆线虫身体一侧的肌肉收缩,而另一侧的肌肉放松,从而实现协调运动6。左旋咪唑是一种用于治疗寄生性线虫感染的驱虫剂,与体壁肌肉上的一类AChr结合并组成性激活,导致时间依赖性麻痹7。因此,改变对左旋咪唑的敏感性可用于识别秀丽隐杆线虫在兴奋性和抑制性信号传导7,8,9,10,11,12,13,14,15的平衡中存在缺陷。例如,左旋咪唑敏感的AChR(L-AChR)亚基的突变,如UNC-63,以及长杆线虫同源物Cubilin,LEV-10,这是突触处L-AChR聚类所必需的,影响兴奋性信号传导并导致左旋咪唑抗性7,8。GABAA受体UNC-49的突变会降低抑制性信号传导并导致对左旋咪唑12的超敏反应。
传统上,对左旋咪唑的超敏反应或耐药性的评估方法是将动物转移到含有左旋咪唑的琼脂平板上,然后定期刺激蠕虫以确定瘫痪发生的时间点13,14,15。我们开发了一种液体左旋咪唑游泳测定法,无需对动物进行物理操作,并允许在短短1小时内筛选数百只动物。在这里,描述了该测定法与野生型,unc-63(x26),lev-10(x17)和unc-49(e407)动物的使用。然而,该协议也可以在暴露于RNAi的秀丽隐杆线虫上进行,就像验证在全基因组RNAi筛选中鉴定的左旋酰胺敏感性改变11所做的那样。
对于该药理学测定,蠕虫在24孔板中生长至成年期,向每个孔中加入M9缓冲液中的0.4mM左旋咪唑,并且每5分钟记录一次移动动物的数量,持续1小时。随着时间的推移,目视观察左旋咪唑诱导的麻痹,并在测定完成后对数据进行定量。对突变体以及野生 秀丽隐杆线虫 的评估允许学生首先对潜在的表型效应进行预测,然后进行实验来测试他们的假设。总之,这种简单,廉价的液体左旋咪唑测定是证明特定基因丢失对NMJ功能影响的理想方法。
研究方案
1. 左旋咪唑测定用平板的制备
- 通过将3g NaCl,2.5g肽胨和17g琼脂与1L去离子(DI)水在带有搅拌棒的烧瓶中混合来制备线虫生长培养基(NGM)培养基。
- 高压灭菌后,将培养基放在设置为70°C的热板上,并以中等速度搅拌1小时。
- 向培养基中滴加 1 mL 5 mg/mL 胆固醇以防止沉淀,加入 1 mL 1 mCl2、1 mL 1 mL 1 M MgSO4 和 25 mL 1 M pH 6.0 磷酸钾缓冲液。
- 将2mLNG培养基转移到带有无菌血清学移液管的24孔板的每个孔中(图1)。
- 让板在台面上干燥2天,然后再接种细菌。为了长期储存,将它们放在4°C。
- 在溶生肉汤(LB)板上划出OP50 大肠杆菌 ,并在37°C下生长过夜。
- 将单个OP50菌落放入B-肉汤中(10克胰蛋白胨和5克NaCl在1L DI H2O中),并将培养物置于37°C振荡过夜。
- 使用无菌移液管,将30μLOP50悬浮液滴到每个孔中间的琼脂上(图1)。
注意:确保不要损坏琼脂表面,因为这会导致蠕虫挖洞。 - 让板在室温下放置至少2天,以允许细菌草坪形成。
注意:如果中心孔中的细菌在2天后不干燥,请将板在罩中打开20分钟(图1)。应在测定前1-2周将板倒入并用细菌接种。
2. 同步秀丽隐杆线虫 (第1天)
- 在6厘米的平板上将野生型,unc-63(x26),lev-10(x17)和 unc-49(e407)秀丽隐杆线虫 生长至成年期,每个菌株至少制备8个板。确认盘子上有许多非饥饿的重力成虫。
注意:这是所需数量的两倍;然而,重要的是要有备用板,以防第一批鸡蛋在漂白过程中被破坏。 - 通过在750毫升DI水中搅拌溶解59.6克Na2HPO4 (二元),29.9克KH2PO4(单碱性),12.8克NaCl和2.5克MgSO4 ,制成10x M9缓冲液。溶解后,将体积调至1 L并过滤灭菌。稀释1:10并高压灭菌以制成1x M9缓冲液。
注意:1x M9缓冲液可以提前几周或几个月制作。 - 在同步当天在引擎盖下准备漂白溶液。在 50 mL 锥形管中混合 10 mL 漂白剂(材料表)、2.5 mL 10 N NaOH 和 37.5 mL 去离子水。在使用漂白溶液时,请戴上护目镜,手套和实验室外套。
- 使用塑料转移移液管,用1x M9缓冲液从至少四个板中洗涤重力成虫,并将其转移到15 mL锥形管中。
- 在室温下以716× g 旋转1分钟,然后使用转移移液器除去上清液。
- 加入10毫升漂白溶液。倒置或轻轻摇动管约4分钟,直到大多数(但不是全部)蠕虫胴体溶解(图1)。
注意:注意不要过度漂白蠕虫,因为这会破坏卵。某些突变可能会增加卵子分离的难度。 - 以716 x g 旋转1分钟。
- 一次倒出漂白剂溶液;只要此时管子不摇晃,卵就会粘在管子的一侧。
- 加入 15 mL 1x M9 缓冲液并转化。以716 x g 旋转1分钟,并以一个平滑的运动倒出M9缓冲液。
- 使用1x M9缓冲液总共进行三次洗涤,如步骤2.9中所述。
- 最终洗涤后,加入10mL新鲜1x M9,并在15°C下放在旋转器上过夜,以分离出饥饿的第一幼虫(L1)阶段动物的同步种群。
注意:在放在旋转器上之前,请检查以确保M9缓冲液中有鸡蛋。如果没有,请用备用板重复准备,漂白时间更短。
3. 电镀同步秀丽隐杆线虫 (第2天)
- 打印出24孔板图并将菌株分配到随机位置。每个菌株应在24孔板中表示至少六次。
- 漂白剂制备后约24小时,在室温下在M9缓冲液中以716× g 离心下孵化饥饿的L1蠕虫1分钟。
- 用塑料转移移液器除去约9 mL的M9缓冲液,然后在剩余的M9缓冲液中轻轻混合饥饿的第一个幼虫期蠕虫(L1s)。
- 立即将M9缓冲液中的3μL蠕虫移液到显微镜载玻片上并确定L1的数量;所需数量为3μL中的20-30 L1s,如果蠕虫浓度太低,请向下旋转并除去M9,如果浓度过高,则加入M9。
注意:检查每3μL至少2x的蠕虫数量,每次倒置管。 - 根据预制的板图(步骤3.1; 图 1)。
注意:经常用M9中的L1s反转管子,以保持蠕虫的均匀分布,因为它们会沉降到底部。如果不这样做,一些井的蠕虫会太少,而另一些井的蠕虫会太多。此外,不要用移液器尖端刺穿琼脂,因为这会导致动物挖洞。 - 让蠕虫在20°C下生长到成年期3天。
注意:使用不同的生长温度和某些突变会影响成熟速度,因此一定要考虑 秀丽隐杆线虫的 生命周期。
4. 进行左旋咪唑测定(第5天)
- 打印一个空白数据表,该数据表将用于记录每5分钟在每个孔中移动的蠕虫数量,持续1小时。
注意:学生将能够每5分钟最多数12口孔中的蠕虫。在第一个小时测定前12个孔,在随后的一小时内测定底部的12个孔。 - 检查24孔板中的蠕虫。使用标记,在任何有污染,饥饿或有太多蠕虫的孔(>40)的板盖上做一个"X",这将使计数变得困难。
- 通过将200μL100mM左旋咪唑储备液加入50mL的1x M9来制作0.4mM左旋咪唑溶液。通过将240.76mg盐酸左旋咪唑溶解在10mL H 2 O中并将其储存在-20°C来制备100mM左旋咪唑储备液。
注意:左旋咪唑必须在M9中稀释;在H2O中稀释会加速瘫痪。学生应戴手套。摄入高浓度的左旋咪唑是有毒的。 - 启动计时器,然后使用转移移液管,将1mL 0.4mM左旋咪唑加入前两个孔中,使动物自由游泳。继续向相邻孔中加入左旋咪唑,根据待测定孔的数量错开时间。
注意:例如,如果测定10孔,将按以下方式加入左旋咪唑:时间0的孔1和2,1分钟后的孔3和4,2分钟后的孔5和6,3分钟后孔7和8,以及4分钟后的9和10。 - 在5分钟时,从第一口孔开始手动仅计算每个孔中移动蠕虫的数量,并将该数字记录在数据表上(图1)。可以使用计数器,但不需要计数器来准确确定移动蠕虫的数量。
注意:学生需要密切关注计时器,因为在许多蠕虫瘫痪之前,他们有时会在早期时间点落后。可以调整时间点的数量,或者如果需要,可以在每个时间点检测更少的孔。 - 继续每5分钟计算每孔中移动蠕虫的数量,持续1小时。
注意:浸入M9诱导在这个1小时测定过程中不断游泳运动,这消除了刺激蠕虫以评估瘫痪的需要(图2A)。暴露于0.4 mM左旋咪唑溶液引起时间依赖性麻痹,如停止游泳所观察到的那样;瘫痪的蠕虫无法恢复。 - 重复步骤 4.4.-4.6。对于板中其余的井。
- 在测定结束时,或在时间允许的情况下,记录每个孔中蠕虫的总数。
5. 数据分析
- 获取板图(步骤3.1)并记录对应于每个孔的应变。
注意:由于收集的数据量很大,对数据的后续分析和讨论至少需要几个小时。 - 将数据输入电子表格,从每个孔中的蠕虫总数开始,并按基因型进行组织。
- 结合来自油井的数据,确定每个菌株在每个时间点移动的蠕虫数量。
- 使用这些数据在统计软件(材料表)中创建"生存曲线",以直观地显示人群的时间依赖性瘫痪(图2B)。
- 制作一个数据表,使左侧列指示时间,后续列包含每个菌株的数据。对于在前5分钟内瘫痪的每种动物,创建一排并输入"1"5分钟。对每个时间点重复此操作。对于在测定结束时不瘫痪的所有动物,输入"0"60分钟。
- 使用统计软件(材料表)中的对数秩(Mantel-Cox)检验进行成对比较,以确定两个不同菌株之间是否存在统计显著性差异。
- 对于附加/替代分析,而不是执行步骤 5.3。和步骤5.4.,确定每个时间点在每个孔中移动的动物的百分比。绘制使用电子表格程序或统计软件测定的所有菌株在每个时间点的标准误差的平均值(图2C)。
结果
通过ACHR和GABA受体发出信号允许秀丽隐杆线虫身体一侧的肌肉收缩,而另一侧的肌肉放松,从而实现协调的运动6,16。左旋咪唑与离子型L-AChR的结合引起收缩,导致野生型动物的时间依赖性瘫痪。在这里,我们评估了野生型,unc-63 L-AChR突变体,lev-10 L-AChR簇突变体和unc-49 GABAA受体突变体秀丽隐杆线虫对左旋咪唑的敏感性。L-AChR亚基的突变,以及将L-AChR运输到肌肉质膜所需的基因,突触后L-AChR的聚集以及下游的Ca2 +信号传导,导致对左旋酰胺索诱导的麻痹的抵抗力7,8,9,10,11,16,17,如在unc-63和lev-10突变体中观察到的那样(图2B,C)。由于胆碱能和GABA能信号传导的适当平衡被破坏,GABA门控离子通道UNC-49的丢失引起左旋咪唑超敏反应(图2B,C)。当该测定最近由本科生在先进的遗传学实验室进行时,100%的学生观察到左旋咪唑对unc-63和lev-10突变体的耐药性,而88%的学生观察到左旋咪唑对unc-49突变体的超敏反应。使用液体左旋咪唑游泳测定收集的这些数据与传统的基于平板的左旋咪唑测定7,8,11,12,13中观察到的表型一致。
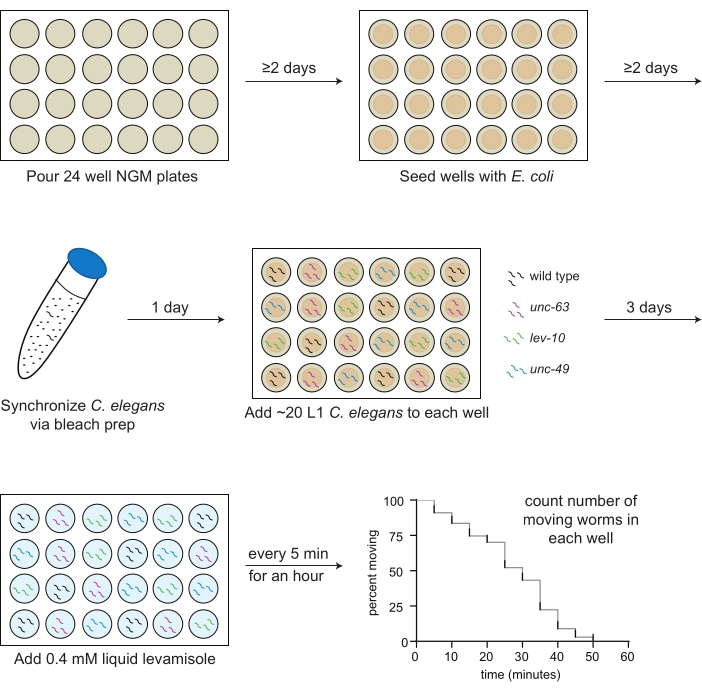
图1:左旋咪唑测定制备和实施示意图, 倒入24孔NGM板;2天后,OP50 大肠杆菌 被播种到孔中。 秀丽隐杆线虫 通过漂白剂制备和每个要测定的菌株的第一幼虫阶段(L1)动物同步(野生型,黑色; unc-63(x26), 洋红色; 列弗-10(x17),绿色; unc-49(e407),蓝色)在第二天根据预定的板图移入孔中。在20ºC下生长3天后,或当动物成年时,向每个孔中加入0.4 mM左旋咪唑M缓冲液,每5分钟计算一次移动动物的数量,持续1小时 。
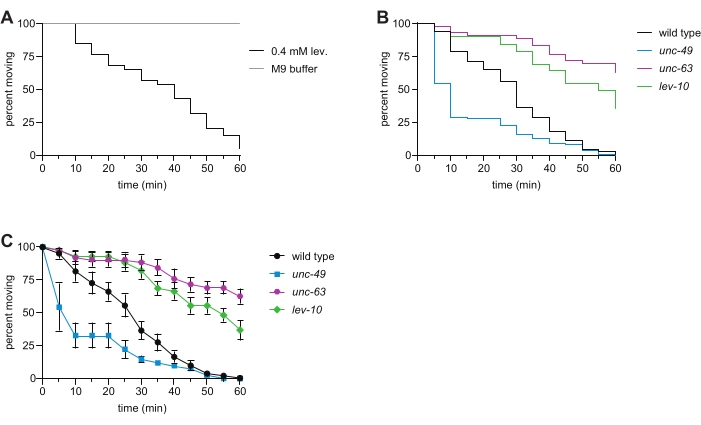
图2:左旋咪唑诱导的野生型和代表性突变秀丽隐杆线虫的麻痹。(A)暴露于0.4mM左旋咪唑引起时间依赖性麻痹;(B)野生型(黑色),unc-63(x26)(品红色),lev-10(x17)(绿色)和unc-49(e407)(蓝色)动物的时间依赖性麻痹在左旋咪唑游泳测定中未观察到这一点。L-AChR亚基UNC-63或L-AChR簇蛋白LEV-10的丢失导致左旋咪唑耐药,GABAA受体UNC-49的丢失引起左旋咪唑超敏反应。n 每个基因型≥50,与本代表性实验中的野生型相比,所有突变体的p<0.0001。(C)使用与图(B)相同的数据,为每个菌株确定每个时间点的移动动物百分比(每个孔±SE的百分比平均值)。请点击此处查看此图的大图。
讨论
改变对左旋咪唑的反应可以识别突触后胆碱能信号传导和肌肉功能所需的基因。此处的方案描述了一种液体左旋咪唑测定法,用于定量1小时内的时间依赖性麻痹。学生对某些基因突变的影响进行预测,进行大样本量的实验,然后量化他们的结果。该测定是一种简单,有效的方法来定量左旋咪唑诱导的麻痹,而无需挑选或刺激动物,使其适用于本科实验室以及研究神经肌肉传播的研究人员。这里讨论的是一些最常见的陷阱,测定的局限性,以及使其能够用于RNAi敲低动物的方案的变体;这里还讨论了如何将该测定嵌入到基于课程的本科研究体验中。
正确制备24孔板至关重要。首先,细菌草坪在井中发现L1动物之前必须完全干燥。如果干燥不够,细菌在测定过程中与左旋咪唑溶液混合,使液体浑浊并防止个体能够计数蠕虫。其次,当通过漂白剂制备同步蠕虫时,动物不得长时间暴露在漂白剂溶液中,因为这会导致卵上的保护涂层分解。第三,每口井只能发现20-30个L1至关重要,因为井中的蠕虫太多使得准确计算在分配的时间内移动的数量变得非常困难。最后,在制备板的过程中保持无菌技术非常重要,因为污染的孔无法进行测定。
进行该测定时必须考虑一些限制。首先,对于缺乏先前实验室经验的人来说,每5分钟计算一次每个孔中移动蠕虫的数量可能是压倒性的,这可能导致数据收集不精确。至于用于确定药物敏感性18,19的其他测定,该实验可以在较少的时间点进行。其次,从漂白剂制备中分离出饥饿的L1的电镀是获得同步种群的简单方法;然而,如果所检测菌株之间的发育时间不同,则必须进行调整。可以将晚期第四幼虫阶段动物(L4s)采摘到24孔板中进行测定;然而,在准备许多盘子时,这太劳动密集型了。或者,应确定每个菌株达到L4所需的时间长度,然后在不同时间将L1放入孔中以调整成熟速度的差异。最后,虽然该测定可用于鉴定对突触后肌肉功能11重要的新基因,但左旋咪唑反应的改变也可以由突触前基因12的突变或RNAi敲低引起。如果观察到左旋咪唑敏感性改变,则必须进行其他实验以确定该表型的原因。
通过对24孔板进行一些修饰,所述的左旋咪唑游泳测定也可以对RNAi敲低动物11进行。通过RNAi的基因敲低可以通过喂养秀 丽隐杆线虫 细菌来实现,这些细菌表达与目的基因20相对应的双链RNA。对于RNAi板的制备,从高压灭菌器中取出后,每升培养基必须加入1mL 1M IPTG和1mL 25mg / mL卡本霉素。通过将单个菌落放入3mLLB肉汤中加3μL25mg / mL卡本西林并在37°C下振荡过夜来生长细菌培养物,并在孔中发现不同细菌时制作平板图。 秀丽隐杆线虫 通过漂白剂制备同步,如上所述;然而,应使用RNAi超敏 eri-1(mg366) 菌株代替野生型来增加基因敲低。RNAi敲低导致与功能丧失突变体11相同的左旋咪唑表型。
这里介绍的协议可用于实验室研究,作为本科实验室的独立实验,或在高级本科课程的开始几周内作为基本 秀丽隐杆线虫 技术和神经肌肉功能的介绍。在更高级的基于发现的课程中,学生可以使用该测定来确定在患有肌无力综合征,肌肉萎缩症或肌病的个体中突变的基因秀 丽隐杆线虫 同源物的丢失是否会改变左旋咪唑敏感性。总之,这种简单,廉价的左旋咪唑敏感性测定提供了一种实践方法,用于学习NMJ的信号传导并获得使用 秀丽隐杆线虫 模型系统的经验。
披露声明
作者没有利益冲突。
致谢
我们感谢里亚·达塔尼和劳伦·霍格斯特罗姆,他们在特拉华大学的BISC413高级遗传学实验室(2022年春季)收集了 图2B,C 中对基因型失明的数据。有关基于BISC413课程的本科生研究体验(CURE)的更多信息,以及J.Tanis设计的实验室手册的访问,可根据要求提供。线虫菌株由 卡诺哈布蒂斯 遗传学中心提供,该中心由NIH-ORIP(P40 OD010440)支持。这项工作得到了P20 GM103446特拉华州英布雷指导治疗奖(J.E.T.)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 60 mm non-vented, sharp edge Petri Dishes | TriTech Research | Cat #: T3308 | |
| BD Difco Bacto Agar | Fisher Scientific | Cat#: DF0140-01-0 | |
| BioLite 24 Well Multidish | Fisher Scientific | Cat#:12-556-006 | |
| Calcium Chloride Dihydrate | Fisher Scientific | Cat#: BP510-500 | |
| Cholesterol | MP Biomedicals | Cat#: 02101382-CF | |
| eri-1(mg366) | Caenorhabditis Genetics Center (CGC) | GR1373 | |
| Gibco Bacto Peptone | Fisher Scientific | Cat#: DF0118-17-0 | |
| Gibco Bacto Tryptone | Fisher Scientific | Cat#: DF0123-17-3 | |
| GraphPad Prism (Statistical software) | GraphPad Software, Inc. | ||
| lev-10(x17) | Caenorhabditis Genetics Center (CGC) | ZZ17 | |
| Levamisole hydrochloride | Fisher Scientific | Cat#: AC187870100 | |
| Low Splash Regular Bleach - 121oz - up & up | Target | Search target.com | |
| Magnesium Sulfate Heptahydrate | Fisher Scientific | Cat#: BP213-1 | |
| Microsoft Excel | Microsoft, Inc | ||
| N2 wild type | Caenorhabditis Genetics Center (CGC) | Bristol N2 | |
| OP50 E. coli | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Potassium Phosphate Dibasic | Fisher Scientific | Cat#: BP363-1 | |
| Potassium Phosphate Monobasic | Fisher Scientific | Cat#: BP362-500 | |
| Sodium Chloride (NaCl) | Fisher Scientific | Cat#: BP358-1 | |
| Sodium Hydroxide 10N | Fisher Scientific | Cat#: SS255-1 | |
| Sodium Phosphate Dibasic | Fisher Scientific | Cat#: BP332-1 | |
| unc-49(e407) | Caenorhabditis Genetics Center (CGC) | CB407 | |
| unc-63(x26) | Caenorhabditis Genetics Center (CGC) | ZZ26 |
参考文献
- Engel, A. G., Shen, X. M., Selcen, D., Sine, S. M. Congenital myasthenic syndromes: Pathogenesis, diagnosis, and treatment. The Lancet Neurology. 14 (4), 420-434 (2015).
- Mahjneh, I., Lochmüller, H., Muntoni, F., Abicht, A. DOK7 limb-girdle myasthenic syndrome mimicking congenital muscular dystrophy. Neuromuscular Disorders. 23 (1), 36-42 (2013).
- Rodríguez Cruz, P. M., et al. Congenital myopathies with secondary neuromuscular transmission defects; A case report and review of the literature. Neuromuscular Disorders. 24 (12), 1103-1110 (2014).
- Montagnese, F., et al. Two patients with GMPPB mutation: The overlapping phenotypes of limb-girdle myasthenic syndrome and limb-girdle muscular dystrophy dystroglycanopathy. Muscle and Nerve. 56 (2), 334-340 (2017).
- Gieseler, K., Qadota, H., Benian, G. M. Development, structure, and maintenance of C. elegans body wall muscle. WormBook. , 1-59 (2017).
- Richmond, J. E., Jorgensen, E. M. One GABA and two acetylcholine receptors function at the C. elegans neuromuscular junction. Nature Neuroscience. 2 (9), 791-797 (1999).
- Lewis, J. A., Wu, C. H., Berg, H., Levine, J. H. The genetics of levamisole resistance in the nematode Caenorhabditis elegans. Genetics. 95 (4), 905-928 (1980).
- Gally, C., Eimer, S., Richmond, J. E., Bessereau, J. L. A transmembrane protein required for acetylcholine receptor clustering in Caenorhabditis elegans. Nature. 431 (7008), 578-582 (2004).
- Eimer, S., et al. Regulation of nicotinic receptor trafficking by the transmembrane Golgi protein UNC-50. The EMBO Journal. 26 (20), 4313-4323 (2007).
- Gendrel, M., Rapti, G., Richmond, J. E., Bessereau, J. L. A secreted complement-control-related protein ensures acetylcholine receptor clustering. Nature. 461 (7266), 992-996 (2009).
- Chaya, T., et al. A C. elegans genome-wide RNAi screen for altered levamisole sensitivity identifies genes required for muscle function. G3: Genes, Genomes, Genetics. 11 (4), 047(2021).
- Vashlishan, A. B., et al. An RNAi screen identifies genes that regulate GABA synapses. Neuron. 58 (3), 346-361 (2008).
- Krajacic, P., Pistilli, E. E., Tanis, J. E., Khurana, T. S., Lamitina, S. T. FER-1/Dysferlin promotes cholinergic signaling at the neuromuscular junction in C. elegans and mice. Biology Open. 2 (11), 1245-1252 (2013).
- Gottschalk, A., et al. Identification and characterization of novel nicotinic receptor-associated proteins in Caenorhabditis elegans. The EMBO Journal. 24 (14), 2566-2578 (2005).
- Loria, P. M., Hodgkin, J., Hobert, O. A conserved postsynaptic transmembrane protein affecting neuromuscular signaling in Caenorhabditis elegans. The Journal of Neuroscience. 24 (9), 2191-2201 (2004).
- Treinin, M., Jin, Y. Cholinergic transmission in C. elegans: Functions, diversity, and maturation of ACh-activated ion channels. Journal of Neurochemistry. 158 (6), 1274-1291 (2021).
- Rapti, G., Richmond, J., Bessereau, J. L. A single immunoglobulin-domain protein required for clustering acetylcholine receptors in C. elegans. The EMBO Journal. 30 (4), 706-718 (2011).
- Kim, S., Sieburth, D. A receptor tyrosine kinase network regulates neuromuscular function in response to oxidative stress in Caenorhabditis elegans. Genetics. 211 (4), 1283-1295 (2019).
- Oh, K., Kim, H. Aldicarb-induced paralysis assay to determine defects in synaptic transmission in Caenorhabditis elegans. Bio-Protocol. 7 (14), 2400(2017).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。