Method Article
Mesure de la sensibilité de Caenorhabditis elegans au levamisole agoniste des récepteurs de l’acétylcholine
Dans cet article
Résumé
Le présent protocole décrit un test pour déterminer la réponse au lévamisole, un agoniste pharmacologique d’une classe de récepteurs de l’acétylcholine de Caenorhabditis elegans . Dans ce test de natation du lévamisole liquide, les chercheurs observent visuellement et quantifient la paralysie dépendante du temps des animaux élevés dans des plaques de 24 puits.
Résumé
À la jonction neuromusculaire (NMJ), la liaison du neurotransmetteur excitateur acétylcholine (ACh) aux récepteurs postsynaptiques conduit à une contraction musculaire. Comme dans le muscle squelettique des vertébrés, la signalisation cholinergique dans les muscles de la paroi corporelle de l’organisme modèle Caenorhabditis elegans est nécessaire pour la locomotion. L’exposition au lévamisole, un agoniste pharmacologique d’une classe de récepteurs ACh sur les muscles de la paroi du corps, provoque une paralysie dépendante du temps des animaux de type sauvage. Une sensibilité altérée au lévamisole suggère des défauts de signalisation au niveau de l’ATMN ou de la fonction musculaire. Ici, un protocole pour un dosage de lévamisole liquide effectué sur C. elegans cultivé dans des plaques de 24 puits est présenté. La nage vigoureuse des animaux dans un liquide permet d’évaluer et de quantifier la paralysie induite par le lévamisolé chez des centaines de vers sur une période d’une heure sans nécessiter de manipulation physique. Cette procédure peut être utilisée avec des mutants de type sauvage et des mutants qui ont une sensibilité altérée au lévamisole pour démontrer les conséquences fonctionnelles d’une signalisation altérée au NMJ.
Introduction
L’activation des récepteurs postsynaptiques de l’acétylcholine (AChR) sur le muscle squelettique entraîne un signal électrique qui conduit à la contraction musculaire. La perturbation de la fonction neuromusculaire entraîne des syndromes myasthéniques et des dystrophies musculaires chez l’homme 1,2,3,4. Le nématode Caenorhabditis elegans a été largement utilisé pour en apprendre davantage sur les processus biologiques fondamentaux conservés au cours de l’évolution et les mécanismes de la maladie. Les muscles squelettiques des vertébrés et les muscles de la paroi corporelle de C. elegans sont fonctionnellement équivalents dans le contrôle de la locomotion5. Ici, un test simple est présenté qui peut être utilisé pour comparer C. elegans de type sauvage avec des mutants qui ont altéré la signalisation neuromusculaire ou la fonction musculaire.
Les apports excitateurs et inhibiteurs reçus des motoneurones cholinergiques et GABAergiques, respectivement, provoquent la contraction des muscles d’un côté du corps de C. elegans tandis que les muscles de l’autre côté se détendent, permettant une locomotioncoordonnée 6. Le lévamisole, un agent anthelminthique utilisé pour traiter les infections par les nématodes parasitaires, se lie à une classe d’AChR sur les muscles de la paroi corporelle et l’active de manière constitutive, entraînant une paralysie dépendante du temps7. Ainsi, une sensibilité altérée au lévamisole peut être utilisée pour identifier C. elegans présentant des défauts dans l’équilibre de la signalisation excitatrice et inhibitrice 7,8,9,10,11,12,13,14,15. Par exemple, des mutations dans des sous-unités de l’AChR sensible au lévamisole (L-AChR), comme UNC-63, ainsi que l’homologue C. elegans de Cubilin, LEV-10, qui est nécessaire pour le regroupement de L-AChR au niveau de la synapse, impactent la signalisation excitatrice et entraînent une résistance au lévamisole 7,8. Les mutations du récepteur GABAA UNC-49 réduisent la signalisation inhibitrice et provoquent une hypersensibilité au lévamisole12.
L’hypersensibilité ou la résistance au lévamisole a traditionnellement été évaluée en transférant les animaux dans des plaques de gélose contenant du lévamisole et en poussant régulièrement les vers pour déterminer le moment où la paralysie se produit13,14,15. Nous avons développé un test de natation au lévamisole liquide qui élimine le besoin de manipulation physique des animaux et permet le dépistage de centaines d’animaux en seulement 1 h. Ici, l’utilisation de ce test avec des animaux de type sauvage, unc-63(x26), lev-10(x17) et unc-49(e407) est décrite. Cependant, ce protocole peut également être effectué sur C. elegans exposé à l’ARNi, comme cela a été fait pour valider les knockdowns identifiés dans un criblage d’ARNi à l’échelle du génome pour une sensibilité altérée au lévamisole11.
Pour ce test pharmacologique, les vers ont été cultivés jusqu’à l’âge adulte dans des plaques de 24 puits, 0,4 mM de lévamisole dans un tampon M9 a été ajouté à chaque puits et le nombre d’animaux en mouvement a été enregistré toutes les 5 minutes pendant 1 h. La paralysie induite par le lévamisolé a été observée visuellement au fil du temps et, après l’achèvement du test, les données ont été quantifiées. L’évaluation des mutants ainsi que de C. elegans de type sauvage permet aux étudiants de faire d’abord des prédictions sur les effets phénotypiques potentiels, puis d’effectuer des expériences pour tester leurs hypothèses. En conclusion, ce test de lévamisole liquide simple et peu coûteux est un moyen idéal de démontrer l’impact de la perte de gènes spécifiques sur la fonction de la NMJ.
Protocole
1. Préparation des plaques pour le dosage du lévamisole
- Préparer le milieu de croissance des nématodes (NGM) en combinant 3 g de NaCl, 2,5 g de peptone et 17 g de gélose avec 1 L d’eau désionisée (DI) dans une fiole munie d’une barre d’agitation.
- Après l’autoclavage, placer le média sur une plaque chauffante réglée à 70 °C et agiter à vitesse modérée pendant 1 h.
- Ajouter 1 mL de 5 mg/mL de cholestérol goutte à goutte pour prévenir la précipitation, 1 mL de 1 M CaCl2, 1 mL de 1 M MgSO4 et 25 mL de tampon de phosphate de potassium 1 M pH 6,0 dans le milieu.
- Transférer 2 mL de milieu NGM dans chaque puits d’une plaque de 24 puits à l’aide d’une pipette sérologique stérile (Figure 1).
- Laissez les assiettes sécher sur la paillasse pendant 2 jours avant de semer avec des bactéries. Pour un stockage à plus long terme, placez-les à 4 °C.
- Étaler OP50 E. coli sur une plaque de bouillon de lysogénie (LB) et pousser pendant la nuit à 37 °C.
- Prélever une seule colonie d’OP50 dans un bouillon B (10 g de tryptone et 5 g de NaCl dans 1 L de DIH2O) et mettre la culture en agitation à 37 °C pendant la nuit.
- À l’aide d’une pipette stérile, déposer 30 μL de suspension d’OP50 sur la gélose au milieu de chaque puits (figure 1).
REMARQUE: Assurez-vous de ne pas endommager la surface de la gélose car cela entraînerait un enfouissement de vers. - Laissez les assiettes reposer à température ambiante pendant au moins 2 jours après l’ensemencement pour permettre la formation d’une pelouse bactérienne.
REMARQUE : Si les bactéries dans les puits centraux ne sont pas sèches après 2 jours, laissez les plaques ouvertes dans la hotte pendant 20 minutes (Figure 1). Les plaques doivent être versées et ensemencées avec des bactéries 1-2 semaines avant le test.
2. Synchronisation de C. elegans (jour 1)
- Cultiver des C. elegans de type sauvage, unc-63(x26), lev-10(x17) et unc-49(e407) jusqu’à l’âge adulte sur des plaques de 6 cm, en préparant au moins huit plaques par souche. Confirmez qu’il y a beaucoup d’adultes gravides non affamés dans les assiettes.
REMARQUE: C’est deux fois plus de plaques que nécessaire; Cependant, il est important d’avoir des plaques de secours au cas où le premier lot d’œufs serait détruit pendant le blanchiment. - Faire 10x tampon M9 en dissolvant 59,6 g de Na 2 HPO 4 (dibasique), 29,9 g de KH 2 PO 4 (monobasique), 12,8 g de NaCl et2,5g de MgSO4 dans 750 mL d’eau DI sous agitation. Une fois dissous, porter le volume à 1 L et filtrer stériliser. Diluer 1:10 et autoclave pour faire 1x tampon M9.
REMARQUE: Le tampon M9 1x peut être fabriqué des semaines ou des mois à l’avance. - Préparer la solution de blanchiment sous le capot le jour de la synchronisation. Mélanger 10 mL d’eau de Javel (Table des matières), 2,5 mL de NaOH 10 N et 37,5 mL d’eau DI dans un tube conique de 50 mL. Portez des lunettes de protection, des gants et une blouse de laboratoire chaque fois que vous travaillez avec la solution de blanchiment.
- À l’aide d’une pipette de transfert en plastique, laver les vers adultes gravides d’au moins quatre plaques avec 1x tampon M9 et les transférer dans un tube conique de 15 mL.
- Faire tourner à 716 x g pendant 1 min à température ambiante, puis retirer le surnageant à l’aide d’une pipette de transfert.
- Ajouter 10 mL de la solution de blanchiment. Retourner ou agiter doucement le tube pendant ~4 minutes jusqu’à ce que la plupart, mais pas toutes, des carcasses de vers se soient dissoutes (figure 1).
REMARQUE: Veillez à ne pas trop blanchir les vers car cela détruirait les œufs. Certaines mutations peuvent augmenter la difficulté de l’isolement des ovules. - Faire tourner à 716 x g pendant 1 min.
- Verser la solution d’eau de Javel en un seul mouvement; Tant que le tube n’est pas secoué à ce stade, les œufs colleront sur le côté du tube.
- Ajouter 15 mL de 1x tampon M9 et inverser. Faites tourner à 716 x g pendant 1 min et versez le tampon M9 en un seul mouvement fluide.
- Effectuez trois lavages au total avec 1x tampon M9, comme décrit à l’étape 2.9.
- Après le lavage final, ajouter 10 ml de 1x M9 frais et placer sur un rotateur pendant la nuit à 15 °C pour isoler une population synchronisée d’animaux affamés au stade larvaire (L1).
REMARQUE: Avant de placer sur le rotateur, vérifiez qu’il y a des œufs dans le tampon M9. Sinon, répétez la préparation avec des plaques de secours et de l’eau de Javel pendant une période plus courte.
3. Placage synchronisé de C. elegans (jour 2)
- Imprimez une carte de plaque de 24 puits et attribuez des souches à des endroits aléatoires. Chaque souche doit être représentée dans la plaque de 24 puits au moins six fois.
- Environ 24 h après la préparation de l’eau de Javel, faire tourner les vers L1 affamés éclos dans un tampon M9 à 716 x g pendant 1 min à température ambiante.
- Retirer ~9 ml de tampon M9 avec une pipette de transfert en plastique, puis mélanger délicatement les premiers vers larvaires affamés (L1) dans le tampon M9 restant.
- Pipeter immédiatement 3 μL des vers dans le tampon M9 sur une lame de microscope et déterminer le nombre de L1; le nombre souhaité est de 20-30 L1s dans 3 μL. Faites tourner vers le bas et retirez M9 si la concentration du ver est trop faible, et ajoutez M9 si la concentration est trop élevée.
REMARQUE: Vérifiez le nombre de vers par 3 μL au moins 2x, en inversant le tube à chaque fois. - Pipet 3 μL de L1 (20-30 vers au total) dans chaque puits selon la carte de plaque préfabriquée (étape 3.1; Graphique 1).
REMARQUE: Inversez fréquemment le tube avec les L1 dans M9 pour maintenir une répartition uniforme des vers car ils se déposeront au fond. Si cela n’est pas fait, certains puits auront trop peu de vers, tandis que d’autres en auront trop. De plus, ne percez pas la gélose avec l’embout de la pipette, car cela enfouirait les animaux. - Laissez les vers grandir jusqu’à l’âge adulte pendant 3 jours à 20 °C.
REMARQUE: L’utilisation de différentes températures de croissance et de certaines mutations peut avoir un impact sur la vitesse de maturation, alors assurez-vous de considérer le cycle de vie de C. elegans.
4. Réalisation du dosage du lévamisole (jour 5)
- Imprimez une fiche technique vierge, qui sera utilisée pour enregistrer le nombre de vers se déplaçant dans chaque puits toutes les 5 minutes pendant 1 h.
NOTE: Les élèves pourront compter les vers dans au plus 12 puits toutes les 5 minutes. Les 12 premiers puits sont analysés au cours de la première heure, et les 12 derniers puits sont analysés dans l’heure suivante. - Vérifiez les vers dans les plaques de 24 puits. À l’aide d’un marqueur, placez un « X » sur le couvercle de la plaque au-dessus de tous les puits contaminés, affamés ou trop nombreux vers (>40), ce qui rendra le comptage difficile.
- Préparer une solution de lévamisole 0,4 mM en ajoutant 200 μL de bouillon de lévamisole de 100 mM à 50 mL de 1x M9. Préparer un stock de lévamisole de 100 mM en dissolvant 240,76 mg de chlorhydrate de lévamisole dans 10 mL deH2Oet le conserver à −20 °C.
NOTE: Le lévamisole doit être dilué dans M9; la dilution dansH2Oaccélère la paralysie. Les élèves doivent porter des gants. L’ingestion de fortes concentrations de lévamisole est toxique. - Démarrez une minuterie puis, à l’aide d’une pipette de transfert, ajoutez 1 mL de lévamisole 0,4 mM aux deux premiers puits, de sorte que les animaux nagent librement. Continuez à ajouter du lévamisole aux puits adjacents, en échelonnant le temps en fonction du nombre de puits à analyser.
NOTE: Par exemple, si 10 puits sont analysés, le lévamisole sera ajouté de la manière suivante: puits 1 et 2 au temps 0, puits 3 et 4 après 1 min, puits 5 et 6 après 2 min, puits 7 et 8 après 3 min, et puits 9 et 10 après 4 min. - À 5 min, commencez à compter manuellement uniquement le nombre de vers en mouvement dans chaque puits, en commençant par le premier puits, et notez ce nombre sur la fiche technique (Figure 1). Les compteurs peuvent être utilisés mais ne sont pas nécessaires pour déterminer avec précision le nombre de vers en mouvement.
REMARQUE: Les élèves doivent garder un œil sur la minuterie car ils prendront parfois du retard pendant les premiers moments avant que de nombreux vers ne paralysent. Le nombre de points temporels peut être ajusté, ou moins de puits peuvent être analysés à chaque point temporel si nécessaire. - Continuez à compter le nombre de vers en mouvement dans chaque puits toutes les 5 minutes pendant 1 h.
REMARQUE : L’immersion dans M9 induit un mouvement de nage constant au cours de ce test de 1 h, ce qui élimine le besoin d’aiguillonner les vers pour évaluer la paralysie (Figure 2A). L’exposition à une solution de lévamisole à 0,4 mM induit une paralysie dépendante du temps observée par l’arrêt de la natation ; Les vers qui paralysent ne se rétablissent pas. - Répétez les étapes 4.4.-4.6. pour le reste des puits dans l’assiette.
- À la fin de l’essai, ou lorsque le temps le permet, notez le nombre total de vers dans chaque puits.
5. Analyse des données
- Obtenez la carte des plaques (étape 3.1.) et notez quelle déformation correspond à chaque puits.
REMARQUE : En raison de la quantité de données recueillies, l’analyse et la discussion subséquentes des données prendront au moins quelques heures. - Entrez les données dans une feuille de calcul, en commençant par le nombre total de vers dans chaque puits et en les organisant par génotype.
- En combinant les données des puits, déterminez le nombre de vers se déplaçant à chaque point temporel pour chaque souche.
- Utilisez ces données pour créer une « courbe de survie » dans le logiciel statistique (Table of Materials) afin d’afficher visuellement la paralysie de la population dépendante du temps (Figure 2B).
- Créez un tableau de données de sorte que la colonne de gauche indique l’heure et que les colonnes suivantes contiennent les données pour chaque souche. Pour chaque animal paralysé au cours des 5 premières minutes, créez une ligne et entrez un « 1 » pendant 5 minutes. Répétez cette opération pour chaque point temporel. Pour tous les animaux qui ne paralysent pas à la fin de l’essai, entrez un « 0 » pendant 60 minutes.
- Effectuer des comparaisons par paires à l’aide du test de log-rank (Mantel-Cox) dans le logiciel statistique (Table of Materials) pour déterminer s’il existe une différence statistiquement significative entre deux souches différentes.
- Pour une analyse supplémentaire/alternative, au lieu d’effectuer l’étape 5.3. et l’étape 5.4., déterminer le pourcentage d’animaux se déplaçant dans chaque puits à chaque point temporel. Tracer la moyenne avec l’erreur-type à chaque point temporel pour toutes les souches analysées à l’aide d’un tableur ou d’un logiciel statistique (figure 2C).
Résultats
La signalisation par les récepteurs AChRs et GABA permet aux muscles d’un côté du corps de C. elegans de se contracter tandis que les muscles de l’autre côté se détendent, permettant une locomotion coordonnée 6,16. La liaison du lévamisole aux L-AChR ionotropes provoque une contraction, entraînant une paralysie dépendante du temps des animaux de type sauvage. Ici, nous avons évalué la sensibilité du type sauvage, du mutant unc-63 L-AChR, du mutant de clustering L-AChR lev-10 et du mutant du récepteur GABAA de l’unc-49 C. elegans au lévamisole. Les mutations dans les sous-unités du L-AChR, ainsi que dans les gènes nécessaires au trafic des L-AChR vers la membrane plasmique musculaire, au regroupement des L-AChR postsynaptiques et à la signalisation Ca 2+ en aval, provoquent une résistance à la paralysie induite par le lévamisole-7,8,9,10,11,16,17, comme observé chez les mutants unc-63 et lev-10 (Figure2B ,C). La perte du canal ionique GABA-dépendant UNC-49 a provoqué une hypersensibilité au lévamisole (Figure 2B,C) en raison de la perturbation du bon équilibre de la signalisation cholinergique et GABAergique12. Lorsque ce test a récemment été effectué par des étudiants de premier cycle dans un laboratoire de génétique avancée, 100% des étudiants ont observé une résistance au lévamisole avec les mutants unc-63 et lev-10, tandis que 88% ont observé une hypersensibilité au lévamisole avec le mutant unc-49. Ces données recueillies avec le test de natation du lévamisole liquide sont cohérentes avec les phénotypes observés dans les dosages traditionnels du lévamisolesur plaque 7,8,11,12,13.
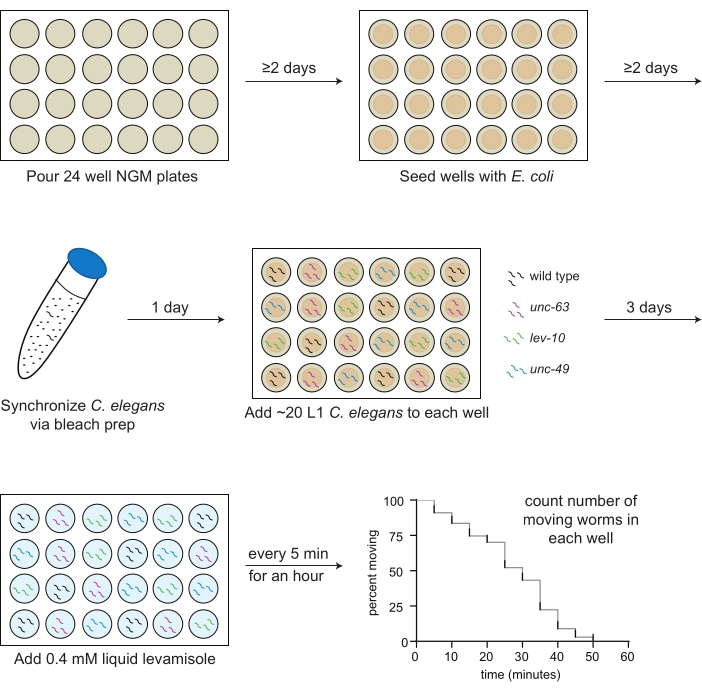
Figure 1 : Schéma de la préparation et de la mise en œuvre du dosage du lévamisol. Des plaques NGM à 24 puits sont coulées; 2 jours plus tard, OP50 Escherichia coli est ensemencé dans les puits. C. elegans est synchronisé par la préparation de l’eau de Javel et les premiers animaux au stade larvaire (L1) pour chaque souche à doser (type sauvage, noir; UNC-63(X26), magenta; Lév-10(x17), vert; UNC-49(E407), bleu) sont pipetées dans les puits selon une carte de plaque prédéterminée le lendemain. Après 3 jours de croissance à 20 ºC, ou lorsque les animaux atteignent l’âge adulte, 0,4 mM de lévamisole dans un tampon M9 est ajouté à chaque puits, et le nombre d’animaux en mouvement est compté toutes les 5 minutes pendant 1 h. Veuillez cliquer ici pour voir une version agrandie de cette figure.
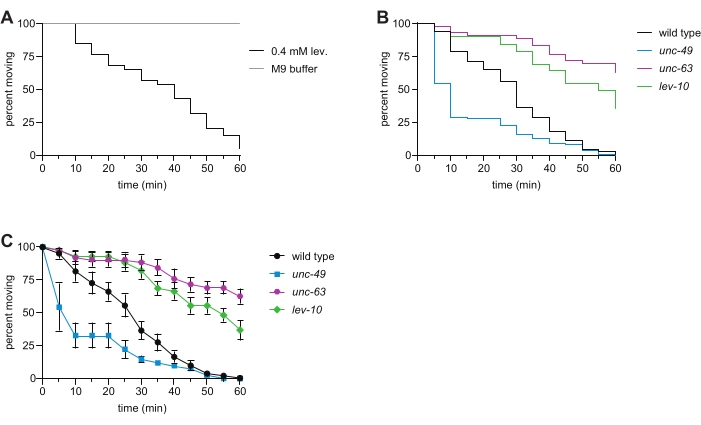
Figure 2 : Paralysie induite par le lévamisolé chez le type sauvage et le mutant représentatif C. elegans. (A) L’exposition à 0,4 mM de lévamisole provoque une paralysie dépendante du temps; ceci n’est pas observé pour les animaux nageant dans 1x tampon M9 pendant 1 h. (B) Paralysie dépendante du temps des animaux de type sauvage (noir), unc-63(x26) (magenta), lev-10(x17) (vert) et unc-49(e407) (bleu) dans le test de natation du lévamisol. La perte de la sous-unité L-AChR UNC-63 ou de la protéine de clustering L-AChR LEV-10 a entraîné une résistance au lévamisole et la perte du récepteur GABAA UNC-49 a provoqué une hypersensibilité au lévamisol. n ≥ 50 par génotype, p < 0,0001 pour tous les mutants par rapport au type sauvage dans cette expérience représentative. (C) En utilisant les mêmes données que dans le panneau (B), le pourcentage d’animaux en mouvement à chaque point temporel (moyenne des pourcentages pour chaque puits ± SE) a été déterminé pour chaque souche. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Une réponse altérée au lévamisole peut identifier les gènes nécessaires à la signalisation cholinergique postsynaptique et à la fonction musculaire. Le protocole décrit ici un dosage de lévamisole liquide utilisé pour quantifier la paralysie dépendante du temps sur une période de 1 heure. Les élèves font des prédictions sur les effets de certaines mutations génétiques, réalisent une expérience avec un échantillon de grande taille, puis quantifient leurs résultats. Ce test est un moyen simple et efficace de quantifier la paralysie induite par le lévamisolé sans cueillir ni aiguillonner les animaux, ce qui le rend approprié pour les laboratoires de premier cycle, ainsi que pour les chercheurs qui étudient la transmission neuromusculaire. Discuté ici sont quelques-uns des pièges les plus courants, les limites du test et une variante du protocole qui permet son utilisation avec des animaux ARNi knockdown; Il est également question ici de la façon dont ce test peut être intégré dans une expérience de recherche de premier cycle basée sur des cours.
Une bonne préparation des plaques de 24 puits est essentielle. Tout d’abord, les pelouses bactériennes doivent être complètement sèches avant de repérer les animaux L1 dans les puits. Si elles ne sont pas assez séchées, les bactéries se mélangent à la solution de lévamisole pendant l’essai, rendant le liquide trouble et empêchant les individus de pouvoir compter les vers. Deuxièmement, lors de la synchronisation des vers par la préparation de l’eau de Javel, les animaux ne doivent pas être exposés trop longtemps à la solution d’eau de Javel, car cela entraînerait la désintégration du revêtement protecteur sur les œufs. Troisièmement, il est crucial de ne repérer que 20 à 30 L1 par puits, car trop de vers dans les puits rendent extrêmement difficile le comptage précis du nombre de L1 par puits. Enfin, il est important de maintenir une technique aseptique lors de la préparation des plaques car les puits contaminés ne peuvent pas être analysés.
Il y a quelques limites qui doivent être prises en compte lors de la réalisation de ce test. Tout d’abord, compter le nombre de vers en mouvement dans chaque puits toutes les 5 minutes peut être accablant pour les personnes qui n’ont pas d’expérience préalable en laboratoire, ce qui pourrait entraîner une collecte de données imprécise. Comme pour les autres tests utilisés pour déterminer la sensibilité aux médicaments18,19, cette expérience peut être réalisée avec moins de points temporels. Deuxièmement, le placage de L1 affamés isolés d’une préparation à l’eau de Javel est une méthode facile pour obtenir une population synchronisée; Cependant, des ajustements doivent être effectués si le calendrier de développement diffère entre les souches testées. Il est possible de prélever des animaux du stade larvaire tardif (L4) dans une plaque de 24 puits pour cet essai; Cependant, lors de la préparation de nombreuses assiettes, cela demande trop de main-d’œuvre. Alternativement, il faut déterminer le temps qu’il faut pour que chaque souche atteigne L4, puis placer les L1 dans les puits à différents moments pour ajuster les différences de vitesse de maturation. Enfin, bien que ce test puisse être utilisé pour identifier de nouveaux gènes importants pour la fonction musculaire postsynaptique11, une réponse altérée au lévamisole peut également être causée par une mutation ou une élimination de l’ARNi des gènes présynaptiques12. Si une sensibilité altérée au lévamisole est observée, des expériences supplémentaires doivent être effectuées pour déterminer la raison de ce phénotype.
En apportant quelques modifications aux plaques de 24 puits, le test de natation au lévamisole décrit peut également être effectué sur des animaux ARNirenversés 11. L’élimination du gène par l’ARNi peut être obtenue en nourrissant des bactéries C. elegans qui expriment un ARN double brin correspondant au gène d’intérêt20. Pour la préparation des plaques d’ARNi, 1 mL de 1M IPTG et 1 mL de carbénicilline 25 mg/mL doivent être ajoutés par litre de milieu après retrait de l’autoclave. Les cultures bactériennes sont cultivées en cueillant une seule colonie dans 3 mL de bouillon LB plus 3 μL de 25 mg / mLcarbénicilline, et en agitant à 37 ° C pendant la nuit, et la carte des plaques est faite lorsque les différentes bactéries sont repérées dans les puits. C. elegans est synchronisé par la préparation de l’eau de Javel comme décrit; cependant, la souche ARNi hypersensible eri-1 (mg366) doit être utilisée à la place du type sauvage pour augmenter le knockdown du gène. Les knockdowns d’ARNi donnent les mêmes phénotypes de lévamisole observés pour les mutants de perte de fonction11.
Le protocole présenté ici peut être utilisé dans la recherche en laboratoire, comme une expérience autonome dans le laboratoire de premier cycle, ou dans les premières semaines d’un cours avancé de premier cycle comme une introduction aux techniques de base de C. elegans et à la fonction neuromusculaire. Dans un cours plus avancé basé sur la découverte, les étudiants peuvent utiliser ce test pour déterminer si la perte des homologues de C. elegans de gènes mutés chez les personnes atteintes de syndromes myasthéniques, de dystrophies musculaires ou de myopathies modifie la sensibilité au lévamisol. En conclusion, ce test de sensibilité au lévamisole simple et peu coûteux offre une approche pratique pour apprendre la signalisation au NMJ et acquérir de l’expérience de travail avec le système modèle C. elegans.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts.
Remerciements
Nous remercions Riya Dattani et Lauren Hogstrom, qui ont recueilli les données de la figure 2B,C aveugles au génotype au laboratoire de génétique avancée BISC413 (printemps 2022) de l’Université du Delaware. Des informations supplémentaires sur l’expérience de recherche de premier cycle basée sur le cours BISC413 (CURE), ainsi que l’accès au manuel de laboratoire conçu par J. Tanis, sont disponibles sur demande. Les souches de nématodes ont été fournies par le Caenorhabditis Genetics Center, qui est soutenu par le NIH-ORIP (P40 OD010440). Ce travail a été soutenu par un prix P20 GM103446 Delaware INBRE Mentored CURE Award (à J.E.T.).
matériels
| Name | Company | Catalog Number | Comments |
| 60 mm non-vented, sharp edge Petri Dishes | TriTech Research | Cat #: T3308 | |
| BD Difco Bacto Agar | Fisher Scientific | Cat#: DF0140-01-0 | |
| BioLite 24 Well Multidish | Fisher Scientific | Cat#:12-556-006 | |
| Calcium Chloride Dihydrate | Fisher Scientific | Cat#: BP510-500 | |
| Cholesterol | MP Biomedicals | Cat#: 02101382-CF | |
| eri-1(mg366) | Caenorhabditis Genetics Center (CGC) | GR1373 | |
| Gibco Bacto Peptone | Fisher Scientific | Cat#: DF0118-17-0 | |
| Gibco Bacto Tryptone | Fisher Scientific | Cat#: DF0123-17-3 | |
| GraphPad Prism (Statistical software) | GraphPad Software, Inc. | ||
| lev-10(x17) | Caenorhabditis Genetics Center (CGC) | ZZ17 | |
| Levamisole hydrochloride | Fisher Scientific | Cat#: AC187870100 | |
| Low Splash Regular Bleach - 121oz - up & up | Target | Search target.com | |
| Magnesium Sulfate Heptahydrate | Fisher Scientific | Cat#: BP213-1 | |
| Microsoft Excel | Microsoft, Inc | ||
| N2 wild type | Caenorhabditis Genetics Center (CGC) | Bristol N2 | |
| OP50 E. coli | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Potassium Phosphate Dibasic | Fisher Scientific | Cat#: BP363-1 | |
| Potassium Phosphate Monobasic | Fisher Scientific | Cat#: BP362-500 | |
| Sodium Chloride (NaCl) | Fisher Scientific | Cat#: BP358-1 | |
| Sodium Hydroxide 10N | Fisher Scientific | Cat#: SS255-1 | |
| Sodium Phosphate Dibasic | Fisher Scientific | Cat#: BP332-1 | |
| unc-49(e407) | Caenorhabditis Genetics Center (CGC) | CB407 | |
| unc-63(x26) | Caenorhabditis Genetics Center (CGC) | ZZ26 |
Références
- Engel, A. G., Shen, X. M., Selcen, D., Sine, S. M. Congenital myasthenic syndromes: Pathogenesis, diagnosis, and treatment. The Lancet Neurology. 14 (4), 420-434 (2015).
- Mahjneh, I., Lochmüller, H., Muntoni, F., Abicht, A. DOK7 limb-girdle myasthenic syndrome mimicking congenital muscular dystrophy. Neuromuscular Disorders. 23 (1), 36-42 (2013).
- Rodríguez Cruz, P. M., et al. Congenital myopathies with secondary neuromuscular transmission defects; A case report and review of the literature. Neuromuscular Disorders. 24 (12), 1103-1110 (2014).
- Montagnese, F., et al. Two patients with GMPPB mutation: The overlapping phenotypes of limb-girdle myasthenic syndrome and limb-girdle muscular dystrophy dystroglycanopathy. Muscle and Nerve. 56 (2), 334-340 (2017).
- Gieseler, K., Qadota, H., Benian, G. M. Development, structure, and maintenance of C. elegans body wall muscle. WormBook. , 1-59 (2017).
- Richmond, J. E., Jorgensen, E. M. One GABA and two acetylcholine receptors function at the C. elegans neuromuscular junction. Nature Neuroscience. 2 (9), 791-797 (1999).
- Lewis, J. A., Wu, C. H., Berg, H., Levine, J. H. The genetics of levamisole resistance in the nematode Caenorhabditis elegans. Genetics. 95 (4), 905-928 (1980).
- Gally, C., Eimer, S., Richmond, J. E., Bessereau, J. L. A transmembrane protein required for acetylcholine receptor clustering in Caenorhabditis elegans. Nature. 431 (7008), 578-582 (2004).
- Eimer, S., et al. Regulation of nicotinic receptor trafficking by the transmembrane Golgi protein UNC-50. The EMBO Journal. 26 (20), 4313-4323 (2007).
- Gendrel, M., Rapti, G., Richmond, J. E., Bessereau, J. L. A secreted complement-control-related protein ensures acetylcholine receptor clustering. Nature. 461 (7266), 992-996 (2009).
- Chaya, T., et al. A C. elegans genome-wide RNAi screen for altered levamisole sensitivity identifies genes required for muscle function. G3: Genes, Genomes, Genetics. 11 (4), 047(2021).
- Vashlishan, A. B., et al. An RNAi screen identifies genes that regulate GABA synapses. Neuron. 58 (3), 346-361 (2008).
- Krajacic, P., Pistilli, E. E., Tanis, J. E., Khurana, T. S., Lamitina, S. T. FER-1/Dysferlin promotes cholinergic signaling at the neuromuscular junction in C. elegans and mice. Biology Open. 2 (11), 1245-1252 (2013).
- Gottschalk, A., et al. Identification and characterization of novel nicotinic receptor-associated proteins in Caenorhabditis elegans. The EMBO Journal. 24 (14), 2566-2578 (2005).
- Loria, P. M., Hodgkin, J., Hobert, O. A conserved postsynaptic transmembrane protein affecting neuromuscular signaling in Caenorhabditis elegans. The Journal of Neuroscience. 24 (9), 2191-2201 (2004).
- Treinin, M., Jin, Y. Cholinergic transmission in C. elegans: Functions, diversity, and maturation of ACh-activated ion channels. Journal of Neurochemistry. 158 (6), 1274-1291 (2021).
- Rapti, G., Richmond, J., Bessereau, J. L. A single immunoglobulin-domain protein required for clustering acetylcholine receptors in C. elegans. The EMBO Journal. 30 (4), 706-718 (2011).
- Kim, S., Sieburth, D. A receptor tyrosine kinase network regulates neuromuscular function in response to oxidative stress in Caenorhabditis elegans. Genetics. 211 (4), 1283-1295 (2019).
- Oh, K., Kim, H. Aldicarb-induced paralysis assay to determine defects in synaptic transmission in Caenorhabditis elegans. Bio-Protocol. 7 (14), 2400(2017).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon