Method Article
מדידת רגישות Caenorhabditis elegans לקולטן אצטילכולין אגוניסט לבאמיזול
In This Article
Summary
הפרוטוקול הנוכחי מתאר בדיקה לקביעת התגובה ללבמיזול, אגוניסט פרמקולוגי של סוג אחד של קולטני אצטילכולין Caenorhabditis elegans . במבחן השחייה הנוזלי הזה, החוקרים מתבוננים באופן חזותי ומכמתים את השיתוק תלוי הזמן של בעלי חיים המעובדים בצלחות של 24 בארות.
Abstract
בצומת הנוירומוסקולרי (NMJ), הקשירה של המוליך העצבי המעורר אצטילכולין (ACh) לקולטנים פוסט-סינפטיים מובילה להתכווצות שרירים. כמו בשרירי השלד של בעלי חוליות, איתות כולינרגי בשרירי דופן הגוף של אורגניזם המודל Caenorhabditis elegans נדרש לתנועה. חשיפה ללבמיזול, אגוניסט פרמקולוגי של סוג אחד של קולטני ACh על שרירי דופן הגוף, גורמת לשיתוק תלוי זמן של בעלי חיים מסוג בר. שינוי ברגישות ללבאמיזול מרמז על פגמים באיתות ב-NMJ או בתפקוד השרירים. כאן מוצג פרוטוקול לבדיקת לבאמיזול נוזלי המבוצעת על C. elegans הגדלים בצלחות של 24 בארות. שחייה נמרצת של בעלי החיים בנוזל מאפשרת הערכה וכמות של שיתוק הנגרם על ידי לבאמיזול במאות תולעים בפרק זמן של שעה ללא צורך במניפולציה פיזית. ניתן להשתמש בהליך זה הן עם סוג בר והן עם מוטנטים ששינו את הרגישות ללבמיזול כדי להדגים את ההשלכות התפקודיות של איתות שונה ב- NMJ.
Introduction
הפעלה של קולטני אצטילכולין פוסט-סינפטיים (AChRs) על שרירי השלד גורמת לאות חשמלי שמוביל להתכווצות שרירים. הפרעה בתפקוד העצבי-שרירי גורמת לתסמונות מיאסטניות ולניוון שרירים בבני אדם 1,2,3,4. הנמטודה Caenorhabditis elegans שימשה רבות כדי ללמוד על תהליכים ביולוגיים בסיסיים שמורים אבולוציונית ומנגנונים של מחלות. שרירי השלד של בעלי החוליות ושרירי דופן הגוף של C. elegans שקולים מבחינה תפקודית בשליטה על תנועה5. כאן, מוצגת בדיקה פשוטה שניתן להשתמש בה כדי להשוות בין סוג פראי C. elegans עם מוטנטים ששינו איתות עצבי-שרירי או תפקוד שרירים.
תשומות מעוררות ומעכבות המתקבלות מנוירונים מוטוריים כולינרגיים ו- GABAergic, בהתאמה, גורמות לשרירים בצד אחד של גוף C. elegans להתכווץ בעוד השרירים בצד השני נרגעים, ומאפשרים תנועה מתואמת6. Levamisole, סוכן anthelmintic המשמש לטיפול בזיהומים נמטודות טפיליות, נקשר ומפעיל באופן מרכיב מחלקה אחת של AChRs על שרירי דופן הגוף, וכתוצאה מכך שיתוק תלוי זמן7. לפיכך, רגישות שונה levamisole ניתן להשתמש כדי לזהות C. elegans עם פגמים במאזן של איתות מעורר ומעכב 7,8,9,10,11,12,13,14,15. לדוגמה, מוטציות בתת-יחידות של ה-AChR הרגיש לבאמיזול (L-AChR), כגון UNC-63, כמו גם הומולוג C. elegans של קובילין, LEV-10, הנדרש לאשכולות L-AChR בסינפסה, פוגעים באיתות מעורר וגורמים להתנגדות לבאמיזול 7,8. מוטציות בקולטן GABAA UNC-49 מפחיתות את האיתות המעכב וגורמות לרגישות יתר ללבאמיזול12.
רגישות יתר או עמידות ללבאמיזול הוערכה באופן מסורתי על ידי העברת בעלי חיים לצלחות אגר המכילות לבאמיזול ולאחר מכן דחיפה קבועה של התולעים כדי לקבוע את נקודת הזמן שבה מתרחש שיתוק13,14,15. פיתחנו בדיקת שחייה נוזלית של levamisole המבטלת את הצורך במניפולציה פיזית של בעלי החיים ומאפשרת הקרנה של מאות בעלי חיים תוך שעה אחת בלבד. כאן מתואר השימוש בבדיקה זו עם בעלי חיים מסוג בר, unc-63(x26), lev-10(x17) ו- unc-49(e407). עם זאת, פרוטוקול זה יכול להתבצע גם על C. elegans שנחשפו ל- RNAi, כפי שנעשה כדי לאמת נוקאאוטים שזוהו במסך RNAi כלל-גנומי עבור רגישות לבאמיזולמשתנה 11.
עבור בדיקה פרמקולוגית זו, תולעים גודלו לבגרות ב -24 צלחות באר, 0.4 mM levamisole בחיץ M9 נוסף לכל באר, ומספר בעלי החיים הנעים נרשם כל 5 דקות במשך שעה אחת. שיתוק המושרה על ידי Levamisole נצפה חזותית לאורך זמן, ולאחר השלמת הבדיקה, הנתונים כומתו. ההערכה של מוטנטים יחד עם סוג פראי C. elegans מאפשרת לתלמידים לבצע תחילה תחזיות לגבי השפעות פנוטיפיות פוטנציאליות ולאחר מכן לבצע ניסויים כדי לבחון את ההשערות שלהם. לסיכום, בדיקת הלבאמיזול הנוזלית הפשוטה, הזולה והזולה הזו היא דרך אידיאלית להדגים את ההשפעה של אובדן גנים ספציפיים על תפקוד NMJ.
Protocol
1. הכנת צלחות למבחן הלבאמיזול
- הכינו מדיה בינונית לצמיחת נמטודה (NGM) על ידי שילוב של 3 גרם NaCl, 2.5 גרם פפטון ו-17 גרם אגר עם 1 ליטר מים שעברו דה-יוניזציה (DI) בבקבוקון עם מוט ערבוב.
- לאחר autoclaving, לשים את התקשורת על צלחת חמה להגדיר 70 מעלות צלזיוס ומערבבים במהירות בינונית במשך 1 שעות.
- הוסף 1 מ"ל של 5 מ"ג / מ"ל כולסטרול טיפה כדי למנוע משקעים, 1 מ"ל של 1 M CaCl2, 1 מ"ל של 1 M MgSO4, ו 25 מ"ל של 1 M pH 6.0 אשלגן פוספט חיץ לתקשורת.
- העבירו 2 מ"ל של מדיית NGM לכל באר של צלחת בת 24 בארות עם פיפטה סרולוגית סטרילית (איור 1).
- תנו לצלחות להתייבש על הספסל במשך יומיים לפני הזריעה עם חיידקים. לאחסון לטווח ארוך יותר, מקם אותם בטמפרטורה של 4 מעלות צלזיוס.
- פזרו את OP50 E. coli על צלחת מרק ליזוגני (LB) וגדלו במשך הלילה בטמפרטורה של 37 מעלות צלזיוס.
- בחרו מושבת OP50 יחידה למרק B (10 גרם של טריפטון ו-5 גרם של NaCl ב-1 ליטר של DI H2O) והניחו את רעידת התרבית בטמפרטורה של 37 מעלות צלזיוס למשך הלילה.
- באמצעות פיפט סטרילי, יש לזרוק 30 μL של תרחיף OP50 על האגר באמצע כל באר (איור 1).
הערה: הקפידו לא לפגוע במשטח האגר מכיוון שהדבר יוביל לחפירת תולעים. - תנו לצלחות לשבת בטמפרטורת החדר לפחות יומיים לאחר הזריעה כדי לאפשר למדשאה חיידקית להיווצר.
הערה: אם החיידקים בבארות המרכזיות אינם יבשים לאחר יומיים, השאירו את הצלחות פתוחות במכסה המנוע למשך 20 דקות (איור 1). את הצלחות יש לשפוך ולזרוע עם חיידקים 1-2 שבועות לפני הבדיקה.
2. סנכרון C. elegans (יום 1)
- לגדל סוג פרא, unc-63(x26), lev-10(x17), ו unc-49(e407) C. elegans לבגרות על צלחות 6 ס"מ, מכין לפחות שמונה צלחות לכל זן. אשרו שיש הרבה מבוגרים לא מורעבים על הצלחות.
הערה: זה פי שניים יותר צלחות לפי הצורך; עם זאת, חשוב שיהיו צלחות גיבוי למקרה שהאצווה הראשונה של ביצים נהרסת במהלך ההלבנה. - צור מאגר M9 פי 10 על-ידי המסת 59.6 גרם של Na 2 HPO 4 (dibasic), 29.9 גרם של KH 2 PO 4 (מונובסיק), 12.8 גרם של NaClו-2.5גרם של MgSO 4 ב-750 מ"ל של מי DI עם ערבוב. לאחר ההמסה, הביאו את עוצמת הקול לנפח של עד 1 ליטר וסנן את השיער. דלל 1:10 ואוטוקלאב כדי ליצור מאגר M9 אחד.
הערה: ניתן ליצור את מאגר M9 1x שבועות או חודשים מראש. - הכן תמיסת הלבנה מתחת למכסה המנוע ביום הסנכרון. מערבבים 10 מ"ל של אקונומיקה (טבלת חומרים), 2.5 מ"ל של 10 N NaOH, ו-37.5 מ"ל של מי DI בצינור חרוטי של 50 מ"ל. יש להרכיב משקפי מגן, כפפות ומעיל מעבדה בכל פעם שעובדים עם תמיסת ההלבנה.
- באמצעות פיפט העברת פלסטיק, יש לשטוף תולעים בוגרות מארבע צלחות לפחות עם חיץ M9 1x ולהעביר אותן לצינור חרוטי של 15 מ"ל.
- סובב ב 716 x g במשך 1 דקה בטמפרטורת החדר, ולאחר מכן להסיר את supernatant באמצעות פיפת העברה.
- מוסיפים 10 מ"ל של תמיסת הלבנה. הפוך או נער בעדינות את הצינור במשך ~4 דקות עד שרוב פגרי התולעים, אך לא כולם, התמוססו (איור 1).
הערה: היזהרו לא להלבין יתר על המידה את התולעים מכיוון שהדבר יהרוס את הביצים. מוטציות מסוימות עלולות להגביר את הקושי בבידוד ביציות. - סובב ב 716 x גרם במשך דקה אחת.
- יוצקים את תמיסת האקונומיקה בתנועה אחת; כל עוד הצינור אינו מזועזע בשלב זה, הביצים יידבקו לצד הצינור.
- הוסף 15 מ"ל של מאגר M9 אחד והפוך. סובבו בעוצמה של 716 x גרם למשך דקה אחת, ושפכו את מאגר M9 בתנועה חלקה אחת.
- בצע שלוש שטיפות בסך הכל עם מאגר M9 אחד, כמתואר בשלב 2.9.
- לאחר השטיפה האחרונה, יש להוסיף 10 מ"ל של 1x M9 טרי ולהניח על סיבוב למשך הלילה בטמפרטורה של 15°C כדי לבודד אוכלוסייה מסונכרנת של חיות שלב הזחל הראשון (L1) המורעבות.
הערה: לפני הנחת על המסובב, בדוק אם יש ביצים במאגר M9. אם לא, חזור על ההכנה עם לוחות גיבוי ואקונומיקה לזמן קצר יותר.
3. ציפוי מסונכרן C. elegans (יום 2)
- הדפיסו מפה של 24 לוחות והקצו זנים למקומות אקראיים. כל זן צריך להיות מיוצג בצלחת 24 באר לפחות שש פעמים.
- כ-24 שעות לאחר הכנת האקונומיקה, סובבו את תולעי L1 המורעבות שבקעו במאגר M9 בטמפרטורה של 716 x גרם למשך דקה אחת בטמפרטורת החדר.
- הסר ~ 9 מ"ל של חיץ M9 עם פיפט העברת פלסטיק, ולאחר מכן לערבב בעדינות את תולעי שלב הזחל הראשון מורעב (L1s) במאגר M9 הנותר.
- מיד pipet 3 μL של התולעים במאגר M9 על שקופית מיקרוסקופ ולקבוע את מספר L1s; המספר הרצוי הוא 20-30 L1s ב-3 μL. סובבו והסירו את M9 אם ריכוז התולעים נמוך מדי, והוסיפו M9 אם הריכוז גבוה מדי.
הערה: בדוק את מספר התולעים לכל 3 μL לפחות 2x, היפוך הצינור בכל פעם. - Pipet 3 μL של L1s (20-30 תולעים בסך הכל) לתוך כל באר על פי מפת צלחת מראש (שלב 3.1; איור 1).
הערה: הפוך את הצינור עם L1s ב- M9 לעתים קרובות כדי לשמור על התפלגות שווה של תולעים מכיוון שהן ישקעו לתחתית. אם זה לא נעשה, כמה בארות יהיה מעט מדי תולעים, בעוד אחרים יהיו יותר מדי. כמו כן, אין לחדור את האגר עם קצה הפיפט מכיוון שזה יגרום לבעלי החיים להתחפר. - תנו לתולעים לגדול לבגרות במשך 3 ימים בטמפרטורה של 20 מעלות צלזיוס.
הערה: השימוש בטמפרטורות גדילה שונות ובמוטציות מסוימות יכול להשפיע על מהירות ההבשלה, לכן הקפד לקחת בחשבון את מחזור החיים של C. elegans.
4. ביצוע בדיקת הלבאמיזול (יום 5)
- הדפס גליון נתונים ריק, שישמש לתיעוד מספר התולעים הנעות בכל באר כל 5 דקות למשך שעה אחת.
הערה: התלמידים יוכלו לספור את התולעים לכל היותר ב-12 בארות כל 5 דקות. 12 הבארות העליונות נבדקות בשעה הראשונה, כאשר 12 הבארות התחתונות נבדקות בשעה שלאחר מכן. - בדוק את התולעים בלוחות 24 הבאר. באמצעות טוש, לעשות "X" על מכסה הצלחת מעל כל בארות שיש להם זיהום, יש רעב, או יש יותר מדי תולעים (>40), אשר יקשה על הספירה.
- צור תמיסת לבאמיזול של 0.4 mM על ידי הוספת 200 μL של מלאי לבאמיזול של 100 mM ל-50 מ"ל של 1x M9. הכינו ציר לבאמיזול של 100 mM על ידי המסת 240.76 מ"ג של לבאמיזול הידרוכלוריד ב-10 מ"ל של H2O ואחסנו אותו בטמפרטורה של −20 מעלות צלזיוס.
הערה: יש לדלל את הלבאמיזול ב-M9; דילול ב- H2O מאיץ שיתוק. התלמידים צריכים ללבוש כפפות. בליעה של ריכוזים גבוהים של לבאמיזול היא רעילה. - הפעל טיימר ולאחר מכן, באמצעות פיפט העברה, להוסיף 1 מ"ל של 0.4 mM levamisole לשתי הבארות הראשונות, כך בעלי החיים שוחים בחופשיות. ממשיכים להוסיף לבמיזול לבארות הסמוכות, תוך הקפדה על הזמן בהתאם למספר הבארות שיש לבחון.
הערה: לדוגמה, אם נבדקות 10 בארות, יתווספו לבמיזול באופן הבא: בארות 1 ו-2 בזמן 0, בארות 3 ו-4 לאחר דקה אחת, בארות 5 ו-6 לאחר 2 דקות, בארות 7 ו-8 לאחר 3 דקות, ובארות 9 ו-10 לאחר 4 דקות. - לאחר 5 דקות, התחילו לספור ידנית רק את מספר התולעים הנעות בכל באר, החל מהבאר הראשונה, ותרשמו את המספר הזה בגליון הנתונים (איור 1). ניתן להשתמש במונים אך אינם נדרשים כדי לקבוע במדויק את מספר התולעים הנעות.
הערה: התלמידים צריכים לפקוח עין על הטיימר מכיוון שלעתים הם מפגרים בנקודות זמן מוקדמות לפני שתולעים רבות משתתקות. ניתן להתאים את מספר נקודות הזמן, או לבחון פחות בארות בכל נקודת זמן במידת הצורך. - המשך לספור את מספר התולעים הנעות בכל באר כל 5 דקות במשך שעה אחת.
הערה: טבילה ב-M9 גורמת לתנועת שחייה מתמדת במהלך בדיקה זו של שעה אחת, מה שמבטל את הצורך בהתנודדות של התולעים כדי להעריך שיתוק (איור 2A). חשיפה לתמיסת לבאמיזול 0.4 mM גורמת לשיתוק תלוי זמן כפי שנצפה על ידי הפסקת השחייה; תולעים המשתקות אינן מתאוששות. - חזור על שלבים 4.4.-4.6. לשאר הבארות בצלחת.
- בסוף הבדיקה, או כאשר הזמן מאפשר, לרשום את המספר הכולל של תולעים בכל באר.
5. ניתוח נתונים
- השג את מפת הלוחות (שלב 3.1.) ורשום איזה זן מתאים לכל באר.
הערה: בשל כמות הנתונים שנאספו, הניתוח והדיון הבאים בנתונים יימשכו לפחות כמה שעות. - הזן את הנתונים לגיליון אלקטרוני, החל מהמספר הכולל של התולעים בכל באר וארגון לפי גנוטיפ.
- שילוב נתונים מהבארות, קובע את מספר התולעים הנעות בכל נקודת זמן עבור כל זן.
- השתמשו בנתונים האלה כדי ליצור "עקומת הישרדות" בתוכנה הסטטיסטית (Table of Materials) כדי להציג באופן חזותי את השיתוק תלוי הזמן של האוכלוסייה (איור 2B).
- צור טבלת נתונים כך שהעמודה הימנית תציין זמן והעמודות הבאות יכילו את הנתונים עבור כל זן. עבור כל בעל חיים המשותק בתוך 5 הדקות הראשונות, צור שורה והזן "1" למשך 5 דקות. חזור על פעולה זו עבור כל נקודת זמן. עבור כל בעלי החיים שאינם משותקים עד סוף הבדיקה, הזן "0" למשך 60 דקות.
- בצע השוואות זוגיות באמצעות מבחן לוג-דרגה (Mantel-Cox) בתוכנה הסטטיסטית (Table of Materials) כדי לקבוע אם יש הבדל מובהק סטטיסטית בין שני זנים שונים.
- לניתוח נוסף/חלופי, במקום לבצע את שלב 5.3. ושלב 5.4., לקבוע את אחוז בעלי החיים הנעים בכל באר בכל נקודת זמן. התווה את הממוצע עם שגיאת תקן בכל נקודת זמן עבור כל הזנים שנבדקו באמצעות תוכנית גיליון אלקטרוני או התוכנה הסטטיסטית (איור 2C).
תוצאות
איתות באמצעות קולטני AChRs ו-GABA מאפשר לשרירים בצד אחד של גוף ה-C. elegans להתכווץ בעוד השרירים בצד השני נרגעים, מה שמאפשר תנועה מתואמת 6,16. קשירת הלבאמיזול ל-L-AChRs היונוטרופי גורמת להתכווצות, מה שמוביל לשיתוק תלוי זמן של חיות בר. כאן, הערכנו את הרגישות של סוג פראי, מוטנט unc-63 L-AChR, מוטנט אשכולות lev-10 L-AChR, ומוטנט קולטן unc-49 GABAA C. elegans ללבמיזול. מוטציות בתת-יחידות של L-AChR, כמו גם בגנים הדרושים לסחר ב-L-AChRs לקרום הפלזמה של השריר, התקבצות של L-AChRs פוסט-סינפטי ואיתות Ca 2+ במורד הזרם, גורמות לעמידות לשיתוק הנגרם על-ידי לבאמיזול 7,8,9,10,11,16,17, כפי שנצפה במוטציות unc-63 ו-lev-10 (איור2B ג). אובדן תעלת היונים המגודרת GABA UNC-49 גרם לרגישות יתר של הלבאמיזול (איור 2B,C) עקב הפרעה באיזון הנכון של איתות כולינרגי ו-GABAergic12. כאשר בדיקה זו בוצעה לאחרונה על ידי סטודנטים לתואר ראשון במעבדה גנטית מתקדמת, 100% מהסטודנטים צפו בהתנגדות לבאמיזול עם המוטנטים unc-63 ו- lev-10, בעוד 88% צפו ברגישות יתר של לבאמיזול עם מוטנט unc-49. נתונים אלה שנאספו עם בדיקת השחייה של הלבאמיזול הנוזלי עולים בקנה אחד עם הפנוטיפים שנצפו במבחני לבאמיזול מסורתיים על בסיס צלחת 7,8,11,12,13.
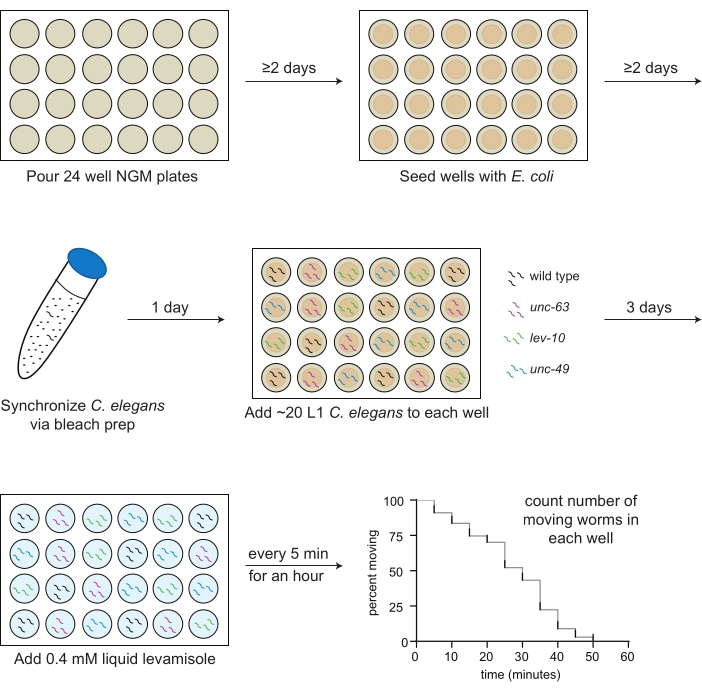
איור 1: סכמת הכנה ויישום של בדיקת לבאמיזול. 24-באר צלחות NGM הם שפכו; יומיים לאחר מכן, OP50 Escherichia coli נזרע לתוך הבארות. C. elegans מסונכרנים באמצעות הכנת אקונומיקה, וחיות שלב הזחל הראשון (L1) עבור כל זן שיש לבחון (סוג פראי, שחור; UNC-63(x26), מגנטה; LEV-10(x17), ירוק; UNC-49(E407), כחול) מוזרמים לתוך הבארות על פי מפת לוחות קבועה מראש למחרת. לאחר 3 ימים של צמיחה ב 20 מעלות צלזיוס, או כאשר בעלי החיים מגיעים לבגרות, 0.4 mM levamisole ב M9 חיץ מתווסף לכל באר, ואת מספר בעלי החיים נעים נספר כל 5 דקות במשך 1 שעה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
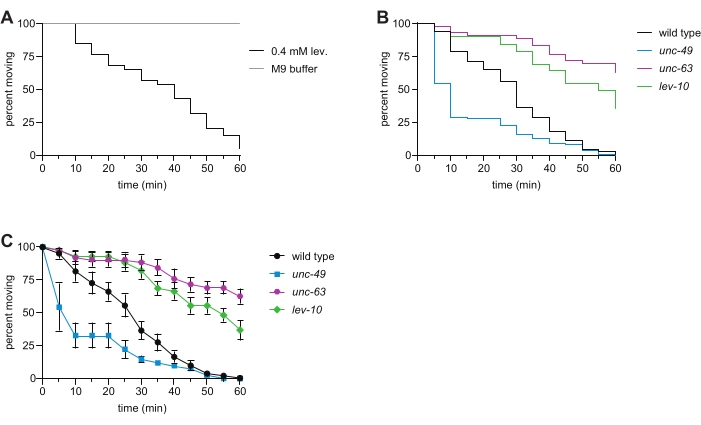
איור 2: שיתוק הנגרם על-ידי לבמיזול בסוג בר ומוטציה מייצגת C. elegans. (A) חשיפה ל-0.4 mM levamisole גורמת לשיתוק תלוי זמן; זה לא נצפה עבור בעלי חיים ששוחים במאגר M9 1x במשך שעה אחת. (B) שיתוק תלוי זמן של בעלי חיים מסוג בר (שחור), unc-63(x26 ) (מגנטה), lev-10(x17 ) (ירוק) ו- UNC-49(E407) (כחול) במבחן השחייה Levamisol. אובדן תת-היחידה L-AChR UNC-63 או L-AChR של חלבון האשכולות LEV-10 הביא לעמידות לבאמיזול, ואובדן קולטן GABAA UNC-49 גרם לרגישות יתר של לבאמיזול. n ≥ 50 לכל גנוטיפ, p < 0.0001 עבור כל המוטנטים בהשוואה לסוג הבר בניסוי מייצג זה. (C) באמצעות אותם נתונים כמו בלוח (B), אחוז בעלי החיים הנעים בכל נקודת זמן (ממוצע האחוזים עבור כל באר ± SE) נקבע עבור כל זן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
תגובה שונה ללבמיזול יכולה לזהות גנים הדרושים לאיתות כולינרגי פוסט-סינפטי ולתפקוד השרירים. הפרוטוקול כאן מתאר בדיקת לבמיזול נוזלי המשמשת לשיתוק כמותי תלוי זמן על פני פרק זמן של שעה. התלמידים מבצעים תחזיות לגבי ההשפעות של מוטציות גנטיות מסוימות, מבצעים ניסוי עם גודל מדגם גדול, ולאחר מכן מכמתים את התוצאות שלהם. בדיקה זו היא דרך פשוטה ויעילה לכמות שיתוק הנגרם על ידי לבאמיזול מבלי לקטוף או לעודד בעלי חיים, מה שהופך אותה למתאימה למעבדות לתואר ראשון, כמו גם לחוקרים החוקרים העברה עצבית-שרירית. נדון כאן בכמה מהמלכודות הנפוצות ביותר, מגבלות הבדיקה, ווריאציה לפרוטוקול המאפשרת את השימוש בה עם חיות RNAi; כמו כן, נדון כאן כיצד ניתן להטמיע מבחן זה בחוויית מחקר לתואר ראשון מבוססת קורסים.
הכנה נכונה של 24 צלחות באר היא חיונית. ראשית, מדשאות חיידקים חייבות להיות יבשות לחלוטין לפני שמזהים חיות L1 בבארות. אם לא מיובשים מספיק, החיידקים מתערבבים עם תמיסת הלבאמיזול במהלך הבדיקה, הופכים את הנוזל לעכור ומונעים מאנשים את היכולת לספור את התולעים. שנית, כאשר מסנכרנים תולעים באמצעות הכנת אקונומיקה, אסור לבעלי החיים להיחשף לתמיסת האקונומיקה למשך זמן רב מדי, שכן הדבר יגרום לציפוי המגן על הביצים להתפורר. שלישית, חשוב מאוד לזהות רק 20-30 L1s לכל באר, מכיוון שתולעים רבות מדי בבארות מקשות מאוד על ספירה מדויקת של המספר הנע בזמן המוקצב. לבסוף, חשוב לשמור על טכניקה אספטית במהלך הכנת הצלחות כמו בארות מזוהמות לא ניתן לבחון.
ישנן מספר מגבלות שיש לקחת בחשבון בעת ביצוע בדיקה זו. ראשית, ספירת מספר התולעים הנעות בכל באר כל 5 דקות עשויה להיות מכריעה עבור אנשים חסרי ניסיון קודם במעבדה, וזה עלול להוביל לאיסוף נתונים לא מדויק. באשר למבחנים אחרים המשמשים לקביעת רגישות לתרופות18,19, ניסוי זה יכול להתבצע עם פחות נקודות זמן. שנית, ציפוי של L1s מורעבים שבודדו מהכנת אקונומיקה הוא שיטה קלה להשגת אוכלוסייה מסונכרנת; עם זאת, יש לבצע התאמות אם התזמון ההתפתחותי שונה בין הזנים הנבדקים. ניתן לבחור חיות שלב זחל רביעיות מאוחרות (L4s) לצלחת בת 24 בארות לצורך בדיקה זו; עם זאת, כאשר מכינים צלחות רבות, זה דורש עבודה רבה מדי. לחלופין, יש לקבוע את משך הזמן שלוקח לכל זן להגיע ל-L4 ולאחר מכן למקם את ה-L1s לתוך הבארות בזמנים שונים כדי להתאים את עצמו להבדלים במהירות ההבשלה. לבסוף, בעוד שניתן להשתמש בבדיקה זו כדי לזהות גנים חדשים החשובים לתפקוד השרירים הפוסט-סינפטיים11, תגובת הלבאמיזול שהשתנתה יכולה להיגרם גם על ידי מוטציה או RNAi של גנים קדם-סינפטיים12. אם נצפתה רגישות לבאמיזול משתנה, יש לבצע ניסויים נוספים כדי לקבוע את הסיבה לפנוטיפ זה.
על ידי ביצוע כמה שינויים בלוחות 24 הבארות, ניתן לבצע את בדיקת השחייה המתוארת של הלבאמיזול גם על חיות RNAi11. ניתן להשיג פגיעה גנטית באמצעות RNAi על ידי הזנת חיידקי C. elegans המבטאים RNA דו-גדילי המתאים לגן המעניין20. להכנת לוחות RNAi, יש להוסיף 1 מ"ל של 1M IPTG ו 1 מ"ל של 25 מ"ג / מ"ל קרבניצ'ילין לליטר מדיה לאחר הסרת autoclave. תרביות חיידקים גדלות על ידי איסוף מושבה אחת לתוך 3 מ"ל של מרק LB בתוספת 3 μL של 25 מ"ג/מ"ל קרבניצילין, ורעידות בטמפרטורה של 37 מעלות צלזיוס במהלך הלילה, ומפת הצלחות נעשית כאשר החיידקים השונים מזוהים בבארות. C. elegans מסונכרנים על ידי הכנה אקונומיקה כמתואר; עם זאת, יש להשתמש בזן ה-RNAi הרגיש ל-eri-1(mg366) במקום בזן הפראי כדי להגביר את ההפלה של הגנים. הדחות RNAi גורמות לאותם פנוטיפים של לבאמיזול שנצפו עבור מוטנטים של אובדן תפקוד11.
הפרוטוקול המוצג כאן יכול לשמש במחקר מעבדה, כניסוי עצמאי במעבדה לתואר ראשון, או בשבועות הפתיחה של קורס מתקדם לתואר ראשון כמבוא לטכניקות בסיסיות של C. elegans ולתפקוד עצבי-שרירי. בקורס מתקדם יותר המבוסס על תגליות, התלמידים יכולים להשתמש במבחן זה כדי לקבוע אם אובדן של C. elegans הומולוגים של גנים שעברו מוטציה אצל אנשים עם תסמונות מיאסטניות, דיסטרופיות שרירים או מיופתיות משנה את הרגישות לבאמיזול. לסיכום, מבחן רגישות הלבאמיזול הפשוט והזול הזה מספק גישה מעשית ללמידה על איתות ב- NMJ וצבירת ניסיון בעבודה עם מערכת המודל של C. elegans.
Disclosures
למחברים אין ניגוד עניינים.
Acknowledgements
אנו מודים לריה דטאני ולורן הוגסטרום, שאספו את הנתונים באיור 2B,C עיוור לגנוטיפ במעבדה לגנטיקה מתקדמת BISC413 (אביב 2022) באוניברסיטת דלאוור. מידע נוסף על חוויית המחקר לתואר ראשון (CURE) המבוססת על קורס BISC413, כמו גם גישה למדריך המעבדה שתוכנן על ידי J. Tanis, זמין על פי בקשה. זני נמטודה סופקו על ידי המרכז לגנטיקה של Caenorhabditis , הנתמך על ידי NIH-ORIP (P40 OD010440). עבודה זו נתמכה על ידי P20 GM103446 דלאוור INBRE מנטורד CURE פרס (ל- J.E.T.).
Materials
| Name | Company | Catalog Number | Comments |
| 60 mm non-vented, sharp edge Petri Dishes | TriTech Research | Cat #: T3308 | |
| BD Difco Bacto Agar | Fisher Scientific | Cat#: DF0140-01-0 | |
| BioLite 24 Well Multidish | Fisher Scientific | Cat#:12-556-006 | |
| Calcium Chloride Dihydrate | Fisher Scientific | Cat#: BP510-500 | |
| Cholesterol | MP Biomedicals | Cat#: 02101382-CF | |
| eri-1(mg366) | Caenorhabditis Genetics Center (CGC) | GR1373 | |
| Gibco Bacto Peptone | Fisher Scientific | Cat#: DF0118-17-0 | |
| Gibco Bacto Tryptone | Fisher Scientific | Cat#: DF0123-17-3 | |
| GraphPad Prism (Statistical software) | GraphPad Software, Inc. | ||
| lev-10(x17) | Caenorhabditis Genetics Center (CGC) | ZZ17 | |
| Levamisole hydrochloride | Fisher Scientific | Cat#: AC187870100 | |
| Low Splash Regular Bleach - 121oz - up & up | Target | Search target.com | |
| Magnesium Sulfate Heptahydrate | Fisher Scientific | Cat#: BP213-1 | |
| Microsoft Excel | Microsoft, Inc | ||
| N2 wild type | Caenorhabditis Genetics Center (CGC) | Bristol N2 | |
| OP50 E. coli | Caenorhabditis Genetics Center (CGC) | OP50 | |
| Potassium Phosphate Dibasic | Fisher Scientific | Cat#: BP363-1 | |
| Potassium Phosphate Monobasic | Fisher Scientific | Cat#: BP362-500 | |
| Sodium Chloride (NaCl) | Fisher Scientific | Cat#: BP358-1 | |
| Sodium Hydroxide 10N | Fisher Scientific | Cat#: SS255-1 | |
| Sodium Phosphate Dibasic | Fisher Scientific | Cat#: BP332-1 | |
| unc-49(e407) | Caenorhabditis Genetics Center (CGC) | CB407 | |
| unc-63(x26) | Caenorhabditis Genetics Center (CGC) | ZZ26 |
References
- Engel, A. G., Shen, X. M., Selcen, D., Sine, S. M. Congenital myasthenic syndromes: Pathogenesis, diagnosis, and treatment. The Lancet Neurology. 14 (4), 420-434 (2015).
- Mahjneh, I., Lochmüller, H., Muntoni, F., Abicht, A. DOK7 limb-girdle myasthenic syndrome mimicking congenital muscular dystrophy. Neuromuscular Disorders. 23 (1), 36-42 (2013).
- Rodríguez Cruz, P. M., et al. Congenital myopathies with secondary neuromuscular transmission defects; A case report and review of the literature. Neuromuscular Disorders. 24 (12), 1103-1110 (2014).
- Montagnese, F., et al. Two patients with GMPPB mutation: The overlapping phenotypes of limb-girdle myasthenic syndrome and limb-girdle muscular dystrophy dystroglycanopathy. Muscle and Nerve. 56 (2), 334-340 (2017).
- Gieseler, K., Qadota, H., Benian, G. M. Development, structure, and maintenance of C. elegans body wall muscle. WormBook. , 1-59 (2017).
- Richmond, J. E., Jorgensen, E. M. One GABA and two acetylcholine receptors function at the C. elegans neuromuscular junction. Nature Neuroscience. 2 (9), 791-797 (1999).
- Lewis, J. A., Wu, C. H., Berg, H., Levine, J. H. The genetics of levamisole resistance in the nematode Caenorhabditis elegans. Genetics. 95 (4), 905-928 (1980).
- Gally, C., Eimer, S., Richmond, J. E., Bessereau, J. L. A transmembrane protein required for acetylcholine receptor clustering in Caenorhabditis elegans. Nature. 431 (7008), 578-582 (2004).
- Eimer, S., et al. Regulation of nicotinic receptor trafficking by the transmembrane Golgi protein UNC-50. The EMBO Journal. 26 (20), 4313-4323 (2007).
- Gendrel, M., Rapti, G., Richmond, J. E., Bessereau, J. L. A secreted complement-control-related protein ensures acetylcholine receptor clustering. Nature. 461 (7266), 992-996 (2009).
- Chaya, T., et al. A C. elegans genome-wide RNAi screen for altered levamisole sensitivity identifies genes required for muscle function. G3: Genes, Genomes, Genetics. 11 (4), 047 (2021).
- Vashlishan, A. B., et al. An RNAi screen identifies genes that regulate GABA synapses. Neuron. 58 (3), 346-361 (2008).
- Krajacic, P., Pistilli, E. E., Tanis, J. E., Khurana, T. S., Lamitina, S. T. FER-1/Dysferlin promotes cholinergic signaling at the neuromuscular junction in C. elegans and mice. Biology Open. 2 (11), 1245-1252 (2013).
- Gottschalk, A., et al. Identification and characterization of novel nicotinic receptor-associated proteins in Caenorhabditis elegans. The EMBO Journal. 24 (14), 2566-2578 (2005).
- Loria, P. M., Hodgkin, J., Hobert, O. A conserved postsynaptic transmembrane protein affecting neuromuscular signaling in Caenorhabditis elegans. The Journal of Neuroscience. 24 (9), 2191-2201 (2004).
- Treinin, M., Jin, Y. Cholinergic transmission in C. elegans: Functions, diversity, and maturation of ACh-activated ion channels. Journal of Neurochemistry. 158 (6), 1274-1291 (2021).
- Rapti, G., Richmond, J., Bessereau, J. L. A single immunoglobulin-domain protein required for clustering acetylcholine receptors in C. elegans. The EMBO Journal. 30 (4), 706-718 (2011).
- Kim, S., Sieburth, D. A receptor tyrosine kinase network regulates neuromuscular function in response to oxidative stress in Caenorhabditis elegans. Genetics. 211 (4), 1283-1295 (2019).
- Oh, K., Kim, H. Aldicarb-induced paralysis assay to determine defects in synaptic transmission in Caenorhabditis elegans. Bio-Protocol. 7 (14), 2400 (2017).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved