需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
建立稳健且可重复的辐射诱导皮肤和肌肉纤维化模型
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种方案,在小鼠后肢诱导辐射诱导的皮肤纤维化, 并通过 肢体偏移和步态指数分析对慢性损伤进行照射后测量,以评估功能结果。该模型阐明了与辐射相关的皮肤纤维化机制,可用于亚临床治疗研究。
摘要
辐射诱发的皮肤纤维化 (RISF) 可能由多种情况引起,包括癌症治疗、意外暴露或恐怖主义行为。放射性束可以穿透皮肤并影响其路径上的结构,包括皮肤、肌肉和内脏器官。皮肤是第一个受到辐射的结构,容易患上慢性纤维化,这很难治疗。目前,有限的治疗选择在减轻与辐射相关的皮肤纤维化方面显示出中等疗效。阻碍有效对策开发的一个关键因素是缺乏一个方便而强大的模型,可以将实验结果转化为人类。在这里,已经建立了一个稳健且可重复的小鼠后肢皮肤纤维化模型,用于预防和治疗评估可能的功能和分子恢复药物。
使用单剂量 40 (Gray) Gy 照射右后肢以诱导皮肤纤维化。受试者在早期出现水肿和皮炎,并伴有可见的皮肤收缩。在接下来的几周内,接受照射的肢体活动范围显着减少。在晚期,急性副作用消退,但慢性纤维化持续存在。步态指数作为额外的功能测定进行,证明功能障碍的发展。这些非侵入性方法证明了追踪纤维化进展的可靠测量方法,这得到了组织学分析的支持。该模型中采用的辐射剂量、应用和照射后分析为研究辐射诱导的皮肤纤维化和测试治疗剂的疗效提供了一种有力且可重复的方法。
引言
皮肤是身体最大的器官,覆盖并保护身体免受危害。它有三个不同的层:表皮、真皮和皮下层。每一层都有其独特的功能:表皮防止脱水和微生物入侵;真皮具有丰富的细胞网络,以及提供拉伸强度和弹性的细胞外基质1;真皮层包含感觉受体、毛囊、腺体以及用于淋巴和毛细血管网络的血管。皮下组织或皮下组织拥有丰富的脂肪组织,塑造身体轮廓并分布机械应力 2,3,4。
由于事故、战争、恐怖主义或治疗应用而产生的辐射以线性渐进的性质渗透到体内,导致皮肤成为第一个接触的器官。由于工业、医疗设施和军事设施中放射性物质的使用增加,此类事件的威胁加剧了5。临床上,皮肤辐射损伤的特征是皮肤辐射综合征 (CRS),这是急性辐射综合征 (ARS) 的四个子综合征之一。皮肤对电离辐射的反应对治疗和保护免受进一步损伤具有重要意义6。当与辐射损伤相结合时,烧伤和创伤等伴随伤害会使临床结果进一步复杂化7。皮肤暴露于辐射的程度与不归点阈值相关,在该阈值下,其他器官的损害会导致单个或多个器官衰竭,并最终导致患者死亡 8,9。皮肤放射损伤包括急性期和慢性期。急性放射性损伤临床表现为红斑、皮肤水肿、皮炎、水疱、表皮剥脱、干性或湿性脱屑、溃疡以及头发和指甲的变化。慢性期表现为皮肤萎缩、纤维化、慢性溃疡和毛细血管扩张10,11。一般来说,急性影响主要表现在表皮,而慢性影响在真皮中最为突出。对辐射暴露的急性反应导致暴露后 12 小时内有丝分裂活性显着降低,随后出现充血、细胞增大、空泡化、核裂和碎裂 4,12。
超过 40 Gy 的辐射剂量会导致湿性脱屑和表皮脱落,导致对感染的易感性增加13。此外,皮肤暴露于辐射会诱导细胞因子的产生,从而触发真皮层的炎症免疫反应。主要的炎症介质包括白细胞介素(IL-1、IL-3、IL-5、IL-6 和 IL-8)和肿瘤坏死因子-α (TNFα)14。炎症消退失败最终会导致放射损伤部位纤维化发展15。额外的物理伤口或热损伤进一步加剧了这种纤维化反应,延伸到肌肉层16。转化生长因子-β (TGFβ) 是纤维化发展中的关键细胞因子17。目前,很少有治疗方案显示出有希望的结果,而且大多数治疗方案可能在患者依从性方面面临挑战。进一步探索皮肤对不同辐射剂量的细胞和分子反应的研究将提高对辐射诱导的皮肤病理生理学的理解,并促进新疗法的开发。
为了促进临床前模型中研究结果的临床转化,以减轻辐射引起的皮肤和软组织损伤,设计照射后治疗干预的高度相关的实验模型至关重要。已经描述了辐射诱导损伤的体外和体内模型,包括辐照内皮细胞18,19、成纤维细胞20 或角质形成细胞19 的细胞培养模型,以及体内啮齿动物、猪和非人灵长类动物模型。啮齿动物模型被广泛用于辐射研究,因为它们在响应辐射损伤方面与人类相似,并且它们的基因作具有灵活性21。在寻求相似结果时,啮齿动物的辐射剂量要求高于人类:脱屑、纤维化和坏死16,22。衡量对辐射反应的评分标准的描述进一步促进了辐射皮肤损伤啮齿动物模型的采用21,23。
目前临床前研究的重点是了解辐射诱导的皮肤损伤的机制和开发治疗方案。因此,建立一个稳健且可重复的临床前模型来创建具有高临床可转化性的辐射损伤至关重要。这项工作描述了一种具有优化辐射剂量和输送技术的皮肤纤维化小鼠模型。我们的模型结合了功能、组织学和分子测量,可用于有效研究纤维化发展的机制并研究新的治疗方案。
Access restricted. Please log in or start a trial to view this content.
研究方案
合乎道德的动物使用得到了机构动物护理和使用委员会 (IACUC) 的批准,该委员会根据《动物福利法》行事。动物被安置在国际实验动物护理评估和认证协会 (AAALAC) 批准的设施中,并根据美国国立卫生研究院实验动物护理和使用指南进行处理。
1. 麻醉
- 将小鼠放入小动物麻醉系统的盒子中(图 1)。将 4% 异氟醚输送到盒子中并等待 5-10 分钟,此时将异氟醚降低到 2-3%。
- 通过捏住脚趾确认麻醉深度。涂抹眼部润滑剂以防止干燥。将受试者移动到异氟醚流速为 2% 的鼻锥上。
- 使用上述技术麻醉每只小鼠进行剃须和肢体测量测定。使用 1.25 mg/kg 的腹膜内戊巴比妥注射剂量麻醉小鼠进行照射。
2. 皮肤区域准备
- 计划在照射前 2-3 天给小鼠剃毛。使用剪刀修剪头发(图 2A)。
- 涂抹脱毛霜并等待 1-2 分钟(图 2B)。用干纱布擦拭乳霜,然后用磷酸盐缓冲盐水 (PBS) 浸泡的纱布冲洗皮肤(图 2C)。
3. 照射程序
- 在照射前 5 分钟用腹膜内注射麻醉每只小鼠。将肢体放置在辐射野 (25 cm x 25 cm) 中并用手术胶带固定(图 3A-C)。
- 使用手术胶带限制身体(图 3D)。放置 1 cm 厚的推注以防止/尽量减少辐射的深度穿透(图 3E)。
- 计算涂抹器和切口因子,将 40 Gy 输送到小鼠皮肤。对于这里的实验,使用直线加速器为 3740 个监控单元生成 6 MeV 电子束,以诱导照射灼伤。在这种情况下,25 cm x 25 cm 的辐射野,剂量为 1,000 MU/min,源到表面的距离 (SSD) 为 100 cm,即从照射源到推注顶部的距离,以输送 40 Gy。照射时间将根据使用的直线加速器、光束能量和磁场大小而变化。应咨询放射或医学物理学家,以计算在直线加速器上提供 40Gy 所需的监测单元。
4. 纤维化发展的目视监测
- 使用手持式数码相机记录纤维化的进展。使用微距设置拍摄详细的照片。
- 通过吸入异氟醚麻醉小鼠。
- 通过将镜头靠近皮肤的位置并按下 Capture(捕捉)按钮来拍照。尽量保持照片的一致性。让受试者处于直接监督下,直到恢复足够的意识来维持胸骨卧位。
5. 测量腿部偏移作为纤维化的功能结果
- 从照射后第 3 周开始,计划每周进行测量,最多 6 周。
- 如上所述开始并维持麻醉。在鼻锥前面准备一个区域,并在中心用胶带固定一个量角器(图 4A)。
- 将鼠标转移到场地上,轻轻地将鼠标的鼻子放在圆锥体上。将右膝盖放在量角器的中心(图 4B)。
- 用左手固定膝盖,用右手用食指和花粉指使脚背屈(图 4C,D)。
- 通过阅读脚趾指示的值来记下伸展程度。对侧未照射的腿执行相同的程序。
6. 步态功能指标的测量
- 3D 打印啮齿动物步行道,创建一条 40 厘米的步行道,悬挂在 15 厘米的高度,地板透明(图 5)。在轨道下方放置一个录像机并开始拍摄。摄像机经过调整,以尽可能高的分辨率和每秒 60 帧的最小帧速率录制视频。
- 打开轨道的一端,然后将鼠标转移到其中。让动物在轨道上自由行走。捕捉动物尽可能平稳地行走至少 3 次。
- 在录制下一个鼠标之前检查视频的质量。
- 将视频传输到带有视频播放器、屏幕截图应用程序、图像处理程序和电子表格软件的计算机。观看录像,使用屏幕截图功能捕获三种不同的清晰足迹(图 6)。
- 打开图像处理程序进行脚趾展开测量。从上部面板中选择 File 并单击 Open 以查找并显示要分析的图像。
- 从上面板的第二行中选择 Straight Line Tool (图 7_1)。使用此工具,标记墙壁宽度并单击 Analyze > Set Scale,然后输入已知距离的精确值以校准比例尺(图 7_2-5)。
- 使用 直线工具 标记不同测量的足迹(图 6C、D;1:脚长,2:外趾张开,3:内趾张开),选择 分析>测量,并记录长度值(图 8)。
- 对受照射和未受照射的肢体执行分析。使用之前发布的以下公式来评估功能24
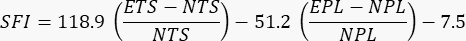
其中 SFI = 坐骨神经功能指数,E = 实验性或受伤的爪子,N = 正常或未受伤的爪子,TS = 脚趾张开,PL = 印记长度。
7. 安乐死
- 将对象转移到 CO2 线路连接盒中。开始 CO2 输注,使腔室内浓度达到 30%-70%。对于 5 L 腔室,气体注入必须在 1.5-3.5 L/min 之间。
- 等待动物停止呼吸 5-10 分钟。通过将头部从颅底固定到位并用力拉动尾巴 , 通过宫颈脱位实施安乐死25.
8. 组织学和下游分析 17
- 拉动受照射的后肢,为切除做准备。选择距极端皮肤后平面 2 cm x 1 cm 的区域。
- 使用一把锋利的剪刀仔细收集皮肤样本。将组织从长轴切成两半,以获得两个单独的部分。
- 将一块组织块固定在 10% 福尔马林缓冲盐水中。处理固定组织以在载玻片上制备组织学切片。
- 将第二块转移到装满干冰的盒子中,以保存蛋白质和 RNA。然后,将组织样品快速转移到 -80 °C 冰箱中并保持冷冻状态直至进一步处理。
- 对载玻片进行苏木精和伊红 (H&E) 染色以及 Masson 三色染色。在显微镜下观察染色的载玻片,并使用 10 倍放大倍率拍摄图像。如上所述,使用图像处理软件测量上皮厚度,用于步态功能测定。
9. 统计
- 将数据表示为平均值±标准差。使用方差分析 (ANOVA) 后跟 Bonferroni 多重比较检验或学生 t 检验来评估结果。
Access restricted. Please log in or start a trial to view this content.
结果
当前照射方案的建立和优化导致小鼠纤维化诱导的一致性和可重复性。照射当天将小鼠的右肢定位并固定在放射野内,并给予 40 Gy 的放射。
通过照射后每周捕获图像来监测皮肤功能障碍的发展。照片显示,优化方案在第 40 天产生纤维化,置信度为 95%。纤维化进展的一个例子,由受照射皮肤的可见收缩阐明,如图 9 所示。
Access restricted. Please log in or start a trial to view this content.
讨论
皮肤损伤可能是意外或医疗相关辐射暴露的结果。由于人为错误或切尔诺贝利和福岛等自然灾害,核反应堆存在意外突破风险26,27。癌症治疗的治疗剂量是最常见的暴露,它使用分次重复给药方案,有可能在治疗区域导致辐射相关纤维化。这种常见的慢性不良反应可在高达 23% 的病例中普遍存在16,28
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有与本作品相关的竞争性经济利益或其他利益冲突。
致谢
这项工作由国防部 W81XWH-19-PRMRP-DA、NIAID/NIH 赠款 5R21AI153971-02 和 PSF/MTF 赠款 603902的研究资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 10% Formalin | Fischer Scientific | 23-427098 | |
| Bolus | Orfit | 8333.SO1/R | |
| Clipper | Kent Scientific Corp. | CL8787-KIT | |
| CO2 | Various | ||
| CO2 Chamber | E-Z Systems Inc. | E-22000 | |
| Depilatory Cream | Church & Dwight Co., Inc. | Nair | |
| Digital Camera | Wolfang | GA100 | |
| Eppendrof Tubes | Eppendorf | 22364111 | |
| Eye Lubricant | Dechra | Puralube Ophthalmic Ointment | |
| Gauze | Covidien | 682252 | |
| Image Processing Program | NIH | Image J | |
| Isoflurane | Dechra | USP Inhalation Anesthetic | |
| Linear Accelaerator | Varian Medical Systems, Inc. | 23EX | |
| PBS | Cytiva | SH30256.LS | |
| Pentobarbital | Akorn Pharmaceuticals | Nembutal | |
| Protractor | Westcott | 550-1120 | |
| Small Animal Anesthesia System | E-Z Systems Inc. | EZ-SA800 | Single animal system |
| Spreadsheet Software | Microsoft | Excel | |
| Surgical Scissors | Medline | MDS0834111 | |
| Surgical Tape | 3M | 1538-1 | |
| Tape | 3M | H-1113 |
参考文献
- Breitkreutz, D., Mirancea, N., Nischt, R. Basement membranes in skin: unique matrix structures with diverse functions. Histochemistry and Cell Biology. 132 (1), 1-10 (2009).
- Kim, J. -S., et al. Comparison of skin injury induced by β-and γ-irradiation in the minipig model. Journal of Radiation Protection and Research. 42 (4), 189-196 (2017).
- Kolarsick, P. A., Kolarsick, M. A., Goodwin, C. Anatomy and physiology of the skin. Journal of the Dermatology Nurses' Association. 3 (4), 203-213 (2011).
- von Essen, C. F. Radiation tolerance of the skin. Acta Radiologica: Therapy, Physics, Biology. 8 (4), 311-330 (1969).
- Dainiak, N., et al. Literature review and global consensus on management of acute radiation syndrome affecting nonhematopoietic organ systems. Disaster Medicine and Public Health Preparedness. 5 (3), 183-201 (2011).
- Hopewell, J. The skin: its structure and response to ionizing radiation. International Journal of Radiation Biology. 57 (4), 751-773 (1990).
- Flynn, D. F., Goans, R. E. Nuclear terrorism: triage and medical management of radiation and combined-injury casualties. Surgical Clinics. 86 (3), 601-636 (2006).
- Peter, R. Cutaneous radiation syndrome in multi-organ failure. The British Journal of Radiology. 78 (1), 180-184 (2005).
- Meineke, V. The role of damage to the cutaneous system in radiation-induced multi-organ failure. The British Journal of Radiology. 78 (1), 95-99 (2005).
- Berger, M., Christensen, D., Lowry, P., Jones, O., Wiley, A. Medical management of radiation injuries: current approaches. Occupational Medicine. 56 (3), 162-172 (2006).
- Ralf, U. P., Petra, G. Management of cutaneous radiation injuries: diagnostic and therapeutic principles of the cutaneous radiation syndrome. Military Medicine. 167, 110-112 (2002).
- Bray, F. N., Simmons, B. J., Wolfson, A. H., Nouri, K. Acute and chronic cutaneous reactions to ionizing radiation therapy. Dermatology and Therapy. 6 (2), 185-206 (2016).
- Mendelsohn, F. A., Divino, C. M., Reis, E. D., Kerstein, M. D. Wound care after radiation therapy. Advances in Skin & Wound. 15 (5), 216-224 (2002).
- Peter, R. U. Radiation Treatment and Radiation Reactions in Dermatology. , Springer. 185-188 (2015).
- Ejaz, A., Greenberger, J. S., Rubin, P. J. Understanding the mechanism of radiation induced fibrosis and therapy options. Pharmacology & Therapeutics. 204, 107399(2019).
- Williams, J. P., et al. Animal models for medical countermeasures to radiation exposure. Radiation research. 173 (4), 557-578 (2010).
- Ejaz, A., Epperly, M. W., Hou, W., Greenberger, J. S., Rubin, J. P. Adipose-derived stem cell therapy ameliorates ionizing irradiation fibrosis via hepatocyte growth factor-mediated transforming growth factor-beta downregulation and recruitment of bone marrow cells. Stem Cells. 37 (6), 791-802 (2019).
- Haubner, F., et al. Effects of external radiation in a co-culture model of endothelial cells and adipose-derived stem cells. Radiation Oncology. 8 (1), 66(2013).
- Ebrahimian, T. G., et al. Cell therapy based on adipose tissue-derived stromal cells promotes physiological and pathological wound healing. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 503-510 (2009).
- Haubner, F., et al. A co-culture model of fibroblasts and adipose tissue-derived stem cells reveals new insights into impaired wound healing after radiotherapy. International Journal of Molecular Sciences. 16 (11), 25947-25958 (2015).
- Urano, M., Kenton, L. A., Kahn, J. The effect of hyperthermia on the early and late appearing mouse foot reactions and on the radiation carcinogenesis: effect on the early and late appearing reactions. International Journal of Radiation Oncology Biology Physics. 15 (1), 159-166 (1988).
- Law, M., Thomlinson, R. The pathogenesis of necrosis after radiotherapy. The British Journal of Radiology. 47 (562), 740(1974).
- Abe, Y., Urano, M. Fraction size-dependent acute skin reaction of mice after multiple twice-a-day doses. International Journal of Radiation Oncology Biology Physics. 18 (2), 359-364 (1990).
- Inserra, M. M., Bloch, D. A., Terris, D. J. Functional indices for sciatic, peroneal, and posterior tibial nerve lesions in the mouse. Microsurgery. 18 (2), 119-124 (1998).
- Suckow, C. P. S. aM. A. Management of Animal Care and Use Programs in Research, Education, and Testing. Weichbrod, R. H., Thompson, G. A., Norton, J. N. , CRC Press/Taylor & Francis. (2018).
- Yamashita, S., Suzuki, S., Suzuki, S., Shimura, H., Saenko, V. Lessons from Fukushima: latest findings of thyroid cancer after the Fukushima nuclear power plant accident. Thyroid. 28 (1), 11-22 (2018).
- Cardis, E., et al. Cancer consequences of the Chernobyl accident: 20 years on. Journal of Radiological Protection. 26 (2), 127-140 (2006).
- Williams, N. R., et al. Radiation-induced fibrosis in breast cancer: A protocol for an observational cross-sectional pilot study for personalised risk estimation and objective assessment. International Journal of Surgery Protocols. 14, 9-13 (2019).
- Meineke, V., Fliedner, T. Radiation-induced multi-organ involvement and failure: challenges for radiation accident medical management and future research. The British Journal of Radiology. 78 (1), 196-200 (2005).
- Stone, H. B. Leg contracture in mice: an assay of normal tissue response. International Journal of Radiation Oncology Biology Physics. 10 (7), 1053-1061 (1984).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。