Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Создание надежной и воспроизводимой модели радиационно-индуцированного фиброза кожи и мышц
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной работе мы представляем протокол индуцирования радиационно-индуцированного фиброза кожи в задних конечностях мышей и выполняем пострадиационные измерения хронических нарушений с помощью анализа экскурсии конечностей и индекса походки для оценки функционального исхода. Модель выясняет механизмы фиброза кожи, связанного с облучением, и полезна в субклинических терапевтических исследованиях.
Аннотация
Радиационно-индуцированный фиброз кожи (RISF) может быть результатом множества сценариев, включая терапию рака, случайное облучение или террористические акты. Радиоактивные лучи могут проникать через кожу и воздействовать на структуры на своем пути, включая кожу, мышцы и внутренние органы. Кожа является первой структурой, которая подвергается воздействию радиации и подвержена развитию хронического фиброза, который трудно поддается лечению. В настоящее время ограниченные варианты лечения демонстрируют умеренную эффективность в смягчении фиброза кожи, связанного с облучением. Ключевым фактором, препятствующим разработке эффективных контрмер, является отсутствие удобной и надежной модели, которая позволила бы транслировать экспериментальные результаты на человека. В данной работе была создана надежная и воспроизводимая модель фиброза кожи задних конечностей мышей для профилактической и терапевтической оценки возможных агентов для функционального и молекулярного восстановления.
Правая задняя конечность была облучена с использованием однократной дозы 40 (Грей) Гр для индуцирования фиброза кожи. У испытуемых развились отеки и дерматиты на ранних стадиях, проистекающие из видимого сужения кожи. Облученные конечности показали значительно сниженный диапазон движений конечностей в последующие недели. На поздних стадиях острые побочные эффекты стихли, но хронический фиброз сохранялся. В качестве дополнительного функционального анализа был проведен индекс походки, который продемонстрировал развитие функциональных нарушений. Эти неинвазивные методы продемонстрировали надежные измерения для отслеживания прогрессирования фиброза, что подтверждается гистологическими анализами. Анализы дозы облучения, его применения и после облучения, используемые в этой модели, представляют собой энергичный и воспроизводимый метод изучения радиационно-индуцированного фиброза кожи и проверки эффективности терапевтических средств.
Введение
Кожа является самым крупным органом тела, покрывающим и защищающим тело от опасностей. Он имеет три отдельных слоя: эпидермис, дерму и гиподерму. Каждый слой имеет свои уникальные функции: эпидермис предотвращает обезвоживание и микробную инвазию; дерма имеет богатую сеть клеток, а также внеклеточный матрикс, обеспечивающий прочность на разрыв и эластичность1; Дермальный слой содержит сенсорные рецепторы, волосяные фолликулы, железы и сосуды для лимфатической и капиллярной сети. Гиподерма или подкожная клетчатка, с ее обилием жировой ткани, очерчивает тело и распределяет механическое напряжение 2,3,4.
Радиация, возникающая в результате несчастных случаев, войн, терроризма или терапевтических применений, проникает через организм линейно-прогрессивным образом, в результате чего кожа становится первым органом, с которым вступает в контакт. Угроза таких инцидентов усилилась в связи с расширением использования радиоактивных материалов в промышленности, медицинских учреждениях и на военных объектах5. Клинически лучевое поражение кожи характеризуется кожным лучевым синдромом (СРК), одним из четырех субсиндромов острого лучевого синдрома (ОЛБ). Реакция кожи на ионизирующее излучение имеет важное значение для лечения и защиты от дальнейших повреждений6. Сопутствующие повреждения, такие как ожоги и травмы, еще больше осложняют клинический исход в сочетании с лучевыми повреждениями7. Степень воздействия радиации на кожу коррелирует с порогом невозврата, от которого повреждение других органов приводит к недостаточности одного или нескольких органов и в конечном итоге приводит к смерти пациента 8,9. Кожное лучевое поражение подразделяется на острую и хроническую фазы. Острое лучевое поражение клинически проявляется в виде эритемы, отека кожи, дерматита, образования волдырей, обнажения эпидермиса, сухой или влажной шелушения, изъязвлений, а также изменений волос и ногтей. Хроническая фаза проявляется в виде дермальной атрофии, фиброза, хронических изъязвлений и телеангиэктазий10,11. В целом, острые эффекты преимущественно проявляются в эпидермисе, в то время как хронические последствия наиболее заметны в дерме. Острая реакция на облучение приводит к заметному снижению митотической активности в течение 12 ч после облучения, за которым следуют гиперемия, увеличение клеток, вакуолизация, ядерный пикноз и фрагментация 4,12.
Дозы облучения, превышающие 40 Гр, приводят к влажному шелушению и потере эпидермиса, что приводит к повышенной восприимчивости к инфекциям13. Кроме того, воздействие радиации на кожу индуцирует выработку цитокинов, вызывая воспалительный иммунный ответ в дермальном слое. Важными медиаторами воспаления являются интерлейкины (IL-1, IL-3, IL-5, IL-6 и IL-8) и фактор некроза опухоли-α (TNFα)14. Неудачное разрешение воспаления может в конечном итоге привести к развитию фиброза в месте лучевого поражения15. Дополнительные физические раны или термические травмы еще больше усугубляют эту фиброзную реакцию, распространяясь через мышечный слой16. Трансформирующий фактор роста-β (TGFβ) является ключевым цитокином в развитии фиброза17. В настоящее время очень немногие варианты лечения показывают многообещающие результаты, и большинство из них могут иметь проблемы с соблюдением пациентами режима лечения. Дальнейшие исследования, изучающие клеточные и молекулярные реакции кожи на различные дозы облучения, улучшат понимание патофизиологии кожи, вызванной радиацией, и будут способствовать разработке новых методов лечения.
Для облегчения клинической трансляции результатов исследований в доклинические модели для облегчения радиационно-индуцированного повреждения кожи и мягких тканей решающее значение имеет разработка высокорелевантных экспериментальных моделей терапевтических вмешательств после облучения. Были описаны модели радиационно-индуцированного повреждения in vitro и in vivo, включая модели клеточных культур облученных эндотелиальных клеток18,19, фибробластов20 или кератиноцитов19, а также модели in vivo грызунов, свиней и животных приматов. Модели грызунов широко используются в радиационных исследованиях из-за их сходства в реакции на лучевое повреждение с человеком и их гибкости в генетических манипуляциях. Потребность в дозе облучения у грызунов выше, чем у человека, при достижении аналогичных результатов: шелушения, фиброза и некроза 16,22. Описание критериев оценки для измерения реакции на радиацию еще больше способствовало принятию на грызунах моделей лучевого повреждения кожи21,23.
Текущие исследования в доклинических условиях сосредоточены на понимании механизмов радиационно-индуцированного повреждения кожи и разработке терапевтических вариантов. Таким образом, создание надежной и воспроизводимой доклинической модели для создания радиационного удара с высокой клинической трансляционируемостью имеет важное значение. В данной работе описана мышиная модель фиброза кожи с оптимизированной дозой облучения и техникой доставки. Наша модель, которая сочетает в себе функциональные, гистологические и молекулярные измерения, может быть использована для эффективного изучения механизма развития фиброза и исследования новых терапевтических возможностей.
Access restricted. Please log in or start a trial to view this content.
протокол
Этичное использование животных было одобрено Комитетом по уходу за животными и их использованию (IACUC), который действует в соответствии с Законом о благополучии животных. Животные были размещены в учреждении, одобренном Международной ассоциацией по оценке и аккредитации лабораторных животных (AAALAC), и лечились в соответствии с Руководством Национальных институтов здравоохранения по уходу и использованию лабораторных животных.
1. Анестезия
- Поместите мышей в коробку с системой анестезии для мелких животных (рисунок 1). Доставьте 4% изофлуран в коробку и подождите 5-10 минут, после чего снизьте уровень изофлурана до 2-3%.
- Подтвердите глубину анестезии, ущипнув палец ноги. Нанесите смазку для глаз, чтобы предотвратить высыхание. Переместите субъект к носовому конусу с потоком 2% изофлурана.
- Используйте описанную выше технику для обезболивания каждой мыши для бритья и измерения конечностей. Используйте внутрибрюшинную инъекцию пентобарбитала в дозе 1,25 мг/кг для обезболивания мышей для облучения.
2. Подготовка участка кожи
- Планируйте брить мышей за 2-3 дня до облучения. Подстригите волосы с помощью машинки для стрижки (Рисунок 2А).
- Нанесите крем для депиляции и подождите 1-2 минуты (Рисунок 2Б). Протрите крем сухой марлей и промойте кожу марлей, смоченной фосфатным буферным раствором (PBS) (рисунок 2C).
3. Процедура облучения
- Обезболите каждую мышь внутрибрюшинной инъекцией, вводимой за 5 минут до облучения. Расположите конечность в поле излучения (25 см x 25 см) и закрепите ее хирургическим пластырем (рисунок 3A-C).
- Ограничьте тело с помощью хирургической ленты (рисунок 3D). Поместите комок толщиной 1 см, чтобы предотвратить/свести к минимуму глубокое проникновение радиации (рисунок 3E).
- Рассчитайте аппликатор и коэффициенты выреза, чтобы нанести 40 Гр на кожу мыши. Для данного эксперимента используйте линейный ускоритель для генерации электронного пучка с энергией 6 МэВ для 3740 мониторных блоков, чтобы вызвать облучение. В этой ситуации поле излучения размером 25 см x 25 см с дозой 1000 МЕ/мин с расстоянием от источника до поверхности 100 см (SSD), которое представляет собой расстояние от источника облучения до верхней части болюса для доставки 40 Гр. Время облучения зависит от используемого линейного ускорителя, энергии пучка и размера поля. Следует проконсультироваться с радиационным или медицинским физиком для расчета единиц измерения, необходимых для подачи 40 Гр на линейный ускоритель.
4. Визуальный мониторинг развития фиброза
- Используйте портативную цифровую камеру, чтобы задокументировать прогрессирование фиброза. Используйте настройку макросъемки для съемки фотографий с высокой детализацией.
- Обезболите мышей путем ингаляции изофлурана.
- Делайте снимки, расположив объектив ближе к коже, и нажмите кнопку захвата. Постарайтесь, чтобы фотографии были как можно более последовательными. Держите субъекта под непосредственным наблюдением до тех пор, пока не будет восстановлено сознание, достаточное для поддержания лежачего положения за грудиной.
5. Измерение экскурсии ноги как функционального результата фиброза
- Начиная с третьей недели после облучения, планируйте проводить измерения каждую неделю в течение 6 недель.
- Начните и поддерживайте анестезию, как описано выше. Подготовьте поле перед носовым обтекателем и зафиксируйте в центре транспортир скотчем (рисунок 4А).
- Перенесите мышь в поле и аккуратно поместите ее носик на конус. Расположите правое колено к центру транспортира (рисунок 4B).
- Удерживайте колено неподвижным с помощью левой руки, а правой рукой удерживайте тыльную сторону стопы указательным и поллексным пальцами (Рисунок 4C, D).
- Обратите внимание на степень разгибания, считывая значение, указанное пальцами ног. Проделайте ту же процедуру на контралатеральной необлученной ноге.
6. Измерение функционального индекса походки
- Напечатайте на 3D-принтере дорожку для выгула грызунов, чтобы создать дорожку для прогулок длиной 40 см, подвешенную на высоте 15 см с прозрачным полом (рисунок 5). Поместите видеорегистратор под дорожку и начните съемку. Камера настроена на запись видео с максимально возможным разрешением и минимальной частотой кадров 60 кадров в секунду.
- Откройте один конец дорожки и перенесите мышку внутрь. Позвольте животному свободно ходить по дорожке. Запечатлейте идущее животное как можно плавнее не менее трех раз.
- Проверьте качество видео перед записью следующей мышкой.
- Перенесите видео на компьютер с помощью видеоплеера, приложения для создания скриншотов, программы обработки изображений и программного обеспечения для работы с электронными таблицами. Просмотрите записи, чтобы запечатлеть три разных четких следа с помощью функции создания снимка экрана (рис. 6).
- Откройте программу обработки изображений для измерения размаха пальцев ног. Выберите «Файл» на верхней панели и нажмите «Открыть », чтобы найти и отобразить изображение для анализа.
- Выберите инструмент «Прямая линия» во втором ряду верхней панели (Рисунок 7_1). С помощью этого инструмента отметьте ширину стены и нажмите «Анализ» > «Установить масштаб», затем введите точное значение для известного расстояния для калибровки масштаба (Рисунок 7_2-5).
- Используйте инструмент «Прямая линия », чтобы отметить след для различных измерений (Рисунок 6C, D; 1: длина стопы, 2: размах внешнего пальца, 3: внутренний размах пальца), выберите «Анализ» > «Измерить» и запишите значение длины (Рисунок 8).
- Выполните анализы как облученных, так и необлученных конечностей. Используйте следующее уравнение, опубликованное ранее, для оценки функциональных возможностей24
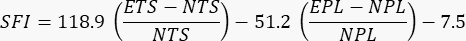
где SFI = индекс седалищной функциональности, E = экспериментальная или поврежденная лапа, N = нормальная или неповрежденная лапа, TS = размах пальцев, а PL = длина отпечатка.
7. Эвтаназия
- Перенесите субъекта в коробку, подключенную к линии CO2 . Начните инфузию CO2 до достижения концентрации 30%-70% в камере. Для камеры объемом 5 л инфузия газа должна составлять от 1,5 до 3,5 л/мин.
- Подождите, пока животное перестанет дышать в течение 5-10 минут. Усыпляют при вывихе шейного отдела, удерживая голову на месте от основания черепа и сильно оттягивая хвост25.
8. Гистология и последующие анализы 17
- Потяните облученную заднюю конечность, чтобы подготовить ее к иссечению. Выберите участок размером 2 см х 1 см до задней плоскости кожи конечностей.
- С помощью острых ножниц осторожно соберите образец кожи. Разрежьте ткань пополам по длинной оси, чтобы получилось два отдельных кусочка.
- Закрепите один кусочек салфетки в 10% формалиновом буферном физрастворе. Обработайте неподвижную ткань для подготовки гистологических срезов на предметных стеклах.
- Переложите вторую часть в коробку, наполненную сухим льдом, чтобы сохранить белки и РНК. Затем быстро перенесите образцы тканей в морозильную камеру при температуре -80 °C и храните их в замороженном виде до дальнейшей обработки.
- Окрасьте предметные стекла для окрашивания гематоксилином и эозином (H&E) и трихромным окрашиванием Массона. Визуализируйте окрашенные предметные стекла под микроскопом и сделайте снимки с использованием 10-кратного увеличения. Измерьте толщину эпителия с помощью программного обеспечения для обработки изображений, как описано выше для функционального анализа походки.
9. Статистика
- Представьте данные в виде среднего значения ± стандартного отклонения. Оцените результаты с помощью дисперсионного анализа (ANOVA), за которым следует тест Бонферрони с множественным сравнением или t-критерий Стьюдента.
Access restricted. Please log in or start a trial to view this content.
Результаты
Создание и оптимизация текущего протокола облучения привели к последовательной и воспроизводимой индукции фиброза у мышей. Правые конечности мышей располагали и обездвиживали в поле облучения в день облучения, и вводили 40 Гр радиации.
Развитие функци...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Повреждение кожи является вероятным результатом случайного или связанного с лечением воздействия радиации. Ядерные реакторы подвержены риску случайного нарушения из-за человеческой ошибки или стихийных бедствий, таких как Чернобыль и Фукусима26,27
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конкурирующих финансовых интересов или других конфликтов интересов, связанных с этой работой.
Благодарности
Эта работа финансируется за счет исследовательских грантов от Министерства обороны W81XWH-19-PRMRP-DA, NIAID/NIH Grant 5R21AI153971-02 и PSF/MTF Grant 603902.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 10% Formalin | Fischer Scientific | 23-427098 | |
| Bolus | Orfit | 8333.SO1/R | |
| Clipper | Kent Scientific Corp. | CL8787-KIT | |
| CO2 | Various | ||
| CO2 Chamber | E-Z Systems Inc. | E-22000 | |
| Depilatory Cream | Church & Dwight Co., Inc. | Nair | |
| Digital Camera | Wolfang | GA100 | |
| Eppendrof Tubes | Eppendorf | 22364111 | |
| Eye Lubricant | Dechra | Puralube Ophthalmic Ointment | |
| Gauze | Covidien | 682252 | |
| Image Processing Program | NIH | Image J | |
| Isoflurane | Dechra | USP Inhalation Anesthetic | |
| Linear Accelaerator | Varian Medical Systems, Inc. | 23EX | |
| PBS | Cytiva | SH30256.LS | |
| Pentobarbital | Akorn Pharmaceuticals | Nembutal | |
| Protractor | Westcott | 550-1120 | |
| Small Animal Anesthesia System | E-Z Systems Inc. | EZ-SA800 | Single animal system |
| Spreadsheet Software | Microsoft | Excel | |
| Surgical Scissors | Medline | MDS0834111 | |
| Surgical Tape | 3M | 1538-1 | |
| Tape | 3M | H-1113 |
Ссылки
- Breitkreutz, D., Mirancea, N., Nischt, R. Basement membranes in skin: unique matrix structures with diverse functions. Histochemistry and Cell Biology. 132 (1), 1-10 (2009).
- Kim, J. -S., et al. Comparison of skin injury induced by β-and γ-irradiation in the minipig model. Journal of Radiation Protection and Research. 42 (4), 189-196 (2017).
- Kolarsick, P. A., Kolarsick, M. A., Goodwin, C. Anatomy and physiology of the skin. Journal of the Dermatology Nurses' Association. 3 (4), 203-213 (2011).
- von Essen, C. F. Radiation tolerance of the skin. Acta Radiologica: Therapy, Physics, Biology. 8 (4), 311-330 (1969).
- Dainiak, N., et al. Literature review and global consensus on management of acute radiation syndrome affecting nonhematopoietic organ systems. Disaster Medicine and Public Health Preparedness. 5 (3), 183-201 (2011).
- Hopewell, J. The skin: its structure and response to ionizing radiation. International Journal of Radiation Biology. 57 (4), 751-773 (1990).
- Flynn, D. F., Goans, R. E. Nuclear terrorism: triage and medical management of radiation and combined-injury casualties. Surgical Clinics. 86 (3), 601-636 (2006).
- Peter, R. Cutaneous radiation syndrome in multi-organ failure. The British Journal of Radiology. 78 (1), 180-184 (2005).
- Meineke, V. The role of damage to the cutaneous system in radiation-induced multi-organ failure. The British Journal of Radiology. 78 (1), 95-99 (2005).
- Berger, M., Christensen, D., Lowry, P., Jones, O., Wiley, A. Medical management of radiation injuries: current approaches. Occupational Medicine. 56 (3), 162-172 (2006).
- Ralf, U. P., Petra, G. Management of cutaneous radiation injuries: diagnostic and therapeutic principles of the cutaneous radiation syndrome. Military Medicine. 167, 110-112 (2002).
- Bray, F. N., Simmons, B. J., Wolfson, A. H., Nouri, K. Acute and chronic cutaneous reactions to ionizing radiation therapy. Dermatology and Therapy. 6 (2), 185-206 (2016).
- Mendelsohn, F. A., Divino, C. M., Reis, E. D., Kerstein, M. D. Wound care after radiation therapy. Advances in Skin & Wound. 15 (5), 216-224 (2002).
- Peter, R. U. Radiation Treatment and Radiation Reactions in Dermatology. , Springer. 185-188 (2015).
- Ejaz, A., Greenberger, J. S., Rubin, P. J. Understanding the mechanism of radiation induced fibrosis and therapy options. Pharmacology & Therapeutics. 204, 107399(2019).
- Williams, J. P., et al. Animal models for medical countermeasures to radiation exposure. Radiation research. 173 (4), 557-578 (2010).
- Ejaz, A., Epperly, M. W., Hou, W., Greenberger, J. S., Rubin, J. P. Adipose-derived stem cell therapy ameliorates ionizing irradiation fibrosis via hepatocyte growth factor-mediated transforming growth factor-beta downregulation and recruitment of bone marrow cells. Stem Cells. 37 (6), 791-802 (2019).
- Haubner, F., et al. Effects of external radiation in a co-culture model of endothelial cells and adipose-derived stem cells. Radiation Oncology. 8 (1), 66(2013).
- Ebrahimian, T. G., et al. Cell therapy based on adipose tissue-derived stromal cells promotes physiological and pathological wound healing. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 503-510 (2009).
- Haubner, F., et al. A co-culture model of fibroblasts and adipose tissue-derived stem cells reveals new insights into impaired wound healing after radiotherapy. International Journal of Molecular Sciences. 16 (11), 25947-25958 (2015).
- Urano, M., Kenton, L. A., Kahn, J. The effect of hyperthermia on the early and late appearing mouse foot reactions and on the radiation carcinogenesis: effect on the early and late appearing reactions. International Journal of Radiation Oncology Biology Physics. 15 (1), 159-166 (1988).
- Law, M., Thomlinson, R. The pathogenesis of necrosis after radiotherapy. The British Journal of Radiology. 47 (562), 740(1974).
- Abe, Y., Urano, M. Fraction size-dependent acute skin reaction of mice after multiple twice-a-day doses. International Journal of Radiation Oncology Biology Physics. 18 (2), 359-364 (1990).
- Inserra, M. M., Bloch, D. A., Terris, D. J. Functional indices for sciatic, peroneal, and posterior tibial nerve lesions in the mouse. Microsurgery. 18 (2), 119-124 (1998).
- Suckow, C. P. S. aM. A. Management of Animal Care and Use Programs in Research, Education, and Testing. Weichbrod, R. H., Thompson, G. A., Norton, J. N. , CRC Press/Taylor & Francis. (2018).
- Yamashita, S., Suzuki, S., Suzuki, S., Shimura, H., Saenko, V. Lessons from Fukushima: latest findings of thyroid cancer after the Fukushima nuclear power plant accident. Thyroid. 28 (1), 11-22 (2018).
- Cardis, E., et al. Cancer consequences of the Chernobyl accident: 20 years on. Journal of Radiological Protection. 26 (2), 127-140 (2006).
- Williams, N. R., et al. Radiation-induced fibrosis in breast cancer: A protocol for an observational cross-sectional pilot study for personalised risk estimation and objective assessment. International Journal of Surgery Protocols. 14, 9-13 (2019).
- Meineke, V., Fliedner, T. Radiation-induced multi-organ involvement and failure: challenges for radiation accident medical management and future research. The British Journal of Radiology. 78 (1), 196-200 (2005).
- Stone, H. B. Leg contracture in mice: an assay of normal tissue response. International Journal of Radiation Oncology Biology Physics. 10 (7), 1053-1061 (1984).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены