Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Etablierung eines robusten und reproduzierbaren Modells der strahleninduzierten Haut- und Muskelfibrose
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll zur Induktion von strahleninduzierter Hautfibrose in der Hintergliedmaße von Mäusen vor und führen Messungen chronischer Beeinträchtigungen nach der Bestrahlung über Exkursions- und Gangindexanalysen der Gliedmaßen durch, um das funktionelle Ergebnis zu bewerten. Das Modell klärt strahlenbedingte Mechanismen der Hautfibrose auf und ist nützlich für subklinische therapeutische Studien.
Zusammenfassung
Strahleninduzierte Hautfibrose (RISF) kann aus einer Vielzahl von Szenarien resultieren, darunter Krebstherapie, versehentliche Exposition oder Terrorakte. Radioaktive Strahlen können die Haut durchdringen und die Strukturen auf ihrem Weg beeinflussen, einschließlich Haut, Muskeln und innere Organe. Die Haut ist die erste Struktur, die Strahlung ausgesetzt ist, und ist anfällig für die Entwicklung einer chronischen Fibrose, die schwer zu behandeln ist. Derzeit zeigen begrenzte Behandlungsoptionen eine moderate Wirksamkeit bei der Milderung strahlenbedingter Hautfibrose. Ein Schlüsselfaktor, der die Entwicklung wirksamer Gegenmaßnahmen behindert, ist das Fehlen eines geeigneten und robusten Modells, das eine Übertragung der experimentellen Ergebnisse auf den Menschen ermöglichen könnte. In dieser Arbeit wurde ein robustes und reproduzierbares Maus-Hautfibrosemodell für die Hintergliedmaßen zur prophylaktischen und therapeutischen Evaluierung möglicher Wirkstoffe für die funktionelle und molekulare Wiederherstellung etabliert.
Die rechte Hintergliedmaße wurde mit einer Einzeldosis von 40 (Gray) Gy bestrahlt, um eine Hautfibrose zu induzieren. Die Probanden entwickelten im Frühstadium Ödeme und Dermatitis, die von einer sichtbaren Hautverengung begleitet wurden. Bestrahlte Gliedmaßen zeigten in den folgenden Wochen einen signifikant reduzierten Bewegungsumfang der Gliedmaßen. Im Spätstadium ließen die akuten Nebenwirkungen nach, die chronische Fibrose blieb jedoch bestehen. Als zusätzlicher Funktionstest wurde ein Gangindex durchgeführt, der die Entwicklung einer Funktionsbeeinträchtigung zeigte. Diese nicht-invasiven Methoden zeigten zuverlässige Messungen zur Verfolgung des Fibroseverlaufs, die durch histologische Analysen unterstützt werden. Die in diesem Modell verwendeten Strahlendosis-, Anwendungs- und Nachbestrahlungsanalysen bieten eine leistungsfähige und reproduzierbare Methode, um strahleninduzierte Hautfibrose zu untersuchen und die Wirksamkeit von Therapeutika zu testen.
Einleitung
Die Haut ist das größte Organ des Körpers, das den Körper bedeckt und vor Gefahren schützt. Es besteht aus drei verschiedenen Schichten: Epidermis, Dermis und Hypodermis. Jede Schicht hat ihre einzigartigen Funktionen: Die Epidermis verhindert Austrocknung und mikrobielle Invasion; Die Dermis verfügt über ein reichhaltiges Zellnetzwerk und eine extrazelluläre Matrix, die für Zugfestigkeit und Elastizität sorgt1; Die Hautschicht enthält die sensorischen Rezeptoren, Haarfollikel, Drüsen und Gefäße für Lymph- und Kapillarnetzwerke. Die Hypodermis oder das Unterhautgewebe mit ihrem Reichtum an Fettgewebe konturiert den Körper und verteilt die mechanischen Spannungen 2,3,4.
Strahlung, die durch Unfälle, Krieg, Terrorismus oder therapeutische Anwendungen erzeugt wird, dringt linear progressiv durch den Körper und führt dazu, dass die Haut das erste Organ ist, das mit ihr in Kontakt kommt. Die Bedrohung durch solche Zwischenfälle hat sich aufgrund des zunehmenden Einsatzes radioaktiver Materialien in Industrien, medizinischen Einrichtungen und militärischen Einrichtungen verschärft5. Klinisch ist die Strahlenschädigung der Haut durch das kutane Strahlensyndrom (CRS) gekennzeichnet, eines von vier Subsyndromen des akuten Strahlensyndroms (ARS). Die Reaktion der Haut auf ionisierende Strahlung hat wichtige Auswirkungen auf die Behandlung und den Schutz vor weiteren Schäden6. Begleitende Verletzungen wie Verbrennungen und Traumata erschweren das klinische Ergebnis zusätzlich, wenn sie mit Strahlenverletzungen kombiniert werden7. Das Ausmaß der Strahlenexposition der Haut korreliert mit einer Point-of-no-Return-Schwelle, ab der die Beeinträchtigung anderer Organe zu einem Versagen einzelner oder mehrerer Organe und schließlich zum Tod des Patienten führt 8,9. Die kutane Strahlenschädigung besteht aus einer akuten und einer chronischen Phase. Eine akute Strahlenschädigung manifestiert sich klinisch als Erythem, Hautödem, Dermatitis, Blasenbildung, epidermale Denudation, trockene oder feuchte Abschuppung, Ulzerationen und Veränderungen der Haare und Nägel. Die chronische Phase manifestiert sich als dermale Atrophie, Fibrose, chronische Ulzerationen und Teleangiektasien10,11. Im Allgemeinen manifestieren sich akute Wirkungen überwiegend in der Epidermis, während chronische Wirkungen in der Dermis am stärksten ausgeprägt sind. Die akute Reaktion auf die Strahlenexposition führt innerhalb von 12 Stunden nach der Exposition zu einer deutlichen Abnahme der mitotischen Aktivität, gefolgt von Hyperämie, Zellvergrößerung, Vakuolisierung, nukleärer Pyknose und Fragmentierung 4,12.
Strahlendosen von mehr als 40 Gy führen zu einer feuchten Abschuppung und einem Verlust der Epidermis, was zu einer erhöhten Anfälligkeit für Infektionen führt13. Darüber hinaus induziert die Strahlenbelastung der Haut die Produktion von Zytokinen, die eine entzündliche Immunreaktion in der Hautschicht auslösen. Zu den prominenten Entzündungsmediatoren gehören Interleukine (IL-1, IL-3, IL-5, IL-6 und IL-8) und Tumornekrosefaktor-α (TNFα)14. Ein Versagen bei der Auflösung der Entzündung kann schließlich zur Entwicklung einer Fibrose an der Stelle der Strahlenverletzung führen15. Zusätzliche körperliche Wunden oder thermische Verletzungen verschlimmern diese fibrotische Reaktion weiter und erstrecken sich durch die Muskelschicht16. Der transformierende Wachstumsfaktor-β (TGFβ) ist das Schlüsselzytokin bei der Entwicklung von Fibrose17. Derzeit zeigen nur sehr wenige Behandlungsoptionen vielversprechende Ergebnisse, und die Mehrheit könnte Probleme mit der Compliance der Patienten haben. Weitere Forschungen, die die zellulären und molekularen Reaktionen der Haut auf unterschiedliche Strahlendosen untersuchen, werden das Verständnis der strahleninduzierten Hautpathophysiologie verbessern und die Entwicklung neuer Therapien fördern.
Um die klinische Translation von Forschungsergebnissen in präklinischen Modellen zur Linderung strahleninduzierter Verletzungen der Haut und der Weichteile zu erleichtern, ist die Entwicklung hochrelevanter experimenteller Modelle für therapeutische Interventionen nach Bestrahlung von entscheidender Bedeutung. Sowohl in vitro als auch in vivo Modelle für strahleninduzierte Schädigungen wurden beschrieben, einschließlich Zellkulturmodellen von bestrahlten Endothelzellen18, 19, Fibroblasten20 oder Keratinozyten19 und in vivo Tiermodellen von Nagetieren, Schweinen und nichtmenschlichen Primaten. Nagetiermodelle werden in der Strahlenforschung aufgrund ihrer Ähnlichkeiten als Reaktion auf Strahlenschäden mit dem Menschen und ihrer Flexibilität bei der genetischen Manipulation häufig verwendet21. Die Anforderungen an die Strahlendosis sind bei Nagetieren höher als bei Menschen, wenn ähnliche Ergebnisse angestrebt werden: Abschuppung, Fibrose und Nekrose16,22. Die Beschreibung von Bewertungskriterien zur Messung der Reaktion auf Strahlung hat die Akzeptanz von Nagetiermodellen für strahlende Hautverletzungen weiter verbessert21,23.
Die aktuelle Forschung im präklinischen Umfeld konzentriert sich auf das Verständnis der Mechanismen strahleninduzierter Hautschäden und die Entwicklung therapeutischer Optionen. Daher ist die Etablierung eines robusten und reproduzierbaren präklinischen Modells zur Erzeugung des Strahlensulls mit hoher klinischer Übertragbarkeit unerlässlich. Diese Arbeit beschreibt ein murines Modell der Hautfibrose mit optimierter Strahlendosis und Verabreichungstechnik. Unser Modell, das funktionelle, histologische und molekulare Messungen kombiniert, kann verwendet werden, um den Mechanismus der Fibroseentwicklung effektiv zu untersuchen und neue therapeutische Optionen zu untersuchen.
Protokoll
Die ethische Verwendung von Tieren wurde vom Institutional Animal Care and Use Committee (IACUC) genehmigt, das in Übereinstimmung mit dem Tierschutzgesetz handelt. Die Tiere wurden in einer von der Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC) zugelassenen Einrichtung untergebracht und gemäß dem National Institutes of Health Guide for the Care and Use of Laboratory Animals behandelt.
1. Anästhesie
- Setzen Sie Mäuse in die Box eines Anästhesiesystems für Kleintiere (Abbildung 1). Geben Sie 4% Isofluran in die Box und warten Sie 5-10 Minuten, dann senken Sie das Isofluran auf 2-3%.
- Bestätigen Sie die Narkosetiefe durch Zehenkneifen. Tragen Sie Augenschmiermittel auf, um ein Austrocknen zu verhindern. Bewegen Sie das Subjekt mit 2 % Isofluranfluss zum Nasenkonus.
- Verwenden Sie die obige Technik, um jede Maus für die Rasur und den Measure der Gliedmaßen zu betäuben. Verwenden Sie eine intraperitoneale Pentobarbital-Injektionsdosis von 1,25 mg/kg, um Mäuse für die Bestrahlung zu betäuben.
2. Vorbereitung der Hautpartie
- Planen Sie, die Mäuse 2-3 Tage vor der Bestrahlung zu rasieren. Schneiden Sie das Haar mit einer Haarschneidemaschine (Abbildung 2A).
- Tragen Sie die Enthaarungscreme auf und warten Sie 1-2 Minuten (Abbildung 2B). Wischen Sie die Creme mit trockener Gaze ab und spülen Sie die Haut mit einer mit Phosphatpuffer Kochsalzlösung (PBS) getränkten Gaze ab (Abbildung 2C).
3. Ablauf der Bestrahlung
- Betäuben Sie jede Maus mit einer intraperitonealen Injektion, die 5 Minuten vor der Bestrahlung verabreicht wird. Positionieren Sie die Extremität im Strahlenfeld (25 cm x 25 cm) und sichern Sie sie mit chirurgischem Klebeband (Abbildung 3A-C).
- Begrenzen Sie den Körper mit chirurgischem Klebeband (Abbildung 3D). Platzieren Sie einen 1 cm dicken Bolus, um ein tiefes Eindringen von Strahlung zu verhindern/zu minimieren (Abbildung 3E).
- Berechnen Sie den Applikator und die Ausschnittsfaktoren, um 40 Gy auf die Maushaut zu bringen. Verwenden Sie für das Experiment hier einen Linearbeschleuniger, um einen 6-MeV-Elektronenstrahl für 3740 Monitoreinheiten zu erzeugen, um Strahlungsverbrennungen zu induzieren. In dieser Einstellung wird ein 25 cm x 25 cm großes Strahlungsfeld bei einer Dosis von 1.000 MU/min mit einem Abstand von 100 cm von der Quelle zur Oberfläche (SSD) angezeigt, d. h. der Abstand von der Bestrahlungsquelle zur Spitze des Bolus, um die 40 Gy abzugeben. Die Bestrahlungszeit variiert je nach verwendetem Linearbeschleuniger, Strahlenergie und Feldgröße. Ein Strahlen- oder Medizinphysiker sollte konsultiert werden, um die Monitoreinheiten zu berechnen, die erforderlich sind, um 40 Gy auf dem Linearbeschleuniger zu liefern.
4. Visuelle Überwachung der Fibroseentwicklung
- Verwenden Sie eine tragbare Digitalkamera, um das Fortschreiten der Fibrose zu dokumentieren. Verwenden Sie die Makroeinstellung, um detaillierte Fotos aufzunehmen.
- Betäuben Sie Mäuse durch Inhalation von Isofluran.
- Nehmen Sie Bilder auf, indem Sie das Objektiv näher an der Haut positionieren und auf Aufnahme drücken. Versuchen Sie, die Fotos so einheitlich wie möglich zu halten. Halten Sie das Subjekt unter direkter Aufsicht, bis genügend Bewusstsein wiedererlangt ist, um das Brustbein aufrecht zu erhalten.
5. Messung der Beinextraktion als funktionelles Ergebnis der Fibrose
- Planen Sie ab der dritten Woche nach der Bestrahlung bis zu 6 Wochen lang wöchentliche Messungen ein.
- Initiieren und halten Sie die Anästhesie wie oben beschrieben aufrecht. Bereiten Sie ein Feld vor dem Nasenkegel vor und befestigen Sie einen Winkelmesser mit Klebeband in der Mitte (Abbildung 4A).
- Bringen Sie die Maus auf das Spielfeld und legen Sie ihre Nase vorsichtig auf den Kegel. Positionieren Sie das rechte Knie in der Mitte des Winkelmessers (Abbildung 4B).
- Halten Sie das Knie mit der linken Hand fixiert und beugen Sie den Fuß mit der rechten Hand mit dem Zeige- und dem Pollex-Finger (Abbildung 4C,D).
- Notieren Sie den Ausdehnungsgrad, indem Sie den durch die Zehen angezeigten Wert ablesen. Führen Sie das gleiche Verfahren am kontralateralen, nicht bestrahlten Bein durch.
6. Messung des Funktionsindex des Gangs
- Drucken Sie den Nagetierweg in 3D, um einen 40 cm langen Gehweg zu erstellen, der in einer Höhe von 15 cm mit einem transparenten Boden aufgehängt ist (Abbildung 5). Platzieren Sie einen Videorecorder unter der Spur und beginnen Sie mit dem Filmen. Die Kamera ist so eingestellt, dass sie ein Video mit der höchstmöglichen Auflösung und einer minimalen Bildrate von 60 Bildern pro Sekunde aufnimmt.
- Öffnen Sie ein Ende der Spur und übertragen Sie die Maus hinein. Lassen Sie das Tier frei auf der Fährte laufen. Fangen Sie das Tier mindestens dreimal so reibungslos wie möglich ein.
- Überprüfen Sie die Qualität des Videos, bevor Sie die nächste Maus aufnehmen.
- Übertragen Sie die Videos mit einem Videoplayer, einer Screenshot-Anwendung, einem Bildbearbeitungsprogramm und einer Tabellenkalkulationssoftware auf einen Computer. Sehen Sie sich die Aufnahmen an, um mit der Screenshot-Funktion drei verschiedene, eindeutige Fußabdrücke zu erfassen (Abbildung 6).
- Öffnen Sie das Bildbearbeitungsprogramm für die Spurspreizmessung. Wählen Sie im oberen Bereich Datei aus und klicken Sie auf Öffnen , um das zu analysierende Bild zu suchen und anzuzeigen.
- Wählen Sie in der zweiten Zeile des oberen Bereichs die Option Geradliniges Werkzeug aus (Abbildung 7_1). Markieren Sie mit diesem Werkzeug die Wandbreite, klicken Sie auf Analysieren > Maßstab festlegen, und geben Sie dann den genauen Wert für einen bekannten Abstand ein, um den Maßstab zu kalibrieren (Abbildung 7_2-5).
- Verwenden Sie das Werkzeug "Gerade Linie ", um den Fußabdruck für verschiedene Messungen zu markieren (Abbildung 6C, D; 1: Fußlänge, 2: äußere Zehenspreizung, 3: innere Zehenspreizung), wählen Sie "Analysieren" > "Messen" aus, und notieren Sie den Längenwert (Abbildung 8).
- Führen Sie die Analysen sowohl für die bestrahlten als auch für die nicht bestrahlten Gliedmaßen durch. Verwenden Sie die folgende zuvor veröffentlichte Gleichung, um die Funktionalität24 zu bewerten
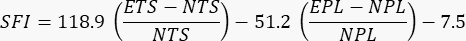
wobei SFI = Ischias-Funktionalitätsindex, E = experimentelle oder verletzte Pfote, N = normale oder unverletzte Pfote, TS = Zehenspreizung und PL = Drucklänge.
7. Euthanasie
- Übertragen Sie den Prüfling in eine CO2 -Anschlussbox. Starten Sie die CO2 - Infusion, um eine Konzentration von 30 % bis 70 % in der Kammer zu erreichen. Bei einer 5-Liter-Kammer muss die Gasinfusion zwischen 1,5 und 3,5 l/min liegen.
- Warten Sie, bis das Tier für 5-10 Minuten aufgehört hat zu atmen. Euthanasieren Sie durch Zervixluxation, indem Sie den Kopf von der Schädelbasis aus festhalten und den Schwanz fest ziehen25.
8. Histologie und nachgelagerte Analysen 17
- Ziehen Sie an der bestrahlten Hintergliedmaße, um sie für die Exzision vorzubereiten. Wählen Sie einen Bereich von 2 cm x 1 cm zur hinteren Ebene der Extremitalhaut.
- Verwenden Sie eine scharfe Schere, um die Hautprobe vorsichtig zu entnehmen. Schneiden Sie das Gewebe von der Längsachse in zwei Hälften, um zwei separate Stücke zu erhalten.
- Fixieren Sie ein Taschentuchstück in 10% formalingepufferter Kochsalzlösung. Verarbeiten Sie das fixierte Gewebe für die Erstellung histologischer Schnitte auf Objektträgern.
- Füllen Sie das zweite Stück in eine mit Trockeneis gefüllte Schachtel, um die Proteine und die RNA zu konservieren. Übergeben Sie die Gewebeproben dann schnell in einen -80 °C heißen Gefrierschrank und bewahren Sie sie bis zur Weiterverarbeitung eingefroren auf.
- Färben Sie die Objektträger für Hämatoxylin- und Eosin-Färbung (H&E) und Massons Trichrom-Färbung. Visualisieren Sie die gefärbten Objektträger unter einem Mikroskop und nehmen Sie Bilder mit 10-facher Vergrößerung auf. Messen Sie die Epitheldicke mit einer Bildverarbeitungssoftware, wie oben für den Gangfunktionsassay beschrieben.
9. Statistik
- Stellen Sie die Daten als Mittelwert ± Standardabweichung dar. Werten Sie die Ergebnisse mit Hilfe der Varianzanalyse (ANOVA) aus, gefolgt von Bonferronis Multivergleichstest oder Student t-Test.
Ergebnisse
Die Etablierung und Optimierung des aktuellen Bestrahlungsprotokolls führte zu einer konsistenten und reproduzierbaren Induktion von Fibrose bei Mäusen. Die rechten Gliedmaßen der Mäuse wurden am Tag der Bestrahlung im Strahlenfeld positioniert und gesichert, und es wurden 40 Gy Bestrahlung verabreicht.
Die Entwicklung der Funktionsbeeinträchtigung der Haut wurde überwacht, indem wöchentlich Bilder nach der Bestrahlung aufgenommen wurden. Fotos zeigten,...
Diskussion
Hautverletzungen sind eine wahrscheinliche Folge einer versehentlichen oder medizinisch behandlungsbedingten Strahlenexposition. Kernreaktoren bergen das Risiko eines versehentlichen Durchbruchs aufgrund von menschlichem Versagen oder Naturkatastrophen wie Tschernobyl und Fukushima26,27. Die therapeutische Dosierung zur Krebsbehandlung ist die häufigste Exposition, bei der fraktionierte Schemata mit wiederholter Verabreichung ve...
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen oder andere Interessenkonflikte im Zusammenhang mit dieser Arbeit.
Danksagungen
Diese Arbeit wird durch Forschungsstipendien des Verteidigungsministeriums W81XWH-19-PRMRP-DA, NIAID/NIH Grant 5R21AI153971-02 und PSF/MTF Grant 603902 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| 10% Formalin | Fischer Scientific | 23-427098 | |
| Bolus | Orfit | 8333.SO1/R | |
| Clipper | Kent Scientific Corp. | CL8787-KIT | |
| CO2 | Various | ||
| CO2 Chamber | E-Z Systems Inc. | E-22000 | |
| Depilatory Cream | Church & Dwight Co., Inc. | Nair | |
| Digital Camera | Wolfang | GA100 | |
| Eppendrof Tubes | Eppendorf | 22364111 | |
| Eye Lubricant | Dechra | Puralube Ophthalmic Ointment | |
| Gauze | Covidien | 682252 | |
| Image Processing Program | NIH | Image J | |
| Isoflurane | Dechra | USP Inhalation Anesthetic | |
| Linear Accelaerator | Varian Medical Systems, Inc. | 23EX | |
| PBS | Cytiva | SH30256.LS | |
| Pentobarbital | Akorn Pharmaceuticals | Nembutal | |
| Protractor | Westcott | 550-1120 | |
| Small Animal Anesthesia System | E-Z Systems Inc. | EZ-SA800 | Single animal system |
| Spreadsheet Software | Microsoft | Excel | |
| Surgical Scissors | Medline | MDS0834111 | |
| Surgical Tape | 3M | 1538-1 | |
| Tape | 3M | H-1113 |
Referenzen
- Breitkreutz, D., Mirancea, N., Nischt, R. Basement membranes in skin: unique matrix structures with diverse functions. Histochemistry and Cell Biology. 132 (1), 1-10 (2009).
- Kim, J. -. S., et al. Comparison of skin injury induced by β-and γ-irradiation in the minipig model. Journal of Radiation Protection and Research. 42 (4), 189-196 (2017).
- Kolarsick, P. A., Kolarsick, M. A., Goodwin, C. Anatomy and physiology of the skin. Journal of the Dermatology Nurses' Association. 3 (4), 203-213 (2011).
- von Essen, C. F. Radiation tolerance of the skin. Acta Radiologica: Therapy, Physics, Biology. 8 (4), 311-330 (1969).
- Dainiak, N., et al. Literature review and global consensus on management of acute radiation syndrome affecting nonhematopoietic organ systems. Disaster Medicine and Public Health Preparedness. 5 (3), 183-201 (2011).
- Hopewell, J. The skin: its structure and response to ionizing radiation. International Journal of Radiation Biology. 57 (4), 751-773 (1990).
- Flynn, D. F., Goans, R. E. Nuclear terrorism: triage and medical management of radiation and combined-injury casualties. Surgical Clinics. 86 (3), 601-636 (2006).
- Peter, R. Cutaneous radiation syndrome in multi-organ failure. The British Journal of Radiology. 78 (1), 180-184 (2005).
- Meineke, V. The role of damage to the cutaneous system in radiation-induced multi-organ failure. The British Journal of Radiology. 78 (1), 95-99 (2005).
- Berger, M., Christensen, D., Lowry, P., Jones, O., Wiley, A. Medical management of radiation injuries: current approaches. Occupational Medicine. 56 (3), 162-172 (2006).
- Ralf, U. P., Petra, G. Management of cutaneous radiation injuries: diagnostic and therapeutic principles of the cutaneous radiation syndrome. Military Medicine. 167, 110-112 (2002).
- Bray, F. N., Simmons, B. J., Wolfson, A. H., Nouri, K. Acute and chronic cutaneous reactions to ionizing radiation therapy. Dermatology and Therapy. 6 (2), 185-206 (2016).
- Mendelsohn, F. A., Divino, C. M., Reis, E. D., Kerstein, M. D. Wound care after radiation therapy. Advances in Skin & Wound. 15 (5), 216-224 (2002).
- Peter, R. U. . Radiation Treatment and Radiation Reactions in Dermatology. , 185-188 (2015).
- Ejaz, A., Greenberger, J. S., Rubin, P. J. Understanding the mechanism of radiation induced fibrosis and therapy options. Pharmacology & Therapeutics. 204, 107399 (2019).
- Williams, J. P., et al. Animal models for medical countermeasures to radiation exposure. Radiation research. 173 (4), 557-578 (2010).
- Ejaz, A., Epperly, M. W., Hou, W., Greenberger, J. S., Rubin, J. P. Adipose-derived stem cell therapy ameliorates ionizing irradiation fibrosis via hepatocyte growth factor-mediated transforming growth factor-beta downregulation and recruitment of bone marrow cells. Stem Cells. 37 (6), 791-802 (2019).
- Haubner, F., et al. Effects of external radiation in a co-culture model of endothelial cells and adipose-derived stem cells. Radiation Oncology. 8 (1), 66 (2013).
- Ebrahimian, T. G., et al. Cell therapy based on adipose tissue-derived stromal cells promotes physiological and pathological wound healing. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 503-510 (2009).
- Haubner, F., et al. A co-culture model of fibroblasts and adipose tissue-derived stem cells reveals new insights into impaired wound healing after radiotherapy. International Journal of Molecular Sciences. 16 (11), 25947-25958 (2015).
- Urano, M., Kenton, L. A., Kahn, J. The effect of hyperthermia on the early and late appearing mouse foot reactions and on the radiation carcinogenesis: effect on the early and late appearing reactions. International Journal of Radiation Oncology Biology Physics. 15 (1), 159-166 (1988).
- Law, M., Thomlinson, R. The pathogenesis of necrosis after radiotherapy. The British Journal of Radiology. 47 (562), 740 (1974).
- Abe, Y., Urano, M. Fraction size-dependent acute skin reaction of mice after multiple twice-a-day doses. International Journal of Radiation Oncology Biology Physics. 18 (2), 359-364 (1990).
- Inserra, M. M., Bloch, D. A., Terris, D. J. Functional indices for sciatic, peroneal, and posterior tibial nerve lesions in the mouse. Microsurgery. 18 (2), 119-124 (1998).
- Suckow, C. P. S. a. M. A., Weichbrod, R. H., Thompson, G. A., Norton, J. N. . Management of Animal Care and Use Programs in Research, Education, and Testing. , (2018).
- Yamashita, S., Suzuki, S., Suzuki, S., Shimura, H., Saenko, V. Lessons from Fukushima: latest findings of thyroid cancer after the Fukushima nuclear power plant accident. Thyroid. 28 (1), 11-22 (2018).
- Cardis, E., et al. Cancer consequences of the Chernobyl accident: 20 years on. Journal of Radiological Protection. 26 (2), 127-140 (2006).
- Williams, N. R., et al. Radiation-induced fibrosis in breast cancer: A protocol for an observational cross-sectional pilot study for personalised risk estimation and objective assessment. International Journal of Surgery Protocols. 14, 9-13 (2019).
- Meineke, V., Fliedner, T. Radiation-induced multi-organ involvement and failure: challenges for radiation accident medical management and future research. The British Journal of Radiology. 78 (1), 196-200 (2005).
- Stone, H. B. Leg contracture in mice: an assay of normal tissue response. International Journal of Radiation Oncology Biology Physics. 10 (7), 1053-1061 (1984).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten