A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הקמת מודל חזק וניתן לשחזור של פיברוזיס בעור ובשרירים הנגרמת על ידי קרינה
* These authors contributed equally
In This Article
Summary
כאן אנו מציגים פרוטוקול להשראת פיברוזיס עורי הנגרמת על ידי קרינה בגפה האחורית של עכברים ומבצעים מדידות לאחר הקרנה של ליקוי כרוני באמצעות ניתוחי סטייה של הגפיים ומדד ההליכה כדי להעריך את התוצאה התפקודית. המודל מבהיר מנגנוני פיברוזיס של העור הקשורים לקרינה ושימושי במחקרים טיפוליים תת-קליניים.
Abstract
פיברוזיס עור הנגרמת על ידי קרינה (RISF) יכולה לנבוע משפע של תרחישים כולל טיפול בסרטן, חשיפה מקרית או פעולות טרור. קרניים רדיואקטיביות יכולות לחדור דרך העור ולהשפיע על המבנים בדרכן, כולל עור, שרירים ואיברים פנימיים. העור הוא המבנה הראשון שנחשף לקרינה והוא רגיש לפתח פיברוזיס כרוני, דבר מאתגר לטיפול. נכון לעכשיו, אפשרויות טיפול מוגבלות מראות יעילות בינונית בהפחתת פיברוזיס עורי הקשור לקרינה. גורם מרכזי המעכב את הפיתוח של אמצעי נגד יעילים הוא היעדר מודל נוח וחזק שיכול לאפשר תרגום של ממצאי הניסוי לבני אדם. כאן, הוקם מודל פיברוזיס של עור הגפיים האחוריות של עכברים חזק וניתן לשחזור להערכה מונעת וטיפולית של גורמים אפשריים להתאוששות תפקודית ומולקולרית.
הגפה האחורית הימנית הוקרנה באמצעות מנה אחת של 40 (אפור) Gy כדי לגרום לפיברוזיס בעור. הנבדקים פיתחו בצקת ודרמטיטיס בשלבים המוקדמים שנמשכו על ידי התכווצות עור נראית לעין. גפיים מוקרנות הראו טווח תנועה מופחת משמעותית של הגפיים בשבועות הבאים. בשלבים מאוחרים, תופעות הלוואי החריפות שככו, אך פיברוזיס כרוני נמשך. מדד הליכה בוצע כבדיקה תפקודית נוספת, שהדגימה התפתחות של ליקוי תפקודי. שיטות לא פולשניות אלה הדגימו מדידות אמינות למעקב אחר התקדמות פיברוזיס, הנתמכת על ידי ניתוחים היסטולוגיים. מינון הקרינה, היישום והניתוחים שלאחר ההקרנה המשמשים במודל זה מציעים שיטה נמרצת וניתנת לשחזור לחקר פיברוזיס בעור הנגרמת על ידי קרינה ובדיקת יעילותם של חומרים טיפוליים.
Introduction
העור הוא האיבר הגדול ביותר בגוף, המכסה ומגן על הגוף מפני סכנות. יש לו שלוש שכבות נפרדות: אפידרמיס, דרמיס והיפודרמיס. לכל שכבה יש את התפקידים הייחודיים שלה: האפידרמיס מונע התייבשות ופלישת חיידקים; לדרמיס רשת תאים עשירה, ומטריצה חוץ-תאית המספקת חוזק מתיחה וגמישות1; שכבת העור מכילה את הקולטנים התחושתיים, זקיקי השיער, הבלוטות וכלי הדם לרשתות הלימפה והנימים. ההיפודרמיס או הרקמה התת עורית, עם שפע רקמת השומן שלה, מתארת את הגוף ומפיצה מתח מכני 2,3,4.
קרינה, הנוצרת כתוצאה מתאונות, מלחמה, טרור או יישומים טיפוליים, חודרת דרך הגוף בטבע פרוגרסיבי ליניארי, ומובילה את העור להיות האיבר הראשון שבא במגע. האיום של תקריות כאלה התגבר עקב השימוש המוגבר בחומרים רדיואקטיביים בתעשיות, מתקנים רפואיים ומתקנים צבאיים5. מבחינה קלינית, נזקי קרינה לעור מאופיינת בתסמונת קרינה עורית (CRS), אחת מארבע תת-תסמונות של תסמונת קרינה חריפה (ARS). לתגובת העור לקרינה מייננת יש השלכות חשובות על הטיפול וההגנה מפני נזקים נוספים6. פציעות נלוות כגון כוויות וטראומה מסבכות עוד יותר את התוצאה הקלינית בשילוב עם פציעות קרינה7. מידת החשיפה של העור לקרינה קשורה לסף נקודת אל-חזור, שממנו פגיעה באיברים אחרים גורמת לכשל של איבר בודד או מרובה, ובסופו של דבר מובילה למוות של המטופל 8,9. פגיעה בקרינה עורית מורכבת משלב אקוטי ושלב כרוני. פגיעת קרינה חריפה מתבטאת קלינית באריתמה, בצקת בעור, דרמטיטיס, שלפוחיות, כריתת אפידרמיס, קיבוע יבש או רטוב, כיב ושינויים בשיער ובציפורניים. השלב הכרוני מתבטא בניוון עור, פיברוזיס, כיב כרוני וטלנגיקטזיות10,11. באופן כללי, השפעות חריפות באות לידי ביטוי בעיקר באפידרמיס, בעוד שהשפעות כרוניות בולטות ביותר בדרמיס. תגובה חריפה לחשיפה לקרינה מובילה לירידה ניכרת בפעילות המיטוטית תוך 12 שעות מהחשיפה, ואחריה היפרמיה, הגדלת תאים, ואקואוליזציה, פיקנוזיס גרעיני ופיצול 4,12.
מינוני קרינה העולים על 40 Gy גורמים להתייבשות לחות ולאובדן האפידרמיס, מה שמוביל לרגישות מוגברת לזיהומים13. בנוסף, חשיפת העור לקרינה גורמת לייצור ציטוקינים, ומעוררת תגובה חיסונית דלקתית בשכבת העור. מתווכים דלקתיים בולטים כוללים אינטרלוקינים (IL-1, IL-3, IL-5, IL-6 ו-IL-8) וגורם נמק גידול-α (TNFα)14. כשל ברזולוציה של דלקת יכול בסופו של דבר לגרום להתפתחות פיברוזיס באתר פגיעת הקרינה15. פצעים פיזיים נוספים או פציעות תרמיות מחמירים עוד יותר את התגובה הפיברוטית הזו, המשתרעת דרך שכבת השריר16. גורם גדילה טרנספורמטיבי-β (TGFβ) הוא הציטוקין העיקרי בהתפתחות פיברוזיס17. נכון לעכשיו, מעט מאוד אפשרויות טיפול מראות תוצאות מבטיחות, ולרובן עשויים להיות אתגרים בהיענות המטופלים. מחקר נוסף הבוחן את התגובות התאיות והמולקולריות של העור למינוני קרינה שונים ישפר את ההבנה של פתופיזיולוגיה של העור הנגרמת על ידי קרינה וישפר את הפיתוח של טיפולים חדשים.
כדי להקל על התרגום הקליני של תוצאות מחקר במודלים פרה-קליניים בהקלה על פגיעה הנגרמת על ידי קרינה בעור וברקמות רכות, תכנון מודלים ניסיוניים רלוונטיים ביותר של התערבויות טיפוליות לאחר הקרנה הוא קריטי. תוארו גם מודלים במבחנה וגם ב-vivo של פגיעה הנגרמת על ידי קרינה, כולל מודלים של תרביות תאים של תאי אנדותל מוקרנים18,19, פיברובלסטים20 או קרטינוציטים19 ומודלים של מכרסמים, חזירים ופרימטים לא אנושיים. מודלים של מכרסמים נמצאים בשימוש נרחב במחקר קרינה בשל הדמיון שלהם בתגובה לפגיעת קרינה עם בני אדם וגמישותם במניפולציה גנטית21. דרישות מינון הקרינה גבוהות יותר במכרסמים מאשר בבני אדם כאשר מחפשים תוצאות דומות: קיבוע, פיברוזיס ונמק16,22. תיאור קריטריוני הניקוד למדידת התגובה לקרינה שיפר עוד יותר את האימוץ של מודלים של מכרסמים של פגיעות עור קרינה21,23.
המחקר הנוכחי בסביבה הפרה-קלינית מתמקד בהבנת המנגנונים של פגיעות עור הנגרמות על ידי קרינה ופיתוח אפשרויות טיפוליות. לפיכך, הקמת מודל פרה-קליני חזק וניתן לשחזור ליצירת עלבון קרינה עם יכולת תרגום קלינית גבוהה היא חיונית. עבודה זו מתארת מודל עכברי של פיברוזיס בעור עם מינון קרינה וטכניקת אספקה אופטימליים. המודל שלנו, המשלב מדידות פונקציונליות, היסטולוגיות ומולקולריות, יכול לשמש כדי לחקור ביעילות את מנגנון התפתחות הפיברוזיס ולחקור אפשרויות טיפוליות חדשות.
Protocol
שימוש אתי בבעלי חיים אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC), הפועלת בהתאם לחוק רווחת בעלי חיים. בעלי חיים שוכנו במתקן שאושר על ידי האגודה להערכה והסמכה של Laboratory Animal Care International (AAALAC) וטופלו על פי המדריך הלאומי של המכונים הלאומיים לבריאות לטיפול ושימוש בחיות מעבדה.
1. הרדמה
- הניחו עכברים בקופסה של מערכת הרדמה של חיות קטנות (איור 1). העבירו 4% איזופלורן לקופסה והמתינו 5-10 דקות ואז הורידו את האיזופלורן ל-2-3%.
- אשר את עומק ההרדמה באמצעות צביטת הבוהן. יש למרוח חומר סיכה לעיניים כדי למנוע יובש. העבר את הנבדק לחרוט האף עם זרימת איזופלורן של 2%.
- השתמש בטכניקה לעיל כדי להרדים כל עכבר לצורך בדיקת גילוח ומדידת גפיים. השתמש במינון הזרקה תוך-צפקי של פנטוברביטל של 1.25 מ"ג/ק"ג כדי להרדים עכברים להקרנה.
2. הכנת אזור העור
- תכנן לגלח את העכברים 2-3 ימים לפני ההקרנה. קצצו את השיער באמצעות קוצץ (איור 2A).
- מרחו קרם להסרת שיער והמתינו 1-2 דקות (איור 2B). נגבו את הקרם עם גזה יבשה ושטפו את העור עם גזה ספוגה במי מלח פוספט (PBS) (איור 2C).
3. הליך הקרנה
- להרדים כל עכבר בזריקה תוך צפקית הניתנת 5 דקות לפני ההקרנה. מקם את הגפה בשדה הקרינה (25 ס"מ על 25 ס"מ) ואבטח אותה עם סרט כירורגי (איור 3A-C).
- הגבל את הגוף באמצעות סרט כירורגי (איור 3D). הניחו בולוס בעובי 1 ס"מ כדי למנוע/למזער חדירה עמוקה של קרינה (איור 3E).
- חשב את גורמי המוליך והחתך כדי לספק 40 Gy לעור העכבר. לצורך הניסוי כאן, השתמש במאיץ ליניארי כדי ליצור אלומת אלקטרונים של 6 MeV עבור 3740 יחידות מוניטור כדי לגרום לכוויות קרינה. במצב זה, שדה קרינה של 25 ס"מ על 25 ס"מ במינון של 1,000 MU לדקה עם מרחק מקור לפני השטח (SSD) של 100 ס"מ, שהוא המרחק ממקור הקרינה לחלק העליון של הבולוס כדי לספק את ה-40 Gy. זמן ההקרנה ישתנה בהתאם למאיץ הליניארי בו נעשה שימוש, אנרגיית האלומה וגודל השדה. יש להתייעץ עם פיזיקאי קרינה או רפואי כדי לחשב את יחידות המוניטור הדרושות כדי לספק 40Gy על המאיץ הליניארי.
4. ניטור חזותי של התפתחות פיברוזיס
- השתמש במצלמה דיגיטלית כף יד כדי לתעד את התקדמות הפיברוזיס. השתמש בהגדרת המאקרו כדי לצלם תמונות מפורטות.
- הרדמת עכברים על ידי שאיפת איזופלורן.
- צלם תמונות על ידי מיקום העדשה קרוב יותר לעור ולחץ על לכידה. נסה לשמור על עקביות התמונות ככל האפשר. יש להשאיר את הנבדק תחת השגחה ישירה עד להכרה מספקת כדי לשמור על שכיבה על עצם החזה.
5. מדידת סטיית רגליים כתוצר תפקודי של פיברוזיס
- החל מהשבוע השלישי לאחר ההקרנה, תכננו לבצע מדידות בכל שבוע למשך עד 6 שבועות.
- התחל ותחזק את ההרדמה כמתואר לעיל. הכינו שדה לפני חרוט האף וקבעו מד זווית עם סרט במרכז (איור 4A).
- העבירו את העכבר לשדה והניחו בעדינות את אפו על החרוט. מקם את ברך ימין למרכז מד זווית (איור 4B).
- שמרו על הברך מקובעת באמצעות יד שמאל והשתמשו ביד ימין כדי לכופף את כף הרגל עם האצבעות המורה והאצבעות הפולקס (איור 4C,D).
- שימו לב למידת ההארכה על ידי קריאת הערך המצוין על ידי אצבעות הרגליים. בצע את אותו הליך על הרגל הנגדית שאינה מוקרנת.
6. מדידת אינדקס תפקודי הליכה
- הדפס בתלת מימד את מסלול ההליכה של המכרסמים כדי ליצור שביל הליכה של 40 ס"מ התלוי בגובה 15 ס"מ עם רצפה שקופה (איור 5). הנח מקליט וידאו מתחת למסלול והתחל לצלם. המצלמה מותאמת להקלטת סרטון ברזולוציה הגבוהה ביותר האפשרית ובקצב פריימים מינימלי של 60 פריימים לשנייה.
- פתח קצה אחד של הרצועה והעבר את העכבר פנימה. תנו לבעל החיים ללכת בחופשיות על המסלול. צלמו את החיה הולכת בצורה חלקה ככל האפשר לפחות שלוש פעמים.
- בדוק את איכות הסרטון לפני הקלטת העכבר הבא.
- העבר את הסרטונים למחשב עם נגן וידאו, יישום צילום מסך, תוכנית לעיבוד תמונה ותוכנת גיליון אלקטרוני. צפו בהקלטות כדי ללכוד שלוש חתימות-שטח שונות וברורות באמצעות פונקציית צילום המסך (איור 6).
- פתח את תוכנית עיבוד התמונה למדידות התפשטות הבוהן. בחר File בחלונית העליונה ולחץ על Open כדי למצוא ולהציג את התמונה לניתוח.
- בחר כלי קו ישר מהשורה השנייה של הפאנל העליון (איור 7_1). בעזרת כלי זה, סמן את רוחב הקיר ולחץ על נתח > הגדר קנה מידה, ולאחר מכן הזן את הערך המדויק עבור מרחק ידוע כדי לכייל את קנה המידה (איור 7_2-5).
- השתמש בכלי הקו הישר כדי לסמן את טביעת הרגל עבור מדידות שונות (איור 6C, D; 1: אורך רגל, 2: התפשטות הבוהן החיצונית, 3: התפשטות הבוהן הפנימית), בחר ניתוח > מדידה ורשום את ערך האורך (איור 8).
- בצע את הניתוחים הן עבור הגפיים המוקרנות והן עבור הגפיים הלא מוקרנות. השתמש במשוואה הבאה שפורסמה בעבר כדי להעריך את הפונקציונליות24
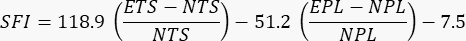
כאשר SFI = מדד פונקציונליות סיאטית, E = כפה ניסיונית או פצועה, N = כפה רגילה או לא פגועה, TS = התפשטות הבוהן ו-PL = אורך הדפסה.
7. המתת חסד
- העבר את הנבדק לקופסה המחוברת לקו CO2 . התחל את עירוי ה-CO2 כדי להגיע לריכוז של 30%-70% בתוך החדר. עבור תא של 5 ליטר, עירוי הגז חייב להיות בין 1.5-3.5 ליטר לדקה.
- המתן עד שהחיה תפסיק את הנשימה למשך 5-10 דקות. המתת חסד על ידי פריקת צוואר הרחם על ידי החזקת הראש במקומו מבסיס הגולגולת ומשיכה חזקה של הזנב25.
8. היסטולוגיה וניתוחים במורד הזרם 17
- משוך את הגפה האחורית המוקרנת כדי להכין אותה לכריתה. בחר אזור של 2 ס"מ על 1 ס"מ למישור האחורי של העור הקיצוני.
- השתמש במספריים חדים כדי לאסוף בזהירות את דגימת העור. חותכים את הרקמה לשניים מהציר הארוך לקבלת שתי חתיכות נפרדות.
- יש לתקן חתיכת טישו אחת במי מלח עם 10% פורמלין. עבד את הרקמה הקבועה להכנת חתכים היסטולוגיים על שקופיות.
- העבירו את החתיכה השנייה לקופסה מלאה בקרח יבש כדי לשמר את החלבונים וה-RNA. לאחר מכן, העבירו במהירות את דגימות הרקמה למקפיא של -80 מעלות צלזיוס ושמרו אותן קפואות עד לעיבוד נוסף.
- צבעו את השקופיות עבור כתם המטוקסילין ואאוזין (H&E) וכתם הטריכרום של מאסון. דמיין את השקופיות המוכתמות במיקרוסקופ וצלם תמונות בהגדלה פי 10. מדוד את עובי האפיתל באמצעות תוכנת עיבוד תמונה כפי שהוסבר לעיל עבור הבדיקה הפונקציונלית של ההליכה.
9. סטטיסטיקה
- הצג את הנתונים כממוצע ± סטיית תקן. הערך את התוצאות באמצעות ניתוח שונות (ANOVA) ואחריו מבחן ההשוואה הרב-תכליתי של בונפרוני או מבחן ה-t של הסטודנט.
תוצאות
הקמה ואופטימיזציה של פרוטוקול ההקרנה הנוכחי הביאו לאינדוקציה עקבית וניתנת לשחזור של פיברוזיס בעכברים. הגפיים הימניות של העכברים מוקמו ואובטחו בתוך שדה הקרינה ביום ההקרנה, וניתנה 40 Gy של קרינה.
התפתחות הפגיעה התפקודית בעור נוטרה על ידי צילום תמונות מדי שב?...
Discussion
פגיעה בעור היא תוצאה סבירה של חשיפה מקרית או הקשורה לטיפול רפואי לקרינה. לכורים גרעיניים יש סיכון לפריצה בשוגג עקב טעות אנוש או אסונות טבע כמו צ'רנוביל ופוקושימה26,27. מינון טיפולי לטיפול בסרטן הוא החשיפה הנפוצה ביותר, המשתמשת במשטרי מינון ?...
Disclosures
למחברים אין אינטרסים פיננסיים מתחרים או ניגודי אינטרסים אחרים הקשורים לעבודה זו.
Acknowledgements
עבודה זו ממומנת על ידי מענקי מחקר ממשרד ההגנה W81XWH-19-PRMRP-DA, NIAID/NIH Grant 5R21AI153971-02 ומענק PSF/MTF 603902.
Materials
| Name | Company | Catalog Number | Comments |
| 10% Formalin | Fischer Scientific | 23-427098 | |
| Bolus | Orfit | 8333.SO1/R | |
| Clipper | Kent Scientific Corp. | CL8787-KIT | |
| CO2 | Various | ||
| CO2 Chamber | E-Z Systems Inc. | E-22000 | |
| Depilatory Cream | Church & Dwight Co., Inc. | Nair | |
| Digital Camera | Wolfang | GA100 | |
| Eppendrof Tubes | Eppendorf | 22364111 | |
| Eye Lubricant | Dechra | Puralube Ophthalmic Ointment | |
| Gauze | Covidien | 682252 | |
| Image Processing Program | NIH | Image J | |
| Isoflurane | Dechra | USP Inhalation Anesthetic | |
| Linear Accelaerator | Varian Medical Systems, Inc. | 23EX | |
| PBS | Cytiva | SH30256.LS | |
| Pentobarbital | Akorn Pharmaceuticals | Nembutal | |
| Protractor | Westcott | 550-1120 | |
| Small Animal Anesthesia System | E-Z Systems Inc. | EZ-SA800 | Single animal system |
| Spreadsheet Software | Microsoft | Excel | |
| Surgical Scissors | Medline | MDS0834111 | |
| Surgical Tape | 3M | 1538-1 | |
| Tape | 3M | H-1113 |
References
- Breitkreutz, D., Mirancea, N., Nischt, R. Basement membranes in skin: unique matrix structures with diverse functions. Histochemistry and Cell Biology. 132 (1), 1-10 (2009).
- Kim, J. -. S., et al. Comparison of skin injury induced by β-and γ-irradiation in the minipig model. Journal of Radiation Protection and Research. 42 (4), 189-196 (2017).
- Kolarsick, P. A., Kolarsick, M. A., Goodwin, C. Anatomy and physiology of the skin. Journal of the Dermatology Nurses' Association. 3 (4), 203-213 (2011).
- von Essen, C. F. Radiation tolerance of the skin. Acta Radiologica: Therapy, Physics, Biology. 8 (4), 311-330 (1969).
- Dainiak, N., et al. Literature review and global consensus on management of acute radiation syndrome affecting nonhematopoietic organ systems. Disaster Medicine and Public Health Preparedness. 5 (3), 183-201 (2011).
- Hopewell, J. The skin: its structure and response to ionizing radiation. International Journal of Radiation Biology. 57 (4), 751-773 (1990).
- Flynn, D. F., Goans, R. E. Nuclear terrorism: triage and medical management of radiation and combined-injury casualties. Surgical Clinics. 86 (3), 601-636 (2006).
- Peter, R. Cutaneous radiation syndrome in multi-organ failure. The British Journal of Radiology. 78 (1), 180-184 (2005).
- Meineke, V. The role of damage to the cutaneous system in radiation-induced multi-organ failure. The British Journal of Radiology. 78 (1), 95-99 (2005).
- Berger, M., Christensen, D., Lowry, P., Jones, O., Wiley, A. Medical management of radiation injuries: current approaches. Occupational Medicine. 56 (3), 162-172 (2006).
- Ralf, U. P., Petra, G. Management of cutaneous radiation injuries: diagnostic and therapeutic principles of the cutaneous radiation syndrome. Military Medicine. 167, 110-112 (2002).
- Bray, F. N., Simmons, B. J., Wolfson, A. H., Nouri, K. Acute and chronic cutaneous reactions to ionizing radiation therapy. Dermatology and Therapy. 6 (2), 185-206 (2016).
- Mendelsohn, F. A., Divino, C. M., Reis, E. D., Kerstein, M. D. Wound care after radiation therapy. Advances in Skin & Wound. 15 (5), 216-224 (2002).
- Peter, R. U. . Radiation Treatment and Radiation Reactions in Dermatology. , 185-188 (2015).
- Ejaz, A., Greenberger, J. S., Rubin, P. J. Understanding the mechanism of radiation induced fibrosis and therapy options. Pharmacology & Therapeutics. 204, 107399 (2019).
- Williams, J. P., et al. Animal models for medical countermeasures to radiation exposure. Radiation research. 173 (4), 557-578 (2010).
- Ejaz, A., Epperly, M. W., Hou, W., Greenberger, J. S., Rubin, J. P. Adipose-derived stem cell therapy ameliorates ionizing irradiation fibrosis via hepatocyte growth factor-mediated transforming growth factor-beta downregulation and recruitment of bone marrow cells. Stem Cells. 37 (6), 791-802 (2019).
- Haubner, F., et al. Effects of external radiation in a co-culture model of endothelial cells and adipose-derived stem cells. Radiation Oncology. 8 (1), 66 (2013).
- Ebrahimian, T. G., et al. Cell therapy based on adipose tissue-derived stromal cells promotes physiological and pathological wound healing. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 503-510 (2009).
- Haubner, F., et al. A co-culture model of fibroblasts and adipose tissue-derived stem cells reveals new insights into impaired wound healing after radiotherapy. International Journal of Molecular Sciences. 16 (11), 25947-25958 (2015).
- Urano, M., Kenton, L. A., Kahn, J. The effect of hyperthermia on the early and late appearing mouse foot reactions and on the radiation carcinogenesis: effect on the early and late appearing reactions. International Journal of Radiation Oncology Biology Physics. 15 (1), 159-166 (1988).
- Law, M., Thomlinson, R. The pathogenesis of necrosis after radiotherapy. The British Journal of Radiology. 47 (562), 740 (1974).
- Abe, Y., Urano, M. Fraction size-dependent acute skin reaction of mice after multiple twice-a-day doses. International Journal of Radiation Oncology Biology Physics. 18 (2), 359-364 (1990).
- Inserra, M. M., Bloch, D. A., Terris, D. J. Functional indices for sciatic, peroneal, and posterior tibial nerve lesions in the mouse. Microsurgery. 18 (2), 119-124 (1998).
- Suckow, C. P. S. a. M. A., Weichbrod, R. H., Thompson, G. A., Norton, J. N. . Management of Animal Care and Use Programs in Research, Education, and Testing. , (2018).
- Yamashita, S., Suzuki, S., Suzuki, S., Shimura, H., Saenko, V. Lessons from Fukushima: latest findings of thyroid cancer after the Fukushima nuclear power plant accident. Thyroid. 28 (1), 11-22 (2018).
- Cardis, E., et al. Cancer consequences of the Chernobyl accident: 20 years on. Journal of Radiological Protection. 26 (2), 127-140 (2006).
- Williams, N. R., et al. Radiation-induced fibrosis in breast cancer: A protocol for an observational cross-sectional pilot study for personalised risk estimation and objective assessment. International Journal of Surgery Protocols. 14, 9-13 (2019).
- Meineke, V., Fliedner, T. Radiation-induced multi-organ involvement and failure: challenges for radiation accident medical management and future research. The British Journal of Radiology. 78 (1), 196-200 (2005).
- Stone, H. B. Leg contracture in mice: an assay of normal tissue response. International Journal of Radiation Oncology Biology Physics. 10 (7), 1053-1061 (1984).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved