Method Article
Langendorff 模型中离 体 小鼠双心室功能的评估
摘要
这里介绍的是一种方案,用于使用离体灌注系统在冷保存后可靠地量化供 体 心脏的右心室和左心室功能。
摘要
原发性移植物功能障碍 (PGD) 仍然是心脏移植后早期死亡的主要原因。冷藏期间缺血时间延长是PGD的重要危险因素,可靠的心脏功能评估对于研究供体心脏在冷藏后的功能反应至关重要。随附的视频描述了一种在不同持续时间的冷保存后使用基于 Langendorff 模型的 离体 灌注评估小鼠右心室和左心室功能的技术。简而言之,将心脏分离并储存在冷的组氨酸-色氨酸-酮戊二酸 (HTK) 溶液中。然后,在Langendorff模型中用Kreb缓冲液灌注心脏60分钟。将硅胶球囊插入左心室和右心室,并记录心脏功能参数(dP/dt,压力-容积关系)。该协议允许在不同的心脏保存方案后可靠地评估心脏功能。重要的是,该技术允许研究天然心脏细胞中的心脏保存反应。使用非常小的小鼠心脏可以接触到大量的转基因小鼠来研究PGD的机制。
引言
心脏移植可提高终末期心力衰竭患者的生存率和生活质量1.不幸的是,心脏供体的短缺限制了可以从这种疗法中受益的患者数量,并限制了临床医生将供体与接受者进行最佳匹配的能力2,3,4。此外,自 2018 年以来,新的分配系统延长了缺血时间,并显着增加了边际供体的使用5。因此,心脏供体的平均年龄和缺血时间随着时间的推移而增加,导致原发性移植物功能障碍 (PGD) 的发生率更高,尽管心脏保存策略有显着改进 6。
PGD 可累及左心室、右心室或双心室,并且仍然是一种危及生命的并发症,是心脏移植后早期死亡的主要原因。鉴于 PDG 对心脏受者的潜在挽救生命影响,研究 PDG 的机制和制定更好的心脏保护策略是重要的考虑因素。因此,允许在长时间储存后对供体心脏功能进行稳健可靠的评估的实验模型对于增加我们对PGD的理解和促进新疗法的开发至关重要。准确评估小鼠心脏功能的能力允许获得大量可以准确识别PGD机制的转基因小鼠模型。
在生理学和药理学研究中,Langendorff 逆行灌注模型广泛用于评估心脏功能7。具体来说,心脏功能是通过连接到左心室 (LV) 腔内压力传感器的硅胶球囊来检测的。PGD的一个关键特征是心室肌肉的收缩和松弛不足。先前的 Langendorff 研究侧重于使用左心室球囊在左心室功能评估中产生可靠且可重复的结果 8,9,10。然而,使用球囊系统使用腔内球囊评估右心室 (RV) 功能不太为人所知。
鉴于移植后 RV 的显着 PGD 发生率11,研究 LV 和 RV 功能的实验方法将有助于确定导致 RV PGD 的分子和生理机制。该协议表明,腔内硅胶球囊可以提供对同一小鼠心脏12 中 LV 和 RV 功能的可靠评估。为了评估Langendorff系统在PGD研究中的潜在用途,我们检查了不同储存期的心脏功能,发现随着小鼠心脏长时间的冷藏,收缩和松弛的心脏功能下降。有趣的是,LV 的功能减少比 RV 高。总之,此处描述的方案可用于评估候选药物和分子途径对左心室和右心室功能的影响。在小鼠心脏上使用这种方法的能力将有助于进行详细的机理研究。
研究方案
该协议中的所有动物实验均已获得密歇根大学安娜堡分校机构动物护理和使用委员会的批准。所有小鼠均以12:12的光周期饲养在无病原体的房间中。有关本协议中使用的所有材料,动物和设备的详细信息,请参阅 材料表 。
1. 硅胶球囊导管的结构
注意: 硅胶气球的制造方式如前所述13.
- 向 100 mL 烧杯中加入 9.5 mL 蒸馏水、14.2 mL 淡玉米糖浆和 33.8 g 蔗糖。加热并搅拌溶液,直到糖完全溶解。
- 将 10 克小麦粉和 5 克水混合,直到达到均匀的稠度,然后静置 10 分钟。
- 将一小块面团揉成椭圆形——"头"——并将其连接到干意大利面条的末端。然后,将该头浸入糖溶液中并慢慢从溶液中取出,因为该头现在已经完全包被。
注意:面团应光滑且质地均匀。面团的大小可以改变以产生不同尺寸的气球,从 5 毫米(短直径)到 7 毫米(长直径)。尝试用糖溶液薄膜覆盖它们。 - 将意大利面条悬挂在聚苯乙烯泡沫块或其他支架上,以均匀地在头上形成光滑的覆盖物并干燥过夜。
- 将模具浸入硅分散体中(分散在二甲苯中的有机硅弹性体)。将意大利面条放回聚苯乙烯泡沫块中,在37°C下2小时或直至干燥。重复此步骤一次。
注意: 必须防止有机硅分散凝胶因暴露在空气中而氧化,因为这会产生不均匀的球囊厚度。 - 将模具放入水中以分离并收集气球。将球囊储存在0.02%叠氮化钠中。
- 从 22 G 针头上切下两钝头尖端;将一个钝端安装到硅胶球囊上,将另一个钝端安装到 PE 管上。用 4-0 真丝将气球绑在针上。
注意: 通过向气球注入水来测试气球的完整性。气球装满后,轻轻按压气球以测试气球是否保持内部张力。如果气球泄漏,请使用新气球。安装的气球可以存放以备将来使用。
2.心脏灌注系统的准备
- 制备 1 L Krebs-Henseleit (KH) 灌注缓冲液并将其转移到水库 Langendorff 系统。
- 将空气管连接到储水器并打开气流以平衡 KH 缓冲液与 5% CO 2 和 95% O2 至少 30 分钟。
- 将水浴设置在41.5°C,并在Langendorff系统的外层循环水,以预热系统和KH缓冲液。
注意:每个系统都需要优化水浴温度。对于该系统,当灌注到心脏时,水浴温度将保持 KH 在 37-37.5 °C。
3. 小鼠心脏的分离、安装和插管
- 对于抗凝,通过腹膜内 (ip) 注射 200 单位的生理盐水肝素到 C57/B6 小鼠腹部的右侧象限。注射前抽吸注射器,以确认针头的斜面不在胃肠道的膀胱或管腔内。在每个实验条件下至少使用四只小鼠(但也要考虑治疗效果的大小)。
- 30分钟后,给予80mg / kg氯胺酮和10mg / kg甲苯噻嗪ip麻醉小鼠。通过捏脚趾并确保没有观察到反应来检查麻醉的小鼠是否失去知觉。如果仅使用ket/xyl的小鼠品系未达到足够的麻醉水平,则可以将乙酰丙嗪2mg / kg添加到ket / xyl混合物中。
- 在胸骨正下方做一个切口。用剪刀剪断隔膜和肋骨,打开胸部。折叠前胸壁,使胸部完全暴露。在降主动脉处切开(靠近主动脉弓)。将小鼠的心脏、肺和胸腺转移到冷组氨酸-色氨酸-酮戊二酸(HTK)缓冲液中。在冰冷的HTK缓冲液下分离器官。通过切除任何结缔组织来暴露主动脉。
注意:通过在切除术中包括升主动脉和主动脉弓区域来最大化主动脉长度,以留出足够的空间连接到针头。
- 将主动脉的末端连接到 22 G 针头,并用 6-0 丝线缝合。确保插管位于主动脉根部上方,以免干扰主动脉瓣。用10mL冷(4°C)HTK缓冲液灌注主动脉约10分钟。
注意:从心脏切除到主动脉插管不到 15 分钟;但是,将灌注速度保持在适当的水平很重要。过快和用力的注射会产生高压并导致血管/心脏损伤。 - 将心脏储存在装有冰冷HTK的50mL管中8小时或立即进行灌注(不要储存对照)并避免直接接触冰。
注意:心脏组织与冰的直接接触可能会导致冷损伤。 - 将针头安装的心脏连接到Langendorff装置中的套管上,并用丝线将其绑在一起。
注意:为了标准化程序,在灌注前总共等待 3 分钟的插管过程。 - 以 3 mL/min 的恒定流速模式开始灌注;然后,切换到 70-80 mmHg 的恒压模式,并将心脏调节至 ~6 mL/min。
注意:轻轻触诊心脏有助于加速心脏复苏。如果在恒压模式下灌注流速远高于 6 mL/min,则插管中可能存在泄漏或主动脉瓣可能无法正常工作。调整连接以修复泄漏。恒定流动模式覆盖了心脏的血管张力自我调节。恒压模式允许心脏调节其冠状动脉灌注流量。因此,恒压模式将精确测量心脏功能和心脏的保存质量。 - 用三向水龙头将放气的充水气球连接到压力传感器和充满水的注射器。经过 15-20 分钟的平衡期后,切开右心房 (RA) 并通过 RA 将球囊插入 RV。使用胶带将球囊固定在 RV 内。 尽量减少 RA 的开放区域以帮助限制心室中的球囊(设置见 图 1 )。
注意:一段时间的平衡是必要的,因为心脏收缩和松弛在开始时不稳定,并且测量的准确性和代表性较差。如果房室结在RA开放期间受损,心脏将出现频繁的心律失常。 - 在 RV 功能数据收集 20 分钟后,切开左心房 (LA) 并通过 LA 将放气的充满水的球囊插入 LV。使用胶带将球囊固定在 LV 内。
注意:心脏应保持稳定的血流动力学超过1.5小时。
4.功能数据记录
- 压力传感器的校准
- 用温盐水填充 10 mL 注射器,并通过三向水龙头将注射器连接到圆顶。打开水龙头,慢慢地用生理盐水填充圆顶,然后关闭所有水龙头并取出注射器。将填充的圆顶连接到换能器;将压力表连接到三向水龙头的第三端。
- 在录音软件中,选择 桥式放大器 从连接到换能器的通道的下拉菜单中。将 通道 重命名为 灌注压力。单击 "归零 "(Zero) 将换能器归零。
- 单击"开始" 开始 记录,使探头现在的读数为 0 mmHg。记录几秒钟后,慢慢推动注射器并将 压力 增加到 100。单击 " 停止"以停止录制。
- 在单位转换对话框中,选择 0 mmHg 的记录区域,然后单击箭头到点 1 并键入 0 mmHg。选择 100 mmHg 的记录区域,单击点 2 的箭头,然后键入 100 mmHg。单击"确定"(OK) 校准换能器。
- 将与带有球囊的压力传感器对应的通道重命名为 心室压力。当心脏连接到系统时开始记录。将球囊插入心室后,使用千分尺注射器通过三向水龙头调节球囊中的 水量 ,以将 舒张末期压力 保持在 5-10 mmHg。
注意:在测量过程中,舒张末期测量值可能会降低,最好从接近 10 mmHg 开始。 - 将 空通道 重命名为 dP/dt。从下拉菜单中,选择" 导数"|"源通道" 作为 "心室压力"。该通道将记录收缩期间心室腔内的压力变化比。
- 选择一个稳定的测量周期,然后单击血压模块上的设置。
- 选择 心室压力 作为 输入通道 , 然后单击选择 进行 计算 |好的。
- 单击 分类器视图 以删除异常心动周期(例如,异常的周期时间或压力)。
- 单击 表格视图 可生成所选周期内最大 dP/dt(收缩)和最小 dP/dt(松弛)的平均值的表格。
注意: 存储每个样本的记录文件并保存平均心脏功能表以进行统计分析。
结果
收获 3 个月大的成年 C57Bl/6 小鼠心脏并安装到 Langendorff 系统中。将供体心脏在HTK中储存0和8小时,然后用含氧KH缓冲液灌注。使用连接到压力传感器的硅胶球囊来测量左心室和右心室功能的收缩和松弛。
主动脉压保持在 70-80 mmHg 范围内。在储存 0 小时和 8 小时的小鼠心脏中,心率相当。通过测量收缩压和舒张压来检查左心室和右心室功能。计算压力变化比的导数dP/dt,用于确定压力动力学。最大 dP/dt 和最小 dP/dt 的绝对数可以代表肌肉收缩和松弛的水平。在储存0小时时,与RV相比,LV具有更高的收缩压(图2C和图3A)。在灌注0小时储存后,左心室显示出比RV更多的肌肉收缩和松弛(图2C和图3B,C)。然而,冷藏 8 小时后,与 0 小时基线相比,LV 和 RV 均显示出显着的功能降低(图 2A-D 和图 3B,C)。左心室心脏收缩的减少更为严重。储存8小时后,LV的收缩和松弛分别为0 h基线的25.1%和30.7%,而与0 h基线相比,RV的功能分别为32.5%和29.1%(图3B,C)。这些结果表明,长期储存后左心室的PGD比右心室有更显着的心脏收缩减少。
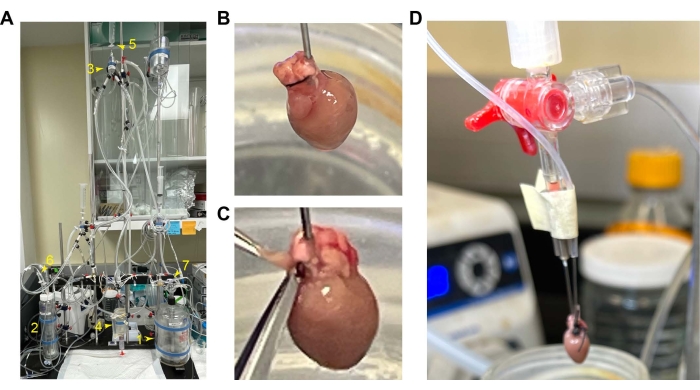
图 1:小鼠心脏的安装和插管 。 (A) 灌注装置的整体设置。1.灌注储液器。2.氧合室。3.空气疏水阀室。4.心腔。5.恒定流量和压力的数值开关。6 和 7.氧气流入。(B) RV 在前面的空心。(C) RV 为打开其型腔而切割的位置。(D) 用套管敲击球囊管。缩写:RV = 右心室。 请点击这里查看此图的较大版本.
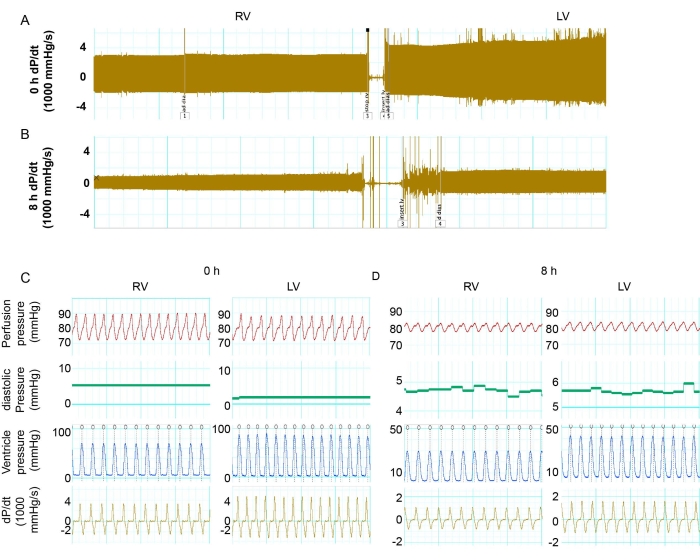
图 2:比较 LV 与 RV 的功能 。 (A) 在储存 0 小时的情况下,RV 中的最大和最小 dP/dt 和供体心脏中 LV 的追踪记录。(B) 储存 8 小时后 RV 中最大和最小 dP/dt 和供体心脏中 LV 的记录。(三、四)0 小时和 8 小时时左心室和右心室的 dP/dt、左心室压力、心率和灌注压的详细信息。缩写:RV = 右心室;LV = 左心室;dP/dt = 压力-时间关系。 请点击这里查看此图的较大版本.
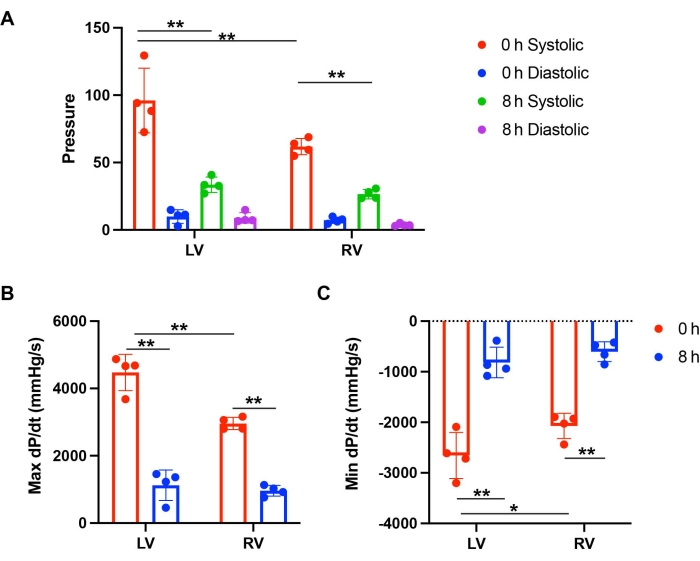
图 3:比较储存和灌注后左心室与右心室的功能 。 (A) 储存 0 小时和 8 小时后左心室和右心室的收缩压和舒张压。(B) 灌注 0 小时和 8 小时后 LV 和 RV 的最大 dP/dt 和 (C) 最小 dP/dt。该图来自 Lei et al.12。 请点击这里查看此图的较大版本.
讨论
该协议描述了 通过 主动脉插管的逆行灌注 Langendorff 方法。该技术可用于评估冷藏后鼠心的左心室和右心室功能。结果表明,使用该方案,供体心脏的长时间冷藏会导致左心室和右心室的心脏功能降低。
心脏移植后急性和慢性排斥反应的研究广泛集中在免疫生物学上14.天然细胞在冷藏过程中对PGD的影响研究较少。PGD 发生在 ~10%-20% 的心脏移植中,占移植后 30 天内早期死亡的 66%。特别是,移植后影响左心室与右心室的 PGD 发生率不同11。在没有受体细胞反应的贡献的情况下,这种离体方法侧重于供 体 心脏冷保存后天然心脏细胞对 PGD 的贡献。进一步的研究可能会将受者反应纳入小鼠心脏移植模型中。
在该方案中,冷保存供体心脏的Langendorff灌注侧重于对温晶体灌注的天然心脏反应,而不会浸润细胞免疫。为了获得可重复的结果,对几个关键步骤进行了标准化。使用HTK溶液将小鼠心脏捕获并储存在冰冷的HTK中,类似于临床实践。用计时器密切监测每颗心脏的HTK溶液的灌注量和输注时间。供体心脏保存在4°C房间中含有HTK的冰上的预冷管中。插管时间 waas 标准化为灌注前 ~3 分钟。所有这些步骤都确保了保冷持续时间是研究中的主要变量。
在灌注开始时,通常可以看到 ~20 分钟的不规则心脏收缩力。心脏组织的逐渐变暖和氧合促进了这种平衡和恢复期。预计在最初的 20 分钟后会有一个相对稳定的时期。在初始平衡期后~18分钟将球囊插入心室腔。一旦插入球囊,我们在心脏稳定 ~25 分钟后开始记录血流动力学。用KH缓冲液灌注可保持稳定的心脏功能~1.5-2小时。因此,我们选择在左心室和右心室中记录 20 分钟的血流动力学。
逆行灌注在研究冷藏后心脏的PGD方面存在一些局限性。首先,由于球囊尺寸和每个心室腔(特别是 RV)空间不足,将两个球囊同时插入 LV 和 RV 非常具有挑战性。因此,我们依次测量 RV 和 LV 的功能。需要注意的是,室间隔对左心室和右心室功能都有显著影响。鼻中隔占右心室功能的 ~50%,因此存在心室间依赖性15。同样重要的是要注意,虽然在 Langendorff 装置中再灌注小鼠心脏的程序需要 ~3 分钟,但在相对温暖的手术区域中植入人类心脏的手术需要 ~45 分钟。相比之下,该Langendorff系统中的小鼠心脏缺血时间较短。在考虑临床转化时应考虑到这一点。
由于我们使用 KH 缓冲液在没有血液的情况下灌注心脏,因此这也可能降低氧气输送效率。然而,在灌注的最初 1.5-2 小时内,心脏功能相对稳定,因此可以进行可靠的血流动力学测量。不幸的是,目前还没有针对这些较小的小鼠心脏的可行的工作心脏灌注模型,并且无法在该系统中评估心室负荷的影响。尽管如此,与移植模型相比,灌注系统具有高度可重复性,并且劳动密集度和耗时更少。它的成本也低于移植研究,这可能使其更适合筛选不同的治疗方案和各种分子途径。通过添加候选药物对保存溶液进行修改,该平台可用于评估药理学药物对降低左心室和右心室中PGD的影响。
披露声明
作者没有任何利益冲突需要披露。
致谢
没有。
材料
| Name | Company | Catalog Number | Comments |
| 4-0 silk suture | Braintree Scientific | SUTS108 | |
| 6-0 Silk suture | Braintree Scientific | SUTS104 | |
| All purpose flour | Kroger | ||
| BD General Use and PrecisionGlide Hypodermic Needles 22 G | Fisher scientific | 14-826-5A | |
| BD Syringe with Luer-Lok Tips (Without Needle) | Fisher scientific | 14-823-16E | |
| Corn Syrup | Kroger | ||
| Custodiol HTK Solution | Essential Pharmaceuticals LLC | ||
| Dissecting Scissors | World Precision Instruments | 14393/14394 | |
| Falcon 50 mL conical tubes | Fisher scientific | 14-959-49A | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H4784 | |
| Krebs Henseleit buffer | Sigma | K3753 | |
| Nusil silicone dispersions | Avantor | ||
| Perfusion system | Radnoti | 130101BEZ | |
| PowerLab | ADInstruments | PL3508 | |
| Sodium azide | Sigma | S2002 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sucrose | Sigma | S0389 | |
| Sucrose | Sigma | S0389 | |
| Xylazine | Sigma | X1126 |
参考文献
- Kim, I. C., Youn, J. C., Kobashigawa, J. A. The past, present and future of heart transplantation. Korean Circulation Journal. 48 (7), 565-590 (2018).
- Gaffey, A. C., et al. Transplantation of "high-risk" donor hearts: Implications for infection. The Journal of Thoracic and Cardiovascular Surgery. 152 (1), 213-220 (2016).
- Hsich, E. M. Matching the market for heart transplantation. Circulation: Heart Failure. 9 (4), 002679 (2016).
- Piperata, A., et al. Heart transplantation in the new era of extended donor criteria. Journal of Cardiac Surgery. 36 (12), 4828-4829 (2021).
- Huckaby, L. V., Hickey, G., Sultan, I., Kilic, A. Trends in the utilization of marginal donors for orthotopic heart transplantation. Journal of Cardiac Surgery. 36 (4), 1270-1276 (2021).
- Singh, S. S. A., Dalzell, J. R., Berry, C., Al-Attar, N. Primary graft dysfunction after heart transplantation: a thorn amongst the roses. Heart Failure Reviews. 24 (5), 805-820 (2019).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Rossello, X., Hall, A. R., Bell, R. M., Yellon, D. M. Characterization of the Langendorff perfused isolated mouse heart model of global ischemia-reperfusion injury: impact of ischemia and reperfusion length on infarct size and LDH release. Journal of Cardiovascular Pharmacology and Therapeutics. 21 (3), 286-295 (2016).
- Matsuura, H., et al. Positive inotropic effects of ATP released via the maxi-anion channel in Langendorff-perfused mouse hearts subjected to ischemia-reperfusion. Frontiers in Cell Development Biology. 9, 597997 (2021).
- Tse, G., Hothi, S. S., Grace, A. A., Huang, C. L. Ventricular arrhythmogenesis following slowed conduction in heptanol-treated, Langendorff-perfused mouse hearts. The Journal of Physiological Sciences. 62 (2), 79-92 (2012).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. The Journal of Heart and Lung Transplantation. 33 (4), 327-340 (2014).
- Lei, I., et al. Differential inflammatory responses of the native left and right ventricle associated with donor heart preservation. Physiological Reports. 9 (17), 15004 (2021).
- Miller, A., Wright, G. L. Fabrication of murine ventricular balloons for the Langendorff heart preparation. Journal of Biotechnology & Biomaterials. 1 (101), (2011).
- Madsen, J. C. Advances in the immunology of heart transplantation. The Journal of Heart and Lung Transplantation. 36 (12), 1299-1305 (2017).
- Voelkel, N. F., et al. Right ventricular function and failure: report of a National Heart, Lung, and Blood Institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。