Method Article
Ex Vivo Murin Biventriküler Fonksiyonunun Langendorff Modelinde Değerlendirilmesi
Bu Makalede
Özet
Burada, bir ex vivo perfüzyon sistemi kullanılarak soğuk korumadan sonra donör kalplerin sağ ve sol ventrikül fonksiyonunu güvenilir bir şekilde ölçmek için bir protokol sunulmaktadır.
Özet
Primer greft disfonksiyonu (PGT), kalp naklini takiben erken ölümlerin önde gelen nedeni olmaya devam etmektedir. Soğuk muhafaza sırasında iskemik sürenin uzaması PGT için önemli bir risk faktörüdür ve soğuk muhafaza sonrası donör kalbin fonksiyonel yanıtlarını incelemek için kardiyak fonksiyonun güvenilir bir şekilde değerlendirilmesi esastır. Ekteki video, farklı süreler boyunca soğuk korumadan sonra bir Langendorff modeline dayalı ex vivo perfüzyon kullanarak murin sağ ve sol ventrikül fonksiyonunu değerlendirmek için bir tekniği açıklamaktadır. Kısaca, kalp izole edilir ve soğuk histidin-triptofan-ketoglutarat (HTK) çözeltisinde saklanır. Daha sonra, kalp bir Langendorff modelinde bir Kreb tamponu ile 60 dakika boyunca perfüze edilir. Sol ve sağ ventriküle silikon balon yerleştirilir ve kardiyak fonksiyonel parametreler kaydedilir (dP/dt, basınç-hacim ilişkileri). Bu protokol, farklı kalp koruma protokollerinden sonra kardiyak fonksiyonun güvenilir bir şekilde değerlendirilmesini sağlar. Daha da önemlisi, bu teknik, özellikle doğal kardiyak hücrelerde kardiyak koruma yanıtlarının incelenmesine izin verir. Çok küçük fare kalplerinin kullanılması, PGD'nin mekanizmalarını araştırmak için çok sayıda transgenik fareye erişim sağlar.
Giriş
Kalp nakli, son dönem kalp yetmezliği olan hastalarda sağkalımı ve yaşam kalitesini artırır1. Ne yazık ki, kalp donörlerinin yetersizliği, bu tedaviden yararlanabilecek hasta sayısını sınırlamakta ve klinisyenlerin donörleri alıcılarla en iyi şekilde eşleştirme yeteneğini sınırlamaktadır 2,3,4. Ayrıca, yeni tahsis sistemi daha uzun iskemik sürelere katkıda bulundu ve 2018'den bu yana marjinal donörlerin kullanımını önemli ölçüde artırdı5. Sonuç olarak, kalp donörlerinin ortalama yaşı ve iskemik süre zamanla artmakta ve kalbin korunmasına yönelik stratejilerdeki önemli gelişmelere rağmen daha yüksek primer greft disfonksiyonu (PGD) oranına yol açmaktadır 6.
PGT sol, sağ veya her iki ventrikülü etkileyebilir ve kalp nakli sonrası erken ölümlerin önde gelen nedenini temsil eden hayatı tehdit eden bir komplikasyon olmaya devam etmektedir. PDG'nin mekanizmalarının araştırılması ve kalbin daha iyi korunması için stratejilerin geliştirilmesi, kalp alıcıları üzerindeki potansiyel hayat kurtarıcı etkisi göz önüne alındığında önemli hususlardır. Bu nedenle, uzun bir saklama süresinden sonra donör kalp fonksiyonunun sağlam ve güvenilir bir şekilde değerlendirilmesine izin veren deneysel modeller, PGD anlayışımızı artırmak ve yeni tedavilerin geliştirilmesini kolaylaştırmak için gereklidir. Fare kalbindeki kardiyak fonksiyonu doğru bir şekilde değerlendirme yeteneği, PGD mekanizmalarını doğru bir şekilde tanımlayabilen geniş bir transgenik fare modelleri repertuarına erişim sağlar.
Fizyolojik ve farmakolojik çalışmalarda, Langendorff retrograd perfüzyon modeli kalp fonksiyonunu değerlendirmek için yaygın olarak kullanılmaktadır7. Spesifik olarak, kardiyak performans, sol ventrikül (LV) boşluğu içindeki bir basınç dönüştürücüsüne bağlı bir silikon balon tarafından tespit edilir. PGD'nin önemli bir özelliği, ventriküler kasın yetersiz kasılıp gevşemesidir. Önceki Langendorff çalışmaları, AG fonksiyonel değerlendirmesindegüvenilir ve tekrarlanabilir sonuçlar üretmek için bir LV balonu kullanmaya odaklanmıştır 8,9,10. Bununla birlikte, balon sistemini kullanarak sağ ventrikül (RV) fonksiyonunu değerlendirmek için intrakaviter balon kullanımı daha az tanınmaktadır.
Transplantasyon sonrası RV'yi içeren önemli bir PGD oranı göz önüne alındığında11, hem LV hem de RV fonksiyonunu incelemek için deneysel yöntemler, RV PGD'ye katkıda bulunan moleküler ve fizyolojik mekanizmaların belirlenmesine yardımcı olacaktır. Bu protokol, intrakaviter silikon balonların aynı murin kalbinde LV ve RV fonksiyonunun güvenilir değerlendirmelerini sağlayabileceğini göstermektedir12. PGT çalışmasında Langendorff sisteminin potansiyel kullanımını değerlendirmek için, farklı depolama süreleri ile kalp fonksiyonlarını inceledik ve murin kalplerinin uzun süreli soğuk depolanması ile kasılma ve gevşemede azalmış kalp fonksiyonu bulduk. İlginç bir şekilde, LV, RV'den daha yüksek bir işlevsel azalmaya sahiptir. Özetle, burada açıklanan protokol, bir aday ilacın ve moleküler yolların hem LV hem de RV fonksiyonu üzerindeki etkisini değerlendirmek için kullanılabilir. Bu yöntemin murin kalpleri üzerinde kullanılabilmesi, detaylı mekanik çalışmaların yapılmasını kolaylaştıracaktır.
Protokol
Bu protokoldeki tüm hayvan deneyleri, Michigan Üniversitesi, Ann Arbor'daki Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır. Tüm fareler, patojen içermeyen odalarda 12:12 ışık döngüsünde barındırıldı. Bu protokolde kullanılan tüm malzemeler, hayvanlar ve ekipmanlarla ilgili ayrıntılar için Malzeme Tablosuna bakın.
1. Silikon balon kateterin yapımı
NOT: Silikon balon daha önce açıklandığı gibiyapılmıştır 13.
- 100 mL'lik bir behere 9,5 mL damıtılmış su, 14,2 mL hafif mısır şurubu ve 33,8 g sükroz ekleyin. Şeker tamamen eriyene kadar çözeltiyi ısıtın ve karıştırın.
- 10 gr buğday unu ve 5 gr suyu eşit bir kıvam elde edene kadar karıştırarak hamuru hazırlayın ve 10 dakika dinlendirin.
- Küçük bir hamur parçasını oval bir "baş" haline getirin ve kuru bir spagetti telinin ucuna takın. Daha sonra, bu başlığı şeker çözeltisine batırın ve kafa artık tamamen kaplandığı için çözeltiden yavaşça çıkarın.
NOT: Hamur pürüzsüz ve düzgün dokulu olmalıdır. Hamur boyutları, 5 mm'den (kısa çap) 7 mm'ye (uzun çap) kadar farklı boyutlarda balonlar oluşturmak için değiştirilebilir. Onları ince bir şeker çözeltisi filmi ile örtmeye çalışın. - Spagetti telini, başın üzerinde eşit şekilde parlak bir örtü oluşturmak ve gece boyunca kurutmak için polistiren köpük blok veya diğer tutucular üzerine asın.
- Kalıbı silikon dispersiyonuna (ksilen içinde dağılmış silikon elastomer) daldırın. Spagetti ipini 37 °C'de 2 saat veya kuruyana kadar polistiren köpük bloğuna geri yerleştirin. Bu adımı bir kez tekrarlayın.
NOT: Silikon dispersiyon jelinin havaya maruz kalma nedeniyle oksitlenmesini önlemek önemlidir, çünkü bu eşit olmayan bir balon kalınlığı oluşturacaktır. - Balonu ayırmak ve toplamak için kalıbı suya yerleştirin. Balonu %0.02 sodyum azid içinde saklayın.
- 22 G'lik bir iğneden iki kör uçlu bir uç kesin; bir kör ucu silikon balona ve diğer kör ucu PE boruya monte edin. Balonu iğnenin üzerine bağlamak için 4-0 ipek kullanın.
NOT: Balonun içine su enjekte ederek balonun bütünlüğünü test edin. Balon doldurulduktan sonra, balonun içinde gerginliği koruyup korumadığını test etmek için balona yumuşak bir şekilde bastırın. Sızdırıyorsa yeni bir balon kullanın. Monte edilen balonlar ileride kullanılmak üzere saklanabilir.
2. Kalp perfüzyon sisteminin hazırlanması
- 1 L Krebs-Henseleit (KH) perfüzyon tamponu yapın ve su deposu Langendorff sistemine aktarın.
- Hava borusunu su haznesine bağlayın ve KH tamponunu en az 5 dakika boyunca %95CO2 ve %95 O30 ile dengelemek için hava akışını açın.
- Su banyosunu 41,5 °C'ye ayarlayın ve sistemi ve KH tamponunu ısıtmak için suyu Langendorff sisteminin dış katmanında dolaştırın.
NOT: Su banyosu sıcaklığı her sistem için optimizasyon gerektirir. Bu sistem için, su banyosu sıcaklığı kalbe perfüze olurken KH'yi 37-37.5 °C'de tutacaktır.
3. Fare kalbinin izolasyonu, montajı ve kanülasyonu
- Antikoagülasyon için, C57 / B6 fare karnının sağ çeyreğine intraperitoneal (i.p.) enjeksiyonla Salin içinde 200 ünite heparin uygulayın. İğnelerin eğiminin GI yolunun mesanesinde veya lümeninde olmadığını doğrulamak için enjeksiyondan önce şırıngayı aspire edin. Her deneysel koşulda en az dört fare kullanın (ancak tedavi etkisinin boyutunu da göz önünde bulundurun).
- 30 dakika sonra, fareyi uyuşturmak için 80 mg / kg ketamin ve 10 mg / kg ksilazin ip uygulayın. Anestezi uygulanmış farenin bilinçsiz olup olmadığını kontrol etmek için ayak parmağını sıkıştırarak ve herhangi bir yanıt gözlenmediğinden emin olun. Asepromazin 2mg / kg, kullanılan fare suşu sadece ket / xyl ile yeterli bir anestezi seviyesine ulaşmazsa ket / xyl kokteyline eklenebilir.
- Sternumun hemen altında bir kesi yapın. Diyaframı ve kaburgaları keserek göğsü açmak için makas kullanın. Göğsü tamamen ortaya çıkarmak için ön göğüs duvarını katlayın. İnen aortta kesin (aort arkına kapalı). Farenin kalbini, akciğerlerini ve timusunu soğuk histidin-triptofan-ketoglutarat (HTK) tamponuna aktarın. Organları buz gibi HTK tamponu altında izole edin. Bağ dokularını çıkararak aortu açığa çıkarın.
NOT: Bir iğneye bağlanmak için yeterli alan sağlamak için hem çıkan aortu hem de aort arkı bölgesini eksizyona dahil ederek aort uzunluğunu en üst düzeye çıkarın.
- Aort ucunu 22 G iğneye bağlayın ve 6-0 ipek dikişle bağlayın. Aort kapağına müdahale etmemek için kanülün aort kökünün üzerinde olduğundan emin olun. Aortu yaklaşık 10 dakika boyunca 10 mL soğuk (4 ° C) HTK tamponu ile perfüze edin.
NOT: Kalbin çıkarılmasından aortun kanülasyonuna kadar 15 dakikadan az sürer; Ancak perfüzyon hızının uygun seviyede tutulması önemlidir. Çok hızlı ve kuvvetli enjeksiyonlar yüksek basınçlar oluşturabilir ve vasküler/kardiyak hasara neden olabilir. - Kalbi buz gibi HTK ile 50 mL'lik bir tüpte 8 saat saklayın veya perfüzyonu hemen gerçekleştirin (kontrolü saklamayın) ve buzla doğrudan temastan kaçının.
NOT: Kalp dokusunun buzla doğrudan teması soğuk yaralanmasına neden olabilir. - İğneye monte edilmiş kalbi Langendorff aparatındaki kanüle bağlayın ve ipek bir dikişle bağlayın.
NOT: Prosedürü standartlaştırmak için, perfüzyondan önce kanülasyon işlemi için toplam 3 dakika bekleyin. - Perfüzyonu 3 mL / dk'da sabit bir akış modu ile başlatın; daha sonra 70-80 mmHg'de sabit basınç moduna geçin ve kalbi ~6 mL/dk'ya ayarlayın.
NOT: Kalbi yumuşak bir şekilde palpe etmek kardiyak reanimasyonu hızlandırmaya yardımcı olabilir. Perfüzyon akış hızı sabit basınç modunda 6 mL/dk'dan çok daha yüksekse, kanülasyonda bir sızıntı olabilir veya aort kapağı düzgün çalışmıyor olabilir. Sızıntıyı gidermek için bağlantıları ayarlayın. Sabit akış modu, kalbin vasküler tonunun kendi kendini düzenlemesini geçersiz kılar. Sabit basınç modu, kalbin koroner perfüzyon akışını düzenlemesini sağlar. Bu nedenle, sabit basınç modu, kalbin kalp fonksiyonunu ve koruma kalitesini hassas bir şekilde ölçecektir. - Sönük, su dolu bir balonu bir basınç dönüştürücüsüne ve üç musluklu su dolu bir şırıngaya bağlayın. 15-20 dakikalık bir dengeleme periyodundan sonra, sağ atriyumu (RA) kesin ve balonu RA aracılığıyla RV'ye yerleştirin. Balonu RV'nin içinde tutmak için bant kullanın. Balonu ventrikülde sınırlamaya yardımcı olmak için RA'nın açık alanını en aza indirin (kurulum için bkz. Şekil 1 ).
NOT: Kardiyak kasılma ve gevşeme başlangıçta stabil olmadığından ve ölçüm daha az doğru ve temsili olduğundan bir dengeleme periyodu gereklidir. RA'nın açılması sırasında AV düğümü hasar görürse, kalp sık sık aritmiler gösterecektir. - 20 dakikalık RV fonksiyonel veri toplamadan sonra, sol atriyumu (LA) kesin ve LA aracılığıyla LV'ye sönük su dolu bir balon yerleştirin. Balonu LV'nin içinde tutmak için bant kullanın.
NOT: Kalp, hemodinamiği 1,5 saatten fazla stabil tutmalıdır.
4. İşlevsel veri kaydı
- Basınç dönüştürücüsünün kalibrasyonu
- 10 mL'lik bir şırıngayı ılık tuzlu su ile doldurun ve şırıngayı üç bir musluktan kubbeye bağlayın. Musluğu açın ve kubbeyi yavaşça tuzlu suyla doldurun ve ardından tüm muslukları kapatın ve şırıngayı çıkarın. Doldurulmuş kubbeyi dönüştürücüye takın; Basınç göstergesini üç musluğun üçüncü ucuna bağlayın.
- Kayıt yazılımında, dönüştürücüye bağlanan kanalın açılır menüsünden Bridge Amp'i seçin. Kanalı Perfüze basınç olarak yeniden adlandırın. Dönüştürücüyü sıfırlamak için Sıfır'a tıklayın.
- Dönüştürücünün şimdi 0 mmHg okuması için Başlat'a tıklayarak kaydı başlatın. Birkaç saniye kayıttan sonra, şırıngayı yavaşça itin ve basıncı 100'e yükseltin. Kaydı durdurmak için durdur'a tıklayın.
- Birim dönüştürme iletişim kutusunda, 0 mmHg için bir kayıt alanı seçin ve Nokta 1'e giden oku tıklatın ve 0 mmHg yazın. 100 mmHg için kayıt alanını seçin, Nokta 2'ye giden oka tıklayın ve 100 mmHg yazın. Dönüştürücüyü kalibre etmek için Tamam'a tıklayın.
- Balonlu basınç dönüştürücüsüne karşılık gelen kanalı Ventrikül basıncı olarak yeniden adlandırın. Kalp sisteme bağlandığında kaydı başlatın. Balonu ventriküle yerleştirdikten sonra, diyastol sonu basıncını 5-10 mmHg'de tutmak için üç musluktan bir mikrometre şırınga kullanarak balondaki su hacmini ayarlayın.
NOT: Diyastol sonu ölçümü, ölçüm sırasında, tercihen 10 mmHg'ye yakın bir seviyeden başlayarak azalabilir. - Boş bir kanalı dP/dt olarak yeniden adlandırın. Açılır menüden, Ventrikül Basıncı olarak Türev | kaynak kanalı'nı seçin. Kanal, kasılma süresi boyunca ventriküler boşluktaki basınç değişiminin oranını kaydedecektir.
- Sabit bir ölçüm periyodu seçin, ardından Kan basıncı modülünde Ayar'a tıklayın.
- Giriş kanalı olarak Ventrikül basıncını seçin ve bir hesaplama periyodu için seçime tıklayın | TAMAM.
- Aykırı kardiyak döngüyü (ör. anormal döngü süresi veya basıncı) kaldırmak için Sınıflandırıcı görünümü'ne tıklayın.
- Seçilen dönem için maksimum dP/dt (daralma) ve minimum dP/dt (gevşeme) ortalamalarının tablolarını oluşturmak için tablo görünümüne tıklayın.
NOT: Her örnek için kayıt dosyasını saklayın ve istatistiksel analiz için ortalama kalp fonksiyonu tablosunu kaydedin.
Sonuçlar
3 aylık yetişkin C57Bl/6 fare kalpleri toplandı ve Langendorff sistemine monte edildi. Donör kalp 0 ve 8 saat HTK'da saklandı ve daha sonra oksijenli KH tamponu ile perfüze edildi. LV ve RV fonksiyonunun kasılmasını ve gevşemesini ölçmek için bir basınç dönüştürücüsüne bağlanan bir silikon balon kullanıldı.
Aort basınçları 70-80 mmHg aralığında tutuldu. Kalp atış hızı, 0 ve 8 saatlik depolama ile fare kalplerinde karşılaştırılabilirdi. LV ve RV fonksiyonları sistolik ve diyastolik basınç ölçülerek incelendi. Basınç değişim oranını hesaplamak için bir türev olan dP/dt, basınç dinamiklerini belirlemek için hesaplandı. Maksimum dP/dt ve min dP/dt'nin mutlak sayısı, kas kasılma ve gevşeme seviyesini temsil edebilir. 0 saatlik depolamada, LV, RV'ye kıyasla daha yüksek sistolik basınca sahipti (Şekil 2C ve Şekil 3A). LV, 0 saatlik depolama perfüzyonundan sonra RV'den daha fazla kas kasılması ve gevşemesi gösterdi (Şekil 2C ve Şekil 3B,C). Bununla birlikte, 8 saatlik soğuk depolamadan sonra, hem AG hem de RV, 0 saatlik bir taban çizgisine kıyasla önemli bir fonksiyonel azalma gösterdi (Şekil 2A-D ve Şekil 3B, C). Kardiyak kasılmadaki azalmalar LV'de daha şiddetliydi. 8 saatlik depolamadan sonra, LV'nin kasılması ve gevşemesi 0 saatlik taban çizgisinin %25.1 ve %30.7'si iken, RV'nin 0 saatlik taban çizgisine kıyasla %32.5 ve %29.1 işlevi vardı (Şekil 3B,C). Bu sonuçlar, uzun süreli depolamadan sonra LV'nin PGD'sinin RV'den daha önemli bir kardiyak kasılma azalmasına sahip olduğunu gösterdi.
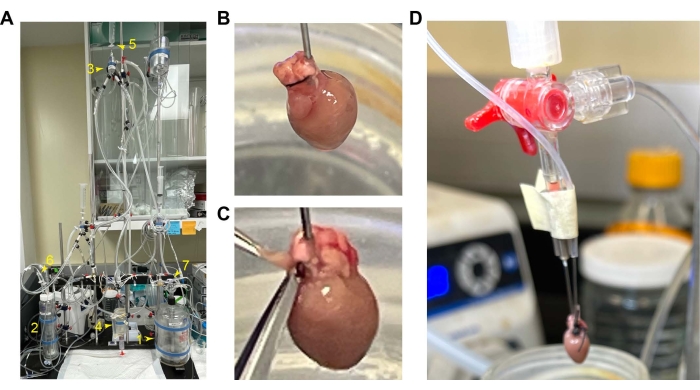
Şekil 1: Fare kalbinin montajı ve kanülasyonu . (A) Perfüzyon kurulumunun genel kurulumu. 1. Perfüzyon rezervuarı. 2. Oksijenasyon odası. 3. Hava kapanı odası. 4. Kalp odası. 5. Sabit akış ve basınç için değer anahtarı. 6 ve 7. Oksijen girişi. (B) Önde karavan ile kanüllü kalpler. (C) Boşluğunu açmak için kesilecek RV'nin konumu. (D) Balon tüpüne kanülle hafifçe vurun. Kısaltma: RV = sağ ventrikül. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
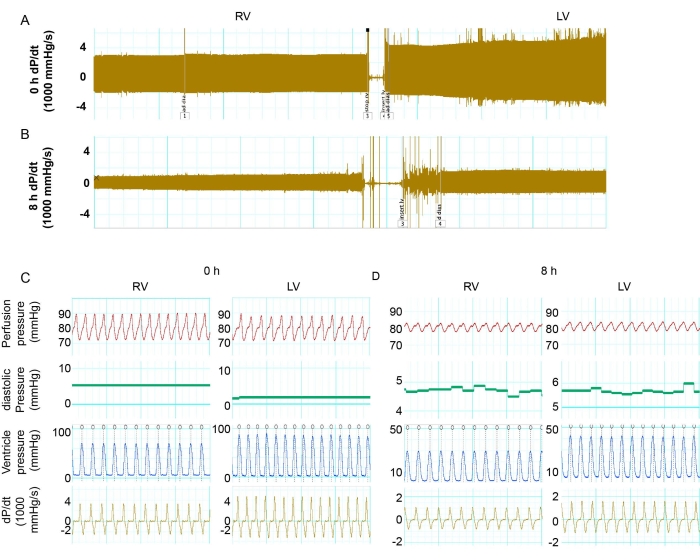
Şekil 2: LV ile RV'nin işlevinin karşılaştırılması . (A) 0 saatlik depolama ile donör kalbindeki RV ve LV'deki maksimum ve min dP/dt'nin izleme kaydı. (B) 8 saatlik depolama ile donör kalbindeki RV ve LV'deki maksimum ve min dP / dt kaydı. (C,D) 0 saat ve 8 saatte AG ve RV'de dP/dt, LV basıncı, kalp atış hızı ve perfüzyon basıncının ayrıntıları. Kısaltmalar: RV = sağ ventrikül; LV = sol ventrikül; dP/dt = basınç-zaman ilişkisi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
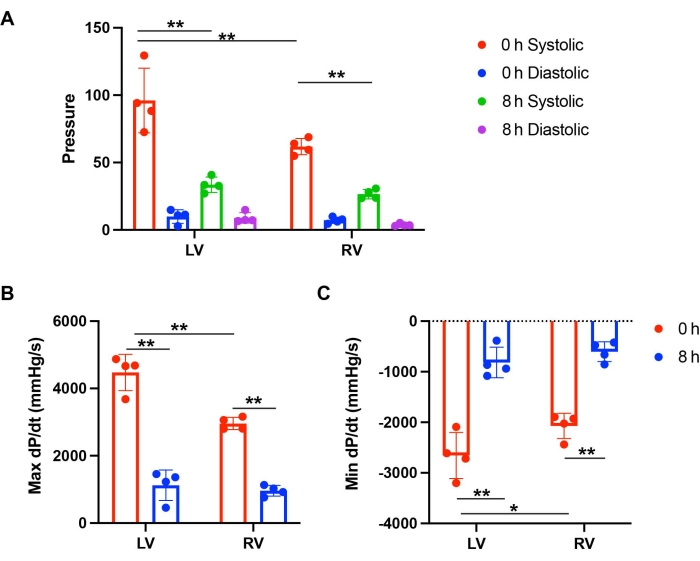
Şekil 3: Depolama ve perfüzyondan sonra LV ile RV'nin işlevinin karşılaştırılması . (A) 0 saat ve 8 saat depolamadan sonra AG ve RV'nin sistolik ve diyastolik basıncı. (B) 0 saat ve 8 saat depolama ile perfüzyondan sonra LV ve RV'nin maksimum dP/dt ve (C) Min dP/dt'si. Bu rakam Lei ve ark.12'den alınmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, aort kanülasyonu yoluyla retrograd perfüzyon Langendorff yöntemini açıklar. Bu teknik, soğuk hava deposundan sonra murin kalplerinin LV ve RV fonksiyonunu değerlendirmek için kullanılabilir. Sonuçlar, donör kalplerin uzun süreli soğuk depolanmasının, bu protokolü kullanarak hem LV hem de RV'de kardiyak fonksiyonun azalmasına yol açtığını göstermektedir.
Kalp nakli sonrası akut ve kronik rejeksiyon çalışmaları yaygın olarak immünobiyolojiye odaklanmaktadır14. Soğuk depolama sırasında doğal hücrelerin PGD üzerindeki etkileri daha az incelenmiştir. PGD, kalp nakillerinin ~%10-20'sinde görülür ve nakilden sonraki 30 gün içinde erken ölümlerin %66'sını oluşturur. Özellikle, LV'yi etkileyen PGD insidansı transplantasyondan sonra RV'ye göre farklılık göstermektedir11. Alıcı hücresel yanıtların katkısı olmadan, bu ex vivo yöntem, donör kalplerin soğuk korunmasından sonra doğal kalp hücrelerinin PGD'ye katkılarına odaklanır. Daha ileri çalışmalar, bir murin kalp nakli modelinde alıcı yanıtlarını içerebilir.
Bu protokolde, soğuk korunmuş donör kalplerinin Langendorff perfüzyonu, hücresel bağışıklığa sızmadan sıcak kristalloid perfüzyona karşı doğal kardiyak yanıtlara odaklandı. Tekrarlanabilir sonuçlar elde etmek için birkaç kritik adım standartlaştırıldı. Fare kalpleri HTK çözeltisi kullanılarak tutuklandı ve klinik uygulamaya benzer şekilde buz gibi soğuk HTK'da saklandı. Her kalp için HTK solüsyonunun perfüzyon hacmi ve infüzyon süresi bir zamanlayıcı ile yakından izlendi. Donör kalp, 4 °C'lik bir odada HTK içeren buz üzerinde önceden soğutulmuş tüplerde tutuldu. Kanülasyon süresi, perfüzyondan önce ~ 3 dakikaya standartlaştırılmıştır. Tüm bu adımlar, soğuk muhafaza süresinin çalışmadaki ana değişken olmasını sağlamıştır.
Perfüzyonun başlangıcında ~ 20 dakika boyunca düzensiz kardiyak kasılma periyodu yaygın olarak görülmüştür. Bu dengeleme ve iyileşme dönemi, kalp dokularının kademeli olarak ısınması ve oksijenlenmesi ile kolaylaştırılmıştır. İlk 20 dakikadan sonra nispeten istikrarlı bir dönem bekleniyordu. Balon, ilk dengeleme periyodundan ~ 18 dakika sonra ventrikül boşluğuna yerleştirildi. Balon yerleştirildikten sonra kalp ~ 25 dakika stabil kaldıktan sonra hemodinami kaydetmeye başladık. KH tamponu ile perfüzyon, ~ 1.5-2 saat boyunca stabil kardiyak performansı korudu. Bu nedenle sol ve sağ ventriküllerin her birinde 20 dakika boyunca hemodinami kaydetmeyi seçtik.
Soğuk hava deposundan sonra kalplerin PGD'sini incelemek için retrograd perfüzyonun çeşitli sınırlamaları vardır. Birincisi, balon boyutu ve her ventriküler boşlukta (özellikle RV) yer olmaması nedeniyle, iki balonun hem LV hem de RV'ye aynı anda yerleştirilmesi çok zordur. Böylece RV ve AG'nin fonksiyonunu sırayla ölçüyoruz. İnterventriküler septumun hem sol hem de sağ ventrikül fonksiyonuna önemli ölçüde katkıda bulunduğunu belirtmek önemlidir. Septum, sağ ventrikül fonksiyonunun ~%50'sine katkıda bulunur, bu nedenle interventriküler bağımlılıkvardır 15. Langendorff cihazında murin kalbinin reperfüzyon prosedürleri ~ 3 dakika sürerken, insan kalbinin nispeten sıcak cerrahi alanda cerrahi implantasyonunun ~ 45 dakika sürdüğünü belirtmek de önemlidir. Buna karşılık, bu Langendorff sistemindeki murin kalbi daha az iskemik zamana maruz kalır. Klinik çeviri düşünülürken bu dikkate alınmalıdır.
Kalbi kansız perfüze etmek için KH tamponu kullandığımızdan, bu da oksijen dağıtımında daha az verimliliğe sahip olabilir. Bununla birlikte, kalp fonksiyonu ilk 1.5-2 saatlik perfüzyon boyunca nispeten stabildir, böylece güvenilir hemodinamik ölçümlere izin verir. Ne yazık ki, şu anda bu küçük murin kalpleri için uygulanabilir bir çalışan kalp perfüzyon modeli yoktur ve ventriküler yüklemenin etkisi bu sistemde değerlendirilememektedir. Buna rağmen, perfüzyon sistemi yüksek oranda tekrarlanabilir ve nakil modellerine göre daha az emek yoğun ve zaman alıcıdır. Ayrıca, farklı terapötik seçeneklerin ve çeşitli moleküler yolların taranması için daha uygun hale getirebilecek nakil çalışmalarından daha az maliyetlidir. Aday ilaçlar eklenerek koruma solüsyonlarında yapılan değişikliklerle, bu platform farmakolojik ajanların hem LV hem de RV'de PGD'yi azaltma üzerindeki etkilerini değerlendirmek için kullanılabilir.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Hiç kimse.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4-0 silk suture | Braintree Scientific | SUTS108 | |
| 6-0 Silk suture | Braintree Scientific | SUTS104 | |
| All purpose flour | Kroger | ||
| BD General Use and PrecisionGlide Hypodermic Needles 22 G | Fisher scientific | 14-826-5A | |
| BD Syringe with Luer-Lok Tips (Without Needle) | Fisher scientific | 14-823-16E | |
| Corn Syrup | Kroger | ||
| Custodiol HTK Solution | Essential Pharmaceuticals LLC | ||
| Dissecting Scissors | World Precision Instruments | 14393/14394 | |
| Falcon 50 mL conical tubes | Fisher scientific | 14-959-49A | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H4784 | |
| Krebs Henseleit buffer | Sigma | K3753 | |
| Nusil silicone dispersions | Avantor | ||
| Perfusion system | Radnoti | 130101BEZ | |
| PowerLab | ADInstruments | PL3508 | |
| Sodium azide | Sigma | S2002 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sucrose | Sigma | S0389 | |
| Sucrose | Sigma | S0389 | |
| Xylazine | Sigma | X1126 |
Referanslar
- Kim, I. C., Youn, J. C., Kobashigawa, J. A. The past, present and future of heart transplantation. Korean Circulation Journal. 48 (7), 565-590 (2018).
- Gaffey, A. C., et al. Transplantation of "high-risk" donor hearts: Implications for infection. The Journal of Thoracic and Cardiovascular Surgery. 152 (1), 213-220 (2016).
- Hsich, E. M. Matching the market for heart transplantation. Circulation: Heart Failure. 9 (4), 002679 (2016).
- Piperata, A., et al. Heart transplantation in the new era of extended donor criteria. Journal of Cardiac Surgery. 36 (12), 4828-4829 (2021).
- Huckaby, L. V., Hickey, G., Sultan, I., Kilic, A. Trends in the utilization of marginal donors for orthotopic heart transplantation. Journal of Cardiac Surgery. 36 (4), 1270-1276 (2021).
- Singh, S. S. A., Dalzell, J. R., Berry, C., Al-Attar, N. Primary graft dysfunction after heart transplantation: a thorn amongst the roses. Heart Failure Reviews. 24 (5), 805-820 (2019).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Rossello, X., Hall, A. R., Bell, R. M., Yellon, D. M. Characterization of the Langendorff perfused isolated mouse heart model of global ischemia-reperfusion injury: impact of ischemia and reperfusion length on infarct size and LDH release. Journal of Cardiovascular Pharmacology and Therapeutics. 21 (3), 286-295 (2016).
- Matsuura, H., et al. Positive inotropic effects of ATP released via the maxi-anion channel in Langendorff-perfused mouse hearts subjected to ischemia-reperfusion. Frontiers in Cell Development Biology. 9, 597997 (2021).
- Tse, G., Hothi, S. S., Grace, A. A., Huang, C. L. Ventricular arrhythmogenesis following slowed conduction in heptanol-treated, Langendorff-perfused mouse hearts. The Journal of Physiological Sciences. 62 (2), 79-92 (2012).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. The Journal of Heart and Lung Transplantation. 33 (4), 327-340 (2014).
- Lei, I., et al. Differential inflammatory responses of the native left and right ventricle associated with donor heart preservation. Physiological Reports. 9 (17), 15004 (2021).
- Miller, A., Wright, G. L. Fabrication of murine ventricular balloons for the Langendorff heart preparation. Journal of Biotechnology & Biomaterials. 1 (101), (2011).
- Madsen, J. C. Advances in the immunology of heart transplantation. The Journal of Heart and Lung Transplantation. 36 (12), 1299-1305 (2017).
- Voelkel, N. F., et al. Right ventricular function and failure: report of a National Heart, Lung, and Blood Institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır