Method Article
ランゲンドルフモデルにおける Ex vivo マウス両心室機能の評価
要約
ここに提示されるのは、 ex vivo 灌流システムを使用して低温保存後のドナー心臓の右心室および左心室機能を確実に定量化するためのプロトコルです。
要約
原発性移植片機能障害(PGD)は、心臓移植後の早期死亡の主な原因であり続けています。冷蔵保存中の虚血時間の延長はPGDの重要な危険因子であり、心機能の信頼性の高い評価は、冷蔵保存後のドナー心臓の機能的反応を研究するために不可欠です。添付のビデオでは、さまざまな期間の低温保存後にランゲンドルフモデルに基づく ex vivo 灌流を使用してマウスの右心室および左心室機能を評価する技術について説明します。簡単に言うと、心臓は単離され、冷たいヒスチジン-トリプトファン-ケトグルタル酸(HTK)溶液に保存されます。次に、心臓をランゲンドルフモデルのクレブ緩衝液で60分間灌流します。シリコンバルーンを左心室と右心室に挿入し、心臓機能パラメータ(dP/dt、圧力と容積の関係)を記録します。このプロトコルは異なった中心の保存のプロトコルの後で心機能の信頼できる評価を可能にする。重要なことに、この技術により、天然の心臓細胞に特異的に心臓温存反応を研究できます。非常に小さなマウスの心臓を使用することで、PGDのメカニズムを調査するために、膨大な数のトランスジェニックマウスにアクセスすることができます。
概要
心臓移植は、末期心不全患者の生存率と生活の質を改善します1.残念ながら、心臓ドナーの不足により、この治療法の恩恵を受けることができる患者の数が制限され、臨床医がドナーとレシピエントを最適にマッチングする能力が制限されています2,3,4。さらに、新しい配分システムは、2018年以降、虚血期間の長期化に寄与し、限界ドナーの利用を大幅に増加させました5。その結果、心臓ドナーの平均年齢と虚血時間は時間の経過とともに増加しており、心臓温存戦略の大幅な改善にもかかわらず、原発性移植片機能障害(PGD)の割合が高くなっています6。
PGDは、左心室、右心室、または両方の心室に影響を与える可能性があり、心臓移植後の早期死亡の主な原因を表す生命を脅かす合併症のままです。PDGのメカニズムの調査とより良い心臓保存のための戦略の開発は、心臓レシピエントへの命を救う可能性のある影響を考えると、重要な考慮事項です。したがって、長期保存後のドナーの心機能の堅牢で信頼性の高い評価を可能にする実験モデルは、PGDの理解を深め、新しい治療法の開発を促進するために不可欠です。マウスの心臓の心機能を正確に評価する能力により、PGDのメカニズムを正確に同定できるトランスジェニックマウスモデルの膨大なレパートリーにアクセスすることができます。
生理学的および薬理学的研究では、ランゲンドルフ逆行性灌流モデルは心臓機能の評価に広く使用されています7。具体的には、心臓性能は、左心室(LV)腔内の圧力トランスデューサに接続されたシリコンバルーンによって検出されます。PGDの主な特徴は、心室筋の収縮と弛緩が不十分であることです。以前のランゲンドルフの研究では、LVバルーンを使用して、LV機能評価で信頼性と再現性のある結果を生み出すことに焦点を当てています8,9,10。ただし、バルーン システムを使用して右心室 (RV) 機能を評価するための腔内バルーンの使用はあまり認識されていません。
移植後のRVが関与する有意なPGD率を考えると11、LVとRVの両方の機能を研究する実験的方法は、RV PGDに寄与する分子的および生理学的メカニズムを決定するのに役立ちます。このプロトコルは、腔内シリコーンバルーンが同じマウスの中心12のLVおよびRV機能の信頼できる評価を提供できることを示しています。PGD研究におけるランゲンドルフシステムの使用の可能性を評価するために、さまざまな保存期間の心臓機能を調べ、マウスの心臓の長期冷蔵保存による収縮と弛緩における心機能の低下を発見しました。興味深いことに、LVはRVよりも機能的なリダクションが進んでいます。要約すると、ここで説明するプロトコルは、LVおよびRV機能の両方に対する候補薬物および分子経路の効果を評価するために使用できます。この方法をマウスの心臓に使用する能力は、詳細な機構研究の実行を容易にします。
プロトコル
このプロトコルのすべての動物実験は、ミシガン大学アナーバー校の施設動物管理および使用委員会によって承認されました。すべてのマウスを病原体のない部屋に12:12の光サイクルで収容しました。このプロトコルで使用されるすべての材料、動物、および機器に関連する詳細については、 材料表 を参照してください。
1. シリコンバルーンカテーテルの製作
注:シリコンバルーンは、前述のように作られています13.
- 100 mLのビーカーに、9.5 mLの蒸留水、14.2 mLのライトコーンシロップ、33.8 gのスクロースを加えます。砂糖が完全に溶けるまで溶液を加熱してかき混ぜます。
- 小麦粉10gと水5gを均一になるまで混ぜて生地を準備し、10分間休ませます。
- 生地の小片を楕円形の「頭」に成形し、乾燥したスパゲッティストランドの端に取り付けます。次に、このヘッドを砂糖溶液に浸し、ヘッドが完全にコーティングされたので、溶液からゆっくりと取り出します。
注意: 生地は滑らかで均一な食感でなければなりません。生地のサイズを変えて、5 mm(短径)から7 mm(長径)まで、さまざまなサイズのバルーンを生成できます。砂糖溶液の薄膜で覆ってみてください。 - スパゲッティストランドを発泡スチロールブロックまたは他のホルダーに吊り下げて、頭の上に光沢のあるカバーを均等に形成し、一晩乾かします。
- 金型をシリコーン分散液(キシレンに分散したシリコーンエラストマー)に浸します。スパゲッティストランドを発泡スチロールブロックに戻し、37°Cで2時間、または乾くまで加熱します。この手順を 1 回繰り返します。
注:シリコーン分散ゲルは、バルーンの厚さが不均一になるため、空気にさらされることによる酸化を防ぐことが不可欠です。 - 型を水に入れてバルーンを分離して集めます。バルーンを0.02%アジ化ナトリウムで保管します。
- 22Gの針から2つの鈍い先端を切り取ります。一方の鈍い端をシリコンバルーンに取り付け、もう一方の鈍い端をPEチューブに取り付けます。4-0シルクを使用して、バルーンを針の所定の位置に結びます。
注意: バルーンに水を注入して、バルーンの完全性をテストします。バルーンがいっぱいになったら、バルーンをそっと押して、バルーンが内部で張力を維持しているかどうかをテストします。漏れている場合は、新しいバルーンを使用してください。取り付けられたバルーンは、将来の使用のために保管できます。
2.心臓灌流システムの準備
- 1 LのKrebs-Henseleit(KH)灌流バッファーを作成し、貯水槽Langendorffシステムに移します。
- エアチューブを貯水槽に接続し、気流をオンにして、KHバッファーを5%CO2および95%O2と少なくとも30分間バランスさせます。
- ウォーターバスを41.5°Cに設定し、ランゲンドルフシステムの外層に水を循環させて、システムとKHバッファーを温めます。
注:ウォーターバスの温度は、システムごとに最適化する必要があります。このシステムでは、心臓に灌流するときに、ウォーターバスの温度はKHを37〜37.5°Cに維持します。
3. マウス心臓の単離、取り付け、カニューレ挿入
- 抗凝固療法のために、C57 / B6マウス腹部の右側象限に腹腔内(i.p.)注射により、生理食塩水中のヘパリン200単位を投与します。注射前にシリンジを吸引して、針の斜角が消化管の膀胱または内腔にないことを確認します。.各実験条件で少なくとも4匹のマウスを使用します(ただし、処理効果の大きさも考慮してください)。
- 30分後、80 mg / kgのケタミンと10 mg / kgのキシラジンi.p.を投与してマウスに麻酔をかけます。.麻酔をかけられたマウスが意識を失っていないか、つま先をつまんで反応がないことを確認します。アセプロマジン2mg / kgは、使用されたマウス株がket / xylのみで適切なレベルの麻酔に達しない場合、ket / xylカクテルに追加できます。.
- 胸骨の真下を切開します。はさみを使って横隔膜と肋骨を切って胸を開きます。胸壁前部を折りたたんで、胸部を完全に露出させます。下行大動脈(大動脈弓まで閉じている)を切断します。マウスの心臓、肺、胸腺を冷たいヒスチジン-トリプトファン-ケトグルタル酸(HTK)緩衝液に移します。氷冷HTKバッファー下で臓器を単離します。結合組織を除去して大動脈を露出させます。
注:上行大動脈と大動脈弓領域の両方を切除に含めて、針に接続するのに十分なスペースを確保することにより、大動脈の長さを最大化します。
- 大動脈の端を22Gの針に接続し、6-0シルク縫合糸で結びます。カニューレが大動脈根の上にあることを確認して、大動脈弁に干渉しないようにします。10 mLの低温(4°C)HTKバッファーで大動脈を約10分間灌流します。
注:心臓の除去から大動脈のカニューレ挿入まで15分もかかりません。ただし、灌流速度を適切なレベルに保つことが重要です。速すぎて激しい注射は、高圧を発生させ、血管/心臓の損傷を引き起こす可能性があります。 - 心臓を氷冷HTKを含む50 mLチューブに8時間保存するか、直ちに灌流を行い(コントロールは保管しないでください)、氷との直接接触を避けてください。
注意: 心臓組織を氷に直接接触させると、寒さによる怪我につながる可能性があります。 - 針に取り付けられた心臓をランゲンドルフ装置のカニューレに接続し、絹の縫合糸で結びます。
注:手順を標準化するには、灌流前にカニューレ挿入プロセスを合計3分間待ちます。 - 3 mL/分で定流量モードで灌流を開始します。次に、70〜80 mmHgで定圧モードに変更し、心臓を~6 mL / minに調整します。
注:心臓をそっと触診すると、心臓の蘇生を早めることができます。定圧モードで灌流流量が6 mL / minをはるかに超えている場合は、カニューレ挿入に漏れがあるか、大動脈弁が正常に機能していない可能性があります。接続を調整して漏れを修正します。コンスタントフローモードは、心臓の血管緊張の自己調整を上書きします。定圧モードにより、心臓は冠状動脈灌流の流れを調節することができます。したがって、定圧モードは、心臓の機能と心臓の保存品質を正確に測定します。 - 空気を抜いて水で満たされたバルーンを、圧力トランスデューサと水で満たされたシリンジに三方タップで接続します。15〜20分の平衡化期間の後、右心房(RA)を切断し、RAを介してバルーンをRVに挿入します。テープを使用してバルーンを RV 内に保持します。 RA の開口領域を最小限にして、バルーンを心室に拘束します(セットアップについては 図 1 を参照)。
注:心臓の収縮と弛緩は最初は安定しておらず、測定値は正確で代表的ではないため、平衡化の期間が必要です。.関節リウマチの開室中にAVリンパ節が損傷すると、心臓は頻繁な不整脈を示します。 - RV機能データ収集の20分後、左心房(LA)を切断し、LAを介して収縮した水で満たされたバルーンをLVに挿入します。テープを使用してバルーンをLV内に保持します。
注意: 心臓は1.5時間以上安定した血行動態を維持する必要があります。
4.機能データ記録
- 圧力トランスデューサの校正
- 10 mLのシリンジに温かい生理食塩水を入れ、シリンジを三方タップでドームに接続します。蛇口を開き、ドームをゆっくりと生理食塩水で満たしてから、すべての蛇口を閉じてシリンジを取り外します。充填されたドームをトランスデューサーに取り付けます。圧力計を三方タップの3番目の端に接続します。
- 録音ソフトウェアで、トランスデューサーに接続しているチャンネルのドロップダウンメニューから ブリッジアンプ を選択します。 チャネル の名前を 「Perfused pressure」に変更します。[ゼロ]をクリックして、トランスデューサを ゼロ にします。
- [開始]をクリックして記録を開始し、トランスデューサーが0mmHgを読み取るようにします。数秒記録した後、シリンジをゆっくりと押し、圧力を100に上げます。[停止] をクリックして記録を停止します。
- [単位変換]ダイアログで、0 mmHg の記録領域を選択し、[ポイント 1]の矢印をクリックして 0 mmHg と入力します。100 mmHgの記録領域を選択し、ポイント2への矢印をクリックして、100 mmHgと入力します。[OK]をクリックして、トランスデューサを校正します。
- バルーンのある圧力トランスデューサに対応するチャンネルの名前を 「Ventricle pressure」に変更します。心臓がシステムに接続されると、記録を開始します。バルーンを心室に挿入した後、三方タップを介してマイクロメーターシリンジを使用してバルーン内の 水量 を調整し、 拡張末期血圧 を 5〜10 mmHgに維持します。.
注:拡張末期の測定値は、測定中に減少する可能性があり、できれば10 mmHg近くから開始します。 - 空のチャネルの名前を dP/dt に変更します。ドロップダウンメニューから、Derivative | source channelをVentricle Pressureとして選択します。チャネルは、収縮期間中の心室腔内の圧力変化の比率を記録します。
- 安定した測定期間を選択し、血圧モジュールの[設定]をクリックします。
- 入力チャネルとして心室圧を選択し、計算期間の選択をクリックします |[OK]をクリックします。
- Classifier viewをクリックして、外れ値の心周期(例:異常なサイクルタイムや圧力)を削除します。
- テーブル ビュー をクリックして、選択した期間の最大dP/dt(収縮)と最小dP/dt(緩和)の平均のテーブルを生成します。
注:記録を保存してください file 各サンプルのファイルと、統計分析のために平均心機能の表を保存します。
結果
成体C57Bl/6マウスの心臓(生後3ヶ月)を採取し、ランゲンドルフシステムに取り付けた。ドナーの心臓をHTKに0時間および8時間保存した後、酸素化KH緩衝液で灌流した。圧力トランスデューサに接続したシリコンバルーンを使用して、LVおよびRV機能の収縮と弛緩を測定しました。
大動脈圧は70〜80mmHgの範囲に維持されました。心拍数は、0時間保存時と8時間保存時のマウス心臓で同等でした。LVおよびRV機能は、収縮期血圧および拡張期血圧を測定することによって調べられた。圧力変化の比率を計算するための微分であるdP/dtを計算して、圧力ダイナミクスを決定しました。最大 dP/dt と最小 dP/dt の絶対数は、筋肉の収縮と弛緩のレベルを表すことができます。0時間の保存では、LVはRVと比較して収縮期血圧が高かった(図2Cおよび図3A)。LVは、0時間の保存の灌流後、RVよりも多くの筋肉の収縮と弛緩を示しました(図2Cおよび図3B、C)。しかし、8時間の冷蔵保存後、LVとRVの両方が、0時間のベースラインと比較して有意な機能低下を示しました(図2A-Dおよび図3B、C)。心臓収縮の減少はLVでより深刻でした。.8時間の保存後、LVの収縮と弛緩は0時間のベースラインの25.1%と30.7%でしたが、RVは0時間のベースラインと比較して32.5%と29.1%の機能を示しました(図3B、C)。これらの結果は、長期保存後のLVのPGDがRVよりも有意な心臓収縮の減少を有することを示した。
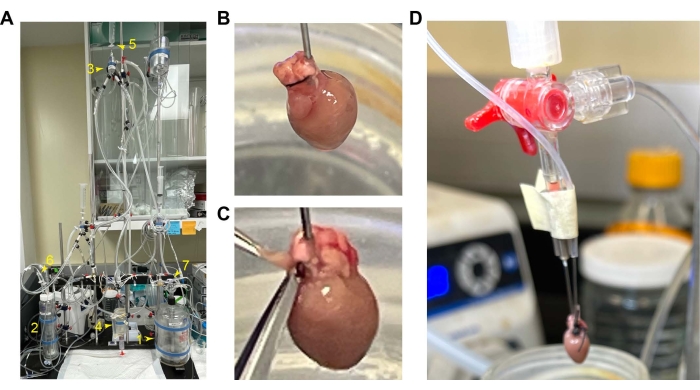
図1:マウス心臓の取り付けとカニューレ挿入 。 (A)灌流セットアップの全体的なセットアップ。1.灌流リザーバー。2.酸素化チャンバー。3.エアトラップチャンバー。4.心臓の部屋。5.一定の流量と圧力のための値スイッチ。6 と 7 です。酸素の流入。(B)RVを前面に見たカニューレ付きハート。(C)キャビティを開くために切断するRVの位置。(D)バルーンチューブをカニューレで軽くたたきます。略語:RV =右心室。 この図の拡大版をご覧になるには、ここをクリックしてください。
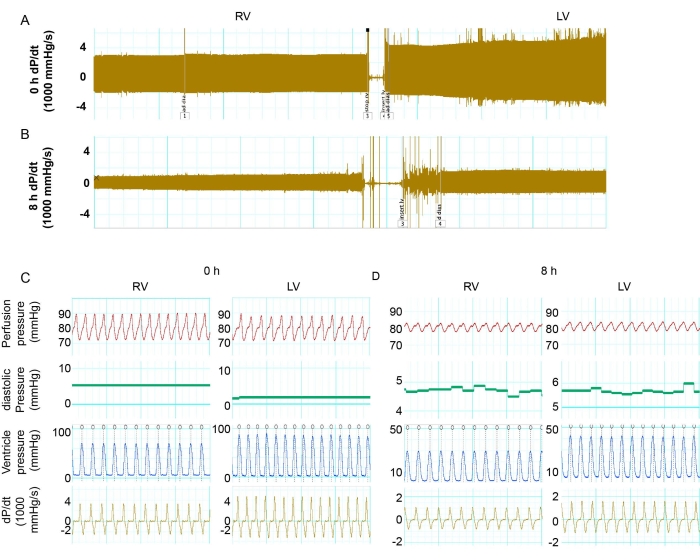
図2:LVとRVの機能の比較 。 (A)0時間の保存で、ドナー心臓のRVおよびLVの最大および最小dP/dtのトレース記録。(B)8時間の保存によるドナー心臓のRVおよびLVの最大および最小dP / dtの記録。(C、D)0 時間および 8 時間での LV および RV の dP/dt、LV 圧力、心拍数、および灌流圧の詳細。略語:RV =右心室;LV = 左心室;dP/dt = 圧力と時間の関係。 この図の拡大版をご覧になるには、ここをクリックしてください。
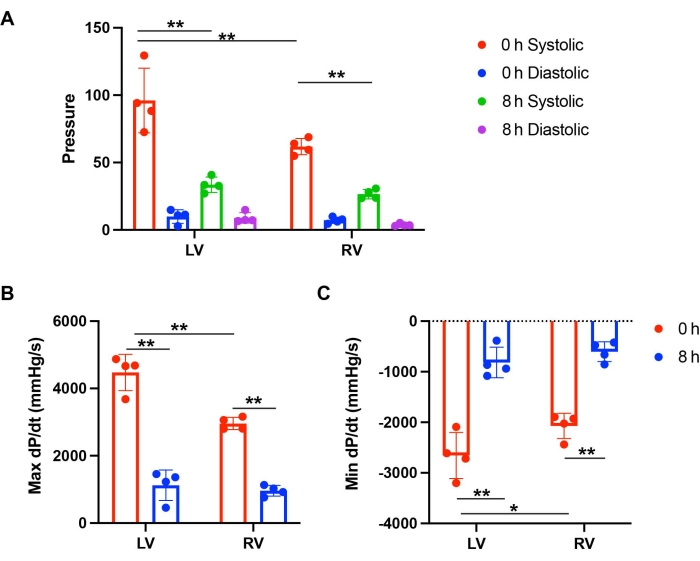
図3:保存および灌流後のLVとRVの機能の比較 。 (A) 0 時間および 8 時間の保管後の LV および RV の収縮期および拡張期血圧。(B) 0 時間および 8 時間の保存による灌流後の LV および RV の最大 dP/dt および (C) 最小 dP/dt。この図はLei et al.12によるものです。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
このプロトコルは大動脈カニューレ挿入 による 逆行性灌流Langendorff方法を記述する。この手法は、低温保存後のマウス心臓のLVおよびRV機能を評価するために使用できます。結果は、ドナーの心臓の長期の低温保存が、このプロトコルを使用したLVとRVの両方で心機能の低下につながることを示しています。
心臓移植後の急性および慢性拒絶反応に関する研究は、免疫生物学に広く焦点を当てている14。低温保存中のPGDに対する天然細胞の影響は、あまりよく調べられていません。PGDは心臓移植の10~20%で発生し、移植後30日以内に早期死亡の66%を占めます。特に、LVとRVに影響を与えるPGDの発生率は、移植後に異なる11。レシピエントの細胞応答の寄与を伴わないこの ex vivo 法は、ドナーの心臓を低温保存した後のPGDへの天然心臓細胞の寄与に焦点を当てています。さらなる研究により、マウスの心臓移植モデルにレシピエントの反応が組み込まれる可能性がある。
このプロトコルでは、低温保存ドナー心臓のランゲンドルフ灌流は、細胞性免疫に浸潤することなく、温かい晶質液灌流に対するネイティブの心臓反応に焦点を当てました。再現性のある結果を得るために、いくつかの重要なステップが標準化されました。マウスの心臓はHTK溶液を用いて捕捉し、臨床診療と同様に氷冷HTKで保存した。すべての心臓に対するHTK溶液の灌流量と注入時間は、タイマーで綿密に監視されました。ドナーの心臓は、4°Cの部屋でHTKを含む氷上で予冷チューブに保管されました。カニューレ挿入時間は、灌流の ~3 分に標準化されています。これらすべてのステップにより、低温保存期間が研究の主要な変数であることが保証されました。
~20分間の不規則な心臓収縮の期間は、 ?? 流の開始時によく見られました。.この平衡化と回復期間は、心臓組織の段階的な加温と酸素化によって促進されました。.最初の20分後には比較的安定した期間が予想されました。バルーンは、最初の平衡化期間の ~18 分後に心室腔に挿入されました。バルーンを挿入した後、心臓が~25分間安定した後、血行動態の記録を開始しました。KH緩衝液による灌流は、1.5~2時間安定した心機能を維持しました。したがって、左心室と右心室のそれぞれで20分間の血行動態を記録することを選択しました。
冷蔵後の心臓のPGDを研究するための逆行性灌流にはいくつかの制限があります。まず、バルーンのサイズと各心室腔(特にRV)のスペースの不足により、LVとRVの両方に2つのバルーンを同時に挿入することは非常に困難です。そこで、RVとLVの機能を順番に測定します。心室中隔は、左心室と右心室の両方の機能に大きく寄与することに注意することが重要です。中隔は右心室機能の~50%に寄与するため、心室依存性があります15。また、ランゲンドルフ装置でのマウス心臓の再灌流処置には~3分かかりますが、比較的温かい手術野でのヒト心臓の外科的移植には~45分かかることに注意することも重要です。それに比べて、このランゲンドルフ系のマウスの心臓は虚血時間が少なくなります。臨床翻訳を検討する際には、この点を考慮する必要があります。
血液を使わずに心臓を灌流するためにKH緩衝液を使用したため、酸素供給の効率も低下する可能性があります。ただし、心臓機能は最初の1.5〜2時間の灌流を通じて比較的安定しているため、信頼性の高い血行動態測定が可能です。残念ながら、現在、これらの小さなマウスの心臓の実行可能な作業心臓灌流モデルはなく、心室負荷の影響をこのシステムで評価することはできません。それにもかかわらず、灌流システムは再現性が高く、移植モデルよりも労働集約的で時間もかかりません。また、移植研究よりもコストがかからないため、さまざまな治療選択肢やさまざまな分子経路のスクリーニングに適している可能性があります。候補薬を追加して保存液を変更することで、このプラットフォームを使用して、LVとRVの両方でPGDの低減に対する薬理学的薬剤の効果を評価できます。
開示事項
著者らには、開示すべき利益相反はありません。
謝辞
何一つ。
資料
| Name | Company | Catalog Number | Comments |
| 4-0 silk suture | Braintree Scientific | SUTS108 | |
| 6-0 Silk suture | Braintree Scientific | SUTS104 | |
| All purpose flour | Kroger | ||
| BD General Use and PrecisionGlide Hypodermic Needles 22 G | Fisher scientific | 14-826-5A | |
| BD Syringe with Luer-Lok Tips (Without Needle) | Fisher scientific | 14-823-16E | |
| Corn Syrup | Kroger | ||
| Custodiol HTK Solution | Essential Pharmaceuticals LLC | ||
| Dissecting Scissors | World Precision Instruments | 14393/14394 | |
| Falcon 50 mL conical tubes | Fisher scientific | 14-959-49A | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H4784 | |
| Krebs Henseleit buffer | Sigma | K3753 | |
| Nusil silicone dispersions | Avantor | ||
| Perfusion system | Radnoti | 130101BEZ | |
| PowerLab | ADInstruments | PL3508 | |
| Sodium azide | Sigma | S2002 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sucrose | Sigma | S0389 | |
| Sucrose | Sigma | S0389 | |
| Xylazine | Sigma | X1126 |
参考文献
- Kim, I. C., Youn, J. C., Kobashigawa, J. A. The past, present and future of heart transplantation. Korean Circulation Journal. 48 (7), 565-590 (2018).
- Gaffey, A. C., et al. Transplantation of "high-risk" donor hearts: Implications for infection. The Journal of Thoracic and Cardiovascular Surgery. 152 (1), 213-220 (2016).
- Hsich, E. M. Matching the market for heart transplantation. Circulation: Heart Failure. 9 (4), 002679 (2016).
- Piperata, A., et al. Heart transplantation in the new era of extended donor criteria. Journal of Cardiac Surgery. 36 (12), 4828-4829 (2021).
- Huckaby, L. V., Hickey, G., Sultan, I., Kilic, A. Trends in the utilization of marginal donors for orthotopic heart transplantation. Journal of Cardiac Surgery. 36 (4), 1270-1276 (2021).
- Singh, S. S. A., Dalzell, J. R., Berry, C., Al-Attar, N. Primary graft dysfunction after heart transplantation: a thorn amongst the roses. Heart Failure Reviews. 24 (5), 805-820 (2019).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Rossello, X., Hall, A. R., Bell, R. M., Yellon, D. M. Characterization of the Langendorff perfused isolated mouse heart model of global ischemia-reperfusion injury: impact of ischemia and reperfusion length on infarct size and LDH release. Journal of Cardiovascular Pharmacology and Therapeutics. 21 (3), 286-295 (2016).
- Matsuura, H., et al. Positive inotropic effects of ATP released via the maxi-anion channel in Langendorff-perfused mouse hearts subjected to ischemia-reperfusion. Frontiers in Cell Development Biology. 9, 597997 (2021).
- Tse, G., Hothi, S. S., Grace, A. A., Huang, C. L. Ventricular arrhythmogenesis following slowed conduction in heptanol-treated, Langendorff-perfused mouse hearts. The Journal of Physiological Sciences. 62 (2), 79-92 (2012).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. The Journal of Heart and Lung Transplantation. 33 (4), 327-340 (2014).
- Lei, I., et al. Differential inflammatory responses of the native left and right ventricle associated with donor heart preservation. Physiological Reports. 9 (17), 15004 (2021).
- Miller, A., Wright, G. L. Fabrication of murine ventricular balloons for the Langendorff heart preparation. Journal of Biotechnology & Biomaterials. 1 (101), (2011).
- Madsen, J. C. Advances in the immunology of heart transplantation. The Journal of Heart and Lung Transplantation. 36 (12), 1299-1305 (2017).
- Voelkel, N. F., et al. Right ventricular function and failure: report of a National Heart, Lung, and Blood Institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved