Method Article
Оценка бивентрикулярной функции мышей ex vivo в модели Лангендорфа
В этой статье
Резюме
Здесь представлен протокол для достоверной количественной оценки функции правого и левого желудочков донорских сердец после холодоконсервации с использованием системы перфузии ex vivo .
Аннотация
Первичная дисфункция трансплантата (ПГД) остается основной причиной ранней смерти после трансплантации сердца. Длительное ишемическое время при консервации холода является важным фактором риска развития ПГД, и надежная оценка сердечной функции имеет важное значение для изучения функциональных реакций донорского сердца после холодоконсервации. В сопроводительном видео описывается методика оценки функции правого и левого желудочков мышей с использованием перфузии ex vivo на основе модели Лангендорфа после консервации холодом в течение разной продолжительности. Короче говоря, сердце изолировано и хранится в холодном растворе гистидина-триптофан-кетоглутарата (HTK). Затем сердце перфузируют буфером Креба в модели Лангендорфа в течение 60 минут. В левый и правый желудочек вводится силиконовый баллон и регистрируются функциональные параметры сердца (dP/dt, зависимость давления от объема). Этот протокол позволяет достоверно оценить сердечную функцию после различных протоколов сохранения сердца. Важно отметить, что этот метод позволяет изучать реакции сохранения сердца именно в нативных клетках сердца. Использование очень маленьких мышиных сердец позволяет получить доступ к огромному количеству трансгенных мышей для изучения механизмов ПГД.
Введение
Трансплантация сердца улучшает выживаемость и качество жизни пациентов с терминальной стадией сердечной недостаточности1. К сожалению, нехватка доноров сердца ограничивает число пациентов, которым может быть полезна эта терапия, и ограничивает возможности клиницистов по оптимальному подбору доноров с реципиентами 2,3,4. Кроме того, с 2018 г. новая система распределения способствовала увеличению продолжительности ишемии и значительному расширению использования маргинальных доноров5. Следовательно, средний возраст доноров сердца и время ишемии со временем увеличиваются, что приводит к более высокой частоте первичной дисфункции трансплантата (ПГД), несмотря на значительные улучшения в стратегиях сохранения сердца 6.
ПГД может поражать левый, правый или оба желудочка и остается опасным для жизни осложнением, которое является основной причиной ранней смерти после трансплантации сердца. Изучение механизмов ФДГ и разработка стратегий для лучшего сохранения сердца являются важными соображениями, учитывая потенциальное жизненно важное воздействие на реципиентов сердца. Таким образом, экспериментальные модели, которые позволяют надежно и надежно оценить функцию донорского сердца после длительного хранения, имеют важное значение для углубления нашего понимания ПГД и содействия разработке новых методов лечения. Способность точно оценивать сердечную функцию в сердце мыши позволяет получить доступ к обширному репертуару трансгенных мышиных моделей, которые могут точно идентифицировать механизмы ПГД.
В физиологических и фармакологических исследованиях для оценки функции сердца широко используется модель ретроградной перфузии Лангендорфа7. В частности, сердечная деятельность определяется с помощью силиконового баллона, подключенного к датчику давления в полости левого желудочка (ЛЖ). Ключевой особенностью ПГД является недостаточное сокращение и расслабление мышцы желудочка. Предыдущие исследования Лангендорфа были сосредоточены на использовании баллона ЛЖ для получения надежных и воспроизводимых результатов функциональной оценки ЛЖ 8,9,10. Тем не менее, использование внутриполостного баллона для оценки функции правого желудочка (ПЖ) с помощью баллонной системы менее известно.
Учитывая значительную частоту ПГД с участием ПЖ после трансплантации11, экспериментальные методы изучения функции как ЛЖ, так и ПЖ помогут определить молекулярные и физиологические механизмы, способствующие ПГД ПЖ. Этот протокол показывает, что внутриполостные силиконовые баллоны могут обеспечить надежную оценку функции ЛЖ и ПЖ в одном и том же сердце мыши12. Чтобы оценить потенциальное использование системы Лангендорфа в исследовании ПГД, мы изучили функции сердца с различными периодами хранения и обнаружили снижение сердечной функции при сокращении и расслаблении при длительном хранении в холоде у мышиных сердец. Интересно, что РН имеет более высокую функциональную редукцию, чем РВ. Таким образом, протокол, описанный здесь, может быть использован для оценки влияния препарата-кандидата и молекулярных путей как на функцию ЛЖ, так и на функцию ПЖ. Возможность использовать этот метод на мышиных сердцах облегчит выполнение детальных механистических исследований.
протокол
Все эксперименты на животных, включенные в этот протокол, были одобрены Комитетом по уходу за животными и их использованию при Мичиганском университете в Энн-Арборе. Все мыши были размещены при световом цикле 12:12 в комнатах, свободных от патогенов. См. Таблицу материалов для получения подробной информации, относящейся ко всем материалам, животным и оборудованию, используемым в этом протоколе.
1. Конструкция силиконового баллонного катетера
ПРИМЕЧАНИЕ: Силиконовый баллон изготовлен, как описано ранее13.
- Добавьте в стакан объемом 100 мл 9,5 мл дистиллированной воды, 14,2 мл светлого кукурузного сиропа и 33,8 г сахарозы. Нагрейте и помешивайте раствор до полного растворения сахара.
- Приготовьте тесто, смешав 10 г пшеничной муки и 5 г воды до получения однородной консистенции, и дайте ему отдохнуть в течение 10 минут.
- Сформируйте из небольшого кусочка теста овал — «голову» — и прикрепите его к концу сухой нити спагетти. Затем окуните эту головку в сахарный раствор и медленно выньте из раствора, так как головка теперь полностью покрыта.
ПРИМЕЧАНИЕ: Тесто должно быть гладким и однородной текстуры. Размеры теста можно варьировать для создания воздушных шаров разных размеров, от 5 мм (короткий диаметр) до 7 мм (длинный диаметр). Попробуйте покрыть их тонкой пленкой сахарного раствора. - Подвесьте нить спагетти на пенополистирольном блоке или других держателях, чтобы сформировать глянцевое покрытие равномерно по голове, и высушите в течение ночи.
- Окуните форму в силиконовую дисперсию (силиконовый эластомер, диспергированный в ксилоле). Поместите нить спагетти обратно в пенополистирольный блок при температуре 37 °C на 2 часа или до полного высыхания. Повторите этот шаг один раз.
ПРИМЕЧАНИЕ: Важно предотвратить окисление силиконового дисперсионного геля из-за воздействия воздуха, так как это приведет к неравномерной толщине баллона. - Поместите форму в воду, чтобы отделить и собрать воздушный шар. Храните баллон в 0,02% азиде натрия.
- Отрежьте кончик с двумя тупыми концами от иглы 22 G; Прикрепите один тупой конец к силиконовому баллону, а другой тупой конец к полиэтиленовой трубке. Используйте шелк 4-0, чтобы завязать воздушный шарик на иголке.
ПРИМЕЧАНИЕ: Проверьте целостность баллона, впрыснув в него воду. После того, как баллон наполнится, слегка нажмите на баллон, чтобы проверить, сохраняет ли баллон натяжение внутри. Используйте новый баллон, если он протекает. Смонтированные баллоны можно хранить для использования в будущем.
2. Подготовка перфузионной системы сердца
- Изготовьте 1 л перфузионного буфера Krebs-Henseleit (KH) и перенесите его в резервуар для воды системы Langendorff.
- Подсоедините воздушную трубку к резервуару для воды и включите поток воздуха, чтобы сбалансировать буфер KH с 5% CO 2 и 95% O2 в течение не менее 30 минут.
- Установите водяную баню на 41,5 °C и обеспечьте циркуляцию воды во внешнем слое системы Лангендорфа, чтобы нагреть систему и буфер KH.
ПРИМЕЧАНИЕ: Температура водяной бани требует оптимизации для каждой системы. Для этой системы температура водяной бани будет поддерживать KH на уровне 37-37,5 °C при перфузии в сердце.
3. Изоляция, монтаж и канюляция сердца мыши
- Для антикоагулянтной терапии вводят 200 единиц гепарина в физиологическом растворе путем внутрибрюшинной (в/в) инъекции в правый квадрант брюшной полости мыши C57/B6. Отсасывайте шприц перед инъекцией, чтобы убедиться, что скос игл не находится в мочевом пузыре или просвете желудочно-кишечного тракта. Используйте не менее четырех мышей в каждом экспериментальном состоянии (но также учитывайте величину эффекта лечения).
- Через 30 мин вводят 80 мг/кг кетамина и 10 мг/кг ксилазина внутривенно для обезболивания мыши. Проверьте, находится ли мышь под наркозом без сознания, ущипнув палец ноги и убедившись, что никакой реакции не наблюдается. Ацепромазин 2 мг/кг может быть добавлен в коктейль кет/ксил, если используемый штамм мышей не достигает адекватного уровня анестезии только кет/ксил.
- Сделайте разрез прямо под грудиной. Ножницами вскрывайте грудную клетку, разрезая диафрагму и ребра. Согните переднюю грудную стенку, чтобы полностью обнажить грудную клетку. Разрез на нисходящей аорте (закрыт к дуге аорты). Перенесите сердце, легкие и тимус мыши в холодный гистидин-триптофан-кетоглутаратный (ГТК) буфер. Изолируют органы под ледяным буфером HTK. Обнажите аорту, удалив все соединительные ткани.
ПРИМЕЧАНИЕ: Увеличьте длину аорты, включив в иссечение как восходящую аорту, так и область дуги аорты, чтобы оставить достаточно места для соединения с иглой.
- Соедините конец аорты с иглой 22 г и перевяжите шелковым швом 6-0. Убедитесь, что канюля находится над корнем аорты, чтобы не мешать аортальному клапану. Профузируйте аорту 10 мл холодного (4 °C) буфера HTK в течение примерно 10 минут.
ПРИМЕЧАНИЕ: От удаления сердца до канюляции аорты проходит менее 15 минут; Однако важно поддерживать скорость перфузии на должном уровне. Слишком быстрые и энергичные инъекции могут вызвать высокое давление и повреждение сосудов/сердца. - Храните сердце в пробирке объемом 50 мл с ледяным HTK в течение 8 часов или немедленно выполняйте перфузию (не храните контроль) и избегайте прямого контакта со льдом.
ПРИМЕЧАНИЕ: Прямой контакт сердечной ткани со льдом может привести к холодовой травме. - Соедините игольчатое сердце с канюлей в аппарате Лангендорфа и перевяжите его шелковым шовом.
ПРИМЕЧАНИЕ: Чтобы стандартизировать процедуру, подождите в общей сложности 3 минуты для процесса канюляции перед перфузией. - Начните перфузию с режимом постоянного потока со скоростью 3 мл/мин; затем переключитесь в режим постоянного давления на 70-80 мм рт.ст. и настройте сердце на ~6 мл/мин.
ПРИМЕЧАНИЕ: Мягкая пальпация сердца может помочь ускорить реанимацию сердца. Если скорость потока перфузии намного выше 6 мл/мин в режиме постоянного давления, возможно, есть утечка в канюляции или аортальный клапан может работать неправильно. Отрегулируйте соединения, чтобы устранить утечку. Режим постоянного потока перекрывает саморегуляцию сосудистого тонуса сердца. Режим постоянного давления позволяет сердцу регулировать коронарный перфузионный поток. Таким образом, режим постоянного давления позволит точно измерить сердечную функцию и сохранность качества сердца. - Подсоедините сдутый, наполненный водой баллон к датчику давления и шприцу, наполненному водой, с помощью трехстороннего крана. После 15-20-минутного периода уравновешивания вырежьте правое предсердие (РА) и введите баллон в РВ через РА. Используйте ленту, чтобы удерживать баллон внутри фургона. Сведите к минимуму открытую область РА, чтобы помочь удерживать баллон в желудочке (см. Рисунок 1 ).
ПРИМЕЧАНИЕ: Период равновесия необходим, так как сокращение и расслабление сердца не являются стабильными в начале, и измерение является менее точным и репрезентативным. Если AV-узел повреждается во время открытия РА, в сердце будут проявляться частые аритмии. - Через 20 минут после сбора функциональных данных ПЖ разрезать левое предсердие (ЛП) и через ЛН ввести в ЛН сдутый баллон, наполненный водой. Используйте скотч, чтобы удерживать баллон внутри LV.
ПРИМЕЧАНИЕ: Сердце должно поддерживать стабильную гемодинамику более 1,5 ч.
4. Запись функциональных данных
- Калибровка датчика давления
- Наполните шприц объемом 10 мл теплым физиологическим раствором и подсоедините шприц к куполу через трехсторонний кран. Откройте кран и медленно наполните купол физиологическим раствором, а затем закройте все краны и извлеките шприц. Прикрепите заполненный купол к преобразователю; Подсоедините манометр к третьему концу трехходового крана.
- В программном обеспечении для записи выберите Bridge Amp (Мостовой усилитель ) из выпадающего меню канала, подключенного к преобразователю. Переименуйте канал в Perfузированное давление. Нажмите кнопку Ноль , чтобы обнулить датчик.
- Начните запись, нажав кнопку Старт , чтобы датчик показывал 0 мм рт.ст. После нескольких секунд записи медленно надавите на шприц и увеличьте давление до 100. Нажмите кнопку «Стоп», чтобы остановить запись.
- В диалоговом окне «Преобразование единиц измерения» выберите область записи для 0 мм рт.ст., щелкните стрелку к точке 1 и введите 0 мм рт.ст. Выберите область записи для 100 мм рт.ст., щелкните стрелку к точке 2 и введите 100 мм рт.ст. Нажмите кнопку ОК, чтобы откалибровать преобразователь.
- Переименуйте канал, соответствующий датчику давления с баллоном, в Давление в желудочках. Начинайте запись, когда сердце подключено к системе. После введения баллона в желудочек регулируют объем воды в баллоне с помощью шприца микрометра через трехсторонний кран для поддержания конечного диастолического давления на уровне 5-10 мм рт. ст.
ПРИМЕЧАНИЕ: Конечная диастолическая мера может снижаться во время измерения, предпочтительно начиная с 10 мм рт.ст. - Переименуйте пустой канал в dP/dt. В раскрывающемся меню выберите Derivative | source channel (Производная | исходный канал ) в качестве Ventricle Pressure (Давление в желудочке). Канал будет фиксировать коэффициент изменения давления в полости желудочка в период сокращений.
- Выберите стабильный период измерения, затем нажмите «Настройка» в модуле «Артериальное давление».
- Выберите Давление в желудочках в качестве входного канала и нажмите кнопку выбора для периода расчета | ОК.
- Щелкните Вид классификатора, чтобы удалить отклонение сердечного цикла (например, аномальное время цикла или давление).
- Щелкните табличное представление, чтобы создать таблицу среднего значения максимального dP/dt ( сокращение ) и минимального dP/dt (расслабление) за выбранный период.
ПРИМЕЧАНИЕ: Сохраните файл записи для каждого образца и сохраните таблицу средней функции сердца для статистического анализа.
Результаты
Взрослые мышиные сердца C57Bl/6 в возрасте 3 месяцев были собраны и установлены в системе Лангендорфа. Донорское сердце хранили в HTK в течение 0 и 8 ч, а затем перфузировали оксигенированным буфером KH. Силиконовый баллон, подключенный к датчику давления, использовался для измерения сокращения и расслабления функций ЛЖ и ПНЖ.
Давление в аорте поддерживалось в диапазоне 70-80 мм рт.ст. Частота сердечных сокращений была сопоставима в сердцах мышей с 0 и 8 часами хранения. Функцию ЛЖ и ПЖ исследовали путем измерения систолического и диастолического давления. Для определения динамики давления рассчитана производная dP/dt для расчета коэффициента изменения давления. Абсолютное число max dP/dt и минимальное dP/dt может представлять собой уровень мышечного сокращения и расслабления. Через 0 ч хранения ЛЖ имела более высокое систолическое давление по сравнению с ПЖ (рис. 2С и рис. 3А). ЛЖ показала большее мышечное сокращение и расслабление, чем ПЖ после перфузии 0 ч хранения (рис. 2С и рис. 3В, В). Однако после 8 ч холодного хранения как РН, так и ПЖ показали значительное функциональное снижение по сравнению с исходным уровнем 0 ч (рис. 2A-D и рис. 3B, C). Снижение сердечных сокращений было более выраженным при ЛЖ. Через 8 ч хранения сокращение и расслабление ЛЖ составило 25,1% и 30,7% от исходного уровня 0 ч, в то время как ПЖ имела 32,5% и 29,1% функции по сравнению с исходным уровнем 0 ч (рис. 3Б, В). Эти результаты показали, что ПГД ЛЖ после длительного хранения имела более значительное снижение сердечных сокращений, чем ПЖ.
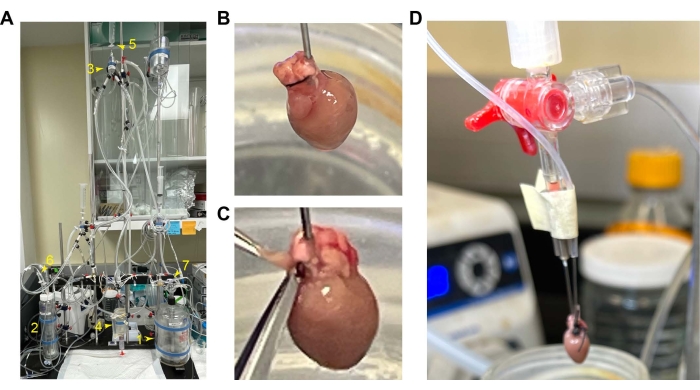
Рисунок 1: Установка и канюляция сердца мыши . (A) Общая настройка перфузионной установки. 1. Перфузионный резервуар. 2. Камера оксигенации. 3. Камера воздухоуловителя. 4. Камера сердца. 5. Переключатель значений для постоянного расхода и давления. 6 и 7. Приток кислорода. (Б) Канюлированные сердца с фургоном спереди. (C) Положение RV для разреза для открытия его полости. (D) Постучите канюлей по баллонной трубке. Аббревиатура: RV = правый желудочек. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
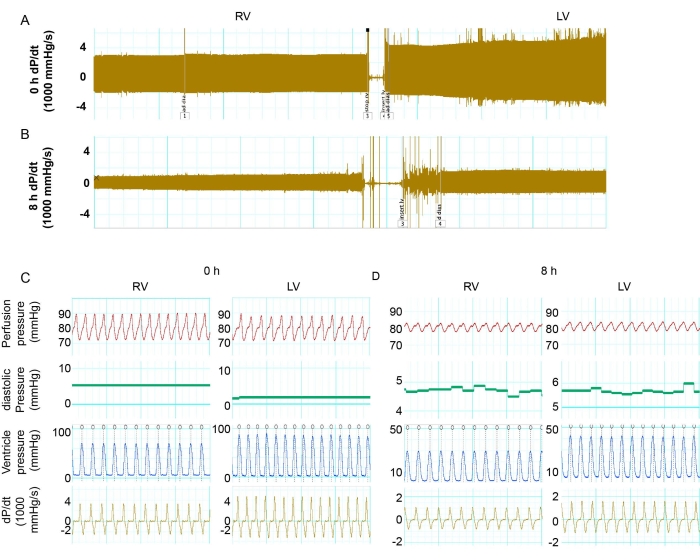
Рисунок 2: Сравнение функций ЛЖ и ПЖ. (А) Отслеживание максимальных и минимальных dP/dt в ПЖ и ЛЖ в сердце донора при 0 ч хранения. (Б) Запись максимальных и минимальных dP/dt в ПЖ и ЛЖ в сердце донора с 8 ч хранения. (С,Д) Подробная информация о dP/dt, давлении ЛЖ, частоте сердечных сокращений и перфузионном давлении в ЛЖ и ПЖ через 0 ч и 8 ч. Сокращения: ПЖ = правый желудочек; ЛЖ = левый желудочек; dP/dt = зависимость давления от времени. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
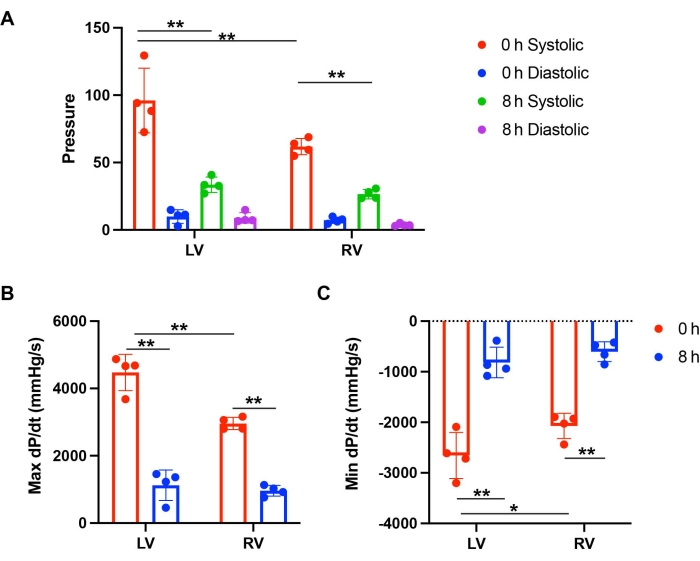
Рисунок 3: Сравнение функции ЛЖ и ПЖ после хранения и перфузии. (А) Систолическое и диастолическое давление ЛЖ и ПЖ через 0 ч и 8 ч хранения. (B) Max dP/dt и (C) Min dP/dt ЛЖ и ПЖ после перфузии при хранении 0 ч и 8 ч. Эта цифра взята из Lei et al.12. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Данный протокол описывает ретроградную перфузию по методу Лангендорфа с помощью аортальной канюляции. Этот метод может быть использован для оценки функции ЛЖ и ПЖ сердца мышей после хранения в холодильнике. Результаты показывают, что длительное холодное хранение донорских сердец приводит к снижению сердечной функции как в ЛЖ, так и в ПЖ при использовании этого протокола.
Исследования острого и хронического отторжения после трансплантации сердца широко сосредоточены на иммунобиологии14. Влияние нативных клеток на ПГД при холодном хранении изучено менее хорошо. ПГД встречается в ~10%-20% случаев трансплантации сердца и является причиной 66% ранней смерти в течение 30 дней после трансплантации. В частности, частота ПГД, влияющей на ЛЖ, и ПЖ различается после трансплантации11. Этот метод ex vivo фокусируется на вкладе нативных сердечных клеток в ПГД после холодного консервирования донорских сердец. Дальнейшие исследования могут включать реакцию реципиента в мышиной модели трансплантации сердца.
В этом протоколе перфузия Лангендорфа холодноконсервированных донорских сердец фокусировалась на нативных сердечных реакциях на теплую кристаллоидную перфузию без инфильтрации клеточного иммунитета. Для достижения воспроизводимых результатов было стандартизировано несколько критических этапов. Сердца мышей останавливали с помощью раствора HTK и хранили в ледяном HTK, аналогично клинической практике. Объем перфузии и время инфузии раствора HTK для каждого сердца тщательно контролировались с помощью таймера. Донорское сердце хранили в предварительно охлажденных пробирках на льду, содержащем HTK, в помещении с температурой 4 °C. Время канюляции стандартизировано до ~3 мин до перфузии. Все эти шаги гарантировали, что продолжительность холодного консервирования была основной переменной в исследовании.
Период нерегулярной сократимости сердца в течение ~20 мин обычно наблюдался в начале перфузии. Этому уравновешиванию и восстановительному периоду способствовало постепенное прогревание и насыщение кислородом сердечных тканей. После начальных 20 мин ожидался относительно стабильный период. Баллон вводили в полость желудочка через ~18 мин после начального периода равновесия. Мы начали регистрировать гемодинамику после того, как сердце стало стабильным в течение ~25 минут, после введения баллона. Перфузия с буфером KH поддерживала стабильную сердечную деятельность в течение ~1,5-2 ч. Поэтому мы решили регистрировать гемодинамику в течение 20 минут в каждом из левого и правого желудочков.
Существует несколько ограничений ретроградной перфузии для исследования ПГД сердец после холодного хранения. Во-первых, из-за размера баллона и нехватки места в каждой полости желудочка (в частности, в ПЖ) одновременное введение двух баллонов как в ЛЖ, так и в ПЖ является очень сложной задачей. Таким образом, мы последовательно измеряем функцию ПЖ и ЛЖ. Важно отметить, что межжелудочковая перегородка вносит значительный вклад в функцию как левого, так и правого желудочка. Перегородка обеспечивает ~50% функции правого желудочка, поэтому существует межжелудочковая зависимость15. Также важно отметить, что в то время как процедуры реперфузии сердца мыши в аппарате Лангендорфа занимают ~3 мин, хирургическая имплантация сердца человека в относительно теплом операционном поле занимает ~45 мин. Для сравнения, сердце мыши в этой системе Лангендорфа подвергается меньшей ишемической ишемии. Это следует учитывать при рассмотрении вопроса о клиническом переводе.
Поскольку мы использовали буфер KH для перфузии сердца без крови, он также может иметь меньшую эффективность в доставке кислорода. Тем не менее, функция сердца относительно стабильна в течение начальных 1,5-2 ч перфузии, что позволяет проводить надежные измерения гемодинамики. К сожалению, в настоящее время не существует жизнеспособных рабочих моделей перфузии сердца для этих небольших мышиных сердец, и влияние желудочковой нагрузки не может быть оценено в этой системе. Несмотря на это, перфузионная система обладает высокой воспроизводимостью и менее трудоемкой и длительной, чем трансплантационные модели. Он также менее затратен, чем исследования по трансплантации, что может сделать его более подходящим для скрининга различных терапевтических вариантов и различных молекулярных путей. С модификацией консервирующих растворов путем добавления препаратов-кандидатов, эта платформа может быть использована для оценки влияния фармакологических агентов на снижение ПГД как в ЛЖ, так и в ПЖ.
Раскрытие информации
У авторов нет конфликта интересов, который они могли бы раскрыть.
Благодарности
Никакой.
Материалы
| Name | Company | Catalog Number | Comments |
| 4-0 silk suture | Braintree Scientific | SUTS108 | |
| 6-0 Silk suture | Braintree Scientific | SUTS104 | |
| All purpose flour | Kroger | ||
| BD General Use and PrecisionGlide Hypodermic Needles 22 G | Fisher scientific | 14-826-5A | |
| BD Syringe with Luer-Lok Tips (Without Needle) | Fisher scientific | 14-823-16E | |
| Corn Syrup | Kroger | ||
| Custodiol HTK Solution | Essential Pharmaceuticals LLC | ||
| Dissecting Scissors | World Precision Instruments | 14393/14394 | |
| Falcon 50 mL conical tubes | Fisher scientific | 14-959-49A | |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H4784 | |
| Krebs Henseleit buffer | Sigma | K3753 | |
| Nusil silicone dispersions | Avantor | ||
| Perfusion system | Radnoti | 130101BEZ | |
| PowerLab | ADInstruments | PL3508 | |
| Sodium azide | Sigma | S2002 | |
| Sodium bicarbonate | Sigma | S5761 | |
| Sucrose | Sigma | S0389 | |
| Sucrose | Sigma | S0389 | |
| Xylazine | Sigma | X1126 |
Ссылки
- Kim, I. C., Youn, J. C., Kobashigawa, J. A. The past, present and future of heart transplantation. Korean Circulation Journal. 48 (7), 565-590 (2018).
- Gaffey, A. C., et al. Transplantation of "high-risk" donor hearts: Implications for infection. The Journal of Thoracic and Cardiovascular Surgery. 152 (1), 213-220 (2016).
- Hsich, E. M. Matching the market for heart transplantation. Circulation: Heart Failure. 9 (4), 002679 (2016).
- Piperata, A., et al. Heart transplantation in the new era of extended donor criteria. Journal of Cardiac Surgery. 36 (12), 4828-4829 (2021).
- Huckaby, L. V., Hickey, G., Sultan, I., Kilic, A. Trends in the utilization of marginal donors for orthotopic heart transplantation. Journal of Cardiac Surgery. 36 (4), 1270-1276 (2021).
- Singh, S. S. A., Dalzell, J. R., Berry, C., Al-Attar, N. Primary graft dysfunction after heart transplantation: a thorn amongst the roses. Heart Failure Reviews. 24 (5), 805-820 (2019).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50 (6), 940-950 (2011).
- Rossello, X., Hall, A. R., Bell, R. M., Yellon, D. M. Characterization of the Langendorff perfused isolated mouse heart model of global ischemia-reperfusion injury: impact of ischemia and reperfusion length on infarct size and LDH release. Journal of Cardiovascular Pharmacology and Therapeutics. 21 (3), 286-295 (2016).
- Matsuura, H., et al. Positive inotropic effects of ATP released via the maxi-anion channel in Langendorff-perfused mouse hearts subjected to ischemia-reperfusion. Frontiers in Cell Development Biology. 9, 597997 (2021).
- Tse, G., Hothi, S. S., Grace, A. A., Huang, C. L. Ventricular arrhythmogenesis following slowed conduction in heptanol-treated, Langendorff-perfused mouse hearts. The Journal of Physiological Sciences. 62 (2), 79-92 (2012).
- Kobashigawa, J., et al. Report from a consensus conference on primary graft dysfunction after cardiac transplantation. The Journal of Heart and Lung Transplantation. 33 (4), 327-340 (2014).
- Lei, I., et al. Differential inflammatory responses of the native left and right ventricle associated with donor heart preservation. Physiological Reports. 9 (17), 15004 (2021).
- Miller, A., Wright, G. L. Fabrication of murine ventricular balloons for the Langendorff heart preparation. Journal of Biotechnology & Biomaterials. 1 (101), (2011).
- Madsen, J. C. Advances in the immunology of heart transplantation. The Journal of Heart and Lung Transplantation. 36 (12), 1299-1305 (2017).
- Voelkel, N. F., et al. Right ventricular function and failure: report of a National Heart, Lung, and Blood Institute working group on cellular and molecular mechanisms of right heart failure. Circulation. 114 (17), 1883-1891 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены