Method Article
亚细胞分离用于从小鼠脑中分离突触成分
摘要
该协议提供了一种强大,详细的方法,可以从小鼠大脑中获得高纯度的突触体,突触囊泡和其他突触部分。该方法能够评估突触过程,包括蛋白质定位和功能(具有区室分辨率)的生化分析。
摘要
突触末端是神经元通信的主要部位。突触功能障碍是许多神经精神和神经系统疾病的标志。因此,通过生化分离表征突触亚区室是阐明健康和疾病中突触过程分子基础的有力方法。该协议描述了通过亚细胞分离从小鼠大脑中分离突触末端和突触亚区室。首先,密封的突触末端结构,称为突触体,在脑组织匀浆后被分离出来。突触体是神经元突触前和突触后隔室,具有夹断和密封的膜。这些结构保持代谢活跃状态,对于研究突触结构和功能很有价值。然后将突触体进行低渗裂解和超速离心,以获得富集用于突触囊泡、突触细胞质和突触质膜的突触亚区室。通过电子显微镜和突触下区室特异性蛋白质的生化富集分析确认馏分纯度。所提出的方法是研究突触的结构和功能特征以及各种脑部疾病的分子病因的简单而有价值的工具。
引言
突触是大脑的基本计算单元,神经元通过它进行交流并发挥多样化和精致复杂的功能。因此,突触对大脑健康至关重要1;突触功能障碍是许多疾病的来源或结果2.突触由突触前和突触后末端构成,两个不同神经元的延伸,它们被突触粘附分子穿过的突触裂缝紧密贴合和分离。信息以称为神经递质的化学信使的形式从突触前到突触后隔室流动1。参与神经传递的分子过程是研究的活跃领域3,4,5。了解突触末梢内的致病过程以及突触对其他神经元亚区室病理的反应是解决大脑疾病的关键步骤1,2。一些方法学的进步,主要应用于小鼠模型,推动了这一追求6。通过差速离心分离突触部分是一种范式转变方法,它能够详细评估健康和疾病中的突触过程。
成人大脑由80-900亿个神经元组成7,8。在小鼠物种中,大鼠大脑包含大约~2亿个神经元,而小鼠有~7000万个9,10。每个神经元与高度极化的神经元网络形成数千个特定的突触连接,这些神经元与神经胶质细胞和致密脉管系统混合在一起。在如此复杂和异质的组织中,将突触作为一个独立的系统进行分离和研究曾经是不可想象的。在1960年代,Victor Whittaker,Catherine Hebb和其他人通过使用亚细胞分离分离11,12,13,14分离完整的突触末端,使这成为可能。为了分离突触囊泡(SV),他们通过等渗透(0.32M)蔗糖中的液体剪切力使大脑匀浆,然后进行超速离心。他们获得了被捏断的、质膜封闭的、完整的神经末梢或静脉曲张,他们称之为神经末梢颗粒(NEP)11,13。由于突触的结构和功能特征保留在这些结构中,NEP后来被称为"突触体",以与其他亚细胞器全等13,15。值得注意的是,爱德华多·德·罗伯蒂斯(Eduardo de Robertis)及其同事创造了"突触囊泡"一词,与惠特克及其同事的工作重叠,并有助于验证"突触体"分离和表征16,17,18。
突触体是生理活性结构,包含储存、释放和再摄取神经递质所需的所有细胞和分子特性13,18。在体外保留关键突触特征和不含非突触成分也有助于这种分离方法的实用性。突触体对理解神经传递的化学和生理特性做出了巨大贡献,现在正用于研究突触分子过程及其在疾病中的改变19,20,21,22,23。突触体也是分离突触成分的初始源材料,例如SVs,网格蛋白包被的囊泡(CCV),突触细胞质,突触质膜,突触线粒体,突触粘附分子和其他感兴趣的成分,可以促进理解突触功能的分子机制18,19,20,24,25,26,27,28.这些亚突触组分可以通过突触体的渗透裂解和蔗糖密度梯度超速离心15,29获得。尽管已知Whittaker研究小组的原始亚细胞分离方法可有效分离高质量的突触体和SVs13,30,但最近的优化提高了亚细胞组分22,23,31,32的纯度。本文提供了一个非常详细且易于访问的经典方案版本,用于小鼠脑组织的亚细胞分离以分离突触体、SV 和其他亚突触组件。
研究方案
所有小鼠实验均获得耶鲁大学机构动物护理和使用委员会(IACUC)的批准(协议2021-11117),并在国际实验动物护理评估和认证协会(AAALAC)认可的设施中进行。动物护理和住房符合《实验动物护理和使用指南》33 ,由耶鲁动物资源中心(YARC)提供。将动物保持在12小时的光照/黑暗循环中, 随意 获取食物和水。以下方案需要每个基因型或条件五到八只小鼠或两到四只大鼠。由于它们的脑容量较大,因此需要更少的大鼠。同样,实验动物的年龄可能会影响分数产量;小于2个月大可能需要额外的小鼠。否则,概述的程序适用于鼠种和任何年龄的健康成年动物。本研究中提供的代表性数据使用从商业来源获得的野生型(C57BL / 6J)小鼠(年龄= 2个月;每个重复4只雄性和4只雌性)(见 材料表)。
1. 实验准备
注意:该协议需要~11小时才能完成单个研究人员。强烈建议在方案执行前一天完成台式设置(图1)、缓冲液制备(表1)、离心机和转子预冷至4°C,以及必要材料和设备的收集和标记(参见 材料表)。
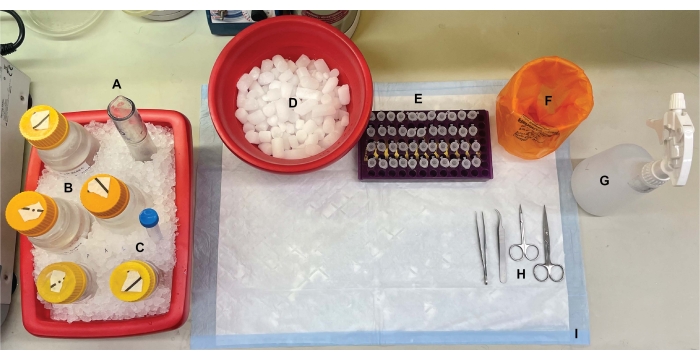
图1:台式设置。 在脑解剖之前,(A)Dounce玻璃均质机和(B)所有缓冲液在冰上冷却。(C)蛋白酶抑制剂储备溶液在冰上解冻。获得了用于离心管的第二个湿冰容器,液氮杜瓦瓶(未显示)和(D)用于短期储存在液氮中快速冷冻的样品的干冰容器。(E)对所有样品预先标记微量离心管,因为在此过程中收集了每个基因型或条件的每个亚细胞级分样品的四个等分试样(节省时间的提示:在进行实验前一天彻底标记所有管)。(F)适当的生物危害废物容器,(G)70%乙醇,(H)手术工具,以及(I)吸收性表面垫。所需的离心管和一次性用品被留出,以便在方案实施期间有效访问(未显示)。 请点击此处查看此图的大图。
- 准备手术台,并收集脑切除所需的剪刀和镊子(见 材料表)。预标记用于小鼠尾部活检的 1.5 mL 微量离心管,每个收集的馏分 4 个管,如图 2 所示。
- 获得两个容器的湿冰,一个容器的干冰和一个台式液氮杜瓦瓶。
- 在冰上解冻苯甲基磺酰氟(PMSF),胃抑素A,抑肽酶和亮肽素储备溶液(见 材料表)。准备必要的缓冲液(表1)。
注意:蔗糖溶液可以提前制备并储存在4°C。 然而,由于蛋白酶抑制剂在水溶液中的不稳定性,必须在实验开始时向所有缓冲液中新鲜添加蛋白酶抑制剂(解冻的原液和片剂)。此外,所有缓冲液必须用不含洗涤剂的玻璃器皿和无洗涤剂的水制备,以便能够收集完整的突触体。 - 将所有缓冲液和玻璃Dounce均质机(见 材料表)冷却在冰上。将离心机设置为4°C并将转子冷却至4°C。
- 将 14 mL 缓冲液 A(表 1)加入冰上的 Dounce 均质器中。
表1:亚细胞分级缓冲液的组成。请按此下载此表格。
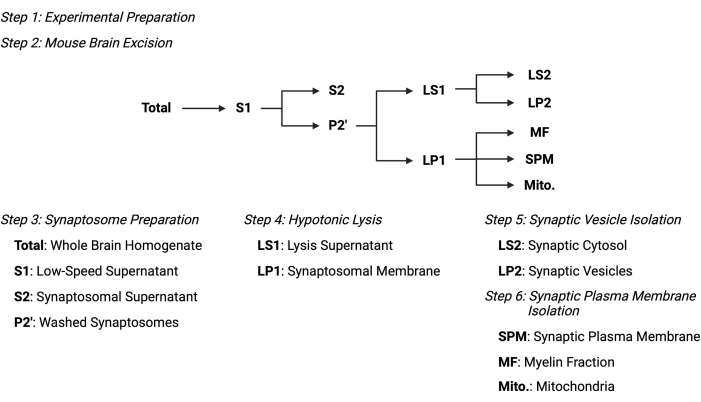
图2:亚细胞分级分离方案概述。 亚细胞分级分离步骤和收集样品的摘要示意图。 请点击此处查看此图的大图。
2.小鼠脑切除术
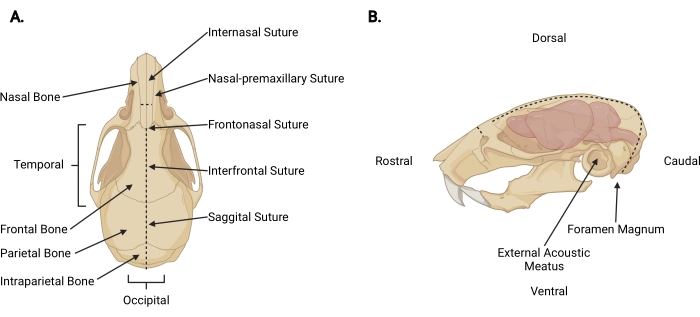
图 3:颅面解剖结构 。 (A)小鼠头骨的背视图,指示相关的颅骨结构。(B)小鼠头骨和大脑的左侧侧视图,指示了相关的颅骨结构和解剖方向。虚线表示应进行切口的位置。 请点击此处查看此图的大图。
- 使用开放式滴法在位于通风橱或生物安全柜中的麻醉室中用100%异芴烷深度麻醉每只小鼠34。通过颈椎脱位处死每只小鼠,然后迅速斩首。在基因型或实验组之间交替进行每次处死和解剖12.安乐死后通过用细剪刀切除 2 mm 的远端尾尖进行尾部活检。储存组织以进行基因分型。
- 用70%乙醇喷洒斩首的头部,以防止头发在解剖过程中粘附在组织和手术器械上。
- 在斩首切口处将细剪刀插入颅周深度,并在鼻间缝合线上做一个矢状中切口(图3A)以将头皮从颅骨上缩回。
- 从枕骨区域向每个颞部工作,修剪筋膜和肌肉,以暴露每个外部声道之外的颅骨外表面(图3B)。
- 用非惯用手固定颅骨的头皮和头骨侧面。用另一个,将细剪刀插入大孔的尾侧 2 毫米,在那里可以看到脊髓退出。做一个中线切口,直到剪刀到达顶骨内表面(图3;虚线)。
注意:在初始切口期间,剪刀必须平行于脊髓,并向颅骨内表面施加压力,以防止损伤脑干和小脑。 - 改变剪刀的角度,使刀片与头骨的背表面平行。继续通过顶骨和额骨向嘴部推进矢状中切口,使用矢状面和额间缝线作为指导。使用恒定的向上压力以避免损伤皮层。在鼻间缝合线之外终止切口(图3A)。
- 通过将剪刀垂直于颅骨放置,每个刀片位于鼻前上颌缝线上,并均匀切割一个,在鼻骨上做一个小的垂直切口(~3毫米),鼻骨与鼻间缝合线相吻合。
注意:此步骤将增加缩回颅骨的便利性,并且对于收集嗅球至关重要,如果该区域感兴趣。 - 在固定嘴部时,使用一对带纹理的镊子的一侧轻轻地将颅骨从大脑中抬起,然后横向和腹侧。根据需要沿中线重复,然后对另一个半球重复,直到整个大脑表面暴露出来。
- 使用弯曲的镊子或细刮刀,轻轻抬起大脑的喙侧。切断视神经和颅神经以完成颅骨切除。
- 对于每种情况,将5至8只小鼠大脑一起收集到含有14mL缓冲液A的冷冻玻璃Dounce均质器中(表1)。
3. 突触体准备
注意:此过程的原理图如图 4 所示。
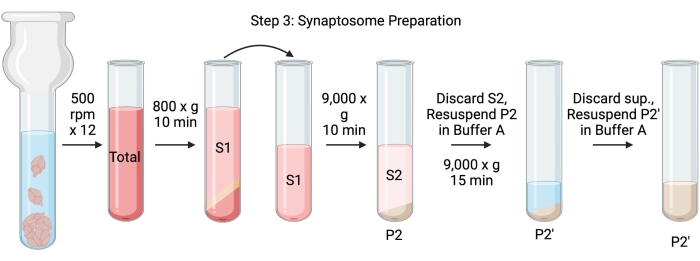
图4:突触体制备。 步骤3的示意图,突触体(P2')的产生。 请点击此处查看此图的大图。
- 使用玻璃 Dounce 均质器以 500 rpm(总计)的速度进行 12 次上下通过,使大脑均质化。在每个下冲程时短暂暂停,以确保组织的彻底均质化。优先在冰浴中均质化,以避免变暖和蛋白质变性。取 5 μL 等分试样通过二辛可宁酸测定法(BCA,参见 材料表)测定蛋白质浓度。取 100 μL 全脑裂解物等分试样进行蛋白质印迹 (WB)。对于此样品和所有后续样品(图2),取两个等分试样用于BCA,两个等分试样用于WB。将所有收集的等分试样在液氮中快速冷冻,并将其储存在-80°C。
- 在高速圆底离心管(14mL)(参见 材料表)中以800× g 在4°C下旋转全脑匀浆10分钟,以获得上清液(S1)。将S1转移到新的离心管中,留下含有完整细胞和细胞核的沉淀(P1)。避免移液蓬松、白色、松散、浅表的颗粒。取 2 x 5 μL 的 S1 用于支链氨基酸,2 x 100 μL 的 S1 用于 WB。
- 在4°C下以9,000× g 旋转S15分钟,以获得突触体上清液(S2)和粗突触体沉淀(P2)。取 2 x 10 μL 的 S2 用于支链氨基酸,2 x 500 μL 的 S2 用于 WB。获得等分试样后弃去上清液,然后继续下一步沉淀。
- 用蛋白酶抑制剂将P2重悬于3mL冰冷的缓冲液A中,并在4°C下以9,000× g 离心15分钟,以获得上清液(S2')和洗涤的突触体(P2')。弃去上清液并保持沉淀。
- 将 P2' 重悬于 3 mL 缓冲液 A 中,避免将主要含有线粒体的深红色部分重悬在沉淀底部。取 2 x 20 μL P2' 用于支链氨基酸,2 x 100 μL P2' 用于 WB。
注意:这可以通过轻轻移液混合沉淀的边缘和表面以重悬白色洗涤的突触体,同时将移液器尖端远离沉淀的红色中心来实现。
4.低渗溶解
注意:此过程的原理图如图 5 所示。
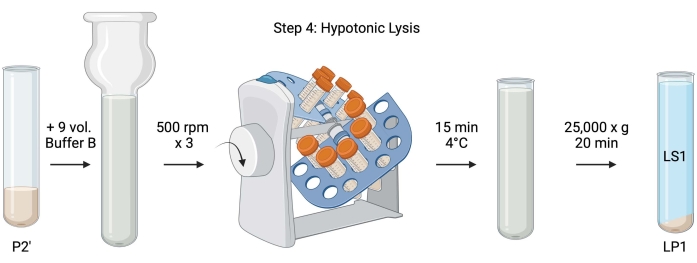
图5:低渗溶解。 步骤4的示意图,低渗裂解突触体以产生裂解上清液(LS1)和突触体膜组分(LP1)。 请点击此处查看此图的大图。
- 对于洗涤突触体的低渗裂解,向重悬的P2'(~27mL)中加入9体积的冷冻缓冲液B(表1)。在玻璃Dounce均质器中匀浆突触体(以500rpm的速度上下通过三次)。
- 将样品转移到 50 mL 带盖的锥形离心管中。在4°C冷藏室中的管式左轮手枪上旋转15分钟。
- 在4°C下以25,000× g 离心裂解P2'20分钟,以获得裂解上清液(LS1)和含有突触体膜(LP1)的裂解沉淀。取 2 x 50 μL LS1 用于支链氨基酸,2 x 400 μL LS1 用于 WB。将LS1转移到带盖的离心管中进行超速离心(见 材料表)。
5.突触囊泡分离
注意:此过程的原理图如图 6 所示。
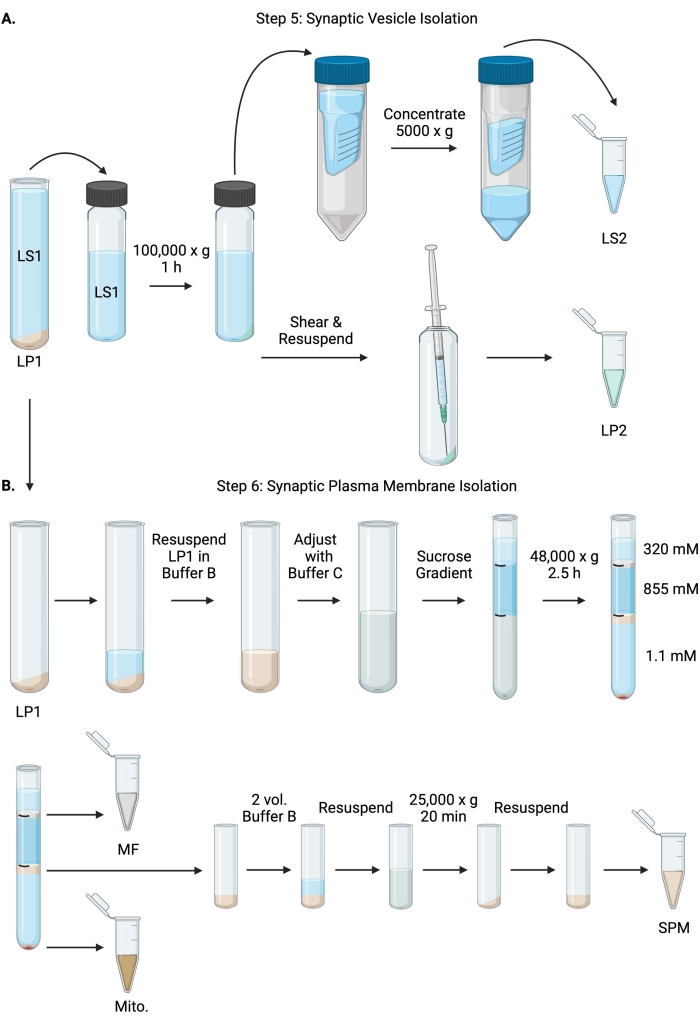
图6:突触囊泡分离和突触质膜分离 。 (A)步骤5的示意图,突触细胞质(LS2)和突触囊泡(LP2)部分的分离,以及(B)步骤6,在蔗糖梯度超速离心后产生髓磷脂(MF),突触质膜(SPM)和线粒体(Mito.)部分。 请点击此处查看此图的大图。
- 在固定角度超速离心机转子(参见 材料表)中以100,000× g 在4°C下离心LS160分钟,以获得突触细胞质上清液(LS2)和突触囊泡沉淀(LP2)。LP2 将很小,半透明,并强烈粘附在离心管的侧面。
- 将 LP2 重悬于 500 μL 缓冲液 A 中。 使用 23 G 针头和 1 mL 注射器,轻轻研磨剪切 LP2。取 2 x 10 μL LP2 用于支链氨基酸,2 x 250 μL LP2 用于 WB。
- 将LS2 (~30 mL)转移到截止时间为10 kDa的离心过滤装置中(参见 材料表)。
注意:如果感兴趣的蛋白质小于 10 kDa,可以使用 4 kDa 截止离心过滤装置,但会导致更长的旋转时间。 - 通过在 5000 x g 下在 4 °C 下旋转长达 1 小时,将 LS2 浓缩至约 0.5 mL。 取 2 x 10 μL 浓缩 LS2 用于支链氨基酸,2 x 250 μL 浓缩 LS2 用于 WB。开始旋转后,直接进入步骤 6.1。
6.突触质膜分离
- 将LP1(步骤4.3)重悬于1 mL缓冲液B中(表1)。取 2 x 10 μL LP1 用于支链氨基酸,2 x 50 μL LP1 用于 WB。使用缓冲液B和缓冲液C将剩余的LP1调节至终体积为7.5 mL,最终蔗糖浓度为1.1 M(表1)。
- 将 7.5 mL 重悬的 LP1 转移到 14 mL 超速离心管中(参见 材料表)。小心地用3.75 mL缓冲液D覆盖LP1(表1),然后用1.25 mL缓冲液A(或更大的体积填充离心管顶部下方)覆盖。避免从管的侧面移液,这会破坏蔗糖梯度界面。覆盖每个蔗糖级分后,用笔标记溶液的顶部。按重量而不是体积平衡超速离心的管,滴加缓冲液A至10mg以内。在4°C下以48,000× g 离心2.5小时,在水平吊篮超速离心机转子中(参见 材料表)。
- 在超速离心后获取完整梯度的图像,以记录每个蔗糖界面的独特性和分级分离的成功。
- 小心地去除320mM蔗糖(缓冲液A)的表层。在 800 μL 体积中回收 320 mM/855 mM 蔗糖界面处的髓鞘级分 (MF)。在 1,000 μL 体积中回收 855 mM/1.1 M 蔗糖界面处的突触质膜 (SPM) 部分。以圆形方式从管壁上移取每个馏分,以确保收集完整的馏分。小心地吸出剩余的蔗糖,并通过重悬于200μL缓冲液B中来回收线粒体沉淀(Mito.)。取 2 x 100 μL MF 用于支链氨基酸和 2 x 10 μL 水户。对于支链氨基酸;将MF和Mito的其余部分分开。WB的样品对半。
- 用2体积的缓冲液B(~2mL)稀释SPM级分,然后在3.5mL离心管(参见 材料表)中的固定角转子中以25,000× g 在4°C下离心20分钟。 弃去上清液并将SPM沉淀重悬于缓冲液A中,最终体积为250μL。取 2 x 5 μL SPM 用于 BCA,并将剩余的 SPM 分成两半用于 WB。
- 执行BCA以确定每个样品的蛋白质浓度,考虑可变的等分试样体积。
注意:对于WB分析,所有亚细胞级分的建议工作蛋白浓度为2μg/ μL(或LS1和MF可实现的最高浓度)。
结果
所提出的方法产生11个脑亚细胞组分,这些部分可以进行进一步纯化和各种形式的下游分析35,36。评估突触体、SVs23 和其他组分质量的金标准方法是电子显微镜 (EM)(图 7)。还可以对特定亚细胞级分中存在的蛋白质进行定量免疫印迹,以评估馏分纯度的标志物(图8)。例如,与初始全脑匀浆(Total)中的蛋白质水平相比,组分的免疫印迹分析显示突触质膜部分(SPM)中的N-钙粘蛋白(CDH2,UniProt名称)富集,突触细胞质(LS2)中的α-突触核蛋白(SYUA),突触囊泡组分(LP2)中的突触素(SYPH)和髓鞘部分(MF)中的髓鞘碱性蛋白(MBP)富集(图8).一旦确定了馏分纯度(例如,注意LS2级分中没有CDH2或LP2级分中SYPH增加了许多倍),定量免疫印迹可用于确定目标蛋白的定位或查询基因型或处理之间蛋白质分布的差异。了解突触蛋白的亚细胞定位可以解剖以前未描述的蛋白质功能。此外,该方法可以阐明疾病状态下的运输缺陷或突触功能障碍,特别是与功能测定配对时。例如,我们的团队使用这种方法鉴定了富含突触细胞质19的酶活性棕榈酰蛋白硫酯酶1。
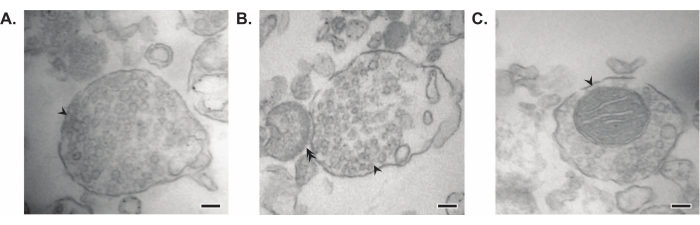
图7:突触体的电子显微镜(EM )。 (A)含有突触囊泡的突触体的代表性EM图像(箭头)。(B)具有突触前(箭头)和突触后成分(双箭头)的突触体的代表性EM图像。(C)包含突触囊泡和线粒体(箭头)(比例尺= 100nm)的突触体的代表性EM图像。 请点击此处查看此图的大图。
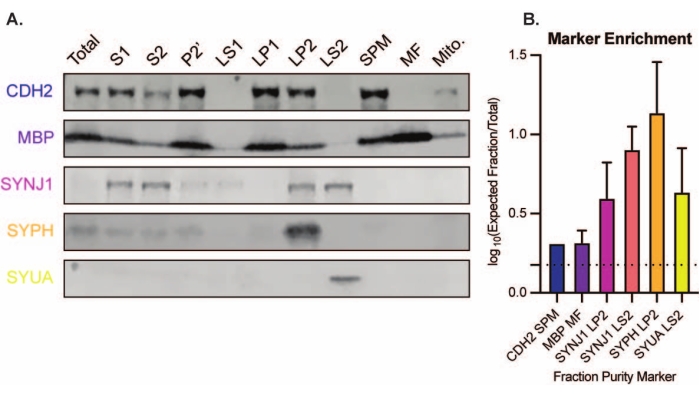
图8:亚细胞组分的免疫印迹分析。 (A)与全脑匀浆(总)相比,亚细胞级分纯度的标志物(用UniProt命名法表示)适当定位:突触质膜部分(SPM)中的N-钙粘蛋白(CDH2),突触囊泡富集部分(LP2)中的突触素1(SYPH)和突触因子1(SYNJ1),突触细胞质(LS2)中的α-突触核蛋白(SYUA), 和髓磷脂部分(MF)中的髓磷脂碱性蛋白(MBP)。(B)免疫印迹定量分析揭示了馏分纯度标记物的富集(总值的倍数变化)。数据以 log10 刻度表示为平均值±标准差。虚线表示1.5倍的变化(y = 0.176)(n = 3次重复实验,8只野生型小鼠;年龄= 2个月;SYPH,SYUA,MBP的n = 4-5个印迹,n = 3个先前由Gorenberg等人发表的绘图值19;n = 5对于SYNJ1;n = 1对于CDH2)。 请点击此处查看此图的大图。
讨论
在他们的开创性研究中,惠特克及其同事使用四个形态学标准来鉴定突触体:(1)结构具有密封的质膜;(2)结构含有类似于神经末梢的SV和原位静脉曲张的大小和数量;(3)结构具有一个或多个小线粒体;(4)突触前膜经常粘附在突触后组件11,12,13上。虽然前两个标准通常适用于每种分离方法,但在本文描述的最新方案中,并非所有产生的突触体都会有线粒体和附着的突触后末端。大约60%的突触体将具有线粒体,估计只有高达15%的突触后末端附着37。如果对突触后成分特别感兴趣,已知使用等渗克雷布斯样匀浆和压力过滤进行富集会产生具有突触后末端的高浓度突触体(也称为突触神经体)22,38。
牺牲动物的方法会影响突触体和突触亚组分的质量。使用不需要麻醉的安乐死方法处死的成年动物将获得最佳的馏分质量。此外,大脑应新鲜解剖,而不是冷冻,并使用1:10比例的匀浆缓冲液(重量/体积)进行均质化,以获得最可行的突触部分22。大脑有一个异质的突触群体,可以通过它们携带的神经递质的类型来区分。突触体的形成通常不受突触类型或神经递质含量的影响13。一个例外是小脑中的苔藓纤维,已知在最佳条件下被破坏,以便从大脑的其余部分获得突触体39,40。因此,如果排除该区域不影响实验目标,则建议在脑均质化之前切除小脑。如果有兴趣分离特定神经递质特征的突触体,则可以首先分离富含含有目标神经递质的神经元的大脑区域。然而,这种方法将对最终馏分产量施加限制,具体取决于感兴趣区域的大小(因此,动物的年龄也是一个考虑因素)。有用于分离神经递质特异性突触体的免疫化学方法,但活力和产量将受到显着损害22。如果评估突触体代谢活力很重要,则可以采用神经递质释放41,42 或某些酶测定43 的测量。
突触体制剂中的常见污染物包括微粒体、游离线粒体、SV 以及神经元和神经胶质膜。通过增加P1和P2级分22的洗涤次数并避免在后续步骤中重悬红色线粒体沉淀,可以减少污染。在代谢活力和时间至关重要的实验中,减少洗涤次数并在蔗糖梯度上使用Ficoll或Percoll梯度将有助于44,45,46。这些方法还可以显着减少污染。惠特克的原始协议产生了高质量的SV。该方法中包含的Nagy等人23的进一步优化可生产出具有显着均匀性和纯度的SV,而不会显着影响产量36。如果感兴趣的特定 SV 亚型,例如谷氨酸能(含 VGLUT-1)或 GABA能(含 VGAT-1)SV,可以使用特异性抗体进行免疫分离47,48。还有替代方法可用于从突触体中分离CCV,由于密度差异,突触体可能与使用该方法获得的SV不在同一界面上20,49,50。
总体而言,根据源脑组织的质量和数量以及实验目标,可以进一步优化分离突触组分的当前方案,以获得具有改进的均匀性和活力的组分。有关进一步的故障排除细节,请参阅Dunkley和Robinson22 以及Ganzella et al.36的书籍章节。
披露声明
作者没有什么可透露的。
致谢
我们要感谢 P. Colosi 的 EM 图像准备。这项工作得到了美国国立卫生研究院(R01 NS064963,SSC;R01 NS110354, SSC;R01 NS083846, SSC;R21 NS094971, SSC;T32 NS007224, SMT;T32 NS041228,SMT),美国国防部(W81XWH-17-1-0564,SSC;W81XWH-19-1-0264,VDJ),在帕金森氏症(ASAP)合作研究网络(SSC)和Michael J. Fox基金会目标进步计划(MJFF-020160,SSC和VDJ)中调整科学。我们使用 BioRender.com 创建了图形插图。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL TB Syringe | BD | 309649 | |
| 1.5 mL Eppendorf Tubes | USA Scientific | 1415-2500 | |
| 14 mL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter | 344060 | Compatible with SW 40 Ti |
| 23 Gauge Precision Glide Hypodermic Needle | BD | 305145 | |
| 26.3 mL, Polycarbonate Bottle with Cap Assembly | Beckman Coulter | 355618 | Compatible with Ti70 |
| 3.5 mL, Open-Top Thickwall Polypropylene Tube | Beckman Coulter | 349623 | Compatible with TLA-100.3 |
| 50 mL Falcon Tubes | Fisher Scientific | 14-432-22 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Millipore Sigma | UFC901024 | |
| Aprotinin | Sigma-Aldrich | A6279 | 1 mg/mL in diH2O |
| Avanti J-26 XP Centrifuge | Beckman Coulter | B22984 | <26,000 rpm |
| Benchtop HDPE Dewar Flask | Thermo Scientific | 5028U19 | |
| C57BL/6J Mice | The Jackson Labs | 000664 | |
| Centrifuge 5810R | Eppendorf | EP022628168 | <14,000 rpm |
| complete, Mini, EDTA-free Protease Inhibitor Cocktail Tablets | Roche | 11873580001 | Add 1 tablet per 50 mL of solution |
| Curved Forceps | Fine Science Tools | 11273-20 | |
| Fine Surgical Scissors | Fine Science Tools | 8r | |
| Glas-Col Tissue Homogenizing System | Cole-Parmer | UX-04369-15 | |
| Graefe Forceps | Fine Science Tools | 11650-10 | |
| High-Speed Polycarbonate Round Bottom Centrifuge Tubes | ThermoFisher | 3117-0500 | Compatible with JA20 |
| Isofluorane | Henry Schein Animal Health | NDC 11695-6776-2 | |
| JA-20 Rotor | Beckman Coulter | 334831 | |
| Leupeptin | American Bio | AB01108 | 1 mg/mL in diH2O |
| N-[2-Hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid] (HEPES) | American Bio | AB00892 | |
| Optima L-80 XP Ultracentrifuge | Beckman Coulter | <100,000 rpm | |
| Optima TLX Ultracentrifuge | Beckman Coulter | <120,000 rpm | |
| Pepstatin A | Thermo Scientific | 78436 | 1 mg/mL in DMSO |
| Phenylmethylsulfonyl fluoride (PMSF) | American Bio | AB01620 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23335 | For determination of protein concentration |
| Pipette Tips | |||
| Serological Pipettes | |||
| Sucrose | Sigma-Aldrich | S0389 | |
| Surgical Scissors | Fine Science Tools | 14002-12 | |
| SW 40 Ti Swinging-Bucket Rotor | Beckman Coulter | 331301 | |
| Teflon-Coated Pestle and Mortar Tissue Grinder | Thomas Scientific | 3431D94 | |
| Ti70 Rotor | Beckman Coulter | 337922 | |
| TLA-100.3 Rotor | Beckman Coulter | 349490 | |
| Tube Revolver | Dot Scientific | DTR-02VS |
参考文献
- Synaptic Transmission. Principles of Neural Science, Fifth Edition. Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J., Education, A. J. , McGraw-Hill Education. New York, NY. (2014).
- Lepeta, K., et al. Synaptopathies: synaptic dysfunction in neurological disorders - A review from students to students. Journal of Neurochemistry. 138 (6), 785-805 (2016).
- Südhof, T. C., Malenka, R. C. Understanding synapses: Past, present, and future. Neuron. 60 (3), 469-476 (2008).
- Südhof, T. C. The molecular machinery of neurotransmitter release (Nobel lecture). Angewandte Chemie International Edition. 53 (47), 12696-12717 (2014).
- Jahn, R., Boyken, J. Molecular Regulation of Synaptic Release. Neuroscience in the 21st Century: From Basic to Clinical. Pfaff, D. W. , Springer. New York. New York, NY. 351-401 (2013).
- Xiong, H., Gendelman, H. E. Current Laboratory Methods in Neuroscience Research. , Springer. New York. New York, NY. (2014).
- Azevedo, F. A., et al. Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology. 513 (5), 532-541 (2009).
- Herculano-Houzel, S. The remarkable, yet not extraordinary, human brain as a scaled-up primate brain and its associated cost. Proceedings of the National Academy of Sciences of the United States of America. 109, 10661-10668 (2012).
- Herculano-Houzel, S., Lent, R. Isotropic fractionator: A simple, rapid method for the quantification of total cell and neuron numbers in the brain. Journal of Neuroscience. 25 (10), 2518-2521 (2005).
- Herculano-Houzel, S., Mota, B., Lent, R. Cellular scaling rules for rodent brains. Proceedings of the National Academy of Sciences of the United States of America. 103 (32), 12138-12143 (2006).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron-microscopic study of cell fragments derived by homogenization and centrifugation. Journal of Anatomy. 96, 79-88 (1962).
- Gray, E. G., Whittaker, V. P. The isolation of synaptic vesicles from the central nervous system. Journal of Physiology. 153, 35-37 (1960).
- Whittaker, V. P. Thirty years of synaptosome research. Journal of Neurocytology. 22 (9), 735-742 (1993).
- Jahn, R., Fasshauer, D. Molecular machines governing exocytosis of synaptic vesicles. Nature. 490, 201-207 (2012).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from nerve-ending particles ('synaptosomes). Biochemical Journal. 90 (2), 293-303 (1964).
- De Robertis, E., Rodriguez De Lores Arnaiz, G., Pellegrino De Iraldi, A. Isolation of synaptic vesicles from nerve endings of the rat brain. Nature. 194, 794-795 (1962).
- De Robertis, E., Pellegrino De Iraldi, A., Rodriguez, G., Gomez, C. J. On the isolation of nerve endings and synaptic vesicles. The Journal of Biophysical and Biochemical Cytology. 9 (1), 229-235 (1961).
- Zimmermann, H., Whittaker, V. P. The Discovery of the Synaptosome and Its Implications. Synaptosomes. Murphy, K. M. , Springer. New York. New York, NY. 9-26 (2018).
- Gorenberg, E. L., et al. Identification of substrates of palmitoyl protein thioesterase 1 highlights roles of depalmitoylation in disulfide bond formation and synaptic function. PLoS Biology. 20 (3), 3001590(2022).
- Vidyadhara, D. J., et al. Dopamine transporter and synaptic vesicle sorting defects initiate auxilin-linked Parkinson's disease. bioRxiv. , (2022).
- Schrimpf, S. P., et al. Proteomic analysis of synaptosomes using isotope-coded affinity tags and mass spectrometry. Proteomics. 5 (10), 2531-2541 (2005).
- Dunkley, P. R., Robinson, P. J. Synaptosome Preparations: Which Procedure Should I Use. Synaptosomes. Murphy, K. M. , Springer. New York. New York, NY. 27-53 (2018).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Research. 109 (2), 285-309 (1976).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127 (4), 831-846 (2006).
- Wagner, J. A., Kelly, R. B. Topological organization of proteins in an intracellular secretory organelle: the synaptic vesicle. Proceedings of the National Academy of Sciences of the United States of America. 76 (8), 4126-4130 (1979).
- Jahn, R., Schiebler, W., Ouimet, C., Greengard, P. A 38,000-dalton membrane protein (p38) present in synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 82 (12), 4137-4141 (1985).
- Binotti, B., Jahn, R., Pérez-Lara, Á An overview of the synaptic vesicle lipid composition. Archives of Biochemistry and Biophysics. 709, 108966(2021).
- Siegel, D. P., Ware, B. R. Electrokinetic properties of synaptic vesicles and synaptosomal membranes. Biophysical Journal. 30 (1), 159-172 (1980).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from disrupted nervending particles. Biochemical Pharmacology. 12 (3), 300-302 (1963).
- Clementi, F., Whittaker, V. P., Sheridan, M. N. The yield of synaptosomes from the cerebral cortex of guinea pigs estimated by a polystyrene bead "tagging" procedure. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 72, 126-138 (1966).
- Carlson, S. S., Wagner, J. A., Kelly, R. B. Purification of synaptic vesicles from elasmobranch electric organ and the use of biophysical criteria to demonstrate purity. Biochemistry. 17 (7), 1188-1199 (1978).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. Journal of Cell Biology. 96 (5), 1374-1388 (1983).
- Hawkins, P., et al. A guide to defining and implementing protocols for the welfare assessment of laboratory animals: eleventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Laboratory Animals. 45 (1), 1-13 (2011).
- Risling, T. E., Caulkett, N. A., Florence, D. Open-drop anesthesia for small laboratory animals. Canadian Veterinary Journal. 53 (3), 299-302 (2012).
- Deutsch, C., Drown, C., Rafalowska, U., Silver, I. A. Synaptosomes from rat brain: Morphology, compartmentation, and transmembrane pH and electrical gradients. Journal of Neurochemistry. 36 (6), 2063-2072 (1981).
- Ganzella, M., Ninov, M., Riedel, D., Jahn, R. Isolation of synaptic vesicles from mammalian brain. Methods in Molecular Biology. 2417, 131-145 (2022).
- Dunkley, P. R., et al. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: homogeneity and morphology of subcellular fractions. Brain Research. 441 (1-2), 59-71 (1988).
- Schwartz, R. D., Skolnick, P., Hollingsworth, E. B., Paul, S. M. Barbiturate and picrotoxin-sensitive chloride efflux in rat cerebral cortical synaptoneurosomes. FEBS Letters. 175 (1), 193-196 (1984).
- Pittaluga, A., Thellung, S., Maura, G., Raiteri, M. Characterization of two central AMPA-preferring receptors having distinct location, function and pharmacology. Naunyn-Schmiedeberg's Archives of Pharmacology. 349 (6), 555-558 (1994).
- Israël, M., Whittaker, V. P. The isolation of mossy fibre endings from the granular layer of the cerebellar cortex. Experientia. 21 (6), 325-326 (1965).
- Khvotchev, M., Lonart, G., Südhof, T. C. Role of calcium in neurotransmitter release evoked by alpha-latrotoxin or hypertonic sucrose. Neuroscience. 101 (3), 793-802 (2000).
- Lonart, G., Janz, R., Johnson, K. M., Südhof, T. C. Mechanism of action of rab3A in mossy fiber LTP. Neuron. 21 (5), 1141-1150 (1998).
- Nicholls, D. G., Sihra, T. S. Synaptosomes possess an exocytotic pool of glutamate. Nature. 321 (6072), 772-773 (1986).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nature Protocols. 3 (11), 1718-1728 (2008).
- Cotman, C. W., Matthews, D. A. Synaptic plasma membranes from rat brain synaptosomes: Isolation and partial characterization. Biochimica et Biophysica Acta. 249 (2), 380-394 (1971).
- Booth, R. F., Clark, J. B. A rapid method for the preparation of relatively pure metabolically competent synaptosomes from rat brain. Biochemical Journal. 176 (2), 365-370 (1978).
- Takamori, S., Riedel, D., Jahn, R. Immunoisolation of GABA-specific synaptic vesicles defines a functionally distinct subset of synaptic vesicles. Journal of Neuroscience. 20 (3), 4904-4911 (2000).
- Burger, P. M., et al. Synaptic vesicles immunoisolated from rat cerebral cortex contain high levels of glutamate. Neuron. 3 (6), 715-720 (1989).
- Blondeau, F., et al. Tandem MS analysis of brain clathrin-coated vesicles reveals their critical involvement in synaptic vesicle recycling. Proceedings of the National Academy of Sciences of the United States of America. 101 (11), 3833-3838 (2004).
- Maycox, P. R., Link, E., Reetz, A., Morris, S. A., Jahn, R. Clathrin-coated vesicles in nervous tissue are involved primarily in synaptic vesicle recycling. Journal of Cell Biology. 118 (6), 1379-1388 (1992).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。