Method Article
Fractionnement subcellulaire pour l’isolement des composants synaptiques du cerveau murin
Dans cet article
Résumé
Ce protocole présente une méthode robuste et détaillée pour obtenir des synaptosomes très purs, des vésicules synaptiques et d’autres fractions synaptiques du cerveau de la souris. Cette méthode permet l’évaluation des processus synaptiques, y compris l’analyse biochimique de la localisation et de la fonction des protéines avec une résolution compartimentale.
Résumé
Les terminaux synaptiques sont les principaux sites de communication neuronale. Le dysfonctionnement synaptique est une caractéristique de nombreux troubles neuropsychiatriques et neurologiques. La caractérisation des sous-compartiments synaptiques par isolement biochimique est donc une méthode puissante pour élucider les bases moléculaires des processus synaptiques, tant dans la santé que dans la maladie. Ce protocole décrit l’isolement des terminaux synaptiques et des sous-compartiments synaptiques du cerveau des souris par fractionnement subcellulaire. Tout d’abord, les structures terminales synaptiques scellées, connues sous le nom de synaptosomes, sont isolées après homogénéisation des tissus cérébraux. Les synaptosomes sont des compartiments neuronaux pré- et post-synaptiques avec des membranes pincées et scellées. Ces structures conservent un état métaboliquement actif et sont précieuses pour étudier la structure et la fonction synaptiques. Les synaptosomes sont ensuite soumis à une lyse hypotonique et à une ultracentrifugation pour obtenir des sous-compartiments synaptiques enrichis en vésicules synaptiques, cytosol synaptique et membrane plasmique synaptique. La pureté de la fraction est confirmée par microscopie électronique et analyse d’enrichissement biochimique pour les protéines spécifiques des compartiments sous-synaptiques. La méthode présentée est un outil simple et précieux pour étudier les caractéristiques structurelles et fonctionnelles de la synapse et l’étiologie moléculaire de divers troubles cérébraux.
Introduction
Les synapses sont les unités de calcul de base du cerveau à travers lesquelles les neurones communiquent et exercent des fonctions diverses et extrêmement complexes. Les synapses sont donc fondamentales pour la santé du cerveau1; Le dysfonctionnement synaptique est impliqué comme source ou résultat de nombreux troubles2. Les synapses sont constituées de terminaisons pré- et post-synaptiques, extensions de deux neurones différents qui sont étroitement apposés et séparés par une fente synaptique traversée par des molécules d’adhésion synaptique. L’information circule du compartiment pré- et post-synaptique sous la forme de messagers chimiques appelés neurotransmetteurs1. Les processus moléculaires impliqués dans la neurotransmission sont des domaines actifs de recherche 3,4,5. Comprendre les processus pathogènes dans les terminaisons synaptiques et la réponse des synapses à la pathologie dans d’autres sous-compartiments neuronaux sont des étapes cruciales pour traiter les troubles du cerveau 1,2. Plusieurs avancées méthodologiques, principalement appliquées aux modèles murins, ont fait progresser cette poursuite6. L’isolement des fractions synaptiques par centrifugation différentielle est l’une de ces méthodes de changement de paradigme qui a permis l’évaluation détaillée des processus synaptiques dans la santé et la maladie.
Le cerveau humain adulte est constitué de 80 à 90 milliards de neurones 7,8. Parmi les espèces murines, le cerveau du rat contient environ ~200 millions de neurones, tandis que les souris en ont ~70 millions 9,10. Chaque neurone forme des milliers de connexions synaptiques spécifiques avec un réseau de neurones hautement polarisés entremêlés de cellules gliales et de système vasculaire dense. Dans des tissus aussi complexes et hétérogènes, il était autrefois impensable d’isoler et d’étudier les synapses en tant que système indépendant. Dans les années 1960, Victor Whittaker, Catherine Hebb et d’autres ont rendu cela possible en isolant des terminaux synaptiques intacts en utilisant le fractionnement subcellulaire11,12,13,14. Dans une tentative d’isoler les vésicules synaptiques (SV), ils ont homogénéisé les cerveaux par la force de cisaillement liquide dans du saccharose iso-osmotique (0,32 M) suivi d’une ultracentrifugation. Ils ont obtenu des terminaisons nerveuses ou varicosités intactes pincées, enfermées par une membrane plasmique, qu’ils ont appelées particules de terminaison nerveuse (NEP)11,13. Comme les caractéristiques structurelles et fonctionnelles de la synapse ont été préservées dans ces structures, les NEP ont ensuite été appelés « synaptosomes » pour la congruence avec d’autres organites subcellulaires13,15. Il convient de noter que les travaux d’Eduardo de Robertis et de ses collègues, qui ont inventé le terme « vésicule synaptique », ont chevauché ceux de Whittaker et de ses collègues et ont contribué à la validation de l’isolement et de la caractérisation des « synaptosomes»16,17,18.
Les synaptosomes sont des structures physiologiquement actives qui contiennent toutes les propriétés cellulaires et moléculaires nécessaires au stockage, à la libération et à la recapture des neurotransmetteurs13,18. La préservation des principales caractéristiques synaptiques in vitro et l’absence de composants non synaptiques contribuent également à l’utilité de cette méthode d’isolement. Les synaptosomes ont énormément contribué à la compréhension des propriétés chimiques et physiologiques de la neurotransmission et sont maintenant utilisés pour étudier les processus moléculaires synaptiques et leurs altérations dans la maladie 19,20,21,22,23. Les synaptosomes sont également le matériau source initial pour isoler les composants synaptiques tels que les SV, les vésicules recouvertes de clathrines (CCV), le cytosol synaptique, la membrane plasmique synaptique, les mitochondries synaptiques, les molécules d’adhésion synaptique et d’autres composants d’intérêt, ce qui peut faciliter la compréhension des mécanismes moléculaires de la fonction synaptique 18,19,20,24,25,26, 27,28. Ces composants sous-synaptiques peuvent être obtenus par la lyse osmotique des synaptosomes et gradient de densité du saccharosepar ultracentrifugation 15,29. Bien que la méthode originale de fractionnement subcellulaire du groupe de recherche de Whittaker soit connue pour être efficace pour isoler les synaptosomes et les SVde qualité 13,30, les optimisations récentes améliorent la pureté des fractions subcellulaires 22,23,31,32. Cet article fournit une version très détaillée et accessible d’un protocole classique pour le fractionnement subcellulaire du tissu cérébral murin afin d’isoler les synaptosomes, les SV et d’autres composants sous-synaptiques.
Protocole
Toutes les expériences sur des souris ont été approuvées par l’Institutional Animal Care and Use Committee (IACUC) de l’Université de Yale (protocole 2021-11117) et réalisées dans un établissement accrédité par l’Association for the Assessment and Accreditation of Laboratory Animal Care International (AAALAC). Les soins et l’hébergement des animaux étaient conformes au Guide pour le soin et l’utilisation des animaux de laboratoire33 et étaient fournis par le Yale Animal Resource Center (YARC). Les animaux ont été maintenus dans un cycle lumière/obscurité de 12 heures avec un accès ad libitum à la nourriture et à l’eau. Cinq à huit souris ou deux à quatre rats par génotype ou condition sont nécessaires pour le protocole suivant. Moins de rats sont nécessaires en raison de leurs plus grands volumes de cerveau. De même, l’âge des animaux de laboratoire peut affecter le rendement fractionné; Des souris supplémentaires peuvent être nécessaires pour les âges de moins de 2 mois. Sinon, les procédures décrites s’appliquent à la fois aux espèces murines et aux animaux adultes en bonne santé de tout âge. Les données représentatives présentées dans cette étude ont utilisé des souris de type sauvage (C57BL/6J) (âge = 2 mois; quatre mâles et quatre femelles par répétition) obtenues d’une source commerciale (voir le tableau des matériaux).
1. Préparation expérimentale
REMARQUE : Ce protocole nécessite ~11 heures pour qu’un seul chercheur puisse le compléter. Il est fortement recommandé de terminer l’installation de la paillasse (Figure 1), la préparation de la mémoire tampon (Tableau 1), le prérefroidissement des centrifugeuses et des rotors à 4 °C, ainsi que la collecte et l’étiquetage des matériaux et de l’équipement nécessaires (voir le tableau des matériaux) la veille de l’exécution du protocole, le cas échéant.
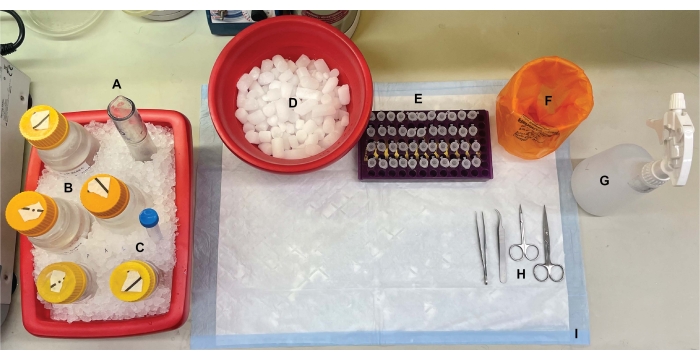
Figure 1 : Configuration de la paillasse. Avant les dissections cérébrales, (A) les homogénéisateurs de verre à rebondes et (B) tous les tampons étaient refroidis sur de la glace. (C) Les solutions mères d’inhibiteurs de protéase ont été décongelées sur de la glace. Un deuxième contenant de glace humide pour tubes à centrifuger, un Dewar d’azote liquide (non illustré) et (D) un récipient de glace sèche pour l’entreposage à court terme des échantillons surgelés dans de l’azote liquide ont été obtenus. (E) Les tubes à microcentrifugeuses ont été pré-étiquetés pour tous les échantillons, car quatre aliquotes de chaque échantillon de fraction subcellulaire par génotype ou condition ont été prélevées au cours de cette procédure (conseil pour gagner du temps: étiquetez soigneusement tous les tubes la veille de l’expérience). (F) Un conteneur approprié pour les déchets présentant un risque biologique, (G) de l’éthanol à 70 %, (H) des outils chirurgicaux et (I) un tampon de surface absorbant. Les tubes centrifugeuses et les produits jetables requis ont été mis de côté pour un accès efficace pendant la mise en œuvre du protocole (non illustré). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Préparez la paillasse pour la chirurgie et récupérez les ciseaux et les forceps nécessaires à l’excision cérébrale (voir le tableau des matériaux). Pré-étiqueter des tubes microcentrifugeuses de 1,5 mL pour les biopsies de la queue de souris et quatre tubes par fraction recueillie, comme l’indique la figure 2.
- Procurez-vous deux contenants de glace humide, un contenant de glace sèche et un flacon Dewar à l’azote liquide de paillasse.
- Décongeler les solutions mères de fluorure de phénylméthylsulfonyle (PMSF), de pepstatine A, d’aprotinine et de leupeptine sur glace (voir le tableau des matières). Préparez les tampons nécessaires (tableau 1).
NOTE: Les solutions de saccharose peuvent être préparées à l’avance et conservées à 4 ° C. Cependant, des inhibiteurs de protéase (bouillons et comprimés décongelés) doivent être ajoutés frais à tous les tampons au début de l’expérience en raison de l’instabilité de ces réactifs dans les solutions aqueuses. De plus, tous les tampons doivent être préparés avec de la verrerie sans détergent et de l’eau sans détergent pour permettre la collecte des synaptosomes intacts. - Refroidir tous les tampons et les homogénéisateurs de verre Dounce (voir le tableau des matériaux) sur la glace. Réglez les centrifugeuses à 4 °C et refroidissez les rotors à 4 °C.
- Ajouter 14 mL de tampon A (tableau 1) à un homogénéisateur Dounce sur de la glace.
Tableau 1 : Composition des tampons de fractionnement subcellulaire. Veuillez cliquer ici pour télécharger ce tableau.
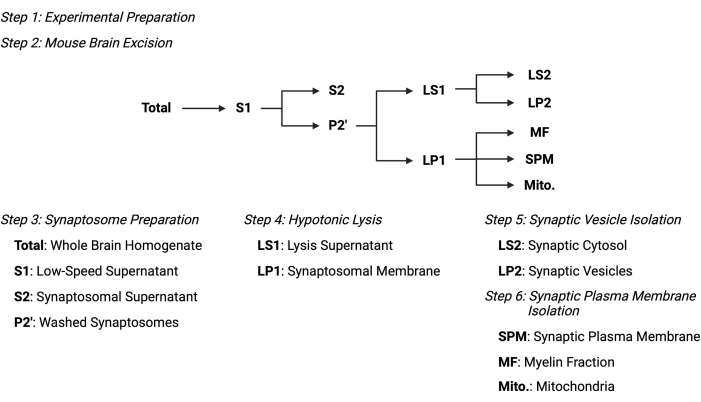
Figure 2 : Vue d’ensemble du protocole de fractionnement subcellulaire. Schéma sommaire des étapes de fractionnement subcellulaire et des échantillons recueillis. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Excision cérébrale de souris
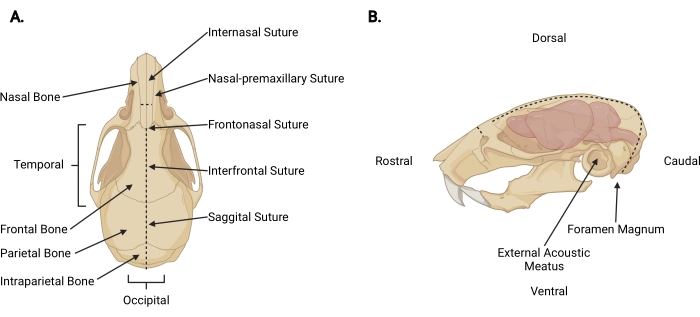
Figure 3 : Anatomie craniofaciale. (A) Vue dorsale d’un crâne de souris avec les structures crâniennes pertinentes indiquées. (B) Vue latérale gauche d’un crâne et d’un cerveau de souris avec les structures crâniennes pertinentes et les directions anatomiques indiquées. Les lignes pointillées représentent les endroits où les incisions doivent être faites. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Anesthésier profondément chaque souris avec 100% d’isofluorane dans une chambre d’anesthésie située dans une hotte ou une enceinte de biosécurité en utilisant une méthode de goutte ouverte34. Sacrifiez chaque souris par une luxation de la colonne cervicale suivie rapidement d’une décapitation. Alterner entre les génotypes ou les groupes expérimentaux pour chaque sacrifice et dissection12. Obtenir des biopsies de la queue après euthanasie en excisant 2 mm de l’extrémité distale de la queue avec des ciseaux fins. Conservez le tissu pour le génotypage.
- Vaporisez la tête décapitée avec de l’éthanol à 70% pour empêcher les cheveux d’adhérer aux tissus et aux instruments chirurgicaux pendant la dissection.
- Insérez de fins ciseaux sous la peau à l’incision de décapitation jusqu’à une profondeur péricrânienne et faites une incision médio-sagittale jusqu’à la suture internasale (Figure 3A) pour rétracter le cuir chevelu du crâne.
- En travaillant de la zone occipitale vers chaque aspect temporal, coupez le fascia et le muscle pour exposer la surface externe du crâne au-delà de chaque méat acoustique externe (Figure 3B).
- Fixez le cuir chevelu et l’aspect rostral du crâne avec la main non dominante. Avec l’autre, insérez de fins ciseaux de 2 mm dans la face caudale du foramen magnum, où la moelle épinière est visible en sortant. Faites une incision médiane jusqu’à ce que les ciseaux atteignent la surface interne de l’os intrapariétal (Figure 3; lignes pointillées).
REMARQUE: Lors de l’incision initiale, les ciseaux doivent être parallèles à la moelle épinière avec une pression appliquée vers la surface interne du crâne pour éviter d’endommager le tronc cérébral et le cervelet. - Changez l’angle des ciseaux pour que les lames soient parallèles à la surface dorsale du crâne. Continuez à faire avancer l’incision médio-sagittale rostralement à travers les os pariétaux et frontaux, en utilisant les sutures sagittales et interfrontales comme guide. Utilisez une pression ascendante constante pour éviter d’endommager le cortex. Terminez l’incision juste au-delà de la suture internasale (Figure 3A).
- Faire une petite incision perpendiculaire (~3 mm) à l’os nasal, rostrale à la suture internasale, en plaçant les ciseaux perpendiculaires au crâne avec chaque lame positionnée à une suture nasale-prémaxillaire et en faisant une coupe uniforme (Figure 3; lignes pointillées).
NOTE: Cette étape augmentera la facilité de rétraction du crâne et sera critique pour la collecte du bulbe olfactif si cette zone est d’intérêt. - Tout en fixant l’aspect rostral, utilisez un côté d’une paire de pinces texturées pour soulever doucement le crâne du cerveau, puis latéralement et ventralement. Répétez l’opération le long de la ligne médiane au besoin, puis pour l’autre hémisphère jusqu’à ce que toute la surface du cerveau soit exposée.
- À l’aide d’une pince incurvée ou d’une fine spatule, soulevez doucement le côté rostral du cerveau. Coupez les nerfs optique et crânien pour compléter l’excision du crâne.
- Pour chaque condition, recueillir cinq à huit cerveaux de souris ensemble dans l’homogénéisateur Dounce en verre réfrigéré contenant 14 ml de tampon A (tableau 1).
3. Préparation des synaptosomes
Remarque : Les schémas de cette procédure sont illustrés à la figure 4.
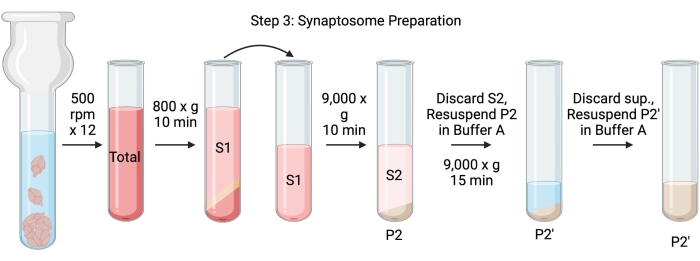
Figure 4 : Préparation des synaptosomes. Schéma de l’étape 3, la génération des synaptosomes (P2'). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Homogénéiser les cerveaux à l’aide d’un homogénéisateur Dounce en verre en 12 passes haut-bas à 500 tr / min (total). Faites une brève pause à chaque descente pour assurer une homogénéisation complète du tissu. Homogénéiser préférentiellement dans un bain de glace pour éviter le réchauffement et la dénaturation des protéines. Prélever des aliquotes de 5 μL pour déterminer la concentration en protéines par le dosage de l’acide bicinchoninique (ACB, voir le tableau des matières). Prendre 100 μL d’aliquotes de lysat de cerveau entier pour le transfert Western (WB). Pour cet échantillon et tous les suivants (figure 2), prélever deux aliquotes pour l’ACB et deux aliquotes pour la Banque mondiale. Congeler rapidement toutes les aliquotes collectées dans de l’azote liquide et les conserver à −80 °C.
- Faire tourner l’homogénat cérébral total dans un tube à centrifuger à fond rond à grande vitesse (14 mL) (voir le tableau des matériaux) à 800 x g pendant 10 minutes à 4 °C pour obtenir le surnageant (S1). Transférer S1 dans un nouveau tube à centrifuger, en laissant la pastille derrière (P1), qui contient des cellules et des noyaux intacts. Évitez de pipeter le granulé moelleux, blanc, lâche et superficiel. Prendre 2 x 5 μL de S1 pour BCA et 2 x 100 μL de S1 pour WB.
- Faire tourner S1 à 9 000 x g pendant 15 min à 4 °C pour obtenir le surnageant synaptosomal (S2) et la pastille brute de synaptosome (P2). Prendre 2 x 10 μL de S2 pour BCA et 2 x 500 μL de S2 pour WB. Jeter le surnageant après avoir obtenu des aliquotes et passer à l’étape suivante avec la pastille.
- Resuspendre P2 dans 3 mL de tampon A glacé avec inhibiteurs de protéase et centrifuger à 9 000 x g pendant 15 min à 4 °C pour obtenir le surnageant (S2') et les synaptosomes lavés (P2'). Jetez le surnageant et conservez la pastille.
- Resuspendre P2' dans 3 mL de tampon A. Éviter de remettre en suspension la partie rouge foncé au fond de la pastille, qui contient principalement des mitochondries. Prendre 2 x 20 μL de P2' pour le BCA et 2 x 100 μL de P2' pour WB.
REMARQUE: Ceci peut être réalisé en mélangeant doucement les bords et la surface de la pastille à la pipette pour remettre en suspension les synaptosomes blanchis à la chaux tout en dirigeant l’extrémité de la pipette loin du centre rouge de la pastille.
4. Lyse hypotonique
Remarque : Les schémas de cette procédure sont illustrés à la figure 5.
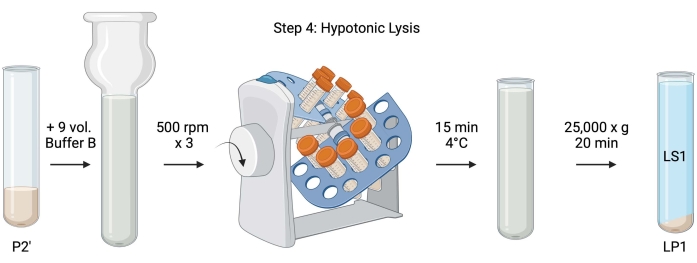
Figure 5 : Lyse hypotonique. Schéma de l’étape 4, la lyse hypotonique des synaptosomes pour générer la lyse surnageante (LS1) et les fractions membranaires synaptosomiques (LP1). Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Pour la lyse hypotonique des synaptosomes lavés, ajouter 9 volumes de tampon B réfrigéré (tableau 1) à P2' remis en suspension (~27 mL). Homogénéiser les synaptosomes dans un homogénéisateur Dounce en verre (trois passes haut-bas à 500 tr/min).
- Transférer les échantillons dans des tubes à centrifuger coniques coiffés de 50 mL. Faites-les tourner sur un revolver à tube dans une chambre froide à 4 °C pendant 15 min.
- Centrifuger lysé P2' à 25 000 x g pendant 20 min à 4 °C pour obtenir le surnageant de lyse (LS1) et la pastille de lyse contenant des membranes synaptosomiques (LP1). Prendre 2 x 50 μL de LS1 pour BCA et 2 x 400 μL de LS1 pour WB. Transférer le LS1 dans un tube centrifuge recouvert pour l’ultracentrifugation (voir le tableau des matériaux).
5. Isolement des vésicules synaptiques
Remarque : Les schémas de cette procédure sont présentés à la figure 6.
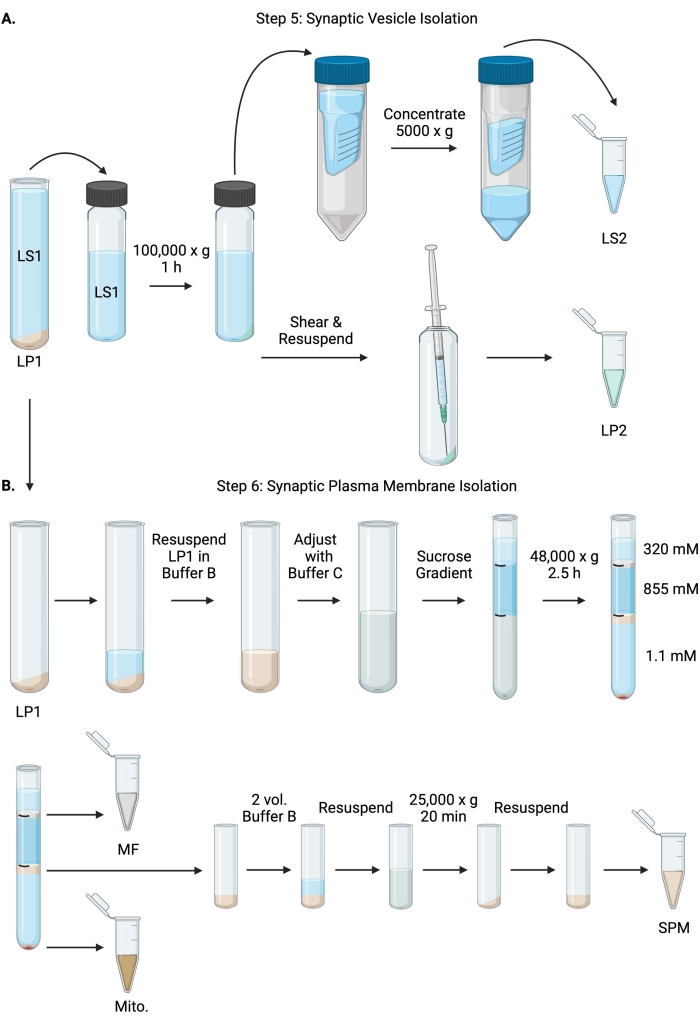
Figure 6 : Isolement des vésicules synaptiques et isolement de la membrane plasmique synaptique. (A) Schéma de l’étape 5, l’isolement des fractions du cytosol synaptique (LS2) et de la vésicule synaptique (LP2), et (B) étape 6, la génération de myéline (MF), de membrane plasmique synaptique (SPM) et mitochondriale (Mito.) après l’ultracentrifugation des gradients de saccharose. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Centrifuger LS1 dans un rotor à ultracentrifugeuses à angle fixe (voir tableau des matériaux) à 100 000 x g pendant 60 min à 4 °C pour obtenir un surnageant synaptique du cytosol (LS2) et une pastille de vésicule synaptique (LP2). LP2 sera petit, translucide et fortement collé au côté du tube de centrifugation.
- Resuspendre le LP2 dans 500 μL de tampon A. À l’aide d’une aiguille de 23 G et d’une seringue de 1 mL, cisailler le LP2 par trituration douce. Prendre 2 x 10 μL de LP2 pour BCA et 2 x 250 μL de LP2 pour WB.
- Transférer le LS2 (~30 mL) dans des unités de filtration centrifuges avec une coupure de 10 kDa (voir le tableau des matériaux).
REMARQUE: Si des protéines inférieures à 10 kDa sont intéressantes, des unités de filtration centrifuge de coupure de 4 kDa sont disponibles, mais entraîneront des temps d’essorage plus longs. - Concentrer le LS2 à environ 0,5 mL en le faisant tourner à 5000 x g pendant 1 h à 4 °C. Prendre 2 x 10 μL de LS2 concentré pour le BCA et 2 x 250 μL de LS2 concentré pour la BM. Après avoir commencé le spin, passez directement à l’étape 6.1.
6. Isolement de la membrane plasmique synaptique
- Resuspendre LP1 (étape 4.3) dans 1 mL de tampon B (tableau 1). Prendre 2 x 10 μL de LP1 pour BCA et 2 x 50 μL de LP1 pour WB. Ajuster la LP1 restante à un volume final de 7,5 mL et à une concentration finale de saccharose de 1,1 M avec le tampon B et le tampon C (tableau 1).
- Transférer 7,5 mL de LP1 en suspension dans un tube à ultracentrifugeuses de 14 mL (voir le tableau des matières). Superposez soigneusement LP1 avec 3,75 mL de tampon D (tableau 1), puis superposez avec 1,25 mL de tampon A (ou un volume plus important à remplir juste en dessous du haut du tube à centrifuger). Évitez de pipeter sur le côté du tube, ce qui perturberait les interfaces de gradient de saccharose. Après avoir superposé chaque fraction de saccharose, marquez le dessus de la solution avec un stylo. Équilibrer les tubes pour l’ultracentrifugation en poids, et non en volume, en ajoutant goutte à goutte le tampon A à 10 mg près. Centrifuger à 48 000 x g pendant 2,5 h à 4 °C dans un rotor à ultracentrifugeuses à godet oscillant (voir le tableau des matériaux).
- Acquérir des images des gradients intacts après l’ultracentrifugation pour documenter la distinction de chaque interface de saccharose et le succès du fractionnement.
- Retirez délicatement la couche superficielle de saccharose de 320 mM (tampon A). Récupérer la fraction de myéline (MF) à l’interface saccharose 320 mM/855 mM dans un volume de 800 μL. Récupérer la fraction de membrane plasmique synaptique (SPM) à l’interface de saccharose 855 mM/1,1 M dans un volume de 1 000 μL. Pipeter chaque fraction à partir de la paroi du tube de manière circulaire pour s’assurer que la fraction complète est recueillie. Aspirer soigneusement le saccharose restant et récupérer la pastille mitochondriale (Mito.) en remettant en suspension dans 200 μL de tampon B. Prendre 2 x 100 μL de MF pour BCA et 2 x 10 μL de Mito. pour l’ACB; diviser le reste de MF et Mito. échantillons en deux pour WB.
- Diluer la fraction SPM avec 2 volumes de tampon B (~2 mL), puis centrifuger dans un rotor à angle fixe dans un tube centrifuge de 3,5 mL (voir le tableau des matériaux) à 25 000 x g pendant 20 min à 4 °C. Jeter le surnageant et remettre en suspension la pastille SPM dans le tampon A pour un volume final de 250 μL. Prendre 2 x 5 μL de SPM pour le BCA et diviser le SPM restant en deux pour WB.
- Effectuer un BCA pour déterminer la concentration en protéines de chaque échantillon, en tenant compte du volume aliquote variable.
REMARQUE : Pour l’analyse WB, la concentration suggérée de protéines de travail pour toutes les fractions subcellulaires est de 2 μg/μL (ou aussi élevée que possible pour LS1 et MF).
Résultats
La méthode présentée aboutit à 11 fractions subcellulaires cérébrales qui peuvent être soumises à une purification supplémentaire et à diverses formes d’analyse en aval35,36. La méthode de référence pour évaluer la qualité des synaptosomes, des SV23 et d’autres composants est la microscopie électronique (EM) (Figure 7). L’immunoblotting quantitatif pour les protéines présentes dans des fractions subcellulaires spécifiques peut également être effectué pour évaluer les marqueurs de pureté des fractions (Figure 8). Par exemple, l’analyse immunoblot des fractions révèle l’enrichissement de la N-cadhérine (CDH2, nom UniProt) dans la fraction de membrane plasmique synaptique (SPM), de la α-synucléine (SYUA) dans le cytosol synaptique (LS2), de la synaptophysine (SYPH) dans la fraction des vésicules synaptiques (LP2) et de la protéine basique de la myéline (MBP) dans la fraction myéline (MF) par rapport aux niveaux de protéines dans l’homogénat initial du cerveau entier (total) (Figure 8 ). Une fois que la pureté de la fraction a été établie (par exemple, notez l’absence de CDH2 dans la fraction LS2 ou l’augmentation de plusieurs fois de SYPH dans la fraction LP2), l’immunoblot quantitatif peut être utilisé pour déterminer la localisation des protéines d’intérêt ou interroger les différences dans la distribution des protéines entre les génotypes ou les traitements. Comprendre la localisation subcellulaire des protéines synaptiques peut permettre la dissection de fonctions protéiques non décrites auparavant. En outre, cette méthode peut élucider les défauts de trafic ou le dysfonctionnement synaptique dans les états pathologiques, en particulier lorsqu’elle est associée à des tests fonctionnels. Par exemple, notre équipe a utilisé cette méthode pour identifier un pool de protéine palmitoyl thioestérase 1 enzymatiquement active qui est enrichi dans le cytosolsynaptique 19.
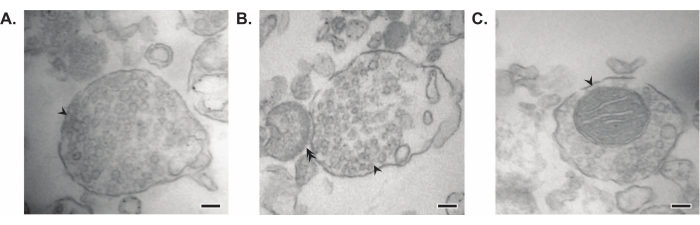
Figure 7 : Microscopie électronique (EM) des synaptosomes. (A) Image EM représentative d’un synaptosome contenant des vésicules synaptiques (flèche). (B) Image EM représentative d’un synaptosome avec des composantes pré- (flèche) et post-synaptiques (double flèche). (C) Image EM représentative d’un synaptosome contenant des vésicules synaptiques et une mitochondrie (flèche) (barres d’échelle = 100 nm). Veuillez cliquer ici pour voir une version agrandie de cette figure.
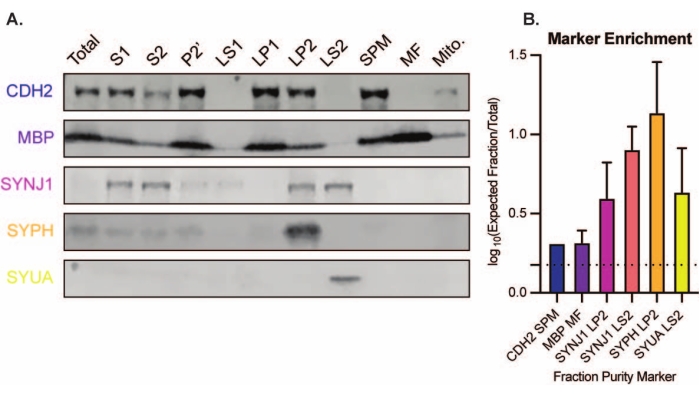
Figure 8 : Analyse immunoblot des fractions subcellulaires. (A) Les marqueurs de pureté de la fraction subcellulaire (indiqués avec la nomenclature UniProt) sont correctement localisés par rapport à l’homogénat du cerveau entier (total): N-cadhérine (CDH2) dans la fraction membranaire plasmique synaptique (SPM), synaptophysine 1 (SYPH) et synaptojanin 1 (SYNJ1) dans la fraction enrichie en vésicule synaptique (LP2), α-synucléine (SYUA) dans le cytosol synaptique (LS2), et la protéine basique de myéline (MBP) dans la fraction de myéline (MF). (B) L’analyse de quantification par immunotransfert révèle l’enrichissement (variation de pli par rapport au total) des marqueurs de pureté des fractions. Les données sont représentées sous forme d’écart type moyen ± sur une échelle log10. La ligne pointillée indique un changement de 1,5 fois (y = 0,176) (n = 3 expériences répétées avec 8 souris de type sauvage; âge = 2 mois; n = 4-5 taches pour SYPH, SYUA, MBP, avec n = 3 valeurs tracées précédemment publiées par Gorenberg et al.19; n = 5 pour SYNJ1; n = 1 pour CDH2). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Dans leurs études fondamentales, Whittaker et ses collègues ont utilisé quatre critères morphologiques pour identifier les synaptosomes: (1) les structures ont une membrane plasmique scellée; 2° les structures contiennent des SV ressemblant à ceux des terminaisons nerveuses et des varicosités in situ en taille et en nombre; (3) les structures possèdent une ou plusieurs petites mitochondries; et (4) la membrane présynaptique adhère fréquemment à une composante post-synaptique11,12,13. Bien que les deux premiers critères s’appliquent généralement à toutes les méthodes d’isolement, dans les protocoles les plus récents décrits dans cet article, tous les synaptosomes résultants n’auront pas de mitochondries et de terminaux post-synaptiques attachés. Environ 60% des synaptosomes auront des mitochondries, et on estime que seulement 15% ont des terminaisons post-synaptiques attachées37. Si les composants post-synaptiques présentent un intérêt particulier, on sait que l’utilisation d’un tampon d’homogénéisation isotonique de type Krebs et de la filtration sous pression pour l’enrichissement produit des concentrations élevées de synaptosomes avec des terminaisons post-synaptiques (également appelées synaptoneurosomes)22,38.
La méthode de sacrifice de l’animal peut avoir un impact sur la qualité des synaptosomes et des sous-fractions synaptiques. Les animaux adultes sacrifiés à l’aide d’une méthode d’euthanasie qui ne nécessite pas d’anesthésie donneront la meilleure qualité de fraction. En outre, les cerveaux doivent être fraîchement disséqués, non congelés et homogénéisés en utilisant un rapport de 1:10 de tampon d’homogénéisation (poids / volume) pour les fractions synaptiques les plus viables22. Le cerveau a une population hétérogène de synapses qui peuvent être différenciées par le type de neurotransmetteurs qu’elles portent. La formation de synaptosomes n’est généralement pas affectée par le type de synapse ou le contenu en neurotransmetteurs13. Une exception concerne les fibres moussues dans le cervelet, qui sont connues pour être perturbées dans des conditions optimales pour obtenir des synaptosomes du reste du cerveau 39,40. Ainsi, l’ablation du cervelet avant l’homogénéisation du cerveau est recommandée si l’exclusion de cette région n’affecte pas l’objectif expérimental. Si vous souhaitez isoler les synaptosomes d’un caractère neurotransmetteur particulier, les zones du cerveau qui sont enrichies pour les neurones contenant le neurotransmetteur d’intérêt peuvent d’abord être isolées. Cependant, cette approche imposera des limites au rendement final en fractions, en fonction de la taille de la région d’intérêt (l’âge des animaux est donc également pris en considération). Il existe des méthodes immunochimiques pour l’isolement des synaptosomes spécifiques aux neurotransmetteurs, mais la viabilité et le rendement seront considérablement compromis22. Si l’évaluation de la viabilité métabolique des synaptosomes est importante, la mesure de la libération des neurotransmetteurs 41,42 ou certains dosages enzymatiques43 peuvent être utilisés.
Les contaminants courants dans les préparations de synaptosomes comprennent les microsomes, les mitochondries libres, les SV et les membranes neuronales et gliales. La contamination peut être réduite en augmentant le nombre de lavages aux fractions P1 et P222 et en évitant la remise en suspension de la pastille mitochondriale rouge dans les étapes suivantes. Dans les expériences où la viabilité métabolique et le temps sont cruciaux, il sera utile de réduire le nombre de lavages et d’utiliser des gradients de Ficoll ou de Percoll sur des gradients de saccharose44,45,46. Ces méthodes réduisent également considérablement la contamination. Le protocole original de Whittaker a produit des SV de haute qualité. Une optimisation plus poussée par Nagy et al.23, incluse dans cette méthode, produit des SV avec une homogénéité et une pureté remarquables sans compromettre significativement le rendement36. Si des sous-types spécifiques de SV sont d’intérêt, tels que les SV glutamatergiques (contenant VGLUT-1) ou GABAergiques (contenant VGAT-1), une immunoisolation à l’aide d’anticorps spécifiques peut être effectuée47,48. D’autres méthodes sont également disponibles pour isoler les CVC des synaptosomes qui, en raison de la densité différentielle, peuvent ne pas être présents à la même interface que les SV obtenus avec cette méthode20,49,50.
Dans l’ensemble, le protocole actuel d’isolement des composants synaptiques peut être optimisé davantage pour obtenir des fractions avec une homogénéité et une viabilité améliorées en fonction de la qualité et de la quantité du tissu cérébral source et des objectifs expérimentaux. Pour plus de détails sur le dépannage, il convient de se référer aux chapitres de livres de Dunkley et Robinson22 et Ganzella et al.36.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier P. Colosi pour la préparation de l’image EM. Ce travail a été soutenu par les National Institutes of Health (R01 NS064963, SSC; R01 NS110354, SSC; R01 NS083846, SSC; R21 NS094971, SSC; T32 NS007224, TMS; T32 NS041228, SMT), le département de la Défense des États-Unis (W81XWH-17-1-0564, SSC; W81XWH-19-1-0264, VDJ), Aligning Science Across Parkinson’s (ASAP) Collaborative Research Network (SSC) et le Michael J. Fox Foundation Target Advancement Program (MJFF-020160, SSC & VDJ). Nous avons créé des illustrations graphiques à l’aide de BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL TB Syringe | BD | 309649 | |
| 1.5 mL Eppendorf Tubes | USA Scientific | 1415-2500 | |
| 14 mL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter | 344060 | Compatible with SW 40 Ti |
| 23 Gauge Precision Glide Hypodermic Needle | BD | 305145 | |
| 26.3 mL, Polycarbonate Bottle with Cap Assembly | Beckman Coulter | 355618 | Compatible with Ti70 |
| 3.5 mL, Open-Top Thickwall Polypropylene Tube | Beckman Coulter | 349623 | Compatible with TLA-100.3 |
| 50 mL Falcon Tubes | Fisher Scientific | 14-432-22 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Millipore Sigma | UFC901024 | |
| Aprotinin | Sigma-Aldrich | A6279 | 1 mg/mL in diH2O |
| Avanti J-26 XP Centrifuge | Beckman Coulter | B22984 | <26,000 rpm |
| Benchtop HDPE Dewar Flask | Thermo Scientific | 5028U19 | |
| C57BL/6J Mice | The Jackson Labs | 000664 | |
| Centrifuge 5810R | Eppendorf | EP022628168 | <14,000 rpm |
| complete, Mini, EDTA-free Protease Inhibitor Cocktail Tablets | Roche | 11873580001 | Add 1 tablet per 50 mL of solution |
| Curved Forceps | Fine Science Tools | 11273-20 | |
| Fine Surgical Scissors | Fine Science Tools | 8r | |
| Glas-Col Tissue Homogenizing System | Cole-Parmer | UX-04369-15 | |
| Graefe Forceps | Fine Science Tools | 11650-10 | |
| High-Speed Polycarbonate Round Bottom Centrifuge Tubes | ThermoFisher | 3117-0500 | Compatible with JA20 |
| Isofluorane | Henry Schein Animal Health | NDC 11695-6776-2 | |
| JA-20 Rotor | Beckman Coulter | 334831 | |
| Leupeptin | American Bio | AB01108 | 1 mg/mL in diH2O |
| N-[2-Hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid] (HEPES) | American Bio | AB00892 | |
| Optima L-80 XP Ultracentrifuge | Beckman Coulter | <100,000 rpm | |
| Optima TLX Ultracentrifuge | Beckman Coulter | <120,000 rpm | |
| Pepstatin A | Thermo Scientific | 78436 | 1 mg/mL in DMSO |
| Phenylmethylsulfonyl fluoride (PMSF) | American Bio | AB01620 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23335 | For determination of protein concentration |
| Pipette Tips | |||
| Serological Pipettes | |||
| Sucrose | Sigma-Aldrich | S0389 | |
| Surgical Scissors | Fine Science Tools | 14002-12 | |
| SW 40 Ti Swinging-Bucket Rotor | Beckman Coulter | 331301 | |
| Teflon-Coated Pestle and Mortar Tissue Grinder | Thomas Scientific | 3431D94 | |
| Ti70 Rotor | Beckman Coulter | 337922 | |
| TLA-100.3 Rotor | Beckman Coulter | 349490 | |
| Tube Revolver | Dot Scientific | DTR-02VS |
Références
- Synaptic Transmission. Principles of Neural Science, Fifth Edition. Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J., Education, A. J. , McGraw-Hill Education. New York, NY. (2014).
- Lepeta, K., et al. Synaptopathies: synaptic dysfunction in neurological disorders - A review from students to students. Journal of Neurochemistry. 138 (6), 785-805 (2016).
- Südhof, T. C., Malenka, R. C. Understanding synapses: Past, present, and future. Neuron. 60 (3), 469-476 (2008).
- Südhof, T. C. The molecular machinery of neurotransmitter release (Nobel lecture). Angewandte Chemie International Edition. 53 (47), 12696-12717 (2014).
- Jahn, R., Boyken, J. Molecular Regulation of Synaptic Release. Neuroscience in the 21st Century: From Basic to Clinical. Pfaff, D. W. , Springer. New York. New York, NY. 351-401 (2013).
- Xiong, H., Gendelman, H. E. Current Laboratory Methods in Neuroscience Research. , Springer. New York. New York, NY. (2014).
- Azevedo, F. A., et al. Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology. 513 (5), 532-541 (2009).
- Herculano-Houzel, S. The remarkable, yet not extraordinary, human brain as a scaled-up primate brain and its associated cost. Proceedings of the National Academy of Sciences of the United States of America. 109, 10661-10668 (2012).
- Herculano-Houzel, S., Lent, R. Isotropic fractionator: A simple, rapid method for the quantification of total cell and neuron numbers in the brain. Journal of Neuroscience. 25 (10), 2518-2521 (2005).
- Herculano-Houzel, S., Mota, B., Lent, R. Cellular scaling rules for rodent brains. Proceedings of the National Academy of Sciences of the United States of America. 103 (32), 12138-12143 (2006).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron-microscopic study of cell fragments derived by homogenization and centrifugation. Journal of Anatomy. 96, 79-88 (1962).
- Gray, E. G., Whittaker, V. P. The isolation of synaptic vesicles from the central nervous system. Journal of Physiology. 153, 35-37 (1960).
- Whittaker, V. P. Thirty years of synaptosome research. Journal of Neurocytology. 22 (9), 735-742 (1993).
- Jahn, R., Fasshauer, D. Molecular machines governing exocytosis of synaptic vesicles. Nature. 490, 201-207 (2012).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from nerve-ending particles ('synaptosomes). Biochemical Journal. 90 (2), 293-303 (1964).
- De Robertis, E., Rodriguez De Lores Arnaiz, G., Pellegrino De Iraldi, A. Isolation of synaptic vesicles from nerve endings of the rat brain. Nature. 194, 794-795 (1962).
- De Robertis, E., Pellegrino De Iraldi, A., Rodriguez, G., Gomez, C. J. On the isolation of nerve endings and synaptic vesicles. The Journal of Biophysical and Biochemical Cytology. 9 (1), 229-235 (1961).
- Zimmermann, H., Whittaker, V. P. The Discovery of the Synaptosome and Its Implications. Synaptosomes. Murphy, K. M. , Springer. New York. New York, NY. 9-26 (2018).
- Gorenberg, E. L., et al. Identification of substrates of palmitoyl protein thioesterase 1 highlights roles of depalmitoylation in disulfide bond formation and synaptic function. PLoS Biology. 20 (3), 3001590(2022).
- Vidyadhara, D. J., et al. Dopamine transporter and synaptic vesicle sorting defects initiate auxilin-linked Parkinson's disease. bioRxiv. , (2022).
- Schrimpf, S. P., et al. Proteomic analysis of synaptosomes using isotope-coded affinity tags and mass spectrometry. Proteomics. 5 (10), 2531-2541 (2005).
- Dunkley, P. R., Robinson, P. J. Synaptosome Preparations: Which Procedure Should I Use. Synaptosomes. Murphy, K. M. , Springer. New York. New York, NY. 27-53 (2018).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Research. 109 (2), 285-309 (1976).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127 (4), 831-846 (2006).
- Wagner, J. A., Kelly, R. B. Topological organization of proteins in an intracellular secretory organelle: the synaptic vesicle. Proceedings of the National Academy of Sciences of the United States of America. 76 (8), 4126-4130 (1979).
- Jahn, R., Schiebler, W., Ouimet, C., Greengard, P. A 38,000-dalton membrane protein (p38) present in synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 82 (12), 4137-4141 (1985).
- Binotti, B., Jahn, R., Pérez-Lara, Á An overview of the synaptic vesicle lipid composition. Archives of Biochemistry and Biophysics. 709, 108966(2021).
- Siegel, D. P., Ware, B. R. Electrokinetic properties of synaptic vesicles and synaptosomal membranes. Biophysical Journal. 30 (1), 159-172 (1980).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from disrupted nervending particles. Biochemical Pharmacology. 12 (3), 300-302 (1963).
- Clementi, F., Whittaker, V. P., Sheridan, M. N. The yield of synaptosomes from the cerebral cortex of guinea pigs estimated by a polystyrene bead "tagging" procedure. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 72, 126-138 (1966).
- Carlson, S. S., Wagner, J. A., Kelly, R. B. Purification of synaptic vesicles from elasmobranch electric organ and the use of biophysical criteria to demonstrate purity. Biochemistry. 17 (7), 1188-1199 (1978).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. Journal of Cell Biology. 96 (5), 1374-1388 (1983).
- Hawkins, P., et al. A guide to defining and implementing protocols for the welfare assessment of laboratory animals: eleventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Laboratory Animals. 45 (1), 1-13 (2011).
- Risling, T. E., Caulkett, N. A., Florence, D. Open-drop anesthesia for small laboratory animals. Canadian Veterinary Journal. 53 (3), 299-302 (2012).
- Deutsch, C., Drown, C., Rafalowska, U., Silver, I. A. Synaptosomes from rat brain: Morphology, compartmentation, and transmembrane pH and electrical gradients. Journal of Neurochemistry. 36 (6), 2063-2072 (1981).
- Ganzella, M., Ninov, M., Riedel, D., Jahn, R. Isolation of synaptic vesicles from mammalian brain. Methods in Molecular Biology. 2417, 131-145 (2022).
- Dunkley, P. R., et al. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: homogeneity and morphology of subcellular fractions. Brain Research. 441 (1-2), 59-71 (1988).
- Schwartz, R. D., Skolnick, P., Hollingsworth, E. B., Paul, S. M. Barbiturate and picrotoxin-sensitive chloride efflux in rat cerebral cortical synaptoneurosomes. FEBS Letters. 175 (1), 193-196 (1984).
- Pittaluga, A., Thellung, S., Maura, G., Raiteri, M. Characterization of two central AMPA-preferring receptors having distinct location, function and pharmacology. Naunyn-Schmiedeberg's Archives of Pharmacology. 349 (6), 555-558 (1994).
- Israël, M., Whittaker, V. P. The isolation of mossy fibre endings from the granular layer of the cerebellar cortex. Experientia. 21 (6), 325-326 (1965).
- Khvotchev, M., Lonart, G., Südhof, T. C. Role of calcium in neurotransmitter release evoked by alpha-latrotoxin or hypertonic sucrose. Neuroscience. 101 (3), 793-802 (2000).
- Lonart, G., Janz, R., Johnson, K. M., Südhof, T. C. Mechanism of action of rab3A in mossy fiber LTP. Neuron. 21 (5), 1141-1150 (1998).
- Nicholls, D. G., Sihra, T. S. Synaptosomes possess an exocytotic pool of glutamate. Nature. 321 (6072), 772-773 (1986).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nature Protocols. 3 (11), 1718-1728 (2008).
- Cotman, C. W., Matthews, D. A. Synaptic plasma membranes from rat brain synaptosomes: Isolation and partial characterization. Biochimica et Biophysica Acta. 249 (2), 380-394 (1971).
- Booth, R. F., Clark, J. B. A rapid method for the preparation of relatively pure metabolically competent synaptosomes from rat brain. Biochemical Journal. 176 (2), 365-370 (1978).
- Takamori, S., Riedel, D., Jahn, R. Immunoisolation of GABA-specific synaptic vesicles defines a functionally distinct subset of synaptic vesicles. Journal of Neuroscience. 20 (3), 4904-4911 (2000).
- Burger, P. M., et al. Synaptic vesicles immunoisolated from rat cerebral cortex contain high levels of glutamate. Neuron. 3 (6), 715-720 (1989).
- Blondeau, F., et al. Tandem MS analysis of brain clathrin-coated vesicles reveals their critical involvement in synaptic vesicle recycling. Proceedings of the National Academy of Sciences of the United States of America. 101 (11), 3833-3838 (2004).
- Maycox, P. R., Link, E., Reetz, A., Morris, S. A., Jahn, R. Clathrin-coated vesicles in nervous tissue are involved primarily in synaptic vesicle recycling. Journal of Cell Biology. 118 (6), 1379-1388 (1992).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon