Method Article
פיצול תת-תאי לבידוד רכיבים סינפטיים ממוח מורין
In This Article
Summary
פרוטוקול זה מציג שיטה חזקה ומפורטת להשגת סינפטוזומים טהורים ביותר, שלפוחיות סינפטיות ושברים סינפטיים אחרים ממוח העכבר. שיטה זו מאפשרת הערכה של תהליכים סינפטיים, כולל ניתוח ביוכימי של לוקליזציה ותפקוד חלבונים ברזולוציה מדורית.
Abstract
מסופים סינפטיים הם האתרים העיקריים של תקשורת עצבית. תפקוד לקוי של סינפטי הוא סימן היכר של הפרעות נוירופסיכיאטריות ונוירולוגיות רבות. אפיון תת-התאים הסינפטיים על ידי בידוד ביוכימי הוא, אם כן, שיטה רבת עוצמה להבהרת הבסיסים המולקולריים של תהליכים סינפטיים, הן בבריאות והן במחלות. פרוטוקול זה מתאר את הבידוד של הדקים סינפטיים ותת-תאים סינפטיים ממוחות עכברים על ידי פיצול תת-תאי. ראשית, מבנים סופניים סינפטיים, המכונים סינפטוזומים, מבודדים בעקבות הומוגניזציה של רקמת המוח. סינפטוזומים הם תאים עצביים טרום ואחרי סינפטיים עם ממברנות מכווצות ואטומות. מבנים אלה שומרים על מצב פעיל מטבולית והם בעלי ערך לחקר המבנה והתפקוד הסינפטי. לאחר מכן, הסינפטוזומים נתונים לתזה היפוטונית ול-ultracentrifugation כדי לקבל תת-תאים סינפטיים מועשרים עבור שלפוחית סינפטית, ציטוזול סינפטי וממברנת פלזמה סינפטית. טוהר השברים מאושר על ידי מיקרוסקופיית אלקטרונים וניתוח העשרה ביוכימית עבור חלבונים ספציפיים לתאים תת-סינפטיים. השיטה המוצגת היא כלי פשוט ובעל ערך לחקר המאפיינים המבניים והתפקודיים של הסינפסה והאטיולוגיה המולקולרית של הפרעות מוחיות שונות.
Introduction
סינפסות הן היחידות החישוביות הבסיסיות של המוח שדרכן נוירונים מתקשרים ומפעילים פונקציות מגוונות ומורכבות להפליא. סינפסות הן, אם כן, היסוד לבריאות המוח1; תפקוד לקוי של המערכת הסינפטית מעורב כמקור או תוצאה של הפרעות רבות2. סינפסות נוצרות על ידי טרמינלים טרום ואחרי סינפטיים, הרחבות של שני נוירונים שונים המופרדים זה מזה ומופרדים על ידי שסע סינפטי שחוצה על ידי מולקולות הידבקות סינפטיות. המידע זורם מהתא הקדם-סינפטי והפוסט-סינפטי בצורה של שליחים כימיים הנקראים נוירוטרנסמיטורים1. התהליכים המולקולריים המעורבים בהעברה עצבית הם תחומי מחקר פעילים 3,4,5. הבנת התהליכים הפתוגניים בתוך הטרמינלים הסינפטיים ותגובת הסינפסות לפתולוגיה בתת-תאים עצביים אחרים הם צעדים חיוניים לטיפול בהפרעות במוח 1,2. מספר פיתוחים מתודולוגיים, המיושמים בעיקר על מודלים של מורין, קידמו את המרדף הזה6. הבידוד של שברים סינפטיים על ידי צנטריפוגה דיפרנציאלית הוא שיטה אחת כזו לשינוי פרדיגמה שאפשרה הערכה מפורטת של תהליכים סינפטיים בבריאות ובמחלות.
המוח האנושי הבוגר מורכב מ-80-90 מיליארד נוירונים 7,8. בקרב מיני מורין, מוח החולדה מכיל כ~200 מיליון נוירונים, בעוד שלעכברים יש ~70 מיליון 9,10. כל תא עצב יוצר אלפי קשרים סינפטיים ספציפיים עם רשת של נוירונים מקוטבים מאוד המשולבים עם תאי גליה וכלי דם צפופים. ברקמה כה מורכבת והטרוגנית, פעם לא היה עולה על הדעת לבודד ולחקור סינפסות כמערכת עצמאית. בשנות ה-60 של המאה ה-20, ויקטור ויטאקר, קתרין הב ואחרים אפשרו זאת על ידי בידוד מסופים סינפטיים שלמים באמצעות פיצול תת-תאי 11,12,13,14. בניסיון לבודד שלפוחיות סינפטיות (SVs), הם הומוגניים במוחם באמצעות כוח גזירה נוזלי בסוכרוז איזו-אוסמוטי (0.32 M) ואחריו אולטרה-צנטריפוגציה. הם השיגו מסופי עצבים או דליות מכווצים, סגורים בקרום פלזמה, שלמים, שאותם כינו חלקיקים קצות עצבים (NEPs)11,13. מכיוון שהמאפיינים המבניים והתפקודיים של הסינפסה נשמרו במבנים אלה, NEPs כונו מאוחר יותר "סינפטוזומים" עבור התאמה עם אברונים תת-תאיים אחרים13,15. ראוי לציין כי עבודתם של אדוארדו דה רוברטיס ועמיתיו, שטבעו את המונח "שלפוחית סינפטית", חפפה לזו של ויטאקר ועמיתיו ותרמה לאימות של בידוד ואפיון "סינפטוזום"16,17,18.
סינפטוזומים הם מבנים פעילים פיזיולוגית המכילים את כל התכונות התאיות והמולקולריות הדרושות לאחסון, שחרור וספיגה מחדש של מוליכים עצביים13,18. שימור המאפיינים הסינפטיים המרכזיים במבחנה והחופש מרכיבים שאינם סינפטיים תורמים גם הם לתועלת של שיטת בידוד זו. סינפטוזומים תרמו רבות להבנת התכונות הכימיות והפיזיולוגיות של העברה עצבית וכעת הם משמשים לחקר תהליכים מולקולריים סינפטיים והשינויים שלהם במחלות 19,20,21,22,23. סינפטוזומים הם גם חומר המקור הראשוני לבידוד רכיבים סינפטיים כגון SVs, שלפוחיות מצופות קלתרין (CCVs), ציטוזול סינפטי, קרום פלזמה סינפטי, מיטוכונדריה סינפטית, מולקולות הידבקות סינפטיות ומרכיבים מעניינים אחרים, אשר יכולים להקל על הבנת המנגנונים המולקולריים של תפקוד סינפטי 18,19,20,24,25,26, 27,28. רכיבים תת-סינפטיים אלה יכולים להתקבל על ידי התזה האוסמוטית של סינפטוזומים ואולטרה-צנטריפוגציה של צפיפות סוכרוז15,29. למרות ששיטת הפיצול התת-תאית המקורית של קבוצת המחקר של ויטאקר ידועה כיעילה בבידוד סינפטוזומים איכותיים ו-SVs 13,30, אופטימיזציות אחרונות משפרות את טוהר השברים התת-תאיים 22,23,31,32. מאמר זה מספק גרסה מפורטת ונגישה ביותר של פרוטוקול קלאסי לפיצול תת-תאי של רקמת מוח מורין לבידוד סינפטוזומים, SVs ורכיבים תת-סינפטיים אחרים.
Protocol
כל הניסויים בעכברים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) באוניברסיטת ייל (פרוטוקול 2021-11117) ובוצעו במתקן שהוסמך על ידי האגודה להערכה והסמכה של טיפול בחיות מעבדה בינלאומי (AAALAC). טיפול בבעלי חיים ודיור בהתאם למדריך לטיפול ושימוש בחיות מעבדה33 וסופקו על ידי מרכז המשאבים לבעלי חיים של ייל (YARC). בעלי חיים הוחזקו במחזור אור/חושך של 12 שעות עם גישה ad libitum למזון ומים. חמישה עד שמונה עכברים או שתיים עד ארבע חולדות לכל גנוטיפ או מצב נדרשים לפרוטוקול הבא. פחות חולדות נחוצות בגלל נפחי המוח הגדולים יותר שלהן. באופן דומה, גיל חיות הניסוי עשוי להשפיע על תפוקת השברים; ייתכן שיידרשו עכברים נוספים לגילאי פחות מחודשיים. אחרת, הנהלים המפורטים חלים הן על מיני מורין והן על בעלי חיים בוגרים בריאים בכל גיל. הנתונים המייצגים שהוצגו במחקר זה השתמשו בעכברים מסוג בר (C57BL/6J) (גיל = חודשיים; ארבעה זכרים וארבע נקבות לכל שכפול) שהתקבלו ממקור מסחרי (ראו טבלת חומרים).
1. הכנה ניסיונית
הערה: פרוטוקול זה דורש ~ 11 שעות כדי שחוקר יחיד ישלים. מומלץ מאוד להשלים את ההתקנה של ספסלים (איור 1), הכנת חיץ (טבלה 1), קירור מראש של צנטריפוגות ורוטורים ל-4 מעלות צלזיוס, ואיסוף ותיוג של חומרים וציוד נחוצים (ראו טבלת חומרים) יום לפני ביצוע הפרוטוקול, במידת הצורך.
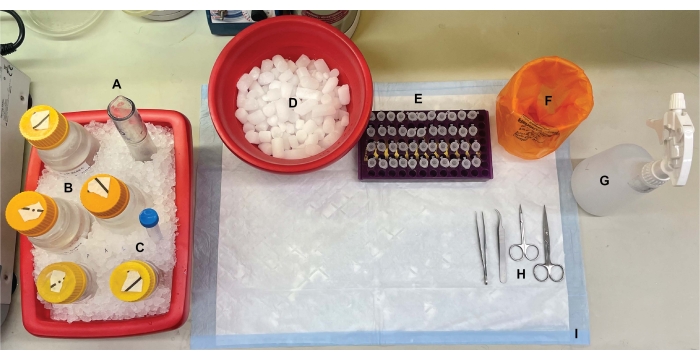
איור 1: מערך הספסלים. לפני ניתוחי המוח, (A) הומוגנייזרים של זכוכית Dounce ו-(B) כל המאגרים היו מצוננים על קרח. (C) תמיסות מלאי של מעכבי פרוטאז הופשרו על קרח. התקבלו מיכל שני של קרח רטוב לצינורות צנטריפוגות, דיואר של חנקן נוזלי (לא מוצג), ו-(D) מיכל של קרח יבש לאחסון לטווח קצר של הדגימות שהוקפאו בחנקן נוזלי. (E) צינורות מיקרוצנטריפוגה סומנו מראש עבור כל הדגימות, שכן במהלך הליך זה נאספו ארבעה אליקוטים של כל דגימת שבר תת-תאי לכל גנוטיפ או מצב (טיפ חוסך זמן: תייג ביסודיות את כל הצינורות יום לפני ביצוע הניסוי). (F) מיכל פסולת ביולוגית מתאים, (G) 70% אתנול, (H) כלי ניתוח, ו-(I) משטח סופג. צינורות הצנטריפוגה והחד-פעמיים הנדרשים הוקצו לגישה יעילה במהלך יישום הפרוטוקול (לא הוצגו). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- הכינו את הספסל לניתוח ואספו את המספריים והמלקחיים הדרושים לכריתת המוח (ראו טבלת חומרים). שפופרות מיקרוצנטריפוגה של 1.5 מ"ל עם תווית מוקדמת עבור ביופסיות זנב עכבר וארבעה צינורות לכל שבר שנאסף, כפי שמתואר באיור 2.
- השיגו שני מיכלים של קרח רטוב, מיכל אחד של קרח יבש ובקבוק חנקן נוזלי של דיואר.
- תמיסות פשיר פניל-מתיל-סולפוניל פלואוריד (PMSF), פסטטין A, אפרוטינין ולאופטין על קרח (ראו טבלת חומרים). הכן את המאגרים הדרושים (טבלה 1).
הערה: ניתן להכין תמיסות סוכרוז מראש ולאחסן אותן בטמפרטורה של 4°C. עם זאת, מעכבי פרוטאז (מלאי מופשר וטבליות) יש להוסיף טריים לכל המאגרים בתחילת הניסוי בשל חוסר היציבות של ריאגנטים אלה בתמיסות מימיות. יתר על כן, כל המאגרים חייבים להיות מוכנים עם כלי זכוכית ללא חומרי ניקוי ומים ללא חומרי ניקוי כדי לאפשר איסוף של סינפטוזומים שלמים. - מצננים את כל המאגרים והזכוכית של ההומוגנייזרים (ראו טבלת חומרים) על הקרח. מכוונים את הצנטריפוגות ל-4°C ומצננים את הרוטורים ל-4°C.
- הוסיפו 14 מ"ל של חיץ A (טבלה 1) להומוגנייזר של Dounce על קרח.
טבלה 1: הרכב מאגרי הפיצול התת-תאיים. אנא לחץ כאן כדי להוריד טבלה זו.
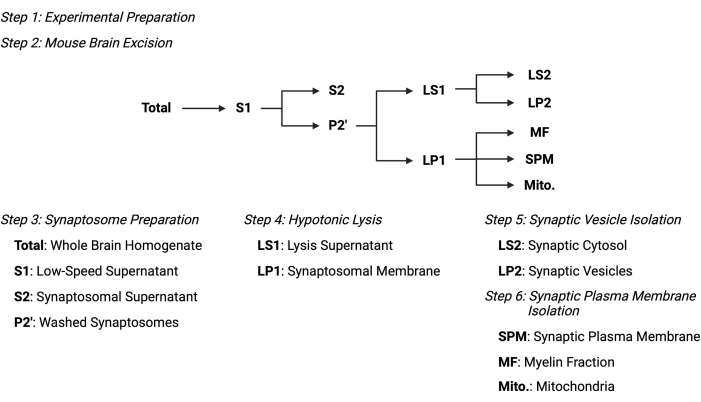
איור 2: סקירה כללית של פרוטוקול הפיצול התת-תאי. סיכום סכמטי של שלבי הפיצול התת-תאיים ודגימות שנאספו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
2. כריתת מוח עכבר
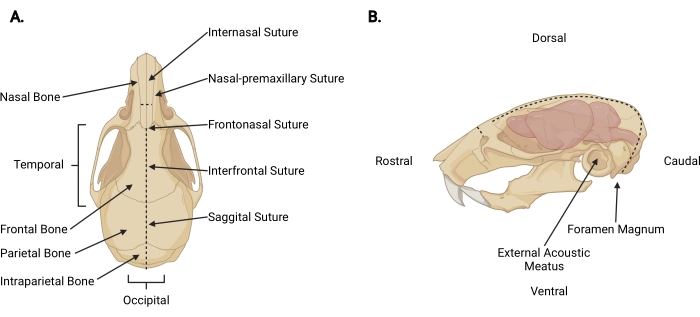
איור 3: אנטומיה קרניופציאלית . (A) מבט דורסלי של גולגולת עכבר עם מבנים גולגולתיים רלוונטיים. (B) מבט רוחבי שמאלי על גולגולת עכבר ומוח עם מבנים גולגולתיים רלוונטיים וכיוונים אנטומיים מסומנים. הקווים המקווקווים מייצגים את המקומות שבהם יש לבצע חתכים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- הרדימו עמוק כל עכבר עם 100% איזופלואורן בתא הרדמה הממוקם במכסה אדים או בארון בטיחות ביולוגית בשיטת טיפה פתוחה34. להקריב כל עכבר על ידי נקע עמוד השדרה הצווארי ואחריו במהירות על ידי עריפת ראש. החלפה בין גנוטיפים או קבוצות ניסוי עבור כל קורבן ונתיחה12. השג ביופסיות זנב לאחר המתת חסד על ידי כריתת 2 מ"מ של קצה הזנב הדיסטלי עם מספריים עדינים. אחסן את הרקמה לגנוטיפ.
- רססו את הראש הערוף ב-70% אתנול כדי למנוע מהשיער להיצמד לרקמה ולמכשירי הניתוח במהלך הדיסקציה.
- הכנס מספריים עדינים מתחת לעור בחתך העריפה לעומק פריקרניאלי ובצע חתך מידסגיטלי עד לתפר הבין-נקבי (איור 3A) כדי לסגת הקרקפת מהגולגולת.
- בעבודה מהאזור העורפי לכיוון כל היבט טמפורלי, חתכו את החיתולית והשריר כדי לחשוף את פני השטח החיצוניים של הגולגולת מעבר לכל בשר אקוסטי חיצוני (איור 3B).
- אבטחו את הקרקפת ואת ההיבט הרוסטרלי של הגולגולת ביד הלא דומיננטית. עם השני, להכניס מספריים עדינים 2 מ"מ לתוך הצד caudal של foramen magnum, שבו חוט השדרה גלוי יוצא. בצע חתך בקו האמצע עד שהמספריים יגיעו לפני השטח הפנימיים של העצם התוך-פריאטלית (איור 3; קווים מקווקווים).
הערה: במהלך החתך הראשוני, המספריים חייבים להיות מקבילים לחוט השדרה עם לחץ המופעל לכיוון פני השטח הפנימיים של הגולגולת כדי למנוע נזק לגזע המוח ולמוח הקטן. - שנה את זווית המספריים כך שהלהבים יפעלו במקביל למשטח הגבי של הגולגולת. המשך לקדם את החתך המידסגיטלי דרך העצמות הקודקודיות והחזיתיות, תוך שימוש בתפרים הסגיטליים והאינטרפרונטליים כמדריך. השתמש בלחץ קבוע כלפי מעלה כדי למנוע נזק לקליפת המוח. סיימו את החתך ממש מעבר לתפר הבין-נקבי (איור 3A).
- בצע חתך ניצב קטן (~ 3 מ"מ) לעצם האף, רוסטרלי לתפר הבין-נקבי, על-ידי הצבת המספריים בניצב לגולגולת כאשר כל להב ממוקם בתפר אף-קדם-מקסילרי והפיכת חתך אחד לאחיד (איור 3; קווים מקווקווים).
הערה: שלב זה יגדיל את הקלות של נסיגת הגולגולת ויהיה קריטי לאיסוף נורת חוש הריח אם אזור זה מעניין. - בעת אבטחת ההיבט הרוסטרלי, השתמש בצד אחד של זוג מלקחיים בעלי מרקם כדי להרים בעדינות את הגולגולת מהמוח, ולאחר מכן לרוחב ולגחון. חזרו על הפעולה לאורך קו האמצע לפי הצורך, ולאחר מכן בחצי הכדור השני עד שכל פני השטח של המוח נחשפים.
- באמצעות מלקחיים מעוקלים או מרית עדינה, בעדינות להרים את הצד rostral של המוח. חותכים את עצבי הראייה והגולגולת כדי להשלים את הכריתה מהגולגולת.
- עבור כל מצב, אספו חמישה עד שמונה מוחות של עכברים יחד לתוך הזכוכית הצוננת Dounce homogenizer המכיל 14 מ"ל של Buffer A (טבלה 1).
3. הכנת סינפטוזום
הערה: הסכמות של הליך זה מוצגות באיור 4.
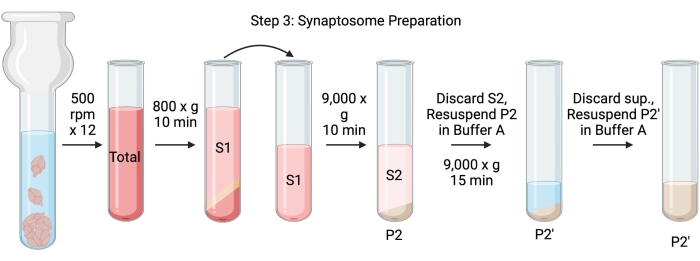
איור 4: הכנת סינפטוזום. סכמת שלב 3, דור הסינפטוזומים (P2). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- הומוגניות של המוח באמצעות הומוגנייזר זכוכית Dounce ב-12 מעברים מעלה-מטה ב-500 סל"ד (סה"כ). השהה לזמן קצר בכל מכת מטה כדי להבטיח הומוגניזציה יסודית של הרקמה. הומוגניות מועדפת באמבט קרח כדי למנוע התחממות ודנטורציה של חלבונים. קח 5 μL aliquots לקביעת ריכוז החלבון על ידי בדיקת חומצה bicinchoninic (BCA, ראה טבלת חומרים). קח 100 μL של ליזאט מוח שלם aliquots עבור כתם מערבי (WB). עבור הדגימה הזו ועבור כל הדגימות הבאות (איור 2), קחו שני אליקוטים עבור BCA ושני אליקוטים עבור WB. הקפיא בהבזק את כל האליקוטים שנאספו בחנקן נוזלי ואחסן אותם בטמפרטורה של −80 מעלות צלזיוס.
- סובבו את ההומוגנט המוחי הכולל בצינור צנטריפוגה תחתון עגול במהירות גבוהה (14 מ"ל) (ראו טבלת חומרים) ב-800 x גרם למשך 10 דקות ב-4 מעלות צלזיוס כדי לקבל את הסופר-נאטנט (S1). מעבירים את S1 לצינור צנטריפוגה חדש, ומשאירים את הכדור מאחור (P1), המכיל תאים וגרעינים שלמים. הימנעו מלהעלות את הגלולה הרכה, הלבנה, הרופפת והשטחית. קח 2 x 5 μL של S1 עבור BCA ו 2 x 100 μL של S1 עבור WB.
- סובב S1 ב-9,000 x g למשך 15 דקות ב-4 °C כדי לקבל את הסופר-נטנט הסינפטוזומלי (S2) ואת כדור הסינפטוזום הגולמי (P2). קח 2 x 10 μL של S2 עבור BCA ו 2 x 500 μL של S2 עבור WB. להשליך את supernatant לאחר קבלת aliquots ולהמשיך לשלב הבא עם גלולה.
- יש להשעות את P2 ב-3 מ"ל של חיץ A קר כקרח עם מעכבי פרוטאזות וצנטריפוגות בעוצמה של 9,000 x גרם למשך 15 דקות ב-4 מעלות צלזיוס כדי לקבל את הסינפטוזומים העל-טבעיים (S2') והסינפטוזומים השטופים (P2). השליכו את הסופר-נאטנט ושמרו על הכדור.
- יש להשעות את P2' ב-3 מ"ל של חיץ A. הימנעו מהחייאת החלק האדום הכהה בתחתית הכדור, המכיל בעיקר מיטוכונדריה. קח 2 x 20 μL של P2' עבור BCA ו- 2 x 100 μL של P2' עבור WB.
הערה: ניתן להשיג זאת על ידי ערבוב עדין של הקצוות והמשטח של הכדור כדי לתלות מחדש את הסינפטוזומים הלבנים השטופים תוך הפניית קצה הפיפטה מהמרכז האדום של הכדור.
4. ליזיס היפוטוני
הערה: הסכמות של הליך זה מוצגות באיור 5.
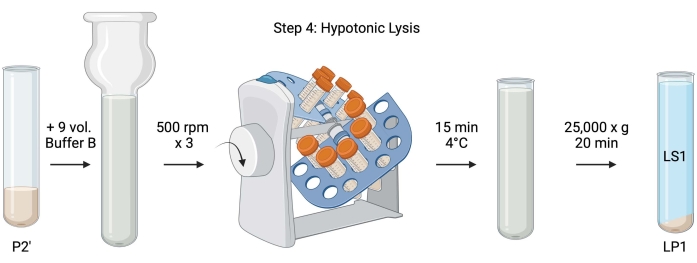
איור 5: ליזיס היפוטוני. סכמת שלב 4, הליזיס ההיפוטוני של סינפטוזומים ליצירת שברים של ממברנה סינפטוסומלית (LS1) ושברים של ממברנה סינפטוזומלית (LP1). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- עבור תזה היפוטונית של סינפטוזומים שטופים, הוסף 9 כרכים של חיץ B מצונן (טבלה 1) כדי להחיות את P2' (~ 27 מ"ל). הומוגניזציה של הסינפטוזומים בזכוכית Dounce homogenizer (שלושה מעברים למעלה-למטה ב 500 סל"ד).
- העבר את הדגימות לצינורות צנטריפוגה חרוטיים מכוסים 50 מ"ל. סובב אותם על אקדח צינור בחדר קר של 4 מעלות צלזיוס למשך 15 דקות.
- הצנטריפוגה שכבה P2' ב-25,000 x g במשך 20 דקות ב-4 °C כדי להשיג את ה-lysis supernatant (LS1) ואת כדור הליזיס המכיל ממברנות סינפטוזומליות (LP1). קח 2 x 50 μL של LS1 עבור BCA ו-2 x 400 μL של LS1 עבור WB. העבר את LS1 לתוך צינור צנטריפוגה מכוסה עבור אולטרה-צנטריפוגציה (ראה טבלת חומרים).
5. בידוד שלפוחית סינפטי
הערה: הסכמות של הליך זה מוצגות באיור 6.
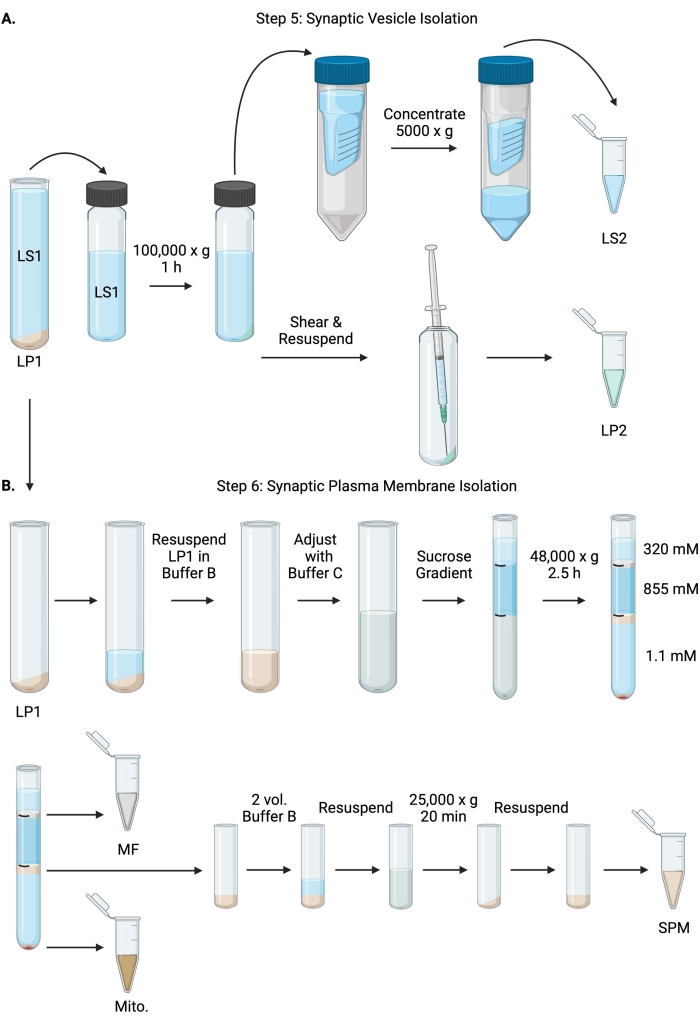
איור 6: בידוד שלפוחית סינפטית ובידוד ממברנת פלזמה סינפטית. (A) סכמת שלב 5, בידוד של שברים ציטוזול סינפטי (LS2) ושלפוחית סינפטית (LP2), ו-(B) שלב 6, יצירת מיאלין (MF), קרום פלזמה סינפטי (SPM) ושברים מיטוכונדריאליים (מיטוכונדריאליים.) בעקבות אולטרה-צנטריפוגה של שיפועי סוכרוז. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
- צנטריפוגה LS1 ברוטור אולטרה-צנטריפוגה בזווית קבועה (ראו טבלת חומרים) ברזולוציה של 100,000 x גרם למשך 60 דקות ב-4 מעלות צלזיוס כדי לקבל ציטוזול סינפטי (LS2) וכדורית שלפוחית סינפטית (LP2). LP2 יהיה קטן, שקוף, ודבוק חזק לצד של צינור הצנטריפוגה.
- יש להשעות את LP2 ב-500 μL של Buffer A. באמצעות מחט של 23 גרם ומזרק של 1 מ"ל, לגזוז את LP2 עם טריטורציה עדינה. קח 2 x 10 μL של LP2 עבור BCA ו 2 x 250 μL של LP2 עבור WB.
- העבר LS2 (~ 30 מ"ל) ליחידות מסנן צנטריפוגליות עם ניתוק של 10 kDa (ראה טבלת חומרים).
הערה: אם חלבונים הקטנים מ-10 kDa מעניינים, קיימות יחידות מסנן צנטריפוגליות עם ניתוק של 4 kDa, אך הן יביאו לזמני סחיטה ארוכים יותר. - רכז LS2 עד כ-0.5 מ"ל על-ידי סיבוב ב-5000 x g למשך עד שעה אחת ב-4 °C. קח 2 x 10 μL של LS2 מרוכז עבור BCA ו 2 x 250 μL של LS2 מרוכז עבור WB. לאחר תחילת הסיבוב, המשך ישירות לשלב 6.1.
6. בידוד קרום פלזמה סינפטי
- השהה את LP1 (שלב 4.3) ב-1 מ"ל של מאגר B (טבלה 1). קח 2 x 10 μL של LP1 עבור BCA ו 2 x 50 μL של LP1 עבור WB. התאם את ה-LP1 הנותר לנפח סופי של 7.5 מ"ל ולריכוז סוכרוז סופי של 1.1 מ' עם חיץ B ומאגר C (טבלה 1).
- העבר 7.5 מ"ל של LP1 שעבר החייאה לתוך צינור אולטרה-צנטריפוגה של 14 מ"ל (ראה טבלת חומרים). שכב בזהירות LP1 עם 3.75 מ"ל של Buffer D (טבלה 1), ולאחר מכן שכבה עם 1.25 מ"ל של Buffer A (או נפח גדול יותר למלא ממש מתחת לחלק העליון של צינור צנטריפוגה). הימנעו מצנרת במורד דופן הצינור, מה שישבש את ממשקי שיפוע הסוכרוז. לאחר כיסוי כל חלק סוכרוז, סמן את החלק העליון של התמיסה עם עט. אזנו את הצינורות עבור אולטרה-צנטריפוגה לפי משקל, לא לפי נפח, עם תוספת טיפה של Buffer A עד 10 מ"ג. צנטריפוגה ב-48,000 x גרם למשך 2.5 שעות ב-4 מעלות צלזיוס ברוטור אולטרה-צנטריפוגה בדלי מתנדנד (ראו טבלת חומרים).
- קבל תמונות של מעברי הצבע השלמים לאחר אולטרה-צנטריפוגציה כדי לתעד את הייחודיות של כל ממשק סוכרוז ואת הצלחת הפיצול.
- הסר בזהירות את השכבה השטחית של סוכרוז 320 mM (חיץ A). שחזר את שבר המיאלין (MF) בממשק סוכרוז של 320 mM/855 mM בנפח של 800 μL. שחזר את שבר קרום הפלזמה הסינפטית (SPM) בממשק של 855 mM/1.1 M סוכרוז בנפח של 1,000 μL. צלע כל שבר כלפי מעלה מדופן הצינור בצורה מעגלית כדי להבטיח שהשבר השלם ייאסף. שאפו בזהירות את הסוכרוז הנותר והחזירו את הכדור המיטוכונדריאלי (מיטו.) על ידי החייאת 200 μL של Buffer B. קח 2 x 100 μL של MF עבור BCA ו 2 x 10 μL של מיטו. עבור BCA; מחלקים את שארית MF ומיטו. דגימות במחצית עבור WB.
- דלל את חלק ה-SPM עם 2 נפחים של Buffer B (~2 מ"ל), ולאחר מכן צנטריפוגה ברוטור בזווית קבועה בצינור צנטריפוגה של 3.5 מ"ל (ראו טבלת חומרים) ב-25,000 x גרם למשך 20 דקות ב-4 מעלות צלזיוס. השליכו את ה-supernatant והחזירו את גלולת ה-SPM במאגר A לנפח סופי של 250 μL. קח 2 x 5 μL של SPM עבור BCA וחלק את ה- SPM הנותר לשניים עבור WB.
- בצע BCA כדי לקבוע את ריכוז החלבון של כל דגימה, תוך התחשבות בנפח אליקוט משתנה.
הערה: עבור ניתוח WB, ריכוז החלבון הפעיל המוצע עבור כל השברים התת-תאיים הוא 2 מיקרוגרם/μL (או גבוה ככל האפשר עבור LS1 ו-MF).
תוצאות
השיטה המוצגת מביאה ל-11 שברים תת-תאיים במוח שיכולים להיות נתונים לטיהור נוסף ולצורות שונות של ניתוח במורד הזרם35,36. שיטת תקן הזהב להערכת האיכות של סינפטוזומים, SVs23 ורכיבים אחרים היא מיקרוסקופיית אלקטרונים (EM) (איור 7). ניתן גם לבצע אימונובלוטינג כמותי עבור חלבונים שנמצאים בשברים תת-תאיים ספציפיים כדי להעריך סמנים של טוהר שברים (איור 8). לדוגמה, ניתוח אימונובלוט של שברים חושף את ההעשרה של N-cadherin (CDH2, שם UniProt) בשבר קרום הפלזמה הסינפטי (SPM), α-סינוקלאין (SYUA) בציטוזול הסינפטי (LS2), סינפטופיזין (SYPH) בשבר השלפוחית הסינפטית (LP2), וחלבון בסיסי של המיאלין (MBP) בשבר המיאלין (MF) בהשוואה לרמות חלבון בהומוגנט הראשוני של המוח השלם (סה"כ) (איור 8 ). לאחר שנקבע טוהר השבר (לדוגמה, שים לב להיעדר CDH2 בשבר LS2 או לעלייה הגדולה פי כמה ב- SYPH בשבר LP2), ניתן להשתמש באימונובלוטינג כמותי כדי לקבוע את לוקליזציה של חלבונים בעלי עניין או הבדלי שאילתה בהתפלגות החלבונים בין גנוטיפים או טיפולים. הבנת הלוקליזציה התת-תאית של חלבונים סינפטיים יכולה לאפשר ניתוח של פונקציות חלבון שלא תוארו קודם לכן. יתר על כן, שיטה זו עשויה להבהיר פגמים בסחר בבני אדם או תפקוד לקוי של המערכת במצבי מחלה, במיוחד בשילוב עם מבחנים פונקציונליים. לדוגמה, הצוות שלנו השתמש בשיטה זו כדי לזהות מאגר של חלבון פלמיטואיל פעיל אנזימטית thioesterase 1 המועשר בציטוזולסינפטי 19.
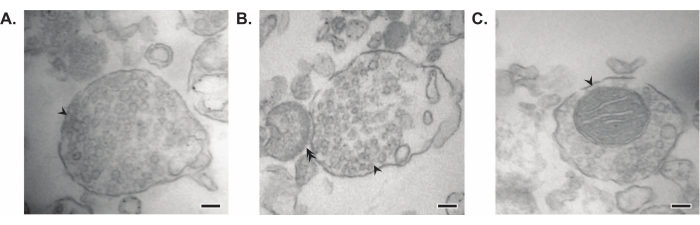
איור 7: מיקרוסקופיית אלקטרונים (EM) של סינפטוזומים. (A) תמונת EM מייצגת של סינפטוזום המכיל שלפוחיות סינפטיות (חץ). (B) תמונת EM מייצגת של סינפטוזום עם רכיבים קדם-(חץ) ופוסט-סינפטיים (חץ כפול). (C) תמונת EM מייצגת של סינפטוזום המכיל שלפוחיות סינפטיות ומיטוכונדריה (חץ) (פסי קנה מידה = 100 ננומטר). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
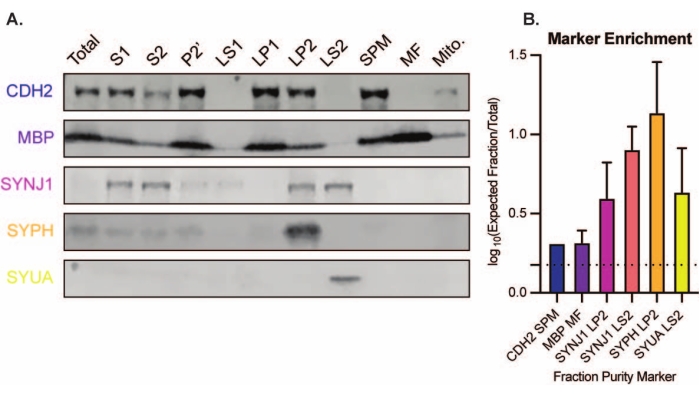
איור 8: ניתוח אימונובלוט של שברים תת-תאיים. (A) סמנים של טוהר שברים תת-תאיים (מסומנים במינוח UniProt) ממוקמים כראוי בהשוואה להומוגנט של המוח כולו (סה"כ): N-cadherin (CDH2) בשבר קרום הפלזמה הסינפטי (SPM), סינפטופיזין 1 (SYPH) וסינפטוג'אנין 1 (SYNJ1) בשבר המועשר בשלפוחית הסינפטית (LP2), α-סינוקלאין (SYUA) בציטוזול הסינפטי (LS2), וחלבון בסיסי של המיאלין (MBP) בשבר המיאלין (MF). (B) ניתוח כימות אימונובלוט חושף את ההעשרה (שינוי קיפול מסך הכל) של סמני טוהר שברים. הנתונים מיוצגים כסטיית תקן ממוצעת ± בסולם log10. הקו המקווקו מציין שינוי של פי 1.5 (y = 0.176) (n = 3 ניסויים משוכפלים עם 8 עכברים מסוג בר; גיל = חודשיים; n = 4-5 כתמים עבור SYPH, SYUA, MBP, עם n = 3 ערכים מתווכים שפורסמו בעבר על ידי Gorenberg et al.19; n = 5 עבור SYNJ1; n = 1 עבור CDH2). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
במחקרי היסוד שלהם, ויטאקר ועמיתיו השתמשו בארבעה קריטריונים מורפולוגיים כדי לזהות סינפטוזומים: (1) למבנים יש קרום פלזמה אטום; (2) המבנים מכילים SVs הדומים לאלה שבקצות העצבים ודליות באתרם בגודל ובמספר; (3) למבנים יש מיטוכונדריה קטנה אחת או יותר; ו-(4) הממברנה הקדם-סינפטית נדבקת לעתים קרובות למרכיב פוסט-סינפטי11,12,13. למרות ששני הקריטריונים הראשונים חלים בדרך כלל על כל שיטת בידוד, בפרוטוקולים האחרונים המתוארים במאמר זה, לא לכל הסינפטוזומים המתקבלים יהיו מיטוכונדריה ומסופים פוסט-סינפטיים מחוברים. כ-60% מהסינפטוזומים יהיו בעלי מיטוכונדריה, ורק עד 15% מעריכים כי הם מחוברים לטרמינלים פוסט-סינפטיים37. אם רכיבים פוסט-סינפטיים מעניינים במיוחד, ידוע כי השימוש במאגר הומוגניזציה איזוטוני דמוי קרבס וסינון לחץ להעשרה מניבים ריכוזים גבוהים של סינפטוזומים עם הדקים פוסט-סינפטיים (המכונים גם סינפטונורוזומים)22,38.
השיטה להקריב את החיה יכולה להשפיע על איכות הסינפטוזומים ותת-החלקיקים הסינפטיים. בעלי חיים בוגרים שהוקרבו בשיטת המתת חסד שאינה דורשת הרדמה יביאו לאיכות השבר הטובה ביותר. יתר על כן, יש לנתח את המוחות באופן טרי, לא להקפיא, ולהפוך אותם להומוגניים באמצעות יחס של 1:10 של חיץ הומוגניזציה (משקל/נפח) עבור השברים הסינפטיים בני הקיימא ביותר22. במוח יש אוכלוסייה הטרוגנית של סינפסות שניתן להבדיל ביניהן על ידי סוג הנוירוטרנסמיטורים שהן נושאות. היווצרות סינפטוזום בדרך כלל אינה מושפעת מסוג סינפסה או תוכן נוירוטרנסמיטר13. יוצא מן הכלל הוא סיבים טחבים במוח הקטן, אשר ידועים להיות משובשים בתנאים אופטימליים לקבלת סינפטוזומים משאר המוח39,40. לכן, הסרת המוח הקטן לפני הומוגניזציה המוח מומלץ אם ההדרה של אזור זה אינו משפיע על המטרה הניסויית. אם מעוניינים לבודד סינפטוזומים של אופי נוירוטרנסמיטר מסוים, אזורים במוח המועשרים עבור נוירונים המכילים את הנוירוטרנסמיטר של עניין יכול להיות מבודד תחילה. עם זאת, גישה זו תטיל מגבלות על תשואת השבר הסופי, בהתאם לגודל אזור העניין (גם גיל בעלי החיים הוא, אם כן, שיקול). ישנן שיטות אימונוכימיות לבידוד של סינפטוזומים ספציפיים לנוירוטרנסמיטר, אך הכדאיות והתשואה ייפגעו באופן משמעותי22. אם הערכת הכדאיות המטבולית של סינפטוזום חשובה, ניתן להשתמש במדידה של שחרור נוירוטרנסמיטר 41,42 או מבחנים אנזימטיים מסוימים43.
מזהמים נפוצים בתכשירי סינפטוזום כוללים מיקרוזומים, מיטוכונדריה חופשית, SVs וקרומים עצביים וגליאליים. ניתן להפחית את הזיהום על ידי הגדלת מספר השטיפות בשברים P1 ו- P222 והימנעות מדחייה מחדש של כדור המיטוכונדריה האדום בשלבים הבאים. בניסויים שבהם הכדאיות והזמן המטבוליים הם קריטיים, הפחתת מספר השטיפות ושימוש בשיפועים של Ficoll או Percoll על פני שיפועים של סוכרוז יעזרו44,45,46. שיטות אלה גם להפחית את הזיהום באופן משמעותי. הפרוטוקול המקורי של ויטאקר הניב SVs באיכות גבוהה. אופטימיזציה נוספת של Nagy et al.23, הכלולה בשיטה זו, מייצרת SVs עם הומוגניות וטוהר יוצאי דופן מבלי להתפשר באופן משמעותי על התשואה36. אם תת-סוגים ספציפיים של SV מעניינים, כגון גלוטמטרג'י (מכיל VGLUT-1) או GABAergic (המכיל VGAT-1) SVs, ניתן לבצע בידוד חיסוני באמצעות נוגדנים ספציפיים47,48. שיטות חלופיות זמינות גם לבידוד CCVs מסינפטוזומים, אשר, בשל צפיפות דיפרנציאלית, לא יכול להיות נוכח באותו ממשק כמו SVs שהושגו בשיטה זו20,49,50.
באופן כללי, ניתן לייעל עוד יותר את הפרוטוקול הנוכחי לבידוד רכיבים סינפטיים כדי להשיג שברים עם הומוגניות וכדאיות משופרות בהתבסס על האיכות והכמות של רקמת המוח המקורית ומטרות הניסוי. לפרטים נוספים על פתרון בעיות, יש לעיין בפרקי הספר מאת דאנקלי ורובינסון22 וגנזלה ואחרים 36.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ברצוננו להודות לפ' קולוסי על הכנת תמונת EM. עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות (R01 NS064963, SSC; R01 NS110354, SSC; R01 NS083846, SSC; R21 NS094971, SSC; T32 NS007224, SMT; T32 NS041228, SMT), משרד ההגנה של ארצות הברית (W81XWH-17-1-0564, SSC; W81XWH-19-1-0264, VDJ), יישור מדע על פני רשת המחקר השיתופית של פרקינסון (ASAP) (SSC), ותוכנית קידום המטרות של קרן מייקל ג'יי פוקס (MJFF-020160, SSC & VDJ). יצרנו איורים גרפיים באמצעות BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL TB Syringe | BD | 309649 | |
| 1.5 mL Eppendorf Tubes | USA Scientific | 1415-2500 | |
| 14 mL, Open-Top Thinwall Ultra-Clear Tube | Beckman Coulter | 344060 | Compatible with SW 40 Ti |
| 23 Gauge Precision Glide Hypodermic Needle | BD | 305145 | |
| 26.3 mL, Polycarbonate Bottle with Cap Assembly | Beckman Coulter | 355618 | Compatible with Ti70 |
| 3.5 mL, Open-Top Thickwall Polypropylene Tube | Beckman Coulter | 349623 | Compatible with TLA-100.3 |
| 50 mL Falcon Tubes | Fisher Scientific | 14-432-22 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Millipore Sigma | UFC901024 | |
| Aprotinin | Sigma-Aldrich | A6279 | 1 mg/mL in diH2O |
| Avanti J-26 XP Centrifuge | Beckman Coulter | B22984 | <26,000 rpm |
| Benchtop HDPE Dewar Flask | Thermo Scientific | 5028U19 | |
| C57BL/6J Mice | The Jackson Labs | 000664 | |
| Centrifuge 5810R | Eppendorf | EP022628168 | <14,000 rpm |
| complete, Mini, EDTA-free Protease Inhibitor Cocktail Tablets | Roche | 11873580001 | Add 1 tablet per 50 mL of solution |
| Curved Forceps | Fine Science Tools | 11273-20 | |
| Fine Surgical Scissors | Fine Science Tools | 8r | |
| Glas-Col Tissue Homogenizing System | Cole-Parmer | UX-04369-15 | |
| Graefe Forceps | Fine Science Tools | 11650-10 | |
| High-Speed Polycarbonate Round Bottom Centrifuge Tubes | ThermoFisher | 3117-0500 | Compatible with JA20 |
| Isofluorane | Henry Schein Animal Health | NDC 11695-6776-2 | |
| JA-20 Rotor | Beckman Coulter | 334831 | |
| Leupeptin | American Bio | AB01108 | 1 mg/mL in diH2O |
| N-[2-Hydroxyethyl] piperazine-N’-[2-ethanesulfonic acid] (HEPES) | American Bio | AB00892 | |
| Optima L-80 XP Ultracentrifuge | Beckman Coulter | <100,000 rpm | |
| Optima TLX Ultracentrifuge | Beckman Coulter | <120,000 rpm | |
| Pepstatin A | Thermo Scientific | 78436 | 1 mg/mL in DMSO |
| Phenylmethylsulfonyl fluoride (PMSF) | American Bio | AB01620 | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23335 | For determination of protein concentration |
| Pipette Tips | |||
| Serological Pipettes | |||
| Sucrose | Sigma-Aldrich | S0389 | |
| Surgical Scissors | Fine Science Tools | 14002-12 | |
| SW 40 Ti Swinging-Bucket Rotor | Beckman Coulter | 331301 | |
| Teflon-Coated Pestle and Mortar Tissue Grinder | Thomas Scientific | 3431D94 | |
| Ti70 Rotor | Beckman Coulter | 337922 | |
| TLA-100.3 Rotor | Beckman Coulter | 349490 | |
| Tube Revolver | Dot Scientific | DTR-02VS |
References
- Synaptic Transmission. Principles of Neural Science, Fifth Edition. Kandel, E. R., Schwartz, J. H., Jessell, T. M., Siegelbaum, S. A., Hudspeth, A. J., Education, A. J. , McGraw-Hill Education. New York, NY. (2014).
- Lepeta, K., et al. Synaptopathies: synaptic dysfunction in neurological disorders - A review from students to students. Journal of Neurochemistry. 138 (6), 785-805 (2016).
- Südhof, T. C., Malenka, R. C. Understanding synapses: Past, present, and future. Neuron. 60 (3), 469-476 (2008).
- Südhof, T. C. The molecular machinery of neurotransmitter release (Nobel lecture). Angewandte Chemie International Edition. 53 (47), 12696-12717 (2014).
- Jahn, R., Boyken, J. Molecular Regulation of Synaptic Release. Neuroscience in the 21st Century: From Basic to Clinical. Pfaff, D. W. , Springer. New York. New York, NY. 351-401 (2013).
- Xiong, H., Gendelman, H. E. Current Laboratory Methods in Neuroscience Research. , Springer. New York. New York, NY. (2014).
- Azevedo, F. A., et al. Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology. 513 (5), 532-541 (2009).
- Herculano-Houzel, S. The remarkable, yet not extraordinary, human brain as a scaled-up primate brain and its associated cost. Proceedings of the National Academy of Sciences of the United States of America. 109, 10661-10668 (2012).
- Herculano-Houzel, S., Lent, R. Isotropic fractionator: A simple, rapid method for the quantification of total cell and neuron numbers in the brain. Journal of Neuroscience. 25 (10), 2518-2521 (2005).
- Herculano-Houzel, S., Mota, B., Lent, R. Cellular scaling rules for rodent brains. Proceedings of the National Academy of Sciences of the United States of America. 103 (32), 12138-12143 (2006).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron-microscopic study of cell fragments derived by homogenization and centrifugation. Journal of Anatomy. 96, 79-88 (1962).
- Gray, E. G., Whittaker, V. P. The isolation of synaptic vesicles from the central nervous system. Journal of Physiology. 153, 35-37 (1960).
- Whittaker, V. P. Thirty years of synaptosome research. Journal of Neurocytology. 22 (9), 735-742 (1993).
- Jahn, R., Fasshauer, D. Molecular machines governing exocytosis of synaptic vesicles. Nature. 490, 201-207 (2012).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from nerve-ending particles ('synaptosomes). Biochemical Journal. 90 (2), 293-303 (1964).
- De Robertis, E., Rodriguez De Lores Arnaiz, G., Pellegrino De Iraldi, A. Isolation of synaptic vesicles from nerve endings of the rat brain. Nature. 194, 794-795 (1962).
- De Robertis, E., Pellegrino De Iraldi, A., Rodriguez, G., Gomez, C. J. On the isolation of nerve endings and synaptic vesicles. The Journal of Biophysical and Biochemical Cytology. 9 (1), 229-235 (1961).
- Zimmermann, H., Whittaker, V. P. The Discovery of the Synaptosome and Its Implications. Synaptosomes. Murphy, K. M. , Springer. New York. New York, NY. 9-26 (2018).
- Gorenberg, E. L., et al. Identification of substrates of palmitoyl protein thioesterase 1 highlights roles of depalmitoylation in disulfide bond formation and synaptic function. PLoS Biology. 20 (3), 3001590(2022).
- Vidyadhara, D. J., et al. Dopamine transporter and synaptic vesicle sorting defects initiate auxilin-linked Parkinson's disease. bioRxiv. , (2022).
- Schrimpf, S. P., et al. Proteomic analysis of synaptosomes using isotope-coded affinity tags and mass spectrometry. Proteomics. 5 (10), 2531-2541 (2005).
- Dunkley, P. R., Robinson, P. J. Synaptosome Preparations: Which Procedure Should I Use. Synaptosomes. Murphy, K. M. , Springer. New York. New York, NY. 27-53 (2018).
- Nagy, A., Baker, R. R., Morris, S. J., Whittaker, V. P. The preparation and characterization of synaptic vesicles of high purity. Brain Research. 109 (2), 285-309 (1976).
- Takamori, S., et al. Molecular anatomy of a trafficking organelle. Cell. 127 (4), 831-846 (2006).
- Wagner, J. A., Kelly, R. B. Topological organization of proteins in an intracellular secretory organelle: the synaptic vesicle. Proceedings of the National Academy of Sciences of the United States of America. 76 (8), 4126-4130 (1979).
- Jahn, R., Schiebler, W., Ouimet, C., Greengard, P. A 38,000-dalton membrane protein (p38) present in synaptic vesicles. Proceedings of the National Academy of Sciences of the United States of America. 82 (12), 4137-4141 (1985).
- Binotti, B., Jahn, R., Pérez-Lara, Á An overview of the synaptic vesicle lipid composition. Archives of Biochemistry and Biophysics. 709, 108966(2021).
- Siegel, D. P., Ware, B. R. Electrokinetic properties of synaptic vesicles and synaptosomal membranes. Biophysical Journal. 30 (1), 159-172 (1980).
- Whittaker, V. P., Michaelson, I. A., Kirkland, R. J. The separation of synaptic vesicles from disrupted nervending particles. Biochemical Pharmacology. 12 (3), 300-302 (1963).
- Clementi, F., Whittaker, V. P., Sheridan, M. N. The yield of synaptosomes from the cerebral cortex of guinea pigs estimated by a polystyrene bead "tagging" procedure. Zeitschrift für Zellforschung und Mikroskopische Anatomie. 72, 126-138 (1966).
- Carlson, S. S., Wagner, J. A., Kelly, R. B. Purification of synaptic vesicles from elasmobranch electric organ and the use of biophysical criteria to demonstrate purity. Biochemistry. 17 (7), 1188-1199 (1978).
- Huttner, W. B., Schiebler, W., Greengard, P., De Camilli, P. Synapsin I (protein I), a nerve terminal-specific phosphoprotein. III. Its association with synaptic vesicles studied in a highly purified synaptic vesicle preparation. Journal of Cell Biology. 96 (5), 1374-1388 (1983).
- Hawkins, P., et al. A guide to defining and implementing protocols for the welfare assessment of laboratory animals: eleventh report of the BVAAWF/FRAME/RSPCA/UFAW Joint Working Group on Refinement. Laboratory Animals. 45 (1), 1-13 (2011).
- Risling, T. E., Caulkett, N. A., Florence, D. Open-drop anesthesia for small laboratory animals. Canadian Veterinary Journal. 53 (3), 299-302 (2012).
- Deutsch, C., Drown, C., Rafalowska, U., Silver, I. A. Synaptosomes from rat brain: Morphology, compartmentation, and transmembrane pH and electrical gradients. Journal of Neurochemistry. 36 (6), 2063-2072 (1981).
- Ganzella, M., Ninov, M., Riedel, D., Jahn, R. Isolation of synaptic vesicles from mammalian brain. Methods in Molecular Biology. 2417, 131-145 (2022).
- Dunkley, P. R., et al. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: homogeneity and morphology of subcellular fractions. Brain Research. 441 (1-2), 59-71 (1988).
- Schwartz, R. D., Skolnick, P., Hollingsworth, E. B., Paul, S. M. Barbiturate and picrotoxin-sensitive chloride efflux in rat cerebral cortical synaptoneurosomes. FEBS Letters. 175 (1), 193-196 (1984).
- Pittaluga, A., Thellung, S., Maura, G., Raiteri, M. Characterization of two central AMPA-preferring receptors having distinct location, function and pharmacology. Naunyn-Schmiedeberg's Archives of Pharmacology. 349 (6), 555-558 (1994).
- Israël, M., Whittaker, V. P. The isolation of mossy fibre endings from the granular layer of the cerebellar cortex. Experientia. 21 (6), 325-326 (1965).
- Khvotchev, M., Lonart, G., Südhof, T. C. Role of calcium in neurotransmitter release evoked by alpha-latrotoxin or hypertonic sucrose. Neuroscience. 101 (3), 793-802 (2000).
- Lonart, G., Janz, R., Johnson, K. M., Südhof, T. C. Mechanism of action of rab3A in mossy fiber LTP. Neuron. 21 (5), 1141-1150 (1998).
- Nicholls, D. G., Sihra, T. S. Synaptosomes possess an exocytotic pool of glutamate. Nature. 321 (6072), 772-773 (1986).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nature Protocols. 3 (11), 1718-1728 (2008).
- Cotman, C. W., Matthews, D. A. Synaptic plasma membranes from rat brain synaptosomes: Isolation and partial characterization. Biochimica et Biophysica Acta. 249 (2), 380-394 (1971).
- Booth, R. F., Clark, J. B. A rapid method for the preparation of relatively pure metabolically competent synaptosomes from rat brain. Biochemical Journal. 176 (2), 365-370 (1978).
- Takamori, S., Riedel, D., Jahn, R. Immunoisolation of GABA-specific synaptic vesicles defines a functionally distinct subset of synaptic vesicles. Journal of Neuroscience. 20 (3), 4904-4911 (2000).
- Burger, P. M., et al. Synaptic vesicles immunoisolated from rat cerebral cortex contain high levels of glutamate. Neuron. 3 (6), 715-720 (1989).
- Blondeau, F., et al. Tandem MS analysis of brain clathrin-coated vesicles reveals their critical involvement in synaptic vesicle recycling. Proceedings of the National Academy of Sciences of the United States of America. 101 (11), 3833-3838 (2004).
- Maycox, P. R., Link, E., Reetz, A., Morris, S. A., Jahn, R. Clathrin-coated vesicles in nervous tissue are involved primarily in synaptic vesicle recycling. Journal of Cell Biology. 118 (6), 1379-1388 (1992).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved