Method Article
优化猪脑组织的微管蛋白产量
摘要
该协议描述了一种从猪脑中高产量分离微管蛋白的技术,该技术针对小规模仪器进行了优化。分离程序由使用共沉降测定和透射电子显微镜 在体外 测定微管蛋白聚合活性的程序补充。
摘要
任何来源的神经组织都是分离微管蛋白的极好材料,因为神经元的树突和轴突富含微管。在这里,我们提出了一种提取微管蛋白的程序,该程序可以通过稍作修改从多个来源用于神经组织。在所提出的方案中,引入了粗裂解物的新澄清步骤,这导致在第一个聚合步骤发生之前不溶性碎片的初始量显着减少。这个额外的步骤允许在使用相同的仪器的同时处理额外的组织,从而增加处理后的匀浆的相对体积。新引入的步骤对纯化的微管蛋白的质量没有显着影响, 体外活性测定 和透射电子显微镜证实了这一点。所述程序包含所有关键步骤,包括组织收集、运输、组织匀浆、微管蛋白分离循环以及使用 FPLC 和随后的活性测量分析通过离子交换色谱进行最终精纯。纯化的微管蛋白的均匀性超过 97%,这通过使用电喷雾电离和 MALDI-TOF 的 MS/MS 分析得到证实。
引言
微管是由 α 和 β 微管蛋白异二聚体形成的中空蛋白丝(直径 24 nm),参与各种重要的细胞过程。它们参与形成细胞内结构、运动、细胞分裂、细胞分化、细胞运输、形状维持和分泌1。微管的细胞功能可受与微管相关蛋白 (MAP) 和其他蛋白质的直接或间接相互作用的影响,或 受 微管蛋白编码2 中定义的复杂翻译后修饰的影响。
微管蛋白纤维产生于成核-伸长机制中 α 和 β 亚基之间的动态非共价相互作用。形成短微管,微管蛋白纤维的后续生长是通过两端的可逆伸长来实现的,形成由排列在平行原丝中的微管蛋白异二聚体组成的圆柱体2。动态不稳定性是指组装的微管通常与其亚基不平衡,但可以在延长的生长和收缩期之间发生相变,同时保持稳定状态 1,2。
微管蛋白纤维的动态不稳定性主要用于许多微管蛋白分离和纯化程序,在高纯度甘油、DMSO、GTP/ATP、Mg2+ 或其他化学试剂(如紫杉醇或聚阳离子)的环境中使用高温聚合和低温解聚循环3。大多数分离程序4 之后进行蛋白质色谱 5,6,7,8,9,这确保了具有核苷二磷酸激酶和 ATP 酶活性 5 的微管蛋白相关蛋白的分离。使用高盐缓冲液可以获得类似的结果10。多种来源,包括神经11、12、13、14 和非神经15 组织、鱼类16(淡水和海水)、酵母或在不同生产菌株11、12、13、14 和其他来源 9,18 中过表达的重组变体17 用于分级分离和纯化。
所提出的方案利用沉淀和蛋白质色谱法从猪脑中分离微管蛋白,使其高度均匀(图 1)。主要优点是使用配备常规分子生物学实验的实验室中提供的仪器实现相对较高的产量。
研究方案
材料 表中描述了所有溶液和仪器的成分。所有溶液均使用 FPLC 级化学品制备,并在使用前通过 0.22 μm 过滤器过滤。在所有操作过程中都使用个人防护设备,例如实验室外套、手套和安全眼镜。所有器械都很干净,没有洗涤剂的痕迹。在手术过程中,遵循了适当的动物护理指南(经机构批准)。所有生物材料,包括脑组织,都是从屠宰场作为原材料购买的。在该方案的任何步骤均未使用活体动物。
1. 活化磷酸纤维素柱,用于快速蛋白质液相色谱
- 将 700 mL 50% 乙醇加入 15 g 干燥的磷酸纤维素树脂中,然后用勺子在烧杯中轻轻混合。
- 将悬浮液倒入适当体积 (700 mL) 的合适色谱柱中。用装有筛块的活塞关闭色谱柱。至少留出 10% 的空头空间。
注:可以使用其他容器,但 FPLC 色谱柱与蠕动泵结合使用,可显著减少填料活化和填料损失所需的时间。 - 在摇床上以 60 rpm 孵育 30 分钟。
- 让树脂沉淀,并使用蠕动泵去除过量的 50% 乙醇,并将流速设置为 3 mL/min。不要让树脂干燥。
- 拆下顶部活塞并加入 300 mL 50% 乙醇。关闭色谱柱,短暂摇晃, 然后通过 蠕动泵去除多余的乙醇。
- 去除剩余的乙醇。向色谱柱中加入 300 mL 超纯水,用活塞关闭色谱柱,然后倾斜直至树脂重悬。使用蠕动泵去除多余的液体。重复此步骤 3 次。
- 从顶部打开色谱柱,加入 500 mL 0.5 M HCl,关闭色谱柱,然后轻轻倾斜重悬填料。在摇床上以 60 rpm 孵育 30 分钟。
- 使用蠕动泵去除多余的液体。加入 300 mL 0.5 M HCl,重悬树脂,并去除多余的液体。
- 去除剩余的 HCl。向色谱柱中加入 300 mL 超纯水,用活塞关闭色谱柱,然后倾斜直至树脂重悬。使用蠕动泵去除多余的液体。重复此步骤 3 次。
- 将 700 mL MES 缓冲液(25 mM MES、0.1 mM EGTA、0.5 mM MgCl2)倒入色谱柱中,并通过倾斜重悬树脂。将悬浮液倒入烧杯中,用 1 M NaOH 将 pH 值调节至 6.1,并在轻轻搅拌下孵育 2 小时。
- 让树脂沉淀,倒出液体,加入 300 mL MES 缓冲液,pH 值为 6.4,并在 4 °C 下孵育过夜。
- 倒出多余的液体,加入 96% 乙醇至 20% 终浓度,并在 4 °C 下储存直至使用。
2. 磷酸纤维素柱填料
- 将 12 mL 活化树脂倒入干净的色谱柱中,并用封闭的底部塞住。让树脂沉淀。沉降树脂的体积约为 5 mL。去除树脂上层(约 2-3 mm),较轻的破碎基质碎片可能会沉积在那里。
- 取下底部塞子,让储存溶液一滴一滴地自由排出。不要让树脂干燥。
- 关闭色谱柱并将其连接到 FPLC 系统。用 PEM 缓冲液(100 mM PIPES pH 6.9、1 mM EGTA、1 mM MgSO4)以 1 mL/min(最大压力 1 bar)洗涤色谱柱 30 分钟,调整活塞高度,将色谱柱倒置,并在相同条件下以反向流动洗涤色谱柱 30 分钟。
- 将装满活化磷酸纤维素的色谱柱在 4 °C 下储存数天。
3. 微管蛋白分离纯化
注意:微管蛋白极易降解,迅速进行至关重要。如有必要,应提前准备、冷却或加热所有溶液、仪器和设备。这些程序对推荐温度的变化很敏感。考虑到纯化过程中产生的生物废物量,解剖后应尽快处理脑组织。该程序针对配备 6 个 75 mL 超速离心比色皿的转头进行了优化。处理过的组织量可以根据可用的超速离心机来增加或减少。
- 组织运输
- 将 500 g 新鲜解剖的猪脑(6-8 块)放入 3 L 运输容器中,倒入冰冷的运输缓冲液(4.1 mM MES pH 7、320 mM 蔗糖、1 mM EGTA)直至完全浸入。在冰上静置 5 分钟,然后将运输缓冲液更换为新的缓冲剂以促进散热。在冰上快速运输以进行进一步加工。
- 组织匀浆
注意:组织匀浆在冷藏室的冰上进行。所有仪器都应进行预冷,以防止自发聚合。微管蛋白的主要来源是灰质,其余的在以下步骤中去除。- 将 100 mL 提取缓冲液(4.1 mM MES pH 7、520 mM 蔗糖、1 mM EGTA、1 mM ATP 和 0.1 mM GTP)倒入 1 L 塑料烧杯中,测定重量 W1 (g),包括容器。ATP 和 GTP 在使用前添加。
- 将猪脑从运输血管中取出,用手指适度用力去除整个小脑、脂肪、大块白质、脑膜和血管。也可以使用剪刀或镊子。将去除不需要组织的猪脑放入装有 100 mL 冷提取缓冲液的烧杯中。继续进行,直到处理完所有组织。
- 用加工过的脑组织称量烧杯并确定 W 2 (g) 重量。
- 根据公式添加提取缓冲液,提取缓冲液重量 = W2 - W1(例如,对于 400 g 组织,添加 300 g 额外的提取缓冲液)。
- 将含有提取缓冲液的脑组织转移到预冷的厨房搅拌机中,以 4-8 次 3 秒的短脉冲进行处理。
- 用高速分散匀浆器 (18 000 rpm) 处理部分匀浆的组织 1 分钟。将悬浮液放在冰上 3-5 分钟,偶尔用勺子混合。重复 5 次或直到完全均质化。
- 倒入预冷的超速离心管中,并在 4 °C 和 50,000 x g 下旋转 10 分钟。保留上清液并丢弃沉淀。重复直到收集到 430 mL 澄清的提取物。
- 将澄清的提取物倒入预冷的超速离心管(每个 70 mL)中,并在 4 °C 和 75,000 x g 下旋转 60 分钟。收集上清液并确定体积 S1。
注:如果只有一个转子,请在温水浴中加热,以进行下一个离心步骤 (37 °C)。
- 第一次聚合
- 根据公式 V = S1/9 mL,加入 10x MEM 缓冲液(1 M MES pH 6.8、10 mM EGTA、10 mM MgCl2)(对于 585 mL 上清液,加入 65 mL 10x MEM 缓冲液)。充分混合,加入甘油至 3.5 M,GTP 至 0.1 mM 终浓度。将悬浮液倒入超速离心管中(上清液的体积超过管的体积;其余的丢弃)。
- 将试管与上清液在 37 °C 的水浴中孵育 45 分钟。
- 将管子在 37 °C 和 75,000 x g 下旋转 90 分钟。测量上清液 (S2) 的体积以确定 MEM 缓冲液的体积,在步骤 3.3.4 中将其添加到沉淀中,然后弃去上清液。将沉淀物保存在含有聚合微管蛋白的地方。
- 准备 0.5 x S2 体积的冰冷的 1x MEM 缓冲液。将等量的 1x MEM 缓冲液加入每个装有沉淀的超速离心管中。在添加的 1x MEM 缓冲液中重悬沉淀,将悬浮液转移到量筒中,并确定总体积。
- 加入 GTP 至 1 mM 终浓度。将悬浮液转移到 Dounce 玻璃均质器中,并在冰上每 10 分钟左右匀浆溶液 45 分钟。活塞需要小心操作,因为它很容易断裂。
注意: 同时,将转子放入加冰的水中冷却。
- 加入 GTP 至 1 mM 终浓度。将悬浮液转移到 Dounce 玻璃均质器中,并在冰上每 10 分钟左右匀浆溶液 45 分钟。活塞需要小心操作,因为它很容易断裂。
- 将均质溶液倒入预冷的超速离心管中,并在 75,000 x g 和 4 °C 下旋转 60 分钟。离心后,测定上清液体积 (S3)。
- 第二次聚合
- 将上清液与 0.35 x S3 mL 甘油混合,并添加 GTP 至 1 mM 终浓度。将上清液倒入超速离心管中,并在 37 °C 下孵育 45 分钟。
注意: 同时,在水浴中将转子预热至 37 °C。 - 将步骤 3.4.1 中的聚合上清液以 75,000 x g 和 37 °C 离心 60 分钟。 确定上清液 (S4) 的体积。
注意: 这是一个可选的停止点。含微管蛋白的沉淀可在液氮中速冻并储存在 -80 °C 下。 - 让冷冻颗粒在冰上缓慢解冻 30 分钟。准备 0.25 x S4 mL 的 PIPES 缓冲液(500 mM PIPES pH 6.9、1 mM EGTA、1 mM MgSO4、1 mM DTT、0.1 mM ATP),均匀分成装有颗粒的试管中,用勺子重悬沉淀,并将溶液转移到 Dounce 玻璃匀浆器中。在冰上每 10 分钟匀浆 45 分钟。
注意: 同时,将转子放入加冰的水中冷却。 - 将含有解聚微管蛋白的溶液倒入超速离心管中,并在 4°C 和 75,000 x g 下旋转 60 分钟。
- 将上清液与 0.35 x S3 mL 甘油混合,并添加 GTP 至 1 mM 终浓度。将上清液倒入超速离心管中,并在 37 °C 下孵育 45 分钟。
- 第三聚合
- 确定上清液 (S5) 的体积并加入 S5/9 mL 的 DMSO。将悬浮液倒入超速离心管中,并在 37 °C 下孵育 20 分钟以聚合。
注意:同时,在水浴中将转子加热至 30 °C。 - 将聚合微管蛋白在 75,000 x g 和 30 °C 下离心 60 分钟。 确定上清液 (S6) 的体积并保留沉淀。
- 将沉淀溶解在 0.25 x S6 mL 的 PEM 缓冲液(100 mM PIPES pH 6.9、1 mM EGTA、1 mM MgSO4、1 mM DTT、0.1 mM ATP)中。使用 Dounce 玻璃均质器增强增溶性。继续添加 PEM 缓冲液,直到颗粒完全溶解(不再可见乳白色颗粒)。
- 确定上清液 (S5) 的体积并加入 S5/9 mL 的 DMSO。将悬浮液倒入超速离心管中,并在 37 °C 下孵育 20 分钟以聚合。
- 离子交换层析纯化
注:采用反向离子交换色谱法去除微管蛋白相关蛋白。微管蛋白在给定的 pH 值下自由流过色谱柱,污染蛋白保留在磷酸纤维素树脂上。所有步骤均在接近 4°C 的温度下或在冰上进行。在 FPLC 纯化之前,不要通过过滤或离心澄清微管蛋白提取物。 - 用 PEM 缓冲液(100 mM PIPES pH 6.9、1 mM EGTA、1 mM MgSO4、1 mM DTT、0.1 mM ATP)平衡 FPLC 和色谱柱。至少使用 10 个柱体积进行平衡。泵流速不应超过用于色谱柱填充的流速 (1 mL/min)。
- 将微管蛋白悬浮液缓慢 (0.5 mL/min) 上样到色谱柱上,并收集流经填料的未结合蛋白。
- 向含有微管蛋白的每 1 mL 级分中加入 10 μL 100 mM GTP。
- 在液氮中冷冻含有微管蛋白的馏分,并立即将其转移到装有液氮的容器中。在这些条件下,微管蛋白可以储存数年。如果微管蛋白在 - 80 °C 下储存,稳定性会在几个月内迅速下降。
结果
在分离和纯化步骤中,采集样品进行 SDS-PAGE 电泳,随后使用考马斯蓝染色进行分析(图 2)。将每个样品的 20 μL 与 10 μL Laemmli 样品缓冲液(188 mM Tris-HCl pH 6.8、3% SDS (w/w)、30% 甘油 (v/v)、0.01 溴酚蓝 (w/w)、15% β-巯基乙醇)混合,并在 95 °C 下孵育 15 分钟。将每个样品 4 μL 上样到 12.5% 丙烯酰胺 SDS 凝胶上,并在还原和变性条件下以每块凝胶 30 mA 的恒定电流分离。
结果证实,相对微管蛋白浓度的增量增加伴随着污染蛋白的减少。此外,与省略此步骤相比,在第一次离心(步骤 3.2.7)中澄清裂解物中没有微管蛋白的显着损失(图 2A、B)。
使用三种独立方法测定蛋白质浓度:BCA 测定、Bradford 蛋白测定和 SDS-PAGE 凝胶密度测定分析19 (图 3)。使用所述程序的微管蛋白总产量为 250 g 神经组织中纯化的 123 mg 微管蛋白。在测量过程中,有必要考虑到储存缓冲液中的高 DTT 浓度对 BCA 测定有重大影响。PEM 缓冲液和 PBS 缓冲液在添加 DTT 的情况下,背景吸光度增加了约 0.900 A595,这显着降低了 BCA 测定的容量(图 3A)。即使用纯水稀释 10 倍后,也可以检测到 DTT 的负面影响(数据未显示)。Bradford 测定似乎不受储存缓冲液的影响(图 3B),光密度测定分析证实了这一点。
微管蛋白制剂的纯度在两个独立的设施(VRI Brno,捷克共和国;CEITEC MU Brno,捷克共和国)使用电喷雾电离和 MALDI-TOF。两项分析均证实猪微管蛋白 α 和 β 存在于几种亚型中。总纯度超过 97.07% (PSMs 1065),其中最普遍的杂质来自 智人 角蛋白 II 型(PSMs 246,占杂质的 2.24%),这些杂质很可能是在微管蛋白分离和 MS/MS 分析样品制备过程中引入的。其他杂质由 322 个 PSM 组成,仅对源自 Sus scrofa 的血清白蛋白、肌动蛋白 γ 和胰蛋白酶原进行鉴定,肽分离度为 1 (0.0069%)。
在随后的实验中,验证了快速冷冻和储存在液氮中后聚合能力的保持。从液氮中取出 10 mg/mL 等分试样,并在冰上缓慢解冻。通过在含有 DTT 、 ATP 和 GTP 的 PEM 缓冲液中稀释等分试样,制备不同浓度 (10 mg/mL、8 mg/mL、6 mg/mL、4 mg/mL 和 2 mg/mL) 的样品,用于自组装实验。将一个稀释系列在 37 °C 下孵育 60 分钟,第二个稀释系列在冰上孵育 60 分钟。两个系列均在 21,000 x g 和 相应温度(4 °C 或 37 °C)下离心 60 分钟。除去 30 μL 上清液,用于 SDS-PAGE。用移液管小心地除去剩余的上清液并丢弃。通过加入 100 μM PEM 缓冲液短暂洗涤沉淀,然后立即使用移液管去除。随后,将沉淀重悬于 50 μL 1x 浓缩 SDS 上样缓冲液中,以保留沉淀和上清液的相对浓度。向每个上清液中加入 10 μL SDS 上样缓冲液。使用 SDS-PAGE 和考马斯染色分析所有样品(图 4)。根据起始浓度调整加载到 SDS-PAGE 的每个样品的体积,因此浓度引起的沉淀差异更加明显。微管蛋白在 PEM 缓冲液中的自组装测试证实了以温度依赖性方式形成微管蛋白纤维的能力。
进行了 MAP2c 驱动的微管蛋白 20,21 组装试验,验证了微管蛋白与其他蛋白质相互作用的能力22。制备 MAP2c 的梯度稀释液,其中 100 μL 1 mg/mL 微管蛋白等分试样与 MAP2c 混合,最终浓度范围为 0 μM 至 8 μM。所有样品均在冰上制备,用新鲜制备的含有 1 mM DTT 和 1 mM GTP 的 PEM 缓冲液稀释。将微管蛋白在 37 °C 下与不同浓度的 MAP2c 一起孵育 15 分钟,然后在 21,000 x g 和 37 °C 下离心 60 分钟。 用 100 μL PEM 缓冲液对沉淀进行两次最终洗涤。该实验证实了制备的微管蛋白进行 MAP2c 驱动聚合的能力,因为只有没有 MAP2c 的样品不会形成沉淀(图 5)。
透射电子显微镜进一步用于确认共聚实验中微管蛋白丝的存在。使用阴性染色制备用 MAP2c 沉淀的纯化微管蛋白的悬浮液,用于透射电子显微镜检查。样品被吸附到 Formvar 涂层、碳稳定的铜网格上。然后用 2% NH4MoO4 对网格进行负染色,并在电子显微镜下以 18,000 倍放大倍率和 80 kV 的加速电压进行检查。具有清晰丝状结构和适当大小的均匀微管的存在表明能够以天然构象形成微管(图 6)。
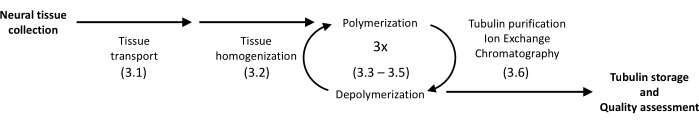
图 1:微管蛋白分离和纯化的示意图。 括号中的数字表示协议步骤。 请单击此处查看此图的较大版本。
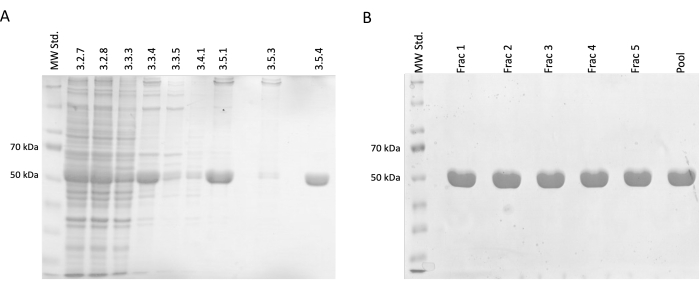
图 2:微管蛋白分离和纯化。 (A) 利用温度驱动聚合法(每条线 3 μL)分离微管蛋白期间采集的样品的 SDS-PAGE 分析。可见杂质减少,相对微管蛋白丰度(约 50 kDa)稳定增加。每行上方的数字对应于协议中的步骤编号。(B) 对磷酸纤维素树脂(每条线 4 μL)进行蛋白质色谱后获得的馏分进行 SDS-PAGE 分析。 请单击此处查看此图的较大版本。
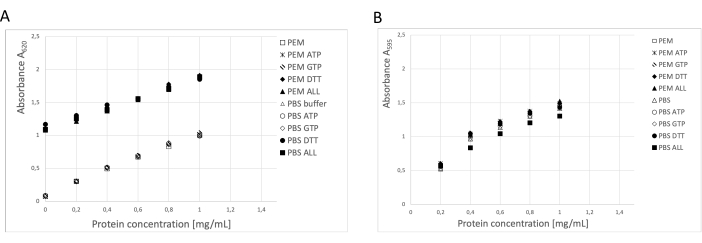
图 3:蛋白质浓度。 将高达 1 mg/mL 的牛血清白蛋白在 PEM 缓冲液或 PBS 中的稀释系列与在 PEM 或 PBS 缓冲液中单独或组合含有 0.1 ATP、1 mM GTP、1 mM DTT(0.1 mM ATP、1 mM GTP 和 1 mM DTT)的 BSA 稀释系列进行比较。(A) 当使用 BCA 分析时,含有 DTT(实线符号)的样品的背景发生了显著变化。(B) 在 Bradford 测定中测量浓度时未检测到这种效应。 请单击此处查看此图的较大版本。
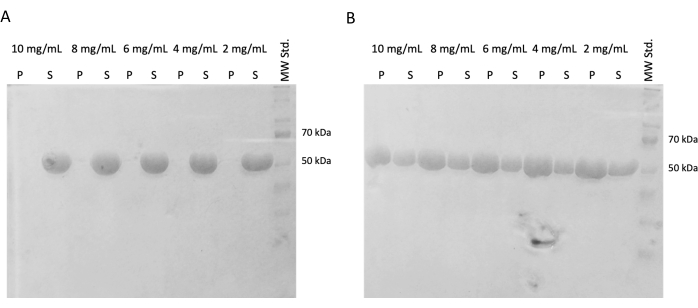
图 4:微管蛋白自组装测定。 自组装测定的 SDS-PAGE 分析证实了在 (A) 4 °C 或 (B) 37 °C 下孵育的储存微管蛋白在宽浓度下以温度依赖性方式聚合的能力。(P - 沉淀,S - 上清液;微管蛋白的相应浓度表示在每对线上方;每个样品的上样量为 10 μg)。 请单击此处查看此图的较大版本。
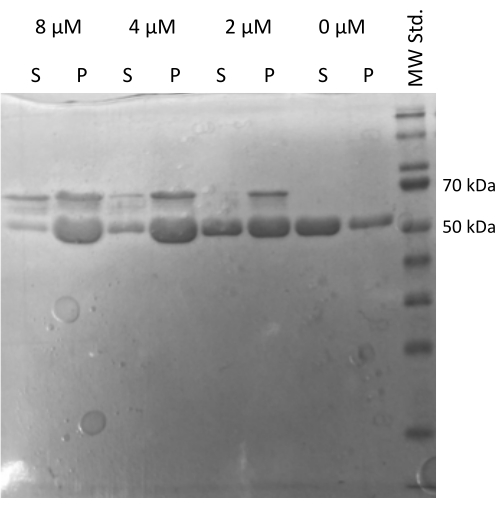
图 5:微管蛋白共沉降测定。 MAP2c 辅助微管蛋白组装的 SDS-PAGE 分析证实了储存的微管蛋白以浓度依赖性方式与微管相关蛋白相互作用驱动的聚合反应的能力。MAP2c 的摩尔浓度显示在每行上方。(P - 沉淀,S - 上清液)。 请单击此处查看此图的较大版本。
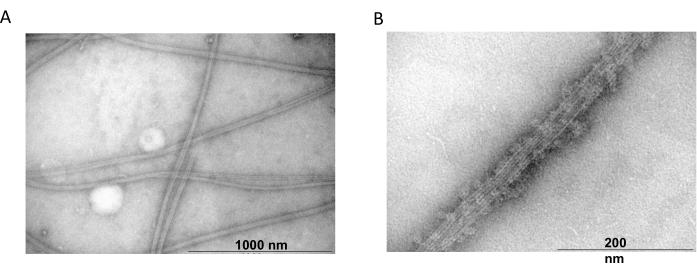
图 6:透射电子显微镜。 TEM 显微照片显示,微管蛋白组装 (A) 成适当直径 (B) 的微管,该微管由用 MAP2c 蛋白修饰的均质微管蛋白丝组成。该条对应于 1000 nm (A) 和 200 nm (B)。 请单击此处查看此图的较大版本。
讨论
任何来源的神经组织都是分离微管蛋白的极好材料,因为神经元的树突和轴突富含微管(高达 40%)23。足够数量的脑组织可以相对容易地获得。主要缺点可能是翻译后修饰水平不明确,这可能会影响后续实验24,25。否则,唯一需要担心的是原料的快速降解,尤其是在温暖的条件下。我们采用了几次转移缓冲交换,以增强运输前的散热,并迅速运输以进行处理,并尽快开始处理。在无法加热的条件下解剖新鲜组织,并在含有 GTP 和甘油的缓冲液中匀浆,从而进一步稳定微管蛋白26。
在所提出的方案中,引入了粗裂解物的澄清步骤(步骤 3.2.7)。通常不建议在第一次聚合之前长时间离心,因为微管蛋白对不可逆修饰和蛋白酶敏感。另一方面,目前的实验表明,在高 G 力下短时间旋转可减少碎片,从而增加加工匀浆的相对体积,而不会显着影响微管蛋白质量。
精确的蛋白质浓度测定对于进一步的实验至关重要,主要是在研究与微管蛋白结合蛋白或抑制剂的相互作用时。在调查过程中,我们遇到了蛋白质浓度测定结果的显着差异。主要原因是高浓度 DTT 、 GTP 和 ATP 的存在干扰了分析。由于储存缓冲液中 DTT 含量高,BCA 测定移至上限,从而降低了测定容量。此外,蛋白质与 ATP 或 GTP 的相似最大吸光度导致使用 280 nm 处的吸光度测定蛋白质浓度不一致。在 FPLC UV 检测器的读数中也存在同样的问题。最可靠且结果稳定的测定是 Bradford 蛋白测定,其中未观察到缓冲化合物的影响。然而,必须在储存缓冲液中制备蛋白质标准品稀释系列。
纯化的微管蛋白产生适当排列的能力是后续实验的先决条件。从本质上讲,即使在富含甘油-GTP 的环境中,微管蛋白也极易降解,导致形成均匀细丝的能力降低。遵循纯化过程并通过实验验证储存的微管蛋白聚合成稳定规则细丝的能力至关重要。在体内和体外已经引入了几种验证微管蛋白状态的独立方法。其中最突出的是圆二色光谱27、表面等离激元共振测定28、热位移测定29、聚合抑制测定30、免疫荧光染色31,32、共沉淀22,33 和透射电子显微镜分析32可以提到。该方案中使用的微管蛋白的聚合测定和共沉淀易于执行。它们可以通过出现在试管底部的沉淀或使用 SDS-PAGE 快速评估。另一方面,沉淀的微管蛋白可以是聚集体的形式。必须包括更复杂的方法,例如透射电子显微镜,以确认微管纤维的存在以进行质量控制。
披露声明
作者没有什么可披露的。
致谢
该研究得到了捷克共和国技术局(项目 nr.TN02000017 - 国家兽医生物技术中心 - NaCeBiVet)。
材料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
参考文献
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 1 The Biology o 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62(2018).
- Ti, S. -C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011(2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826(2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Lazar, I. GelAnalyzer 19.1. , Available from: www.gelanalyzer.com (2024).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105(2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207(2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605(2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392(2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。