Method Article
Optimización del rendimiento de tubulina a partir de tejido cerebral porcino
En este artículo
Resumen
Este protocolo describe una técnica para el aislamiento de alto rendimiento de tubulina del cerebro porcino optimizada para instrumentación a pequeña escala. Los procedimientos de aislamiento se complementan con procedimientos para determinar la actividad de polimerización de la tubulina in vitro mediante ensayos de cosedimentación y microscopía electrónica de transmisión.
Resumen
El tejido neural de cualquier fuente es un material excelente para el aislamiento de tubulina, ya que las dendritas y los axones de las neuronas son ricos en microtúbulos. Aquí, presentamos un procedimiento para extraer tubulina que se puede emplear, con pequeñas modificaciones, para el tejido neural de múltiples fuentes. En el protocolo presentado, se ha introducido un nuevo paso de clarificación del lisado de crudo, lo que condujo a una reducción significativa en la cantidad inicial de desechos insolubles antes de que ocurriera el primer paso de polimerización. Este paso adicional permitió el procesamiento de tejido adicional utilizando la misma instrumentación y, por lo tanto, aumentando el volumen relativo del homogeneizado procesado. El paso recién introducido no tiene un efecto significativo en la calidad de la tubulina purificada, como lo confirman los ensayos de actividad in vitro y la microscopía electrónica de transmisión. El procedimiento descrito contiene todos los pasos cruciales, incluida la recolección de tejidos, el transporte, la homogeneización de tejidos, los ciclos de aislamiento de tubulina y el pulido final mediante cromatografía de intercambio iónico mediante FPLC y ensayos de medición de actividad posteriores. La homogeneidad de la tubulina purificada fue superior al 97%, como se confirmó mediante el análisis MS/MS utilizando ionización por electrospray y MALDI-TOF.
Introducción
Los microtúbulos, filamentos de proteínas huecas (24 nm de diámetro) formados por heterodímeros de alfa y beta-tubulina, participan en diversos procesos celulares esenciales. Participan en la formación de estructuras intracelulares, la motilidad, la división celular, la diferenciación celular, el transporte celular, el mantenimiento de la forma y la secreción1. Las funciones celulares de los microtúbulos pueden verse afectadas por interacciones directas o indirectas con proteínas asociadas a microtúbulos (MAP) y otras proteínas , o a través de complejas modificaciones postraduccionales definidas en el código de tubulina2.
Las fibras de tubulina surgen de interacciones dinámicas no covalentes entre subunidades alfa y beta en el mecanismo de nucleación-elongación. Se forman microtúbulos cortos, y el crecimiento posterior de las fibras de tubulina se logra mediante elongación reversible en ambos extremos, formando cilindros formados por heterodímeros de tubulina dispuestos en protofilamentos paralelos2. La inestabilidad dinámica se refiere al hecho de que los microtúbulos ensamblados a menudo no están en equilibrio con sus subunidades, pero pueden sufrir una transición de fase entre un período prolongado de crecimiento y contracción mientras se mantiene un estado estacionario 1,2.
La inestabilidad dinámica de las fibras de tubulina se utiliza principalmente en muchos procedimientos de separación y purificación de tubulina que utilizan ciclos de polimerización a alta temperatura y despolimerización a baja temperatura en el entorno de glicerol de alta pureza, DMSO, GTP / ATP, Mg2+ u otros agentes químicos (como taxol o policationes)3. La mayoría de los procedimientos de separación4 son seguidos por cromatografía de proteínas 5,6,7,8,9, que asegura la separación de las proteínas asociadas a la tubulina con actividad de nucleósido difosfoquinasa y ATPasa 5. Se pueden obtener resultados similares utilizando tampones con alto contenido de sal10. Para el fraccionamiento se utilizaron múltiples fuentes, incluyendo tejidos neuronales 11,12,13,14 y no neurales 15, peces16 (tanto de agua dulce como marinos), levaduras o variantes recombinantes17 sobreexpresadas en diferentes cepas de producción 11,12,13,14, y otras fuentes 9,18 y otras fuentes 9,18 purificación.
El protocolo presentado utiliza precipitación y cromatografía de proteínas para aislar la tubulina del cerebro porcino en alta homogeneidad (Figura 1). La principal ventaja es un rendimiento relativamente alto logrado con la instrumentación disponible en laboratorios equipados para experimentos rutinarios de biología molecular.
Protocolo
La composición de todas las soluciones e instrumentación se describe en la Tabla de Materiales. Todas las soluciones se prepararon utilizando productos químicos de grado FPLC y se filtraron a través de un filtro de 0,22 μm antes de su uso. Se utilizó equipo de protección personal, por ejemplo, bata de laboratorio, guantes y gafas de seguridad, durante todas las operaciones. Todos los instrumentos estaban limpios y libres de restos de detergentes. Durante los procedimientos, se siguieron las pautas de cuidado de los animales apropiadas (aprobadas por la institución). Todo el material biológico, incluido el tejido cerebral, se compraba en un matadero como materia prima. No se utilizaron animales vivos en ninguna etapa del protocolo.
1. Activación de una columna de fosfocelulosa para cromatografía líquida rápida de proteínas
- Añadir 700 ml de etanol al 50% a 15 g de resina de fosfocelulosa seca y mezclar suavemente en el vaso de precipitados con una cuchara.
- Vierta la suspensión en una columna cromatográfica adecuada de volumen adecuado (700 mL). Cierre la columna con pistones equipados con fritas. Deje al menos el 10% del espacio libre para la cabeza.
NOTA: Se pueden utilizar otros recipientes, pero la columna FPLC, en combinación con una bomba peristáltica, reduce significativamente el tiempo necesario para la activación de la resina y las pérdidas de resina. - Incubar en un agitador de balancines a 60 rpm durante 30 min.
- Deje que la resina se asiente y elimine el exceso de etanol al 50% utilizando la bomba peristáltica con el flujo ajustado a 3 mL/min. No dejes que la resina se seque.
- Retire el pistón superior y agregue 300 mL de etanol al 50%. Cierre la columna, agítela brevemente y elimine el exceso de etanol a través de una bomba peristáltica.
- Retire el etanol restante. Agregue 300 ml de agua ultrapura en la columna, cierre la columna con el pistón e incline hasta que la resina se vuelva a suspender. Elimine el exceso de líquido con una bomba peristáltica. Repita este paso tres veces.
- Abra la columna en la parte superior, agregue 500 mL de HCl de 0,5 M, cierre la columna y vuelva a suspender la resina inclinándola suavemente. Incubar en un agitador de balancines a 60 rpm durante 30 min.
- Elimine el exceso de líquido con una bomba peristáltica. Añadir 300 mL de HCl 0,5 M, resuspender la resina y eliminar el exceso de líquido.
- Agregue 300 mL de agua ultrapura en la columna, cierre la columna con el pistón e incline hasta que la resina se vuelva a suspender. Elimine el exceso de líquido con una bomba peristáltica. Repita este paso tres veces.
- Vierta los 700 mL de tampón MES (25 mM MES, 0,1 mM EGTA, 0,5 mM MgCl2) en la columna y vuelva a suspender la resina inclinándola. Vierta la suspensión en el vaso de precipitados, ajuste el pH a 6,1 con 1 M de NaOH y deje incubar durante 2 h con una agitación suave.
- Dejar reposar la resina, decantar el líquido, añadir 300 mL de tampón MES, pH 6,4, e incubar toda la noche a 4 °C.
- Decantar el exceso de líquido, añadir etanol al 96% hasta una concentración final del 20% y almacenar a 4 °C hasta su uso.
2. Empaquetadura de columna de fosfocelulosa
- Vierta 12 mL de resina activada en la columna cromatográfica limpia con un tapón de fondo cerrado. Deja que la resina se asiente. El volumen de resina sedimentada es de unos 5 mL. Retire la capa superior de resina (aproximadamente 2-3 mm) donde podrían depositarse fragmentos de matriz rotos más ligeros.
- Retire el tapón inferior y deje que la solución de almacenamiento se drene libremente, gota a gota. No dejes que la resina se seque.
- Cierre la columna y conéctela al sistema FPLC. Lavar la columna con tampón PEM (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4) a 1 mL/min (presión máx. 1 bar) durante 30 min, ajustar la altura del pistón, dar la vuelta a la columna y lavar la columna en las mismas condiciones durante los siguientes 30 min en el flujo inverso.
- Almacene la columna llena de fosfocelulosa activada a 4 °C durante varios días.
3. Separación y purificación de la tubulina
NOTA: La tubulina es muy propensa a la degradación y es crucial proceder rápidamente. Todas las soluciones, instrumentos y equipos deben prepararse, enfriarse o calentarse, si es necesario, con anticipación. Los procedimientos son sensibles a los cambios en las temperaturas recomendadas. El tejido cerebral debe procesarse tan pronto como sea posible después de la disección, teniendo en cuenta la cantidad de desechos biológicos producidos durante la purificación. El procedimiento se optimizó para el rotor con seis cubetas de ultracentrifugación de 75 mL. La cantidad de tejido procesado se puede aumentar o disminuir de acuerdo con la ultracentrífuga disponible.
- Transporte de tejidos
- Coloque 500 g de cerebros porcinos recién diseccionados (6-8 piezas) en un recipiente de transporte de 3 L y vierta el tampón de transporte helado (4,1 mM MES pH 7, 320 mM Sacarosa, 1 mM EGTA) hasta que esté completamente sumergido. Deje reposar sobre hielo durante 5 min y cambie el tampón de transporte por uno nuevo para facilitar la disipación del calor. Transporte rápido sobre hielo para su posterior procesamiento.
- Homogeneización de tejidos
NOTA: La homogeneización de tejidos se realiza sobre hielo en una cámara frigorífica. Todos los instrumentos deben estar preenfriados para evitar la polimerización espontánea. La fuente principal de tubulina es la materia gris, y el resto se elimina en los siguientes pasos.- Vierta 100 mL de tampón de extracción (4,1 mM MES pH 7, 520 mM de sacarosa, 1 mM de EGTA, 1 mM de ATP y 0,1 mM de GTP) en un vaso de precipitados de plástico de 1 L y determine el peso W1 (g) incluyendo el recipiente. ATP y GTP se añaden justo antes del uso.
- Saque el cerebro porcino del recipiente de transporte y extraiga todo el cerebelo, la grasa, los grandes trozos de materia blanca, las meninges y los vasos sanguíneos con los dedos aplicando una fuerza modesta. También se pueden utilizar tijeras o pinzas. Coloque los sesos porcinos rayados de tejido no deseado en el vaso de precipitados con 100 ml de tampón de extracción en frío. Proceda hasta que se procese todo el tejido.
- Pese el vaso de precipitados con tejido cerebral procesado y determine el peso W2 (g).
- Agregue el tampón de extracción de acuerdo con la fórmula, peso del tampón de extracción = W2 - W1 (por ejemplo, para 400 g de tejido, se agregan 300 g de tampón de extracción adicional).
- Transfiera el tejido cerebral con tampón de extracción a la licuadora de cocina preenfriada y procese en 4-8 pulsos cortos de tres segundos.
- Procese el tejido parcialmente homogeneizado con un homogeneizador de dispersión de alta velocidad (18 000 rpm) durante 1 min. Deje la suspensión en hielo durante 3-5 minutos, mezclando ocasionalmente con una cuchara. Repita cinco veces o hasta completar la homogeneización.
- Verter en tubos de ultracentrifugación preenfriados y centrifugar durante 10 min, a 4 °C y 50.000 x g. Guarde el sobrenadante y deseche el pellet. Repita hasta recoger 430 mL de extracto clarificado.
- Verter el extracto clarificado en tubos de ultracentrifugación preenfriados (70 mL cada uno) y centrifugar a 4 °C y 75.000 x g durante 60 min. Recoja el sobrenadante y determine el volumen S1.
NOTA: Si solo existe un rotor, caliéntelo en un baño de agua tibia para el siguiente paso de centrifugación (37 °C).
- Primera polimerización
- Añadir 10x tampón MEM (1 M MES pH 6,8, 10 mM EGTA, 10 mM MgCl2) según la fórmula V = S1/9 mL (para 585 mL de sobrenadante, añadir 65 mL de tampón MEM 10x). Mezclar bien y añadir glicerol a 3,5 M y GTP a 0,1 mM de concentración final. Verter la suspensión en tubos de ultracentrifugación (el volumen de sobrenadante supera el volumen de los tubos; el resto se desecha).
- Incubar los tubos con el sobrenadante en un baño de agua durante 45 min a 37 °C.
- Girar los tubos durante 90 min a 37 °C y 75.000 x g. Mida el volumen del sobrenadante (S2) para determinar el volumen del tampón MEM, agréguelo a los gránulos en el paso 3.3.4 y luego deseche el sobrenadante. Mantenga el pellet donde está contenida la tubulina polimerizada.
- Prepare un volumen de 0,5 x S2 de búfer MEM helado 1x. Agregue una cantidad igual de 1x tampón MEM en cada tubo de ultracentrífuga con el pellet. Vuelva a suspender los gránulos en el tampón MEM 1x agregado, transfiera las suspensiones al cilindro graduado y determine el volumen total.
- Añadir GTP a la concentración final de 1 mM. Transfiera la suspensión a un homogeneizador de vidrio Dounce y homogeneice la solución cada 10 minutos aproximadamente durante 45 minutos en hielo. El pistón debe operarse con cuidado, ya que puede romperse fácilmente.
NOTA: Mientras tanto, enfríe el rotor en agua con hielo.
- Añadir GTP a la concentración final de 1 mM. Transfiera la suspensión a un homogeneizador de vidrio Dounce y homogeneice la solución cada 10 minutos aproximadamente durante 45 minutos en hielo. El pistón debe operarse con cuidado, ya que puede romperse fácilmente.
- Verter la solución homogeneizada en tubos de ultracentrifugación preenfriados y centrifugar a 75.000 x g y 4 °C durante 60 min. Después de la centrifugación, determine el volumen del sobrenadante (S3).
- Segunda polimerización
- Mezclar el sobrenadante con los 0,35 x S3 mL de glicerol y añadir GTP hasta 1 mM de concentración final. Verter el sobrenadante en tubos de ultracentrifugación e incubar durante 45 min a 37 °C.
NOTA: Mientras tanto, caliente el rotor a 37 °C en el baño de agua. - Centrifugar el sobrenadante polimerizado del paso 3.4.1 durante 60 min a 75.000 x g y 37 °C. Determine el volumen del sobrenadante (S4).
NOTA: Este es un punto de parada opcional. El pellet con tubulina puede congelarse en nitrógeno líquido y almacenarse a -80 °C. - Deje que los gránulos congelados se descongelen lentamente en hielo durante 30 minutos. Prepare 0,25 x S4 mL de tampón PIPES (500 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP), divida uniformemente en tubos con gránulos, vuelva a suspender los gránulos con una cuchara y transfiera la solución a un homogeneizador de vidrio Dounce. Homogeneizar cada 10 min en hielo durante 45 min.
NOTA: Mientras tanto, enfríe el rotor en agua con hielo. - Verter la solución con tubulina despolimerizada en tubos de ultracentrifugación y centrifugar durante 60 min a 4 °C y 75.000 x g.
- Mezclar el sobrenadante con los 0,35 x S3 mL de glicerol y añadir GTP hasta 1 mM de concentración final. Verter el sobrenadante en tubos de ultracentrifugación e incubar durante 45 min a 37 °C.
- Tercera polimerización
- Determine el volumen de sobrenadante (S5) y agregue S5/9 mL de DMSO. Vierta la suspensión en tubos de ultracentrifugación e incube durante 20 minutos a 37 °C para polimerizar.
NOTA: Mientras tanto, caliente el rotor a 30 °C en el baño de agua. - Centrifugar la tubulina polimerizada durante 60 min a 75.000 x g y 30 °C. Determine el volumen de sobrenadante (S6) y conserve los pellets.
- Disolver los pellets en 0,25 x S6 mL de tampón PEM (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP). Utilice un homogeneizador de vidrio Dounce para mejorar la solubilización. Siga añadiendo tampón PEM hasta que los gránulos se disuelvan por completo (ya no se ven partículas opalescentes).
- Determine el volumen de sobrenadante (S5) y agregue S5/9 mL de DMSO. Vierta la suspensión en tubos de ultracentrifugación e incube durante 20 minutos a 37 °C para polimerizar.
- Purificación por cromatografía de intercambio iónico
NOTA: La cromatografía de intercambio iónico inverso se emplea para eliminar las proteínas asociadas a la microtubulina. La tubulina fluye libremente a través de la columna a un pH dado, y las proteínas contaminantes se retienen en la resina de fosfocelulosa. Todos los pasos se realizan a temperaturas cercanas a los 4 °C o sobre hielo. No clarificar el extracto de tubulina antes de la purificación por FPLC, ya sea por filtración o centrifugación. - Equilibrar el FPLC y la columna con el tampón PEM (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP). Utilice al menos 10 volúmenes de columna para el equilibrio. El caudal de la bomba no debe exceder el caudal utilizado para el empaquetamiento de la columna (1 mL/min).
- Cargue la suspensión de tubulina lentamente (0,5 mL/min) en la columna y recoja la proteína no unida que fluye a través de la resina.
- Añadir 10 μL de 100 mM GTP a cada fracción de 1 mL que contenga la proteína tubulina.
- Congele las fracciones que contengan tubulina en nitrógeno líquido y transfiéralas inmediatamente al recipiente con nitrógeno líquido. La tubulina puede almacenarse durante varios años en estas condiciones. La estabilidad disminuye rápidamente a lo largo de varios meses si la tubulina se almacena a -80 °C.
Resultados
Durante las etapas de separación y purificación, se tomaron muestras para la electroforesis SDS-PAGE y posteriormente se analizaron mediante tinción con azul de Coomassie (Figura 2). Se mezclaron 20 μL de cada muestra con 10 μL de tampón de muestra Laemmli (188 mM de Tris-HCl pH 6,8, 3% SDS (p/p), 30% glicerol (v/v), 0,01 azul de bromofenol (p/p), 15% β-mercaptoetanol) y se incubaron a 95 °C durante 15 min. Se cargaron 4 μL de cada muestra en gel SDS de acrilamida al 12,5% y se separaron bajo una corriente constante de 30 mA por gel en condiciones reductoras y desnaturalizantes.
Los resultados confirmaron un aumento incremental en la concentración relativa de tubulina acompañado de una reducción de las proteínas contaminantes. Además, no hubo una pérdida significativa de tubulina en el lisado clarificado en la primera centrifugación (paso 3.2.7) en comparación con la omisión de este paso (Figura 2A,B).
La concentración de proteína se determinó utilizando tres métodos independientes: ensayo de BCA, ensayo de proteína de Bradford y análisis de densitometría en gel SDS-PAGE19 (Figura 3). El rendimiento total de tubulina utilizando el procedimiento descrito fue de 123 mg de tubulina purificada a partir de 250 g de tejido neural. Durante las mediciones, es necesario tener en cuenta que la alta concentración de DTT en el tampón de almacenamiento tiene un impacto significativo en el ensayo BCA. Tanto el tampón PEM como el tampón PBS, con la adición de DTT, aumentan la absorbancia de fondo en aproximadamente 0,900 A595, lo que reduce significativamente la capacidad del ensayo BCA (Figura 3A). El efecto negativo de la TDT es detectable incluso después de una dilución diez veces con agua pura (datos no mostrados). El ensayo de Bradford no pareció verse afectado por el tampón de almacenamiento (Figura 3B), como lo confirmó el análisis de densitometría.
La pureza de la preparación de tubulina se verificó mediante análisis de espectrometría de masas en dos instalaciones independientes (VRI Brno, República Checa; CEITEC MU Brno, República Checa) mediante ionización por electrospray y MALDI-TOF. Ambos análisis confirmaron la presencia de tubulinas porcinas alfa y beta en varias isoformas. La pureza general fue superior al 97,07% (PSMs 1065), con las impurezas más prevalentes originadas en la Queratina Tipo II de Homo sapiens (PSMs 246, 2,24% de impurezas) que se introdujeron probablemente durante el aislamiento de la tubulina y la preparación de la muestra para el análisis MS/MS. Otras impurezas compuestas por 322 PSMs y solo albúmina sérica, actina gamma y tripsinógeno originarias de Sus scrofa se identificaron con una resolución peptídica (0,0069%).
En experimentos posteriores, se verificó la preservación de la capacidad de polimerización después de la congelación instantánea y el almacenamiento en nitrógeno líquido. La alícuota de 10 mg/mL se eliminó del nitrógeno líquido y se descongeló lentamente en hielo. Se prepararon muestras de diferentes concentraciones (10 mg/mL, 8 mg/mL, 6 mg/mL, 4 mg/mL y 2 mg/mL) diluyendo las alícuotas en tampón PEM que contenía DTT, ATP y GTP para el experimento de autoensamblaje. Una serie de dilución se incubó a 37 °C durante 60 min, y la segunda se incubó en hielo durante 60 min. Ambas series se centrifugaron durante 60 min a 21.000 x g y la temperatura correspondiente (4 °C o 37 °C). Se extrajeron 30 μL de sobrenadante y se utilizaron para SDS-PAGE. El sobrenadante restante se retiró cuidadosamente con una pipeta y se desechó. Los gránulos se lavaron brevemente añadiendo 100 μM de tampón PEM, seguido de una eliminación inmediata con una pipeta. Posteriormente, los gránulos se resuspendieron en 50 μL de tampón de carga SDS concentrado 1x para preservar la concentración relativa de gránulo y sobrenadante. A cada sobrenadante se añadieron 10 μL de tampón de carga SDS. Todas las muestras se analizaron mediante el SDS-PAGE y la tinción de Coomassie (Figura 4). El volumen de cada muestra cargada en SDS-PAGE se ajustó de acuerdo con la concentración inicial, por lo que la diferencia en la precipitación debido a la concentración es más evidente. La prueba de autoensamblaje de tubulina en tampón PEM confirmó la capacidad de formar fibras de tubulina de manera dependiente de la temperatura.
Se realizó el ensayo de ensamblaje de tubulina20,21 impulsado por MAP2c que verificó la capacidad de la tubulina para interactuar con otras proteínas22. Se prepararon las diluciones seriadas de MAP2c donde se mezclaron 100 μL de alícuotas de tubulina de 1 mg/mL con MAP2c hasta la concentración final que osciló entre 0 μM y 8 μM. Todas las muestras se prepararon en hielo diluyéndolas en tampón PEM recién preparado con 1 mM de DTT y 1 mM de GTP. La tubulina se incubó durante 15 min a 37 °C con diferentes concentraciones de MAP2c, y se centrifugó durante 60 min a 21.000 x g y 37 °C. El lavado final del pellet se realizó dos veces con 100 μL de tampón PEM. El experimento confirmó la capacidad de la tubulina preparada para someterse a la polimerización impulsada por MAP2c, ya que solo la muestra sin MAP2c no formó un pellet (Figura 5).
La microscopía electrónica de transmisión se utilizó además para confirmar la presencia de filamentos de tubulina a partir de experimentos de copolimerización. Las suspensiones de tubulina purificada precipitadas con MAP2c se prepararon para microscopía electrónica de transmisión mediante tinción negativa. Las muestras se adsorbieron en rejillas de cobre estabilizadas con carbono recubiertas de Formvar. A continuación, las rejillas se tiñeron negativamente con 2% de NH4MoO4 y se examinaron bajo un microscopio electrónico con un aumento de 18.000x y una tensión de aceleración de 80 kV. La presencia de microtúbulos homogéneos con una estructura filamentosa clara y un tamaño adecuado mostró la capacidad de formar microtúbulos en conformación nativa (Figura 6).
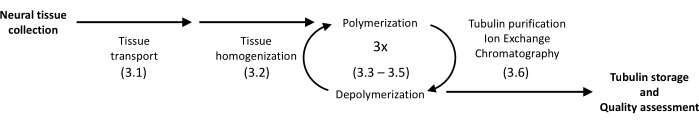
Figura 1: Diagrama esquemático de separación y purificación de tubulina. El número entre paréntesis se refiere al paso del protocolo. Haga clic aquí para ver una versión más grande de esta figura.
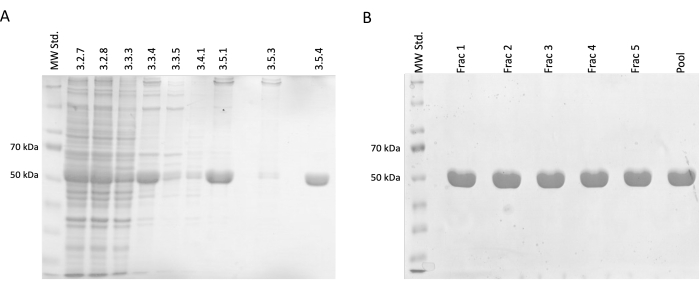
Figura 2: Separación y purificación de la tubulina. (A) El análisis SDS-PAGE de las muestras tomadas durante la separación de la tubulina utilizando polimerización impulsada por la temperatura (3 μL por línea). La disminución de las impurezas con un aumento estable de la abundancia relativa de tubulina (aproximadamente 50 kDa) es visible. Los números encima de cada línea corresponden al número de paso en el protocolo. (B) El análisis SDS-PAGE de fracciones obtenidas después de la cromatografía de proteínas en resina de fosfocelulosa (4 μL por línea). Haga clic aquí para ver una versión más grande de esta figura.
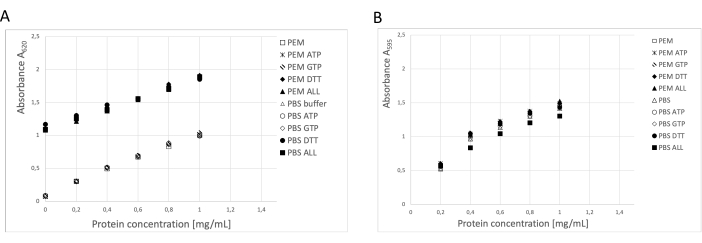
Figura 3: Concentración de proteínas. La serie de dilución de albúmina sérica bovina de hasta 1 mg/mL en tampón PEM o PBS se comparó con la serie de dilución BSA que contenía 0,1 ATP, 1 mM GTP, 1 mM DTT por separado o en combinación (0,1 mM ATP, 1 mM GTP y 1 mM DTT) en el tampón PEM o PBS. (A) Cuando se utilizó el ensayo BCA, hubo un cambio significativo en el fondo de las muestras que contenían DTT (símbolos sólidos). (B) Este efecto no se detectó cuando se midieron las concentraciones en el ensayo de Bradford. Haga clic aquí para ver una versión más grande de esta figura.
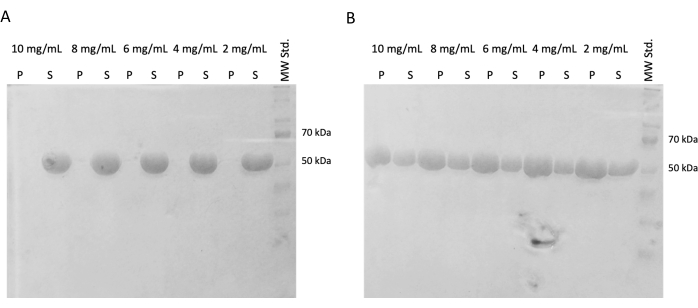
Figura 4: Ensayo de autoensamblaje de tubulina. El análisis SDS-PAGE del ensayo de autoensamblaje confirmó la capacidad de la tubulina almacenada incubada a (A) 4 °C o (B) 37 °C para polimerizar de manera dependiente de la temperatura en un amplio espectro de concentraciones. (P - pellet, S - sobrenadante; la concentración respectiva de tubulina se denota encima de cada par de líneas; la cantidad de cada muestra cargada fue de 10 μg). Haga clic aquí para ver una versión más grande de esta figura.
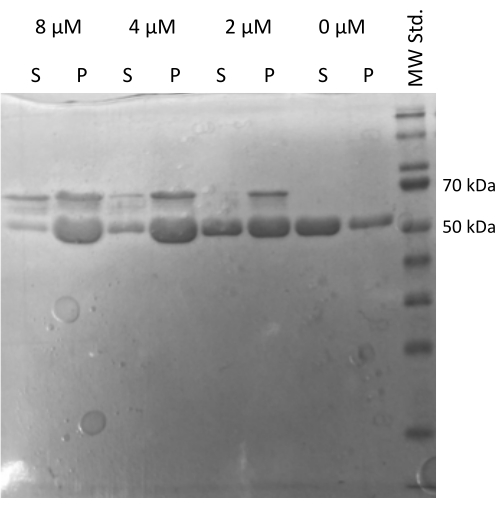
Figura 5: Ensayo de cosedimentación de tubulina. El análisis SDS-PAGE del ensamblaje de tubulina asistido por MAP2c confirmó la capacidad de la tubulina almacenada para someterse a la polimerización impulsada por la interacción con la proteína asociada a los microtúbulos de una manera dependiente de la concentración. La concentración molar de MAP2c se indica encima de cada línea. (P - pellet, S - sobrenadante). Haga clic aquí para ver una versión más grande de esta figura.
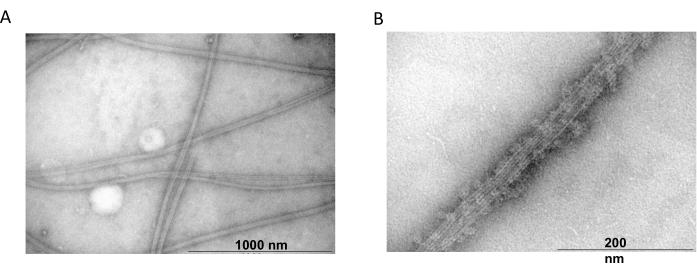
Figura 6: Microscopía electrónica de transmisión. Las microfotografías de TEM mostraron que la tubulina se ensambla (A) en microtúbulos de diámetro apropiado (B) que consisten en filamentos de tubulina homogéneos decorados con proteínas MAP2c. La barra corresponde a 1000 nm (A) y 200 nm (B). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El tejido neural de cualquier fuente es un excelente material para el aislamiento de tubulina, ya que las dendritas y axones de las neuronas son ricos en microtúbulos (hasta un 40%)23. El tejido cerebral se puede obtener con relativa facilidad en cantidades suficientes. La principal desventaja podría ser un nivel no especificado de modificaciones postraduccionales, que pueden afectar a los experimentos posteriores24,25. De lo contrario, la única preocupación es la rápida degradación del material de partida, especialmente en condiciones cálidas. Empleamos varios intercambios de tampón de transferencia para mejorar la disipación de calor antes del transporte y el transporte rápido para el procesamiento, que comienza lo antes posible. El tejido fresco se disecciona en condiciones que impiden el calentamiento y se homogeneiza en un tampón que contiene GTP y glicerol, que estabiliza aún más la tubulina26.
En el protocolo presentado, se ha introducido la etapa de clarificación (paso 3.2.7) del lisado crudo. Por lo general, no se recomienda la centrifugación prolongada antes de la primera polimerización debido a la susceptibilidad de la tubulina a modificaciones irreversibles y proteasas. Por otro lado, los experimentos presentes demostraron que un giro corto con una fuerza G alta reduce los desechos y, por lo tanto, aumenta el volumen relativo del homogeneizado procesado sin afectar significativamente la calidad de la tubulina.
La determinación exacta de la concentración de proteínas es esencial para experimentos posteriores, principalmente cuando se estudian las interacciones con proteínas de unión a la tubulina o inhibidores. Durante las investigaciones, encontramos diferencias significativas en los resultados de los ensayos de concentración de proteínas. La razón principal fue la presencia de DTT, GTP y ATP en altas concentraciones que interferían con los ensayos. El ensayo BCA se desplazó a los límites superiores debido a la alta cantidad de DTT en el tampón de almacenamiento, lo que disminuyó la capacidad del ensayo. Además, los máximos de absorbancia similares de las proteínas y el ATP o GTP causaron inconsistencias en la determinación de la concentración de proteínas utilizando la absorbancia a 280 nm. El mismo problema se notó en las lecturas del detector UV FPLC. El ensayo más fiable, con resultados estables, fue el ensayo de proteínas de Bradford, en el que no se observó ninguna influencia de los compuestos tampón. No obstante, es esencial preparar la serie de dilución estándar de proteínas en el tampón de almacenamiento.
La capacidad de la tubulina purificada para crear arreglos apropiados es un requisito previo para experimentos posteriores. La tubulina es, por naturaleza, muy propensa a la degradación incluso en el entorno rico en glicerol-GTP, lo que resulta en una capacidad reducida para formar filamentos homogéneos. Es fundamental seguir el proceso de purificación y verificar experimentalmente la capacidad de la tubulina almacenada para polimerizar en filamentos regulares estables. Se han introducido varios métodos independientes que verifican el estado de la tubulina in vivo e in vitro. Entre los más destacados, el espectroscopía de dicroísmo circular27, el ensayo de resonancia de plasmón de superficie28, el ensayo de desplazamiento térmico29, el ensayo de inhibición de la polimerización30, la tinción de inmunofluorescencia31,32, la coprecipitación22,33 y el análisis de microscopio electrónico de transmisión32 se puede mencionar. El ensayo de polimerización y coprecipitación de tubulina utilizado en este protocolo es fácil de realizar. Pueden evaluarse rápidamente mediante los gránulos que se encuentran en el fondo del tubo o mediante SDS-PAGE. Por otro lado, la tubulina precipitada puede presentarse en forma de agregados. Se deben incluir métodos más sofisticados, como la microscopía electrónica de transmisión, para confirmar la presencia de fibras de microtúbulos para el control de calidad.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El estudio contó con el apoyo de la Agencia de Tecnología de la República Checa (proyecto nr. TN02000017 - Centro Nacional de Biotecnología en Medicina Veterinaria - NaCeBiVet).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
Referencias
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 1 The Biology o 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62(2018).
- Ti, S. -C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011(2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826(2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Lazar, I. GelAnalyzer 19.1. , Available from: www.gelanalyzer.com (2024).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105(2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207(2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605(2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392(2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados