Method Article
Optimierung der Tubulinausbeute aus Schweinehirngewebe
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt eine Technik zur hochwirksamen Isolierung von Tubulin aus dem Schweinehirn, die für die Instrumentierung in kleinem Maßstab optimiert ist. Ergänzt werden die Isolationsverfahren durch Verfahren zur Bestimmung der Tubulinpolymerisationsaktivität in vitro mittels Co-Sedimentationsassays und Transmissionselektronenmikroskopie.
Zusammenfassung
Nervengewebe jeglicher Herkunft ist ein hervorragendes Material für die Tubulinisolierung, da die Dendriten und Axone der Neuronen reich an Mikrotubuli sind. Hier stellen wir ein Verfahren zur Extraktion von Tubulin vor, das mit geringfügigen Modifikationen für Nervengewebe aus mehreren Quellen eingesetzt werden kann. In dem vorgestellten Protokoll wurde ein neuer Klärschritt des Rohlysats eingeführt, der zu einer signifikanten Reduzierung der anfänglichen Menge an unlöslichen Rückständen führte, bevor der erste Polymerisationsschritt stattfand. Dieser zusätzliche Schritt ermöglichte die Verarbeitung von zusätzlichem Gewebe bei gleicher Instrumentierung und somit die Vergrößerung des relativen Volumens des verarbeiteten Homogenats. Der neu eingeführte Schritt hat keinen signifikanten Einfluss auf die Qualität des gereinigten Tubulins, wie In-vitro-Aktivitätsassays und Transmissionselektronenmikroskopie bestätigen. Das beschriebene Verfahren umfasst alle entscheidenden Schritte, einschließlich Gewebeentnahme, Transport, Gewebehomogenisierung, Tubulin-Isolationszyklen und abschließende Politur durch Ionenaustauschchromatographie mittels FPLC und anschließende Aktivitätsmessassays. Die Homogenität des gereinigten Tubulins betrug mehr als 97%, was durch MS/MS-Analyse mittels Elektrospray-Ionisation und MALDI-TOF bestätigt wurde.
Einleitung
Mikrotubuli, hohle Proteinfilamente (24 nm Durchmesser), die aus Alpha- und Beta-Tubulin-Heterodimeren gebildet werden, sind an verschiedenen essentiellen zellulären Prozessen beteiligt. Sie sind an der Bildung intrazellulärer Strukturen, der Motilität, der Zellteilung, der Zelldifferenzierung, dem Zelltransport, der Formerhaltung und der Sekretionbeteiligt 1. Die zellulären Funktionen von Mikrotubuli können durch direkte oder indirekte Wechselwirkungen mit Mikrotubuli-assoziierten Proteinen (MAPs) und anderen Proteinen oder durch komplexe posttranslationale Modifikationen, die im Tubulin-Code2 definiert sind, beeinflusst werden.
Tubulinfasern entstehen durch dynamische nicht-kovalente Wechselwirkungen zwischen alpha- und beta-Untereinheiten im Nukleations-Elongationsmechanismus. Kurze Mikrotubuli werden gebildet, und das anschließende Wachstum der Tubulinfasern wird durch reversible Dehnung an beiden Enden erreicht, wodurch Zylinder gebildet werden, die aus Tubulin-Heterodimeren bestehen, die in parallelen Protofilamentenangeordnet sind 2. Dynamische Instabilität bezieht sich auf die Tatsache, dass zusammengesetzte Mikrotubuli oft nicht im Gleichgewicht mit ihren Untereinheiten sind, sondern einen Phasenübergang zwischen einer längeren Wachstums- und Schrumpfungsperiode durchlaufen können, während sieeinen stationären Zustand beibehalten 1,2.
Die dynamische Instabilität von Tubulinfasern wird hauptsächlich in vielen Tubulintrennungs- und Reinigungsverfahren ausgenutzt, bei denen Zyklen der Hochtemperaturpolymerisation und der Niedertemperaturdepolymerisation in der Umgebung von hochreinem Glycerin, DMSO, GTP/ATP, Mg2+ oder anderen chemischen Mitteln (wie Taxol oder Polykationen) verwendet werden3. Den meisten Trennverfahren4 folgt die Proteinchromatographie 5,6,7,8,9, die die Trennung von Tubulin-assoziierten Proteinen mit Nukleosiddiphosphokinase und ATPase-Aktivität 5 gewährleistet. Ähnliche Ergebnisse können durch die Verwendung von Puffern mit hohem Salzgehalt10 erzielt werden. Mehrere Quellen, einschließlich neuronaler 11,12,13,14 und nicht-neuronaler 15 Gewebe, Fische16 (sowohl Süßwasser- als auch Meeresgewebe), Hefen oder rekombinante Varianten17, die in verschiedenen Produktionsstämmen 11,12,13,14 überexprimiert wurden, und andere Quellen 9,18 wurden für die Fraktionierung verwendet und Reinigung.
Das vorgestellte Protokoll verwendet Präzipitation und Proteinchromatographie, um Tubulin aus dem Schweinehirn in eine hohe Homogenität zu isolieren (Abbildung 1). Der Hauptvorteil ist eine relativ hohe Ausbeute, die mit Instrumenten erzielt wird, die in Labors zur Verfügung stehen, die für molekularbiologische Routineexperimente ausgestattet sind.
Protokoll
Die Zusammensetzung aller Lösungen und Instrumente ist in der Materialtabelle beschrieben. Alle Lösungen wurden mit FPLC-Chemikalien hergestellt und vor der Verwendung durch einen 0,22-μm-Filter filtriert. Bei allen Arbeiten wurde persönliche Schutzausrüstung wie Laborkittel, Handschuhe und Schutzbrille verwendet. Alle Instrumente waren sauber und frei von Spuren von Reinigungsmitteln. Während der Eingriffe wurden die entsprechenden Tierhaltungsrichtlinien (wie von der Institution genehmigt) befolgt. Das gesamte biologische Material, einschließlich des Hirngewebes, wurde als Rohmaterial von einem Schlachthof gekauft. In keinem Schritt des Protokolls wurden lebende Tiere verwendet.
1. Aktivierung einer Phosphocellulosesäule für die schnelle Proteinflüssigkeitschromatographie
- Geben Sie 700 ml 50%iges Ethanol zu 15 g trockenem Phosphocelluloseharz und mischen Sie es vorsichtig mit einem Löffel im Becherglas.
- Gießen Sie die Suspension in eine geeignete chromatographische Säule mit entsprechendem Volumen (700 ml). Die Säule mit Kolben verschließen, die mit Fritten bestückt sind. Lassen Sie mindestens 10 % des leeren Kopfraums.
HINWEIS: Es können auch andere Gefäße verwendet werden, aber die FPLC-Säule in Kombination mit einer Peristaltikpumpe reduziert die für die Harzaktivierung erforderliche Zeit und die Harzverluste erheblich. - Auf einem Wippenschüttler bei 60 U/min 30 min inkubieren.
- Lassen Sie das Harz absetzen und entfernen Sie den Überschuss an 50 % Ethanol mit der Schlauchpumpe mit einem auf 3 mL/min eingestellten Durchfluss. Lassen Sie das Harz nicht trocknen.
- Entfernen Sie den oberen Kolben und fügen Sie 300 ml 50 % Ethanol hinzu. Schließen Sie die Säule, schütteln Sie sie kurz und entfernen Sie das überschüssige Ethanol über eine Schlauchpumpe.
- Entfernen Sie das restliche Ethanol. Geben Sie 300 mL Reinstwasser in die Säule, schließen Sie die Säule mit dem Kolben und kippen Sie, bis das Harz wieder suspendiert ist. Entfernen Sie überschüssige Flüssigkeit mit einer Schlauchpumpe. Wiederholen Sie diesen Schritt dreimal.
- Öffnen Sie die Säule oben, fügen Sie 500 mL 0,5 M HCl hinzu, schließen Sie die Säule und resuspendieren Sie das Harz durch leichtes Kippen. Auf einem Wippenschüttler bei 60 U/min 30 min inkubieren.
- Entfernen Sie überschüssige Flüssigkeit mit einer Schlauchpumpe. Fügen Sie 300 mL 0,5 M HCl hinzu, resuspendieren Sie das Harz und entfernen Sie die überschüssige Flüssigkeit.
- Entfernen Sie das restliche HCl. Geben Sie 300 mL Reinstwasser in die Säule, schließen Sie die Säule mit dem Kolben und kippen Sie, bis das Harz wieder resuspendiert ist. Entfernen Sie überschüssige Flüssigkeit mit einer Schlauchpumpe. Wiederholen Sie diesen Schritt dreimal.
- Gießen Sie die 700 mL MES-Puffer (25 mM MES, 0,1 mM EGTA, 0,5 mM MgCl2) in die Säule und resuspendieren Sie das Harz durch Kippen. Die Suspension wird in das Becherglas gegossen, der pH-Wert mit 1 M NaOH auf 6,1 eingestellt und 2 h unter leichtem Rühren inkubiert.
- Lassen Sie das Harz absetzen, dekantieren Sie die Flüssigkeit, fügen Sie 300 mL MES-Puffer mit einem pH-Wert von 6,4 hinzu und inkubieren Sie es über Nacht bei 4 °C.
- Die überschüssige Flüssigkeit dekantieren, 96 % Ethanol auf 20 % Endkonzentration zugeben und bis zur Verwendung bei 4 °C lagern.
2. Packung der Phosphozellulose-Säule
- Gießen Sie 12 mL aktiviertes Harz in die saubere chromatographische Säule mit geschlossenem Bodenstopfen. Lassen Sie das Harz absetzen. Das Volumen des abgesetzten Harzes beträgt etwa 5 ml. Entfernen Sie die obere Schicht des Harzes (ca. 2-3 mm), wo sich leichtere zerbrochene Matrixfragmente ablagern könnten.
- Entfernen Sie den unteren Stopfen und lassen Sie die Aufbewahrungslösung Tropfen für Tropfen frei abtropfen. Lassen Sie das Harz nicht trocknen.
- Schließen Sie die Säule und verbinden Sie sie mit dem FPLC-System. Waschen Sie die Säule mit PEM-Puffer (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4) bei 1 mL/min (max. Druck 1 bar) für 30 min, stellen Sie die Kolbenhöhe ein, drehen Sie die Säule auf den Kopf und waschen Sie die Säule unter den gleichen Bedingungen für die nächsten 30 min im Gegenstrom.
- Lagern Sie die mit aktivierter Phosphocellulose gefüllte Säule mehrere Tage bei 4 °C.
3. Tubulintrennung und -reinigung
HINWEIS: Tubulin ist sehr anfällig für Abbau, und es ist wichtig, schnell vorzugehen. Alle Lösungen, Instrumente und Geräte sollten bei Bedarf im Voraus vorbereitet, gekühlt oder erhitzt werden. Die Verfahren reagieren empfindlich auf Schwankungen der empfohlenen Temperaturen. Das Hirngewebe sollte so schnell wie möglich nach der Dissektion verarbeitet werden, wobei die Menge an biologischem Abfall zu berücksichtigen ist, die bei der Reinigung entsteht. Das Verfahren wurde für den Rotor mit sechs 75 mL Ultrazentrifugationsküvetten optimiert. Die Menge des aufbereiteten Gewebes kann je nach verfügbarer Ultrazentrifuge erhöht oder verringert werden.
- Transport von Gewebe
- 500 g frisch präpariertes Schweinehirn (6-8 Stück) in ein 3 L Transportgefäß geben und den eiskalten Transportpuffer (4,1 mM MES pH 7, 320 mM Saccharose, 1 mM EGTA) aufgießen, bis er vollständig eingetaucht ist. Lassen Sie es 5 Minuten auf Eis stehen und tauschen Sie den Transportpuffer gegen einen frischen aus, um die Wärmeableitung zu erleichtern. Schneller Transport auf Eis zur Weiterverarbeitung.
- Homogenisierung von Gewebe
HINWEIS: Die Gewebehomogenisierung erfolgt auf Eis in einem Kühlraum. Alle Instrumente sollten vorgekühlt werden, um eine spontane Polymerisation zu verhindern. Die Hauptquelle für Tubulin ist die graue Substanz, und der Rest wird in den folgenden Schritten entfernt.- 100 mL Extraktionspuffer (4,1 mM MES pH 7, 520 mM Saccharose, 1 mM EGTA, 1 mM ATP und 0,1 mM GTP) werden in ein 1 l Kunststoffbecherglas gegossen und das Gewicht W1 (g) einschließlich des Gefäßes bestimmt. ATP und GTP werden erst kurz vor der Verwendung zugegeben.
- Nehmen Sie das Schweinehirn aus dem Transportgefäß und entfernen Sie das gesamte Kleinhirn, das Fett, große Brocken der weißen Substanz, die Hirnhäute und die Blutgefäße mit den Fingern mit bescheidener Kraft. Eine Schere oder Pinzette kann ebenfalls verwendet werden. Schweinehirne, die von unerwünschtem Gewebe befreit sind, mit 100 ml kaltem Extraktionspuffer in das Becherglas geben. Fahren Sie fort, bis das gesamte Gewebe verarbeitet ist.
- Wiegen Sie das Becherglas mit aufbereitetem Hirngewebe und bestimmen Sie das Gewicht von W2 (g).
- Fügen Sie Extraktionspuffer gemäß der Formel Extraktionspuffergewicht = W2 - W1 hinzu (z. B. für 400 g Gewebe werden 300 g zusätzlicher Extraktionspuffer hinzugefügt).
- Das Hirngewebe mit Extraktionspuffer in den vorgekühlten Küchenmixer geben und in 4-8 kurzen, dreisekündigen Impulsen verarbeiten.
- Verarbeiten Sie das teilweise homogenisierte Gewebe mit einem Hochgeschwindigkeits-Dispersionshomogenisator (18 000 U/min) für 1 min. Lassen Sie die Suspension 3-5 Minuten auf Eis und mischen Sie sie gelegentlich mit einem Löffel. Fünfmal wiederholen oder bis zur vollständigen Homogenisierung.
- In vorgekühlte Ultrazentrifugationsröhrchen füllen und 10 min bei 4 °C und 50.000 x g schleudern. Bewahren Sie den Überstand auf und entsorgen Sie das Pellet. Wiederholen Sie diesen Vorgang, bis 430 ml geklärter Extrakt gesammelt sind.
- Den geklärten Extrakt in vorgekühlte Ultrazentrifugationsröhrchen (je 70 mL) füllen und bei 4 °C und 75.000 x g 60 min schleudern. Sammeln Sie den Überstand und bestimmen Sie das Volumen S1.
HINWEIS: Wenn nur ein Rotor vorhanden ist, erhitzen Sie ihn in einem warmen Wasserbad für den nächsten Zentrifugationsschritt (37 °C).
- Erste Polymerisation
- 10x MEM-Puffer (1 M MES pH 6,8, 10 mM EGTA, 10 mM MgCl2) gemäß Formel V = S1/9 mL zugeben (für 585 mL Überstand 65 mL 10x MEM-Puffer zugeben). Gut mischen und Glycerin auf 3,5 M und GTP auf 0,1 mM Endkonzentration hinzufügen. Die Suspension wird in Ultrazentrifugationsröhrchen gegossen (das Volumen des Überstands übersteigt das Volumen der Röhrchen; der Rest wird verworfen).
- Die Röhrchen mit dem Überstand werden in einem Wasserbad 45 min bei 37 °C inkubiert.
- Schleudern Sie die Röhrchen 90 min lang bei 37 °C und 75.000 x g. Messen Sie das Volumen des Überstands (S2), um das Volumen des MEM-Puffers zu bestimmen, geben Sie ihn zu den Pellets in Schritt 3.3.4 und entsorgen Sie dann den Überstand. Bewahren Sie das Pellet dort auf, wo das polymerisierte Tubulin enthalten ist.
- Bereiten Sie 0,5 x S2 Volumen eiskalten 1x MEM-Puffer vor. Geben Sie in jedes Ultrazentrifugenröhrchen mit dem Pellet die gleiche Menge 1x MEM-Puffer. Pellets in dem zugegebenen 1x MEM-Puffer resuspendieren, Suspensionen in den Messzylinder überführen und das Gesamtvolumen bestimmen.
- GTP bis 1 mM Endkonzentration hinzufügen. Übertragen Sie die Suspension in einen Dounce Glashomogenisator und homogenisieren Sie die Lösung etwa alle 10 Minuten für 45 Minuten auf Eis. Der Kolben muss vorsichtig betätigt werden, da er leicht brechen kann.
HINWEIS: In der Zwischenzeit den Rotor in Wasser mit Eis kalt stellen.
- GTP bis 1 mM Endkonzentration hinzufügen. Übertragen Sie die Suspension in einen Dounce Glashomogenisator und homogenisieren Sie die Lösung etwa alle 10 Minuten für 45 Minuten auf Eis. Der Kolben muss vorsichtig betätigt werden, da er leicht brechen kann.
- Die homogenisierte Lösung in vorgekühlte Ultrazentrifugationsröhrchen füllen und 60 min lang bei 75.000 x g und 4 °C schleudern. Nach der Zentrifugation ist das Überstandsvolumen (S3) zu bestimmen.
- Zweite Polymerisation
- Mischen Sie den Überstand mit den 0,35 x S3 mL Glycerin und fügen Sie GTP zu 1 mM Endkonzentration hinzu. Den Überstand in Ultrazentrifugationsröhrchen füllen und 45 min bei 37 °C inkubieren.
HINWEIS: In der Zwischenzeit den Rotor im Wasserbad auf 37 °C erwärmen. - Der polymerisierte Überstand aus Schritt 3.4.1 wird 60 min lang bei 75.000 x g und 37 °C zentrifugiert. Das Volumen des Überstands (S4) ist zu bestimmen.
HINWEIS: Dies ist ein optionaler Haltepunkt. Das Pellet mit Tubulin kann in flüssigem Stickstoff schockgefrostet und bei -80 °C gelagert werden. - Lassen Sie die gefrorenen Pellets 30 Minuten lang langsam auf Eis auftauen. Bereiten Sie 0,25 x S4 mL PIPES-Puffer (500 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP) vor, verteilen Sie sie gleichmäßig in Röhrchen mit Pellets, resuspendieren Sie die Pellets mit einem Löffel und geben Sie die Lösung in einen Dounce Glashomogenisator. Jeweils 10 min auf Eis 45 min homogenisieren.
HINWEIS: In der Zwischenzeit den Rotor in Wasser mit Eis kalt stellen. - Die Lösung mit dem depolymerisierten Tubulin in Ultrazentrifugationsröhrchen gießen und 60 min bei 4 °C und 75.000 x g schleudern.
- Mischen Sie den Überstand mit den 0,35 x S3 mL Glycerin und fügen Sie GTP zu 1 mM Endkonzentration hinzu. Den Überstand in Ultrazentrifugationsröhrchen füllen und 45 min bei 37 °C inkubieren.
- Dritte Polymerisation
- Bestimmen Sie das Volumen des Überstands (S5) und fügen Sie S5/9 mL DMSO hinzu. Die Suspension wird in Ultrazentrifugationsröhrchen gegossen und 20 Minuten bei 37 °C inkubiert, um zu polymerisieren.
HINWEIS: In der Zwischenzeit den Rotor im Wasserbad auf 30 °C erwärmen. - Das polymerisierte Tubulin wird 60 min lang bei 75.000 x g und 30 °C zentrifugiert. Das Volumen des Überstands (S6) bestimmen und die Pellets aufbewahren.
- Die Pellets werden in 0,25 x S6 mL PEM-Puffer (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP) aufgelöst. Verwenden Sie einen Dounce Glashomogenisator, um die Solubilisierung zu verbessern. Fügen Sie PEM-Puffer hinzu, bis sich die Pellets vollständig aufgelöst haben (es sind keine opaleszierenden Partikel mehr sichtbar).
- Bestimmen Sie das Volumen des Überstands (S5) und fügen Sie S5/9 mL DMSO hinzu. Die Suspension wird in Ultrazentrifugationsröhrchen gegossen und 20 Minuten bei 37 °C inkubiert, um zu polymerisieren.
- Reinigung der Ionenaustauschchromatographie
HINWEIS: Die Reverse-Ionenaustausch-Chromatographie wird eingesetzt, um Mikrotubulin-assoziierte Proteine zu entfernen. Tubulin fließt bei gegebenem pH-Wert frei durch die Säule, und kontaminierende Proteine werden auf dem Phosphocelluloseharz zurückgehalten. Alle Arbeitsschritte werden bei Temperaturen um die 4° C oder auf Eis durchgeführt. Klären Sie den Tubulinextrakt vor der FPLC-Reinigung nicht, weder durch Filtration noch durch Zentrifugation. - Äquilibrieren Sie den FPLC und die Säule mit dem PEM-Puffer (100 mM PIPES pH 6,9, 1 mM EGTA, 1 mM MgSO4, 1 mM DTT, 0,1 mM ATP). Verwenden Sie mindestens 10 Spaltenvolumina für die Äquilibrierung. Der Pumpendurchfluss sollte den für die Säulenpackung verwendeten Durchfluss (1 ml/min) nicht überschreiten.
- Laden Sie die Tubulinsuspension langsam (0,5 ml/min) auf die Säule und sammeln Sie das ungebundene Protein, das durch das Harz fließt.
- Fügen Sie 10 μl 100 mM GTP zu jeder 1 ml-Fraktion hinzu, die das Tubulinprotein enthält.
- Tubulinhaltige Fraktionen in flüssigem Stickstoff einfrieren und sofort in den Behälter mit flüssigem Stickstoff überführen. Tubulin kann unter diesen Bedingungen mehrere Jahre gelagert werden. Die Stabilität nimmt über mehrere Monate rapide ab, wenn das Tubulin bei - 80 °C gelagert wird.
Ergebnisse
Während der Trenn- und Reinigungsschritte wurden Proben für die SDS-PAGE-Elektrophorese entnommen und anschließend mit Coomassie-Blau-Färbung analysiert (Abbildung 2). 20 μl jeder Probe wurden mit 10 μl Laemmli Probenpuffer (188 mM Tris-HCl pH 6,8, 3 % SDS (w/w), 30 % Glycerin (v/v), 0,01 Bromphenolblau (w/w), 15 % β-Mercaptoethanol) gemischt und 15 min lang bei 95 °C inkubiert. 4 μl jeder Probe wurden auf 12,5 % Acrylamid SDS-Gel geladen und unter einem konstanten Strom von 30 mA pro Gel unter reduzierenden und denaturierenden Bedingungen getrennt.
Die Ergebnisse bestätigten einen inkrementellen Anstieg der relativen Tubulinkonzentration, begleitet von einer Verringerung der kontaminierenden Proteine. Darüber hinaus gab es bei der ersten Zentrifugation (Schritt 3.2.7) keinen signifikanten Verlust von Tubulin im geklärten Lysat im Vergleich zum Weglassen dieses Schritts (Abbildung 2A,B).
Die Proteinkonzentration wurde mit drei unabhängigen Methoden bestimmt: BCA-Assay, Bradford-Protein-Assay und SDS-PAGE-Gel-Densitometrie-Analyse19 (Abbildung 3). Die Gesamtausbeute an Tubulin unter Verwendung des beschriebenen Verfahrens betrug 123 mg gereinigtes Tubulin aus 250 g Nervengewebe. Bei den Messungen ist zu berücksichtigen, dass die hohe DTT-Konzentration im Lagerpuffer einen signifikanten Einfluss auf den BCA-Assay hat. Sowohl der PEM-Puffer als auch der PBS-Puffer erhöhen mit der Zugabe von DTT die Hintergrundabsorption um etwa 0,900 A595, was die Kapazität des BCA-Assays erheblich reduziert (Abbildung 3A). Die negative Wirkung von DTT ist auch nach zehnfacher Verdünnung mit reinem Wasser nachweisbar (Daten nicht gezeigt). Der Bradford-Assay schien durch den Speicherpuffer nicht beeinflusst zu werden (Abbildung 3B), was durch die Densitometrie-Analyse bestätigt wurde.
Die Reinheit des Tubulinpräparats wurde durch massenspektrometrische Analysen an zwei unabhängigen Einrichtungen (VRI Brno, Tschechische Republik; CEITEC MU Brno, Tschechische Republik) mit Elektrospray-Ionisation und MALDI-TOF. Beide Analysen bestätigten das Vorhandensein von Schweinetubulinen alpha und beta in mehreren Isoformen. Die Gesamtreinheit betrug mehr als 97,07 % (PSMs 1065), wobei die häufigsten Verunreinigungen von Homo sapiens Keratin Typ II (PSMs 246, 2,24 % der Verunreinigungen) stammten, die höchstwahrscheinlich während der Tubulinisolierung und Probenvorbereitung für die MS/MS-Analyse eingebracht wurden. Andere Verunreinigungen, die aus 322 PSMs und nur Serumalbumin, Aktin-gamma und Trypsinogen aus Sus scrofa bestehen, wurden mit einer Peptidauflösung (0,0069%) identifiziert.
In nachfolgenden Experimenten wurde der Erhalt der Polymerisationskapazität nach dem Schockfrosten und der Lagerung in flüssigem Stickstoff nachgewiesen. Das 10 mg/ml-Aliquot wurde aus flüssigem Stickstoff entfernt und langsam auf Eis aufgetaut. Proben unterschiedlicher Konzentrationen (10 mg/ml, 8 mg/ml, 6 mg/ml, 4 mg/mL und 2 mg/mL) wurden durch Verdünnen der Aliquote in PEM-Puffer, der DTT, ATP und GTP enthält, für das Selbstorganisationsexperiment hergestellt. Eine Verdünnungsreihe wurde 60 min lang bei 37 °C inkubiert, die zweite wurde 60 min lang auf Eis inkubiert. Beide Serien wurden für 60 min bei 21.000 x g und der entsprechenden Temperatur (4 °C bzw. 37 °C) zentrifugiert. 30 μl Überstand wurden entfernt und für SDS-PAGE verwendet. Der verbleibende Überstand wurde vorsichtig mit einer Pipette entfernt und verworfen. Die Pellets wurden kurz durch Zugabe von 100 μM PEM-Puffer gewaschen und anschließend sofort mit einer Pipette entfernt. Anschließend wurden die Pellets in 50 μL 1x konzentriertem SDS-Ladepuffer resuspendiert, so dass die relative Konzentration von Pellet und Überstand erhalten bleibt. Jedem Überstand wurden 10 μl SDS-geladener Puffer zugesetzt. Alle Proben wurden mittels SDS-PAGE und Coomassie-Färbung analysiert (Abbildung 4). Das Volumen jeder Probe, die auf SDS-PAGE geladen wurde, wurde entsprechend der Ausgangskonzentration angepasst, so dass der Unterschied in der Ausfällung aufgrund der Konzentration deutlicher ist. Der Selbstorganisationstest von Tubulin in PEM-Puffer bestätigte die Fähigkeit, Tubulinfasern temperaturabhängig zu bilden.
Der MAP2c-getriebene Tubulin 20,21-Assemblierungsassay, der die Fähigkeit von Tubulin zur Interaktion mit anderen Proteinen überprüfte, wurde durchgeführt 22. Die seriellen Verdünnungen von MAP2c wurden hergestellt, wobei 100 μl 1 mg/ml Tubulin-Aliquots mit MAP2c bis zu einer Endkonzentration von 0 μM bis 8 μM gemischt wurden. Alle Proben wurden auf Eis durch Verdünnung in frisch aufbereitetem PEM-Puffer mit 1 mM DTT und 1 mM GTP aufbereitet. Das Tubulin wurde 15 min bei 37 °C mit unterschiedlichen Konzentrationen von MAP2c inkubugiert und 60 min bei 21.000 x g und 37 °C zentrifugiert. Die abschließende Wäsche des Pellets wurde zweimal mit 100 μl PEM-Puffer durchgeführt. Das Experiment bestätigte die Fähigkeit des präparierten Tubulins für eine MAP2c-getriebene Polymerisation, da nur die Probe ohne MAP2c kein Pellet bildete (Abbildung 5).
Die Transmissionselektronenmikroskopie wurde außerdem verwendet, um das Vorhandensein von Tubulinfilamenten aus Copolymerisationsexperimenten zu bestätigen. Suspensionen von gereinigtem Tubulin, die mit MAP2c ausgefällt wurden, wurden für die Transmissionselektronenmikroskopie mittels Negativfärbung hergestellt. Die Proben wurden auf Formvar-beschichteten, kohlenstoffstabilisierten Kupfergittern adsorbiert. Anschließend wurden die Gitter mit 2% NH4MoO 4 negativ gefärbt und unter einem Elektronenmikroskop bei 18.000-facher Vergrößerung und einer Beschleunigungsspannung von 80 kV untersucht. Das Vorhandensein homogener Mikrotubuli mit einer klaren filamentösen Struktur und angemessener Größe zeigte die Fähigkeit, Mikrotubuli in nativer Konformation zu bilden (Abbildung 6).
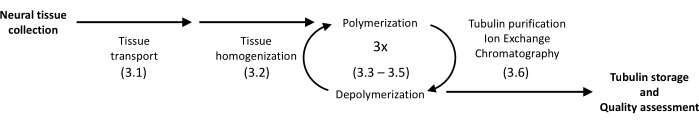
Abbildung 1: Ein schematisches Diagramm der Tubulintrennung und -reinigung. Die Zahl in Klammern bezieht sich auf den Protokollschritt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
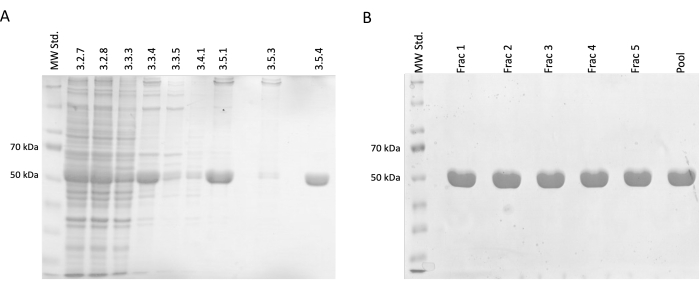
Abbildung 2: Tubulintrennung und -reinigung. (A) Die SDS-PAGE-Analyse von Proben, die bei der Trennung von Tubulin mittels temperaturgesteuerter Polymerisation (3 μL pro Linie) entnommen wurden. Die Abnahme der Verunreinigungen mit einer stabilen Zunahme der relativen Tubulinhäufigkeit (ca. 50 kDa) ist sichtbar. Die Zahlen über jeder Zeile entsprechen der Schrittnummer im Protokoll. (B) Die SDS-PAGE-Analyse von Fraktionen, die nach der Proteinchromatographie an Phosphocelluloseharz (4 μl pro Linie) erhalten wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
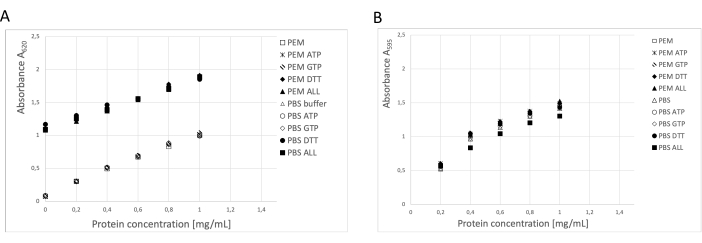
Abbildung 3: Proteinkonzentration. Die Verdünnungsreihe von Rinderserumalbumin von bis zu 1 mg/ml in PEM-Puffer oder PBS wurde mit BSA-Verdünnungsreihen verglichen, die 0,1 ATP, 1 mM GTP, 1 mM DTT einzeln oder in Kombination (0,1 mM ATP, 1 mM GTP und 1 mM DTT) im PEM- oder PBS-Puffer enthielten. (A) Bei der Verwendung des BCA-Assays kam es zu einer signifikanten Verschiebung des Hintergrunds von Proben, die DTT (feste Symbole) enthielten. (B) Dieser Effekt wurde bei der Messung der Konzentrationen im Bradford-Assay nicht festgestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
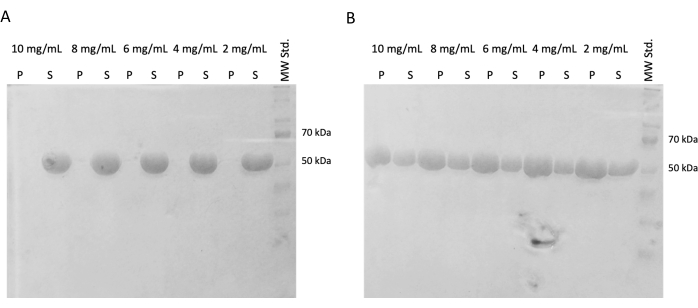
Abbildung 4: Tubulin-Selbstassemblierungsassay. Die SDS-PAGE-Analyse des Selbstorganisationsassays bestätigte die Fähigkeit von gelagertem Tubulin, das entweder bei (A) 4 °C oder (B) 37 °C inkubiert wurde, temperaturabhängig in einem breiten Konzentrationsspektrum zu polymerisieren. (P - Pellet, S - Überstand; die jeweilige Tubulinkonzentration ist über jedem Linienpaar angegeben; die Menge jeder geladenen Probe betrug 10 μg). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
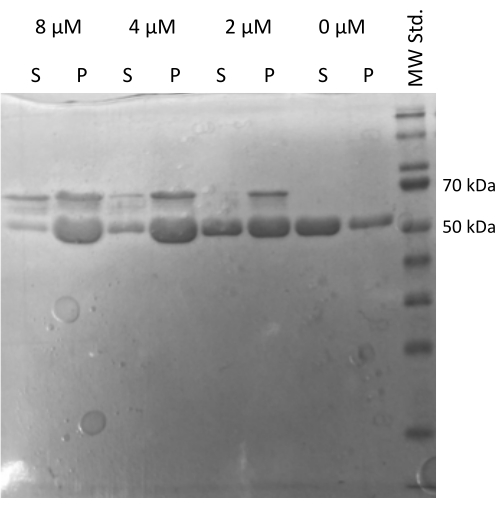
Abbildung 5: Tubulin-Co-Sedimentations-Assay. Die SDS-PAGE-Analyse der MAP2c-unterstützten Tubulin-Assemblierung bestätigte die Fähigkeit des gelagerten Tubulins, eine Polymerisation durchzuführen, die durch die Interaktion mit dem Mikrotubuli-assoziierten Protein in einer konzentrationsabhängigen Weise angetrieben wird. Die molare Konzentration von MAP2c ist über jeder Linie angegeben. (P - Pellet, S - Überstand). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
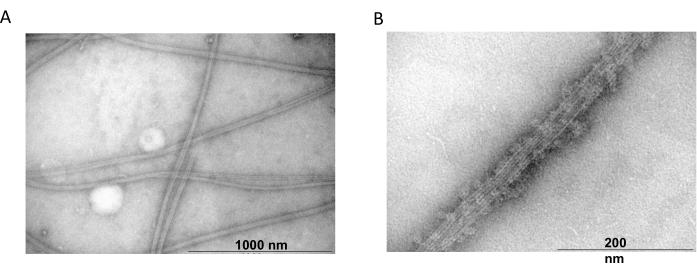
Abbildung 6: Transmissionselektronenmikroskopie. Die TEM-Mikrofotografien zeigten, dass Tubulin (A) zu Mikrotubuli mit entsprechendem Durchmesser (B) zusammenfügt, die aus homogenen Tubulinfilamenten bestehen, die mit MAP2c-Proteinen dekoriert sind. Der Balken entspricht 1000 nm (A) und 200 nm (B). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das Nervengewebe jeglicher Quelle ist ein hervorragendes Material für die Tubulinisolierung, da die Dendriten und Axone der Neuronen reich an Mikrotubuli sind (bis zu 40 %)23. Hirngewebe kann relativ einfach in ausreichender Menge gewonnen werden. Der Hauptnachteil könnte ein unspezifisches Maß an posttranslationalen Modifikationen sein, die sich auf nachfolgende Experimente auswirken können24,25. Andernfalls besteht die einzige Sorge vor dem schnellen Abbau des Ausgangsmaterials, insbesondere bei warmen Bedingungen. Wir haben mehrere Transferpuffer ausgetauscht, um die Wärmeableitung vor dem Transport und den schnellen Transport für die Verarbeitung zu verbessern, die so schnell wie möglich beginnt. Das frische Gewebe wird unter Bedingungen präpariert, die eine Erwärmung verhindern, und in einem GTP und Glycerin enthaltenden Puffer homogenisiert, der Tubulin26 weiter stabilisiert.
In dem vorgestellten Protokoll wurde der Klärungsschritt (Schritt 3.2.7) des Rohlysats eingeführt. Eine längere Zentrifugation vor der ersten Polymerisation wird aufgrund der Anfälligkeit der Tubuline für irreversible Modifikationen und Proteasen im Allgemeinen nicht empfohlen. Andererseits zeigten die vorliegenden Experimente, dass ein kurzer Schleudern bei hoher G-Kraft die Ablagerungen reduziert und somit das relative Volumen des verarbeiteten Homogenats erhöht, ohne die Tubulinqualität signifikant zu beeinflussen.
Die exakte Bestimmung der Proteinkonzentration ist essentiell für weitere Experimente, vor allem wenn Wechselwirkungen mit Tubulin-bindenden Proteinen oder Inhibitoren untersucht werden. Während der Untersuchungen stießen wir auf signifikante Unterschiede in den Ergebnissen der Proteinkonzentrationsassays. Der Hauptgrund war das Vorhandensein von DTT, GTP und ATP in hohen Konzentrationen, die die Assays beeinträchtigten. Der BCA-Assay wurde aufgrund der hohen Menge an DTT im Lagerpuffer an die oberen Grenzen verschoben, wodurch die Assay-Kapazität verringert wurde. Darüber hinaus führten die ähnlichen Absorptionsmaxima von Proteinen und ATP bzw. GTP zu Inkonsistenzen bei der Bestimmung der Proteinkonzentration mit der Extinktion bei 280 nm. Das gleiche Problem machte sich bei den Messwerten des FPLC-UV-Detektors bemerkbar. Der zuverlässigste Assay mit stabilen Ergebnissen war der Bradford-Protein-Assay, bei dem kein Einfluss von Pufferverbindungen beobachtet wurde. Dennoch ist es wichtig, die Proteinstandardverdünnungsreihe im Lagerpuffer vorzubereiten.
Die Fähigkeit des gereinigten Tubulins, geeignete Anordnungen zu schaffen, ist eine Voraussetzung für nachfolgende Experimente. Tubulin ist von Natur aus sehr anfällig für den Abbau, selbst in der Glycerin-GTP-reichen Umgebung, was zu einer verminderten Fähigkeit führt, homogene Filamente zu bilden. Es ist von entscheidender Bedeutung, den Reinigungsprozess zu verfolgen und die Fähigkeit des gelagerten Tubulins, zu stabilen regulären Filamenten zu polymerisieren, experimentell zu überprüfen. Mehrere unabhängige Methoden zur Überprüfung des Tubulinzustands wurden in vivo und in vitro eingeführt. Zu den bekanntesten gehören die Zirkulardichroismus-Spektroskopie27, der Oberflächenplasmonenresonanz-Assay28, der Thermo-Shift-Assay29, der Polymerisationshemmungs-Assay30, die Immunfluoreszenzfärbung31,32, die Kopräzipitation22,33 und die Transmissionselektronenmikroskop-Analyse32 erwähnt werden können. Der Polymerisationsassay und die Copräzipitation von Tubulin, die in diesem Protokoll verwendet werden, sind einfach durchzuführen. Sie können schnell ausgewertet werden, entweder durch die am Boden des Rohrs auftretenden Pellets oder mit SDS-PAGE. Auf der anderen Seite kann das ausgefällte Tubulin in Form von Aggregaten vorliegen. Ausgefeiltere Methoden, wie z. B. die Transmissionselektronenmikroskopie, müssen einbezogen werden, um das Vorhandensein von Mikrotubuli-Fasern für die Qualitätskontrolle zu bestätigen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Studie wurde von der Technologieagentur der Tschechischen Republik (Projekt-Nr. TN02000017 - Nationales Zentrum für Biotechnologie in der Veterinärmedizin - NaCeBiVet).
Materialien
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
Referenzen
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 1 The Biology o 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62(2018).
- Ti, S. -C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011(2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826(2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Lazar, I. GelAnalyzer 19.1. , Available from: www.gelanalyzer.com (2024).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105(2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207(2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605(2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392(2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten