Method Article
ブタ脳組織からのチューブリン収量の最適化
要約
このプロトコールは、小規模の装置に最適化されたブタの脳からのチューブリンの高収率単離技術について説明しています。単離手順は、共沈降アッセイと透過型電子顕微鏡を使用して in vitro でチューブリン重合活性を測定する手順によって補完されます。
要約
神経細胞の樹状突起と軸索には微小管が豊富に含まれているため、あらゆる供給源からの神経組織はチューブリンの分離に最適な材料です。ここでは、複数の供給源からの神経組織にわずかな変更を加えて使用できるチューブリンを抽出する手順を紹介します。提示されたプロトコルでは、粗溶解物の新しい清澄化ステップが導入されており、これにより、最初の重合ステップが発生する前に不溶性破片の初期量が大幅に減少しました。この追加のステップにより、同じ器具を使用しながら追加の組織を処理できるため、処理されたホモジネートの相対体積が増加しました。新たに導入されたステップは、 in vitro 活性アッセイおよび透過型電子顕微鏡によって確認されたように、精製チューブリンの品質に大きな影響を与えません。記載されている手順には、組織の収集、輸送、組織の均質化、チューブリンの分離サイクル、FPLCを使用したイオン交換クロマトグラフィーによる最終研磨、その後の活性測定アッセイなど、すべての重要なステップが含まれています。精製チューブリンの均一性は97%以上であり、エレクトロスプレーイオン化とMALDI-TOFを用いたMS/MS分析で確認されました。
概要
α-チューブリンおよびβ-チューブリンヘテロ二量体によって形成される中空タンパク質フィラメント(直径24 nm)である微小管は、さまざまな重要な細胞プロセスに関与しています。それらは、細胞内構造の形成、運動性、細胞分裂、細胞分化、細胞輸送、形状維持、および分泌に関与しています1。微小管の細胞機能は、微小管関連タンパク質(MAP)や他のタンパク質との直接的または間接的な相互作用、またはチューブリンコード2で定義された複雑な翻訳後修飾によって影響を受ける可能性があります。
チューブリンファイバーは、核形成伸長メカニズムにおけるαサブユニットとβサブユニット間の動的な非共有結合相互作用から生じます。短い微小管が形成され、その後のチューブリン繊維の成長は、両端が可逆的に伸びることによって達成され、平行なプロトフィラメント2に配置されたチューブリンヘテロ二量体からなる円柱を形成する。動的不安定性とは、組み立てられた微小管がしばしばそのサブユニットと平衡状態にないが、定常状態を維持しながら、成長と収縮の長期にわたる相転移を経験する可能性があるという事実を指す1,2。
チューブリン繊維の動的不安定性は、主に、高純度グリセロール、DMSO、GTP/ATP、Mg2+、またはその他の化学物質(タキソールやポリカチオンなど)3の環境下で、高温重合と低温解重合のサイクルを使用する多くのチューブリン分離および精製手順で利用されています。ほとんどの分離手順4は、タンパク質クロマトグラフィー5,6,7,8,9によって行われ、これにより、ヌクレオシドジホスホキナーゼおよびATPase活性5を持つチューブリン関連タンパク質の分離が保証されます。同様の結果は、高塩緩衝液10を利用することによっても得ることができる。神経11、12、13、14および非神経15組織、魚類16(淡水および海洋の両方)、酵母、または異なる生産株11、12、13、14で過剰発現した組換え変異体17、および他の供給源9、18を含む複数の供給源を分画に用い、浄化。
提示されたプロトコルは、沈殿とタンパク質クロマトグラフィーを利用して、ブタの脳からチューブリンを高均質に単離します(図1)。主な利点は、日常的な分子生物学実験用の設備の整った研究室で利用可能な装置で比較的高い収率を達成できることです。
プロトコル
すべての溶液と機器の組成は、 材料表に記載されています。すべての溶液は、FPLCグレードの薬品を使用して調製し、使用前に0.22μmフィルターでろ過しました。すべての手術では、白衣、手袋、安全メガネなどの個人用保護具が使用されました。すべての器具は清潔で、洗剤の痕跡はありませんでした。手続き中は、適切な動物飼育ガイドライン(施設によって承認されたもの)が守られました。脳組織を含むすべての生物学的材料は、原材料として屠殺場から購入されました。プロトコルのどのステップでも生きた動物は使用されていません。
1. 高速タンパク質液体クロマトグラフィーのためのリン酸化セルロースカラムの活性化
- 乾燥ホスホセルロース樹脂15gに50%エタノール700mLを加え、ビーカーにスプーンでやさしく混ぜます。
- 懸濁液を適切な容量(700 mL)の適切なクロマトグラフィーカラムに注ぎます。フリット付きのピストンでコラムを閉じます。空のヘッドスペースの少なくとも10%を残してください。
注:他の容器を使用することもできますが、FPLCカラムを蠕動ポンプと組み合わせることで、樹脂の活性化と樹脂の損失に必要な時間を大幅に短縮できます。 - ロッカーシェーカーで60rpmで30分間インキュベートします。
- 樹脂を沈殿させ、流量を3mL / minに設定したペリスタルティックポンプを使用して、過剰な50%エタノールを除去します。樹脂を乾かさないでください。
- トップピストンを取り外し、50%エタノールを300mL加えます。カラムを閉じ、軽く振って、ペリスタルティックポンプ で 余分なエタノールを取り除きます。
- 残りのエタノールを取り除きます。カラムに300mLの超純水を加え、ピストンでカラムを閉じ、樹脂が再懸濁するまで傾けます。蠕動ポンプを使用して余分な液体を取り除きます。この手順を 3 回繰り返します。
- 上部のカラムを開き、0.5 M HClを500 mL加えてカラムを閉じ、樹脂を穏やかに傾けて再懸濁します。ロッカーシェーカーで60rpmで30分間インキュベートします。
- 蠕動ポンプを使用して余分な液体を取り除きます。0.5 M HClを300 mL加え、レジンを再懸濁し、余分な液体を取り除きます。
- 残ったHClを取り除き、超純水300mLをカラムに加え、ピストンでカラムを閉じ、レジンが再懸濁するまで傾けます。蠕動ポンプを使用して余分な液体を取り除きます。この手順を 3 回繰り返します。
- 700 mLのMESバッファー(25 mM MES、0.1 mM EGTA、0.5 mM MgCl2)をカラムに注ぎ、樹脂を傾けて再懸濁します。懸濁液をビーカーに注ぎ、1 M NaOHでpHを6.1に調整し、穏やかに撹拌して2時間インキュベートします。
- 樹脂を沈殿させ、液体をデカントし、300 mLのMESバッファー(pH 6.4)を加え、4°Cで一晩インキュベートします。
- 余分な液体をデカントし、96%エタノールを最終濃度20%に加え、使用するまで4°Cで保存します。
2. リン酸化セルロースカラム充填剤
- 12 mLの活性樹脂を、閉じた底プラグでクリーンなクロマトグラフィーカラムに注ぎます。樹脂が沈殿するのを待ちます。沈殿した樹脂の量は約5mLです。樹脂の上層(約2〜3 mm)を、軽い壊れたマトリックスの破片が堆積する可能性のある場所から取り除きます。
- 下部のプラグを取り外し、保存液を一滴ずつ自由に排出します。樹脂を乾かさないでください。
- カラムを閉じてFPLCシステムに接続します。PEM バッファー (100 mM PIPES pH 6.9、1 mM EGTA、1 mM MgSO4) で 1 mL/分 (最大圧力 1 bar) でカラムを 30 分間洗浄し、ピストンの高さを調整し、カラムを逆さまにして、次の 30 分間、同じ条件で逆流でカラムを洗浄します。
- 活性ホスホセルロースを充填したカラムを4°Cで数日間保存します。
3. チューブリンの分離と精製
注:チューブリンは分解されやすいため、迅速に進行することが重要です。すべての溶液、機器、および機器は、事前に準備、冷却、または必要に応じて加熱する必要があります。この手順は、推奨温度の変化に敏感です。脳組織は、精製中に生成される生物学的廃棄物の量を考慮して、解剖後できるだけ早く処理する必要があります。この手順は、6 つの 75 mL 超遠心キュベットを使用したローターに最適化されました。処理された組織の量は、利用可能な超遠心分離機に応じて増減することができます。
- 組織輸送
- 解剖したばかりのブタ脳500g(6〜8個)を3Lの輸送容器に入れ、氷冷した輸送緩衝液(4.1 mM MES pH 7、320 mMサッカロース、1 mM EGTA)を完全に浸すまで注ぎます。氷の上に5分間放置し、熱放散を容易にするためにトランスポートバッファーを新しいものに変更します。氷上で迅速に輸送し、さらなる処理を行います。
- 組織の均質化
注:組織の均質化は、冷蔵室の氷上で行われます。すべての機器は、自然重合を防ぐために事前に冷却する必要があります。チューブリンの主な供給源は灰白質であり、残りは次の手順で除去されます。- 100 mLの抽出バッファー(4.1 mM MES pH 7、520 mMサッカロース、1 mM EGTA、1 mM ATP、および0.1 mM GTP)を1 Lプラスチックビーカーに注ぎ、容器を含む重量W1(g)を決定します。ATPとGTPは使用直前に追加されます。
- ブタの脳を輸送容器から取り出し、適度な力を加えて、小脳全体、脂肪、大きな白質の塊、髄膜、血管を指で取り除きます。ハサミやピンセットも使用できます。不要な組織で縞模様になったブタの脳を、100mLの冷抽出バッファーを入れたビーカーに入れます。すべての組織が処理されるまで続行します。
- 処理された脳組織でビーカーを計量し、W2(g)重量を決定します。
- 抽出緩衝液の重量=W2〜W1という式に従って抽出緩衝液を添加する(例えば、400gの組織に対して、300gの抽出緩衝液を添加する)。
- 抽出バッファーで脳組織を予冷したキッチンブレンダーに移し、4〜8回の短い3秒パルスで処理します。
- 部分的に均質化された組織を高速分散ホモジナイザー(18,000 rpm)で1分間処理します。懸濁液を氷の上に3〜5分間置き、時々スプーンで混ぜます。5回、または完全に均質化されるまで繰り返します。
- 予め冷却した超遠心チューブに注ぎ、4°C、50,000 x gで10分間遠心します。上清はそのままにして、ペレットを捨てます。430 mLの清澄抽出物が収集されるまで繰り返します。
- 清澄化した抽出物を予め冷却した超遠心チューブ(各70 mL)に注ぎ、4°Cおよび75,000 x g で60分間遠心します。上清を収集し、ボリュームS1を決定します。
注:ローターが1つしかない場合は、次の遠心分離ステップ(37°C)のために温水浴で加熱します。
- 最初の重合
- 式V = S1/9 mLに従って、10x MEMバッファー(1 M MES pH 6.8、10 mM EGTA、10 mM MgCl2)を添加します(上清585 mLの場合、10x MEMバッファー65 mLを添加します)。よく混合し、グリセロールを3.5 Mに、GTPを0.1 mMの最終濃度に添加します。懸濁液を超遠心チューブに注ぎます(上清の量がチューブの量を超え、残りは廃棄されます)。
- チューブを上清と共に水浴中で37°Cで45分間インキュベートします。
- チューブを37°C、75,000 x gで90分間回転させます。上清(S2)の量を測定してMEMバッファーの量を決定し、ステップ3.3.4でペレットに追加してから、上清を廃棄します。ペレットは重合チューブリンが入っている場所に保管してください。
- 0.5 x S2容量の氷冷1x MEMバッファーを調製します。ペレットと一緒に各超遠心チューブに同量の1x MEMバッファーを加えます。添加した1x MEMバッファーにペレットを再懸濁し、懸濁液をメスシリンダーに移し、総容量を決定します。
- GTP を 1 mM の最終濃度に加えます。懸濁液をDounceガラスホモジナイザーに移し、氷上で約10分ごとに溶液を45分間均質化します。ピストンは壊れやすいため、慎重に操作する必要があります。
注意: その間、ローターを氷を入れた水で冷やします。
- GTP を 1 mM の最終濃度に加えます。懸濁液をDounceガラスホモジナイザーに移し、氷上で約10分ごとに溶液を45分間均質化します。ピストンは壊れやすいため、慎重に操作する必要があります。
- 均質化した溶液を予め冷却した超遠心チューブに注ぎ、75,000 x g 、4°Cで60分間遠心します。遠心分離後、上清量(S3)を測定します。
- 2回目の重合
- 上清を0.35 x S3 mLのグリセロールと混合し、GTPを1 mMの最終濃度まで加えます。上清を超遠心チューブに注ぎ、37°Cで45分間インキュベートします。
注:その間に、ウォーターバスでローターを37°Cにウォームアップします。 - ステップ3.4.1の重合上清を75,000 x g 、37°Cで60分間遠心分離します。 上清の量を決定します(S4)。
注意: これはオプションの停止ポイントです。チューブリン入りペレットは、液体窒素で衝撃凍結し、-80°Cで保存できます。 - 凍結したペレットを氷上で30分間ゆっくりと解凍し、0.25 x S4 mLのPIPESバッファー(500 mM PIPES pH 6.9、1 mM EGTA、1 mM MgSO4、1 mM DTT、0.1 mM ATP)を調製し、ペレットの入ったチューブに均等に分け、スプーンでペレットを再懸濁し、溶液をDounceガラスホモジナイザーに移します。氷上で10分ごとに45分間均質化します。
注意: その間、ローターを氷を入れた水で冷やします。 - 解重合チューブ入り溶液を超遠心チューブに注ぎ、4°C、75,000 x gで60分間遠心します。
- 上清を0.35 x S3 mLのグリセロールと混合し、GTPを1 mMの最終濃度まで加えます。上清を超遠心チューブに注ぎ、37°Cで45分間インキュベートします。
- 3回目の重合
- 上清(S5)の量を決定し、S5/9 mLのDMSOを添加します。懸濁液を超遠心チューブに注ぎ、37°Cで20分間インキュベートして重合します。
注:その間、ウォーターバスでローターを30°Cにウォームアップします。 - 重合したチューブリンを75,000 x g 、30°Cで60分間遠心分離します。 上清(S6)の量を決定し、ペレットを保持します。
- ペレットを0.25 x S6 mLのPEMバッファー(100 mM PIPES pH 6.9、1 mM EGTA、1 mM MgSO4、1 mM DTT、0.1 mM ATP)に溶解します。Dounceガラスホモジナイザーを使用して、可溶化を促進します。ペレットが完全に溶解するまで(乳白色の粒子が見えなくなるまで)、PEMバッファーを添加し続けます。
- 上清(S5)の量を決定し、S5/9 mLのDMSOを添加します。懸濁液を超遠心チューブに注ぎ、37°Cで20分間インキュベートして重合します。
- イオン交換クロマトグラフィー精製
注:逆イオン交換クロマトグラフィーは、ミクロチューブリン関連タンパク質の除去に使用されます。チューブリンは所定のpHでカラム内を自由に流れ、汚染タンパク質はホスホセルロース樹脂上に保持されます。すべてのステップは、4°Cに近い温度または氷上で行われます。FPLC精製前に、ろ過または遠心分離によってチューブリン抽出物を清澄化しないでください。 - FPLCとカラムをPEMバッファー(100 mM PIPES pH 6.9、1 mM EGTA、1 mM MgSO4、1 mM DTT、0.1 mM ATP)で平衡化します。平衡化のために少なくとも10カラム容量を使用してください。ポンプの流量は、カラム充塡に使用される流量(1 mL/分)を超えてはなりません。
- チューブリン懸濁液をゆっくりと(0.5 mL/分)カラムにロードし、レジンを流れる未結合タンパク質を回収します。
- チューブリンタンパク質を含む各1 mL画分に10 μLの100 mM GTPを添加します。
- チューブリンを含む画分を液体窒素で凍結し、すぐに液体窒素で容器に移します。チューブリンは、これらの条件下で数年間保存することができます。チューブリンを-80°Cで保存すると、安定性は数か月にわたって急速に低下します。
結果
分離および精製ステップでは、SDS-PAGE電気泳動用のサンプルを採取し、その後、Coomassie-blue染色を使用して分析しました(図2)。各サンプル20μLをLaemmliサンプルバッファー10μL(188 mM Tris-HCl pH 6.8、3% SDS (w/w)、30%グリセロール(v/v)、0.01ブロモフェノールブルー(w/w)、15% β-メルカプトエタノール)と混合し、95°Cで15分間インキュベートし、各サンプル4μLを12.5%アクリルアミドSDSゲルにロードし、還元および変性条件で1ゲルあたり30mAの定電流で分離しました。
その結果、相対チューブリン濃度の漸進的な増加と、汚染タンパク質の減少が確認されました。さらに、最初の遠心分離(ステップ3.2.7)では、このステップを省略した場合(図2A、B)と比較して、清澄化されたライセート中のチューブリンの有意な損失はありませんでした。
タンパク質濃度は、BCAアッセイ、Bradfordタンパク質アッセイ、およびSDS-PAGEゲルデンシトメトリー分析19 (図3)の3つの独立した方法を使用して決定しました。記載された手順を用いたチューブリンの全収率は、250gの神経組織から精製されたチューブリン123mgであった。測定時には、保存バッファー中の高DTT濃度がBCAアッセイに大きな影響を与えることを考慮する必要があります。PEMバッファーとPBSバッファーの両方を、DTTを添加すると、バックグラウンド吸光度が約0.900 A595増加し、BCAアッセイの容量が大幅に減少します(図3A)。DTTの悪影響は、純水で10倍希釈した後でも検出できます(データは示していません)。Bradfordアッセイは、デンシトメトリー分析で確認されたように、保存バッファー(図3B)の影響を受けていないようでした。
チューブリン調製物の純度は、2つの独立した施設(VRI Brno、Czech Republic;CEITEC MU Brno, Czech Republic)のエレクトロスプレーイオン化とMALDI-TOFを使用。どちらの分析でも、いくつかのアイソフォームにブタのチューブリンαとβが存在することが確認されました。全体の純度は 97.07% を超え(PSMs 1065)、最も多く見られる不純物は ホモ サピエンス ケラチン II 由来(PSMs 246、不純物の 2.24%)で、これはおそらくチューブリン単離と MS/MS 分析のためのサンプル調製中に導入されました。322 PSM と Sus scrofa 由来の血清アルブミン、アクチンガンマ、およびトリプシノーゲンのみで構成されるその他の不純物が、1 つのペプチド分解能(0.0069%)で同定されました。
その後の実験では、急速凍結後の重合能力の保存と液体窒素中での保存を確認しました。10 mg/mL アリコートを液体窒素から取り出し、氷上でゆっくりと解凍しました。自己組織化実験のために、DTT、ATP、および GTP を含む PEM バッファーでアリコートを希釈することにより、異なる濃度のサンプル(10 mg/mL、8 mg/mL、6 mg/mL、4 mg/mL、および 2 mg/mL)を調製しました。1つの希釈シリーズを37°Cで60分間インキュベートし、もう1つの希釈シリーズを氷上で60分間インキュベートしました。両シリーズを、21,000 x g および対応する温度(4°Cまたは37°C)で60分間遠心分離しました。上清30μLを除去し、SDS-PAGEに使用した。残った上清はピペットで丁寧に取り除き、廃棄しました。ペレットは、100 μMのPEMバッファーを加えて短時間洗浄した後、ピペットを使用して直ちに除去しました。その後、ペレットを50 μLの1倍濃縮SDSローディングバッファーに再懸濁して、ペレットと上清の相対濃度が保持されるようにしました。10 μL の SDS ローディングバッファーを各上清に加えました。すべてのサンプルは、SDS-PAGEおよびCoomassie Stainingを使用して分析しました(図4)。SDS-PAGEにロードされる各サンプルの量は、開始濃度に応じて調整されているため、濃度による降水量の差がより明確になります。PEM緩衝液中でのチューブリンの自己組織化試験により、温度依存的にチューブリン繊維を形成する能力が確認されました。
MAP2c駆動チューブリン20,21アセンブリアッセイを実施し、チューブリンが他のタンパク質と相互作用する能力を検証した22。MAP2cの段階希釈液は、100 μLの1 mg/mLチューブリンアリコートをMAP2cと混合して、最終濃度0 μMから8 μMの範囲に調製しました。すべてのサンプルは、新たに調製したPEMバッファーで1 mM DTTおよび1 mM GTPで希釈することにより、氷上で調製しました。チューブリンを異なる濃度のMAP2cで37°Cで15分間インキュベートし、21,000 x g、37°Cで60分間遠心分離しました。 ペレットの最終洗浄は、100 μLのPEMバッファーで2回行いました。この実験では、MAP2cを含まないサンプルのみがペレットを形成しなかったため、調製したチューブリンがMAP2cによる重合を受ける能力が確認されました(図5)。
さらに、共重合実験から得られたチューブリンフィラメントの存在を確認するために、透過型電子顕微鏡を用いた。MAP2cで沈殿させた精製チューブリンの懸濁液を、ネガティブ染色を用いた透過型電子顕微鏡法のために調製した。サンプルは、Formvarでコーティングされた炭素安定化銅グリッドに吸着されました。次に、グリッドを2%NH4MoO4 で陰性染色し、18,000倍の倍率と80kVの加速電圧で電子顕微鏡で調べました。明確な糸状構造と適切なサイズを持つ均質な微小管の存在は、天然のコンフォメーションで微小管を形成する能力を示しました(図6)。
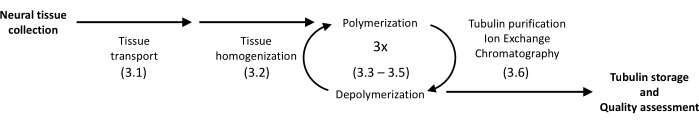
図1:チューブリンの分離と精製の概略図。 括弧内の数字はプロトコルステップを示しています。 この図の拡大版を表示するには、ここをクリックしてください。
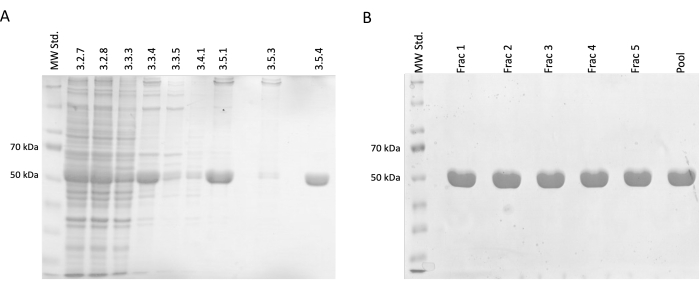
図2:チューブリンの分離と精製 (A)温度駆動重合を利用したチューブリン分離中に採取したサンプルのSDS-PAGE分析(1ラインあたり3 μL)。チューブリンの相対存在量(約50 kDa)の安定した増加に伴う不純物の減少が見られます。各行の上の数字は、プロトコルのステップ番号に対応しています。(B)リン酸化セルロース樹脂上のタンパク質クロマトグラフィー後に得られた画分のSDS-PAGE分析(1ラインあたり4μL)。 この図の拡大版を表示するには、ここをクリックしてください。
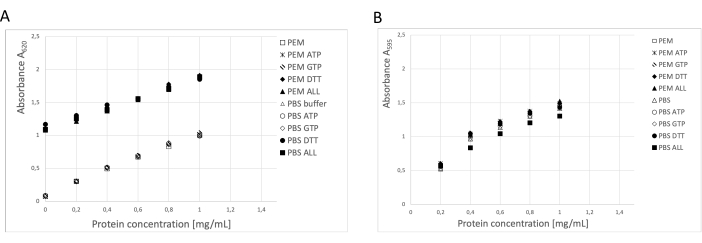
図3:タンパク質濃度。 PEM バッファーまたは PBS 中で 1 mg/mL までのウシ血清アルブミンの希釈シリーズを、PEM または PBS バッファー中に 0.1 ATP、1 mM GTP、1 mM DTT を別々に、または組み合わせて 0.1 mM ATP、1 mM GTP、および 1 mM DTT を含む BSA 希釈シリーズと比較しました。(A)BCAアッセイを使用した場合、DTT(ソリッドシンボル)を含むサンプルのバックグラウンドに大きな変化が見られました。(B)この効果は、ブラッドフォードアッセイで濃度を測定したときには検出されませんでした。 この図の拡大版を表示するには、ここをクリックしてください。
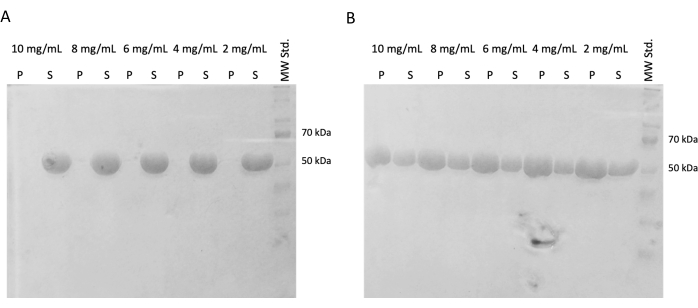
図4:Tubulin自己組織化アッセイ。 自己組織化アッセイのSDS-PAGE解析により、(A)4 °Cまたは(B)37 °Cでインキュベートした保存チューブリンが、広範囲の濃度で温度依存的に重合する能力が確認されました。(P-ペレット、S-上清;チューブリンのそれぞれの濃度は各ラインペアの上に示され、ロードされた各サンプルの量は10μgであった)。 この図の拡大版を表示するには、ここをクリックしてください。
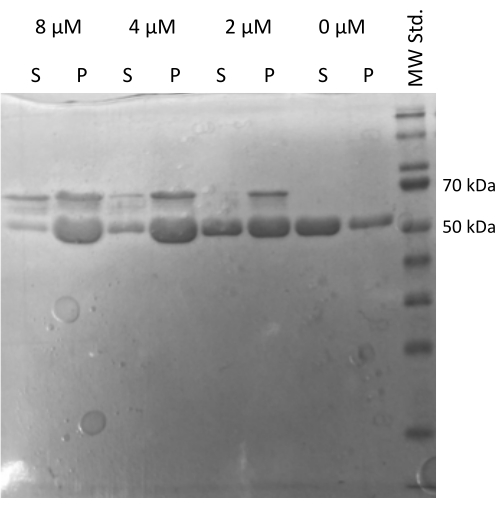
図5:チューブリン共沈降アッセイ。 MAP2c支援チューブリン集合体のSDS-PAGE解析により、貯蔵チューブリンが微小管関連タンパク質との相互作用によって濃度依存的に重合する能力が確認されました。MAP2cのモル濃度は、各線の上に示されています。(P - ペレット、S - 上清)。 この図の拡大版を表示するには、ここをクリックしてください。
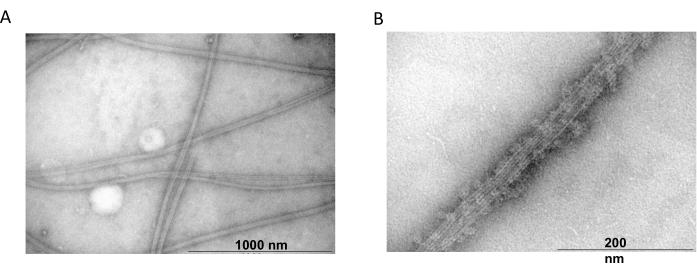
図6:透過型電子顕微鏡。 TEM顕微鏡写真は、チューブリンが(A)MAP2cタンパク質で装飾された均質なチューブリンフィラメントからなる適切な直径(B)の微小管に集合することを示しました。バーは1000 nm(A)と200 nm(B)に対応します。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ニューロンの樹状突起と軸索は微小管が豊富(最大40%)であるため、あらゆるソースからの神経組織はチューブリン分離のための優れた材料です23。脳組織は、十分な量で比較的容易に得ることができる。主な欠点は、不特定のレベルの翻訳後修飾であり、これはその後の実験に影響を与える可能性がある24,25。それ以外の場合、唯一の懸念は、特に暖かい条件で出発物質が急速に劣化することです。輸送前の熱放散を強化するために、いくつかのトランスファーバッファー交換を採用し、できるだけ早く開始される処理のための迅速な輸送を行いました。新鮮な組織は、加熱が防止される条件で解剖され、GTPとグリセロールを含む緩衝液で均質化され、チューブリン26がさらに安定化されます。
提示されたプロトコルでは、粗溶解物の清澄化ステップ(ステップ3.2.7)が導入されています。最初の重合前に遠心分離を長時間行うことは、チューブリンが不可逆的な修飾やプロテアーゼに対して感受性があるため、一般的には推奨されません。一方、本実験では、高Gフォースでの短いスピンが破片を減らし、チューブリンの品質に大きな影響を与えることなく、処理されたホモジネートの相対体積を増加させることを実証しました。
正確なタンパク質濃度の決定は、主にチューブリン結合タンパク質または阻害剤との相互作用を研究する場合、さらなる実験に不可欠です。調査中、タンパク質濃度アッセイの結果に大きな違いが見られました。主な理由は、高濃度のDTT、GTP、およびATPの存在がアッセイに干渉することでした。BCAアッセイは、保存バッファー中のDTTの量が多いため、上限にシフトし、アッセイ容量が減少しました。また、タンパク質とATPまたはGTPの吸光度最大値が類似しているため、280nmの吸光度を用いたタンパク質濃度測定に不整合が生じていました。同じ問題は、FPLC UV検出器からの読み取りでも顕著でした。最も信頼性が高く、安定した結果が得られたアッセイは、緩衝化合物の影響が観察されなかったBradfordタンパク質アッセイでした。それにもかかわらず、タンパク質標準希釈シリーズを保存バッファーに調製することが不可欠です。
精製されたチューブリンが適切な配列を作り出す能力は、その後の実験の前提条件です。チューブリンは、その性質上、グリセロールGTPが豊富な環境でも非常に分解しやすく、その結果、均質なフィラメントを形成する能力が低下します。精製プロセスを追跡し、保存されたチューブリンが重合して安定した通常のフィラメントになる能力を実験的に検証することが重要です。チューブリンの状態を検証するいくつかの独立した方法が、in vivoおよびin vitroで導入されています。その中でも特に顕著なのは、円二色性分光法27、表面プラズモン共鳴法28、熱シフト法29、重合阻害法30、免疫蛍光染色法31,32、共沈法22,33、透過型電子顕微鏡分析32であるを挙げることができます。このプロトコールで使用されるチューブリンの重合アッセイと共沈は、簡単に実行できます。チューブの底に発生するペレットまたはSDS-PAGEを使用して迅速に評価できます。一方、沈殿したチューブリンは凝集体の形態をとることができます。透過型電子顕微鏡などのより高度な方法を含めて、品質管理のために微小管繊維の存在を確認する必要があります。
開示事項
著者は何も開示していません。
謝辞
この研究は、チェコ共和国技術庁(project nr.TN02000017 - National Centre for Biotechnology in Veterinary Medicine - NaCeBiVet).
資料
| Name | Company | Catalog Number | Comments |
| 1.5 mL tubes | --- | --- | Common material |
| 10 mL tubes | --- | --- | Common material |
| 50 mL tubes | --- | --- | Common material |
| ATP | ROTH | HN35.2 | Analytical grade |
| DMSO | ROTH | A994.2 | Analytical grade |
| Dounce glass homogenizer | P-LAB | H244043 | Homogenizer |
| DTT | ROTH | 6908.1 | Analytical grade |
| EGTA | ROTH | 3054.3 | Analytical grade |
| Ethanol | PENTA | 70390-11001 | Analytical grade |
| Glycerol | ROTH | 6967.2 | Analytical grade |
| Graduated beakers | --- | --- | Common equipment |
| Graduated cilinders | --- | --- | Common equipment |
| GTP | MERCK | 36051-31-7 | Very high quality |
| HCl | PENTA | 19360-11000 | Analytical grade |
| Izolated box for tissue transport | --- | --- | Common equipment |
| Kitchen blender | Waring | 7011HB | Glass or plastic vessel |
| Liquid nitrogen | --- | --- | Common material |
| MES | ROTH | 6066.4 | Analytical grade |
| MgCl2 | MERCK | 814733 | Analytical grade |
| MgSO4 | PENTA | 43180-31000 | Analytical grade |
| NaOH | PENTA | 15650-11000 | Analytical grade |
| Optima XPN100 | Beckman Coulter | A94469 | Ultracentrifuge |
| Phosphocellulose column | VWR | GENO786-1291 | Empty column |
| Phosphocellulose resin | Creative - Biomart, inc | Phosphate-001C | Ion exchange resin |
| PIPES | ROTH | 9156.2 | Analytical grade |
| Saccharose | PENTA | 24970-31000 | Analytical grade |
| Scales | --- | --- | Common equipment |
| Scissors | --- | --- | Common equipment |
| Spoons | --- | --- | Plastic or glass |
| Ti45 rotor | Beckman Coulter | 339160 | Rotor for Ultracentrifuge |
| Tweezers | --- | --- | Common equipment |
| Ultra turrax IKA T18 basic | IKA | 356 1000 | Laboratory dispenser |
| Water bath 37 °C | --- | --- | Stirred |
参考文献
- Verhey, K. J., Gaertig, J. The tubulin code. Cell Cycle. 6 (17), 2152-2160 (2007).
- Murphy, D. B., Hiebsch, R. R. Purification of microtubule protein from beef brain and comparison of the assembly requirements for neuronal microtubules isolated from beef and hog. Anal Biochem. 96 (1), 225-235 (1979).
- Borisy, G. G., Marcum, J. M., Olmsted, J. B., Murphy, D. B., Johnson, K. A. Purification of tubulin and associated high molecular weight proteins from porcine brain and characterization of microtubule assembly in vitro. Ann NY Acad Sci. 253, 1 The Biology o 107-132 (1975).
- Weisenberg, R. C. Microtubule formation in vitro in solutions containing low calcium concentrations. Science. 177 (4054), 1104-1105 (1972).
- Roychowdhury, S., Gaskin, F. Separation of assembly-competent tubulin from brain microtubule protein preparations using a fast-performance liquid chromatography procedure. J Neurochem. 46 (5), 1399-1405 (1986).
- Weingarten, M. D., Suter, M. M., Littman, D. R., Kirschner, M. W. Properties of the depolymerization products of microtubules from mammalian brain. Biochemistry. 13 (27), 5529-5537 (1974).
- Souphron, J., et al. Purification of tubulin with controlled post-translational modifications by polymerization-depolymerization cycles. Nat Protoc. 14 (5), 1634-1660 (2019).
- Jacobs, M., Huitorel, P. Tubulin-associated nucleoside diphosphokinase. Eur J Biochem. 99 (3), 613-622 (1979).
- Munguía, B., et al. Purification of native M. vogae and H. contortus tubulin by TOG affinity chromatography. Exp Parasitol. 182, 37-44 (2017).
- Castoldi, M., Popov, A. V. Purification of brain tubulin through two cycles of polymerization-depolymerization in a high-molarity buffer. Protein ExpPurif. 32 (1), 83-88 (2003).
- Minoura, I., et al. Overexpression, purification, and functional analysis of recombinant human tubulin dimer. FEBS Lett. 587 (21), 3450-3455 (2013).
- Liu, C., Yao, J., Yin, J., Xue, J., Zhang, H. Recombinant α- and β-tubulin from Echinococcus granulosus: Expression, purification and polymerization. Parasite. 25, 62(2018).
- Ti, S. -C., Wieczorek, M., Kapoor, T. M. Purification of affinity tag-free recombinant tubulin from insect cells. STAR protoc. 1 (1), 100011(2020).
- Bodakuntla, S., Jijumon, A. S., Janke, C., Magiera, M. M. Purification of tubulin with controlled post-translational modifications and isotypes from limited sources by polymerization-depolymerization cycles. JVisExp. (165), e61826(2020).
- Sackett, D. L., Werbovetz, K. A., Morrissette, N. S. Isolating tubulin from nonneural sources. Methods Cell Biol. 95, 17-32 (2010).
- Modig, C., Strömberg, E., Wallin, M. Different stability of posttranslationally modified brain microtubules isolated from cold-temperate fish. Mol Cell Biochem. 130 (2), 137-147 (1994).
- Fourest-Lieuvin, A. Purification of tubulin from limited volumes of cultured cells. Protein Exp Purif. 45 (1), 183-190 (2006).
- MacRae, T. H., Gull, K. Purification and assembly in vitro of tubulin from Trypanosoma brucei. Biochem J. 265 (1), 87-93 (1990).
- Lazar, I. GelAnalyzer 19.1. , Available from: www.gelanalyzer.com (2024).
- Jansen, S., et al. Quantitative mapping of microtubule-associated protein 2c (MAP2c) phosphorylation and regulatory protein 14-3-3ζ-binding sites reveals key differences between MAP2c and its homolog Tau. JBiol Chem. 292 (24), 3-3 (2017).
- Melková, K., et al. Structure and functions of microtubule associated proteins Tau and MAP2c: Similarities and differences. Biomolecules. 9 (3), E105(2019).
- Herzog, W., Weber, K. Fractionation of brain microtubule-associated proteins: Isolation of two different proteins which stimulate tubulin polymerization in vitro. Eur J Biochem. 92 (1), 1-8 (1978).
- Castle, A. G., Crawford, N. Isolation of tubulin from pig platelets. FEBS Lett. 51 (1), 195-200 (1975).
- Wloga, D., Joachimiak, E., Fabczak, H. Tubulin post-translational modifications and microtubule dynamics. Int J Mol Sci. 18 (10), E2207(2017).
- Lafanechère, L., Job, D. The third tubulin pool. Neurochem Res. 25 (1), 11-18 (2000).
- Arai, T., Ihara, Y., Arai, K., Kaziro, Y. Purification of tubulin from bovine brain and its interaction with guanine nucleotides. J Biochem. 77 (3), 647-658 (1975).
- Mahaddalkar, T., et al. Structural investigations into the binding mode of a novel noscapine analogue, 9-(4-vinylphenyl) noscapine, with tubulin by biochemical analyses and molecular dynamic simulations. J Biomol Struct Dyn. 35 (11), 2475-2484 (2017).
- Chen, H., et al. Structure-activity relationship study of novel 6-Aryl-2-benzoyl-pyridines as tubulin polymerization inhibitors with potent antiproliferative properties. J Med Chem. 63 (2), 827-846 (2020).
- Yao, D., et al. Ferulin C triggers potent PAK1 and p21-mediated anti-tumor effects in breast cancer by inhibiting Tubulin polymerization in vitro and in vivo. Pharmacol Res. 152, 104605(2020).
- Sweetnam, P. M., et al. The role of receptor binding in drug discovery. JNat Prod. 56 (4), 441-455 (1993).
- Qi, Z. -Y., et al. Synthesis and biological evaluation of 1-(benzofuran-3-yl)-4-(3,4,5-trimethoxyphenyl)-1H-1,2,3-triazole derivatives as tubulin polymerization inhibitors. Bioorg Chem. 94, 103392(2020).
- Sáez-Calvo, G., et al. Triazolopyrimidines are microtubule-stabilizing agents that bind the vinca inhibitor site of tubulin. Cell Chem Bio. 24 (6), 737-750 (2017).
- Bellocq, C., et al. Purification of assembly-competent tubulin from Saccharomyces cerevisiae. EurJ Biochem. 210 (1), 343-349 (1992).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved