Method Article
通过冷冻STEM断层扫描原 位 可视化细胞器
摘要
冷冻 STEM 断层扫描提供了一种可视化完整细胞细胞器的方法,无需包埋、切片或其他侵入性制剂。获得的3D分辨率目前在几纳米的范围内,视场为几微米,可访问厚度约为1微米。
摘要
低温电子显微镜(cryo-EM)依赖于嵌入其天然水介质中的生物或有机标本的成像;水被固化成玻璃(即玻璃化)而不结晶。冷冻电镜方法最近广泛用于以近原子分辨率确定生物大分子的结构。该方法已扩展到使用断层扫描研究细胞器和细胞,但传统的宽场透射EM成像模式在标本厚度方面受到严重限制。这导致了使用聚焦离子束铣削薄片的做法;高分辨率是通过重建的子断层图平均获得的,但剩余层外的三维关系丢失。厚度限制可以通过扫描探头成像来规避,类似于扫描EM或共聚焦激光扫描显微镜。虽然材料科学中的扫描透射电子显微镜(STEM)在单个图像中提供原子分辨率,但低温生物标本对电子辐照的敏感性需要特殊考虑。该协议提供了使用STEM进行冷冻断层扫描的设置。描述了双聚光镜和三聚光镜系统显微镜的基本局部配置,而自动化则由非商用SerialEM软件提供。还描述了批量采集和与先前采集的荧光图的相关比对的增强功能。例如,我们展示了线粒体的重建,指出了内膜和外膜和磷酸钙颗粒,以及周围的微管,肌动蛋白丝和核糖体。冷冻STEM断层扫描擅长揭示细胞质中的细胞器结构,在某些情况下,甚至可以揭示培养中贴壁细胞的核外围。
引言
细胞器的三维(3D)可视化是现代细胞生物学中的一项重要任务。考虑到所涉及的尺度,从分泌囊泡的数十纳米到细胞核的数微米,找到适合所有应用的单一显微镜技术具有挑战性。虽然现代荧光显微镜在分辨率方面可以跨越大部分范围,但只有标记的分子出现。细胞剧院仍然是电子显微镜的领域。传统的化学固定、塑料包埋和重金属染色方法具有很强的侵入性,因此结果可能取决于样品制备的细节。另一方面,冷冻电镜受到玻璃化水介质需求的约束;形成的冰晶衍射电子照明,导致对比度高于目标有机材料的对比度伪影。
在过去的十年中,开发或适应细胞研究的EM成像技术激增1。高压冷冻结合迭代聚焦离子束(FIB)铣削和使用扫描电子显微镜(即FIB-SEM)的连续表面成像是目前大型试样的首选方法2。低温软X射线断层扫描(cryo-SXT)适用于几微米大小的样品,受软X射线在水中的特征吸收长度限制3,4,5。该量表包括许多完整的细胞类型,X射线吸收对比的定量性质增加了浓度测量6或光谱学7的一个方面。当与断层图平均相结合时,基于相衬透射电子显微镜(TEM)的冷冻透射电子断层扫描(cryo-ET)可为大分子或复合物提供最高分辨率8,9,10。然而,完整的细胞器很少如此规则,以至于它们可以平均整个细胞。此外,由于试样中的非弹性散射(涉及能量损失)和磁性物镜11,12中的色差的组合,宽场TEM的传统模式将试样厚度限制在几百纳米。较大的能量扩散要求使用能量滤波器来消除由此产生的失焦雾霾,但敏感的标本仍然会遭受辐射损伤,而图像信号会随着厚度的增加而呈指数级减弱。
另一种成像模式,扫描透射EM(STEM),避免了对能量过滤的需求,并保留了非弹性散射电子以进行图像形成,尽管目前的分辨率低于TEM断层扫描(图1)。事实上,没有形成真实的图像。相反,就像在扫描EM中一样,测量是逐点进行的,图像由计算机组装。放大倍率仅由扫描步骤的大小决定,而不改变镜头电流。如果配置得当,冷冻STEM断层扫描(CSTET)的样品厚度的有用范围可以达到1.5甚至2μm,尽管舒适区,其中有用信号强度仍然是照明的很大一部分,约为600-900 nm11,13。这足以看到细胞质的很大一部分,偶尔可以看到细胞核的边缘。在实践中,我们发现通过插入低温流体的标准方法进行玻璃化比STEM成像对厚度施加更严格的限制。本视频文章的目的是促进将CSTET整合到研究实验室和显微镜设施的细胞和细胞器成像工具箱中。
第一个挑战是,CSTET中的显微镜操作尚未像冷冻透射电镜断层扫描那样标准化用于生命科学应用。STEM硬件很少(如果有的话)瞄准冷冻电镜市场。然而,随着最新一代显微镜的出现,这种情况正在发生变化,许多现有工具都可以进行改装。STEM作为一种技术已经起飞,并在很大程度上接管了材料科学,对低温和低剂量方法的兴趣也萌芽了14,15。材料科学文献中充斥着首字母缩略词BF-STEM,ADF-STEM,HAADF-STEM,4D-STEM,DPC-STEM等,这增加了混乱。我们在这里提供一个推荐的起点,根据我们在魏茨曼科学研究所的集体经验,它为基于明场(BF)STEM成像的有用结果提供了最通用的协议16。它绝不会穷尽甚至探索各种可能性,但它将作为进一步增强的基础。虽然我们强调冷冻STEM,但大多数协议与塑料嵌入部分的室温STEM断层扫描同样相关。
STEM的本质是用聚焦电子探头(图1),照明锥扫描标本,并逐像素记录来自衍射(散射)平面的信号,以产生2D图像17,18。无定形标本,包括大多数细胞材料,将在传输过程中产生漫散射模式。最简单的实用STEM配置是放置一个圆形探测器来记录中心盘(即,在没有标本的情况下传输的探头照明)。试样将电子从该照明锥体散射到信号减弱的程度。这会产生BF图像 - 标本在明亮的背景上看起来很暗。环形探测器也可以(或代替)用于检测照明锥外部标本的散射。取出标本后,没有信号。当标本就位时,物体在暗场 (DF) 图像中的深色背景上显示为明亮。STEM(BF、环形暗场[ADF]、高角度环形暗场[HAADF]等)的命名法主要是指探测器的采集角度范围。
照明的会聚角代表了STEM对细胞断层扫描的基本适应。当重中之重是高分辨率时,收敛角应尽可能大。(这类似于共聚焦激光扫描显微镜;分辨率由探头直径决定,探头直径以波长除以数值孔径的比例。请注意,我们指的是EM的半角或半收敛角。另一方面,当优先考虑景深时,分辨率的妥协提供了很大的优势,因为聚焦光束保持大致平行的距离等于波长除以半角平方的两倍。理想情况下,整个细胞体积保持在焦点19中。例如,在 300 keV 处,电子去布罗意波长为 0.002 nm,因此 1 mrad 的收敛产生 2 nm 的分辨率和 4 微米的景深。在这些条件下,即使在数据收集过程中不聚焦也可以进行断层扫描,但只能在采集开始时进行一次。具有传统断层扫描功能的 STEM 可以达到 7 或 8 mrad 的半会聚角;因此,原则上,我们可以达到0.25 nm量级的分辨率,但焦深仅为62 nm。这对于细胞成像来说显然太薄了。带有三个聚光镜的更先进的显微镜可在相当大的范围内连续调整半会聚角。对于更传统的双聚光镜配置,收敛由聚光镜(C2)孔径离散固定。
对于坚固的塑料嵌入样品,可以在每次倾斜时记录一个焦点序列,并将它们组合在一起以获得高分辨率20,但对于低温样品,辐射预算受到太严重限制。最后,在权衡BF或DF成像的优势时,对于厚标本,应考虑试样中多重弹性散射的影响。BF信号受多重散射的破坏较小,对于厚样品16,21,显示出更高的分辨率。
一个有用的经验法则是设置比收敛大几倍的收集角度。标本越厚,收集盘应越大。磁盘太小将提供低信号强度;太大的磁盘会导致图像对比度差,因为只有最高角度的散射才会起作用。应针对给定样品优化收集角度。作为(衍射)相机长度函数的探测器角度必须独立校准。它们可以通过显微镜软件方便地显示。在实践中,收集与照明半角之比分别为θ到α的2到5倍(图1)是细胞标本CSTET的推荐起点。
以下协议描述了使用流行的SerialEM软件进行显微镜控制的STEM断层扫描操作22,23。SerialEM不依赖于特定的制造商,它广泛用于TEM断层扫描。大多数层析成像设置操作可以直接从TEM进行。SerialEM策略是将扫描系统建模为相机。这使得从TEM到STEM的简单交叉成为可能。但是,应该记住,放大倍率和分档等参数完全是人为的。重要的参数是以微米为单位的视场、视野中的像素数和曝光时间。像素间距或采样是线性场除以像素数,而停留时间是像素数除以曝光时间。
STEM和CSTET的最低配置涉及显微镜上的三个功能:扫描发生器,STEM检测器和断层扫描控制软件。该协议引用了 FEI/赛默飞世尔科技 (TFS) 的命名法,但概念是通用的。TFS的专有软件已经在JoVE的TEM24中进行了描述,STEM操作非常相似。
我们假设显微镜已由服务团队或经验丰富的员工提前对准,并且可以通过加载文件来调用色谱柱对准。微小的调整称为直接对准,可以存储在所谓的FEG寄存器(TFS显微镜)中。直接对齐包括旋转中心、枢轴点、衍射对齐和聚光镜散光补偿。必须反复执行调整。请注意,TFS显微镜实现了不同的纳米探针(nP)和微探针(μP)模式;对于给定的聚光镜孔径,它们分别提供相对较窄或较宽的视场,在TEM中具有平行照明,在STEM中具有或多或少的收敛(紧密聚焦)电子束。其他制造商使用不同的方案来覆盖会聚角的范围。
在开始之前,应根据所研究的样品选择视场 L和采样(像素宽度)l。例如,对于 l = 1 nm/像素,应选择覆盖 4 μm2 视野的 4,000 x 4,000 像素图像。分辨率充其量是空间采样的两倍,因此2 nm和探头直径d应该与之匹配。探头角度的校准超出了该协议的范围,因此我们假设可以使用表格或屏幕读数。探头直径大约是电子波长除以半会聚角(以弧度为单位):d = λ/θ。对于 300 keV 电子,波长 λ 为 0.002 nm,对于 200 keV 电子为 0.0025 nm,因此 1 mrad 的 θ 将分别提供 2 或 2.5 nm 的光斑直径。
该协议的呈现越来越复杂。第一个任务是生成STEM图像,这取决于显微镜制造商的软件,然后是倾斜系列,我们使用SerialEM。许多读者无疑会熟悉SerialEM,因此更复杂的任务自然而然地出现。没有必要严格遵循程序。与自动化相关的开发可以直接用于STEM和TEM。有经验的用户可能会反转协议,从荧光图的相关配准开始,然后继续设置批量断层扫描。更多详细信息可以在 SerialEM 本身的大量文档和教程库中找到,包括最近一篇关于自动化25 最新发展的 JoVE 文章。
研究方案
1. 干设置
- 初步对齐:加载列对齐文件,然后打开 柱阀。如果使用侧入式冷冻支架,请打开 冷冻护罩。以 TEM 模式启动。光束应出现在屏幕上。如果没有,请降低放大倍率。
- 按下控制面板上的按钮,使显微镜以共心聚焦。
- 将光斑尺寸设置为一个方便的值(例如,6),以便直接或使用内置相机(取决于显微镜型号)可视化荧光屏。
- 将显微镜设置为STEM模式,并验证焦点是否使用聚光镜(强度)而不是物镜。设置以真为中心的焦点。然后,退出衍射模式进行初始调整。
- 确保光束没有消隐。降低放大倍率,直到光束出现在屏幕上。将光束偏移调整到中心,并将放大倍率提高到约 70kx,同时将光束保持在中心。
- 插入所需的聚光镜孔径,通常为 50 μm。检查光圈居中。当稍微来回转动对焦旋钮时,光斑应该会扩大和收缩,但会保持原位,就像飞机切割假想的垂直沙漏一样。如果光圈未居中,照明将横向移动,就像沙漏倾斜一样。
- 将光束对焦,然后按对齐选项卡中的 强度列表 焦点(如果可用),或返回到共心焦点,如 1.2 中所示。将光束位置重新调整到中心。
- 调整旋转中心。将焦点步进轮旋转到最小或高于一步,使光束轻轻脉冲,并确保在焦点上下移动时保持静止。
- 选择枢轴点,并通过 X 和 Y 调整将两个点组合在一起。
注意: 如果在 TFS 仪器上安装了相板,则仅应使用 X 调整。 - 稍微散焦光束,并调整聚光镜柱头以使圆盘变圆。通过焦点上下优化;通过焦点时,不应有向一个方向或另一个方向拉长的趋势。
- 使镜头归一化。然后,在使用光束偏移保持光斑居中的同时,逐渐将放大倍率增加到约240kx,并重复旋转中心和枢轴点调整(步骤1.6-1.8)。
- 返回衍射模式。光束应在荧光屏上显示为均匀的圆盘。相机长度(CL)现在有效地控制了到探测器的光学距离,就像在X射线晶体学中一样。改变它并观察圆盘收缩和放大,就好像屏幕位置会朝向或远离标本一样。此锥体代表 BF 照明。
注意:对于每个CL,都需要调整衍射对齐,以便将投影光束带到中心轴。通常不需要全部优化它们,只需要一个(或几个)用于检测。 - 以高放大倍率启用 STEM 模式。
- 如果有BF STEM检测器,请从它开始。将载物台带到具有空孔的区域,并使用所需的CL调整衍射对齐以使光束居中。
- 许多显微镜仅配备HAADF检测器;有一个技巧可以将其用作BF探测器。首先,缩回检测器,将光束如上所示在直接对准中,插入一个物镜孔径,通常是小孔径,例如20μm,并调整其位置以均匀地包围光束。(最简单的方法是插入标本或测试网格以查看照明周围的光晕)。然后,使用衍射对齐将光束移离轴并移动到检测器区域。在屏幕上观察光束的同时插入和缩回探测器,以确认光束被探测器阻挡。
- 在显微镜软件中启动扫描并调整亮度和对比度(B / C)设置,以便在光束消隐时信号接近0,当全照明落在探测器上时接近饱和。使用示波器显示屏提供帮助。这些设置可能会以意想不到的方式耦合,因此应多次迭代调整。
- 在高放大倍率寄存器(SA模式)下将显微镜返回到相对较低的放大倍率,而不进入低放大倍率(LM)模式。
- 记下屏幕电流以供以后参考(请参阅步骤 3.1.1)。电流可以通过喷枪镜头和光斑尺寸设置来改变,就像在TEM中一样,增加的数字对应于电流的减小。
- 此时,保存 FEG 寄存器以方便返回到标准值。
注意:该设施可以准备一组默认的FEG寄存器,以便用户可以从工作配置开始。
2. 放置试样
- 在LM TEM模式下,确保网格不透明。找到一个网格正方形以进行初始调整。找到一些空旷的区域、洞或撕裂的网格正方形很方便。记录舞台位置,以便方便地返回它们。
- 将样品带到以工心为中心的高度。有几种方法可以做到这一点。例如,使用载物台摆动器倾斜网格,同时沿 Z 轴移动标本高度,直到图像停止横向移动。或者,在观看屏幕上标记一些特征并将舞台倾斜 30°。要素将横向移动。调整试样高度以使其恢复到原始位置。增加放大倍率或载物台倾斜度以细化。返回 0° 倾斜。
- 返回 STEM 模式并插入 STEM 检测器。转到最低高放大倍率 (SA) 模式。确保在计算机屏幕上观察到图像。快速扫描以避免不必要的暴露;通常为 1 μs/像素或更低。请注意,当扫描速度过快时,图像可能会在左边框处失真(见 图2)。
- 按下 真心对焦,增加放大倍率,并在扫描时优化对焦。使用显微镜软件提供的聚焦放大镜很方便。
- 调整聚光镜散光。这可以通过支气管图方法最精确地完成。将光束放在薄的样品区域上,聚焦在透射光束爆炸的点上,在两侧样品的阴影图像之间。然后,调整冷凝器调谐,使中央圆盘变圆。这需要一些练习,特别是对于低温样品。
注意:另一种方法是找到一些金颗粒(通常用作断层扫描中对齐的基准标记)。增加放大倍率并上下聚焦,调整散光,使颗粒保持圆形而不会在任一方向上伸长。 - 转到LM STEM模式并继续扫描以查找感兴趣的区域。如有必要,大致在此时重新调整探测器 B/C 设置(步骤 1.13.3)。
3. 记录图像
- 估计记录剂量。根据经验,整个断层扫描的目标是 100-150 e-/Å2 。检查每个标本的剂量耐受性。以安培 (A) 为单位的电流除以每个电子的电荷表示 e-/s 的计数,该计数乘以曝光时间 T(以秒为单位),然后除以 Å2 中的视场。为方便起见,以纳安为单位表示电流(从屏幕上读取),以微米为单位表示视野宽度,以秒为单位表示帧曝光时间,并使用以下适当因素:
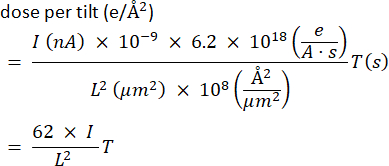
此数字应乘以倾斜次数,以获得系列中的总曝光量。例如,在电流I = 0.04 nA,场L = 4μm,曝光时间为12秒的情况下,我们每次倾斜获得1.9 e-/Å 2,或者对于一系列61个投影,我们获得约110 e-/Å2。 - 将载物台返回到孔中(或缩回网格),并使用光斑尺寸和/或枪透镜设置调整光束电流,以达到所需的屏幕电流。如果测量值为0,则插入更大的C2孔径以增加电流。然后,通过将测量值除以直径比的平方来校正,最后返回到较小的孔径。
- 根据步骤1.13.3细化B/C设置,最后将载物台返回到感兴趣区域,并在成像条件下重新检查直接对齐和散光。
- 获取测试图像。
4. 带串行EM的断层扫描
- 在显微镜计算机上启动SerialEM服务器(SerialEM通常安装在另一台计算机上)。然后,打开 串行EM。STEM在SerialEM中像相机一样出现,具有相同的界面。确保通信针对设置正确运行。例如,显微镜选项卡应显示正确的放大倍率。如果这不起作用,请在此处停止并进行故障排除。
- 找到摄像机和脚本选项卡,然后打开 设置。确保选择了 STEM 相机,并为每种模式选择合适的合并和停留时间。确保适当的检测器出现在左下角的"获取通道"框中。按底部的 获取 进行测试。同样,如果没有任何反应,或者如果光束没有取消空白,请不要继续。停止并检查通信。
注意:这些模式的使用方式与TEM断层扫描类似。分箱是与TEM兼容的一种技巧。重要的参数是像素数;不同的显微镜系统使用不同的分档来达到相同的计数。- 查看和搜索应该是像素相对较少的快速扫描(例如,1 秒时为 512 x 512 像素)。
- 对焦通常是录制速度快的小区域。因此,在低剂量模式下,选择"聚焦"以与"记录"模式不同的放大倍率,这有助于提高准确性。保持光斑尺寸不变。
- 对于记录模式,请使用上面在曝光估计中选择的参数。如果可用,还可以选择 "动态对焦",这将在倾斜图像中逐行校正对焦。
- 为方便起见,请稍后选择预览的分箱与视图的分箱相同(请参阅增强功能 #1,步骤 5.5)。图像大小(像素数)不必相同。
- 使用试用模式在采集过程中使记录区域保持居中。它可以类似于View,但请注意帧左侧没有明显的扫描失真(有关示例,请参见 图2 )。同样,在低剂量模式下,试用版的放大倍率可能与记录模式下不同。
- 立即使用蒙太奇模式进行网格扫描。它应该足够像素密集以找到感兴趣的区域;建议:512 x 512 或 1024 x 1024。确保图像良好,动态范围不错(在图像显示控件中可以看到),因为此模式用于查找标本区域。
- 保存设置文件,以便将这些选项保留为下一个会话的默认值(如果程序崩溃,可能会很快发生)。
- 测试图像偏移和载物台偏移校准。在微探针(或纳米探针)模式下,单击 "查看图像",将鼠标悬停在其上,按住按钮,然后沿对角线拖动约四分之一的视野。然后,采取另一种观点。图像应完美重叠。在按住 Shift 键 的同时再次拖动以重复此操作(以强制舞台移动)。图像应该很好地重叠,尽管可能不太精确。
- 转到 LM 模式并测试载物台偏移。如果这些测试失败,请停止并进行故障排除。其余的将不起作用。
- 制作整个网格的蒙太奇LM地图。这也可以在TEM中完成。
- 转到最低放大倍率 STEM 模式,在该模式下,图像不会被光圈阻挡,通常在 185 倍左右。
- 单击导航 器菜单>打开。然后,单击导航 器菜单>导航选项>取消选择将地图转换为字节。
- 选择"导航器"菜单>"蒙太奇和网格">"设置完整蒙太奇"。将打开一个菜单。要检查的选项包括:移动舞台而不是移动图像、如果导航器打开,则从每个蒙太奇制作贴图,以及使用蒙太奇贴图,而不是记录参数。图像网格应大致为 6 x 6 或 7 x 7。查找要记录的总区域。如果需要太多图像,则可能无法从显微镜正确读取放大倍率(图3)。停下来检查。
- 要开始蒙太奇采集,请按蒙太奇控件上的开始或"摄像机和脚本"下的蒙太奇。 将打开另一个菜单以选择文件参数:mrc,存储为整数,然后在另一个对话框中,选择要存储的文件名。确保将数据存储在合适的数据区域中,而不是在SerialEM自己的用户设置下。建议不要将大型数据存储在系统所在的C盘上。
- 采集完成后,蒙太奇将出现在主窗口中(图4)。现在,可以使用导航器上的标记和点在网格中导航,就像在TEM中一样。
- 重新检查散光校正。通常,快速扫描一小块区域并与焦点一起调整就足够了,以便金纳米颗粒等点状特征在高放大倍率下进出焦点(如SEM上)时保持完全圆形。更保守地说,在修复散光之前,可以重复步骤1.5-1.8的直接对齐。
- 将高放大倍率成像与 LM 蒙太奇对齐。
- 转到 LM 蒙太奇上具有一些易于识别的特征的位置。添加一个点,单击导航 器窗口>添加点,然后单击该功能。再次按下(停止添加)以停用。
- 以最低高等(HM)放大倍率拍摄视图或试用图像,并找到指示的项目。将标记放在该位置(绿色十字),并在"导航器"窗口中突出显示相应的点,在" 导航器"菜单中>"移动到标记..."中,在打开的对话框中,选择 "所有地图 "和 "保存 Shift",如图 5 所示。
- 通过将舞台移动到其他位置并验证HM图像是否在LM蒙太奇中选择的相同位置居中进行测试。如果该特征在 HM 图像中不可见,则 LM 和 HM 模式之间的偏移可能太大。在这种情况下,请在较大的区域上制作多边形蒙太奇。单击 导航器 窗口>添加面,选择一些点,然后再次单击 添加面 以关闭。单击" 导航器"菜单>"蒙太奇"和"网格">设置多边形蒙太奇,>"蒙太奇控件"开始。然后,如上找到相应的点,然后单击 切换到标记...。
- 设置低剂量模式。
- 打开低剂量 控制 选项卡并选中 低剂量模式 框。
- 选中 持续更新 并转到 查看。为此模式选择显微镜放大倍率,通常为最低或接近最低。选择接下来的每个模式并设置适当的放大倍率。应设置记录以达到所需的像素大小,并且焦点放大倍率应足够高,以便清晰地解析基准标记或其他用于聚焦的高对比度特征。然后,立即取消选中 连续更新。
注意:试用模式可以设置为类似于记录,在这种情况下,跟踪区域必须从记录区域移开以尽量减少曝光,也可以设置为低放大倍率,包括大部分周围环境。 - 拍摄视图图像并使用定义区域位置设置试用位置:试用。
注意:建议#1:鉴于采样区域和时间的变化,低磁试验增加的曝光可能很小。只要网格条不进入视野,这种跟踪方法通常更可靠。建议#2:也可以更新光斑尺寸,以便针对不同的模式调整剂量,例如焦点。为了显微镜光学设置的稳定性,我们建议不要这样做,而是将光斑尺寸保留为适合记录,然后根据需要调整曝光时间以获得更快的扫描模式。 - 单击 "低剂量控制"选项卡>"转到:Rec.",然后单击" 导航器"菜单>"打开映像状态">"添加当前状态"。给它起个名字,以便于回忆(例如,用于微探针STEM的μP STEM)。可以为不同的任务定义不同的状态。
- 将载物台移动到感兴趣的断层扫描位置(有关以下导航器使用的更多信息)。
- 在导航器中添加点,方法是单击 导航器窗口>添加点。
- 通过选择" 任务">"真心性">"粗糙"来优化真心高度。"导航器"窗口>更新 Z。
- 设置"焦点"和"试用"区域。首先,拍摄视图图像。然后,在" 低剂量控制 "选项卡的" 定义区域位置"下,选择 "焦点"或"试验"。沿倾斜轴调整两个区域的位置。焦点不应与"记录"区域重叠。
注意:请记住,有一些过冲,特别是在左边缘,因此两者都不应紧邻录制区域。通过在记录放大倍率下重复扫描,然后在放大倍率下获得更广阔的视野,可以在测试区域评估过冲的程度。
- 为了获得良好的测量(根据经验可选),每次拍摄视图或预览图像时,将载物台倾斜至 +60°,然后倾斜 -60°,以确保网格条不会进入以绿色显示的记录区域视野。
- 设置倾斜系列。
- 打开一个新文件以保存数据,方法是单击 "文件>打开新文件 ",然后选择一个文件名。选择 倾斜系列菜单>倾斜系列设置 (图6)。故障排除:如果" 打开新" 按钮为灰色,请检查之前的倾斜系列是否已终止。如果没有,请单击" 倾斜系列">"终止"来终止。
- 在 "倾斜到 "和 "结束于 "框中设置极端倾斜角度(通常分别为 -60° 和 +60°)以及增量(通常为 2°)。
- 对于剂量对称模式(推荐 - 确保低剂量模式仍处于活动状态),请从 ___ 开始检查两个方向的运行系列。空白通常为 0,但可用于补偿预倾斜的 FIB 薄片(例如,在 20° 处)。
- 为简单起见,请选中 保持曝光时间不变。改变这一点需要对暴露计算进行一些修改,并且还会干扰代数重建(例如,ART/SART/SIRT),这些重建将投影强度与原始数据进行比较(参见步骤7.1)。
- 选中 跳过自动对焦。小的半会聚角(例如 1 mrad)意味着景深如此之长,以至于可能没有必要对焦。作为测试,聚焦在 0°,倾斜到 60° 或 -60°,然后按 "记录"。保持专注主要是精确的以心为中心的高度。对于更大的收敛,可能需要在系列期间聚焦。在这种情况下,请看一看,在 "低剂量控制 "选项卡中,定义区域和焦点的位置,并调整焦点区域。
- 初始和最终操作:如果精确执行了以真心为中心的高度调整,则无需重复。取消选中 在系列结束时关闭柱阀, 除非有充分的理由不这样做。
- 为了跟踪控制参数,有很多选项。对于无人参与的数据收集,首要任务是避免程序因用户输入而停止。使用建议的设置:如果丢失的字段百分比超过 5,则重复记录。然后,跟踪之后并选中 在获取新轨道参考 之前与预览对齐 和 获取新轨道参考 如果记录对齐方式相差 2%。 对于有人值守的数据收集,应用更严格的参数,以避免损失数小时仪器时间的风险。
- 准备好启动时,按窗口底部的 GO 。最后,选择 倾斜系列>终止。
5. 使用导航器在多个点进行批量采集(增强功能#1)
注意:该协议是基本的,因为a)它与TEM相同,b)新的工具可用,可能会使完整的描述过时。
- 将完整的网格蒙太奇加载到主窗口。
- 选择一些看起来很有前途的区域。单击 添加点 并添加到所选网格方块的中心。再次单击 添加点 以停用该模式。
- 激活低剂量成像状态后,选择导航器窗口>选中每个选定方块的获取和新建文件。对于第一个,将打开一个对话框,显示文件属性(图 7),然后是文件名。选择蒙太奇图像,然后在蒙太奇设置对话框(图 8)中,选中在低剂量模式下使用视图参数,并制作一个足够大的网格以覆盖正方形(大约 100 x 100 μm)。
- 单击导航器菜单>获取项目,然后选择用于映射的参数。最重要的是,在主要操作中,选中创建导航器地图,然后选中粗略的同心度和精细的同心性,然后按 Go(图 9)。对于 200 目网格,这将产生大致整个正方形的地图(图 10)
- 准备断层扫描位置选择。通过单击"文件">"打开新文件"打开 新文件。给它一个文件名(例如,AnchorMaps.mrc)。
- 激活低剂量模式后,进入 "摄像机和脚本">设置 ,并确保"查看"和"预览"处于同一分箱状态(否则,它们无法存储在同一文件中)。
- 通过单击 导航器窗口>转到 XYZ 来访问方形地图中的点。
- 为带有标记的第一个断层扫描选择一个位置。拍摄预览图像并通过用鼠标右键拖动来优化位置。然后,选择导航 器窗口>新地图,然后单击 是 以保存对话框。接下来,拍摄同一区域的视图图像,然后再次另存为新地图。确保视图地图已突出显示,并在右上角的导航器窗口中选中 定位点状态 。
- 选择第二个位置,再次进行预览并优化上述位置,这次在导航器窗口中推送 锚点地图 。这会将预览和视图另存为导航器中的新地图。
- 对所有所需位置重复步骤 5.5.4。从一个网格方块移动到另一个网格方块,方法是选择点,然后在"导航"窗口中按" 转到 XYZ "。
- 对于参考对焦,请选择网格的清晰区域,然后用手或自动对焦仔细对焦。在显微镜面板上按 复位散焦 。在 SerialEM 中创建脚本,方法是单击"脚本>编辑" >"编辑 15 "(或其他空闲数字),然后输入两行:"脚本名称集去焦点"和"设置去焦点 0"。
- 在"导航器"窗口中,突出显示第一个位置("预览"或"视图")。按 Shift-T,然后突出显示最后一个位置,然后再次按 Shift-T。将打开"文件属性"对话框。选择要保存的单帧图像和参数,包括文件名。编辑文件名,但在末尾保留项目标签。
注意:以数字结尾的文件名将自动更新连续倾斜系列。使用"导航 器"菜单>"导航"选项很方便,>文件名中使用项目标签。 - 接下来,倾斜系列设置菜单将自动打开。像以前一样填充(图6),但不要选择优化优心度。导航器中的预览点现在将被标记为 TS。可以使用项目列表上方导航器窗口中的按钮返回此菜单。
- 选择 导航器菜单>获取项目。这一次,为最终数据选择参数。选择 主要操作:获取倾斜系列 ,然后选择 管理杜瓦瓶/真空、 重新对齐到项目、精细等中心度和 操作前运行脚本,运行 S cript:设置散焦。选择常规选项: 发生错误时无消息框 并在 结束时关闭柱阀,然后点击 GO (图11)。SerialEM 现在将访问所有锚点图,并记录每个位置的倾斜序列(图 12)。
6. 光电联用显微地图注册(增强功能#2)
- 如果尚未完成,请将完整的网格蒙太奇加载到主窗口中,然后通过单击"窗口">"新建 窗口" 创建一个新窗口并为其命名。请注意,完整的网格蒙太奇出现在注册 1 中。
- 通过单击导航 器菜单>导入地图导入光电联用显微地图图像。它应该进入注册 2。也可以如上所述为其分配一个新窗口。
- 检查光电联用显微贴图以确定相对于整个网格蒙太奇的相对旋转。在显示网格条的地图上执行此操作最简单。请注意,地图也可能被翻转。使用 导航器菜单>旋转地图大致对齐,如果需要,可以使用翻转。
注意:以下步骤也可以容纳翻转,但提前这样做会使以下内容更容易。可以重复此步骤,直到对齐看起来令人满意,但不必精确。 - 引入注册点以实现精确对齐。在一个窗口上放置许多相应的点,然后在另一个窗口上放置。对于每个此类点,请检查导航器窗口最顶部的 注册点 。相应的点将标有升序索引,后跟 R1 或 R2 分别表示网格蒙太奇或导入的地图。
注意:使用查找器网格使此步骤非常简单。否则,请选择实体要素,例如中心标记或格网正方形的角。原则上,三个点足以进行粗略对齐,但更多的点有助于补偿蒙太奇结构中的微小不匹配。 - 如果需要光电联用显微图的多个通道,例如,不同的荧光颜色或没有明场背景的荧光,请按照上述步骤6.2导入这些通道,并将套准更改为2。这样,他们将继承第一个地图的注册点。
- 通过" 导航器"菜单>"变换"项强制注册。相应的注册点现在将显示在所有地图上,这些地图将列在注册 1 中。要直观地对齐,请单击导航 器菜单>旋转地图。请注意,从导航器 窗口加载地图时,除非选中 加载时 旋转框,否则不会自动旋转地图。它始终可以从"导航"窗口旋转。
- 现在应该可以在荧光图上放置标记物或点,并将载物台移动到网格上的相应位置(图13)。
7.3D重建
- 这涉及与TEM断层扫描相同的基本步骤:倾斜系列的对齐,然后通常是背投。有几个软件平台可用,数据可以像TEM数据一样处理,只是应跳过CTF校正。
- 应用强度归一化以增强高倾斜投影的贡献或平衡序列期间照明的变化,但需要注意的是定量信息会受到影响。例如,IMOD26 运行良好,而 AreTomo27 对于无基准点对齐非常有用;如果存在基准粒子,ClusterAlign28 可以将它们作为簇而不是单个点跟踪;这对于 STEM 数据特别有用,其中斑点可能会被高对比度特征丢失或隐藏。
- 使用 3D 反卷积29 进行重建,以增强对比度和去噪。重建后,通过任何标准方法表示 STEM 体积数据,例如正交切片或等值面分割。值得注意的是,强度分布是单极性的,没有传统相衬TEM中出现的对比度反转或傅里叶条纹。一般来说,STEM断层图的一种有趣的表示方法是反转明场(图14)。效果是"X射线眼睛",通过澄清的细胞30看到感兴趣的致密物体。
结果
在 STEM 中准备的完整网格蒙太奇显示了具有感兴趣单元格的区域(图 4)。请注意,图像处于暗场中,因此空孔显示为暗孔。细胞看起来部分明亮,其中电子散射向HAADF检测器。在最厚的部分,通常是中心或网格条附近,对比度再次变暗。这是由于多重散射,电子达到探测器未捕获的角度。实际上,这些区域对于断层扫描来说太厚了。
下一阶段涉及中等放大倍率的地图(图10)。这些通常被称为中等蒙太奇地图或方形地图,指的是网格正方形而不是形状。即使在最低的微探针STEM模式下,它们也将作为蒙太奇图像获取。单击导航器窗口中的项目可将地图图像加载到主窗口中。在此区域内选择断层扫描采集的特定点。使用预览模式在录制放大率处定位该区域。请记住,预览和录制之间可能会有横向偏移,具体取决于扫描速度。可以在此处记录单个倾斜系列。例如,线粒体通常可以在预览和记录图像中识别(图12)。
对于批量断层扫描,载物台将围绕网格移动,可能不会返回到完全相同的位置。锚点贴图用于确保通过将预览图像与较低放大率视图匹配来可靠地重新识别所需的记录区域,即使载物台移动已移动也是如此。PyEM23,24 提供了一种更快的替代方案,当然值得推荐,但还不是标准安装的一部分。
在光电联用显微方法中,荧光图可用于识别层析成像的感兴趣区域。荧光是从外部获取的,必须配准到完整的网格蒙太奇上。使网格条和孔可见很有用,因此可以在导入之前准备合并的荧光+明场复合物,例如在GIMP (https://www.gimp.org)或ImageJ31 软件中(请注意ImageJ反转垂直轴)。当荧光的动态范围很大时,可能很难在没有饱和的情况下产生这样的合并。在这种情况下,可以分别导入两个映射,然后按照说明一起注册(图 13)。这样,在导航器窗口中荧光图上的一个点,然后是"转到XY",将载物台带到安装在TEM中的网格上的相应位置。请注意,蒙太奇(或荧光图,如果也是蒙太奇)创建中的小不一致会导致小位移;因此,为了获得最佳精度,应将荧光专门重新配准到方形图中。通常,根据支撑膜上的孔或与明场光图像共享的特征,通过肉眼进行这种配准就足够了。
倾斜序列的重建会产生 3D 体积(图 14)。本例的像素大小为 2.042 nm,导致视场为 ~4 μm。磷酸钙沉积物(橙色箭头)脱颖而出,因为与周围环境相比原子序数更高。微管(红色箭头)可以在整个视野中追踪。此外,可以清楚地看到内外线粒体膜(绿色箭头)。肌动蛋白可以观察到为束或单个细丝。为了达到更各向同性的分辨率,可以通过反卷积处理重建。
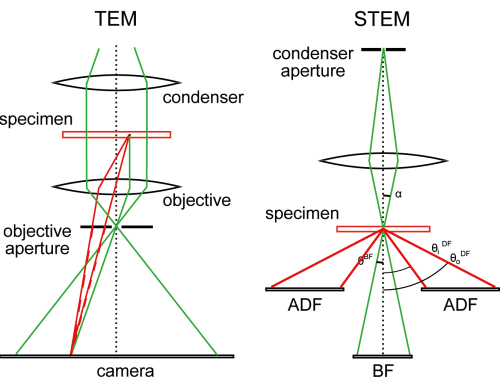
图 1:TEM 与 STEM 的比较。 在TEM中,视野由近平行光束照射,物镜在相机上形成放大图像。对于冷冻透射电镜,物镜孔径打开以通过散射电子波(红色虚线),散焦后,通过干扰未散射(绿色)波产生相差。另一方面,STEM在标本上光栅聚焦光束,并以逐像素的方式收集散射的电子。多个探测器可以收集散射到不同角度的电子。这个数字是从30修改过来的。 请点击此处查看此图的大图。

图2:由于高扫描速率,左侧的图像失真示例。 请注意黄色箭头标记的变形,以及定量图中扭曲的椭圆形孔。 请点击此处查看此图的大图。
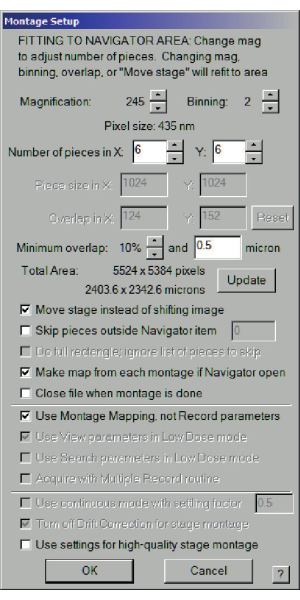
图 3:整个网格蒙太奇的蒙太奇设置对话框。 选择X和Y的放大倍率和碎片数,使总面积达到约2,000μm,以获得大部分网格的地图。还可以选择"移动舞台而不是移动图像"和"使用蒙太奇贴图",而不是"录制参数"。 请点击此处查看此图的大图。

图 4:在 STEM 模式下记录的全低放大倍率网格图。破碎区域在暗场图像中显示为完全黑色。深灰色区域可能太厚且玻璃化不良。在此扫描中,断层扫描的良好候选区域为白色或浅灰色。比例尺 = 100 μm。 请点击此处查看此图的大图。
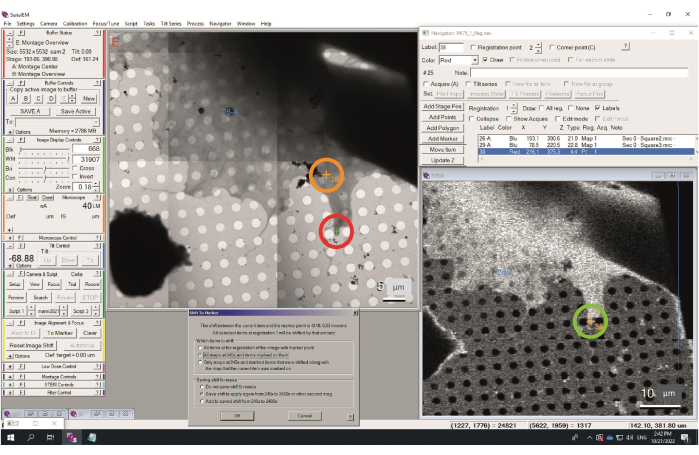
图 5:切换到标记过程。 在低分辨率地图中,可识别的对象由添加点(此图中为 38)标记。请注意低分辨率地图(绿色圆圈)和中分辨率地图(橙色圆圈)之间的切换。然后,对象由标记(绿色十字、红色圆圈)标记,并启动"移至标记"对话框。所选选项将以 245 倍的速度将所有地图移动相同的数量。 请点击此处查看此图的大图。
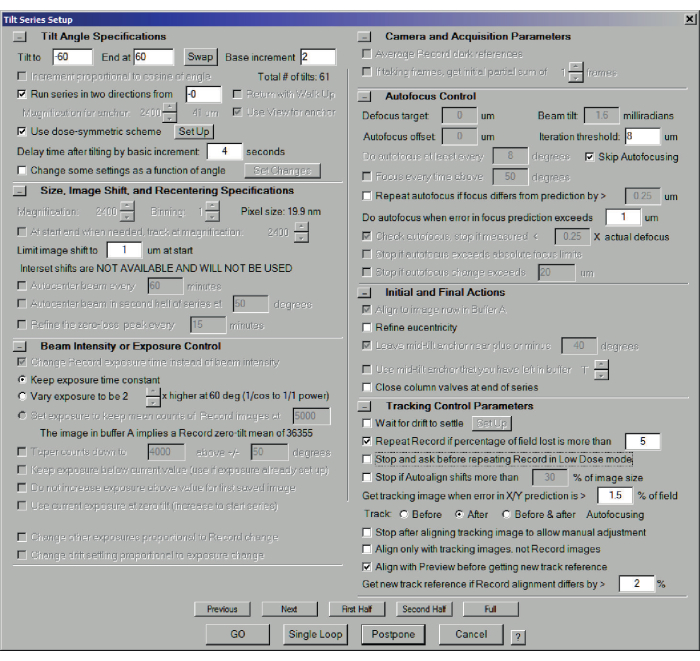
图 6:STEM 倾斜系列的倾斜系列设置对话框。 剂量对称方案在 -60° 至 +60° 范围内以 2° 为步长使用。由于使用低会聚角时焦深高,自动对焦会被跳过。没有必要像以前那样完善优心性。 请点击此处查看此图的大图。
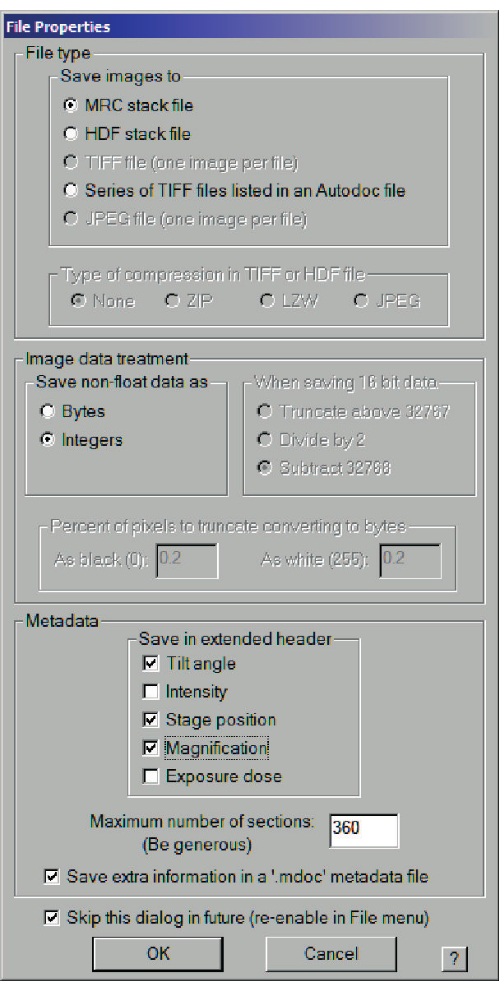
图 7:中分辨率地图的文件属性对话框。 另存为 MRC 堆栈文件,选择整数,然后将额外信息保存在 .mdoc 元数据文件中。 请点击此处查看此图的大图。
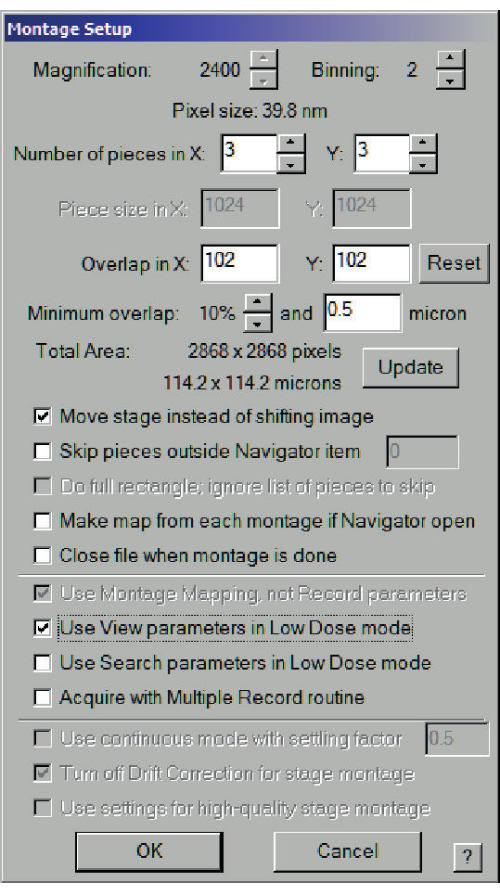
图 8:用于保存中分辨率地图的蒙太奇设置对话框。 对于 200 目网格上的正方形(宽度为 90 μm),建议总面积至少为 90 μm x 90 μm。选择移动载物台而不是移动图像和在低剂量模式下使用视图参数。 请点击此处查看此图的大图。
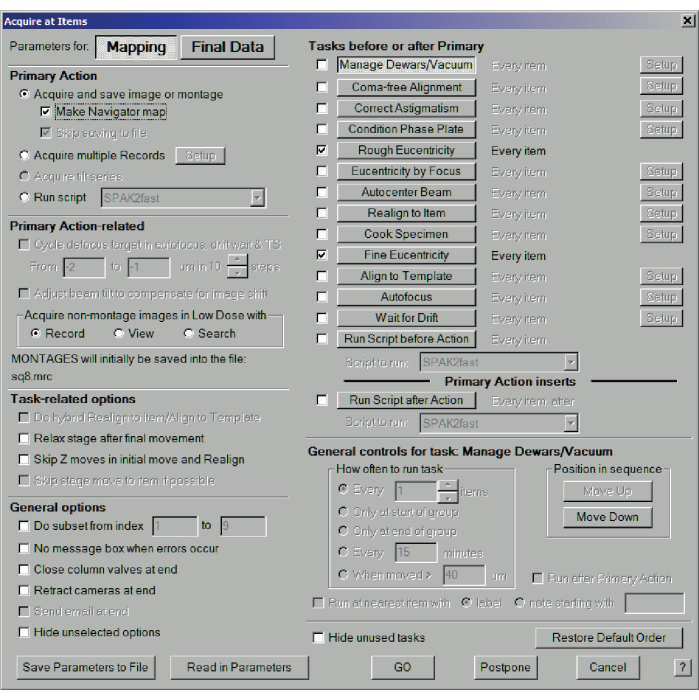
图 9:记录中等分辨率图。 获取项目对话框以记录中等分辨率地图。选择映射,获取并保存图像或蒙太奇,然后勾选制作导航器地图。在"主要任务之前"或"之后的任务"中,选择"粗略和精细同心"。在无人协助的情况下,可以选择"发生错误时无消息框"和"末端关闭柱阀"。请点击此处查看此图的大图。

图 10:中分辨率地图的图像。 在 STEM 模式下通过 3 x 3 的蒙太奇录制的中分辨率地图(方形地图)。用于数据收集的两个中等分辨率锚点地图由蓝色方块表示。比例尺 = 10 μm。 请点击此处查看此图的大图。
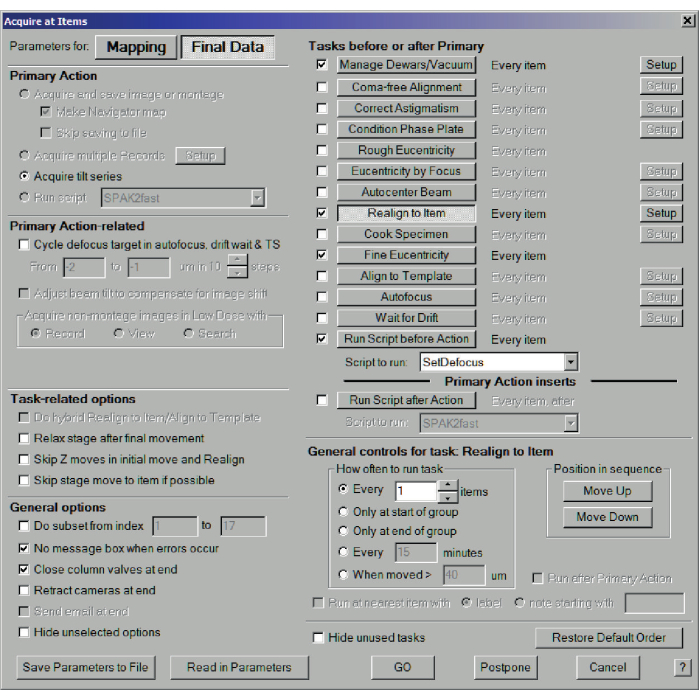
图 11:批量倾斜系列数据。 用于收集批量倾斜系列的"在项目上获取"对话框。对于倾斜系列数据采集,请选择最终数据和获取倾斜系列。在"主要任务之前或之后的任务"中,选中"管理杜瓦瓶/真空"(在"设置"菜单中选择适当的设置)、"重新对齐到项目"、"精细等中心度"和"操作前运行脚本"。在"常规"选项中,选中"发生错误时无消息"框和"结束时关闭柱阀"(请参阅 5.14)。 请点击此处查看此图的大图。
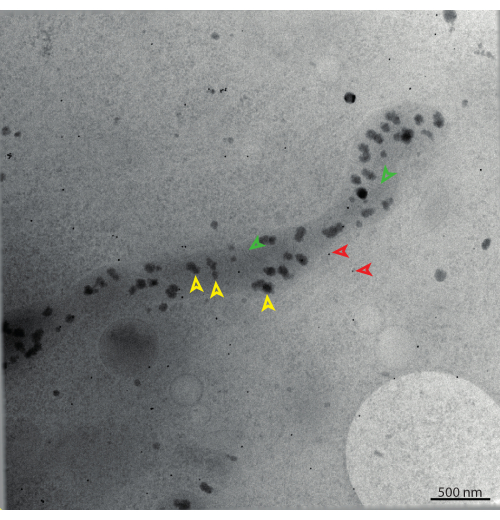
图 12:线粒体的 STEM 倾斜系列的 0° 倾斜。 橙色箭头指向磷酸钙沉积物(基质颗粒),绿色箭头指向嵴,红色箭头指向 15 nm 金基准标记。比例尺 = 500 nm。 请点击此处查看此图的大图。
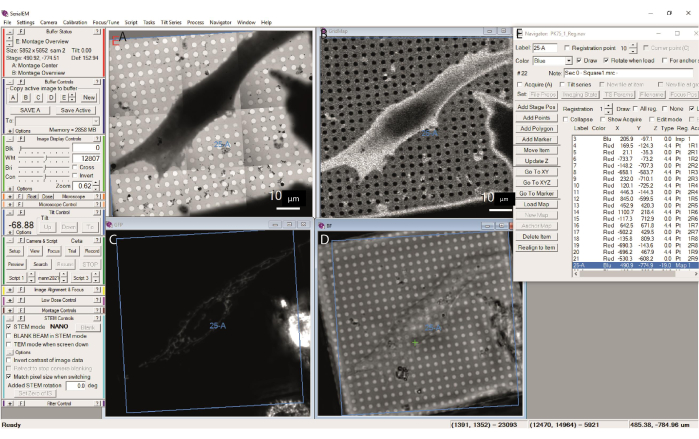
图 13:注册的冷冻光电联用显微图。 (A) 中分辨率 STEM 图(方形图,26-A)注册到 (B) 低分辨率 STEM 图,(C) BF 通道冷冻 FM 图和 (D) GFP 通道冷冻 FM 图。九个注册点(标签 4-21)显示在 (E) 导航器中。请点击此处查看此图的大图。

图 14:体积渲染。通过类似SIRT(30个周期)过滤断层图在不同深度的(A)60 nm和(B)40 nm厚的切片的体积渲染。像素尺寸为2.048nm,其视场约为4μm。请注意与图12相比的倒置密度,这意味着高强度特征很亮。橙色、白色、红色、绿色和浅蓝色箭头分别指向磷酸钙沉积物、核糖体、微管、内外线粒体膜以及肌动蛋白丝。比例尺 = 500 nm。请点击此处查看此图的大图。
讨论
该协议应帮助生命科学显微镜学家,他们有兴趣在常规TEM断层扫描无法进入的细胞区域中获得细胞内细胞器的3D视图。相同的方案也可用于塑料切片的STEM断层扫描,对暴露的限制放宽。协议应被视为一个起点,而不是一套硬性规则。事实上,STEM 的力量在于它的灵活性;没有一种正确的方法来操作它。
我们强调,STEM本身仅指扫描的探头,并不定义图像形成。对比度主要取决于探测器的配置。更直接的方法采用轴对称的探测器,要么是以光轴为中心的圆盘,要么是围绕它的环形。通常,当照明直接撞击探测器时,我们记录BF图像,其中(电子散射)标本看起来很暗;相反,当探测器仅收集散射电子时,我们记录DF图像,其中致密的标本看起来很亮。当合适的硬件可用时,SerialEM可以同时采集和记录这两个信号。还有更复杂的配置可供选择,从具有多个段的探测器到完全像素化的相机。相衬成像可以实现,例如,通过评估离轴检测器元件32、33之间的差异。收集每个像素的整个 2D 散射(衍射)图案定义了称为 4D STEM34 的方法,该方法能够从相同的原始数据重建多个图像对比度。四维STEM使电子叠层成像成为可能,这提供了另一种获得相衬35的方法。
我们专注于我们认为对研究细胞器和完整细胞或微米厚细胞切片最有用的特定STEM模式。这尤其需要使用BF成像,在照明中具有较小的半会聚角,在探测器上具有相对较大的收集角。小收敛提供了大景深,因此整个样品在整个倾斜系列19中保持聚焦。在实践中,使用良好的显微镜载物台,还可以消除采集过程中对焦点调整的需要。价格是分辨率的妥协,如协议第3节所述。我们建议使用~2 nm的探针进行4k图像,其像素间距为1 nm,可达到4μm的视野。但是,强烈建议读者进行实验。第二个考虑因素是在探测器一侧。当照明盘底部填充轴上BF检测器时,相衬被抑制,散射(幅度)对比度占主导地位;这种情况被称为不相干明场对比度36。问题是按多少分数填充,答案取决于样品。非常薄的样品在完全填充的检测器下表现出最佳对比度(即,收集角度与照明角度相匹配),但较厚的样品会将所有强度散射出去,留下对比度差的噪声信号。一个有用的经验法则是,样品越厚,BF检测器的外截止角应为21。当然,检测器尺寸和位置是固定的,因此衍射盘尺寸使用相机长度进行调整,如第1节所述。如果检测器放大器设置使得信号充满动态范围,但在直接照明下不饱和(1.12.3),则可以增加相机长度,直到达到合理的信号强度和对比度。再次鼓励读者进行实验。可以说,艺术就在角度中。
协议中未讨论的另一个参数是显微镜加速电压。在较低的电压下,照明电子与样品的相互作用会更强。在其他条件相同的情况下,我们可以期待在较低电压下获得更高的对比度。另一方面,试样内多次散射的开始限制了可用的试样厚度,因此更高的电压允许使用较厚的试样。然而,这些影响相当微妙。迄今为止,我们在 200 kV 和 300 kV 加速度方面的经验是相似的。
考虑到STEM在分辨率方面的预期,这再次取决于样品和检测器配置。使用单颗粒分析方法,铁蛋白上的金属离子可以通过环形暗场STEM定位到几埃37的精度。最近,使用通过积分差分相衬(iDPC)STEM32 和叠层成像35获得的图像实现了病毒和蛋白质样品的亚纳米分辨率。对于厚细胞标本中的独特物体,以及使用此处描述的方法,这种高分辨率是不现实的。最佳分辨率是探头直径,它与所述的半会聚角有关。其他因素会降低分辨率,特别是达到大视场的粗像素采样、倾斜系列中的错位以及探头光束在传输中的扩散。图像与塑料切片断层扫描相得益彰。例如,使用此处描述的设置,应该很容易看到微管的空心,而不是单个原丝。
总而言之,STEM方法和硬件都处于开发阶段。我们可以预期,成像方面的创新也将影响断层扫描,将STEM带入其他技术无法进入的领域。我们预计,与基于现代光学超分辨率方法的相关低温荧光成像的融合将特别富有成效。细胞器的规模为100-1,000nm,是这些新兴方法的理想目标。
披露声明
作者声明不存在利益冲突。
致谢
我们非常感谢SerialEM软件包的作者和维护者David Mastronade和Günther Resch的持续支持。P.K.由奥地利科学基金(FWF)通过薛定谔奖学金J4449-B资助。出于开放获取的目的,作者已将CC-BY公共版权许可应用于由此提交产生的任何作者接受的手稿版本。M.E.和S.G.W.感谢以色列科学基金会(第1696/18号拨款)和欧盟地平线2020结对项目ImpaCT(拨款号857203)的资助。M.E.感谢ERC在CryoSTEM项目中提供的资金(拨款号101055413)。M.E.是Sam和Ayala Zacks教授主席的现任者,也是Irving和Cherna Moskowitz纳米和生物纳米成像中心的负责人。M.E.的实验室受益于Harold Perlman家族的历史慷慨。我们还感谢欧洲联盟提供的资金。然而,所表达的观点和意见仅代表作者的观点和意见,并不一定反映欧盟或欧洲研究理事会执行机构的观点和意见。欧洲联盟和授权当局都不能对此负责。
材料
| Name | Company | Catalog Number | Comments |
| SerialEM | University of Colorado | Veriosn 4.0 | SerialEM is a free software platform for microscope control and data acquisition. |
| STEM-capable transmission electron microscope | The protocol was written based on experience with several microscopes of Thermo Fisher Scientific: Titan Krios, Talos Arctica, and Tecnai T20-F. In principle it should be applicable to other manufacturers as well. |
参考文献
- Elbaum, M. Expanding horizons of cryo-tomography to larger volumes. Current Opinion in Microbiology. 43, 155-161 (2018).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. Journal of Structural Biology. 184 (2), 355-360 (2013).
- Do, M., Isaacson, S. A., McDermott, G., Le Gros, M. A., Larabell, C. A. Imaging and characterizing cells using tomography. Archives of Biochemistry and Biophysics. 581, 111-121 (2015).
- Groen, J., Conesa, J. J., Valcárcel, R., Pereiro, E. The cellular landscape by cryo soft X-ray tomography. Biophysical Reviews. 11 (4), 611-619 (2019).
- Kapishnikov, S., et al. Oriented nucleation of hemozoin at the digestive vacuole membrane in Plasmodium falciparum. Proceedings of the National Academy of Sciences. 109 (28), 11188-11193 (2012).
- Kapishnikov, S., et al. Unraveling heme detoxification in the malaria parasite by in situ correlative X-ray fluorescence microscopy and soft X-ray tomography. Scientific Reports. 7 (1), (2017).
- Sviben, S., et al. A vacuole-like compartment concentrates a disordered calcium phase in a key coccolithophorid alga. Nature Communications. 7, 11228 (2016).
- Wan, W., Briggs, J. A. Cryo-electron tomography and subtomogram averaging. Methods in Enzymology. , 329-367 (2016).
- Zhang, P. Advances in cryo-electron tomography and subtomogram averaging and classification. Current Opinion in Structural Biology. 58, 249-258 (2019).
- Bäuerlein, F. J. B., Baumeister, W. Towards visual proteomics at high resolution. Journal of Molecular Biology. 433 (20), 167187 (2021).
- Elbaum, M., Seifer, S., Houben, L., Wolf, S. G., Rez, P. Toward compositional contrast by cryo-STEM. Accounts of Chemical Research. 54 (19), 3621-3631 (2021).
- Elbaum, M., Wolf, S. G., Houben, L. Cryo-scanning transmission electron tomography of biological cells. MRS Bulletin. 41 (7), 542-548 (2016).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of vitrified cells. Nature Methods. 11 (4), 423-428 (2014).
- Houben, L., Weissman, H., Wolf, S. G., Rybtchinski, B. A mechanism of ferritin crystallization revealed by cryo-STEM tomography. Nature. 579 (7800), 540-543 (2020).
- Li, Y., Huang, W., Li, Y., Chiu, W., Cui, Y. Opportunities for cryogenic electron microscopy in materials science and nanoscience. ACS Nano. 14 (8), 9263-9276 (2020).
- Hohmann-Marriott, M. F., et al. Nanoscale 3D cellular imaging by axial scanning transmission electron tomography. Nature Methods. 6 (10), 729-731 (2009).
- Engel, A. Scanning transmission electron microscopy: biological applications. Advances in Imaging and Electron Physics. 159, 357-386 (2009).
- Wolf, S. G., Elbaum, M. CryoSTEM tomography in biology. Methods in Cell Biology. 152, 197-215 (2019).
- Biskupek, J., Leschner, J., Walther, P., Kaiser, U. Optimization of STEM tomography acquisition-A comparison of convergent beam and parallel beam STEM tomography. Ultramicroscopy. 110 (9), 1231-1237 (2010).
- Trepout, S., Messaoudi, C., Perrot, S., Bastin, P., Marco, S. Scanning transmission electron microscopy through-focal tilt-series on biological specimens. Micron. 77, 9-15 (2015).
- Rez, P., Larsen, T., Elbaum, M. Exploring the theoretical basis and limitations of cryo-STEM tomography for thick biological specimens. Journal of Structural Biology. 196 (3), 466-478 (2016).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. 16 (6), 471-477 (2019).
- Sheng, Y., Morris, K., Radecke, J., Zhang, P. Cryo-electron tomography remote data collection and subtomogram averaging. Journal of Visualized Experiments. (185), e63923 (2022).
- Weis, F., Hagen, W. J. H., Schorb, M., Mattei, S. Strategies for optimization of cryogenic electron tomography data acquisition. Journal of Visualized Experiments. (169), e62383 (2021).
- O'Toole, E., vander Heide, P., McIntosh, J. R., Mastronarde, D. Large-scale electron tomography of cells using SerialEM and IMOD. Cellular Imaging: Electron Tomography and Related Techniques. , 95-116 (2018).
- Zheng, S., et al. AreTOMO: An integrated software package for automated marker-free, motion-corrected cryo-electron tomographic alignment and reconstruction. Journal of Structural Biology. (6), 100068 (2022).
- Seifer, S., Elbaum, M. ClusterAlign: A fiducial tracking and tilt series alignment tool for thick sample tomography. Biological Imaging. 2, 7 (2022).
- Waugh, B., et al. Three-dimensional deconvolution processing for STEM cryotomography. Proceedings of the National Academy of Sciences. 117 (44), 27374-27380 (2020).
- Kirchenbuechler, D., et al. Cryo-STEM tomography of intact vitrified fibroblasts. AIMS Biophysics. 2 (3), 259-273 (2015).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Lazić, I., et al. Single-particle cryo-EM structures from iDPC-STEM at near-atomic resolution. Nature Methods. 19 (9), 1126-1136 (2022).
- Seifer, S., Houben, L., Elbaum, M. Flexible STEM with simultaneous phase and depth contrast. Microscopy and Microanalysis. , 1-12 (2021).
- Ophus, C. Four-dimensional scanning transmission electron microscopy (4D-STEM): from scanning nanodiffraction to ptychography and beyond. Microscopy and Microanalysis. 25 (3), 563-582 (2019).
- Zhou, L., et al. Low-dose phase retrieval of biological specimens using cryo-electron ptychography. Nature Communications. 11 (1), 2773 (2020).
- Nellist, P. D. The principles of STEM imaging. Scanning Transmission Electron Microscopy: Imaging and Analysis. , 91-115 (2011).
- Elad, N., Bellapadrona, G., Houben, L., Sagi, I., Elbaum, M. Detection of isolated protein-bound metal ions by single-particle cryo-STEM. Proceedings of the National Academy of Sciences. 114 (42), 11139-11144 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。