Method Article
クライオSTEMトモグラフィーによるオルガネラのin situ 可視化
要約
クライオSTEMトモグラフィーは、埋め込み、切片作成、またはその他の侵襲的な調製物なしで、無傷の細胞の細胞小器官を視覚化する手段を提供します。得られた3D解像度は現在、数ナノメートルの範囲であり、数マイクロメートルの視野および1μmのオーダーのアクセス可能な厚さを有する。
要約
極低温電子顕微鏡(クライオEM)は、天然の水性媒体に埋め込まれた生物学的または有機試料のイメージングに依存しています。水は結晶化せずにガラスに固化(すなわちガラス化)される。クライオ電子顕微鏡法は、最近、生体高分子の構造を原子に近い分解能で決定するために広く使用されています。このアプローチは、断層撮影法を用いた細胞小器官や細胞の研究にも拡張されていますが、従来の広視野透過EMイメージングのモードは、標本の厚さに厳しい制限があります。これは、集束イオンビームを使用して薄いラメラを粉砕する慣行につながりました。再構成からサブトモグラム平均化によって高い分解能が得られますが、残りの層の外側の3次元関係は失われます。厚さの制限は、走査型EMまたは共焦点レーザー走査型顕微鏡と同様に、走査型プローブイメージングによって回避できます。材料科学における走査型透過電子顕微鏡(STEM)は、単一の画像で原子分解能を提供しますが、電子照射に対する極低温生物試料の感度には特別な考慮事項が必要です。このプロトコルは、STEMを使用したクライオトモグラフィーのセットアップを提供します。顕微鏡の基本的な局所構成は、2コンデンサーシステムと3コンデンサーシステムの両方で説明されていますが、自動化は非商用のSerialEMソフトウェアによって提供されます。バッチ取得の機能強化と、以前に取得した蛍光マップとの相関アライメントについても説明します。例として、ミトコンドリアの再構成を示し、内膜と外膜、リン酸カルシウム顆粒、および周囲の微小管、アクチンフィラメント、およびリボソームを指摘します。クライオSTEMトモグラフィーは、細胞質内の細胞小器官の劇場、場合によっては培養中の接着細胞の核周辺を明らかにすることに優れています。
概要
細胞小器官の3次元(3D)可視化は、現代の細胞生物学において最も重要な課題です。分泌小胞の数十ナノメートルから細胞核の数十ミクロンまで、関連するスケールを考えると、すべてのアプリケーションに適合する単一の顕微鏡技術を見つけることは困難です。最新の蛍光顕微鏡法は、分解能の点では広い範囲に及ぶ可能性がありますが、標識された分子のみが現れます。細胞劇場は依然として電子顕微鏡の領域です。従来の化学的固定、プラスチック包埋、重金属による染色の方法は侵襲性が強いため、サンプル調製の詳細によって結果が異なる場合があります。一方、クライオEMは、水性媒体をガラス化する必要性によって制約されます。形成される氷結晶は電子照明を回折し、目的の有機材料よりも高いコントラストのコントラストアーチファクトを引き起こします。
過去10年間で、細胞研究用に開発または適合されたEMイメージング技術が急増しました1。反復集束イオンビーム(FIB)ミリングと組み合わせた高圧凍結と走査型電子顕微鏡(すなわち、FIB-SEM)を使用したシリアル表面イメージングは、現在、大型試料2に最適な方法です。極低温軟X線断層撮影法(クライオSXT)は、水中の軟X線の特性吸収長によって制限される数ミクロンのサイズのサンプルに適しています3、4、5。このスケールには多くの無傷の細胞型が含まれており、X線吸収コントラストの定量的性質は、濃度測定6または分光法7の側面を追加します。位相差透過型電子顕微鏡(TEM)に基づくクライオ透過電子線トモグラフィー(クライオET)は、サブトモグラム平均法と組み合わせると、高分子または複合体に対して最高の分解能を提供します8,9,10。しかし、無傷の細胞小器官が非常に規則的であるため、全体を平均化できることはまれです。また、従来の広視野TEMの態様は、試料内の非弾性散乱(エネルギー損失を伴う)と磁気対物レンズ11,12内の色収差との組み合わせにより、試料の厚さが数百ナノメートルに制限されていた。大きなエネルギー拡散により、エネルギーフィルターを使用して焦点の合っていないヘイズを除去する必要がありますが、感度の高い試料は依然として放射線損傷を受け、画像信号は厚さが増すにつれて指数関数的に弱くなります。
代替イメージングモードである走査透過EM(STEM)は、エネルギーフィルタリングの必要性を回避し、TEMトモグラフィーよりも解像度が低いにもかかわらず、画像形成のために非弾性散乱電子を保持します(図1)。実際、実際の画像は形成されていません。代わりに、スキャンEMのように、測定はポイントごとに行われ、画像はコンピューターによって組み立てられます。倍率は、レンズ電流を変えずにスキャンステップのサイズによってのみ決定されます。適切に構成されている場合、クライオSTEM断層撮影(CSTET)の試料厚さの有用な範囲は1.5または2μmに達する可能性がありますが、有用な信号強度が照明のかなりの部分のままである快適ゾーンは約600〜900nmです11,13。これは、細胞質の大部分、そして時には細胞核の端を見るのに十分である。実際には、極低温液に突入する標準的な方法によるガラス化は、STEMイメージングよりも厚さに厳しい制約を課すことがわかりました。このビデオ記事の目的は、研究室や顕微鏡施設での細胞およびオルガネライメージング用のツールチェストへのCSTETの組み込みを容易にすることです。
最初の課題は、CSTETの顕微鏡操作が、クライオTEM断層撮影のようにライフサイエンスアプリケーション向けにまだ標準化されていないことです。STEMハードウェアがクライオEM市場をターゲットにすることはめったにありません。しかし、これは最新世代の顕微鏡で変化しており、多くの既存のツールを後付けすることができます。技術としてのSTEMは、極低温および低線量法への関心も高まっている材料科学で離陸し、大部分を引き継いでいます14,15。材料科学の文献には、BF-STEM、ADF-STEM、HAADF-STEM、4D-STEM、DPC-STEMなどの頭字語がたくさんあり、混乱を増しています。ここでは、ワイツマン科学研究所での集合的な経験において、明視野(BF)STEMイメージングに基づく有用な結果を得るための最も一般的なプロトコルを提供する推奨される出発点を提供します16。それは決して可能性の範囲を使い果たしたり探求したりすることはありませんが、それはさらなる強化の基礎として役立ちます。クライオSTEMを重視していますが、ほとんどのプロトコルは、プラスチック包埋切片の室温STEM断層撮影にも同様に関連しています。
STEMの本質は、集束電子プローブ(図1)、照明コーンで試料をスキャンし、透過の回折(散乱)面からの信号をピクセルごとに記録して、2D画像を生成することです17,18。ほとんどの細胞材料を含むアモルファス標本は、透過時に拡散散乱パターンを生成します。最も簡単で実用的なSTEM構成は、中央ディスク(つまり、標本なしで送信されるプローブ照明)を記録するための円形検出器を配置することです。試料は、信号が減少する程度にこの照明円錐から電子を散乱させます。これによりBF画像が生成され、標本は明るい背景で暗く見えます。環状検出器を使用して、照明コーンの外側の試料からの散乱を検出することもできます(または代わりに)。試験片を取り除いた状態では、信号はありません。標本が所定の位置にあるとき、オブジェクトは暗視野(DF)画像の暗い背景に明るく見えます。STEM(BF、環状暗視野[ADF]、高角環状暗視野[HAADF]など)の命名法は、主に検出器の収集角度の範囲を指します。
照明の収束角は、細胞断層撮影へのSTEMの本質的な適応を表しています。高解像度が最優先される場合、収束角度はできるだけ大きくする必要があります。(これは共焦点レーザー走査型顕微鏡に似ています;分解能はプローブの直径によって決定され、波長を開口数で割った値としてスケーリングされます。なお、EMについては半角または半収束角を参照します。一方、優先が被写界深度である場合、集束ビームは波長を半角の2乗で割った距離でほぼ平行のままであるため、解像度の低下は大きな利点をもたらします。理想的には、セル体積全体がフォーカス19に留まる。例えば、300 keVでは、電子デブロイ波長は0.002 nmであるため、1 mradの収束は2 nmの分解能と4ミクロンの被写界深度をもたらします。これらの条件下では、断層撮影は、データ収集プロセス中に焦点を合わせなくても、取得の開始時に一度だけ実行することができる。従来の断層撮影が可能なSTEMは、7または8 mradの半収束角に達する可能性があります。したがって、原理的には0.25nm程度の解像度に達することができましたが、焦点深度はわずか62nmでした。これは明らかに細胞イメージングには薄すぎます。3つのコンデンサーレンズを備えたより高度な顕微鏡は、かなりの範囲にわたって半収束角度の連続調整を提供します。より伝統的な2コンデンサー構成では、収束はコンデンサー(C2)アパーチャによって離散的に固定されます。
堅牢なプラスチック包埋サンプルの場合、各傾斜で焦点系列を記録し、それらを組み合わせて高解像度20にすることができますが、極低温標本の場合、放射線バジェットが厳しく制限されすぎます。最後に、BFまたはDFイメージングの利点を比較検討する際には、厚い試料の場合、試料内の多重弾性散乱の影響を考慮する必要があります。BF信号は多重散乱による破損が少なく、厚い試料に対してより高い分解能を示す16,21。
有用な経験則は、収束よりも数倍大きい収集角度を設定することでした。標本が厚いほど、収集ディスクを大きくする必要があります。ディスクが小さすぎると、信号強度が低くなります。ディスクが大きすぎると、最大角度の散乱のみが寄与するため、画像のコントラストが低下します。収集角度は、特定のサンプルに対して最適化する必要があります。(回折)カメラの長さの関数としての検出器角度は、個別に校正する必要があります。それらは顕微鏡ソフトウェアによって便利に表示されてもよい。実際には、収集と照明の半角の比率、θとαの係数がそれぞれ2〜5倍(図1)であり、細胞標本のCSTETの推奨される開始点です。
以下のプロトコルは、顕微鏡制御のための一般的なSerialEMソフトウェアを用いたSTEM断層撮影動作を説明する22、23。シリアルEMは特定のメーカーに縛られておらず、TEM断層撮影で広く使用されています。断層撮影のセットアップにおけるほとんどの操作は、TEMから直接引き継ぐことができます。SerialEM戦略は、スキャンシステムをカメラとしてモデル化することです。これにより、TEMからSTEMへの簡単なクロスオーバーが可能になります。ただし、倍率やビニングなどのパラメータは完全に人工的なものであることに注意してください。重要なパラメータは、ミクロン単位の視野、視野内のピクセル数、および露光時間です。ピクセル間隔、またはサンプリングは、線形フィールドをピクセル数で割った値であり、滞留時間はピクセル数を露光時間で割った値です。
STEMおよびCSTETの最小構成には、スキャンジェネレータ、STEM検出器、断層撮影制御ソフトウェアの3つの顕微鏡機能が含まれます。このプロトコルは、FEI/サーモフィッシャーサイエンティフィック(TFS)の命名法を参照していますが、概念は一般的です。TFSのプロプライエタリなソフトウェアは、TEM24のJoVEで説明されており、STEM操作は非常に似ています。
顕微鏡はサービスチームまたは経験豊富なスタッフによって事前に位置合わせされており、ファイルをロードすることでカラムの位置合わせを呼び出すことができることを前提としています。微調整はダイレクトアライメントと呼ばれ、いわゆるFEGレジスタ(TFS顕微鏡)に保存できます。直接アライメントには、回転中心、ピボットポイント、回折アライメント、およびコンデンサー非点収差の補正が含まれます。調整は繰り返し実行する必要があります。TFS顕微鏡は、異なるナノプローブ(nP)モードとマイクロプローブ(μP)モードを実装していることに注意してください。所与のコンデンサー開口部に対して、これらはそれぞれTEMにおける平行照明およびSTEMにおける多かれ少なかれ収束する(緊密に集束された)電子ビームを有する比較的狭いまたは広い視野を提供する。他のメーカーは、収束角の範囲をカバーするために異なるスキームを使用しています。
開始する前に、調査中のサンプルに応じて、視野 Lとサンプリング(ピクセル幅)lを選択する必要があります。例えば、 l = 1nm/ピクセルの場合、4μm2 の視野をカバーする4,000×4,000ピクセルの画像を選択するべきである。分解能はせいぜい空間サンプリングの2倍なので、2 nm、プローブの直径dはそれに一致する必要があります。プローブ角度のキャリブレーションはこのプロトコルの範囲を超えているため、テーブルまたは画面の読み取りが利用可能であると想定しています。プローブの直径は、ほぼ電子波長を半収束角(ラジアン単位)で割ったものです:d = λ/θ。波長λは、300 keVの場合は0.002 nm、200 keVの電子の場合は0.0025 nmであるため、θが1 mradの場合、スポット径はそれぞれ2または2.5 nmになります。
プロトコルは、複雑さが増すにつれて提示されます。最初のタスクは、顕微鏡メーカーのソフトウェアに依存するSTEM画像を作成し、次にSerialEMを使用するチルトシリーズを作成することです。多くの読者は間違いなくSerialEMに精通しているので、より複雑なタスクは自然に起こります。手順を厳密に守る必要はありません。自動化に関連する開発は、TEMだけでなくSTEMにも直接実装できます。経験豊富なユーザーは、蛍光マップの相関登録から始めて、バッチ断層撮影のセットアップを継続して、プロトコルを反転させる可能性があります。詳細については、オートメーション25の最新の開発に関する最近のJoVEの記事を含む、SerialEM自体の広範なドキュメントとチュートリアルライブラリを参照してください。
プロトコル
1.ステムのセットアップ
- 予備アライメント: カラムアライメントファイルをロードし、 カラムバルブを開きます。サイドエントリークライオホルダーを使用する場合は、 クライオシールドを開きます。TEMモードで起動します。ビームが画面に表示されます。そうでない場合は、倍率を下げます。
- コントロールパネルのボタンを押して、顕微鏡をユーセントリックフォーカスにします。
- スポットサイズを、蛍光スクリーンを直接または内蔵カメラ(顕微鏡モデルに応じて)で視覚化するのに便利な値(例:6)に設定します。
- 顕微鏡をSTEMモードに設定し、フォーカスが対物レンズではなく集光レンズ(強度)を使用していることを確認します。ユーセントリックフォーカスを設定します。次に、初期調整のために回折モードを終了します。
- ビームが空白になっていないことを確認してください。ビームが画面に表示されるまで倍率を下げます。ビームを中央にシフトし、ビームを中央に保ちながら、最大で約70kxのステップで倍率を上げます。
- 目的のコンデンサー開口部(通常は50μm)を挿入します。絞りのセンタリングを確認してください。フォーカスノブを少し前後に回すと、スポットは伸縮しますが、飛行機が想像上の垂直砂時計を切断するかのように、所定の位置にとどまります。絞りが中央にない場合、砂時計が傾いているかのように、照明は横方向にシフトします。
- ビームに焦点を合わせ、位置合わせタブの 強度リスト フォーカス(使用可能な場合)を押すか、1.2のようにユーセントリックフォーカスに戻ります。ビーム位置を中央に再調整します。
- 回転の中心を調整します。フォーカスステップホイールを最小または1ステップ上に回して、ビームが穏やかにパルスするようにし、フォーカスが上下に移動してもビームが静止していることを確認します。
- ピボットポイントを選択し、2つのポイントをXとYの調整でまとめます。
注意: 位相プレートがTFS機器に取り付けられている場合は、X調整のみを使用する必要があります。 - ビームの焦点を少し下げ、コンデンサースティグメーターを調整してディスクを丸くします。フォーカスを上下に移動して最適化します。フォーカスを通過するときに一方向または他の方向に伸びる傾向があってはなりません。
- レンズを正規化します。次に、ビームシフトを使用してスポットを中央に保ちながら、倍率を約240kxまで徐々に上げ、回転中心とピボットポイントの調整を繰り返します(手順1.6〜1.8)。
- 回折モードに戻ります。ビームは蛍光スクリーン上に均一なディスクとして現れるはずです。カメラの長さ(CL)は、X線結晶構造解析のように、検出器までの光学距離を効果的に制御するようになりました。それを変更し、画面の位置が標本に近づいたり遠ざかったりするかのように、ディスクが収縮および拡大するのを確認します。この円錐はBFイルミネーションを表します。
注:CLごとに、投影ビームを中心軸に合わせるために調整する回折アライメントがあります。通常、それらすべてを絞り込む必要はなく、検出に使用するのは1つ(または少数)だけです。 - 高倍率でSTEMモードを使用します。
- BF STEM検出器が利用可能な場合は、そこから始めます。空の穴のある領域にステージを移動し、回折アライメントを調整して、目的のCLを使用してビームを中央に配置します。
- 多くの顕微鏡にはHAADF検出器しか装備されていません。これをBF検出器として使用するトリックがあります。まず、検出器を後退させ、上記のようにビームを直接位置合わせの中心に配置し、対物レンズ開口部(通常は20μmなどの小さな開口部)を挿入し、ビームを均一に囲むように位置を調整します。(これを行う最も簡単な方法は、試験片またはテストグリッドを挿入して、照明の周りのハローを確認することです)。次に、回折アライメントを使用して、ビームを軸から外して検出器領域に移動します。画面上のビームを見ながら検出器を挿入および収縮させ、ビームが検出器によってブロックされていることを確認します。
- 顕微鏡ソフトウェアでスキャンを開始し、明るさとコントラスト(B/C)の設定を調整して、ビームがブランクされると信号が0に近く、検出器に完全な照明が当たると飽和に近くなるようにします。スコープ表示を使用して支援します。設定は予期しない方法で結合される可能性があるため、調整を数回繰り返す必要があります。
- 顕微鏡を低倍率(LM)モードに入らずに、高倍率レジスタ(SAモード)で比較的低い倍率に戻します。
- 後で参照できるように、画面の電流をメモします(手順3.1.1を参照)。電流は、TEMと同様に、ガンレンズとスポットサイズの設定で変更でき、電流の減少に対応する数値が増加します。
- この時点で、FEGレジスタを保存して、標準値に戻しやすくします。
注:施設は、ユーザーが作業構成から開始できるように、FEGレジスタのデフォルトセットを準備できます。
2. 試料の配置
- LM TEM モードでは、グリッドが不透明でないことを確認します。初期調整を行うためのグリッドの正方形を見つけます。空の領域、穴、または破れたグリッドの正方形を見つけると便利です。ステージの位置を記録して、便利に戻します。
- サンプルをユーセントリックの高さにします。これを行うにはいくつかの方法があります。例えば、ステージワブラーを使用して、画像が横方向にシフトしなくなるまで、Z軸に沿って標本の高さを移動しながらグリッドを傾けます。または、表示画面でいくつかの機能をマークし、ステージを30°傾けます。フィーチャが横方向に移動します。試験片の高さを調整して元の位置に戻します。倍率またはステージの傾きを上げて絞り込みます。0°の傾きに戻ります。
- STEMモードに戻り、STEM検出器を挿入します。最低の高倍率(SA)モードに移動します。コンピュータ画面に画像が表示されることを確認します。不必要な露出を避けるために迅速にスキャンします。1μs/ピクセル以下が一般的です。スキャンが速すぎると、画像の左の境界線が歪んで表示される場合があることに注意してください( 図2を参照)。
- ユーセントリックフォーカスを押し、倍率を上げて、スキャン中にフォーカスを調整します。顕微鏡ソフトウェアが提供するフォーカスルーペを使用すると便利です。
- コンデンサーの乱視を調整します。これはロンキグラム法によって最も正確に行うことができます。薄いサンプル領域にビームを当てて、送信ビームが爆発するポイント、両側のサンプルのシャドウ画像の間に焦点を合わせます。次に、コンデンサーのチューニングを調整して、中央のディスクを丸くします。これには、特に極低温サンプルの場合、ある程度の練習が必要です。
注:別の方法は、いくつかの金粒子を見つけることです(トモグラフィーでのアライメントの基準マーカーとしてよく使用されます)。倍率を上げて上下に焦点を合わせ、粒子がどちらの方向にも伸びずに丸いままになるように非点収差を調整します。 - LM STEMモードに移動し、スキャンを続行して興味深い領域を見つけます。必要に応じて、おおよそこの時点で検出器のB / C設定を再調整します(手順1.13.3)。
3.画像を記録する
- 記録する線量を推定します。経験則として、断層像全体で100-150 e-/Å2 を目指します。検体ごとの線量耐性を確認してください。アンペア(A)単位の電流を電子あたりの電荷で割った値は、e-/sのカウントを表し、これに秒単位の露光時間 Tを掛け、Å2の視野で割ったものです。便宜上、電流をナノアンペア(画面から読み取ったもの)、視野の幅をマイクロメートルで、フレームの露光時間を秒単位で適切な係数で表します。
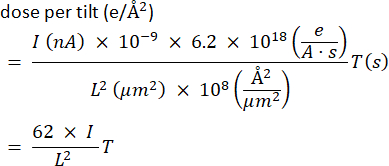
この数値に傾斜数を掛けて、シリーズの合計露出を取得する必要があります。たとえば、電流I = 0.04 nA、磁場L = 4 μm、露光時間が12 sの場合、傾斜あたり1.9 e-/Å2、または一連の61の投影で約110 e-/Å2が得られます。 - ステージを穴に戻し(またはグリッドを引っ込めて)、スポットサイズやガンレンズの設定を使用してビーム電流を調整し、目的のスクリーン電流に到達します。測定値が0の場合は、より大きなC2アパーチャを挿入して電流を増やします。次に、測定値を直径の比率の2乗で割って修正し、最後に小さい方の開口部に戻ります。
- 手順1.13.3に従ってB / C設定を調整し、最後にステージを関心のある領域に戻し、イメージング条件下での直接位置合わせと非点収差を再確認します。
- テスト画像を取得します。
4. シリアルEMによるトモグラフィー
- 顕微鏡コンピュータでシリアルEMサーバーを起動します(シリアルEMは通常、別のコンピュータにインストールされます)。次に、 シリアルEMを開きます。STEMは、同じインターフェースを備えたカメラのようにシリアルEMに表示されます。通信がセットアップに対して適切に実行されていることを確認します。たとえば、[顕微鏡]タブには正しい倍率が表示されます。これが機能しない場合は、ここで停止してトラブルシューティングを行います。
- カメラとスクリプトのタブを見つけて 、[セットアップ]を開きます。STEMカメラが選択されていることを確認し、モードごとに適切なビニング時間と滞留時間を選択します。適切な検出器が左下の[取得するチャネル]ボックスに表示されていることを確認します。下部にある [ 取得 ] を押してテストします。繰り返しますが、何も起こらない場合、またはビームが空白にならない場合は、続行しないでください。通信を停止して確認します。
注:モードはTEM断層撮影と同様の方法で使用されます。ビニングはTEMとの互換性のための工夫です。重要なパラメータはピクセル数です。異なる顕微鏡システムは、同じカウントに到達するために異なるビニングを使用します。- 表示と検索は、比較的少ないピクセル(たとえば、1秒で512 x 512ピクセル)の高速スキャンである必要があります。
- フォーカスは通常、高速記録の小さな領域です。したがって、低線量モードでは、フォーカスを選択して記録モードとは異なる倍率にし、精度を高めることができます。スポットサイズは変更しないでください。
- 記録モードでは、露出推定で上記で選択したパラメータを使用します。可能な場合は、ダイナミックフォーカスも選択して、傾いた画像の フォーカスを行ごとに補正します。
- 後で便宜上、プレビューのビニングをビューのビニングと同じに選択します(拡張機能#1、ステップ5.5を参照)。画像サイズ(ピクセル数)は同じである必要はありません。
- 試用モードを使用して、集録中にレコード領域を中央に保ちます。これは View と似ていますが、フレームの左側に明らかなスキャンの歪みがないように注意してください (例については 、図 2 を参照してください)。繰り返しになりますが、低線量モードでは、試験は記録モードとは異なる倍率を持つことができます。
- グリッドスキャンには、すぐにモンタージュモードを使用します。関心のある領域を見つけるのに十分なピクセル密度である必要があります。推奨: 512 x 512 または 1024 x 1024。このモードは標本領域を見つけるために使用されるため、適切なダイナミックレンジ(画像表示コントロールに表示される)で画像が良好であることを確認してください。
- 設定ファイルを保存して、これらの選択肢が次のセッションのデフォルトとして保持されるようにします(プログラムがクラッシュした場合にすぐに発生する可能性があります)。
- 画像シフトとステージシフトのキャリブレーションをテストします。マイクロプローブ(またはナノプローブ)モードでは、[ 画像の表示]をクリックし、マウスでその上にカーソルを合わせ、ボタンを押したまま、視野の約4分の1だけ斜めにドラッグします。次に、別のビューを取得します。画像は完全に重なっている必要があります。 Shift キーを押したままもう一度ドラッグして繰り返します(ステージの移動を強制するため)。画像はうまく重なり合うはずですが、おそらく精度は低くなります。
- LMモードに移動し、ステージシフトをテストします。これらのテストが失敗した場合は、停止してトラブルシューティングを行います。残りは機能しません。
- グリッド全体のモンタージュLMマップを作成します。これはTEMでも行うことができます。
- 画像が絞りで遮られない最低倍率のSTEMモード(通常は約185倍)に移動します。
- 「ナビゲーター」メニュー>「開く」をクリックします。次に、「ナビゲータ」メニュー>「ナビゲーションオプション」をクリックし>マップをバイトに変換を選択解除します。
- [ナビゲーター] メニュー > [Montaging & Grids] > [Full Montage] を選択します。メニューが開きます。チェックするオプションは、画像をシフトする代わりにステージを移動する、ナビゲーターが開いている場合は各モンタージュからマップを作成する、およびレコードパラメーターではなくモンタージュマッピングを使用するです。画像グリッドは、約 6 x 6 または 7 x 7 である必要があります。記録する総面積を探します。必要な画像が多すぎると、顕微鏡から倍率が正しく読み取られない可能性があります(図3)。停止して確認してください。
- モンタージュの取得を開始するには、モンタージュコントロールの[開始]を押すか、[カメラとスクリプト]の下の[モンタージュ]を押します。 別のメニューが開き、ファイルパラメータを選択します:mrc、整数として保存し、さらに別のダイアログで、保存するファイル名を選択します。データは、SerialEM独自のユーザー設定ではなく、適切なデータ領域に保存してください。システムが存在するCディスクには大きなデータを保存しないことをお勧めします。
- 取得が完了すると、モンタージュがメインウィンドウに表示されます(図4)。TEMと同じように、ナビゲーターのマーカーとポイントを使用してグリッド内を移動できるようになりました。
- 乱視矯正を再確認してください。通常、小さな領域をすばやくスキャンし、焦点と一緒に調整して、金ナノ粒子などの点状の特徴が高倍率で(SEMのように)焦点を合わせたり外れたりするときに完全に丸いままになるようにすれば十分です。より控えめに言えば、乱視を修正する前に、ステップ1.5〜1.8の直接整列を繰り返すことができます。
- 高倍率の画像をLMモンタージュに合わせます。
- LMモンタージュ上の位置に移動し、簡単に認識できる機能を使用します。ポイントを追加し、[ ナビゲーター] ウィンドウ > [ポイントの追加] をクリックして、フィーチャをクリックします。もう一度押す(追加を停止する)と非アクティブ化されます。
- 最低の高倍率(HM)でビューまたはトライアル画像を撮影し、指定されたアイテムを見つけます。図 5 に示すように、マーカーをそこに配置 (緑色の十字) し、[ナビゲーター] ウィンドウで対応するポイントを強調表示した状態で、[ナビゲーター] メニューの [マーカーにシフト...] >開いたダイアログで [すべてのマップ] と [Shift の保存] を選択します。
- ステージを他の位置に移動し、HM画像がLMモンタージュで選択したのと同じ位置の中央にあることを確認してテストします。特徴がHM画像に表示されない場合は、LMモードとHMモード間のシフトが大きすぎる可能性があります。この場合、より広い領域にポリゴンモンタージュを作成します。[ ナビゲーター] ウィンドウ > [ポリゴンの追加] をクリックし、いくつかのポイントを選択してから、もう一度 [ ポリゴンの追加] をクリックして閉じます。[ ナビゲーター]メニューをクリックして、[モンタージュとグリッド]>>[ポリゴンモンタージュの設定]をクリックし、[開始]>モンタージュコントロールをクリックします。次に、上記のように対応するポイントを見つけて、[ マーカーに移動]をクリックします...。
- 低線量モードを設定します。
- 低線 量管理 タブを開き、 低線量モード ボックスをチェックします。
- [継続的な更新]をオンにして、[表示]に移動します。このモードの顕微鏡倍率(通常は最低または最低の隣)を選択します。次の各モードを選択し、適切な倍率を設定します。レコードは目的のピクセルサイズになるように設定する必要があり、フォーカス倍率は、焦点を合わせるための基準マーカーまたはその他の高コントラストの特徴が明確に解決されるのに十分な高さである必要があります。次に、すぐに[継続的更新]のチェックを外します。
注意: 試用モードは、露出を最小限に抑えるためにトラッキング領域を記録領域から移動させるか、周囲の大部分を含む低倍率に設定することができます。 - ビュー画像を取得し、エリアの位置を定義:トライアルを使用してトライアル位置を設定します。
注:推奨事項#1:サンプリングされた領域と時間の変化を考えると、低マグトライアルの追加曝露は最小限に抑えられる可能性があります。グリッド バーが視野に入らない限り、通常、この追跡方法はより信頼性が高くなります。推奨事項#2:フォーカスなどのさまざまなモードの線量を調整するために、スポットサイズを更新することもできます。顕微鏡の光学系設定を安定させるために、これを行わず、スポットサイズを記録に適したままにして、必要に応じて露光時間を調整することをお勧めします。 - 低線量制御タブ>[記録に移動]をクリックし、[ナビゲーター]メニューをクリックして>[イメージング状態を開く]>[現在の状態を追加]をクリックします。簡単に思い出せるように名前を付けます(例:マイクロプローブSTEMの場合はμP STEM)。さまざまなタスクに対してさまざまな状態を定義できます。
- トモグラフィーの対象となる場所にステージを移動します(ナビゲーターの使用については以下を参照)。
- ナビゲータにポイントを追加するには、[ ナビゲータ] ウィンドウ > [ポイントの追加] をクリックします。
- 真心の高さを調整するには 、[タスク]>[真心度]>[ラフ]を選択します。[ナビゲーター] ウィンドウ > [Z を更新] をクリックします。
- フォーカスとトライアルの領域を設定します。まず、ビュー画像を撮影します。次に、[ 低線量管理 ]タブの[ 領域の位置の定義]で、[ フォーカス]または[試験]を選択します。傾斜軸に沿って 2 つの領域の位置を調整します。フォーカスは [レコード] 領域と重ならないようにする必要があります。
注意: 特に左端にオーバーシュートがあるため、どちらも[記録]領域のすぐ隣に設定しないでください。オーバーシュートの程度は、記録倍率で繰り返しスキャンし、倍率を下げてより広い視野を得ることで、テスト領域で評価できます。
- 適切な測定(経験上オプション)のために、ビューまたはプレビュー画像を撮影するたびにステージを+60°に傾けてから-60°に傾けて、グリッドバーが緑色で表示されているレコード領域の視野に入らないようにします。
- チルトシリーズを設定します。
- 新しいファイルを開いてデータを保存するには 、[ファイル] > [新規作成 ] をクリックし、ファイル名を選択します。[ チルトシリーズ]メニュー>[チルトシリーズセットアップ ]を選択します(図6)。トラブルシューティング: [新規開く ]ボタンが灰色の場合は、前のチルトシリーズが終了していることを確認してください。そうでない場合は、[ シリーズを傾ける] > [終了] をクリックして終了します。
- [傾斜]ボックスと[終了]ボックスの極端な傾斜角度(通常-60°と+60°)と、増分(通常2°)を設定します。
- 線量対称モード(推奨-低線量モードがまだアクティブであることを確認してください)の場合、 ___から2方向にシリーズを実行するにチェックを入れます。ブランクは通常0ですが、事前に傾いたFIBラメラを補正するために使用できます(たとえば、20°)。
- わかりやすくするために、[ 露出時間を一定に保つ] をオンにします。これを変更するには、露出計算のやり直しが必要であり、投影強度を元のデータと比較する代数再構成(ART/SART/SIRTなど)にも干渉する可能性があります(ステップ7.1を参照)。
- [ オートフォーカスをスキップする]をオンにします。1 mradなどの小さな半収束角は、焦点を合わせる必要がないほど長い被写界深度を意味します。テストとして、0°で焦点を合わせ、60°または-60°に傾けて、 記録を押します。焦点を維持することは、主に正確なユーセントリックの高さの問題です。より大きな収束のために、シリーズの間に焦点を合わせる必要があるかもしれません。この場合、ビューを取り、[ 低線量制御 ]タブで、領域と焦点の位置を定義し、焦点領域を調整します。
- 初期アクションと最終アクション:ユーセントリック高さ調整が正確に行われた場合、それを繰り返す必要はありません。チェックを外し ます シリーズの終わりにカラムバルブを閉じる そうしない正当な理由がない限り。
- 制御パラメータを追跡するために、多くのオプションがあります。無人データ収集の場合、最優先事項は、ユーザー入力のためにプログラムが停止しないようにすることです。推奨設定を使用する: フィールドの損失率が 5 を超える場合は [記録] を繰り返します。次に、後にトラックし、新しいトラック参照 を取得する前にプレビューと整列 し、レコードアライメントが2%異なる場合は 新しいトラック参照を取得します 。有人データ収集では、より厳格なパラメータを適用して、何時間もの機器時間を失うリスクを回避します。
- 開始する準備ができたら、ウィンドウの下部にある [GO ]を押します。最後に、[ シリーズを傾ける] > [終了] を選択します。
5. ナビゲータを使用した複数ポイントでのバッチ取得 (拡張 #1)
注:プロトコルは、a)TEMと同一であり、b)完全な説明を時代遅れにする可能性のある新しいツールが利用可能になりつつあるため、初歩的なものです。
- フルグリッドモンタージュをメインウィンドウにロードします。
- 有望に見えるいくつかの領域を選択してください。[ ポイントの追加 ] をクリックし、選択したグリッドの四角形の中心に追加します。もう一度 [ ポイントを追加 ] をクリックして、モードを無効にします。
- 低線量イメージング状態をアクティブにした状態で、[ナビゲーター]ウィンドウを選択し>選択した各正方形の[アイテムで取得]と[アイテムの新しいファイル]をオンにします。最初に、ファイルのプロパティ(図7)のダイアログが開き、次にファイル名が表示されます。モンタージュ画像を選択し、[モンタージュ設定]ダイアログ(図8)で、[低線量モードでビューパラメータを使用]をオンにして、正方形を覆うのに十分な大きさ(約100 x 100 μm)のグリッドを作成します。
- ナビゲーターメニュー>アイテムで取得]をクリックし、マッピングのパラメーターを選択します。最も重要なのは、[プライマリ アクション] で [ナビゲーター マップの作成]、[大まかな等心度]、[細かい等心度] の順にチェックし、[実行] を押すことです (図 9)。200メッシュのグリッドの場合、これにより、ほぼ正方形全体のマップが生成されます(図10)
- 断層撮影位置の選択を準備します。[ ファイル] > [新規作成] をクリックして、新しいファイルを開きます。ファイル名を付けます (例: AnchorMaps.mrc)。
- 低線量モードをアクティブにして、 カメラ&スクリプト>セットアップ に入り、表示とプレビューが同じビニングになっていることを確認します(そうしないと、同じファイルに保存できません)。
- 正方形のマップ内のポイントにアクセスするには 、[ナビゲーター] ウィンドウ > [XYZ に移動] をクリックします。
- マーカー付きの最初の断層撮影の位置を選択します。プレビュー画像を取得し、マウスの右ボタンでドラッグして位置を調整します。次に、[ ナビゲーター ウィンドウ] > [新しいマップ] を選択し、ダイアログで [ はい ] をクリックして保存します。次に、同じエリアのビュー画像を取得し、もう一度新しいマップとして保存します。[ビュー] マップが強調表示されていることを確認し、右上の [ナビゲーター] ウィンドウで [ アンカー状態] をオンにします。
- 2番目の位置を選択し、もう一度プレビューを実行して上記のように場所を絞り込み、今度はナビゲーターウィンドウで アンカーマップ を押します。これにより、プレビューとビューの両方がナビゲーターに新しいマップとして保存されます。
- 目的のすべての場所に対して手順5.5.4を繰り返します。あるグリッドの正方形から別のグリッドの正方形に移動するには、点を選択し、[ナビゲータ]ウィンドウで[ XYZに移動 ]を押します。
- 参照フォーカスの場合は、グリッドの明確な領域を選択し、手またはオートフォーカスで慎重に焦点を合わせます。顕微鏡パネルの [焦点ぼけをリセット ]を押します。[ スクリプト>編集] > [編集 15 ] (または別の空き番号) をクリックして SerialEM でスクリプトを作成し、ScriptName SetDefocus と SetDefocus 0 の 2 行を入力します。
- 「ナビゲータ」ウィンドウで、最初の場所 (「プレビュー」または「表示」) をハイライト表示します。Shift-Tを押してから最後の位置を強調表示し、もう一度Shift-Tを押します。[ファイルのプロパティ]ダイアログが開きます。ファイル名を含めて保存する単一フレームの画像とパラメータを選択します。ファイル名を編集しますが、項目ラベルは最後に残します。
注意: 数字で終わるファイル名は、連続するチルトシリーズで自動的に更新されます。[ ナビゲーター]メニュー>[ナビゲーション]オプション>[ファイル名にアイテムラベルを使用する]オプションを使用すると便利です。 - 次に、チルトシリーズセットアップメニューが自動的に開きます。前と同じように充填しますが(図6)、真心を調整は選択しないでください。ナビゲーターのプレビューポイントがTSとしてマークされます。このメニューに戻るには、項目リストの上にある「ナビゲータ」ウィンドウのボタンを使用します。
- [ナビゲーター] メニュー > [アイテムの取得] を選択します。今回は、最終データのパラメータを選択します。プライマリアクション:傾斜系列を取得を選択し、デュワー/真空の管理、アイテムに再調整、精密ユーセントリシティ、アクションの前にスクリプトを実行を選択し、Sクリップで実行します:SetDefocus。一般オプションを選択します:エラーが発生したときにメッセージボックスを表示せず、最後にカラムバルブを閉じてからGOを押します(図11)。SerialEMは、すべてのアンカーマップを訪問し、各位置で傾斜系列を記録します(図12)。
6. CLEM マップの登録 (拡張機能 #2)
- まだ行っていない場合は、完全なグリッドモンタージュをメインウィンドウにロードし、[ウィンドウ] >[新しいウィンドウ ]をクリックして新しいウィンドウを作成し、名前を付けます。完全なグリッドモンタージュが登録 1 に表示されることに注意してください。
- [ ナビゲーター] メニュー > [マップのインポート] をクリックして、CLEM マップ イメージをインポートします。登録 2 に入るはずです。上記のように新しいウィンドウを割り当てることもできます。
- CLEM マップを調べて、完全なグリッド モンタージュに対する相対的な回転を決定します。グリッドバーが表示されているマップ上でこれを行うのが最も簡単です。マップが反転することもあることに注意してください。 [ナビゲーター]メニューの[マップの回転]を使用して大まかに位置合わせ>、必要に応じて[反転]を使用します。
注:次の手順でもフリップに対応できますが、事前にフリップを行うと、次の作業がはるかに簡単になります。この手順は、アライメントが満足のいくものになるまで繰り返すことができますが、正確である必要はありません。 - 正確な位置合わせのための基準点を導入します。対応する点を一方のウィンドウに配置し、次にもう一方のウィンドウに配置します。このようなポイントごとに、[ナビゲーター] ウィンドウの最上部にある [登録ポイント ] をオンにします。対応するポイントには昇順インデックスのラベルが付けられ、その後にグリッド モンタージュまたはインポートされたマップの R1 または R2 が続きます。
注:ファインダーグリッドを使用すると、この手順が非常に簡単になります。それ以外の場合は、中央マーカーやグリッド四角形のコーナーなどのソリッド フィーチャを選択します。原則として、大まかなアライメントには3ポイントで十分ですが、より多くのポイントはモンタージュ構造の小さな不一致を補うのに役立ちます。 - CLEM マップの複数のチャンネルが必要な場合 (たとえば、異なる蛍光色や明視野背景のない蛍光など)、上記の手順 6.2 のようにそれらをインポートし、登録を 2 に変更します。このようにして、最初のマップから登録ポイントを継承します。
- ナビゲーターメニュー>変換項目による登録を強制します。対応する基準地点がすべてのマップに表示され、登録 1 に表示されます。視覚的に整列するには、[ナビゲーター] メニュー> [マップの回転] をクリックします。[ナビゲーター] ウィンドウからマップを読み込む場合、[読み込み時に回転] ボックスがオンになっていない限り、マップは自動的に回転されないことに注意してください。これは、[ナビゲーター] ウィンドウからいつでも回転できます。
- これで、マーカーまたはポイントを蛍光マップに配置し、ステージをグリッド上の対応する位置に移動できるようになります(図13)。
7.3D再建
- これには、TEM断層撮影と同じ基本的なステップが含まれます:傾斜系列のアライメントとそれに続く典型的な後方投影。いくつかのソフトウェアプラットフォームが利用可能であり、CTF補正をスキップする必要があることを除いて、データはTEMデータと同様に扱うことができます。
- 強度正規化を適用して、高傾斜投影の寄与を高めたり、シリーズ中の照明の変化のバランスを取りますが、定量的な情報が影響を受けることに注意してください。たとえば、IMOD26 はうまく機能しますが、AreTomo27 は基準のないアライメントに非常に役立ちます。基準パーティクルが存在する場合、ClusterAlign28 は個々のスポットではなくクラスターとしてそれらをたどることができます。これは、高コントラストの特徴によってスポットが失われたり隠れたりする可能性のあるSTEMデータに特に役立ちます。
- 3Dデコンボリューション29 による再構成に続いて、コントラストの向上とノイズ除去を行います。再構築したら、オルソスライスや等値面セグメンテーションなどの標準的な方法のいずれかでSTEM体積データを表します。特に、強度分布は単極であり、従来の位相コントラストTEMに現れるコントラスト反転やフーリエ縞はありません。一般に、STEM断層像の興味深い表現手段は、明視野を反転させることです(図14)。その効果は「X線の目」の効果であり、清澄化されたセル30を通して関心のある高密度の物体を見る。
結果
STEMで作成されたフルグリッドモンタージュは、関心のある細胞がある領域を示しています(図4)。画像は暗いフィールドにあるため、空の穴は暗く表示されることに注意してください。細胞は部分的に明るく見え、電子はHAADF検出器に向かって散乱されます。最も厚い部分、通常は中央またはグリッドバーの近くでは、コントラストは再び暗くなります。これは多重散乱によるもので、電子は検出器によって捕捉されない角度に達します。実際には、これらの領域は断層撮影には厚すぎます。
次の段階には、中間倍率のマップが含まれます(図10)。これらはしばしばミディアムモンタージュマップ、または正方形マップと呼ばれ、形状ではなくグリッドの正方形を指します。最も低いマイクロプローブSTEMモードでも、モンタージュ画像として取得されます。[ナビゲータ] ウィンドウでアイテムをクリックすると、マップ イメージがメイン ウィンドウに読み込まれます。断層撮影のための特定のポイントは、この領域内で選択されます。プレビューモードを使用して、記録倍率で領域を見つけます。スキャン速度によっては、プレビューと記録の間に横方向のシフトがある場合があることに注意してください。単一のチルトシリーズをここに記録することができます。たとえば、ミトコンドリアは、プレビューおよび記録画像で識別されることがよくあります(図12)。
バッチ断層撮影の場合、ステージはグリッドの周りを移動し、まったく同じ場所に戻らない場合があります。アンカーマップは、ステージの動きがずれた場合でも、プレビュー画像を低倍率のビューに一致させることで、目的のレコード領域を確実に再識別するために使用されます。PyEM23,24は、確かに推奨されるより高速な代替手段を提供しますが、まだ標準インストールの一部ではありません。
CLEMアプローチでは、蛍光マップを使用して、トモグラフィーの関心のある領域を特定できます。蛍光は外部で取得され、フルグリッドモンタージュに登録する必要があります。グリッドバーと穴が見えるようにしておくと便利なので、インポート前に、たとえばGIMP(https://www.gimp.org)やImageJ31 ソフトウェア(ImageJが縦軸を反転するように注意してください)で、マージされた蛍光+明視野複合体を準備できます。蛍光のダイナミックレンジが大きいと、飽和せずにこのような融合を作成することが困難な場合がある。この場合、2 つのマップを別々にインポートし、説明に従って一緒に登録できます (図 13)。このようにして、ナビゲーターウィンドウの蛍光マップ上のポイントに続いて「Go To XY」が続くと、ステージはTEMに取り付けられたグリッド上の対応する位置に移動します。モンタージュ(またはモンタージュの場合は蛍光マップ)の作成における小さな不整合が小さな変位につながることに注意してください。したがって、最適な精度を得るには、蛍光を正方形マップに特異的に再登録する必要があります。多くの場合、支持フィルムの穴または明視野光画像と共有される特徴に基づいて、目視でこの登録を行うだけで十分である。
傾斜系列を再構築すると、3Dボリュームが得られます(図14)。この例のピクセルサイズは2.042nmで、視野は~4μmです。リン酸カルシウムの堆積物(オレンジ色の矢印)は、周囲に比べて原子番号が高いため、目立ちます。微小管(赤い矢じり)は、視野全体にわたって追跡できます。また、ミトコンドリアの内膜と外膜(緑色の矢じり)がはっきりと見えます。アクチンは束または個々のフィラメントとして観察することができる。より等方的な分解能を達成するために、再構成はデコンボリューションによって処理され得る。
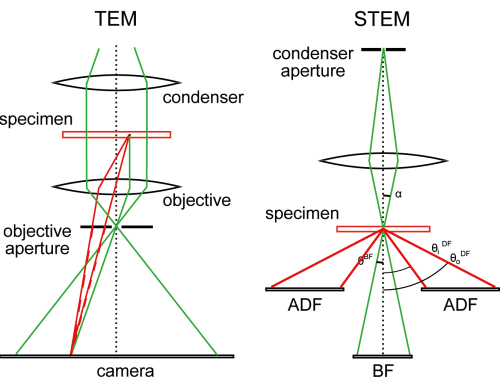
図1:TEMとSTEMの比較。 TEMでは、視野はほぼ平行なビームによって照らされ、対物レンズはカメラ上に拡大像を形成する。クライオTEMの場合、対物レンズの開口部を開いて散乱電子波(赤い破線)を通過させ、焦点がぼけると、非散乱(緑)波との干渉によって位相差が生じます。一方、STEMは、試料全体に集束ビームをラスター化し、散乱した電子をピクセルごとに収集します。複数の検出器は、異なる角度に散乱された電子を収集することができます。この数値は30から変更されています。 この図の拡大版を表示するには、ここをクリックしてください。

図2:スキャンレートが高いことによる左側の画像の歪みの例。 黄色の矢印でマークされた歪みと、クォンティフォイルの歪んだ楕円形の穴に注意してください。 この図の拡大版を表示するには、ここをクリックしてください。
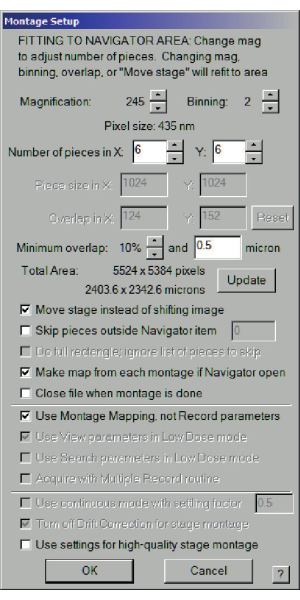
図3:グリッドモンタージュ全体のモンタージュ設定ダイアログ。XとYの倍率とピース数を選択して、総面積が約2,000μmに達するようにして、ほとんどのグリッドのマップを取得します。また、画像をシフトする代わりに「ステージを移動」を選択し、「記録」パラメーターではなく「モンタージュマッピングを使用」を選択します。この図の拡大版を表示するには、ここをクリックしてください。

図4:STEMモードで記録されたフル低倍率のグリッドマップ。 壊れた領域は、暗視野画像では完全に黒く表示されます。濃い灰色の領域は、厚すぎてガラス化が不十分である可能性があります。断層撮影に適した候補領域は、このスキャンでは白または薄い灰色です。スケールバー = 100 μm。 この図の拡大版を表示するには、ここをクリックしてください。
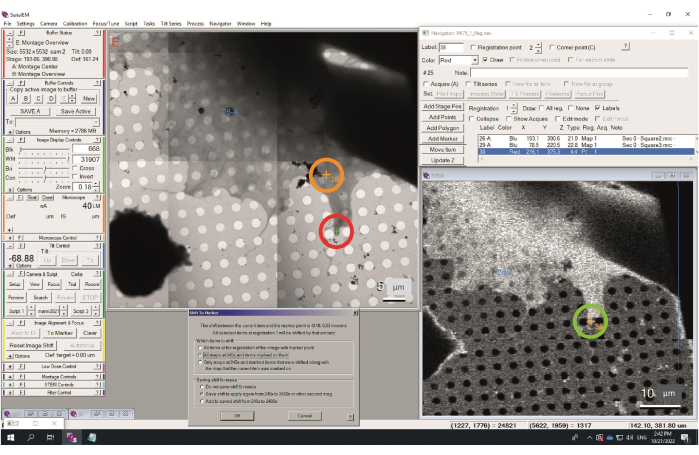
図5:マーカープロセスへの移行。 認識可能なオブジェクトは、低解像度マップで[ポイントの追加](この図では38)によってマークされます。低解像度マップ(緑色の円)と中解像度マップ(オレンジ色の円)の間のシフトに注意してください。次に、オブジェクトがマーカー(緑の十字、赤い円)でマークされ、[マーカーに移動]ダイアログが開始されます。選択したオプションは、すべてのマップを245倍で同じ量だけ移動します。 この図の拡大版を表示するには、ここをクリックしてください。
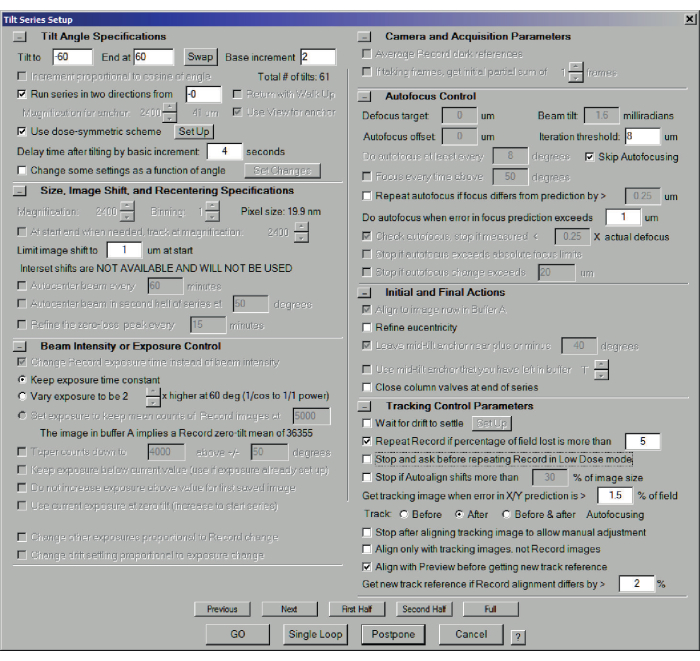
図6:STEMチルトシリーズのチルトシリーズセットアップダイアログ。 線量対称スキームは、-60°から+60°まで2°刻みで使用されます。低い収束角度を使用すると焦点深度が高いため、オートフォーカスがスキップされます。これは以前に行われたように真心度を洗練する必要はありません。 この図の拡大版を表示するには、ここをクリックしてください。
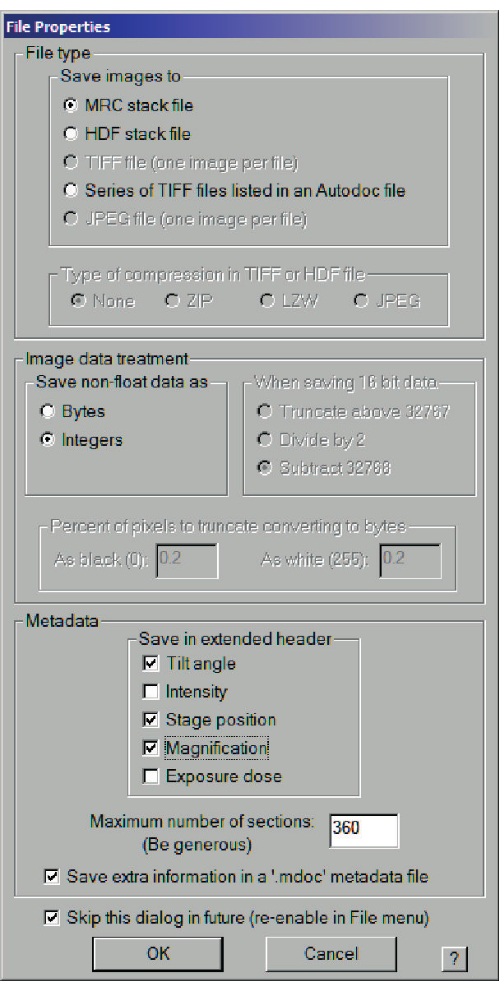
図7:中解像度マップのファイルプロパティダイアログ。 MRC スタック ファイルとして保存し、整数を選択して、追加情報を .mdoc メタデータ ファイルに保存します。 この図の拡大版を表示するには、ここをクリックしてください。
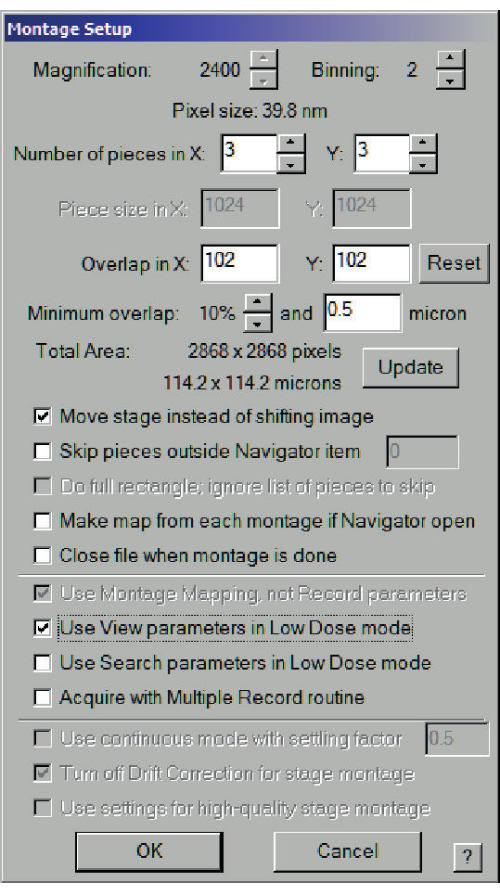
図8:中解像度のマップを保存するためのモンタージュ設定ダイアログ。 幅90μmの200メッシュグリッド上の正方形の場合、少なくとも90μm x 90μmの総面積が推奨されます。画像をシフトする代わりにステージの移動を選択し、低線量モードでビューパラメータを使用します。 この図の拡大版を表示するには、ここをクリックしてください。
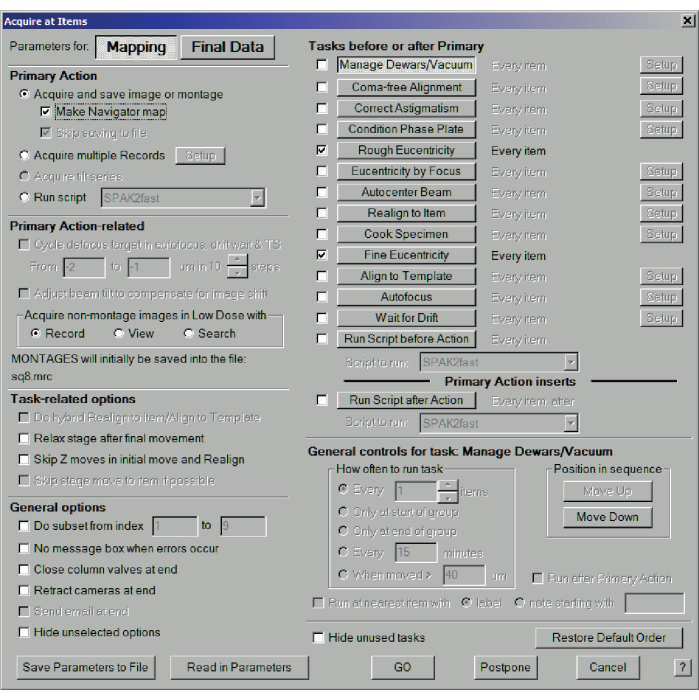
図9:記録媒体の解像度マップ。 中解像度のマップを記録するためのアイテムダイアログで取得します。マッピングを選択し、画像またはモンタージュを取得して保存し、[ナビゲーターマップを作成]にチェックマークを付けます。プライマリの前または後のタスクで、[粗い真心度]と[細かい真心度]を選択します。支援しない場合は、必要に応じて [エラーが発生したときにメッセージ ボックスを表示しない] と [最後に列バルブを閉じる] を選択します。 この図の拡大版を表示するには、ここをクリックしてください。

図10:中解像度マップの画像。 3 x 3のモンタージュによってSTEMモードで記録された中解像度マップ(正方形マップ)。データ収集用の 2 つの中解像度アンカー マップは、青い四角形で示されます。スケールバー = 10 μm。 この図の拡大版を表示するには、ここをクリックしてください。
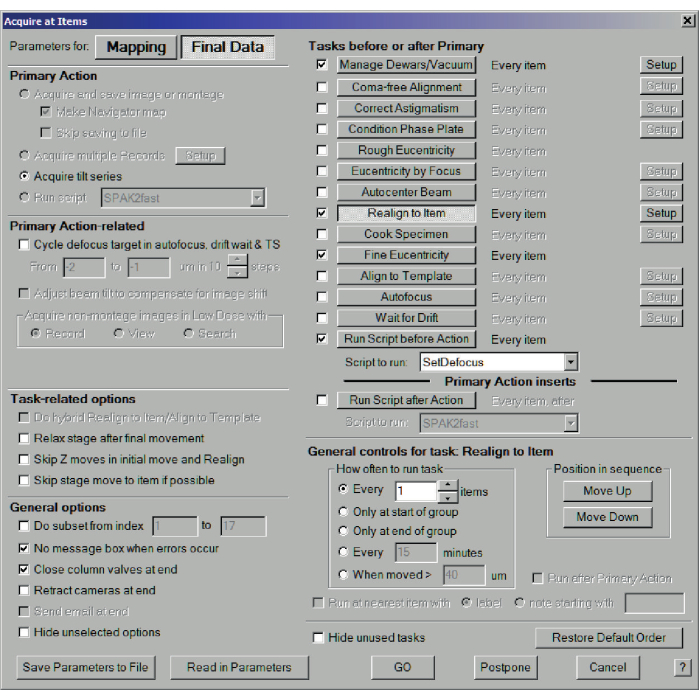
図11:バッチチルトシリーズデータ。 バッチチルトシリーズを収集するためのアイテムダイアログで取得します。傾斜系列データ収集の場合は、[最終データ]と[傾斜系列を取得]を選択します。プライマリの前後のタスクで、[デュワー/バキュームの管理]([セットアップ]メニューで適切な設定を選択)、[アイテムに再配置]、[微細な真心度]、および[アクションの前にスクリプトを実行]をオンにします。一般オプションで、エラーが発生したときにメッセージボックスがないとチェックを入れ、最後にカラムバルブを閉じます(5.14を参照)。 この図の拡大版を表示するには、ここをクリックしてください。
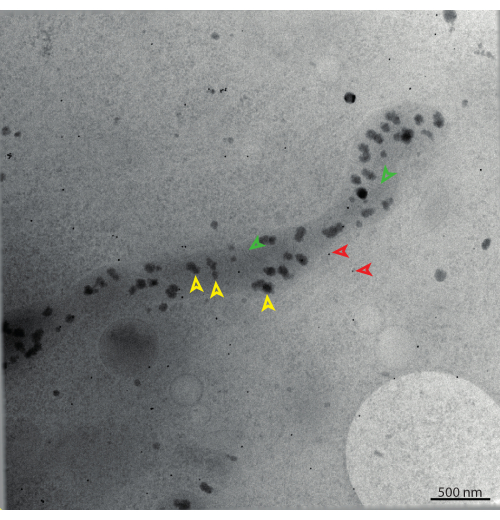
図12:ミトコンドリアのSTEM傾斜系列の0°傾斜。 オレンジ色の矢印はリン酸カルシウムの堆積物(マトリックス顆粒)、緑色の矢印はクリステ、赤い矢印は15 nmの金の基準マーカーを示しています。スケールバー= 500 nm。 この図の拡大版を表示するには、ここをクリックしてください。
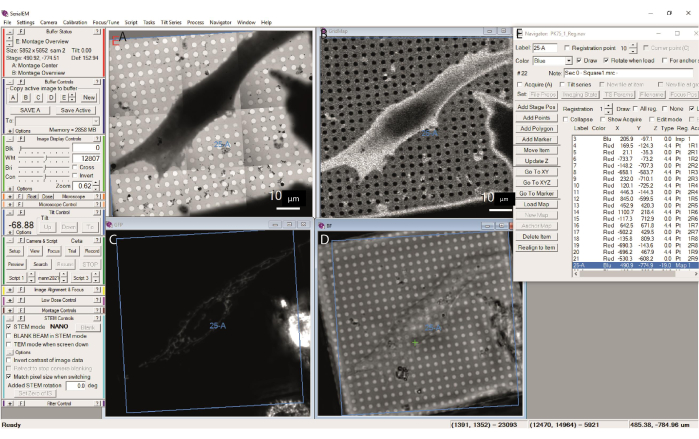
図13:登録されたクライオ-CLEMマップ 。 (A)中解像度STEMマップ(正方形マップ、26-A)が(B)低解像度STEMマップ、(C)BFチャネルクライオFMマップ、および(D)GFPチャネルクライオFMマップに登録されています。9 つの基準点 (ラベル 4-21) は、(E) ナビゲーターに表示されます。 この図の拡大版を表示するには、ここをクリックしてください。

図 14: ボリュームのレンダリング。 (A)60 nmおよび(B)厚さ40 nmの切片を、異なる深さでSIRTのような(30サイクル)フィルター断層撮影したボリュームレンダリング。ピクセルサイズは2.048nmで、約4μmの視野が得られます。 図12と比較した逆密度は、高輝度の特徴が明るいことを意味します。オレンジ、白、赤、緑、および水色の矢印は、それぞれリン酸カルシウム沈着物、リボソーム、微小管、ミトコンドリアの内膜および外膜、およびアクチンフィラメントを指しています。スケールバー= 500 nm。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、従来のTEM断層撮影ではアクセスできない細胞領域の細胞内オルガネラの3Dビューを取得することに関心のあるライフサイエンス顕微鏡学者を支援する必要があります。同じプロトコルは、曝露に対する制約を緩和したプラスチック切片のSTEM断層撮影にも使用することができます。プロトコルは、一連の厳格なルールではなく、出発点と見なす必要があります。確かに、STEMの力はその柔軟性です。それを操作するための正しい方法はありません。
STEM自体は、スキャンされたプローブのみを指し、画像形成を定義するものではないことを強調します。コントラストは、主に検出器の構成に依存します。より簡単な方法は、光軸を中心とした円盤またはそれを囲む円環のいずれかの軸対称性を有する検出器を使用する。一般に、照明が検出器に直接当たると、(電子散乱)試料が暗く見えるBF画像を記録します。逆に、検出器が散乱電子のみを収集する場合、高密度の試料が明るく見えるDF画像を記録します。適切なハードウェアが利用可能な場合、SerialEMはこれらの信号の両方を同時に集録して記録することができます。複数のセグメントを持つ検出器から完全にピクセル化されたカメラまで、さらに洗練された構成が可能です。位相差イメージングは、例えば、軸外検出器素子32、33間の差を評価することによって達成することができる。ピクセルごとに2D散乱(回折)パターン全体を収集することは、同じ元のデータから複数の画像コントラストの再構築を可能にする4D STEM34として知られる方法を定義します。4次元STEMは電子タイコグラフィを可能にし、これは位相差35を得るための別の手段を提供する。
私たちは、細胞小器官および無傷細胞またはミクロン厚の細胞切片の研究に最も有用であると考える特定のSTEMモダリティに焦点を当ててきました。これは特に、照明における小さな半収束角および検出器における比較的大きな収集角度を有するBFイメージングの使用を伴う。小さな収束は大きな被写界深度を提供し、その結果、サンプル全体がチルトシリーズ19全体を通して焦点を合わせたままになります。実際には、優れた顕微鏡ステージを使用すると、取得中の焦点調整の必要性も排除できます。価格は、プロトコルのセクション3で説明されているように、解像度の妥協です。1 nmのピクセル間隔で4 μmの視野に達する~2 nmのプローブを使用した4k画像を提案しました。ただし、読者は実験することを強くお勧めします。2番目の考慮事項は、検出器の側面にあります。照明ディスクが軸上のBF検出器をアンダーフィルすると、位相コントラストが抑制され、散乱(振幅)コントラストが支配的になります。この状態は、インコヒーレント明視野コントラスト36と呼ばれている。問題は、アンダーフィルする割合であり、答えはサンプルによって異なります。非常に薄いサンプルは、検出器が完全に満たされた状態で最高のコントラストを示します(つまり、収集角度は照明の角度と一致します)が、厚いサンプルはすべての強度を散乱させ、コントラストの低いノイズの多い信号を残します。有用な経験則は、サンプルが厚いほど、BF検出器の外側のカットオフ角度を21にする必要があるということです。検出器のサイズと位置はもちろん固定されているため、回折ディスクのサイズは、セクション1で説明したように、カメラの長さを使用して調整されます。検出器アンプの設定が、信号がダイナミックレンジを満たすが、直接照明(1.12.3)で飽和しないようなものである場合、適切な信号強度とコントラストに達するまでカメラの長さを増やすことができます。繰り返しますが、読者は実験することをお勧めします。芸術は、いわば角度にあります。
プロトコルで説明されていない別のパラメータは、顕微鏡の加速電圧です。発光電子と試料との相互作用は、より低い電圧で強くなります。他の条件がすべて等しい場合、低電圧でより高いコントラストが期待できます。一方、使用可能な試料の厚さを制限するのは、試験片内の多重散乱の開始であるため、電圧が高いほど、より厚い試料を使用できます。ただし、これらの効果はかなり微妙です。200 kVと300 kVの加速度に関するこれまでの経験は似ています。
分解能の観点からSTEMに何が期待できるかを考えると、これも試料と検出器の構成に依存します。単粒子分析アプローチを使用すると、フェリチン上の金属イオンは、環状暗視野STEMによって数オングストロームの精度に局在化することができました37。最近では、統合微分位相差(iDPC)STEM32 とタイコグラフィ35によって得られた画像を使用して、ウイルスおよびタンパク質サンプルのサブナノメートル分解能が達成されました。厚い細胞標本のユニークな物体の場合、およびここで説明した方法では、そのような高解像度は現実的ではありません。最適な分解能はプローブの直径であり、これは説明されている半収束角に関連しています。他の要因、特に広い視野に到達するための粗いピクセルサンプリング、チルトシリーズのミスアライメント、および送信中のプローブビームの広がりなど、解像度が低下します。画像はプラスチック断層撮影とよく比較されます。たとえば、ここで説明するセットアップでは、微小管の中空コアは簡単に確認できますが、個々のプロトフィラメントは確認できません。
要約すると、STEMメソッドとハードウェアはどちらも開発段階にあります。イメージングの革新はトモグラフィーにも影響を与え、STEMを他の技術ではアクセスできなかったドメインに導くことが期待できます。最新の光学超解像法に基づく相関極低温蛍光イメージングとの収束は、特に実り多いものになると期待しています。100〜1,000 nmの細胞小器官のスケールは、これらの新しい方法の理想的なターゲットです。
開示事項
著者は利益相反を宣言しません。
謝辞
SerialEMソフトウェアパッケージの作者でありメンテナであるDavid Mastronade氏とGünther Resch氏からの継続的かつ継続的なサポートに非常に感謝しています。P.K.は、シュレーディンガーフェローシップJ4449-Bを通じてオーストリア科学基金(FWF)から資金提供を受けました。オープンアクセスの目的で、著者は、この投稿から生じる著者が受け入れた原稿バージョンにCC-BYパブリック著作権ライセンスを適用しました。M.E.とSGWは、イスラエル科学財団(助成金番号1696/18)および欧州連合ホライズン2020双子プロジェクトImpaCT(助成金番号857203)からの資金提供を認めています。M.E.は、CryoSTEMプロジェクト(助成金番号101055413)におけるERCからの資金提供を認めています。M.E.は、サムとアヤラザックス教授の議長の現職者であり、アーヴィングアンドチェルナモスコウィッツナノおよびバイオナノイメージングセンターの責任者です。M.E.の研究所は、ハロルド・パールマン家の歴史的な寛大さから恩恵を受けてきました。我々はまた、欧州連合による資金提供を認識する。ただし、表明された見解や意見は著者のものであり、必ずしも欧州連合または欧州研究会議執行機関の見解や意見を反映しているわけではありません。欧州連合も付与機関もそれらに対して責任を負うことはできません。
資料
| Name | Company | Catalog Number | Comments |
| SerialEM | University of Colorado | Veriosn 4.0 | SerialEM is a free software platform for microscope control and data acquisition. |
| STEM-capable transmission electron microscope | The protocol was written based on experience with several microscopes of Thermo Fisher Scientific: Titan Krios, Talos Arctica, and Tecnai T20-F. In principle it should be applicable to other manufacturers as well. |
参考文献
- Elbaum, M. Expanding horizons of cryo-tomography to larger volumes. Current Opinion in Microbiology. 43, 155-161 (2018).
- Schertel, A., et al. Cryo FIB-SEM: Volume imaging of cellular ultrastructure in native frozen specimens. Journal of Structural Biology. 184 (2), 355-360 (2013).
- Do, M., Isaacson, S. A., McDermott, G., Le Gros, M. A., Larabell, C. A. Imaging and characterizing cells using tomography. Archives of Biochemistry and Biophysics. 581, 111-121 (2015).
- Groen, J., Conesa, J. J., Valcárcel, R., Pereiro, E. The cellular landscape by cryo soft X-ray tomography. Biophysical Reviews. 11 (4), 611-619 (2019).
- Kapishnikov, S., et al. Oriented nucleation of hemozoin at the digestive vacuole membrane in Plasmodium falciparum. Proceedings of the National Academy of Sciences. 109 (28), 11188-11193 (2012).
- Kapishnikov, S., et al. Unraveling heme detoxification in the malaria parasite by in situ correlative X-ray fluorescence microscopy and soft X-ray tomography. Scientific Reports. 7 (1), (2017).
- Sviben, S., et al. A vacuole-like compartment concentrates a disordered calcium phase in a key coccolithophorid alga. Nature Communications. 7, 11228 (2016).
- Wan, W., Briggs, J. A. Cryo-electron tomography and subtomogram averaging. Methods in Enzymology. , 329-367 (2016).
- Zhang, P. Advances in cryo-electron tomography and subtomogram averaging and classification. Current Opinion in Structural Biology. 58, 249-258 (2019).
- Bäuerlein, F. J. B., Baumeister, W. Towards visual proteomics at high resolution. Journal of Molecular Biology. 433 (20), 167187 (2021).
- Elbaum, M., Seifer, S., Houben, L., Wolf, S. G., Rez, P. Toward compositional contrast by cryo-STEM. Accounts of Chemical Research. 54 (19), 3621-3631 (2021).
- Elbaum, M., Wolf, S. G., Houben, L. Cryo-scanning transmission electron tomography of biological cells. MRS Bulletin. 41 (7), 542-548 (2016).
- Wolf, S. G., Houben, L., Elbaum, M. Cryo-scanning transmission electron tomography of vitrified cells. Nature Methods. 11 (4), 423-428 (2014).
- Houben, L., Weissman, H., Wolf, S. G., Rybtchinski, B. A mechanism of ferritin crystallization revealed by cryo-STEM tomography. Nature. 579 (7800), 540-543 (2020).
- Li, Y., Huang, W., Li, Y., Chiu, W., Cui, Y. Opportunities for cryogenic electron microscopy in materials science and nanoscience. ACS Nano. 14 (8), 9263-9276 (2020).
- Hohmann-Marriott, M. F., et al. Nanoscale 3D cellular imaging by axial scanning transmission electron tomography. Nature Methods. 6 (10), 729-731 (2009).
- Engel, A. Scanning transmission electron microscopy: biological applications. Advances in Imaging and Electron Physics. 159, 357-386 (2009).
- Wolf, S. G., Elbaum, M. CryoSTEM tomography in biology. Methods in Cell Biology. 152, 197-215 (2019).
- Biskupek, J., Leschner, J., Walther, P., Kaiser, U. Optimization of STEM tomography acquisition-A comparison of convergent beam and parallel beam STEM tomography. Ultramicroscopy. 110 (9), 1231-1237 (2010).
- Trepout, S., Messaoudi, C., Perrot, S., Bastin, P., Marco, S. Scanning transmission electron microscopy through-focal tilt-series on biological specimens. Micron. 77, 9-15 (2015).
- Rez, P., Larsen, T., Elbaum, M. Exploring the theoretical basis and limitations of cryo-STEM tomography for thick biological specimens. Journal of Structural Biology. 196 (3), 466-478 (2016).
- Mastronarde, D. N. Automated electron microscope tomography using robust prediction of specimen movements. Journal of Structural Biology. 152 (1), 36-51 (2005).
- Schorb, M., Haberbosch, I., Hagen, W. J. H., Schwab, Y., Mastronarde, D. N. Software tools for automated transmission electron microscopy. Nature Methods. 16 (6), 471-477 (2019).
- Sheng, Y., Morris, K., Radecke, J., Zhang, P. Cryo-electron tomography remote data collection and subtomogram averaging. Journal of Visualized Experiments. (185), e63923 (2022).
- Weis, F., Hagen, W. J. H., Schorb, M., Mattei, S. Strategies for optimization of cryogenic electron tomography data acquisition. Journal of Visualized Experiments. (169), e62383 (2021).
- O'Toole, E., vander Heide, P., McIntosh, J. R., Mastronarde, D. Large-scale electron tomography of cells using SerialEM and IMOD. Cellular Imaging: Electron Tomography and Related Techniques. , 95-116 (2018).
- Zheng, S., et al. AreTOMO: An integrated software package for automated marker-free, motion-corrected cryo-electron tomographic alignment and reconstruction. Journal of Structural Biology. (6), 100068 (2022).
- Seifer, S., Elbaum, M. ClusterAlign: A fiducial tracking and tilt series alignment tool for thick sample tomography. Biological Imaging. 2, 7 (2022).
- Waugh, B., et al. Three-dimensional deconvolution processing for STEM cryotomography. Proceedings of the National Academy of Sciences. 117 (44), 27374-27380 (2020).
- Kirchenbuechler, D., et al. Cryo-STEM tomography of intact vitrified fibroblasts. AIMS Biophysics. 2 (3), 259-273 (2015).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Lazić, I., et al. Single-particle cryo-EM structures from iDPC-STEM at near-atomic resolution. Nature Methods. 19 (9), 1126-1136 (2022).
- Seifer, S., Houben, L., Elbaum, M. Flexible STEM with simultaneous phase and depth contrast. Microscopy and Microanalysis. , 1-12 (2021).
- Ophus, C. Four-dimensional scanning transmission electron microscopy (4D-STEM): from scanning nanodiffraction to ptychography and beyond. Microscopy and Microanalysis. 25 (3), 563-582 (2019).
- Zhou, L., et al. Low-dose phase retrieval of biological specimens using cryo-electron ptychography. Nature Communications. 11 (1), 2773 (2020).
- Nellist, P. D. The principles of STEM imaging. Scanning Transmission Electron Microscopy: Imaging and Analysis. , 91-115 (2011).
- Elad, N., Bellapadrona, G., Houben, L., Sagi, I., Elbaum, M. Detection of isolated protein-bound metal ions by single-particle cryo-STEM. Proceedings of the National Academy of Sciences. 114 (42), 11139-11144 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved