Method Article
整个新生儿耳蜗外植体作为 体外 模型
摘要
目前的方案更新了以前的方案,并结合了相对简单的方法来培养高质量的耳蜗外植体。这在活细胞和固定细胞中提供了可靠的数据采集和高分辨率成像。该协议支持研究内耳细胞的持续趋势。
摘要
未经治疗的听力损失会给全球医疗保健系统带来巨大的成本,并损害个人的生活质量。感音神经性耳聋的特征是耳蜗中感觉毛细胞和听觉神经的累积性和不可逆性丧失。整个重要的耳蜗外植体是听力研究的基本工具之一,用于检测毛细胞损失和表征内耳细胞的分子机制。多年前,制定了新生儿耳蜗隔离方案,尽管随着时间的推移进行了修改,但仍有改进的潜力。
本文提出了一种在多孔培养室中分离和培养整个新生儿耳蜗外植体的优化方案,该方案能够研究沿耳蜗整个长度的毛细胞和螺旋神经节神经元细胞。使用来自小鼠和大鼠的耳蜗外植体测试了该协议。获取健康的耳蜗外植体,研究毛细胞、螺旋神经节神经元细胞与周围支持细胞之间的相互作用。
这种方法的主要优点之一是它简化了器官培养步骤,而不会影响外植体的质量。Corti器官的所有三个匝都附着在腔室的底部,这有利于体外实验和外植 体 的综合分析。我们提供了一些来自活体和固定外植体不同实验的耳蜗图像示例,证明外植体尽管暴露于耳毒性药物,但仍保留其结构。这种优化的方案可广泛用于哺乳动物耳蜗的综合分析。
引言
大多数感音神经性耳聋病例是由于感觉毛细胞、听觉神经细胞和/或听觉突触退化所致 1。感觉细胞的这种退行性过程是渐进的,通常是不可逆的,因此导致听力损失2。因此,关于应激条件下感觉细胞的活力和信号通路变化的信息对于保护细胞免受损伤和损失至关重要。对培养物中的耳蜗外植体的研究可以概括组织复合物并维持正常的细胞-细胞网络,从而能够更好地描述信号转导过程。为了建立耳毒性的实验模型,经常使用抗生素庆大霉素和化疗药物顺铂,因为它们已知具有耳毒性副作用3。
随着时间的推移,耳蜗外植体的体外培养系统已经开发和修改;然而,在一些出版物中,通常缺少对整个耳蜗外植体培养的逐步方案的描述。Parker 等人发表了 Corti 小鼠器官原代培养的首批视频方案之一,其中作者描述了分离感觉上皮、在玻璃盖玻片上培养以及用于转染实验的外植体电穿孔的步骤4。先前还发表了另一种使用玻璃盖玻片的方案,其中内耳细胞结构的组织被认为是5。已经报道了使用Millicell膜培养Corti器官和前庭器官的小鼠外植体的替代方案6。这些视频报道为该方法的改进做出了贡献,但仍存在需要解决的挑战。为了解决因使用玻璃盖玻片和插入物而产生的一些问题,本方案旨在简化器官培养步骤并培养高质量的器官以获得可靠的数据。这是通过在实验过程中尽量减少对器官的直接处理并在获得活细胞和固定细胞的高分辨率图像之前避免器官转移来实现的。
本方案更新了先前发表的体外培养系统,并引入了Corti器官分离和转移到培养室的几种优化,以及新载玻片室的集成以改善培养条件和进一步分析。这种优化的方案降低了损坏器官的风险,当在培养基更换期间或从盖玻片或膜转移器官以进行进一步分析时,可能会发生这种情况4,5,6。玻璃盖玻片比塑料盖玻片具有更好的反射指数;然而,它们很脆弱,更容易破裂。这里使用的多孔室连接到显微镜载玻片上,非常适合器官培养和高分辨率成像。分离器官的转移是用刮刀进行的,刮刀允许将器官带入正确的方向并滑入腔室,而不是像以前推荐的那样用移液管施加力 4,5,6。
如前所述,聚-D-赖氨酸包被的多孔室应包含足够的培养基,有助于器官转移和外植体的正确定位,而无需施加粘附压力,同时避免器官重叠6.此外,使用共聚焦 Z 堆栈解决意外的器官重叠和不均匀结构。该方案已针对各种应用进行了优化,例如小鼠和大鼠外植体,Corti和耳蜗器官的外植体,含血清和无血清培养基中的培养,耳毒性评估和一般药物反应实验。人工耳蜗外植体安装在具有盖玻底的腔室中并孵育,这有助于人工蜗外植体粘附到腔室中,以便在体外实验、外植体的后处理以及活体和固定人工蜗外植 体 的成像期间进行最佳处理。Corti器官整个长度的可视化和毛细胞的定量被简化。此外,对支持细胞、螺旋神经节神经元细胞和神经突的评估是准确的。因此,该协议可用于哺乳动物耳蜗细胞的综合分析。
研究方案
所有动物程序均按照瑞士巴塞尔市动物福利委员会的指导方针和规定进行。实验采用出生后C57BL/6JR小鼠、Wistar大鼠和STAT1缺陷小鼠(混合C57BL/6-129/SvEv)7 ,年龄为3-5天,男女不限。
1. 涂覆多孔室
- 准备完整的培养基。
- 对于Corti外植体的器官,制备含有Dulbecco改良Eagle培养基(DMEM),10%胎牛血清(FBS),25mM HEPES和30U / mL青霉素的培养基。
- 对于Corti外植体和耳蜗外植体的器官,制备含有DMEM / F12,1x N 2添加剂,1x B27减去抗氧化剂和30 U / mL青霉素的培养基。
- 通过在层流罩中将 10 mL 细胞培养水加入 5 mg 聚-D-赖氨酸中来制备聚-D-赖氨酸储备溶液。聚-D-赖氨酸的最终浓度为 0.5 mg/mL。
注:将剩余的储备溶液分装,并储存在-20°C。- 通过在无菌水中以1:10稀释储备溶液来制备聚-D-赖氨酸的工作溶液。
- 用 150 μL/孔的聚-D-赖氨酸工作溶液涂覆 8 孔室,并在室温下孵育 30 分钟。
注:如果使用 4 孔室,则涂有 300 μL/孔的聚-D-赖氨酸工作溶液。 - 通过真空或移液吸出溶液。
- 用 200 μL 无菌水洗涤 2 次,用 200 μL 完全培养基或 DMEM 洗涤一次。
- 向每个孔中加入 150 μL 完全培养基。
注:如果使用 4 孔室,则加入 250 μL/孔的完全培养基。 - 在放置外植体之前,将腔室置于37°C和5%CO2 的培养箱中至少30分钟。
2.颞骨解剖
- 用70%乙醇对手术台进行消毒,并在玻璃微球灭菌器中对所有器械进行灭菌。
- 将无菌的60毫米培养皿放在装有冰的桶上。
- 倒入几毫升 1x 磷酸盐缓冲盐水 (PBS),并将其放在冰上。
注:在1x PBS中使用30 U / mL青霉素以避免细菌污染。 - 将无菌垫放在无菌托盘上,然后用手术剪刀快速将幼犬斩首。如果污染是频繁发生的事件,则将头部浸入 70% 乙醇中 5 秒。
注:该协议针对P3-P5岁的小鼠和大鼠进行了测试。耳蜗组织更难从老年小鼠和大鼠身上解剖,并且外植体在培养物中的存活率有限。 - 将动物头放在无菌垫上。移除下颌骨。提起皮肤并将其从头骨上剥开。
- 通过将镊子放入眼眶腔中来握住头骨。
- 沿着矢状缝合线小心地切开颅骨,然后用锋利的手术刀刀片在冠状缝合区域切开,而不会损坏耳蜗。
注意: 避免施加太大的压力,并避免使用手术刀向前和向后移动,因为这可能会损坏耳蜗骨,从而损坏耳蜗管。 - 小心地从两个头骨半部取出大脑。
- 将头骨两半转移到60毫米培养皿中,加入步骤2.3中制备的冰冷PBS。
3.耳蜗的隔离
- 在显微镜下定位颞骨中的耳蜗。将镊子放在上半规管中。
- 使用胰岛素注射器(小鼠)或镊子(大鼠)松开耳蜗和颞骨之间的周围组织。
- 小心地将颞骨从耳蜗上拉开,使耳蜗与颞骨一起连接到前庭。在将颞骨推到一边之前,确保耳蜗没有周围组织。
注意: 用力过大会损坏耳蜗管。 - 将耳蜗固定在固定位置,用另一只手小心地取出软骨耳蜗囊。小心地将镊子的尖端插入顶点区域或转弯之间(可见为白线),然后逐块取出胶囊。暴露耳蜗导管。
- 小心地将镊子放在耳蜗下,并将其与前庭器官和颞骨分离。
- 将耳蜗转移到含有冰冷PBS的新60毫米培养皿中。
- 调整显微镜的放大倍率以更好地观察外植体。
- 按照Corti外植体器官的后续步骤:
- 用镊子将器官固定在底部。用镊子在基钩区域抓住耳蜗管,轻轻地取出耳蜗管。
- 将耳蜗导管从耳蜗上松开,不要撕裂它。
- 小心地去除带有血管纹的螺旋韧带,将器官固定在底部并将它们拉开。
注意:也可以通过保持顶点区域而不是基部区域来实现组织分离。这在解剖大鼠器官或较老的小鼠幼崽(>P5)时可能会有所帮助。 - 将器官固定在底部并将其逐块拉下,小心地去除 Reissner 膜。
注意:这是一个可选步骤,因为 Reissner 膜不会干扰成像的采集。
- 按照耳蜗外植体的后续步骤操作:
- 使用胰岛素注射器(小鼠)或镊子(大鼠)将螺旋神经节从骨螺旋层上分离。
- 在分离过程中轻轻松开modiolus。
注意:外植体可以分成两部分,以便更好地处理。 - 用镊子抓住钩子区域。
- 小心地将其拉下,将其与血管纹一起去除。
- 将器官固定在底部并将其逐块拉下,小心地去除 Reissner 膜。
注意:建议此步骤,因为Reissner膜通常会折叠并覆盖神经元细丝,因此可能会影响实验。
4. 耳蜗外植体培养
- 将外植体从培养皿转移到多孔室。使用实验室刮刀将外植体抬起,毛细胞朝上。包括几微升的 1x PBS,以防止样品粘在刮刀上。
注意:严重受损的外植体会粘在刮刀上。 - 通过在培养基中轻轻挥动刮刀,让外植体从刮刀滑入腔室。在8孔室载玻片的每孔中放置一个外植体。
注意: 如果外植体粘在刮刀上,请将刮刀放在培养基中,然后使用镊子分离外植体。始终将镊子放在外植体的内缘(远离毛细胞)。 - 在显微镜下检查外植体是否以正确的方向转移并放置在孔的中心。
注意:毛细胞朝下的定向不正确的外植体往往会沿其宽度向上显示 U 形。通过将外植体移动到腔室的角落(有更多的培养基可用)并引导它们旋转来纠正它们的方向。 - 使用 100 μL 移液管取出 80 μL 培养基,并将其丢弃。
- 在显微镜下检查毛细胞和螺旋神经节神经元细胞是否可见。如有必要,使用镊子轻轻推开一些重叠的组织。
- 取出剩余的培养基,等待~10秒。
- 将培养基移回。在外植体旁边添加一滴或两滴培养基,并在距离外植体一定距离处添加其余培养基,以防止外植体分离。
注意:即使外植体附着在腔室上,也应始终首先通过在外植体旁边移液一到两滴来添加培养基。这样,当添加剩余的完整培养基时,外植体不会被抬起。 - 将腔室放回培养箱中,孵育2小时,使器官牢固地附着在腔室底部。
- 取出培养基,并使用 100 μL 或 200 μL 移液管小心加入 300 μL 新鲜预热的完全培养基。不要使用 1 mL 移液器。
注:如果需要预处理,在附着 2 小时后,加入 300 μL 含有目标物质的完全培养基。如果使用 4 孔室,则最多使用 500 μL/孔。 - 将腔室放回培养箱。
5. 耳毒性药物的测试
- 将外植体放置过夜以适应培养条件并恢复。
- 准备不同浓度的耳毒性药物,以找到合适的浓度,以建立约50%毛细胞损失的耳毒性模型。庆大霉素使用50μM至250μM,顺铂使用40μM至320μM。新鲜制备顺铂溶液,并避光保存。
- 取出培养基,小心地加入 300 μL 含有所需耳毒性药物的培养基。
- 将外植体与庆大霉素和顺铂在37°C孵育24小时至48小时,以确定毛细胞存活。
注意:药物浓度和暴露时间是根据研究目的选择的。外植体的保存在这里测试长达72小时。如果计划进行长期培养,请勿使用血清。 - 按照下一节对耳蜗细胞进行染色。
6. 固定和免疫荧光
- 在实验结束时弃去培养基,并立即用200μL预热的1x PBS洗涤外植体。
- 用 200 μL 4% 多聚甲醛 (PFA) 在化学通风橱下固定外植体 15 分钟。
注意:PFA 是一种危险化学品;在首次使用 PFA 之前,请阅读材料安全数据表 (MSDS)。 - 用200μL的1x PBS洗涤外植体两次。将外植体储存在4°C的1x PBS中,以防染色程序需要推迟。
- 制备由1x PBS和1%-5%Triton-X100组成的透化溶液。
- 弃去1x PBS,加入200μL透化溶液,并将外植体孵育15分钟。
- 准备封闭液。
- 对于Corti外植体的器官,制备由1x PBS,10%正常山羊血清(NGS,用于山羊二抗,或来自与二抗相同物种的另一种血清)组成的封闭溶液。或者,如果细胞仅用鬼笔环肽染色,则使用 1%-5% 牛血清白蛋白 (BSA)。
- 对于耳蜗外植体,如果使用小鼠一抗(例如,小鼠抗TuJ1)染色螺旋神经节细胞,则制备由1x PBS,10%NGS和Fab片段(Fab片段山羊抗小鼠IgG H + L,稀释度1:200)组成的封闭溶液。
- 加入200μL封闭溶液,将外植体孵育1小时。
- 丢弃封闭溶液。对于与Fab片段一起孵育的外植体,加入200μL的4%PFA,并孵育5分钟。
- 用1x PBS洗涤外植体5分钟。
- 制备由 1x PBS、5% NGS 和 0.1%-0.25% Triton-X100 组成的抗体溶液。
- 稀释抗体溶液中的一抗 MYO7A(ab3481 以 1:500 的稀释度或 MYO7A 138-1 以 1:100 的稀释度)标记毛细胞,稀释 TuJ1 (1:400) 标记螺旋神经节神经元。
注意:如果毛细胞仅用鬼笔环肽标记,则在1x PBS中以1:150稀释鬼笔环肽,在室温下孵育40分钟至1小时,然后继续执行步骤6.22。 - 通过省略一抗,包括二抗非特异性结合的对照。
- 将170μL抗体溶液与一抗一起加入相应的孔中,并在4°C下轻轻摇动(40-60rpm)孵育过夜。
- 用1x PBS洗涤外植体4次,每次5分钟。
- 稀释抗体溶液中的二抗(例如,山羊抗兔 Alexa Fluor 488 或山羊抗小鼠 Alexa Fluor 568 IgG,稀释度为 1:500)。
- 加入170μL抗体溶液和二抗,并在室温下孵育1小时。
注意:从这一步开始,保护外植体免受长时间的光照。 - 用1x PBS洗涤外植体2次,每次5分钟。
- 继续进行下一步,对外植体进行连续双标记。与目标的第二一抗(例如,用于毛细胞的MYO7A)在4°C下轻轻摇动(40-60rpm)孵育过夜。或者,在室温下与鬼笔环肽(1:150)孵育40分钟至1小时,然后继续执行步骤6.22。
注意:如果一抗来自同一宿主物种,则进行顺序标记。最后进行鬼笔环肽标记以进行多重免疫荧光。 - 用1x PBS洗涤外植体4次,每次5分钟。
- 稀释抗体溶液中的二抗(例如,山羊抗兔 Alexa Fluor 488 或山羊抗小鼠 Alexa Fluor 568 IgG,稀释度为 1:500)。
- 加入 170 μL 二抗,并在室温下孵育 1 小时。
- 用1x PBS洗涤外植体2次,每次5分钟。
- 制备1mg / mL的DAPI储备溶液,并储存在-20°C。 以1:10稀释DAPI储备溶液以制备0.1mg / mL的工作溶液,并储存在4°C。
注意: 如果使用含有 DAPI 的安装介质,请跳过步骤 23 并转到步骤 26。 - 在1x PBS中以1:100稀释DAPI工作溶液,并将外植体与200μLDAPI溶液孵育5分钟。
- 用1x PBS洗涤外植体2次,每次5分钟。
- 尽可能多地取出1x PBS,使腔室底部干燥。不要让外植体干燥。
- 等待 2-5 秒,将一滴封固剂直接添加到外植体上。
注意: 由于表面张力,外植体上的安装介质将保持在原位。可以使用硬化安装介质。 - 将腔室储存在 4°C 直至成像。
7. 外植体活细胞的免疫荧光
- 孵育过夜后使用分离的外植体。
- 取出培养基,小心地加入含有 125 μM 顺铂的 300 μL 培养基。
- 将外植体孵育18小时以测量活外植体中的线粒体超氧化物。
- 在药物暴露结束时丢弃培养基。
- 加入 300 μL 渗透性探针以检测细胞 ROS(例如,250 nM 线粒体氢乙胺)和/或 Caspase-3(例如,与核酸结合染料偶联的 2 μM DEVD 肽)。
- 在37°C孵育30分钟。
- 用 200 μL 温热的 Hank 平衡盐溶液 (HBSS) 或适当的缓冲液轻轻洗涤外植体两次。
- 在2小时内用400nm的荧光激发和590nm的发射检测对细胞进行成像。
- 在实验结束时弃去培养基,并立即用200μL预热的1x PBS洗涤外植体。
- 固定外植体,并如上所述对耳蜗细胞进行染色。
8. 共聚焦成像可视化
- 使用配备有转盘共聚焦单元的显微镜或配备点扫描共聚焦单元的共聚焦显微镜对外植体进行成像。
- 使用带有20倍空气物镜(数值孔径:0.75)的旋转盘获取图像以进行细胞计数。或者,使用带有40倍空气物镜(数值孔径:0.95)或100倍油物镜(数值孔径:1.45)的点扫描共聚焦显微镜获取图像,以可视化和计数突触或对立体纤毛进行成像。
注意: 调整每个通道的激光强度和曝光时间,以避免图像饱和度过高和饱和度不足。将相同的设置应用于同一实验的所有外植体。 - 设置显微镜,使用 20 倍空气物镜、z 轴堆叠和自动拼接工具捕获整个耳蜗外植体的 3D 图像。使用3 x 3相邻的田地,15%重叠的小鼠外植体,4 x 4个相邻的田地将大鼠外植体缝合在一起。
- 使用显微镜软件或免费的开源FIJI软件调整图像8.
注意:反卷积是一种图像处理技术,可以应用于共聚焦图像,以提高其对比度和分辨率 9-11。
结果
本方案已在新生小鼠和大鼠的耳蜗上进行了测试。本文展示了来自不同实验的外植体图像。Corti器官的外植体暴露于庆大霉素或顺铂,可见毛细胞损失。Corti器官的外植体在正常和应激条件下都保持其结构和总长度(图1 和 图2)。沿先前暴露于顺铂的大鼠外植体的整个长度的存活毛细胞是可单独检测到的(图1)。除了检测存活的毛细胞外,还检测到发生细胞凋亡的毛细胞(图2)。这种方法有助于存活细胞的可视化和计数,这可以使用深度学习方法执行,如前所述12。还可以使用适当的细胞渗透性探针检测活耳蜗细胞中的生物过程(图3)。
在含有螺旋神经节神经元的耳蜗外植体的情况下,可以将外植体切成两部分,也可以切掉顶端区域以提供更好的培养条件。在这里,我们选择分离顶点区域,因为它在应力条件下受到的影响较小。图 4 显示了耳蜗外植体的基部和内侧区域。检测用毛细胞标记物MYO7A标记的毛细胞。同样,鉴定了健康和受损的螺旋神经节细胞体和用神经元标志物 TuJ1 标记的神经突。螺旋神经节区域的分析可以手动执行,也可以使用开源软件(例如带有 NeuronJ 插件的 FIJI)进行神经突追踪13 或扩展(如 TrackMate 和 Cellpose)进行形态分割14,15。对小鼠外植体的仔细检查揭示了耳蜗细胞和毛细胞立体纤毛的高分辨率(图5)。
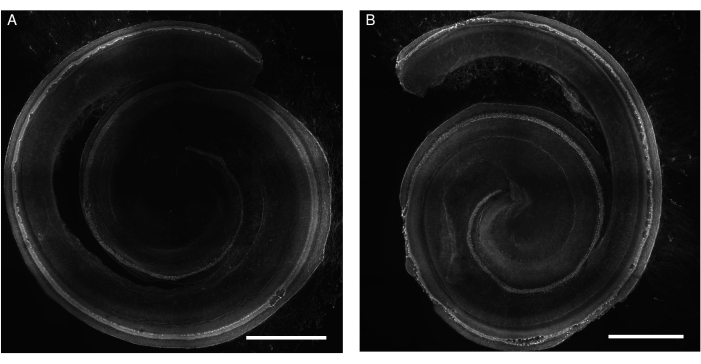
图1:暴露于庆大霉素的大鼠Corti器官的外植体。 (A)对照和(B)庆大霉素暴露(200μM,24小时)外植体的代表性图像(最大强度投影)。毛细胞用鬼笔环肽标记,可以沿着耳蜗的整个长度可视化。为了更好地说明,图像为灰色调。使用带有20倍物镜(数值孔径:0.75)的转盘共聚焦显微镜获取图像。比例尺 = 500 μm。 请点击这里查看此图的较大版本.
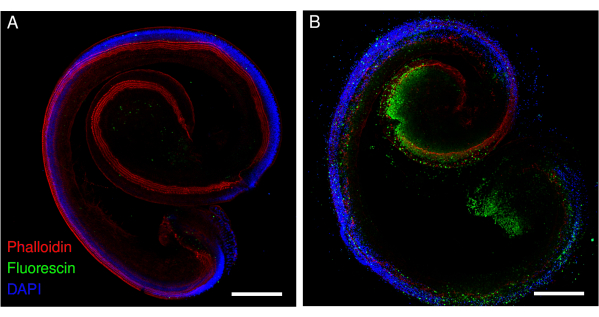
图2:暴露于顺铂的小鼠的Corti器官外植体。 (A)对照和(B)顺铂暴露(160μM,48小时)外植体的代表性图像(最大强度投影)。用鬼笔环肽(红色)标记毛细胞,用荧光素标记凋亡毛细胞。使用点扫描共聚焦显微镜和20倍物镜(数值孔径:0.75)获取图像。比例尺 = 200 μm. 请点击这里查看此图的较大版本.
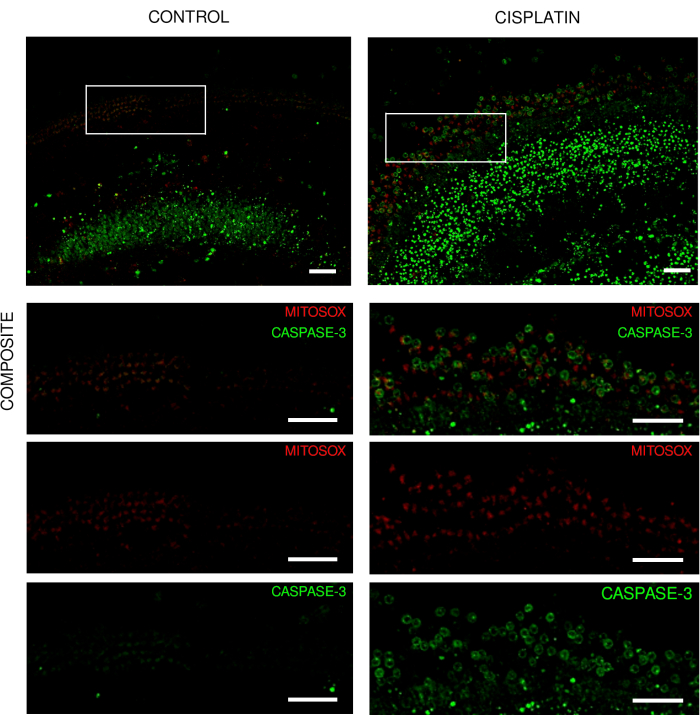
图 3:来自实时成像实验的 Corti 器官外植体。 来自野生型小鼠的外植体的代表性图像(最大强度投影)显示(A)对照外植体和(B)外植体暴露于125μM顺铂18小时。用线粒体氢乙啶和半胱天冬酶-3标记毛细胞。使用转盘共聚焦显微镜和20倍物镜(数值孔径:0.75)采集图像。比例尺 = 50 μm. 请点击这里查看此图的较大版本.
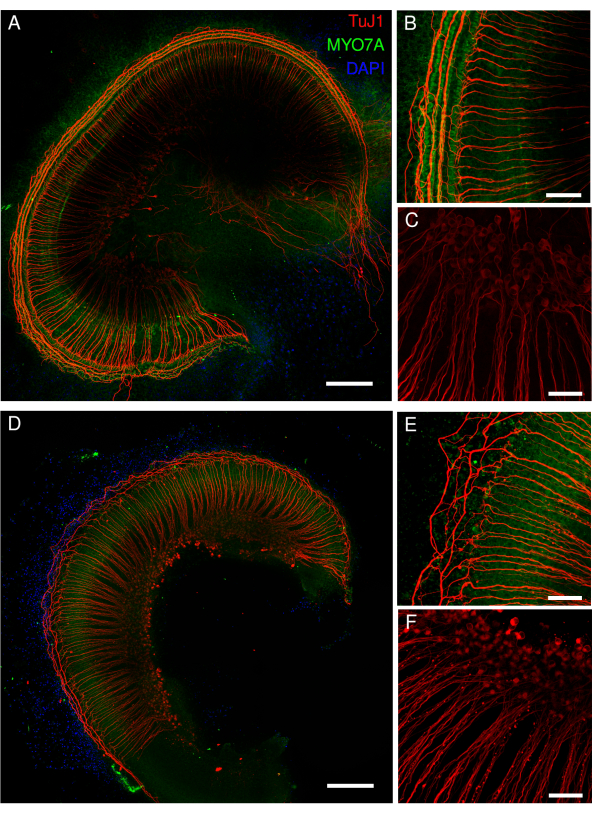
图 4:暴露于顺铂的 STAT1 敲除小鼠的耳蜗外植体。(A)对照外植体和(D)外植体暴露于40μM顺铂48小时的代表性图像(最大强度投影)。毛细胞体用MYO7A抗体(绿色)标记,螺旋神经节细胞用TuJ1抗体(红色)和DAPI核标记(蓝色)标记。使用点扫描共聚焦显微镜和 20 倍物镜(数值孔径:0.75)和额外的 2.15 倍变焦(B、C、E、F)采集图像。比例尺 = (B,C,E,F) 50 μm 和 (A,D) 200 μm。 请点击这里查看此图的较大版本.
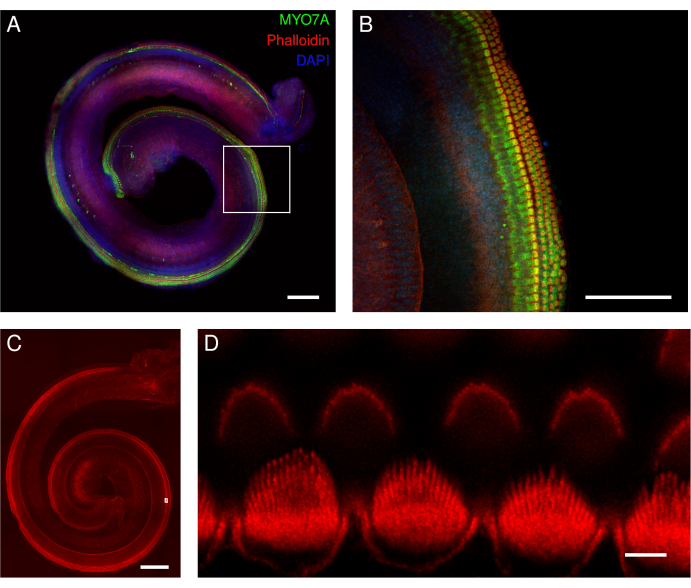
图 5:Corti 外植体的小鼠器官。 (A-D)野生型小鼠全长外植体的代表性图像(最大强度投影)。(甲,乙)外植体用MYO7A抗体、鬼笔环肽和DAPI核标记标记。(B)在放大的概述中,用MYO7A抗体(绿色)标记的毛细胞的细胞体清晰可见。(C,D)鬼笔环肽标记毛细胞的立体纤毛和角质层板。外植体用鬼笔环肽标记。(D)在放大的概述中,单个内毛细胞立体纤毛的去卷积图像被很好地识别(下行),而单个外毛细胞立体纤毛则更难描绘(上行)。图A和图C中的图像是用带有20倍物镜(数值孔径:0.75)的转盘共聚焦显微镜采集的。图B中的图像是用相同的显微镜拍摄的,但使用40倍空气物镜(数值孔径:0.95)。图D中的图像是用点扫描共聚焦显微镜和100倍油物镜(数值孔径:1.45)和另外3.46倍变焦拍摄的。每个XY切片平均扫描4次,像素尺寸为0.02 μm。比例尺 = (D) 3 μm、(B) 100 μm 和 (A,C) 200 μm。 请点击这里查看此图的较大版本.
讨论
更新该协议的目的是简化从外植体分离到活耳蜗和固定耳蜗细胞成像的步骤。我们改进了分离过程中的一些步骤,并引入了一些创新工具,旨在建立一个高效且平稳运行的方案,以获得高质量的外植体。所描述的方法是先前报告4,5的优化方案。此外,目前的一些研究缺乏逐步更新的方案。通过简化的外植体培养步骤,该方案提供了保存完好的外植体的轻松处理,这对于可重复的数据至关重要。引入带有聚合物盖玻片的多孔腔室用于内耳外植体,改善了器官附着和完整外植体的保存。在这里,我们提出了几个在应激条件下的实验示例,以证明尽管毛细胞丢失和神经突受损,但培养中的器官仍保持其细胞组织。
培养内耳器官的挑战之一是避免器官的分离和漂浮,因为这会影响外植体的完整性、对治疗的反应以及随后的检查。以前,外植体在玻璃盖玻片上培养 4,5。虽然在玻璃表面进行培养似乎是一个不错的选择,但对玻璃进行涂层非常耗时,而且盖玻片本身易碎且脆弱。使用Millicell细胞培养插入物的替代方案试图解决这个问题6。然而,用外植体切割和转移膜似乎是该协议中的一个微妙步骤。此外,在盖玻片的安装和密封过程中,外植体可能会损坏。在我们提出的方法中,一旦将外植体转移到聚-D-赖氨酸包被的腔室中并放置在正确的位置,就不需要进一步的转移或用盖玻片覆盖。该协议的另一个优点是使用具有薄透气性聚合物盖玻片的腔室,为器官外植体提供最佳培养条件。这种聚合物具有与玻璃相似的光学质量,因此适用于高分辨率显微镜中的细胞成像。
在培养基中加入血清用于细胞和组织培养的大多数方案,包括用 1%-10% FBS4、5、6、16 培养内耳外植体。血清的存在会影响实验的培养条件;因此,在某些情况下,首选不含血清的培养。耳蜗外植体培养物中血清的缺失被添加到DMEM中或通过将N2添加到Neurobasal-A培养基中5,6来代替。在这方面,我们测试了有和没有血清的外植体的培养条件。在这两种情况下,内耳细胞都至关重要,并且对耳毒性条件有反应。我们对这些条件进行了72小时的测试,但外植体可以在培养物中维持更长时间,特别是当与其他研究建议的无血清培养基以及N2,B27和生长因子一起孵育时5,16。
除了分离内耳外植体的一般关键步骤外,例如器官分离的持续时间和使用的抗生素,该协议中还有一些关键步骤,但这些步骤是可控的。该方法的关键步骤之一与插入器官后残留在腔室中的培养基体积有关。这已经过优化,以保持外植体的活力并附着在底面上。另一个关键步骤与允许外植体附着在腔室底部所需的孵育时间有关。用几微升培养基孵育超过2小时可能会影响外植体的健康。也可以使用较短的孵育时间,例如1小时,只要注意不要分离外植体即可。另一个重要方面是聚-D-赖氨酸的残基。应严格遵循聚-D-赖氨酸的洗涤步骤,因为聚-D-赖氨酸的溴化物盐残留物可能对细胞有毒。在精确地遵循洗涤步骤后,涂有聚-D-赖氨酸的涂层有助于外植体顺利粘附到腔室上,以便在它们牢固地附着在腔室底部之前纠正位置。
这种方法的局限性之一是使用正置显微镜对细胞进行成像。对于那些使用倒置显微镜的实验室来说,这可能是一个重要问题。带有可拆卸硅胶室的载玻片可用于正置和倒置显微镜;然而,我们需要首先测试聚-D-赖氨酸的包衣条件。另一个限制是腔室的存储,因为插入物不可拆卸,与标准显微镜载玻片的 1 mm 高度相比,一个带盖的腔室的总高度接近 11 mm。然而,8 孔室比16 之前建议的 4 孔板使用更少的空间。
我们在这里展示用两台显微镜采集的图像。点扫描共聚焦显微镜由于其光学截面较薄,可提供高分辨率的组织图像,而转盘共聚焦显微镜则提供更快的成像时间和良好的分辨率。使用共聚焦显微镜观察内毛细胞 (IHC) 和外毛细胞 (OHC) 的立体纤毛。由于 IHC 的立体纤毛比 OHC 的立体纤毛大,因此在这项工作中反复且很好地可视化了它们。对于OHC立体纤毛,其他替代显微镜可以改善可视化,例如超分辨率显微镜(SRM)。使用转盘显微镜获取的外植体图像足以使用深度学习方法轻松集成自动毛细胞计数12。此外,较短的采集时间对于活细胞和组织的实验也很重要。此外,该方案不仅限于新生儿耳蜗外植体。通过一些优化,也可以培养其他外植体,如前庭器官或胚胎组织。
耳蜗细胞(如毛细胞和神经元) 的体外 定量对于评估细胞活力以及受损或丢失细胞的百分比非常重要。对信号通路和细胞功能的研究有助于揭示死亡和存活的机制。胚胎和新生儿耳蜗组织的检查有助于研究耳蜗的发育阶段。因此,该协议将有助于优化内耳外植体的 体外 研究,例如,建立耳毒性模型,研究发育阶段,评估信号通路和进行药物筛选研究。
披露声明
作者没有要披露的利益冲突。
致谢
我们要感谢巴塞尔大学生物医学系动物设施在动物护理方面的支持,显微镜核心设施以及生物医学系信息技术服务的技术援助,以及瑞士国家科学基金会 (SNSF) 的财政支持(医学博士奖学金给 M.C., 授权号323530_191222)。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL High-Clarity Polypropylene Conical Tube 17 x 120 mm style | FALCON | 352096 | |
| 45° Angled Forceps | Fine Science Tools | 11251-35 | |
| 50 mL Polypropylene Conical Tube 30 x 115 mm style | FALCON | 352070 | |
| Antifade Mounting Medium | VECTASHIELD | H-1000 | |
| Alexa Fluor 568 phalloidin | Thermofisher | 2151755 | |
| Anti-beta III Tubulin antibody [TUJ-1] | Abcam | ab14545 | |
| Antifade Mounting Medium With DAPI | VECTASHIELD | H-1200 | |
| Anti-myosin VII rabbit polyclonal | Abcam | ab3481 | |
| B-27 Supplement (50x), minus antioxidants | Thermofisher | 10889038 | |
| CARBON STEEL surgical blades 23 | Swann Moiton | 210 | |
| CellEvent™ Caspase-3/7 Green Detection Reagent | Thermofisher | C10723 | |
| DMEM/F-12/(1:1)(1x) + GlutaMAX | Thermofisher | 31331028 | |
| Double spatulas, one curved end | VWR | RSGA038.150 | |
| Ethyl alcohol 70% V/V 1,000 mL | bichsel | 160 0 106 00 | |
| Fetal Bovine Serum, certified | Thermofisher | 16000036 | |
| Fixative Solution 4% paraformaldehyde prepared in PBS | Thermofisher | 201255309/201255305 | |
| High Intensity Cold Halogen Light Source | Intralux® | 5100 | |
| Huygens Professional version 21.10 | Scientific Volume Imaging | ||
| ibidi µ-Slide 8 well | ibidi | 80826 | |
| microscope | LEICA | M80 | |
| microscope | LEICA | MS5 | |
| MitoSOX™ Red Mitochondrial Superoxide Indicator, for live-cell imaging | Thermofisher | M36008 | |
| N2 supplement (100x) | Thermofisher | 17502048 | |
| Nikon Eclipse Ti microscope with a Yokogawa CSU-W1 spinning disk confocal unit, and a Photometrics Prime 95B camera. | NIKON | ||
| Nikon Eclipse Ti microscope with an A1 point-scanning confocal unit | NIKON | ||
| Operating scissors | Fine Science Tools | 14005-16 | |
| Operating scissors | Fine Science Tools | 14088-10 | |
| Operating tweezers | Fine Science Tools | 11008-15 | |
| PBS pH 7.2 (1x), 500mL | Thermofisher | 20012-019 | |
| Penicillin | Sigma-Aldrich | P3032 | |
| POLY-D-LYSINE HYDROBROMIDE MOL WT GT 30 | Sigma-Aldrich | P7405 | |
| Scalpel Handle #4 | Fine Science Tools | 10004-13 | |
| Steri 250 Second sterilizer | Simon Keller AG | 031100 | |
| Sterilizer, desiccant pellets | Simon Keller AG | 31120 | |
| Tissue Culture Dish 60 x 15 mm | FALCON | 353802 | |
| Tissue Culture Dish 60 x 15 mm | FALCON | 353004 | |
| Trito X-100 | Sigma | T9284 | |
| Unconventional myosin-VIIa | Developmental Studies Hybridoma Bank | 138-1s | |
| WFI for Cell Culture[-]Antimicrobial, 500 mL | Thermofisher | A12873-01 |
参考文献
- Mukherjea, D., et al. The design and screening of drugs to prevent acquired sensorineural hearing loss. Expert Opinion on Drug Discovery. 6 (5), 491-505 (2011).
- Takeda, H., Dondzillo, A., Randall, J. A., Gubbels, S. P. Challenges in cell-based therapies for the treatment of hearing loss. Trends in Neurosciences. 41 (11), 823-837 (2018).
- Schacht, J., Talaska, A. E., Rybak, L. P. Cisplatin and aminoglycoside antibiotics: Hearing loss and its prevention. The Anatomical Record. 295 (11), 1837-1850 (2012).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Durbin, J. E., Hackenmiller, R., Simon, M. C., Levy, D. E. Targeted disruption of the mouse Stat1 gene results in compromised innate immunity to viral disease. Cell. 84 (3), 443-450 (1996).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Etournay, R., et al. Cochlear outer hair cells undergo an apical circumference remodeling constrained by the hair bundle shape. Development. 137 (8), 1373-1383 (2010).
- MacDonald, G. H., Rubel, E. W. Three-dimensional imaging of the intact mouse cochlea by fluorescent laser scanning confocal microscopy. Hearing Research. 243 (1-2), 1-10 (2008).
- Sibarita, J. B. Deconvolution microscopy. Advances in Biochemical Engineering/Biotechnology. 95, 201-243 (2005).
- Cortada, M., Sauteur, L., Lanz, M., Levano, S., Bodmer, D. A deep learning approach to quantify auditory hair cells. Hearing Research. 409, 108317 (2021).
- Meijering, E., et al. Design and validation of a tool for neurite tracing and analysis in fluorescence microscopy images. Cytometry A. 58 (2), 167-176 (2004).
- Ershov, D., et al. TrackMate 7: Integrating state-of-the-art segmentation algorithms into tracking pipelines. Nature Methods. 19 (7), 829-832 (2022).
- Stringer, C., Wang, T., Michaelos, M., Pachitariu, M. Cellpose: A generalist algorithm for cellular segmentation. Nature Methods. 18 (1), 100-106 (2021).
- Zhang, L. W., Cang, X. H., Chen, Y., Guan, M. X. In vitro culture of mammalian inner ear hair cells. Journal of Zhejiang University of Science B. 20 (2), 170-179 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。