Method Article
İn vitro Model Olarak Tüm Yenidoğan Koklear Eksplantları
Bu Makalede
Özet
Mevcut protokol, önceki protokolleri güncellemekte ve yüksek kaliteli koklear eksplantların kültürlenmesi için nispeten basit yaklaşımlar içermektedir. Bu, canlı ve sabit hücrelerde güvenilir veri toplama ve yüksek çözünürlüklü görüntüleme sağlar. Bu protokol, iç kulak hücrelerini incelemeye yönelik devam eden eğilimi desteklemektedir.
Özet
Tedavi edilmeyen işitme kaybı, küresel sağlık sistemine önemli maliyetler getirmekte ve bireylerin yaşam kalitesini bozmaktadır. Sensörinöral işitme kaybı, kokleadaki duyusal tüy hücrelerinin ve işitme sinirlerinin kümülatif ve geri dönüşümsüz kaybı ile karakterizedir. Tüm ve hayati koklear eksplantlar, tüylü hücre kaybını tespit etmek ve iç kulak hücrelerinin moleküler mekanizmalarını karakterize etmek için işitme araştırmalarında temel araçlardan biridir. Yıllar önce, yenidoğan koklear izolasyonu için bir protokol geliştirildi ve zaman içinde değiştirilmiş olmasına rağmen, hala iyileştirme potansiyeline sahiptir.
Bu makale, kokleanın tüm uzunluğu boyunca tüy hücrelerinin ve spiral ganglion nöron hücrelerinin incelenmesini sağlayan çok kuyulu kültür odalarında tüm neonatal koklear eksplantların izole edilmesi ve kültürlenmesi için optimize edilmiş bir protokol sunmaktadır. Protokol, farelerden ve sıçanlardan alınan koklear eksplantlar kullanılarak test edildi. Tüy hücreleri, spiral ganglion nöron hücreleri ve çevresindeki destek hücreler arasındaki etkileşimi incelemek için sağlıklı koklear eksplantlar elde edildi.
Bu yöntemin temel avantajlarından biri, eksplantların kalitesinden ödün vermeden organ kültürü adımlarını basitleştirmesidir. Corti organının üç dönüşü de odanın dibine tutturulmuştur, bu da in vitro deneyleri ve eksplantların kapsamlı analizini kolaylaştırır. Canlı ve sabit eksplantlarla yapılan farklı deneylerden elde edilen koklear görüntülerin bazı örneklerini sunuyoruz ve eksplantların ototoksik ilaçlara maruz kalmasına rağmen yapılarını koruduğunu gösteriyoruz. Bu optimize edilmiş protokol, memeli kokleasının bütünleştirici analizi için yaygın olarak kullanılabilir.
Giriş
Sensörinöral işitme kaybı vakalarının çoğu, duyusal tüy hücrelerinin, işitsel sinir hücrelerinin ve/veya işitsel sinapsların dejenerasyonundan kaynaklanır1. Duyu hücrelerindeki bu dejeneratif süreç ilerleyicidir ve genellikle geri döndürülemez, bu nedenle işitme kaybına neden olur2. Bu nedenle, duyusal hücrelerin canlılığı ve stres koşulları altında sinyal yollarındaki değişiklikler hakkındaki bilgiler, hücreleri hasardan ve dolayısıyla kayıptan korumak için çok önemlidir. Kültürde koklear eksplantların araştırılması, doku kompleksinin rekapitülasyonuna ve normal bir hücre-hücre ağının korunmasına izin verir, bu da sinyalleme süreçlerinin daha iyi tanımlanmasını sağlar. Deneysel ototoksisite modelleri oluşturmak için, antibiyotik gentamisin ve kemoterapötik ajan sisplatin sıklıkla kullanılmıştır, çünkü ototoksik yan etkileri olduğu bilinmektedir3.
Koklear eksplantların in vitro kültür sistemleri zaman içinde geliştirilmiş ve modifiye edilmiştir; Bununla birlikte, tüm koklear eksplantların kültürü için aşamalı protokolün bir açıklaması genellikle bazı yayınlarda eksiktir. Corti'nin murin organının birincil kültürü için ilk video protokollerinden biri, yazarların duyusal epitelin izolasyonu, cam lameller üzerinde kültürleme ve transfeksiyon deneyleri için eksplantların elektroporasyonu için adımları tanımladığıParker ve ark. tarafından yayınlandı 4. İç kulaktaki hücresel yapının organizasyonunun kabul edildiği cam lamellerin kullanıldığı başka bir protokol de daha önce yayınlanmıştı5. Corti organı ve vestibüler organın fare eksplantlarının kültürü için Millicell membranı kullanan alternatif bir protokol bildirilmiştir6. Bu video raporları, yöntemin geliştirilmesine katkıda bulunmuştur, ancak hala çözülmesi gereken zorluklar vardır. Cam lamellerin ve eklerin kullanımından kaynaklanan bir dizi sorunu ele almak için mevcut protokol, organ kültürü adımlarını kolaylaştırmayı ve güvenilir veriler için yüksek kaliteli organları kültürlemeyi amaçlamaktadır. Bu, deneysel prosedürler sırasında organın doğrudan elleçlenmesini en aza indirerek ve canlı ve sabit hücrelerin yüksek çözünürlüklü görüntülerini elde etmeden önce organ transferinden kaçınarak elde edilir.
Mevcut protokol, daha önce yayınlanmış in vitro kültür sistemlerini güncellemekte ve Corti organının izolasyonunda ve kültür odalarına transferde çeşitli optimizasyonların yanı sıra kültür koşullarını ve daha fazla analizi iyileştirmek için yeni bir slayt odasının entegrasyonunu sunmaktadır. Bu optimize edilmiş protokol, ortam değişimi sırasında cam lameller kullanıldığında veya organın daha ileri analiz için lamellerden veya membranlardan transferi sırasında ortaya çıkabilecek organa zarar verme riskini azaltır 4,5,6. Cam lameller, plastik olanlardan daha iyi bir yansıtıcı indekse sahiptir; Ancak kırılgandırlar ve daha kolay kırılabilirler. Burada kullanılan çok kuyulu odalar, organ kültürü ve yüksek çözünürlüklü görüntüleme için çok uygun olan bir mikroskop lamına tutturulmuştur. İzole edilen organların transferi, daha önce önerildiği gibi pipetle kuvvet uygulamak yerine, organın doğru yöne getirilmesini ve hazneye kaydırılmasını sağlayan bir spatula ile gerçekleştirilir 4,5,6.
Yeterli ortam içermesi gereken poli-D-lizin kaplı çok kuyulu odalar, daha önce belirtildiği gibi, yapışkan basınç uygulamadan ve organ üst üste binmesini önlerken, organ transferini ve eksplantların uygun şekilde konumlandırılmasını kolaylaştırır6. Ek olarak, kazara organ örtüşmesi ve düzensiz yapılar, konfokal bir Z-yığını kullanılarak çözülür. Bu protokol, fare ve sıçan eksplantları, Corti ve koklea organının eksplantları, serum içeren ve serumsuz ortamda kültür, ototoksik değerlendirmeler ve genel ilaç yanıtı deneyleri gibi çeşitli uygulamalar için optimize edilmiştir. Koklear eksplantlar, in vitro deneyler sırasında optimum kullanım için koklear eksplantların odacıklara yapışmasını kolaylaştıran, canlı ve sabit koklear eksplantların görüntülenmesi için lamel tabanlı kabinlere monte edilir ve inkübe edilir. Corti organının tüm uzunluğunun görselleştirilmesi ve saç hücrelerinin miktarının belirlenmesi kolaylaştırılmıştır. Ek olarak, destekleyici hücrelerin, spiral ganglion nöron hücrelerinin ve nöritlerin değerlendirmeleri doğrudur. Bu nedenle, bu protokol memeli koklear hücrelerinin kapsamlı bir analizi için kullanılabilir.
Protokol
Tüm hayvan prosedürleri, İsviçre'nin Basel Kantonu Şehri Hayvan Refahı Komitesi'nin yönergelerine ve düzenlemelerine uygun olarak gerçekleştirildi. Deneyler için doğum sonrası C57BL / 6JR fareleri, Wistar sıçanları ve STAT1 eksikliği olan fareler (karışık C57BL / 6-129 / SvEv)7 3-5 günlük ve her iki cinsiyetten kullanıldı.
1. Çok kuyulu odaların kaplanması
- Komple kültür ortamı hazırlayın.
- Corti eksplantlarının organı için, Dulbecco'nun Modifiye Kartal Ortamı (DMEM),% 10 fetal sığır serumu (FBS), 25 mM HEPES ve 30 U / mL penisilin içeren ortam hazırlayın.
- Corti eksplantları ve koklear eksplantların organı için DMEM/F12, 1x N2 takviyesi, 1x B27 eksi antioksidanlar ve 30 U/mL penisilin içeren bir besiyeri hazırlayın.
- Bir laminer başlıkta 5 mg poli-D-lizine 10 mL hücre kültürü suyu ekleyerek bir poli-D-lizin stok çözeltisi hazırlayın. Poli-D-lizinin nihai konsantrasyonu 0.5 mg / mL'dir.
NOT: Kalan stok çözeltisini ayırın ve −20 °C'de saklayın.- Stok çözeltisini steril suda 1:10 oranında seyrelterek poli-D-lizin çalışma çözeltilerini hazırlayın.
- 8 oyuklu bir odayı 150 μL / oyuklu poli-D-lizin çalışma çözeltisi ile kaplayın ve oda sıcaklığında 30 dakika inkübe edin.
NOT: 4 oyuklu bir oda kullanılıyorsa, 300 μL/kuyucuklu poli-D-lizin çalışma solüsyonu ile kaplayın. - Çözeltiyi vakum veya pipetleme ile aspire edin.
- 2 kez 200 μL steril su ile ve bir kez 200 μL tam kültür ortamı veya DMEM ile yıkayın.
- Her oyuğa 150 μL tam kültür ortamı ekleyin.
NOT: 4 oyuklu bir oda kullanılıyorsa, 250 μL/kuyucuklu tam kültür ortamı ekleyin. - Bir eksplant yerleştirmeden önce hazneyi en az 30 dakika boyunca 37 °C ve% 5CO2'de inkübatöre yerleştirin.
2. Temporal kemiğin diseksiyonu
- Ameliyat masasını% 70 etanol ile dezenfekte edin ve tüm aletleri bir cam mikroküre sterilizatöründe sterilize edin.
- Buz içeren bir kovaya steril bir 60 mm Petri kabı yerleştirin.
- Birkaç mililitre 1x fosfat tamponlu salin (PBS) dökün ve buz üzerinde tutun.
NOT: Bakteriyel kontaminasyonu önlemek için 1x PBS'de 30 U/mL penisilin kullanın. - Steril bir tepsiye steril bir ped yerleştirin ve yavru hayvanın kafasını ameliyat makasıyla hızlı bir şekilde ayırın. Kirlenme sık görülen bir olaysa, kafayı 5 saniye boyunca %70 etanole batırın.
NOT: Bu protokol P3-P5 yaşlarındaki fareler ve sıçanlar için test edilmiştir. Koklear dokuların yaşlı farelerden ve sıçanlardan ayrılması daha zordur ve kültürde eksplantların hayatta kalması sınırlıdır. - Hayvan kafasını steril bir ped üzerine yerleştirin. Mandibulayı çıkarın. Cildi kaldırın ve kafatasından geri soyun.
- Forsepsleri yörünge boşluklarına yerleştirerek kafatasını tutun.
- Kafatasını sagital sütür boyunca dikkatlice kesin ve ardından kokleaya zarar vermeden keskin bir neşter bıçağı ile koronal sütür bölgesinde kesin.
NOT: Koklear kemiğe ve dolayısıyla koklear kanala zarar verebileceğinden çok fazla basınç uygulamaktan kaçının ve neşterle ileri ve geri hareketlerden kaçının. - Beyni iki kafatası yarısından dikkatlice çıkarın.
- Kafatası yarımlarını, adım 2.3'te hazırlanan buz gibi PBS ile 60 mm'lik bir Petri kabına aktarın.
3. Koklea izolasyonu
- Mikroskop altında temporal kemikteki kokleayı lokalize edin. Forsepsleri üstün yarım daire kanalına yerleştirin.
- Bir insülin şırıngası (fareler) veya forseps (sıçanlar) kullanarak koklea ve temporal kemik arasındaki çevre dokuyu gevşetin.
- Temporal kemiği dikkatlice kokleadan uzaklaştırın, kokleayı temporal kemikle birlikte girişe bağlı tutun. Temporal kemiği bir kenara itmeden önce kokleanın çevre dokudan arınmış olduğundan emin olun.
NOT: Çok fazla kuvvet uygulamak koklear kanala zarar verir. - Kokleayı sabit bir pozisyonda tutun ve diğer elinizle kıkırdaklı koklear kapsülü dikkatlice çıkarın. Forsepsin uçlarını apeks bölgesine veya dönüşler arasına (beyaz bir çizgi olarak görünür) dikkatlice yerleştirin ve kapsülü parça parça çıkarın. Koklear kanalı açığa çıkarın.
- Forsepsleri dikkatlice kokleanın altına yerleştirin ve vestibüler organdan ve temporal kemikten ayırın.
- Kokleayı buz gibi PBS içeren 60 mm'lik yeni bir kaba aktarın.
- Eksplantları daha iyi görselleştirmek için mikroskobun büyütme oranını ayarlayın.
- Corti eksplantlarının organı için sonraki adımları izleyin:
- Organı forseps ile tabanda tutun. Koklear kanalı bazal kanca bölgesinden forseps ile tutarak nazikçe çıkarın.
- Koklear kanalı yırtmadan modiolustan gevşetin.
- Organı tabandan tutarak ve çekerek stria vaskularis ile spiral bağı dikkatlice çıkarın.
NOT: Doku ayrımı, taban bölgesi yerine apeks bölgesi tutularak da sağlanabilir. Bu, sıçan organlarını veya daha yaşlı fare yavrularını (>P5) incelerken yardımcı olabilir. - Organı tabandan tutarak ve parça parça çekerek Reissner zarını dikkatlice çıkarın.
NOT: Reissner membranı görüntülemenin alınmasını engellemediği için bu isteğe bağlı bir adımdır.
- Koklear eksplantlar için sonraki adımları izleyin:
- Bir insülin şırıngası (fareler) veya forseps (sıçanlar) kullanarak spiral ganglionu kemik spiral laminadan ayırın.
- Ayırma sırasında modiolusu yavaşça gevşetin.
NOT: Eksplantlar daha iyi kullanım için iki parçaya bölünebilir. - Kanca bölgesini forseps ile kavrayın.
- Stria vaskülaris ile spiral bağı çekerek dikkatlice çıkarın.
- Organı tabandan tutarak ve parça parça çekerek Reissner zarını dikkatlice çıkarın.
NOT: Bu adım önerilir, çünkü Reissner zarı genellikle nöron filamentlerini katlar ve kaplar ve bu nedenle deneyleri etkileyebilir.
4. Koklear eksplantların kültürü
- Eksplantları Petri kabından çok kuyulu odalara aktarın. Bir laboratuvar spatulası kullanarak saç hücreleri yukarı bakacak şekilde eksplantları kaldırın. Numunelerin spatulaya yapışmasını önlemek için birkaç mikrolitre 1x PBS ekleyin.
NOT: Ciddi şekilde hasar görmüş eksplantlar spatulaya yapışacaktır. - Spatulayı ortamda hafifçe sallayarak eksplantların spatuladan hazneye kaymasına izin verin. 8 oyuklu bir oda slaytının kuyucuğuna bir eksplant yerleştirin.
NOT: Eksplant spatulaya yapışırsa, spatulayı ortamda tutun ve eksplantları ayırmak için forseps kullanın. Forsepsleri her zaman eksplantın iç sınırına (saç hücrelerinden uzağa) yerleştirin. - Mikroskop altında, eksplantların doğru yönde aktarıldığını ve kuyuların ortasına yerleştirildiğini kontrol edin.
NOT: Saç hücreleri aşağı bakacak şekilde yanlış yönlendirilmiş eksplantlar, genişlikleri boyunca yukarı doğru U şekli gösterme eğilimindedir. Eksplantları odaların köşelerine hareket ettirerek yönlerini düzeltin (daha fazla ortam mevcuttur) ve döndürmeye yönlendirin. - 100 μL'lik bir pipet kullanarak ortamın 80 μL'sini çıkarın ve atın.
- Saç hücrelerinin ve spiral ganglion nöron hücrelerinin görünür olup olmadığını mikroskop altında kontrol edin. Gerekirse, üst üste binen bazı dokuları nazikçe ayırmak için forseps kullanın.
- Ortamın geri kalanını çıkarın ve ~10 saniye bekleyin.
- Ortamı geri pipetleyin. Eksplantın ayrılmasını önlemek için eksplantın yanına bir veya iki damla ortam ve ortamın geri kalanını eksplanttan biraz uzakta ekleyin.
NOT: Eksplantlar haznelere tutturulmuş olsa bile, ortam her zaman önce eksplantların yanına bir ila iki damla pipetlenerek eklenmelidir. Bu şekilde, kalan tam ortam eklendiğinde eksplantlar kaldırılmayacaktır. - Odayı inkübatöre geri koyun ve organların haznenin dibine sıkıca yapışmasını sağlamak için 2 saat inkübe edin.
- Ortamı çıkarın ve 100 μL veya 200 μL'lik bir pipet kullanarak dikkatlice 300 μL taze önceden ısıtılmış tam ortam ekleyin. 1 mL'lik pipet kullanmayın.
NOT: Bir ön işlem isteniyorsa, 2 saatlik bağlantıdan sonra, ilgilenilen maddeyi içeren 300 μL tam ortam ekleyin. 4 oyuklu bir oda kullanılıyorsa, 500 μL/kuyuya kadar kullanın. - Odaları inkübatöre geri koyun.
5. Ototoksik ajanların testi
- Kültür koşullarına uyum sağlamak ve iyileşmek için eksplantları gece boyunca bırakın.
- Yaklaşık% 50 saç hücresi kaybı olan bir ototoksik model oluşturmak için uygun konsantrasyonu bulmak için farklı konsantrasyonlarda ototoksik ajanlar hazırlayın. Gentamisin için 50 μM ile 250 μM arasında ve sisplatin için 40 μM ile 320 μM arasında kullanın. Sisplatin çözeltilerini taze hazırlayın ve ışıktan koruyun.
- Ortamı çıkarın ve istenen ototoksik ilacı içeren 300 μL ortamı dikkatlice ekleyin.
- Saç hücresinin sağkalımını belirlemek için eksplantları gentamisin ve sisplatin ile 37 ° C'de 24 saat ila 48 saat inkübe edin.
NOT: İlaç konsantrasyonları ve maruz kalma süresi, çalışmanın amacına bağlı olarak seçilir. Eksplantların korunması burada 72 saate kadar test edildi. Uzun süreli bir kültür yapmayı planlıyorsanız serum kullanmayın. - Koklear hücreleri boyamak için bir sonraki bölümü izleyin.
6. Fiksasyon ve immünofloresan
- Deneyin sonunda ortamı atın ve eksplantları hemen 200 μL önceden ısıtılmış 1x PBS ile yıkayın.
- Eksplantları 200 μL %4 paraformaldehit (PFA) ile kimyasal çeker ocak altında 15 dakika sabitleyin.
DİKKAT: PFA tehlikeli bir kimyasaldır; PFA ile ilk kez çalışmadan önce malzeme güvenlik bilgi formunu (MSDS) okuyun. - Eksplantları 200 μL 1x PBS ile iki kez yıkayın. Boyama prosedürlerinin ertelenmesi gerekmesi ihtimaline karşı eksplantları 1x PBS'de 4 °C'de saklayın.
- 1x PBS ve %1-%5 Triton-X100'den oluşan geçirgenlik çözeltisini hazırlayın.
- 1x PBS'yi atın, 200 μL geçirgenlik çözeltisi ekleyin ve eksplantları 15 dakika inkübe edin.
- Engelleme çözümü hazırlayın.
- Corti eksplantlarının organı için, 1x PBS,% 10 normal keçi serumu (keçi sekonder antikorları için NGS veya sekonder antikorlarla aynı türden başka bir serum) içeren bloke edici solüsyon hazırlayın. Alternatif olarak, hücreler sadece falloidin ile boyanmışsa% 1 -% 5 sığır serum albümini (BSA) kullanın.
- Koklear eksplantlar için, fare primer antikorları kullanılıyorsa, 1x PBS, %10 NGS ve Fab fragmanından (Fab fragmanı keçi-anti fare IgG H+L, seyreltme 1:200) oluşan blokaj solüsyonu hazırlayın.
- 200 μL bloke edici çözelti ekleyin ve eksplantları 1 saat inkübe edin.
- Engelleme çözümünü atın. Fab fragmanı ile inkübe edilen eksplantlara 200 μL% 4 PFA ekleyin ve 5 dakika inkübe edin.
- Eksplantları 1x PBS ile 5 dakika yıkayın.
- 1x PBS, %5 NGS ve %0.1-%0.25 Triton-X100'den oluşan bir antikor çözeltisi hazırlayın.
- Birincil antikoru antikor çözeltisi içinde seyreltin -MYO7A (1:500 seyreltmede ab3481 veya 1:100'de MYO7A 138-1)-saç hücrelerini etiketlemek için ve TuJ1 (1:400) spiral ganglion nöronlarını etiketlemek için.
NOT: Saç hücreleri sadece falloidin ile etiketlenmişse, falloidini 1x PBS'de 1:150'de seyreltin, oda sıcaklığında 40 dakika ila 1 saat inkübe edin ve adım 6.22'ye geçin. - Birincil antikoru atlayarak ikincil antikorun spesifik olmayan bağlanması için bir kontrol ekleyin.
- Karşılık gelen kuyucuğa birincil antikor ile 170 μL antikor çözeltisi ekleyin ve gece boyunca 4 ° C'de hafifçe çalkalama (40-60 rpm) ile inkübe edin.
- Eksplantları 4x 5 dakika boyunca her biri 1x PBS ile yıkayın.
- İkincil antikoru antikor çözeltisi içinde seyreltin (örneğin, keçi anti-tavşan Alexa Fluor 488 veya keçi anti-fare Alexa Fluor 568 IgG, 1:500 seyreltmede).
- İkincil antikor ile 170 μL antikor çözeltisi ekleyin ve oda sıcaklığında 1 saat inkübe edin.
NOT: Bu adımdan itibaren, eksplantları uzun süreli ışığa maruz kalmaktan koruyun. - Eksplantları 2x 5 dakika boyunca her biri 1x PBS ile yıkayın.
- Eksplantların sıralı çift etiketlenmesi için bir sonraki adıma geçin. İlgilenilen ikinci bir primer antikor (örneğin, saç hücreleri için MYO7A) ile gece boyunca 4 ° C'de hafifçe çalkalayarak (40-60 rpm) inkübe edin. Alternatif olarak, phalloidin (1:150) ile oda sıcaklığında 40 dakika ila 1 saat inkübe edin ve adım 6.22'ye geçin.
NOT: Birincil antikorlar aynı konakçı türden ise sıralı etiketleme yapın. Multipleks immünofloresan için sonunda falloidin etiketlemesi yapın. - Eksplantları 4x 5 dakika boyunca her biri 1x PBS ile yıkayın.
- İkincil antikoru antikor çözeltisi içinde seyreltin (örneğin, keçi anti-tavşan Alexa Fluor 488 veya keçi anti-fare Alexa Fluor 568 IgG, 1:500 seyreltmede).
- 170 μL ikincil antikor ekleyin ve oda sıcaklığında 1 saat inkübe edin.
- Eksplantları 2x 5 dakika boyunca her biri 1x PBS ile yıkayın.
- 1 mg / mL'lik bir DAPI stok çözeltisi hazırlayın ve −20 ° C'de saklayın. 0.1 mg / mL'lik çalışma çözeltileri hazırlamak için DAPI stok çözeltisini 1:10 oranında seyreltin ve 4 ° C'de saklayın.
NOT: 23. adımı atlayın ve DAPI içeren montaj ortamı kullanılıyorsa 26. adıma gidin. - DAPI çalışma solüsyonunu 1x PBS'de 1:100 oranında seyreltin ve eksplantları 200 μL DAPI solüsyonu ile 5 dakika inkübe edin.
- Eksplantları 2x 5 dakika boyunca her biri 1x PBS ile yıkayın.
- Haznenin tabanının kurumasını sağlamak için 1x PBS'yi mümkün olduğunca çıkarın. Eksplantın kurumasına izin vermeyin.
- 2-5 saniye bekleyin ve doğrudan eksplantın üzerine bir damla montaj ortamı ekleyin.
NOT: Eksplant üzerindeki montaj ortamı, yüzey gerilimi nedeniyle yerinde kalacaktır. Sertleştirme montaj ortamı kullanılabilir. - Görüntülemeye kadar hazneleri 4°C'de saklayın.
7. Eksplantlardan canlı hücrelerin immünofloresansı
- Gece boyunca inkübasyondan sonra izole edilmiş eksplantları kullanın.
- Ortamı çıkarın ve dikkatlice 125 μM sisplatin içeren 300 μL ortam ekleyin.
- Canlı eksplantlardaki mitokondriyal süperoksidi ölçmek için eksplantları 18 saat inkübe edin.
- İlaca maruz kalmanın sonunda ortamı atın.
- Hücresel ROS'u (örneğin, 250 nM mito-hidroetidin) ve / veya Kaspaz-3'ü (örneğin, bir nükleik asit bağlayıcı boyaya konjuge edilmiş 2 μM DEVD peptidi) tespit etmek için 300 μL geçirgen bir prob ekleyin.
- 37 °C'de 30 dakika inkübe edin.
- Eksplantları 200 μL ılık Hank'in dengeli tuz çözeltisi (HBSS) veya uygun bir tampon ile iki kez nazikçe yıkayın.
- 400 nm'de floresan uyarımı ve 590 nm'de emisyon algılama ile hücreleri 2 saat içinde görüntüleyin.
- Deneyin sonunda ortamı atın ve eksplantları hemen 200 μL önceden ısıtılmış 1x PBS ile yıkayın.
- Eksplantları sabitleyin ve koklear hücreleri yukarıda tarif edildiği gibi boyayın.
8. Konfokal görüntüleme ile görselleştirme
- Dönen bir disk konfokal ünitesi ile donatılmış bir mikroskop veya nokta taramalı konfokal ünite ile donatılmış bir konfokal mikroskop kullanarak eksplantları görüntüleyin.
- Hücre sayımı için 20x hava objektifine (sayısal açıklık: 0,75) sahip dönen bir disk kullanarak görüntüleri elde edin. Alternatif olarak, sinapsları görselleştirmek ve saymak veya stereocilia'yı görüntülemek için 40x hava objektifi (sayısal açıklık: 0.95) veya 100x yağ objektifi (sayısal diyafram: 1.45) ile nokta taramalı bir konfokal mikroskop kullanarak görüntüleri elde edin.
NOT: Görüntülerin aşırı ve az doygunluğunu önlemek için her kanal için lazer yoğunluğunu ve pozlama süresini ayarlayın. Aynı deneyin tüm eksplantlarına aynı ayarları uygulayın. - Mikroskobu, 20x hava objektifi, z-yığını ve otomatik dikiş araçları kullanarak tüm koklear eksplantın 3D görüntüsünü yakalayacak şekilde ayarlayın. Fare eksplantları için %15 örtüşme ile 3 x 3 bitişik alan ve sıçan eksplantlarının birbirine dikilmesi için 4 x 4 bitişik alan kullanın.
- Mikroskop yazılımını veya ücretsiz açık kaynaklı FIJI yazılımını kullanarak görüntüleri ayarlayın8.
NOT: Bir görüntü işleme tekniği olan dekonvolüsyon, kontrastlarını ve çözünürlüklerini 9-11 keskinleştirmek için konfokal görüntülere uygulanabilir.
Sonuçlar
Bu protokol yenidoğan fare ve sıçanların kokleaları üzerinde test edilmiştir. Bu makale, farklı deneylerden elde edilen eksplantların görüntülerini sunmaktadır. Corti organının eksplantları gentamisin veya sisplatine maruz bırakıldı ve saç hücresi kaybı görüldü. Corti organının eksplantları, hem normal hem de stres koşulları altında yapılarını ve toplam uzunluklarını korumuştur (Şekil 1 ve Şekil 2). Daha önce sisplatine maruz kalan sıçan eksplantlarının tüm uzunluğu boyunca hayatta kalan saç hücreleri ayrı ayrı tespit edilebilirdi (Şekil 1). Hayatta kalan saç hücrelerinin saptanmasının yanı sıra apoptoz geçiren tüylü hücreler de tespit edilmiştir (Şekil 2). Bu yaklaşım, daha önce açıklandığı gibi derin öğrenme yaklaşımı kullanılarak gerçekleştirilebilen hayatta kalan hücrelerin görselleştirilmesini ve sayılmasını kolaylaştırır12. Uygun hücre geçirgen problar kullanılarak canlı koklear hücrelerdeki biyolojik süreçleri tespit etmek de mümkün olmuştur (Şekil 3).
Spiral ganglion nöronları içeren koklear eksplantlar söz konusu olduğunda, eksplantlar iki parçaya bölünebilir veya daha iyi kültür koşulları sağlamak için apeks bölgesi kesilebilir. Burada apeks bölgesini ayırmayı seçtik, çünkü stres koşullarından daha az etkileniyor. Şekil 4, koklear eksplantların taban ve medial bölgelerini göstermektedir. Saç hücresi belirteci MYO7A ile etiketlenmiş saç hücreleri tespit edildi. Benzer şekilde, nöronal belirteç TuJ1 ile etiketlenmiş sağlıklı ve hasarlı spiral ganglion hücre gövdeleri ve nöritler tanımlandı. Spiral ganglion bölgelerinin analizi manuel olarak veya nörit izleme için NeuronJ eklentisi 13 veya morfolojik segmentasyon14,15 için TrackMate ve Cellpose gibi uzantılar ile FIJI gibi açık kaynaklı yazılımlar kullanılarak gerçekleştirilebilir. Fare eksplantlarının daha yakından incelenmesi, koklear hücrelerin ve tüy hücresi stereosilyalarının yüksek çözünürlüğünü ortaya çıkardı (Şekil 5).
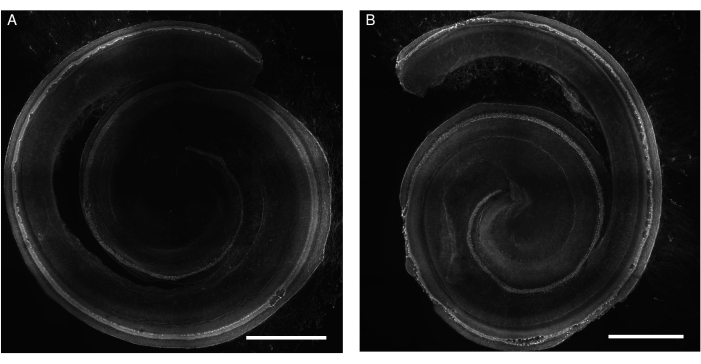
Şekil 1: Gentamisin'e maruz kalan sıçanlardan Corti organının eksplantları. (A) kontrol ve (B) gentamisine maruz kalan (24 saat boyunca 200 μM) eksplantların temsili görüntüleri (maksimum yoğunluk projeksiyonu). Saç hücreleri falloidin ile etiketlenmiştir ve kokleanın tüm uzunluğu boyunca görselleştirilebilir. Daha iyi gösterim için, görüntü gri tonlardadır. Görüntüler, 20x objektifli (sayısal açıklık: 0.75) dönen diskli konfokal mikroskop kullanılarak elde edildi. Ölçek çubuğu = 500 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
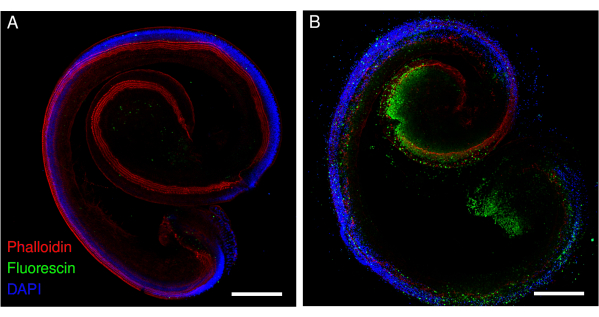
Şekil 2: Sisplatine maruz kalan farelerden Corti organının eksplantları. (A) kontrol ve (B) sisplatine maruz kalan (48 saat boyunca 160 μM) eksplantların temsili görüntüleri (maksimum yoğunluk projeksiyonu). Saç hücreleri falloidin (kırmızı) ile etiketlenir ve apoptotik saç hücreleri floresan ile etiketlenir. Görüntüler, nokta taramalı konfokal mikroskop ve 20x objektif (sayısal açıklık: 0.75) kullanılarak elde edildi. Ölçek çubuğu = 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
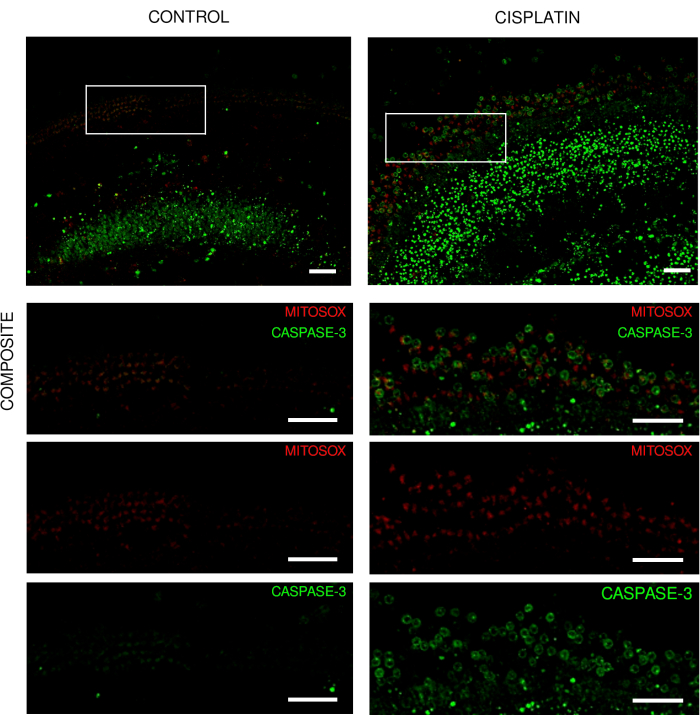
Şekil 3: Canlı görüntüleme deneylerinden Corti organının eksplantları. 18 saat boyunca 125 μM sisplatine maruz bırakılan (A) kontrol eksplantlarını ve (B) eksplantlarını gösteren vahşi tip farelerden eksplantların temsili görüntüleri (maksimum yoğunluk projeksiyonu). Saç hücreleri mito-hidroetidin ve kaspaz-3 ile etiketlenmiştir. Görüntüler, dönen disk konfokal mikroskop ve 20x objektif (sayısal açıklık: 0.75) kullanılarak elde edildi. Ölçek çubuğu = 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 4: Sisplatine maruz kalan STAT1 nakavt farelerinden koklear eksplantlar. 48 saat boyunca 40 μM sisplatine maruz kalan (A) kontrol eksplantlarının ve (D) eksplantlarının temsili görüntüleri (maksimum yoğunluk projeksiyonu). Saç hücresi gövdeleri MYO7A antikoru (yeşil) ve spiral ganglion hücreleri TuJ1 antikoru (kırmızı) ve DAPI nükleer etiketlemesi (mavi) ile etiketlenir. Görüntüler, nokta taramalı konfokal mikroskop ve ek 2.15 yakınlaştırma (B,C,E,F) ile 20x objektif (sayısal diyafram: 0.75) kullanılarak elde edildi. Ölçek çubuğu = (B,C,E,F) 50 μm ve (A,D) 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
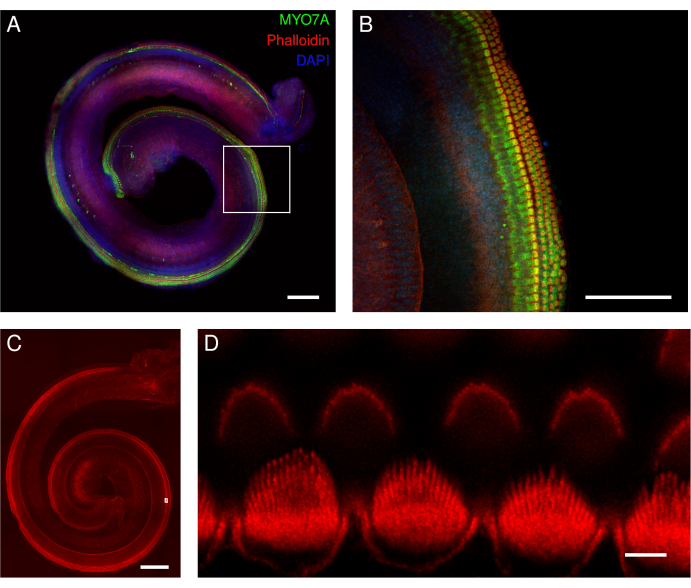
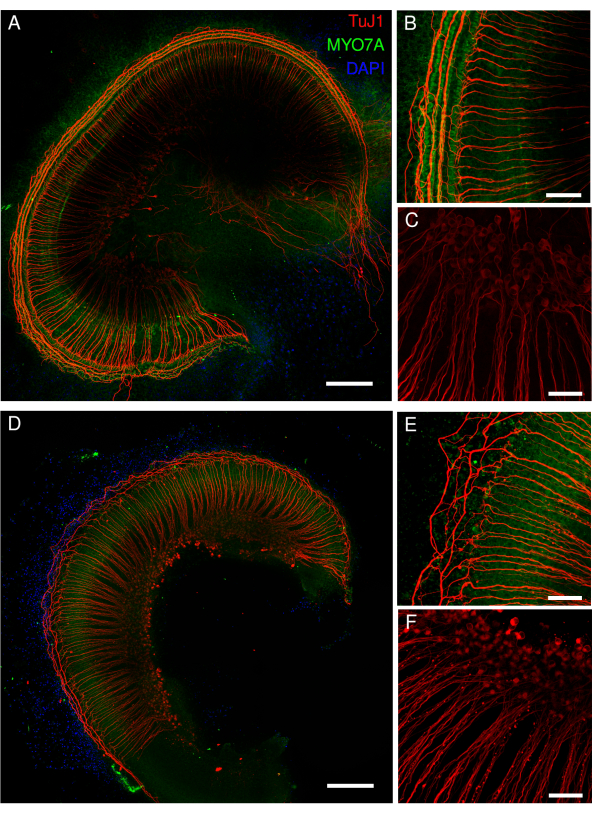
Şekil 5: Corti eksplantlarının fare organı. (A-D) Yabani tip farelerden alınan tam uzunluktaki eksplantların temsili görüntüleri (maksimum yoğunluk projeksiyonu). (A,B) Eksplantlar MYO7A antikoru, phalloidin ve DAPI nükleer etiketlemesi ile etiketlendi. (B) Büyütülmüş genel bakışta, MYO7A antikoru (yeşil) ile etiketlenmiş saç hücrelerinin hücre gövdeleri açıkça görülebilir. (C,D) Phalloidin, saç hücrelerinin stereokirpiklerini ve kütiküler plakasını etiketler. Eksplantlar falloidin ile etiketlendi. (D) Büyütülmüş genel bakışta, tek tek iç tüy hücresi stereosilyalarının kıvrımsız görüntüleri iyi tanımlanırken (alt sıra), tek tek dış tüy hücresi stereokirilerinin tanımlanması daha zordur (üst sıra). A ve C panellerindeki görüntüler, 20x objektifli (sayısal açıklık: 0.75) dönen diskli konfokal mikroskop ile elde edildi. Panel B'deki görüntü aynı mikroskopla ancak 40x hava objektifi ile elde edildi (sayısal açıklık: 0.95). D panelindeki görüntü, nokta taramalı konfokal mikroskop ve ek 3.46 yakınlaştırma ile 100x yağ objektifi (sayısal açıklık: 1.45) ile elde edildi. Taramaların XY bölümü başına dört kez ortalaması alındı ve piksel boyutu 0.02 μm idi. Ölçek çubukları = (D) 3 μm, (B) 100 μm ve (A,C) 200 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokolün güncellenmesinin amacı, eksplantların izolasyonundan canlı ve sabit koklear hücrelerin görüntülenmesine kadar olan adımları kolaylaştırmaktı. İzolasyon sırasında bazı adımları iyileştirdik ve yüksek kaliteli eksplantlar elde etmek için verimli ve sorunsuz çalışan bir protokol oluşturmak amacıyla bazı yenilikçi araçlar sunduk. Açıklanan yöntem, önceki raporlardanoptimize edilmiş bir protokoldür 4,5. Ek olarak, bazı güncel çalışmalar kademeli olarak güncellenmiş bir protokolden yoksundur. Basitleştirilmiş eksplant kültürü adımları ile bu protokol, tekrarlanabilir veriler için gerekli olan iyi korunmuş eksplantların kolay işlenmesini sağlar. İç kulak eksplantları için polimer lamel ile çok kuyucuklu odaların eklenmesi, organ bağlanmasını ve bozulmamış eksplantların korunmasını iyileştirir. Burada, kültürdeki organların saç hücrelerinin kaybına ve nöritlerin zarar görmesine rağmen hücresel organizasyonlarını koruduğunu göstermek için stres koşulları altında birkaç deney örneği sunuyoruz.
İç kulak organlarının kültürlenmesindeki zorluklardan biri, eksplantların bütünlüğünü, tedaviye yanıtı ve sonraki muayeneleri etkilediği için organların ayrılmasını ve yüzmesini önlemektir. Daha önce, eksplantlar cam lameller 4,5 üzerinde kültürleniyordu. Cam yüzeylerde kültür iyi bir alternatif gibi görünse de, camın kaplanması zaman alıcıdır ve lamellerin kendileri kırılgan ve hassastır. Millicell hücre kültürü eklerini kullanan alternatif bir protokol bu sorunu çözmeye çalışır6. Bununla birlikte, membranın eksplantlarla kesilmesi ve aktarılması bu protokolde hassas bir adım gibi görünmektedir. Ek olarak, lamellerin montajı ve sızdırmazlığı sırasında eksplantlar zarar görebilir. Önerdiğimiz yaklaşımda, eksplantlar poli-D-lizin kaplı odalara aktarıldıktan ve doğru konuma yerleştirildikten sonra, başka bir transfer veya lamel ile kaplama gerekmez. Bu protokolün bir diğer avantajı, organ eksplantları için en uygun kültür koşullarını sağlayan ince bir gaz geçirgen polimer lamel içeren odaların kullanılmasıdır. Bu polimer, cama benzer bir optik kaliteye sahiptir, bu nedenle yüksek çözünürlüklü mikroskopide hücre görüntüleme için uygun hale getirir.
Ortama serum ilavesi, %1-10 FBS 4,5,6,16 ile iç kulak eksplantlarının kültürü de dahil olmak üzere hücre ve doku kültürü için çoğu protokolde kullanılır. Serumun varlığı, deneylerin kültür koşullarını etkiler; Bu nedenle, bazı durumlarda, serumsuz kültür tercih edilir. Koklear eksplantların kültüründe serum yokluğu, ya DMEM'e N2 ilavesi ya da Neurobazal-A besiyerineN2 ilavesi ile değiştirildi 5,6. Bu bağlamda, eksplantların kültür koşullarını serumlu ve serumsuz olarak test ettik. Her iki koşulda da, iç kulak hücreleri hayati önem taşıyordu ve ototoksik koşullara yanıt veriyordu. Bu koşulları 72 saat boyunca test ettik, ancak eksplantlar, diğer çalışmalarda önerildiği gibi, özellikle N2, B27 ve büyüme faktörleri ile birlikte serumsuz ortamla inkübe edildiğinde kültürde daha da uzun süre korunabilir 5,16.
İç kulak eksplantlarının izolasyonunda organ izolasyonunun süresi ve kullanılan antibiyotik gibi genel kritik adımlara ek olarak, bu protokolde yönetilebilir bazı kritik adımlar da vardır. Bu yöntemdeki kritik adımlardan biri, organ yerleştirildikten sonra haznede kalan ortamın hacmi ile ilgilidir. Bu, eksplantları canlı tutmak ve alt yüzeye bağlı tutmak için optimize edilmiştir. Diğer bir kritik adım, eksplantların odanın dibine yapışmasına izin vermek için gereken inkübasyon süresi ile ilgilidir. Birkaç mikrolitre ortam ile 2 saatten daha uzun inkübasyon süreleri, eksplantların sağlığını etkileyebilir. Eksplantların ayrılmamasına özen gösterildiği sürece 1 saat gibi daha kısa inkübasyon süreleri de kullanılabilir. Bir diğer önemli husus, poli-D-lizin kalıntılarıdır. Poli-D-lizinin yıkama adımları kesinlikle takip edilmelidir, çünkü poli-D-lizinin bromür tuzunun kalıntıları hücreler için toksik olabilir. Yıkama adımları tam olarak takip edildikten sonra, poli-D-lizin ile kaplama, eksplantların haznelere düzgün yapışmasını kolaylaştırır, böylece haznenin tabanına sıkıca bağlanmadan önce pozisyon düzeltilebilir.
Bu yöntemin sınırlamalarından biri, dik mikroskopi kullanılarak hücrelerin görüntülenmesidir. Bu, ters mikroskoplu laboratuvarlar için önemli bir sorun olabilir. Dik ve ters mikroskopi için çıkarılabilir silikon hazneli cam slaytlar kullanılabilir; bununla birlikte, önce poli-D-lizin ile kaplama koşullarımızın test edilmesi gerekir. Diğer bir sınırlama, odaların depolanmasıdır, çünkü ekler çıkarılabilir değildir ve kapaklı bir bölmenin toplam yüksekliği, standart bir mikroskop lamının 1 mm yüksekliğine kıyasla yaklaşık 11 mm'dir. Bununla birlikte, 8 oyuklu oda,16'dan önce önerilen 4 oyuklu plakalardan daha az yer kaplar.
Burada iki mikroskopla elde edilen görüntüleri sunuyoruz. Nokta taramalı konfokal mikroskop, ince optik kesiti sayesinde dokuların yüksek çözünürlüklü görüntülerini sağlarken, dönen disk konfokal mikroskobu, iyi çözünürlükle daha hızlı görüntüleme süresi sağlar. İç saç hücrelerinin (IHC'ler) ve dış saç hücrelerinin (OHC'ler) stereosilileri konfokal mikroskopi kullanılarak görselleştirilir. IHC'lerin stereosiliaları OHC'lerinkinden daha büyük olduğundan, bu çalışmada tekrar tekrar ve iyi görselleştirildiler. OHC stereosilia için, süper çözünürlüklü mikroskopi (SRM) gibi diğer alternatif mikroskoplar görselleştirmeyi iyileştirebilir. Dönen disk mikroskobu ile elde edilen eksplant görüntüleri, derin öğrenme yaklaşımı12 kullanılarak otomatik saç hücresi sayımının kolay entegrasyonu için yeterlidir. Ayrıca, kısa edinme süresi, canlı hücreler ve dokularla yapılan deneyler için önemlidir. Ayrıca bu protokol neonatal koklear eksplantlarla sınırlı değildir. Bazı optimizasyonlarla, vestibüler organlar veya embriyonik dokular gibi diğer eksplantlar da kültürlenebilir.
Tüy hücreleri ve nöronlar gibi koklear hücrelerin in vitro olarak ölçülmesi, hücre canlılığını ve dolayısıyla hasarlı veya kayıp hücrelerin yüzdesini değerlendirmek için önemlidir. Sinyal yolaklarının ve hücre fonksiyonlarının araştırılması, ölüm ve hayatta kalma mekanizmalarının ortaya çıkarılmasına yardımcı olur. Embriyonik ve neonatal koklear dokuların incelenmesi, kokleanın gelişim evrelerinin araştırılmasında yararlıdır. Bu nedenle, bu protokol, örneğin ototoksik modeller oluşturmak, gelişim aşamalarını araştırmak, sinyal yollarını değerlendirmek ve ilaç tarama çalışmaları yapmak için iç kulak eksplantlarının in vitro çalışmalarını optimize etmeye yardımcı olacaktır.
Açıklamalar
Yazarların ifşa edecek herhangi bir çıkar çatışması yoktur.
Teşekkürler
Basel Üniversitesi Biyotıp Bölümü Hayvan Tesisi'ne hayvan bakımındaki destekleri için, Mikroskopi Çekirdek Tesisleri'ne ve Biyotıp Bölümü Bilgi Teknolojileri Servisi'ne teknik yardımları için ve İsviçre Ulusal Bilim Vakfı'na (SNSF) mali destek için teşekkür ederiz (MD-PhD bursu. Hibe numarası 323530_191222).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 15 mL High-Clarity Polypropylene Conical Tube 17 x 120 mm style | FALCON | 352096 | |
| 45° Angled Forceps | Fine Science Tools | 11251-35 | |
| 50 mL Polypropylene Conical Tube 30 x 115 mm style | FALCON | 352070 | |
| Antifade Mounting Medium | VECTASHIELD | H-1000 | |
| Alexa Fluor 568 phalloidin | Thermofisher | 2151755 | |
| Anti-beta III Tubulin antibody [TUJ-1] | Abcam | ab14545 | |
| Antifade Mounting Medium With DAPI | VECTASHIELD | H-1200 | |
| Anti-myosin VII rabbit polyclonal | Abcam | ab3481 | |
| B-27 Supplement (50x), minus antioxidants | Thermofisher | 10889038 | |
| CARBON STEEL surgical blades 23 | Swann Moiton | 210 | |
| CellEvent™ Caspase-3/7 Green Detection Reagent | Thermofisher | C10723 | |
| DMEM/F-12/(1:1)(1x) + GlutaMAX | Thermofisher | 31331028 | |
| Double spatulas, one curved end | VWR | RSGA038.150 | |
| Ethyl alcohol 70% V/V 1,000 mL | bichsel | 160 0 106 00 | |
| Fetal Bovine Serum, certified | Thermofisher | 16000036 | |
| Fixative Solution 4% paraformaldehyde prepared in PBS | Thermofisher | 201255309/201255305 | |
| High Intensity Cold Halogen Light Source | Intralux® | 5100 | |
| Huygens Professional version 21.10 | Scientific Volume Imaging | ||
| ibidi µ-Slide 8 well | ibidi | 80826 | |
| microscope | LEICA | M80 | |
| microscope | LEICA | MS5 | |
| MitoSOX™ Red Mitochondrial Superoxide Indicator, for live-cell imaging | Thermofisher | M36008 | |
| N2 supplement (100x) | Thermofisher | 17502048 | |
| Nikon Eclipse Ti microscope with a Yokogawa CSU-W1 spinning disk confocal unit, and a Photometrics Prime 95B camera. | NIKON | ||
| Nikon Eclipse Ti microscope with an A1 point-scanning confocal unit | NIKON | ||
| Operating scissors | Fine Science Tools | 14005-16 | |
| Operating scissors | Fine Science Tools | 14088-10 | |
| Operating tweezers | Fine Science Tools | 11008-15 | |
| PBS pH 7.2 (1x), 500mL | Thermofisher | 20012-019 | |
| Penicillin | Sigma-Aldrich | P3032 | |
| POLY-D-LYSINE HYDROBROMIDE MOL WT GT 30 | Sigma-Aldrich | P7405 | |
| Scalpel Handle #4 | Fine Science Tools | 10004-13 | |
| Steri 250 Second sterilizer | Simon Keller AG | 031100 | |
| Sterilizer, desiccant pellets | Simon Keller AG | 31120 | |
| Tissue Culture Dish 60 x 15 mm | FALCON | 353802 | |
| Tissue Culture Dish 60 x 15 mm | FALCON | 353004 | |
| Trito X-100 | Sigma | T9284 | |
| Unconventional myosin-VIIa | Developmental Studies Hybridoma Bank | 138-1s | |
| WFI for Cell Culture[-]Antimicrobial, 500 mL | Thermofisher | A12873-01 |
Referanslar
- Mukherjea, D., et al. The design and screening of drugs to prevent acquired sensorineural hearing loss. Expert Opinion on Drug Discovery. 6 (5), 491-505 (2011).
- Takeda, H., Dondzillo, A., Randall, J. A., Gubbels, S. P. Challenges in cell-based therapies for the treatment of hearing loss. Trends in Neurosciences. 41 (11), 823-837 (2018).
- Schacht, J., Talaska, A. E., Rybak, L. P. Cisplatin and aminoglycoside antibiotics: Hearing loss and its prevention. The Anatomical Record. 295 (11), 1837-1850 (2012).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Durbin, J. E., Hackenmiller, R., Simon, M. C., Levy, D. E. Targeted disruption of the mouse Stat1 gene results in compromised innate immunity to viral disease. Cell. 84 (3), 443-450 (1996).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Etournay, R., et al. Cochlear outer hair cells undergo an apical circumference remodeling constrained by the hair bundle shape. Development. 137 (8), 1373-1383 (2010).
- MacDonald, G. H., Rubel, E. W. Three-dimensional imaging of the intact mouse cochlea by fluorescent laser scanning confocal microscopy. Hearing Research. 243 (1-2), 1-10 (2008).
- Sibarita, J. B. Deconvolution microscopy. Advances in Biochemical Engineering/Biotechnology. 95, 201-243 (2005).
- Cortada, M., Sauteur, L., Lanz, M., Levano, S., Bodmer, D. A deep learning approach to quantify auditory hair cells. Hearing Research. 409, 108317 (2021).
- Meijering, E., et al. Design and validation of a tool for neurite tracing and analysis in fluorescence microscopy images. Cytometry A. 58 (2), 167-176 (2004).
- Ershov, D., et al. TrackMate 7: Integrating state-of-the-art segmentation algorithms into tracking pipelines. Nature Methods. 19 (7), 829-832 (2022).
- Stringer, C., Wang, T., Michaelos, M., Pachitariu, M. Cellpose: A generalist algorithm for cellular segmentation. Nature Methods. 18 (1), 100-106 (2021).
- Zhang, L. W., Cang, X. H., Chen, Y., Guan, M. X. In vitro culture of mammalian inner ear hair cells. Journal of Zhejiang University of Science B. 20 (2), 170-179 (2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır