Method Article
Цельные неонатальные кохлеарные экспланты как модель in vitro
В этой статье
Резюме
Текущий протокол обновляет предыдущие протоколы и включает в себя относительно простые подходы к культивированию высококачественных кохлеарных эксплантов. Это обеспечивает надежный сбор данных и получение изображений с высоким разрешением в живых и неподвижных ячейках. Этот протокол поддерживает продолжающуюся тенденцию изучения клеток внутреннего уха.
Аннотация
Нелеченая потеря слуха приводит к значительным издержкам для глобальной системы здравоохранения и ухудшает качество жизни людей. Нейросенсорная тугоухость характеризуется кумулятивной и необратимой потерей чувствительных волосковых клеток и слуховых нервов в улитке. Цельные и жизненно важные кохлеарные экспланты являются одним из основных инструментов в исследованиях слуха для обнаружения потери волосковых клеток и характеристики молекулярных механизмов клеток внутреннего уха. Много лет назад был разработан протокол кохлеарной изоляции новорожденных, и, хотя со временем он был изменен, он все еще имеет потенциал для улучшения.
В данной работе представлен оптимизированный протокол выделения и культивирования целых неонатальных кохлеарных эксплантов в многолуночных культуральных камерах, который позволяет исследовать волосковые клетки и спиральные ганглиозные нейронные клетки по всей длине улитки. Протокол был протестирован с использованием кохлеарных эксплантов мышей и крыс. Были получены здоровые кохлеарные экспланты для изучения взаимодействия между волосковыми клетками, клетками нейронов спирального ганглия и окружающими поддерживающими клетками.
Одним из основных преимуществ этого метода является то, что он упрощает этапы культивирования органов без ущерба для качества эксплантатов. Все три витка органа Корти прикреплены ко дну камеры, что облегчает эксперименты in vitro и всесторонний анализ эксплантов. Мы приводим несколько примеров кохлеарных изображений из различных экспериментов с живыми и фиксированными эксплантами, демонстрирующими, что экспланты сохраняют свою структуру, несмотря на воздействие ототоксических препаратов. Этот оптимизированный протокол может быть широко использован для интегративного анализа улитки млекопитающих.
Введение
Большинство случаев нейросенсорной тугоухости обусловлены дегенерацией сенсорных волосковых клеток, слуховых нервных клеток и/или слуховых синапсов1. Этот дегенеративный процесс в сенсорных клетках является прогрессирующим и, как правило, необратимым, что приводитк потере слуха2. Таким образом, информация о жизнеспособности сенсорных клеток и изменениях в сигнальных путях в условиях стресса имеет решающее значение для защиты клеток от повреждения и, следовательно, потери. Исследование кохлеарных эксплантов в культуре позволяет рекапитулировать тканевый комплекс и поддерживать нормальную межклеточную сеть, что позволяет лучше описывать сигнальные процессы. Для создания экспериментальных моделей ототоксичности часто использовали антибиотик гентамицин и химиотерапевтическое средство цисплатин, поскольку известно, что они обладают ототоксическимипобочными эффектами.
Системы культивирования in vitro кохлеарных эксплантов разрабатывались и модифицировались с течением времени; Тем не менее, описание поэтапного протокола культивирования целых кохлеарных эксплантов часто отсутствует в нескольких публикациях. Один из первых видеопротоколов первичной культуры мышиного органа Corti был опубликован Parker et al., в котором авторы описали этапы выделения сенсорного эпителия, культивирования на стеклянных покровных стеклах и электропорации эксплантов для экспериментов по трансфекции4. Также ранее был опубликован другой протокол с использованием стеклянных покровных стекол, в котором рассматривалась организация клеточной структуры во внутреннем ухе5. Сообщается об альтернативном протоколе с использованием мембраны Millicell для культивирования мышиных эксплантов кортиевого органа и вестибулярного органа6. Эти видеорепортажи внесли свой вклад в совершенствование метода, но все еще есть проблемы, которые необходимо решить. Для решения ряда вопросов, возникающих в связи с использованием стеклянных покровных стеблей и вкладышей, настоящий протокол направлен на оптимизацию этапов культивирования органов и культивирование высококачественных органов для получения достоверных данных. Это достигается за счет минимизации непосредственного воздействия на орган во время экспериментальных процедур и избегания пересадки органов до получения изображений живых и фиксированных клеток с высоким разрешением.
Настоящий протокол обновляет ранее опубликованные системы культивирования in vitro и вносит ряд оптимизаций в изоляцию кортиевского органа и перенос в культуральные камеры, а также интеграцию новой слайдовой камеры для улучшения условий культивирования и дальнейшего анализа. Этот оптимизированный протокол снижает риск повреждения органа, который может возникнуть при использовании стеклянных покровных стекол во время смены среды или во время переноса органа из покровных стекол или мембран для дальнейшего анализа 4,5,6. Стеклянные покровные стекла имеют лучший отражающий показатель, чем пластиковые; Однако они хрупкие и могут легко сломаться. Многолуночные камеры, используемые здесь, прикреплены к предметному стеклу микроскопа, который хорошо подходит для культивирования органов и визуализации с высоким разрешением. Перенос изолированных органов выполняется с помощью шпателя, который позволяет привести орган в правильную ориентацию и скользить в камеру, а не прикладывать усилие пипеткой, как ранее рекомендовалось 4,5,6.
Многолуночные камеры с поли-D-лизиновым покрытием, которые должны содержать достаточное количество среды, облегчают перенос органов и правильное позиционирование эксплантатов без применения адгезивного давления и при этом избегают перекрытия органов, как упоминалось ранее6. Кроме того, случайное перекрытие органов и неровные структуры разрешаются с помощью конфокального Z-стека. Этот протокол был оптимизирован для различных применений, таких как экспланты мышей и крыс, экспланты кортиевого и улиткового органов, культивирование в сывороточной и безсывороточной среде, ототоксические оценки и эксперименты по общему лекарственному ответу. Кохлеарные экспланты монтируются и инкубируются в камерах с покровным дном, что облегчает адгезию кохлеарных эксплантов к камерам для оптимального обращения во время экспериментов in vitro , постобработки эксплантов и визуализации живых и фиксированных кохлеарных эксплантов. Визуализация всей длины кортиевского органа и количественное определение волосковых клеток упорядочены. Кроме того, оценки поддерживающих клеток, спиральных ганглиозных нейронных клеток и нейритов являются точными. Таким образом, данный протокол может быть использован для комплексного анализа кохлеарных клеток млекопитающих.
протокол
Все процедуры с животными проводились в соответствии с рекомендациями и правилами Комитета по благополучию животных кантона Базель, Швейцария. Для экспериментов использовали постнатальных мышей C57BL/6JR, крыс линии Wistar и мышей с дефицитом STAT1 (смешанный C57BL/6-129/SvEv)7 в возрасте 3-5 дней и обоего пола.
1. Нанесение покрытий на многолуночные камеры
- Подготовьте полную питательную среду.
- Для органа кортиевских эксплантатов приготовьте среду, содержащую модифицированную орлиную среду (DMEM) Дульбекко, 10% фетальную бычью сыворотку (FBS), 25 мМ HEPES и 30 ЕД/мл пенициллина.
- Для органных эксплантов корти и кохлеарных эксплантов приготовьте среду, содержащую DMEM/F12, 1x добавку N2, 1x B27 минус антиоксиданты и 30 ЕД/мл пенициллина.
- Приготовьте исходный раствор поли-D-лизина, добавив 10 мл воды для культивирования клеток к 5 мг поли-D-лизина в ламинарном колпаке. Конечная концентрация поли-D-лизина составляет 0,5 мг/мл.
ПРИМЕЧАНИЕ: Смешайте оставшийся исходный раствор и храните при температуре −20 °C.- Готовят рабочие растворы поли-Д-лизина, разводя исходный раствор 1:10 в стерильной воде.
- Покройте 8-луночную камеру рабочим раствором 150 мкл/лунку поли-D-лизина и инкубируйте в течение 30 минут при комнатной температуре.
ПРИМЕЧАНИЕ: Если используется 4-луночная камера, покройте 300 мкл/лунку рабочего раствора поли-D-лизина. - Отсасывайте раствор вакуумом или пипетированием.
- Промыть 2 раза 200 мкл стерильной воды и один раз 200 мкл полной питательной среды или DMEM.
- Добавьте 150 мкл полной питательной среды в каждую лунку.
ПРИМЕЧАНИЕ: Если используется камера с 4 лунками, добавьте 250 мкл/лунку полной питательной среды. - Поместите камеру в инкубатор при температуре 37 °C и 5%CO2 не менее чем на 30 мин перед размещением эксплантата.
2. Рассечение височной кости
- Продезинфицируйте хирургический стол 70% этиловым спиртом и стерилизуйте все инструменты в стеклянном стерилизаторе с микросферами.
- Поместите стерильную чашку Петри диаметром 60 мм на ведро со льдом.
- Налейте несколько миллилитров 1x фосфатно-солевого буфера (PBS) и держите на льду.
ПРИМЕЧАНИЕ: Используйте пенициллин 30 ед/мл в 1x PBS, чтобы избежать бактериального загрязнения. - Положите стерильную прокладку на стерильный лоток и быстро обезглавьте щенка ножницами. Погрузите голову в 70% этанол на 5 секунд, если загрязнение является частым явлением.
ПРИМЕЧАНИЕ: Этот протокол был протестирован на мышах и крысах в возрасте P3-P5. Кохлеарные ткани труднее отделить от старых мышей и крыс, а выживаемость эксплантов в культуре ограничена. - Положите голову животного на стерильную прокладку. Удалите нижнюю челюсть. Приподнимите кожу и снимите ее с черепа.
- Удерживайте череп, поместив щипцы в глазничные полости.
- Аккуратно разрежьте череп по сагиттальному шву, а затем разрежьте в области венечного шва острым лезвием скальпеля, не повредив улитку.
ПРИМЕЧАНИЕ: Избегайте слишком сильного давления и избегайте движений скальпелем вперед и назад, так как это может повредить кохлеарную кость и, следовательно, кохлеарный проток. - Аккуратно извлеките мозг из двух половин черепа.
- Перенесите половинки черепа в чашку Петри диаметром 60 мм с ледяным PBS, приготовленным на шаге 2.3.
3. Изоляция улитки
- Локализуют улитку в височной кости под микроскопом. Поместите щипцы в верхний полукружный канал.
- Ослабьте окружающие ткани между улиткой и височной костью с помощью инсулинового шприца (мыши) или щипцов (крысы).
- Осторожно оттяните височную кость от улитки, удерживая улитку прикрепленной к преддверию с височной костью. Убедитесь, что улитка свободна от окружающих тканей, прежде чем отодвигать височную кость в сторону.
ПРИМЕЧАНИЕ: Слишком большое усилие может повредить кохлеарный проток. - Держите улитку в фиксированном положении, а другой рукой осторожно извлеките хрящевую кохлеточную капсулу. Осторожно вставьте кончики щипцов в область апекса или между витками (видно белой линией) и снимайте капсулу по частям. Обнажите кохлеарный проток.
- Осторожно поместите щипцы под улитку и отделите ее от вестибулярного органа и височной кости.
- Переложите улитку в новую 60-миллиметровую чашку, содержащую ледяной PBS.
- Отрегулируйте увеличение микроскопа, чтобы лучше визуализировать экспланты.
- Выполните следующие шаги для эксплантатов кортиевского органа:
- Удерживают орган у основания щипцами. Осторожно извлеките кохлеарный проток, захватив его щипцами в области базального крючка.
- Отмотайте кохлеарный проток от модиолуса, не разрывая его.
- Осторожно удалите спиральную связку с сосудистыми стриями, удерживая орган у основания и оттягивая их.
ПРИМЕЧАНИЕ: Разделение тканей также может быть достигнуто путем удержания верхушечной области вместо базовой. Это может быть полезно при вскрытии органов крыс или старых детенышей мышей (>P5). - Осторожно удалите мембрану Рейсснера, удерживая орган у основания и оттягивая его по частям.
ПРИМЕЧАНИЕ: Это необязательный шаг, так как мембрана Рейсснера не мешает получению изображения.
- Для кохлеарных эксплантов выполните следующие действия:
- Отделите спиральный ганглий от костной спиральной пластинки с помощью инсулинового шприца (мыши) или щипцов (крысы).
- Аккуратно размотайте модиол во время отсоединения.
ПРИМЕЧАНИЕ: Эксплантаты можно разделить на две части для удобства обращения. - Захватите область крючка щипцами.
- Осторожно удалите спиральную связку с сосудистым бороздкой, потянув за нее.
- Осторожно удалите мембрану Рейсснера, удерживая орган у основания и оттягивая его по частям.
Примечание: Этот шаг рекомендуется, потому что мембрана Рейсснера обычно сворачивается и покрывает нити нейронов и, следовательно, может повлиять на эксперименты.
4. Культура кохлеарных эксплантов
- Переместите экспланты из чашки Петри в многолуночные камеры. Поднимите эксплантаты волосковыми клетками вверх с помощью лабораторного шпателя. Добавьте несколько микролитров 1x PBS, чтобы предотвратить прилипание образцов к шпателю.
ПРИМЕЧАНИЕ: Сильно поврежденные экспланты прилипают к шпателю. - Позвольте эксплантам соскользнуть со шпателя в камеру, осторожно помахивая шпателем в среде. Разместите по одному экспланту на лунку в 8-луночном камерном слайде.
ПРИМЕЧАНИЕ: Если эксплант прилипает к шпателю, удерживайте шпатель в среде и используйте щипцы, чтобы отсоединить эксплантаты. Всегда размещайте щипцы на внутренней границе эксплантата (подальше от волосковых клеток). - Проверьте под микроскопом, что эксплантаты были перенесены в правильной ориентации и размещены в центре лунок.
ПРИМЕЧАНИЕ: Неправильно ориентированные эксплантаты с волосковыми клетками, обращенными вниз, как правило, имеют U-образную форму вверх по ширине. Скорректируйте их ориентацию, переместив экспланты в углы камер (доступно больше среды) и направьте их на вращение. - Удалите 80 мкл среды с помощью пипетки на 100 мкл и выбросьте ее.
- Проверьте под микроскопом, видны ли волосковые клетки и клетки нейронов спирального ганглия. При необходимости используйте щипцы, чтобы осторожно раздвинуть некоторые перекрывающиеся ткани.
- Удалите оставшуюся часть носителя и подождите ~10 с.
- Пропитывайте среднюю спину. Добавьте одну или две капли среды рядом с эксплантом и остальную среду на некотором расстоянии от эксплантата, чтобы предотвратить отслоение эксплантата.
ПРИМЕЧАНИЕ: Даже если экспланты прикреплены к камерам, среда всегда должна быть добавлена сначала путем пипетирования одной-двух капель рядом с эксплантами. Таким образом, экспланты не будут подниматься вверх при добавлении оставшейся полной среды. - Верните камеру в инкубатор и инкубируйте в течение 2 ч, чтобы органы прочно прикрепились ко дну камеры.
- Извлеките среду и осторожно добавьте 300 мкл свежей предварительно нагретой полной среды с помощью пипетки на 100 мкл или 200 мкл. Не используйте пипетку объемом 1 мл.
ПРИМЕЧАНИЕ: Если требуется предварительная обработка, через 2 часа после добавления добавьте 300 мкл полной среды, содержащей интересующее вещество. Если используется 4-луночная камера, используйте до 500 мкл/лунку. - Верните камеры в инкубатор.
5. Испытание ототоксическими агентами
- Оставьте экспланты на ночь, чтобы они адаптировались к условиям культуры и восстановились.
- Подготовьте различные концентрации ототоксических агентов, чтобы найти подходящую концентрацию для создания ототоксической модели с потерей примерно 50% волосковых клеток. Используйте от 50 мкМ до 250 мкМ для гентамицина и от 40 мкМ до 320 мкМ для цисплатина. Готовьте растворы цисплатина свежими, и защищайте их от света.
- Удалите среду и осторожно добавьте 300 мкл среды, содержащей желаемый ототоксический препарат.
- Инкубируют экспланты с гентамицином и цисплатином при 37 °C в течение 24–48 ч для определения выживаемости волосковых клеток.
ПРИМЕЧАНИЕ: Концентрации препарата и время экспозиции выбираются в зависимости от цели исследования. Сохранность эксплантов здесь проверялась до 72 ч. Не используйте сыворотку, если планируете проводить длительное бактериологическое исследование. - Следуйте следующему разделу, чтобы окрасить клетки улитки.
6. Фиксация и иммунофлюоресценция
- В конце эксперимента выбросьте среду и сразу же промойте экспланты 200 мкл предварительно подогретого 1x PBS.
- Зафиксируйте экспланты 200 мкл 4% параформальдегида (PFA) в течение 15 мин под химическим вытяжным шкафом.
ВНИМАНИЕ: PFA является опасным химическим веществом; прочтите паспорт безопасности материала (MSDS) перед первой работой с PFA. - Дважды промойте экспланты 200 мкл 1x PBS. Храните эксплантаты в 1x PBS при температуре 4 °C на случай, если процедуры окрашивания придется отложить.
- Приготовьте раствор для пермеабилизации, состоящий из 1x PBS и 1%-5% Triton-X100.
- Выбросьте 1x PBS, добавьте 200 мкл раствора пермеабилизации и инкубируйте экспланты в течение 15 минут.
- Приготовьте раствор для блокировки.
- Для органа эксплантатов корти приготовьте блокирующий раствор, состоящий из 1x PBS, 10% нормальной козьей сыворотки (NGS, для козьих вторичных антител, или другой сыворотки того же вида, что и вторичные антитела). В качестве альтернативы можно использовать 1%-5% бычий сывороточный альбумин (БСА), если клетки окрашены только фаллоидином.
- Для кохлеарных эксплантов приготовьте блокирующий раствор, состоящий из 1x PBS, 10% NGS и фрагмента Fab (Fab fragment goat-anti mouse IgG H+L, разведение 1:200) при использовании мышиных первичных антител (например, мышиного анти-TuJ1) для окрашивания спиральных ганглиозных клеток.
- Добавьте 200 мкл блокирующего раствора и инкубируйте экспланты в течение 1 ч.
- Откажитесь от решения для блокировки. К эксплантам, инкубированным с фрагментом Fab, добавляют 200 мкл 4% PFA и инкубируют в течение 5 мин.
- Промойте экспланты 1x PBS в течение 5 минут.
- Приготовьте раствор антител, состоящий из 1x PBS, 5% NGS и 0,1%-0,25% Triton-X100.
- Разбавьте первичное антитело в растворе антител - MYO7A (ab3481 в разведении 1:500 или MYO7A 138-1 в 1:100) - для мечения волосковых клеток и TuJ1 (1:400) для мечения нейронов спиральных ганглиозов.
ПРИМЕЧАНИЕ: Если волосковые клетки помечены только фаллоидином, разбавьте фаллоидин в соотношении 1:150 в 1x PBS, инкубируйте от 40 мин до 1 ч при комнатной температуре и переходите к шагу 6.22. - Включите контроль неспецифического связывания вторичного антитела, опустив первичное антитело.
- Добавьте 170 мкл раствора антител с первичным антителом в соответствующую лунку и инкубируйте в течение ночи при 4 °C при легком встряхивании (40-60 об/мин).
- Промойте экспланты 4 раза по 5 минут каждый с помощью 1x PBS.
- Разбавьте вторичное антитело в растворе антител (например, козий антикроличий Alexa Fluor 488 или козий антимышиный Alexa Fluor 568 IgG в разведении 1:500).
- Добавьте 170 мкл раствора антител со вторичным антителом и инкубируйте в течение 1 ч при комнатной температуре.
ПРИМЕЧАНИЕ: Начиная с этого этапа, защищайте эксплантаты от длительного воздействия света. - Промойте экспланты 2 раза по 5 минут каждый с помощью 1 PBS.
- Переходите к следующему шагу для последовательной двойной маркировки эксплантов. Инкубируют со вторым первичным антителом (например, MYO7A для волосковых клеток) в течение ночи при 4 °C при легком встряхивании (40-60 об/мин). В качестве альтернативы инкубируют с фаллоидином (1:150) в течение от 40 мин до 1 ч при комнатной температуре и переходят к шагу 6.22.
ПРИМЕЧАНИЕ: Выполняйте последовательное мечение, если первичные антитела принадлежат одному и тому же виду хозяина. Выполняйте мечение фаллоидином в конце для мультиплексной иммунофлюоресценции. - Промойте экспланты 4 раза по 5 минут каждый с помощью 1x PBS.
- Разбавьте вторичное антитело в растворе антител (например, козий антикроличий Alexa Fluor 488 или козий антимышиный Alexa Fluor 568 IgG в разведении 1:500).
- Добавьте 170 мкл вторичного антитела и инкубируйте в течение 1 ч при комнатной температуре.
- Промойте экспланты 2 раза по 5 минут каждый с помощью 1 PBS.
- Приготовьте исходный раствор DAPI в концентрации 1 мг/мл и храните при температуре −20 °C. Разбавляют исходный раствор DAPI в соотношении 1:10 для приготовления рабочих растворов 0,1 мг/мл и хранят при температуре 4 °C.
ПРИМЕЧАНИЕ: Пропустите шаг 23 и перейдите к шагу 26, если используется монтажный носитель, содержащий DAPI. - Разбавьте рабочий раствор DAPI 1:100 в 1x PBS и инкубируйте экспланты с 200 мкл раствора DAPI в течение 5 мин.
- Промойте экспланты 2 раза по 5 минут каждый с помощью 1 PBS.
- Снимите 1x PBS настолько, насколько это возможно, чтобы дно камеры высохло. Не допускайте высыхания экспланта.
- Подождите 2-5 секунд и добавьте одну каплю монтажной среды непосредственно на эксплант.
ПРИМЕЧАНИЕ: Монтажная среда на экспланте останется на месте из-за поверхностного натяжения. Можно использовать закаливающую монтажную среду. - Храните камеры при температуре 4°C до получения изображения.
7. Иммунофлуоресценция живых клеток из эксплантов
- Используйте изолированные экспланты после ночной инкубации.
- Удалите среду и осторожно добавьте 300 мкл среды, содержащей 125 мкМ цисплатина.
- Инкубируйте экспланты в течение 18 ч, чтобы измерить митохондриальный супероксид в живых эксплантах.
- Утилизируйте среду по окончании воздействия препарата.
- Добавьте 300 мкл проницаемого зонда для обнаружения клеточных АФК (например, 250 нМ митогидроэтидина) и/или каспазы-3 (например, пептида DEVD 2 мкМ, конъюгированного с красителем, связывающим нуклеиновую кислоту).
- Инкубируют при 37 °C в течение 30 мин.
- Дважды осторожно промойте экспланты 200 мкл теплого сбалансированного раствора соли Хэнка (HBSS) или подходящим буфером.
- Визуализация клеток в течение 2 ч с возбуждением флуоресценции на длине волны 400 нм и детектированием излучения на длине волны 590 нм.
- В конце эксперимента выбросьте среду и сразу же промойте экспланты 200 мкл предварительно подогретого 1x PBS.
- Зафиксируйте эксплантаты и окрасьте клетки улитки, как описано выше.
8. Визуализация с помощью конфокальной визуализации
- Изображение эксплантатов получают с помощью микроскопа, оснащенного конфокальным блоком с вращающимся диском, или конфокального микроскопа, оснащенного конфокальным блоком точечного сканирования.
- Получение изображений с помощью вращающегося диска с 20-кратным воздушным объективом (числовая апертура: 0,75) для подсчета клеток. В качестве альтернативы можно получить изображения с помощью точечного сканирующего конфокального микроскопа с 40-кратным воздушным объективом (числовая апертура: 0,95) или 100-кратным масляным объективом (числовая апертура: 1,45) для визуализации и подсчета синапсов или изображения стереоцилий.
ПРИМЕЧАНИЕ: Отрегулируйте интенсивность лазерного излучения и время экспозиции для каждого канала, чтобы избежать перенасыщения и недонасыщения изображений. Примените одни и те же настройки ко всем эксплантам одного эксперимента. - Настройте микроскоп для получения 3D-изображения всей кохлеарной эксплантации с помощью 20-кратного воздушного объектива, z-стека и инструментов автоматического сшивания. Используйте 3 x 3 смежных поля с перекрытием 15% для эксплантов мыши и 4 x 4 смежных поля для эксплантов крыс, которые нужно сшить вместе.
- Отрегулируйте изображения с помощью программного обеспечения микроскопа или бесплатного программного обеспечения FIJI с открытым исходным кодом8.
ПРИМЕЧАНИЕ: Деконволюция, метод обработки изображений, может быть применен к конфокальным изображениям для повышения их контрастности и разрешения 9-11.
Результаты
Настоящий протокол был апробирован на улитке новорожденных мышей и крыс. В данной работе представлены изображения эксплантов из различных экспериментов. Экспланты кортианского органа подвергались воздействию гентамицина или цисплатина, и наблюдалась потеря волосяных клеток. Экспланты кортиевского органа сохраняли свою структуру и общую длину как в нормальных, так и в стрессовых условиях (рис. 1 и рис. 2). Уцелевшие волосковые клетки по всей длине эксплантов крыс, ранее подвергшихся воздействию цисплатина, были индивидуально обнаружены (рис. 1). Помимо обнаружения выживших волосковых клеток, были обнаружены также волосковые клетки, подвергающиеся апоптозу (рис. 2). Такой подход облегчает визуализацию и подсчет выживших клеток, что может быть выполнено с использованием подхода глубокого обучения, как описано ранее12. Также удалось обнаружить биологические процессы в живых клетках улитки с помощью соответствующих проницаемых для клеток зондов (рис. 3).
В случае кохлеарных эксплантов, содержащих нейроны спиральных ганглиозов, экспланты могут быть разрезаны на две части или область верхушки могут быть отрезаны для обеспечения лучших условий культивирования. Здесь мы решили выделить область апекса, потому что она меньше подвержена влиянию стрессовых условий. На рисунке 4 показаны основание и медиальная области кохлеарных эксплантов. Обнаружены волосковые клетки, помеченные маркером волосковых клеток MYO7A. Аналогичным образом были идентифицированы здоровые и поврежденные спиральные ганглиозные клеточные тела и нейриты, меченные нейрональным маркером TuJ1. Анализ спиральных ганглионарных областей может быть выполнен вручную или с помощью программного обеспечения с открытым исходным кодом, такого как FIJI с плагином NeuronJ для трассировки нейритов13 или расширений, таких как TrackMate и Cellpose для морфологической сегментации14,15. Более тщательное изучение эксплантов мышей выявило высокую разрешающую способность кохлеарных клеток и стереоцилии волосковых клеток (рис. 5).
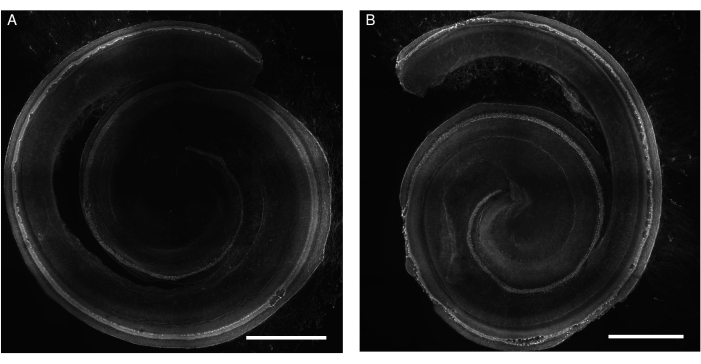
Рисунок 1: Экспланты кортиевского органа у крыс, подвергшихся воздействию гентамицина. Репрезентативные изображения (проекция максимальной интенсивности) (А) контрольных и (Б) гентамицинов-экспонированных (200 мкМ в течение 24 ч) эксплантов. Волосковые клетки помечены фаллоидином и могут быть визуализированы по всей длине улитки. Для лучшей иллюстрации изображение выполнено в серых тонах. Изображения получены с помощью вращающегося дискового конфокального микроскопа с объективом 20x (числовая апертура: 0,75). Масштабная линейка = 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
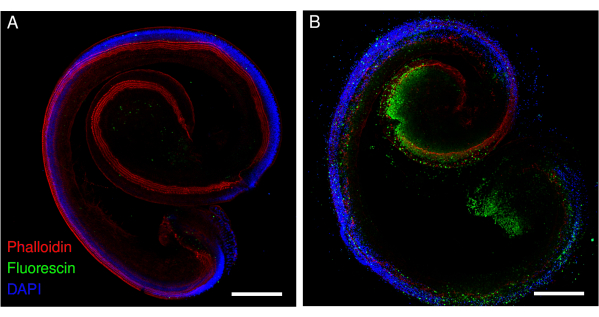
Рисунок 2: Экспланты кортиевского органа у мышей, подвергшихся воздействию цисплатина. Репрезентативные изображения (проекция максимальной интенсивности) (А) контрольных и (Б) цисплатинов, экспонированных (160 мкМ в течение 48 ч) эксплантов. Волосковые клетки помечены фаллоидином (красным), а апоптотические волосковые клетки помечены флуоресцином. Изображения были получены с помощью конфокального микроскопа с точечным сканированием и 20-кратным объективом (числовая апертура: 0,75). Масштабная линейка = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
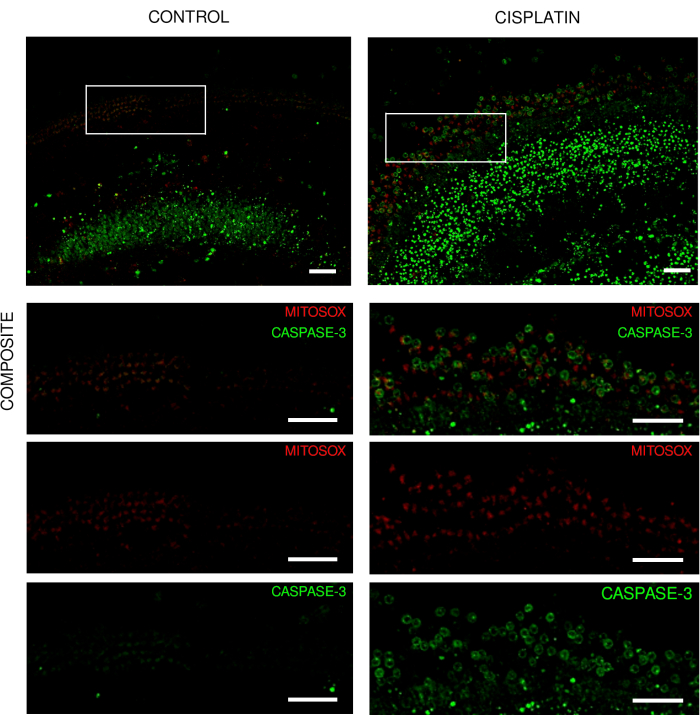
Рисунок 3: Экспланты кортиевского органа из экспериментов по визуализации в реальном времени. Репрезентативные изображения (проекция максимальной интенсивности) эксплантов диких мышей, показывающие (А) контрольные экспланты и (Б) экспланты при воздействии цисплатина 125 мкМ в течение 18 ч. Волосковые клетки мечены митогидроэтидином и каспазой-3. Изображения были получены с помощью конфокального микроскопа с вращающимся диском и 20-кратного объектива (числовая апертура: 0,75). Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
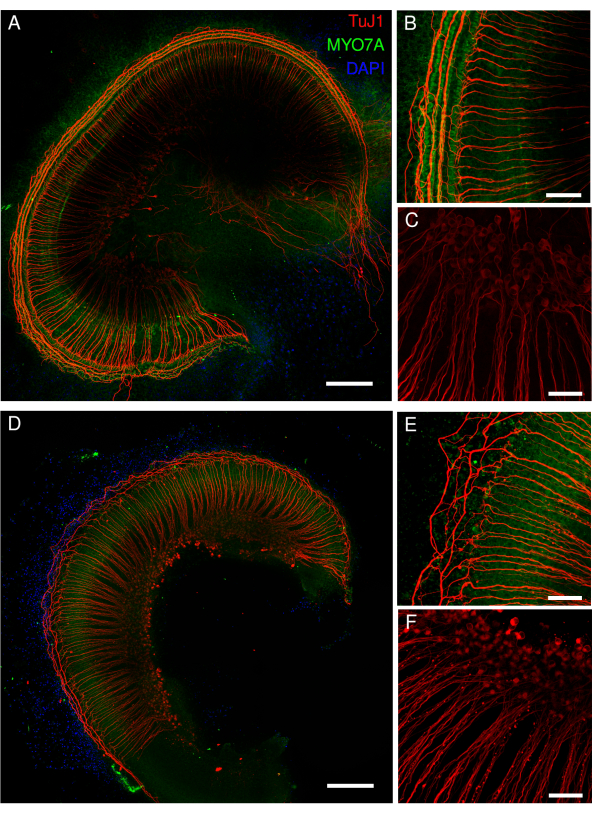
Рисунок 4: Кохлеарные эксплантаты мышей с нокаутом STAT1, подвергшихся воздействию цисплатина. Репрезентативные изображения (проекция максимальной интенсивности) (A) контрольных эксплантов и (D) эксплантов, подвергшихся воздействию 40 мкМ цисплатина в течение 48 ч. Тела волосковых клеток помечены антителом MYO7A (зеленый), а спиральные ганглиозные клетки — антителом TuJ1 (красный) и ядерной меткой DAPI (синий). Изображения были получены с помощью конфокального микроскопа с точечным сканированием и 20-кратного объектива (числовая апертура: 0,75) с дополнительным зумом 2,15 (B, C, E, F). Масштабная линейка = (B,C,E,F) 50 мкм и (A,D) 200 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
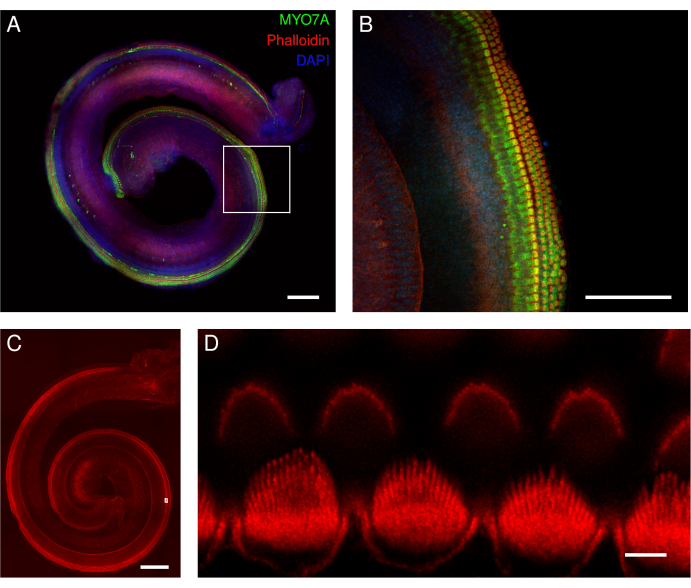
Рисунок 5: Мышиный орган кортиевских эксплантов. (А-Д) Репрезентативные изображения (проекция максимальной интенсивности) эксплантов дикого типа в полный рост. (А,Б) Экспланты были помечены антителами MYO7A, фаллоидином и ядерной меченицей DAPI. (B) В увеличенном обзоре хорошо видны тела волосковых клеток, помеченных антителами MYO7A (зеленого цвета). (С,Д) Фаллоидин помечает стереоцилии и кутикулярную пластинку волосковых клеток. Эксплантаты были помечены фаллоидином. (D) В увеличенном обзоре деконволютированные изображения отдельных внутренних стереоцилий волосковых клеток хорошо идентифицируются (нижний ряд), в то время как отдельные наружные стереоцилии волосковых клеток труднее очерчены (верхний ряд). Изображения на панелях А и С были получены с помощью конфокального микроскопа с вращающимся диском и объективом 20x (числовая апертура: 0,75). Изображение на панели B было получено с помощью того же микроскопа, но с 40-кратным воздушным объективом (числовая апертура: 0,95). Изображение на панели D было получено с помощью точечного сканирующего конфокального микроскопа и 100-кратного масляного объектива (числовая апертура: 1,45) с дополнительным зумом 3,46. Сканирование было усреднено четыре раза на участок XY, а размер пикселя составил 0,02 мкм. Масштабные линейки = (D) 3 мкм, (B) 100 мкм и (A,C) 200 мкм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Цель обновления этого протокола состояла в том, чтобы упростить этапы от изоляции эксплантов до визуализации живых и фиксированных кохлеарных клеток. Мы усовершенствовали некоторые этапы изоляции и внедрили некоторые инновационные инструменты с целью создания эффективного и бесперебойного протокола для получения высококачественных эксплантов. Описанный метод является оптимизированным протоколом из предыдущих отчетов 4,5. Кроме того, в некоторых современных исследованиях отсутствует поэтапно обновляемый протокол. Благодаря упрощенным этапам культивирования эксплантов этот протокол обеспечивает легкую работу с хорошо сохранившимися эксплантами, что важно для воспроизводимых данных. Внедрение многолуночных камер с полимерным покровным стеклом для эксплантов внутреннего уха улучшает прикрепление органа и сохранение интактных эксплантов. Здесь мы приводим несколько примеров экспериментов в условиях стресса, чтобы продемонстрировать, что органы в культуре сохраняют свою клеточную организацию, несмотря на потерю волосковых клеток и повреждение нейритов.
Одной из сложностей при культивировании органов внутреннего уха является предотвращение отслоения и всплытия органов, так как это влияет на целостность эксплантатов, реакцию на лечение и последующие обследования. Ранее экспланты культивировали на стеклянных покровных стеклах 4,5. Несмотря на то, что культура на стеклянных поверхностях кажется хорошей альтернативой, нанесение покрытия на стекло занимает много времени, а сами покровные стекла хрупкие и нежные. Альтернативный протокол с использованием клеточных культур Millicell пытается решить эту проблему6. Тем не менее, разрезание и перенос мембраны с эксплантатами, по-видимому, является деликатным шагом в этом протоколе. Кроме того, экспланты могут быть повреждены во время монтажа и герметизации покровного стекла. В предлагаемом нами подходе, после того, как экспланты перемещены в камеры с поли-D-лизиновым покрытием и помещены в правильное положение, дальнейшее перемещение или покрытие покровными стеклами не требуется. Еще одним преимуществом этого протокола является использование камер с тонким газопроницаемым полимерным покровным стеклом, которое обеспечивает оптимальные условия культивирования для эксплантатов органов. Этот полимер обладает оптическими свойствами, аналогичными стеклу, что делает его пригодным для визуализации клеток в микроскопии высокого разрешения.
Добавление сыворотки в среду используется в большинстве протоколов культивирования клеток и тканей, включая культивирование эксплантов внутреннего уха с 1%-10% FBS 4,5,6,16. Наличие сыворотки влияет на культуральные условия проведения экспериментов; Таким образом, в определенных ситуациях предпочтение отдается посеву без сыворотки. Отсутствие сыворотки в культуре кохлеарных эксплантов замещали либо добавлением N2 к DMEM, либо добавлением N2 к среде Neurobasal-A 5,6. В связи с этим мы протестировали условия культивирования эксплантов с сывороткой и без нее. В обоих случаях клетки внутреннего уха были жизненно важными и реагировали на ототоксические условия. Мы протестировали эти условия в течение 72 ч, но экспланты могут сохраняться в культуре еще дольше, особенно при инкубации с безсывороточной средой вместе с N2, B27 и факторами роста, как было предложено в других исследованиях 5,16.
В дополнение к общим критическим этапам изоляции эксплантов внутреннего уха, таким как продолжительность изоляции органа и используемый антибиотик, в этом протоколе также есть некоторые критические шаги, которые, тем не менее, являются управляемыми. Один из важнейших этапов в этом методе связан с объемом среды, которая остается в камере после введения органа. Это было оптимизировано для сохранения эксплантатов живыми и прикрепленными к нижней поверхности. Еще один важный этап связан с инкубационным временем, необходимым для того, чтобы экспланты могли прикрепиться ко дну камеры. Инкубационное время более 2 ч с несколькими микролитрами среды может повлиять на здоровье эксплантатов. Также можно использовать более короткое время инкубации, например, 1 ч, при условии, что экспланты не отделяются. Еще одним важным аспектом являются остатки поли-D-лизина. Следует строго соблюдать этапы промывки поли-D-лизина, поскольку остатки бромистой соли поли-D-лизина могут быть токсичными для клеток. После точного выполнения этапов промывки покрытие поли-D-лизином способствует плавному приклеиванию эксплантов к камерам, что позволяет исправить положение до того, как они прочно прикрепятся к дну камеры.
Одним из ограничений этого метода является визуализация клеток с помощью вертикальной микроскопии. Это может быть важной проблемой для лабораторий с инвертированными микроскопами. Стеклянные предметные стекла со съемными силиконовыми камерами могут использоваться для вертикальной и инвертированной микроскопии; тем не менее, наши условия покрытия поли-D-лизином должны быть сначала протестированы. Еще одним ограничением является хранение камер, поскольку вкладыши не снимаются, а общая высота одной камеры с крышкой составляет почти 11 мм по сравнению с высотой 1 мм стандартного предметного стекла микроскопа. Тем не менее, 8-луночная камера занимает меньше места, чем 4-луночные планшеты, предложенные до16.
Мы представляем здесь изображения, полученные с помощью двух микроскопов. В то время как конфокальный микроскоп с точечным сканированием обеспечивает изображения тканей с высоким разрешением благодаря тонкому оптическому сечению, конфокальный микроскоп с вращающимся диском обеспечивает более быстрое время визуализации с хорошим разрешением. Стереоцилии внутренних волосковых клеток (ВПХ) и наружных волосковых клеток (ВГК) визуализируются с помощью конфокальной микроскопии. Поскольку стереоцилии ИГХ больше, чем у ВГК, они неоднократно и хорошо визуализировались в данной работе. Для стереоцилии OHC другие альтернативные микроскопы могут улучшить визуализацию, такие как микроскопия сверхвысокого разрешения (SRM). Изображений эксплантов, полученных с помощью микроскопа с вращающимся диском, достаточно для простой интеграции автоматизированного подсчета волосковых клеток с использованием подхода глубокого обучения12. Кроме того, короткое время сбора данных важно для экспериментов с живыми клетками и тканями. Кроме того, этот протокол не ограничивается неонатальными кохлеарными эксплантами. При некоторой оптимизации можно культивировать и другие экспланты, такие как вестибулярные органы или эмбриональные ткани.
Количественная оценка кохлеарных клеток, таких как волосковые клетки и нейроны, in vitro важна для оценки жизнеспособности клеток и, следовательно, процента поврежденных или потерянных клеток. Исследования сигнальных путей и функций клеток помогают выявить механизмы гибели и выживания. Исследования эмбриональных и неонатальных кохлеарных тканей полезны для изучения стадий развития улитки. Таким образом, этот протокол поможет оптимизировать исследования in vitro эксплантов внутреннего уха, например, для создания ототоксических моделей, изучения стадий развития, оценки сигнальных путей и проведения скрининговых исследований лекарственных препаратов.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы хотели бы выразить признательность Ветеринарному центру Департамента биомедицины Базельского университета за поддержку в уходе за животными, Центру микроскопии, а также Службе информационных технологий Департамента биомедицины за техническую помощь, а также Швейцарскому национальному научному фонду (SNSF) за финансовую поддержку (стипендия MD-PhD для магистра, Номер гранта 323530_191222).
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL High-Clarity Polypropylene Conical Tube 17 x 120 mm style | FALCON | 352096 | |
| 45° Angled Forceps | Fine Science Tools | 11251-35 | |
| 50 mL Polypropylene Conical Tube 30 x 115 mm style | FALCON | 352070 | |
| Antifade Mounting Medium | VECTASHIELD | H-1000 | |
| Alexa Fluor 568 phalloidin | Thermofisher | 2151755 | |
| Anti-beta III Tubulin antibody [TUJ-1] | Abcam | ab14545 | |
| Antifade Mounting Medium With DAPI | VECTASHIELD | H-1200 | |
| Anti-myosin VII rabbit polyclonal | Abcam | ab3481 | |
| B-27 Supplement (50x), minus antioxidants | Thermofisher | 10889038 | |
| CARBON STEEL surgical blades 23 | Swann Moiton | 210 | |
| CellEvent™ Caspase-3/7 Green Detection Reagent | Thermofisher | C10723 | |
| DMEM/F-12/(1:1)(1x) + GlutaMAX | Thermofisher | 31331028 | |
| Double spatulas, one curved end | VWR | RSGA038.150 | |
| Ethyl alcohol 70% V/V 1,000 mL | bichsel | 160 0 106 00 | |
| Fetal Bovine Serum, certified | Thermofisher | 16000036 | |
| Fixative Solution 4% paraformaldehyde prepared in PBS | Thermofisher | 201255309/201255305 | |
| High Intensity Cold Halogen Light Source | Intralux® | 5100 | |
| Huygens Professional version 21.10 | Scientific Volume Imaging | ||
| ibidi µ-Slide 8 well | ibidi | 80826 | |
| microscope | LEICA | M80 | |
| microscope | LEICA | MS5 | |
| MitoSOX™ Red Mitochondrial Superoxide Indicator, for live-cell imaging | Thermofisher | M36008 | |
| N2 supplement (100x) | Thermofisher | 17502048 | |
| Nikon Eclipse Ti microscope with a Yokogawa CSU-W1 spinning disk confocal unit, and a Photometrics Prime 95B camera. | NIKON | ||
| Nikon Eclipse Ti microscope with an A1 point-scanning confocal unit | NIKON | ||
| Operating scissors | Fine Science Tools | 14005-16 | |
| Operating scissors | Fine Science Tools | 14088-10 | |
| Operating tweezers | Fine Science Tools | 11008-15 | |
| PBS pH 7.2 (1x), 500mL | Thermofisher | 20012-019 | |
| Penicillin | Sigma-Aldrich | P3032 | |
| POLY-D-LYSINE HYDROBROMIDE MOL WT GT 30 | Sigma-Aldrich | P7405 | |
| Scalpel Handle #4 | Fine Science Tools | 10004-13 | |
| Steri 250 Second sterilizer | Simon Keller AG | 031100 | |
| Sterilizer, desiccant pellets | Simon Keller AG | 31120 | |
| Tissue Culture Dish 60 x 15 mm | FALCON | 353802 | |
| Tissue Culture Dish 60 x 15 mm | FALCON | 353004 | |
| Trito X-100 | Sigma | T9284 | |
| Unconventional myosin-VIIa | Developmental Studies Hybridoma Bank | 138-1s | |
| WFI for Cell Culture[-]Antimicrobial, 500 mL | Thermofisher | A12873-01 |
Ссылки
- Mukherjea, D., et al. The design and screening of drugs to prevent acquired sensorineural hearing loss. Expert Opinion on Drug Discovery. 6 (5), 491-505 (2011).
- Takeda, H., Dondzillo, A., Randall, J. A., Gubbels, S. P. Challenges in cell-based therapies for the treatment of hearing loss. Trends in Neurosciences. 41 (11), 823-837 (2018).
- Schacht, J., Talaska, A. E., Rybak, L. P. Cisplatin and aminoglycoside antibiotics: Hearing loss and its prevention. The Anatomical Record. 295 (11), 1837-1850 (2012).
- Parker, M., Brugeaud, A., Edge, A. S. Primary culture and plasmid electroporation of the murine organ of Corti. Journal of Visualized Experiments. (36), e1685 (2010).
- Landegger, L. D., Dilwali, S., Stankovic, K. M. Neonatal murine cochlear explant technique as an in vitro screening tool in hearing research. Journal of Visualized Experiments. (124), e55704 (2017).
- Ogier, J. M., Burt, R. A., Drury, H. R., Lim, R., Nayagam, B. A. Organotypic culture of neonatal murine inner ear explants. Frontiers in Cellular Neuroscience. 13, 170 (2019).
- Durbin, J. E., Hackenmiller, R., Simon, M. C., Levy, D. E. Targeted disruption of the mouse Stat1 gene results in compromised innate immunity to viral disease. Cell. 84 (3), 443-450 (1996).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Etournay, R., et al. Cochlear outer hair cells undergo an apical circumference remodeling constrained by the hair bundle shape. Development. 137 (8), 1373-1383 (2010).
- MacDonald, G. H., Rubel, E. W. Three-dimensional imaging of the intact mouse cochlea by fluorescent laser scanning confocal microscopy. Hearing Research. 243 (1-2), 1-10 (2008).
- Sibarita, J. B. Deconvolution microscopy. Advances in Biochemical Engineering/Biotechnology. 95, 201-243 (2005).
- Cortada, M., Sauteur, L., Lanz, M., Levano, S., Bodmer, D. A deep learning approach to quantify auditory hair cells. Hearing Research. 409, 108317 (2021).
- Meijering, E., et al. Design and validation of a tool for neurite tracing and analysis in fluorescence microscopy images. Cytometry A. 58 (2), 167-176 (2004).
- Ershov, D., et al. TrackMate 7: Integrating state-of-the-art segmentation algorithms into tracking pipelines. Nature Methods. 19 (7), 829-832 (2022).
- Stringer, C., Wang, T., Michaelos, M., Pachitariu, M. Cellpose: A generalist algorithm for cellular segmentation. Nature Methods. 18 (1), 100-106 (2021).
- Zhang, L. W., Cang, X. H., Chen, Y., Guan, M. X. In vitro culture of mammalian inner ear hair cells. Journal of Zhejiang University of Science B. 20 (2), 170-179 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены