Method Article
大肠杆菌长期进化实验中的每日转移、存档种群和测量适应性
摘要
该协议描述了如何通过执行其日常转移和定期冷冻来维持 大肠杆菌 长期进化实验(LTEE),以及如何进行竞争测定以测量进化细菌的适应性改善。这些程序可以作为研究人员开始自己的微生物进化实验的模板。
摘要
长期进化实验(LTEE)跟踪了十二个 大肠杆菌 种群,因为它们已经适应了简单的实验室环境超过35年和77,000个细菌世代。LTEE中使用的设置和程序是研究微生物进化的可靠和可重复方法的缩影。在该协议中,我们首先描述了LTEE群体如何转移到新鲜培养基中并每天培养。然后,我们描述了如何定期检查LTEE种群是否有可能的污染迹象并存档,以提供永久冻结的"化石记录"以供以后的研究。这些程序中包含的多种保护措施旨在防止污染,在发生各种问题时检测问题,并从中断中恢复,而不会明显阻碍实验进度。在LTEE中监测进化变化的整体节奏和特征的一种方法是测量实验中种群和菌株的竞争适应性。我们描述了如何进行共培养竞争测定,并提供电子表格和R包(fitnessR)用于根据结果计算相对适应性。在LTEE的过程中,一些人群的行为以有趣的方式发生了变化,全基因组测序等新技术为研究种群如何进化提供了额外的途径。最后,我们将讨论如何更新原始LTEE程序以适应或利用这些变化。该协议对于使用LTEE作为模型系统来研究进化与遗传学,分子生物学,系统生物学和生态学之间联系的研究人员非常有用。更广泛地说,LTEE为那些正在开始自己的进化实验的人提供了一个行之有效的模板,新的微生物,环境和问题。
引言
1988年2月,Richard Lenski在加州大学欧文分校接种了12个装有确定葡萄糖限制生长培养基的烧瓶,并接种了大 肠杆菌 的克隆培养物1。第二天,他将每个烧瓶中1%的培养物转移到一组含有新鲜生长培养基的新烧瓶中。这种1:100的稀释允许细菌种群在耗尽可用葡萄糖之前扩大100倍,相当于大约62/3代细胞分裂。第二天重复了这个程序,从那以后每天都重复,有几次中断。即使实验搬迁,这些日常转移仍在继续,首先是 1992 年的密歇根州立大学,然后是 2022 年的德克萨斯大学奥斯汀分校。与此同时,新的突变不断在这些 大肠杆菌 种群中产生遗传变异,自然选择导致进化的细胞超越了它们的祖先。
Lenski设计了这个实验,现在被称为长期进化实验(LTEE),以研究进化的动力学和可重复性。为了回答这些问题,他在实验装置及其协议的设计中加入了几个重要功能2。其中一个特征是仔细选择模式生物。最初的十二个种群都是从具有直接共同祖先的大 肠杆菌 B菌株REL606的单个菌落开始的。选择这种菌株是因为它已经在实验室环境中普遍使用,完全无性繁殖,并且不含质粒或完整的噬菌体3,4 - 所有这些都使研究其进化变得更加简单。简化实验的另一种选择是在生长培养基中使用非常低浓度的葡萄糖来限制生长后每个烧瓶中细胞的密度。使用低细胞密度旨在通过减少种群内生态相互作用进化的可能性(例如,通过交叉喂养)来更容易分析种群适应性的变化5。
REL606由于araA基因的点突变而无法使用ʟ-阿拉伯糖作为碳和能量源(Ara−)。在开始LTEE之前,从REL6066中分离出具有恢复的araA序列的自发突变体,命名为REL607。REL607能够在阿拉伯糖(Ara+)上生长。REL606用于启动六个LTEE群体,REL607用于启动其他六个。阿拉伯糖不存在于LTEE期间使用的生长培养基中,因此在这些条件下REL607的行为与REL606相同。然而,当接种在阿拉伯糖四唑(TA)琼脂上时,Ara−和Ara+细胞分别形成红色和白色集落。这种区分两种祖先大肠杆菌菌株及其后代的方法非常有用。它可用于检测LTEE群体之间的交叉污染。它还有助于测量 Ara− 菌株或种群相对于 Ara+ 菌株或种群在相互竞争时的适应度。通过建立相反标记的竞争对手的共培养来测量适应性,然后监测红色和白色菌落的频率(通过在TA平板上散布培养物稀释液获得)在竞争者最初混合时与在与LTEE相同的条件下经过一个或多个生长周期后的变化。在每个生长周期中,更合适的细胞类型的代表性将增加。
LTEE的另一个关键特征是定期存档不断发展的种群样本。当与甘油等冷冻保护剂混合时,大肠杆菌细胞可以冷冻并随后复活7。作为LTEE协议的一部分,每75天(相当于大约500代),每个未转移到新烧瓶中的部分与甘油混合,在多个小瓶中分离,并储存在冰箱中。这种冻结的"化石记录"使研究人员能够对LTEE进行首次研究,其中他们从不同的时间点复活了进化的大肠杆菌种群,并将它们与祖先菌株竞争,以跟踪健康状况增加的速度1。随着冻结的"化石记录"的更多"阶层"被保存下来,适应性进化已被定期重新测量。从这些测量中得出的总体结论是,即使在相同的环境中经过如此多代的进化之后,LTEE的适应性至今仍在继续改善8,9,10。
是什么让LTEE持续了这么久?许多使其原始问题能够被提出和回答的相同功能也起到了安全措施和故障保险的作用,以防止由于运气不好、人为错误和世界事件而导致不可避免的中断。每天,当培养物转移到新鲜生长培养基时,进行转移的研究人员在Ara−和Ara+群体之间交替。然后,当种群被冷冻时,可以将它们接种在选择性和指示性琼脂上,以检查是否有任何"相邻"种群被意外交叉污染或混合(例如,白色菌落属于应该只形成红色菌落的种群)或被外来微生物污染(例如,意外的菌落形态或细胞密度)。如果种群受到损害,其祖先可以从冰箱中复活并代替其继续前进。因此,Ara标记和冷冻档案具有双重目的,既是实验资源,也是安全措施。
由于其历史保存完好且易于获取,LTEE样品已使用实验开始时不存在的技术进行了研究。例如,全基因组测序已被用于检查LTEE群体11,12,13,14,15的突变动力学,转录组学和核糖体分析已被用于检查基因表达的变化16,17。遗传工具已被用于重建因单个突变或几个进化突变的组合而不同的菌株,以了解它们对适应性和各种表型的影响18,19,20,21。来自冷冻"化石记录"的样本很容易补充,以便可以将实验历史的部分或全部副本运送到其他实验室。LTEE样本现在存在于除南极洲以外的所有大陆,并且正在由比实验本身更年轻的研究人员进行研究。LTEE的稳健方法以及从其历史记录中进化的大肠杆菌样品和菌株也成为进化实验的起点,检查其他问题和环境22,23,24,25,26,27,28,29。
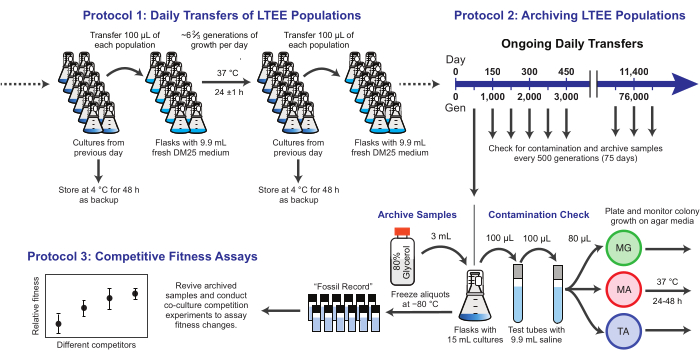
图 1:LTEE 程序概述。 请点击此处查看此图的大图。
在这里,我们展示了 大肠杆菌 长期进化实验中使用的三个核心协议(图1)。我们描述了:(1)如何进行日常转移,(2)如何存档群体样本和克隆分离株,以及(3)如何执行和分析共培养竞争测定以测量适应性差异。我们希望这些协议能够促进LTEE资源的持续使用,并为新的微生物进化实验的设计提供信息。
研究方案
1. LTEE人群的每日转移
注意:每天通过用前一天烧瓶中的1%培养物接种新鲜培养基来转移12个LTEE群体。 图 1 总结了此过程中的步骤。从菌株REL606开始的六个Ara− 群体被指定为A−1至A−6,从菌株REL607开始的六个Ara+ 群体被指定为A+1至A+6。严格遵守无菌技术以及转移人口的时间表和顺序,可将污染和其他中断的风险降至最低。
- 用 70% 乙醇或 10% 漂白剂溶液擦拭 LTEE 转移的表面,对进行 LTEE 转移的表面进行消毒。点燃本生燃烧器以产生局部上升气流并使玻璃器皿燃烧。
注意:戴上实验室手套以防止污染。为了明火周围的安全,仅使用由不易燃的丁腈等材料制成的手套至关重要。 - 准备 13 个 50 mL 硼硅酸盐锥形瓶,瓶盖 20 mL 硼硅酸盐或聚丙烯烧杯,这些烧杯已通过高压灭菌进行洗涤和灭菌。检查烧瓶是否有可见的碎屑,并更换任何不完全干净的烧瓶。
- 使用红色标记标记六个烧瓶 A−1 至 A−6,使用黑色标记标记其他六个烧瓶 A+1 至 A+6。标记最后一个剩余的烧瓶,该烧瓶为空白,日期为月/日格式和星期几。
- 使用无菌 10 mL 血清移液管向 13 个烧瓶中的每一个填充 9.9 mL DM25 培养基。取下用作盖子的烧杯后和更换烧杯之前,点燃每个烧瓶的口。在填充每个烧瓶之间点燃移液器的尖端。
注意:制作 DM25 的说明可在线获取30。如果使用塑料血清移液器,请放弃燃烧其尖端或限制在火焰中的时间,以避免塑料熔化。 - 从振荡培养箱中取出前一天的LTEE烧瓶。
- 通过将每个烧瓶举到灯光下来检查每个烧瓶以评估其浊度和颜色,检查烧瓶的完整性,并寻找异物的存在。
注意:肉眼可见,与空白相比,所有 Ara− 和 Ara+ 培养物看起来都会略微浑浊,但 A−3 除外,由于培养基中柠檬酸盐的生长,其浑浊度将比其他培养物多 ~10 倍。许多外部微生物污染物也能够在柠檬酸盐上生长,因此A−3以外的人群中浊度增加可能表明污染。有关转移前LTEE培养物的图像,请参阅 代表性结果 部分。 - 可选:通过将 1 mL 空白和 1 mL 每种培养物移液到 1 cm 塑料比色皿中,并在消隐仪器后使用分光光度计获取 600 nm (OD 600) 的光密度读数,确认每种 LTEE 培养物具有预期的浊度。
注意:对于刚开始使用LTEE并且不确定通过肉眼判断浊度以及记录和调查可疑异常的研究人员,这个额外的步骤非常有用。只有在完成当天的正常转移到新烧瓶(以下步骤)后,才从前一天的烧瓶中取样以测量OD 600,以最大程度地降低污染将继续繁殖的细胞群的风险如果OD 600值符合预期。有关LTEE培养物的典型OD600值,请参阅 代表性结果 部分。 - 使用带有无菌过滤器吸头的 P200 微量移液器,将每个 LTEE 烧瓶中的 100 μL 培养物转移到含有新鲜 DM25 的相应烧瓶中。从 A−1 开始,然后转移 A+1。之后,继续在 − 和 + 种群之间交替。为了跟踪哪些培养物被转移,在从烧瓶移液或移液到烧瓶后,将烧瓶向左移动。
注意:Ara− 和Ara+ 种群之间的严格转移和交替顺序有助于防止和检测交叉污染和混淆。遵守严格的无菌技术:每次转移使用新鲜的移液器吸头,在开盖后和重新盖上盖之前立即点燃烧瓶口,并在每次转移之间用 70% 乙醇润湿的无绒纸擦拭微量移液器的桶和喷射器。切勿使用漂白剂对微量移液器进行消毒,因为即使是微量也会杀死培养物。 - 将新接种的烧瓶在37°C下孵育24±1小时,以120rpm的轨道振荡在1英寸直径上。
- 将前一天的培养物储存在4°C。 将这些备份区域性保留两天。丢弃三天前在4°C下保存的旧培养物。
注意:前两天的培养物提供了两套完整的备份,如有必要,如果发生任何问题或事故,或者在转移之前发现前一天培养物的污染(例如,奇怪的颜色或意外的颗粒),则可以重新启动实验。 - 在转移日志笔记本中输入时间、日期、转移编号、进行转移的研究人员的姓名或首字母缩写、培养物是否正常以及任何其他相关信息。如果发生以下任何一种情况,请继续执行步骤 1.12-1.14:(1) 前一天的空白被污染,(2) 烧瓶或其盖子破裂或破裂,(3) 烧瓶含有异物,(4) 烧瓶在转移过程中翻倒或掉落,或 (5) 有任何其他事件或观察结果使继续使用这些烧瓶值得怀疑。
- 如果前一天的LTEE培养物有任何问题,事故或怀疑污染,请不要从中转移。相反,将整套十二种培养物储存在4°C,以供以后检查和进一步表征。
- 检索含有从前一天转移并储存在4°C的备份培养物的烧瓶。 将它们放在工作台上加热至室温。轻轻旋转每个烧瓶以重悬细胞。
- 从备用烧瓶转移到含有新鲜培养基的新烧瓶中,并按照步骤1.6-1.11中的描述正常继续实验。在传输日志中记下使用了备份区域性,并记录与前一天相同的传输编号。
注意:即使仅在一个群体的烧瓶中发现问题,也要从备用烧瓶中转移所有十二个种群,以便所有种群中经过的世代数保持相位。如果在储存在4°C的备用烧瓶中发现污染,则必须使用步骤3.1-3.2中描述的程序从冷冻种群中重新启动受影响的LTEE群体。LTEE的转移数不应增加,直到复兴后DM25中第一批培养物的生长。
2. 存档 LTEE 种群
注意:LTEE群体的样本每75次转移一次冷冻一次。在100倍转移稀释后,种群每天增长~6 2/3代,因此这一时期对应于~500代。在存档过程中,还将LTEE群体接种在不同类型的琼脂培养基上以检查污染。或者,可以从这些板中挑选代表性克隆并存档。 图 1 总结了这些步骤。
- 在计划冷冻的前一天或前几天,准备三种类型的琼脂平板:最小葡萄糖(MG),最小阿拉伯糖(MA)和阿拉伯糖四唑铵(TA)。每种类型的琼脂制作十二个盘子,外加一些额外的。同时准备至少 250 mL 的 0.85% (w/v) 无菌盐水和 50 mL 的 80% (v/v) 无菌甘油。
注意:所有介质和溶液的配方均可在线获取30.LTEE达到常规存档时间表的倍数500的前一天是自上次冻结以来的第74天加上 由于检测到或怀疑问题时从4°C备份烧瓶转移而增加的任何天数。 - 可选:如果从LTEE群体中存档克隆分离株,请准备额外的耗材:从每个群体中分离三个克隆需要72 MG板,80 mL 80%(v / v)甘油和370 mL DM1000。
- 在计划冻结的前一天执行每日LTEE转移的步骤1.2时,准备一组额外的十二个烧瓶。使用红色标记标记六个额外的烧瓶xA−1至xA-6,并使用黑色标记标记其他六个xA + 1至xA + 6。
注意:"x"表示额外的烧瓶集将用于存档,并将它们与另一组烧瓶区分开来,后者将用于并行继续LTEE的日常传输。 - 在执行每日LTEE转移的步骤1.4时,使用25 mL血清移液管用14.85 mL DM25填充每个额外的烧瓶。
- 按照步骤 1.5−1.11 中所述完成正常的 LTEE 传输。然后,重复步骤 1.8 的说明,但这次将前一天的每个 LTEE 培养物中的 150 μL 转移到将用于存档的 14.85 mL 新鲜 DM25 的额外烧瓶中。
注意:在此步骤和所有后续步骤中,请遵循这些准则避免污染和混淆。从总体 A−1 开始,然后转移 A+1,然后继续交替使用 − 和 + 种群。切换群体时,用蘸有 70% 乙醇的无绒纸擦拭微量移液器的桶和喷射器。移液后,将烧瓶和试管移入托盘或架子中,以跟踪已完成的转移。 - 将十二个烧瓶的一组孵育在37°C下存档24±1小时,120rpm轨道振荡,直径为1英寸,与步骤1.9中所述的十二个LTEE培养物和空白一起。
- 在冻结当天进行LTEE转移之前至少一小时准备电镀LTEE群体的用品。
- 选择12个MG,12个MA和12个TA琼脂平板。目视检查每个,以确保它没有任何明显的污染。
- 为十二个LTEE群体(A−1至A + 6)中的每个标示每种类型的板之一。
注意:标记板时,写在培养皿底部的侧面。这对于当人们想要从琼脂下方检查或拍摄它们时不遮挡菌落很重要。不要在盖子上写字,因为它们可能会混淆。 - 将琼脂平板置于37°C培养箱中至少20分钟以加热它们,然后再在步骤2.10中使用它们。
- 准备24个含有9.9毫升盐水的试管。将它们排列在十二组中,每组两管。
- 以与平板相同的方式标记两组十二个试管中的每一个,在LTEE群体标识符下方添加"1"或"2",以指定它们用于稀释该群体的顺序。
- 使用烧瓶执行步骤1.1-1.11,该烧瓶将像往常一样继续LTEE的日常转移。在步骤1.5中,还从振荡培养箱中取出含有额外培养物的十二个烧瓶以进行存档。
- 从 12 个附加烧瓶中的每一个移取 100 μL 培养物,以存档到该 LTEE 群体的第一对盐水试管中。用这些100倍稀释液彻底涡旋管。然后,从每个管中移取 100 μL 到相应的第二管盐水中。彻底涡旋最终的10,000倍培养稀释液。
- 从含有 10,000 倍培养稀释液的每个试管中吸取 80 μL,到该群体的标记 TA、MG 和 MA 板中。根据需要,使用无菌扩散棒或无菌扩散珠将液体均匀地散布在琼脂表面上。重复直到所有十二个群体都接种在所有三种类型的培养基上。
- 如有必要,让板干燥,直到琼脂上看不到液体。将平板倒置(琼脂面朝上)置于设置为37°C的重力对流培养箱中。
注意:倒置孵育板可防止琼脂变干,并防止冷凝物滴落到琼脂表面。在孵育过程中,液体中细胞在琼脂表面上的移动可能会涂片菌落并产生不正确的菌落计数。 - 将 3 mL 无菌 80% (v/v) 甘油添加到指定用于存档的 12 个额外烧瓶中。通过旋转和轻轻涡旋充分混合。
- 将每个烧瓶中的混合物分配到无菌冷冻管中,这些冷冻管已标记有样品的唯一标识符,样品所属的LTEE群体,冷冻的世代,它是混合(群体)样品以及日期。将 6 mL 移液到一个大瓶中,将 1.25 mL 移液到六个小瓶中。
注意:大瓶是工作原料。一个小瓶是备用的,以防工作库存耗尽或被污染。其他五个小瓶是可以发送到其他实验室的副本。 - 将填充的小瓶在-80°C冷冻。
- 孵育24小时和48小时后检查并记录TA,MG和MA平板上菌落的生长和形态。
注意:有关REL606和REL607祖先以及12个LTEE种群中的每一个在76,000代时形成的菌落的图像和描述,请参阅 代表性结果 部分。 - 可选:存档克隆分离物时,请执行以下步骤。
- 从MG平板中为每个LTEE群体挑选三个克隆分离株(集落),在新的MG板上分别划线,并在37°C下将这些平板孵育16-24小时。
注意:如果存在具有不同形态的菌落,LTEE 的标准做法是通过首先选择最常见的类型,然后从少数类型中选择更多菌落来采样以获得最大的多样性。还可以使用随机采样策略,在展开细胞之前在培养皿底部的底部标记点,然后在生长后选择离每个标记最近的分离菌落。 - 第二天,在新的MG板上划线每个板的代表性菌落,并在37°C下孵育这些板16-24小时。
- 第二天,将每个MG板中的一个分离菌落接种到含有10mL新鲜DM1000的烧瓶中。此外,用 10 mL DM1000 填充一个额外的烧瓶,作为未接种的空白以测试培养基污染。
- 将烧瓶在37°C孵育16-24小时,120rpm轨道振荡,直径为1英寸。
- 孵育后,向每个烧瓶中加入 2 mL 无菌 80% (v/v) 甘油并旋转混合。
- 将每个烧瓶中的 1.25 mL 等分试样分配到小的无菌小瓶中,标有每个克隆、其 LTEE 群体和起源生成、克隆样品和日期的唯一标识符。
- 将填充的小瓶在-80°C冷冻。
- 从MG平板中为每个LTEE群体挑选三个克隆分离株(集落),在新的MG板上分别划线,并在37°C下将这些平板孵育16-24小时。
3. 竞争性健身检测
注意:在LTEE中,生殖适应性是根据不同细菌在与每日转移相同的条件下在一个或多个24小时培养周期中实现的相对倍增数来量化的。具体来说,一个竞争对手与另一个竞争对手的相对适应度是他们在共同文化中正面竞争时实现的倍增率的比率。一对中的每个竞争对手可能是一个完整的群体,也可能是以前作为LTEE冷冻"化石记录"的一部分存档的克隆分离株。或者,一个或两个竞争对手可能是经过基因改造以添加或删除特定突变以测试其效果的克隆。两个竞争者必须具有相反的Ara+/Ara− 状态,因为该遗传标记用于在此测定过程中区分它们。竞争分析的总体工作流程如图 2所示。共培养阶段的持续时间可以从一天延长到三天(或更长时间),以提高在测试几乎均匀匹配的竞争对手之间的差异时适应性估计的精度。有关此协议的其他关键注意事项和可能的修改,请参阅 讨论 。
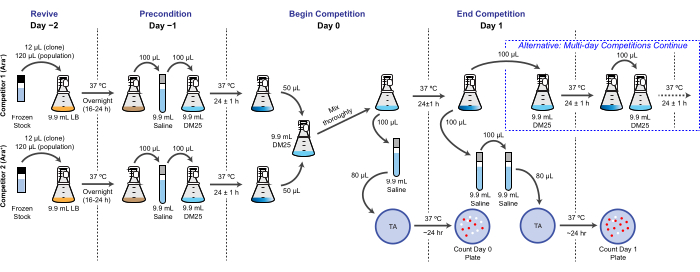
图 2:竞争测定流程图。 显示了为期一天的竞赛测定的完整程序。为期三天的程序在第1天和第2天继续使用替代途径,直到第3天以与一天比赛第1天相同的方式进行电镀。请点击此处查看此图的大图。
- 准备用品
- 确定将使用多少个竞争对手LTEE菌株和/或群体,以及将为每对竞争对手进行多少重复竞争测定。按照以下步骤中所述准备必要的用品。
注意:所有介质和溶液的配方均可在线获取30.比赛实验所有日子所需的烧瓶和试管可以事先填充,也可以在使用当天根据需要填充。如果提前填充烧瓶和试管,请将它们储存在室温下避光,以尽量减少蒸发。TA板需要至少在使用前两天准备,以便在倒入后足够干燥,以便进行培养稀释。始终准备一些额外的烧瓶、试管和 TA 板,以便在出现移液错误、污染板或其他小事故时可以继续实验。 - 对于复兴日(第 −2 天),用 20 mL 烧杯填充一个无菌 50 mL 锥形瓶,每株或 大肠杆菌 群体中加入 9.9 mL DM1000 或溶原肉汤 (LB),将用作竞争对手。用 9.9 mL 的相同培养基再填充一个烧瓶,作为未接种的空白。
- 对于预处理日(Day −1),每个竞争者用9.9 mL的0.85%(w / v)无菌盐水填充一个试管,在一对竞争者之间每次重复测定用9.9mL DM 25填充两个烧瓶,以及另一个装有9.9 mL DM 25的烧瓶用于空白。
- 在比赛开始的当天(第 0 天),用 9.9 mL DM25 填充一个烧瓶,用 9.9 mL 的 0.85% (w/v) 无菌盐水填充一个试管,每个比赛测定重复准备一个 TA 板。再用 9.9 mL DM25 填充一个烧瓶作为空白。
- 替代方案:对于超过第一天的多天比赛的每一天,每次比赛重复用 9.9 mL DM25 填充一个烧瓶,并用 9.9 mL DM25 再填充一个烧瓶以获得空白。
- 在比赛的最后一天(例如, 第 1 天或第 3 天),用 9.9 mL 的 0.85% (w/v) 无菌盐水填充两个试管,并为每个比赛重复准备一个 TA 板。
- 确定将使用多少个竞争对手LTEE菌株和/或群体,以及将为每对竞争对手进行多少重复竞争测定。按照以下步骤中所述准备必要的用品。
- 第 −2 天:在 DM1000 或 LB 中分别复活竞争对手
- 对于每个竞争对手,标记一个装满 9.9 mL DM1000 或 LB 的烧瓶。 标记一个装满来自同一批培养基的 9.9 mL 的额外烧瓶,作为未接种的空白以测试污染。
注意:冷冻原液在LB或DM1000中复活,以便更均匀和可预测地恢复冷冻保存的细胞。用作冷冻保护剂的甘油可以被 大肠杆菌代谢,如果在DM25中复活样品,这将导致细胞密度高于预期。LB和DM1000支持生长到如此高的细胞密度,以至于这种并发症可以忽略不计。 - 将含有竞争对手菌株冷冻原液的冷冻管从-80°C冰箱中取出。使用时将小瓶放在冰桶中冷藏。
- 每个冷冻原液解冻后,彻底涡旋以重悬 大肠杆菌 细胞。如果复活克隆,则用 12 μL 冷冻原液接种含有新鲜培养基的烧瓶。如果使种群复活,则用120μL冷冻原液接种烧瓶。
注意:将120μL体积的冷冻原液用于群体,因此当1%的LTEE群体转移到新烧瓶中时,复活的细胞数量与每日瓶颈大致相同。多次解冻和涡旋冷冻种群会给细胞带来压力,并随着时间的推移降低种群的生存能力。如果给定的LTEE种群或克隆将在比赛中多次使用,则最好重新生长和冷冻多个拷贝的种群,这样就不会多次解冻和重新冷冻单个拷贝。 - 将复活瓶和空白在37°C孵育过夜(16-24小时),以120rpm的轨道振荡1英寸直径。
- 对于每个竞争对手,标记一个装满 9.9 mL DM1000 或 LB 的烧瓶。 标记一个装满来自同一批培养基的 9.9 mL 的额外烧瓶,作为未接种的空白以测试污染。
- Day −1:在DM25中单独预条件竞争对手
- 对于每个参赛者,标记装有 9.9 mL 盐水的试管。对于一对竞争者之间的每次重复竞争测定,标记两个装满 9.9 mL DM25 的 50 mL 烧瓶,每个烧瓶都有重复编号和其中一个竞争者的名称。标记一个装满 9.9 mL DM25 的额外烧瓶作为空白。
- 将装有复活竞争对手培养物的烧瓶从培养箱中取出。用肉眼检查它们的浑浊度,以确认它们生长并且没有明显的污染。
- 从每个烧瓶中吸取 100 μL 到该竞争对手的生理盐水试管中。
注意:此步骤将培养物稀释100倍,这是必要的,因为LB和DM1000中的细胞密度远高于LTEE中使用的DM25环境(参见 代表性结果)。 - 在将稀释培养物中的 100 μL 移液到装有新鲜 DM25 的烧瓶中之前,彻底涡旋每个稀释管。为每个重复测定接种两个这些预处理瓶,每个竞争对手一个。
- 将预处理瓶和空白在37°C孵育24±1小时,以120rpm的轨道振荡在1英寸直径上。
- 第 0 天:通过混合竞争对手和盘子进行初始计数来开始比赛
- 对于每个竞赛测定重复,标记一个装有 9.9 mL DM25 的烧瓶和一个装有 9.9 mL 盐水的试管。以唯一标识每对竞争对手和竞争测定的重复编号的方式标记烧瓶和试管。标记一个装满 9.9 mL DM25 的额外烧瓶作为空白。
- 将预处理瓶从培养箱中取出。用肉眼检查它们的浑浊度,以确认它们生长并且没有明显的污染。
- 将 50 μL 的 Ara− 竞争物转移到装满新鲜 DM25 的第一个重复竞赛烧瓶中。立即将 50 μL Ara+ 竞争物转移到同一竞赛瓶中,并通过轻轻旋转进行混合。
- 对所有竞争对手对的所有重复重复步骤3.4.3。
注意:竞赛烧瓶现在具有在DM25中生长的大 肠杆菌 培养物的总体100倍稀释度,与LTEE中细胞在每次每日转移后经历的条件相同。执行传输和混合的顺序很重要。立即将两个竞争对手一个接一个地添加到每个烧瓶中,这样两者都不会在新鲜培养基中领先一步。例如,不要将 Ara− 培养物添加到所有竞赛培养瓶中,然后返回并添加所有 Ara+ 菌株。 - 从每个新接种的竞赛烧瓶中吸取 100 μL 到标记为该竞争测定重复的盐水试管中,以便这些试管中的每一个都含有合并的预处理 DM25 培养物的总体 10,000 倍稀释度。
- 将竞赛烧瓶和空白放入振荡培养箱中。将竞争烧瓶在37°C孵育24±1小时,120rpm轨道振荡直径为1英寸。
- 同一天,将竞赛烧瓶放入培养箱后,立即彻底涡旋步骤3.4.5中的每个试管,并按照步骤2.10所述将这些10,000倍稀释液的80μL散布在TA板上。用混合的一对菌株、重复编号和"第 0 天"标记每个板底部的侧面,以指示它将用于确定每个竞争对手的初始表示。
- 将TA板倒置在37°C的重力对流培养箱中孵育,直到Ara− 和Ara+ 竞争对手的菌落可见且可区分。一般来说,这发生在16-24小时内,但对于一些进化的菌株可能需要更长的时间。计算每个平板上Ara− (红色)和Ara+ (白色)菌落的数量并记录结果。
注意:即使将板储存在4°C下,TA板上Ara- 和Ara+ 菌落的颜色之间的差异也会随着时间的推移变得不那么明显,因此一旦从培养箱中取出,也需要尽快对其进行计数。显示由Ara− 和Ara+ 细胞形成的菌落的典型外观的TA板图像包含在 代表性结果中。该部分还包含常见"边缘情况"菌落的图像(例如,不同菌落类型的重叠或生长),并解释了如何计算它们。如果先前未表征任何竞争者在TA平板上形成的菌落的生长速率和形态,则在第0天从预处理瓶中散布80μL的10,000倍稀释盐水中,当竞争物仍然彼此分离时。然后,在37°C孵育16-24小时或更长时间后检查这些对照板上的菌落。
- 备选方案:第1天和第2天:继续为期三天的比赛
- 对于每个竞争测定重复,标记一个装有 9.9 mL DM 25 的烧瓶。以唯一标识每对竞争者、重复编号和竞争测定日期的方式标记烧瓶。标记一个装满 9.9 mL DM25 的额外烧瓶作为空白。
- 将前一天的竞赛瓶从培养箱中取出。用肉眼检查它们的浊度,以验证预期的生长并检测污染。
- 将每个竞赛烧瓶中的 100 μL 转移到相应的新鲜培养基烧瓶中,用于比赛的第二天。
- 将新的竞赛烧瓶和空白放入振荡培养箱中。将它们在37°C下孵育24±1小时,以120rpm的轨道振荡在1英寸直径上。
- 在比赛的第2天重复步骤3.5.1-3.5.4,然后再继续。
- 第 1 天或第 3 天:完成比赛并盘子进行最终计数
- 对于每个竞赛瓶,准备两个装有 9.9 mL 盐水的试管。以唯一标识每对竞争物、重复编号以及它们是用于第一次稀释还是第二次稀释的方式标记它们。
- 将竞赛烧瓶从培养箱中取出。用肉眼检查它们的浑浊度,以检测它们是否生长并且没有明显的污染。
- 从每个竞赛烧瓶中吸取 100 μL 到第一管生理盐水中进行重复。所得试管含有 100 倍稀释的 DM25 培养物。
- 涡旋每个 100 倍稀释管以使其充分混合,并将 100 μL 移液到第二管盐水中以进行重复。所得试管含有 10,000 倍稀释的 DM25 培养物。
- 彻底涡旋每个含有 10,000 倍稀释液的试管,并将其 80 μL 铺在 TA 板上,如步骤 2.10 中所述。用混合的一对菌株、重复编号标记每个板底部的侧面,为期一天的比赛为"第 1 天",为期三天的比赛为"第 3 天",以表明它将用于确定每个竞争对手的最终代表。
- 将TA板在37°C孵育,并计数生长后的Ara−和Ara+ 菌落,如步骤3.4.8中所述。
注意:在所有转移和电镀步骤中跟踪每个竞争测定的重复次数。混淆不同重复测定之间的最终计数和初始计数 - 即使相同的两个竞争对手在每一个中混合 - 将导致不正确的适应性估计。
- 计算和绘图适合度
- 如果使用 Excel 计算和绘制相对适应度,请下载 XLS 电子表格(补充文件 1)。如果使用 R,请安装 fitnessR 包31 并下载逗号分隔值 (CSV) 模板(补充文件 2),或按照其小插图中的说明生成此文件的新副本。
- 输入100的"转印稀释度",用于在下载文件中的指定细胞或列中进行的竞赛测定。输入参赛者共培养的每日生长周期总数作为"转移次数"(例如,为期三天的比赛为 3)。
- 在指定的单元格或列中输入每对竞争者的名称,参考菌株为"竞争对手1",测试菌株或群体为"竞争对手2"。
- 对于每个竞争测定重复,将相应的初始和最终菌落计数输入到下载文件的指定列中。
- 如果使用 Excel 电子表格,它现在将显示此估计值的平均相对适应度值和 95% 置信限。将不同竞争对手组合的结果复制到另一个工作表中,并创建一个汇总结果的图表。如果使用 R 分析数据,请按照 fitnessR 包的小插图中的说明执行这些计算,输出包含计算值的 CSV 文件,然后绘制结果。
结果
LTEE培养物的外观和浊度
由于DM25中的葡萄糖浓度低,完全生长的LTEE群体的浊度仅在12个烧瓶中的11个中几乎不可见。当用肉眼检查LTEE培养物的正常生长和污染迹象时(步骤1.6),每个含有LTEE群体的烧瓶应与空白并排比较(图3A)。例外是群体A-3,它进化为使用柠檬酸盐作为额外的碳和能量来源,因此达到更高的细胞密度32。REL606和REL607祖先菌株的DM25培养物的浊度与典型进化群体的浊度相似(图3B)。由于葡萄糖浓度较高,LTEE菌株和群体在DM1000中生长到更高的密度,并且在LB中具有更高的密度(图3B)。A−3 LTEE 群体的 DM25 培养物密度介于 DM25 和 DM1000 中 REL606 培养物的密度之间(图 3C)。

图3:LTEE培养物的外观 。 (A)在实验达到76,253 1/3代的当天,DM25生长24小时后含有十二个LTEE群体的烧瓶与空白一起图片。(B)含有在DM25,DM1000和LB中生长24小时的REL606和REL607祖先培养物的培养瓶与培养基空白一起图片。(C)并排放大同一烧瓶的图片,显示DM25中A−3群体烧瓶的浊度与DM25和DM1000中的REL606祖先相比如何。 请点击此处查看此图的大图。
分光光度计读数在DM25中生长的培养物在600nm(OD 600)处的光学密度(步骤1.7)与LTEE群体(图4A)及其祖先(图4B)的这些视觉观察结果相匹配。这些读数可用于在怀疑污染或错误时定量比较和记录生长情况。对于76,000至76,500代之间的LTEE种群的测量,我们发现A−3(进化为在柠檬酸盐上生长的种群)的OD600平均为0.223(0.218-0.227,95%置信区间)。其他11个群体的OD600平均为0.0252(0.0239-0.0265,95%置信区间)。在11个正常人群中,OD600读数有轻微但显着的差异(F10,88 = 5.1035, p = 7.5×10−6)。LTEE种群在大约5-6小时的孵化后达到固定期。如果它们在早上转移,则在当天下午中后期将可见增长。许多种类的微生物能够在柠檬酸盐上有氧生长。因此,A−3以外的人群浊度增加可能是外部污染的迹象。
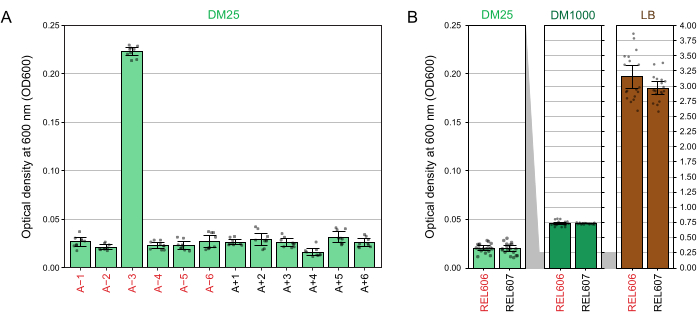
图4:LTEE培养物的浊度。 (A)实验的76,000至76,500代之间三个不同日子的24小时生长周期后12个LTEE群体在600nm处的光密度(OD 600)。三个不同日期中每个日期的三个 1 mL 等分试样的 OD 600 值绘制为点。从这些值中减去同一天三种不同等分试样的空白的平均OD 600值。填充条显示平均值。误差线是 95% 置信限。(B) DM25、DM1000和LB中REL606和REL607祖先的培养物的OD600。将每种条件和菌株在两种不同培养物的三个不同日期中每个日期的三个 1 mL 等分试样的 OD 600 值绘制为点。从这些值中减去同一天三种不同等分试样的空白的平均OD 600值。填充条显示平均值,误差条是 95% 置信限。面板之间的灰色阴影区域显示了 OD600 轴如何在 DM25 面板与 DM1000 和 LB 面板之间重新缩放。 请点击此处查看此图的大图。
LTEE菌落的生长和形态
当通过将种群接种在不同的培养基上来检查种群是否受到污染(步骤2.15)时,REL606和REL607祖先和所有进化的种群在最小葡萄糖(MG)琼脂平板上形成具有半透明和有些不规则边缘的白色菌落(图5A)。MG琼脂的组成与日常LTEE转移中使用的DM25相同,只是葡萄糖浓度更高,因此进化的LTEE群体通常在MG上形成比祖先更大的菌落。由于其在DM25中较高的细胞密度,如果A−3群体的接种体积与其他群体相同,则A−3群体将具有数倍的菌落,这可能会限制菌落的大小。最常见的污染微生物类型在MG上形成纯白色,不透明和完美的圆形菌落。
在最小的阿拉伯糖(MA)琼脂上,REL607祖先和Ara+ 种群通常都形成略微半透明的白色菌落。这种典型的生长模式在Ara+ 种群中持续了76,000代,除了A + 6,它在阿拉伯糖上进化出生长缺陷,并且在MA上不再形成菌落(图5B)。在DM25的LTEE转移过程中,没有选择维持阿拉伯糖的生长,因此随着实验的继续,其他Ara+ 群体也可能最终停止在MA琼脂平板上形成菌落。除A-3外,Ara− 种群不会在MA琼脂上形成菌落,尽管仔细检查可能会发现由于琼脂中的微量营养物质而出现的微菌落。A−3群体在MA上形成许多小菌落,因为这些细胞可以在该培养基中也存在的柠檬酸盐上生长。MA上的污染物菌落很少见。
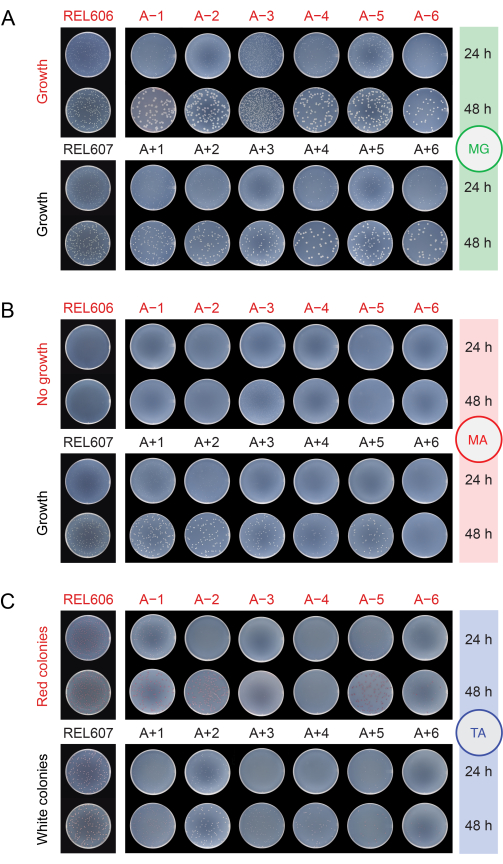
图 5:电镀 LTEE 群体以检测污染。 将REL606和REL607祖先以及实验达到76,026 2/3代的当天的12个LTEE群体的稀释液接种在(A)MG,(B)MA和(C)TA琼脂平板上,并在24小时和48小时后拍照。对所有培养物进行了相同的稀释,但祖先的接种体积是LTEE群体方案中描述的一半,以在一定程度上解释其较高的细胞密度。 请点击此处查看此图的大图。
在阿拉伯糖四唑(TA)琼脂上,REL606祖先和所有Ara− 群体预计将形成红色菌落,而REL607祖先和所有Ara+ 种群通常应形成白色菌落(可能包括浅粉红色或桃色)(图5C)。LTEE祖先形成健壮的菌落,在16-24小时内很容易在TA琼脂上识别为Ara−和Ara+ 。最初,这种差异可用于检测Ara−和Ara+ 种群之间的交叉污染。然而,TA琼脂的营养成分比日常转移中使用的化学定义的DM25培养基更为复杂,并且LTEE中的 大肠杆菌 没有进化压力来保持在这些条件下稳健生长的能力。因此,一些进化的LTEE种群现在在TA平板上表现出生长不良,需要48小时才能形成菌落或根本不可靠地生长。进化的LTEE种群在TA上形成的菌落的颜色和形态也相对于祖先发生了变化,并且彼此分化。一些异常菌落的存在并不总是污染的迹象。自发突变可能发生,使LTEE菌株的Ara标记状态发生变化,特别是从Ara+ 到Ara− ,因为与恢复araA活性的逆转突变相比,功能丧失突变影响阿拉伯糖利用的可能性更高。切换Ara标记状态的突变在进化出超突变的人群中更为常见(A−1,A−2,A-3,A-4,A+3和A+6)13。在TA琼脂上,其他物种的污染微生物通常(但并非总是)形成小的,完美的圆形菌落,红色中心被明显的白色边界包围,与任何LTEE菌株或种群形成的边界不同。
共文化大赛结果
两个LTEE祖先(分别为REL606和REL607)的所有Ara−和Ara+对以及存档在20,000代的A−5和A + 5群体样本(分别为REL8597和REL8604)之间的竞争表明如何在TA琼脂上区分和计数具有不同Ara标记状态的菌落(步骤3.4.8和3.6.6)(图6).在DM1000中从复活开始的一天和三天测定之前和之后,每对竞争对手的六个重复烧瓶计数菌落(表1)。在相同稀释度和铺板体积下观察到的菌落总数与哪些竞争对手混合不同,因为进化的LTEE群体的培养物达到的细胞密度低于DM25中祖先菌株的培养物。这种差异是细胞大小增加进化的结果,在实验8,33的前几千代期间,所有LTEE群体都发生了这种进化。
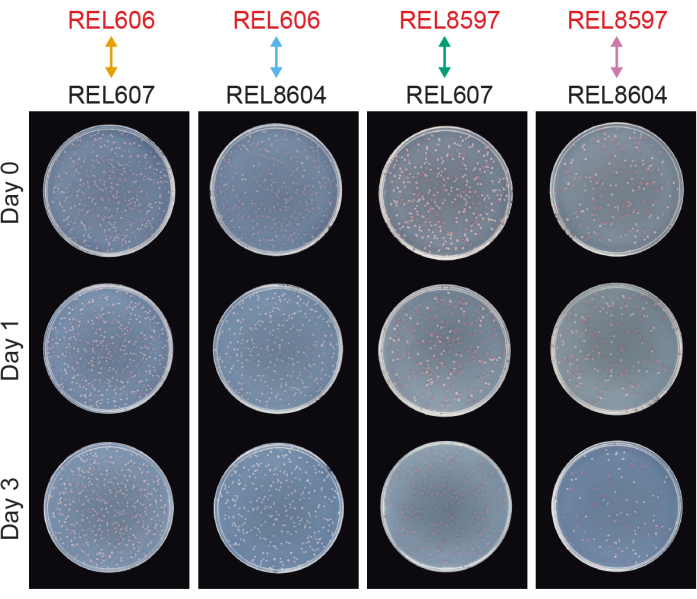
图 6:接种在 TA 琼脂平板上的竞争测定。 来自竞争测定的TA琼脂平板示例。REL606和REL607分别是LTEE的Ara− 和Ara+ 祖先。REL8597和REL8604分别是来自LTEE冻结"化石记录"的20,000个A−5和A + 5种群。在比赛的第0天,第1天和第3天显示了对应于每对菌株之间一次重复测定的TA板。在37°C下生长24小时后拍摄平板。 REL606和REL8597竞争对手的细胞是Ara− 并形成红色菌落。REL607和REL8604竞争对手的细胞是Ara+ 并形成白色菌落。 请点击此处查看此图的大图。
典型竞争TA板上的大多数菌落将很好地分离或重叠,因此很容易计算出有多少不同类型的初始环状菌落一起生长(图7A)。然而,可能会出现一些情况,在这种情况下,如何计算两种颜色混合的非典型菌落或生长并不明显。首先,当白色的Ara+菌落和红色的Ara−菌落重叠时,Ara+菌落往往会过度生长并包裹Ara−菌落。在这种情况下,应该将较大的Ara+菌落中的一个小红色斑块或半透明"间隙"算作Ara−菌落(图7B)。其次,自发的Ara+突变体偶尔会出现在Ara−殖民地。这些突变体通常表现为白色扇区(),从红色菌落内部扩散得更快,因为一旦它们获得阿拉伯糖作为额外的营养物质,它们就会生长得更快(图7C)。这些白扇区殖民地算作一个阿拉-殖民地,没有阿拉+殖民地。如果将板孵育48小时或更长时间,这种情况变得更加常见。第三,有时观察到半透明的粉红色菌落(图7D)。这些是由Ara-竞争对手组成的。最后,当它们在琼脂制备过程中或在其表面上散布培养稀释液时,当它们被一些外部微生物细胞污染时,TA平板上有时会生长少量内部略有不同的红色阴影的圆形菌落(图7E)。这些污染物菌落不应计算在内。如果怀疑竞争培养物的污染,因为其任何TA平板上有许多非典型菌落,则应排除该复制。
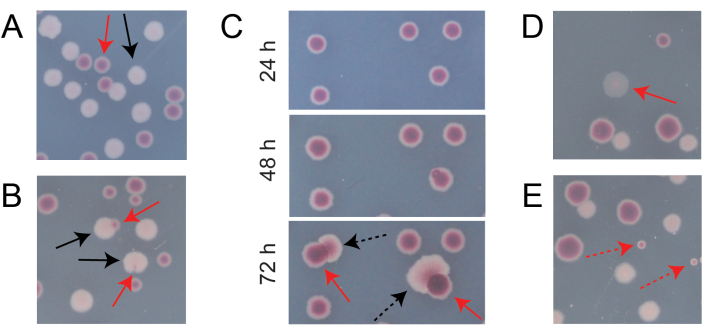
图 7:在 TA 琼脂上计数 Ara− 和 Ara+ 菌落时遇到的边缘情况。 在每个面板中,一些应该计数的Ara− 和Ara+ 菌落分别用红色和黑色实心箭头标记。 不应计数 的菌落用虚线箭头表示,对应于它们看起来的类型。除图C外,所有照片均在孵育24小时后拍摄。 (A)正常Ara−和Ara+ 菌落的例子。(B)Ara+ 菌落过度生长附近Ara− 菌落的例子,包括一个在白色菌落外部几乎看不到的透明缝隙的例子。将这些病例中的每一个都算作两个菌落,每种类型一个。(C)Ara− 菌落产生Ara+ 突变扇区的例子。将每个病例仅算作一个 Ara− 殖民地。出现的白色扇区()是由于菌落内出现的 Ara+ 突变体。在生长24小时,48小时和72小时后显示相同的菌落区域。(D)半透明的粉红色菌落的例子。算作阿拉−。(E)由非 大肠杆菌微生物的外部污染形成的菌落的例子。它们是红色的,但较小且完全圆形,具有明显的白色边界。 请点击此处查看此图的大图。
使用 Excel 电子表格(补充文件 1)或通过在 R 中对输入到 CSV 模板中的菌落计数(补充文件 2)运行 fitnessR 包函数来分析这些比赛中的菌落计数,表明这两个祖先在测定精度内的适应性方面无法区分,20,000 代 A−5 和 A+5 群体都明显比祖先更合适, 并且两个进化的种群都比另一个种群更合适(韦尔奇的 t检验, p > 0.05)(图8)。与一对紧密匹配的比赛(REL606 与 REL607)的一天比赛相比,三天比赛的相对适应度估计的精度有所提高。如果需要,可以通过进行更长的竞争和更长的生长周期来进一步提高这些测量的精度。然而,一旦一个竞争对手在额外的比赛天数后相对于另一个竞争对手变得如此丰富,以至于无法准确确定两种菌株的比例,因为很少或没有不太适合类型的菌落可以计算,那么多天比赛的结果就没有信息。祖先与进化的20,000代种群(REL606与REL8604和REL607与REL8597)为期三天的比赛就是这种情况(图6 和 表1)。
表1:来自竞争性健身测定的菌落计数。 对两个Ara− 和两个Ara+ 竞争者的所有成对组合进行了为期一天和三天的竞争测定,重复了六次。REL606和REL607分别是LTEE的Ara− 和Ara+ 祖先。REL8597和REL8604分别是来自LTEE冻结"化石记录"的20,000代A−5和A + 5种群。 请按此下载此表格。
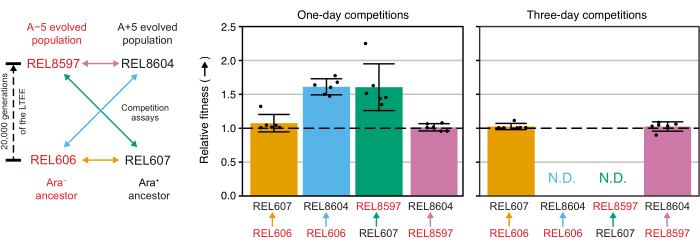
图8:使用竞争测定法测量的相对适应度。LTEE祖先与20,000代A−5和A + 5 LTEE群体之间为期一天和三天的竞争测定结果。左图将四个成对比赛显示为颜色编码的双头箭头。两个Ara−(红色标签)和两个Ara+(黑标)竞争对手的每种组合都进行了六倍复制测试。使用fitnessR软件包31在R中分析表1中的菌落计数,并使用ggplot2软件包(版本3.4.0)34绘制结果。健身显示为标签中的箭头相对于箭头来自的竞争对手的竞争对手(例如,REL8604相对于REL606)。显示了从每个竞争测定重复的菌落计数估计的相对适应度值(点),一对竞争对手的平均相对适应度值(用与图表相同的颜色编码填充的条形)和95%置信区间(误差条)。祖先和进化种群之间为期三天的竞争无法确定相对适应度值(N.D.),因为第3天平板上的祖先菌落为零或很少(见表1)。请点击此处查看此图的大图。
补充文件 1.用于计算相对适合度的Excel电子表格文件。请点击此处下载此文件。
补充文件 2.逗号分隔值输入文件模板,用于使用 fitnessR 包计算 R 中的相对适应度。请点击此处下载此文件。
讨论
LTEE的长期弹性及其方法
大肠杆菌长期进化实验(LTEE)现已进入第四个十年。对于任何持续时间的微生物进化实验,保持可重复的环境、避免污染、存档样品和准确测量适应性至关重要。LTEE展示了实现这些目标的几种经过时间考验的策略,包括使用摇动良好的烧瓶来创造均匀的环境和支持低细胞密度的化学定义生长培养基。此外,LTEE采用的祖先菌株在遗传标记上有所不同,该标记提供易于筛选且在进化环境中选择性中性的表型(菌落颜色)。这种实验设计功能提供了一种识别内部和外部污染的方法,并有助于测量适应性。然而,自1988年以来,LTEE使用的所有程序和保障措施并非都同样强大。随着大肠杆菌种群的进化,LTEE开始时一些可靠的方法变得不那么有效。幸运的是,这些有问题的方法现在可以使用自实验开始以来开发的技术来增强或替换。
检测污染
检测污染对LTEE至关重要。污染可以有两种:LTEE种群之间(交叉污染)和来自环境的微生物(外部污染)。在大多数情况下,在培养基制备和日常转移过程中谨慎使用无菌技术并密切注意可以防止这两种类型的污染,但它们确实会发生。在实验早期,TA琼脂上的铺板可用于检测交叉污染的情况,因为转移总是在Ara−和Ara+群体之间交替。这些大肠杆菌对某些噬菌体的敏感性和抗性的指纹也旨在成为一种设计特征,可以将LTEE群体与可能污染它们的常用大肠杆菌实验室菌株区分开来4。然而,随着实验的进行,这些遗传标记变得不可靠(例如,一些种群不再在TA琼脂上形成菌落)10,35。幸运的是,这些种群在实验过程中经历了不同的进化历史,因此在遗传上已经分化,这创造了新的遗传标记,现在可用于检测交叉污染。例如,每个群体都进化出pykF和nadR基因14,36,37突变的独特组合。我们有时会对这两个基因进行PCR扩增和Sanger测序,以测试具有异常形态或颜色的菌落是否是由于交叉污染引起的。随着全基因组和全群体测序的成本不断下降,LTEE人群的常规测序可能很快成为可能,从而为监测它们是否有污染迹象提供了新的机会。
衡量竞争适应性
LTEE已经超越其原始方法的另一个情况是,进化的大 肠杆菌 在实验环境中的适应性已经增加到如此程度,以至于人们不再能够使用此处描述的协议直接测量当今种群相对于其祖先的适应性。进化的种群胜过祖先的程度如此之大,以至于在一天的竞争之后,几乎没有祖先殖民地可以计算。处理这种巨大适应度差异的一种方法是使用菌株的不等起始比,对混合到不太合适的竞争者(例如,90 μL 祖先和 10 μL 进化的竞争者)的初始体积进行加权。第二种方法是鉴定具有比LTEE祖先更高的适应性的进化Ara− 克隆,通过选择MA琼脂来分离其自发的Ara+ 回复突变体,然后使用竞争测定6,38验证恢复菌株与其亲本具有相同的适应性。然后,这种新的Ara−/Ara+ 对可以用作一组常见的竞争菌株,以代替REL606 / REL607。理想情况下,选择作为共同竞争物的进化的Ara− 克隆(及其Ara+ 还原体)相对于实验中所有感兴趣的菌株具有中等适应性。在LTEE的前50,000代中,这两种方法(使用不相等的起始比率或共同的竞争对手)与典型方法39相比没有产生有意义的适应度测量值。
对竞争协议的这些修改做出了某些简化的假设,这些假设可能并不总是正确的。一是健身测量是传递的。也就是说,如果我们分别竞争两个种群与一个共同的竞争菌株,那么我们可以推断两个种群的相对适应性。在大多数情况下,LTEE40已经发现这种关系是正确的,但对于其他实验41则不然。造成这种差异的一个原因可能是负频率依赖性适应度效应的演变。当从LTEE的A−2种群的两个不同谱系中分离出来的菌株相互竞争时,就会发生这种情况19,42。由于交叉喂养,每种在罕见时都有优势,这稳定了它们的共存。测序数据显示具有不同突变集的谱系长期共存,这表明其他LTEE人群中也可能出现类似的相互作用14,43,尽管目前尚不清楚它们是否足够强大以显着改变适应性估计。最后,LTEE32的A−3群体中柠檬酸盐有氧生长的演变意味着,当它们与不能使用柠檬酸盐的细胞竞争时,这些细胞的适应性现在包含使用"私有"资源,这使得解释这些结果变得复杂。尽管有这些例外,但使用低葡萄糖浓度和良好的摇晃环境无疑简化了LTEE菌株和人群之间的适应性比较。
在后来的几代中,一些LTEE种群不再在TA琼脂上形成菌落,这使得使用甚至修改后的协议进行竞争实验变得困难或不可能10。不需要菌落生长的替代方法可用于确定两个竞争对手的相对代表性,例如FREQ-seq,它使用二代测序来计数扩增子44中含有两个替代等位基因的读段比例。这种方法或类似的方法可能与Ara等位基因或新进化的突变(例如 pykF 和 nadR中的突变)一起使用,而不是祖先序列。进行引入其他类型的中性标记的遗传修饰也可用于测量相对适应性。例如,在LTEE分支实验中,荧光蛋白基因已入细胞的染色体中,以便可以使用流式细胞术45对竞争对手进行计数。另一种方法开辟了在同一竞争烧瓶中混合两种以上菌株的可能性,方法是插入可以PCR扩增并测序到不同竞争对手的基因组中的条形码。这种方法已被用于进化实验中的谱系追踪46。流式细胞术和条形码测序都可以准确测量两种菌株与菌落计数的更极端的比例(因为它们可以查询 10,000 个细胞/基因组>与琼脂平板上可计数的 < 500 个),因此使用这些方法还有望增加相对于常见竞争对手可以测量的适应性差异的动态范围。
长期微生物进化实验的替代设计
尽管有其所有优点,但LTEE并不完美。其设计的某些方面使其劳动密集型且容易受到人为错误的影响。例如,研究人员每天必须进入实验室并在锥形瓶之间移液以继续实验。竞争实验也可能带来令人生畏的后勤障碍,因为对无菌玻璃器皿、培养基、培养箱空间和菌落计数的要求迅速上升,即使是少数竞争对手也在接受适度复制的测试。我们经常被问到为什么我们不利用实验室自动化系统,例如在96孔微孔板上操作的移液机器人,或连续培养系统,例如恒化器或turbidostats。答案很简单:从某种意义上说,LTEE是其悠久历史的囚徒。我们不敢偏离在50 mL锥形瓶中以特定速度振荡的10 mL培养物,因为这将从根本上改变实验。这些种群几十年来一直在适应的环境的微妙方面(例如,曝气量)将在微孔板或连续培养系统中发生变化。每次转移的群体瓶颈也可能不同(例如,在微孔板中较小),从而改变进化动态。简而言之,偏离这里描述的方法将使LTEE成为一个不同的实验,或者至少有可能引入破坏进化轨迹的不连续性。
设计新进化实验的研究人员应该考虑这些繁殖微生物种群的其他方式,同时意识到它们的潜在优点和缺点。在某些方面,使用移液机器人在微孔板中转移群体在逻辑上更简单,并且由于可以以这种方式繁殖的大量重复群体,因此可以证明非常强大47,48,49。然而,大多数当前设置中的自动转移不是在完全无菌的条件下进行的,这增加了外部污染的可能性。为了防止污染,生长培养基通常补充抗生素,抗生素成为影响进化的环境特征。微孔板中的转移也更容易发生交叉污染事件。最后,微孔板的环境 - 特别是如果它们没有摇晃 - 倾向于选择壁生长,聚集和其他现象,这些现象可能通过在一个孔中创建多个壁龛使进化复杂化。使用丰富的培养基或高浓度的营养物质来保持小孔中的种群规模可能会加剧这些复杂性。如果出现这种相互作用,它们会使测量和解释适应性变得更加困难。
用于微生物进化的连续培养系统包括恒化器,其中新鲜培养基不断泵入并泵出培养物,以及turbidostats,其中通过自动传感和泵送定期稀释培养物以保持细胞处于恒定生长状态。当人们想要模拟微生物生理学和进化时,这些系统非常有用,因为它们通过将微生物保持在始终具有营养的环境中来避免微生物在生长和饥饿之间过渡50。甚至可以添加传感器,实时测量光密度、O2 消耗、pH 值以及培养物环境和生长的其他方面。然而,目前的连续培养系统要么需要昂贵的设备购买,要么需要专业知识来构建定制设置51,52,53,54。此外,壁生长,其中细胞通过粘附在培养室中逃避稀释,困扰着连续培养系统中的进化动态,除非它们定期灭菌。由于这些限制,与连续转移进化实验相比,迄今为止大多数恒化器和浑浊剂进化实验的持续时间有限和/或涉及的独立进化种群相对较少。
结论
我们在这里展示的LTEE方法对于研究其独特的历史记录和继续这些 大肠杆菌 种群的开放式进化至关重要。它们还为正在考虑新的进化实验的其他人提供了一个起点,这些实验可以利用实验室自动化或添加自然环境中发现的各种复杂性元素,这些元素在LTEE中被故意省略。自1988年以来,实验进化作为一个领域蓬勃发展。在此期间,全球实验室的研究人员已经证明了这种方法在研究进化、通过引入创造性实验设计和使用新技术监测结果方面的巨大灵活性。LTEE的方法并不代表终点,但我们希望它们将继续启发并为该领域提供未来的基础。
披露声明
未声明利益冲突。
致谢
我们感谢Richard Lenski和许多研究并为维持 大肠杆菌 长期进化实验做出贡献的研究人员,特别是Neerja Hajela。LTEE目前由美国国家科学基金会(DEB-1951307)支持。
材料
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | T8877 | |
| 20 mL Glass Beaker | Sigma-Aldrich | CLS100020 | |
| 50 mL Erlenmeyer Flasks | Sigma-Aldrich | CLS498050 | |
| Agar | Sigma-Aldrich | A1296 | |
| Ammonium Sulfate | Sigma-Aldrich | AX1385 | |
| Antifoam | Sigma-Aldrich | A5757 | |
| Arabinose | Sigma-Aldrich | A3256 | |
| Freezer Box (2") | VWR | 82007-142 | |
| Freezer Box (3") | VWR | 82007-144 | |
| Freezer Box Cell Divider (49-place) | VWR | 82007-150 | |
| Freezer Box Cell Divider (81-place) | VWR | 82007-154 | |
| Freezer Vials (1/2-Dram) | VWR | 66009-816 | |
| Freezer Vials (2-Dram) | VWR | 66010-560 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Glycerol | Fisher Scientific | G33 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Metal Tray | Winco | SPJP-202 | |
| Petri Dish | Fisher Scientific | FB0875712 | |
| Potassium Phosphate Dibasic Trihydrate | Sigma-Aldrich | P5504 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5379 | |
| Sodium Chloride | Sigma-Aldrich | M7506 | |
| Sodium Citrate Tribasic Dihydrate | Sigma-Aldrich | C7254 | |
| Test Tube Cap (18mm) | VWR | 10200-142 | |
| Test Tube Rack (18mm, steel) | Adamas-Beta | N/A | Test Tube Racks Stainless Steel Grid Arrangement 72 Holes (17-19 mm) |
| Test Tubes (18 x 150 mm) | VWR | 47729-583 | |
| Thiamine, Hydrochloride | Millipore | 5871 | |
| Tryptone | Gibco | 211705 | |
| Yeast Extract | Gibco | 212750 |
参考文献
- Lenski, R. E., Rose, M. R., Simpson, S. C., Tadler, S. C. Long-term experimental evolution in Escherichia coli. I. Adaptation and divergence during 2,000 generations. The American Naturalist. 138 (6), 1315-1341 (1991).
- Fox, J. W., Lenski, R. E. From here to eternity-the theory and practice of a really long experiment. PLoS Biology. 13 (6), e1002185(2015).
- Daegelen, P., Studier, F. W., Lenski, R. E., Cure, S., Kim, J. F. Tracing ancestors and relatives of Escherichia coli B, and the derivation of B strains REL606 and BL21(DE3). Journal of Molecular Biology. 394 (4), 634-643 (2009).
- Studier, F. W., Daegelen, P., Lenski, R. E., Maslov, S., Kim, J. F. Understanding the differences between genome sequences of Escherichia coli B strains REL606 and BL21(DE3) and comparison of the E. coli B and K-12 genomes. Journal of Molecular Biology. 394 (4), 653-680 (2009).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nature Reviews Genetics. 14 (12), 827-839 (2013).
- Lenski, R. E. Experimental studies of pleiotropy and epistasis in Escherichia coli. II. Compensation for maladaptive pleiotropic effects associated with resistance to virus T4. Evolution. 42 (3), 425-432 (1988).
- Calcott, P. H., Gargett, A. M. Mutagenicity of freezing and thawing. FEMS Microbiology Letters. 10 (2), 151-155 (1981).
- Lenski, R. E., Travisano, M. Dynamics of adaptation and diversification: a 10,000-generation experiment with bacterial populations. Proceedings of the National Academy of Sciences of the United States of America. 91 (15), 6808-6814 (1994).
- Wiser, M. J., Ribeck, N., Lenski, R. E. Long-term dynamics of adaptation in asexual populations. Science. 342 (6164), New York, N.Y. 1364-1367 (2013).
- Lenski, R. E., et al. Sustained fitness gains and variability in fitness trajectories in the long-term evolution experiment with Escherichia coli. Proceedings of the Royal Society B: Biological Sciences. 282 (1821), 20152292(2015).
- Barrick, J. E., et al. Genome evolution and adaptation in a long-term experiment with Escherichia coli. Nature. 461 (7268), 1243-1247 (2009).
- Blount, Z. D., Barrick, J. E., Davidson, C. J., Lenski, R. E. Genomic analysis of a key innovation in an experimental Escherichia coli population. Nature. 489 (7417), 513-518 (2012).
- Tenaillon, O., et al. Tempo and mode of genome evolution in a 50,000-generation experiment. Nature. 536 (7615), 165-170 (2016).
- Good, B. H., McDonald, M. J., Barrick, J. E., Lenski, R. E., Desai, M. M. The dynamics of molecular evolution over 60,000 generations. Nature. 551 (7678), 45-50 (2017).
- Consuegra, J., et al. Insertion-sequence-mediated mutations both promote and constrain evolvability during a long-term experiment with bacteria. Nature Communications. 12 (1), 980-980 (2021).
- Cooper, T. F., Rozen, D. E., Lenski, R. E. Parallel changes in gene expression after 20,000 generations of evolution in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 100 (3), 1072-1077 (2003).
- Favate, J. S., Liang, S., Cope, A. L., Yadavalli, S. S., Shah, P. The landscape of transcriptional and translational changes over 22 years of bacterial adaptation. eLife. 11, e81979(2022).
- Khan, A. I., Dinh, D. M., Schneider, D., Lenski, R. E., Cooper, T. F. Negative epistasis between beneficial mutations in an evolving bacterial population. Science. 332 (6034), 1193-1196 (2011).
- Plucain, J., et al. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli. Science. 343 (6177), 1366-1369 (2014).
- Quandt, E. M., Deatherage, D. E., Ellington, A. D., Georgiou, G., Barrick, J. E. Recursive genomewide recombination and sequencing reveals a key refinement step in the evolution of a metabolic innovation in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2217-2222 (2014).
- Leon, D., D'Alton, S., Quandt, E. M., Barrick, J. E. Innovation in an E. coli evolution experiment is contingent on maintaining adaptive potential until competition subsides. PLoS Genetics. 14 (4), e1007348(2018).
- Bennett, A. F., Lenski, R. E., Mittler, J. E. Evolutionary adaptation to temperature. I. Fitness responses of Escherichia coli to changes in its thermal environment. Evolution. 46 (1), 16-30 (1992).
- Kibota, T. T., Lynch, M. Estimate of the genomic mutation rate deleterious to overall fitness in E. coli. Nature. 381 (6584), 694-696 (1996).
- Friesen, M. L., Saxer, G., Travisano, M., Doebeli, M. Experimental evidence for sympatric ecological diversification due to frequency-dependent competition in Escherichia coli. Evolution. 58 (2), 245-260 (2004).
- Cooper, T. F. Recombination speeds adaptation by reducing competition between beneficial mutations in populations of Escherichia coli. PLoS Biology. 5 (9), e225(2007).
- Cooper, T. F., Lenski, R. E. Experimental evolution with E. coli in diverse resource environments. I. Fluctuating environments promote divergence of replicate populations. BMC Evolutionary Biology. 10, 11(2010).
- Quan, S., et al. Adaptive evolution of the lactose utilization network in experimentally evolved populations of Escherichia coli. PLoS Genetics. 8 (1), e1002444(2012).
- Deatherage, D. E., Kepner, J. L., Bennett, A. F., Lenski, R. E., Barrick, J. E. Specificity of genome evolution in experimental populations of Escherichia coli evolved at different temperatures. Proceedings of the National Academy of Sciences of the United States of America. 114 (10), E1904-E1912 (2017).
- Izutsu, M., Lake, D. M., Matson, Z. W. D., Dodson, J. P., Lenski, R. E. Effects of periodic bottlenecks on the dynamics of adaptive evolution in microbial populations. BioRixv. , 4457(2021).
- Chavarria-Palma, J. E., Blount, Z. D., Barrick, J. E. LTEE Media Recipes. , (2022).
- Barrick, J. E., Lake, D. M. fitnessR: fitnessR-v1.0.0. barricklab. , (2023).
- Blount, Z. D., Borland, C. Z., Lenski, R. E. Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 105 (23), 7899-7906 (2008).
- Grant, N. A., Magid, A. A., Franklin, J., Dufour, Y., Lenski, R. E. Changes in cell size and shape during 50,000 generations of experimental evolution with Escherichia coli. Journal of Bacteriology. 203 (10), 22(2021).
- Wickham, H. ggplot2: Elegant Graphics for Data Analysis. , Springer-Verlag. New York. (2016).
- Meyer, J. R., et al. Parallel changes in host resistance to viral infection during 45,000 generations of relaxed selection. Evolution. 64 (10), 3024-3034 (2010).
- Woods, R., Schneider, D., Winkworth, C. L., Riley, M. A., Lenski, R. E. Tests of parallel molecular evolution in a long-term experiment with Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 103 (24), 9107-9712 (2006).
- Barrick, J. E., Deatherage, D. E., D'Alton, S. LTEE-Ecoli: genomics resources for the Long-Term Evolution Experiment with Escherichia coli. , Available from: https://github.com/barricklab/LTEE-Ecoli (2022).
- Izutsu, M., Lenski, R. E. Experimental test of the contributions of initial variation and new mutations to adaptive evolution in a novel environment. Frontiers in Ecology and Evolution. 10, 958406(2022).
- Wiser, M. J., Lenski, R. E. A comparison of methods to measure fitness in Escherichia coli. PLoS One. 10 (5), 0126210(2015).
- de Visser, J. A. G. M., Lenski, R. E. Long-term experimental evolution in Escherichia coli. XI. Rejection of non-transitive interactions as cause of declining rate of adaptation. BMC Evolutionary Biology. 2 (1), 19(2002).
- Paquin, C. E., Adams, J. Relative fitness can decrease in evolving asexual populations of S. cerevisiae. Nature. 306 (5941), 368-371 (1983).
- Rozen, D. E., Lenski, R. E. Long-Term Experimental Evolution in Escherichia coli. VIII. Dynamics of a balanced polymorphism. The American Naturalist. 155 (1), 24-35 (2000).
- Quandt, E. M., Gollihar, J., Blount, Z. D., Ellington, A. D., Georgiou, G., Barrick, J. E. Fine-tuning citrate synthase flux potentiates and refines metabolic innovation in the Lenski evolution experiment. eLife. 4, e09696(2015).
- Chubiz, L. M., Lee, M. -C., Delaney, N. F., Marx, C. J. FREQ-Seq: a rapid, cost-effective, sequencing-based method to determine allele frequencies directly from mixed populations. PLoS One. 7 (10), e47959(2012).
- Gallet, R., Cooper, T. F., Elena, S. F., Lenormand, T. Measuring selection coefficients below 10-3: method, questions, and prospects. Genetics. 190 (1), 175-186 (2012).
- Levy, S. F., et al. Quantitative evolutionary dynamics using high-resolution lineage tracking. Nature. 519 (7542), 181-186 (2015).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic variation and the fate of beneficial mutations in asexual populations. Genetics. 188 (3), 647-661 (2011).
- Frenkel, E. M., et al. Crowded growth leads to the spontaneous evolution of semistable coexistence in laboratory yeast populations. Proceedings of the National Academy of Sciences. 112 (36), 11306-11311 (2015).
- Jordt, H., et al. Coevolution of host-plasmid pairs facilitates the emergence of novel multidrug resistance. Nature Ecology and Evolution. 4 (6), 863-869 (2020).
- Gresham, D., Dunham, M. J. The enduring utility of continuous culturing in experimental evolution. Genomics. 104 (6), 399-405 (2014).
- Miller, A. W., Befort, C., Kerr, E. O., Dunham, M. J. Design and use of multiplexed chemostat arrays). Journal of Visualized Experiments. (72), e50262(2013).
- Toprak, E., et al. Building a morbidostat: an automated continuous-culture device for studying bacterial drug resistance under dynamically sustained drug inhibition. Nature Protocols. 8 (3), 555-567 (2013).
- Wong, B. G., Mancuso, C. P., Kiriakov, S., Bashor, C. J., Khalil, A. S. Precise, automated control of conditions for high-throughput growth of yeast and bacteria with eVOLVER. Nature Biotechnology. 36 (7), 614-623 (2018).
- Ekkers, D. M., Branco Dos Santos, F., Mallon, C. A., Bruggeman, F., Van Doorn, G. S. The omnistat: A flexible continuous-culture system for prolonged experimental evolution. Methods in Ecology and Evolution. 11 (8), 932-942 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。