Method Article
Günlük Transferler, Popülasyonların Arşivlenmesi ve Escherichia coli ile Uzun Vadeli Evrim Deneyinde Uygunluğun Ölçülmesi
Bu Makalede
Özet
Bu protokol, Escherichia coli Uzun Vadeli Evrim Deneyi'nin (LTEE) günlük transferlerini ve periyodik donmalarını gerçekleştirerek nasıl sürdürüleceğini ve evrimleşmiş bakterilerdeki uygunluk iyileştirmelerini ölçmek için rekabet testlerinin nasıl yapılacağını açıklamaktadır. Bu prosedürler, kendi mikrobiyal evrim deneylerine başlayan araştırmacılar için bir şablon görevi görebilir.
Özet
Uzun Süreli Evrim Deneyi (LTEE), 35 yıldan fazla bir süredir basit bir laboratuvar ortamına ve 77.000 bakteri nesline adapte oldukları için on iki Escherichia coli popülasyonunu takip etti. LTEE'de kullanılan kurulum ve prosedürler, mikrobiyal evrimi incelemek için güvenilir ve tekrarlanabilir yöntemleri özetlemektedir. Bu protokolde, LTEE popülasyonlarının her gün taze ortama nasıl aktarıldığını ve kültürlendiğini açıklıyoruz. Daha sonra, LTEE popülasyonlarının olası kontaminasyon belirtileri açısından düzenli olarak nasıl kontrol edildiğini ve daha sonraki çalışmalar için kalıcı bir dondurulmuş "fosil kaydı" sağlamak üzere arşivlendiğini açıklıyoruz. Bu prosedürlere dahil edilen çoklu önlemler, kontaminasyonu önlemek, çeşitli sorunları ortaya çıktıklarında tespit etmek ve deneyin ilerlemesini önemli ölçüde engellemeden kesintilerden kurtulmak için tasarlanmıştır. LTEE'de evrimsel değişikliklerin genel temposunun ve karakterinin izlenmesinin bir yolu, deneyden popülasyonların ve suşların rekabetçi uygunluğunu ölçmektir. Ortak kültür yarışma testlerinin nasıl yapıldığını açıklıyoruz ve sonuçlardan göreceli uygunluğu hesaplamak için hem bir elektronik tablo hem de bir R paketi (fitnessR) sağlıyoruz. LTEE boyunca, bazı popülasyonların davranışları ilginç şekillerde değişti ve tüm genom dizilimi gibi yeni teknolojiler, popülasyonların nasıl geliştiğini araştırmak için ek yollar sağladı. Orijinal LTEE prosedürlerinin bu değişikliklere uyum sağlamak veya bu değişikliklerden yararlanmak için nasıl güncellendiğini tartışarak bitiriyoruz. Bu protokol, LTEE'yi evrim ve genetik, moleküler biyoloji, sistem biyolojisi ve ekoloji arasındaki bağlantıları incelemek için bir model sistem olarak kullanan araştırmacılar için yararlı olacaktır. Daha geniş anlamda, LTEE, yeni mikroplar, ortamlar ve sorularla kendi evrim deneylerine başlayanlar için denenmiş ve doğru bir şablon sağlar.
Giriş
Şubat 1988'de Richard Lenski, Kaliforniya Üniversitesi, Irvine1'de Escherichia coli'nin klonal kültürleri ile tanımlanmış bir glikoz sınırlı büyüme ortamı içeren on iki şişeyi aşıladı. Ertesi gün, kültürün% 1'ini her bir şişeden taze büyüme ortamı içeren bir dizi yeni şişeye aktardı. Bu 1:100 seyreltme, bakteri popülasyonlarının, kabaca 62/3 nesil hücre bölünmesine karşılık gelen mevcut glikozu tüketmeden önce 100 kat genişlemesine izin verdi. Bu prosedür ertesi gün tekrarlandı ve o zamandan beri birkaç kesinti ile her gün oldu. Bu günlük transferler, deney yeniden taşınsa bile, önce 1992'de Michigan State Üniversitesi'ne ve ardından 2022'de Austin'deki Teksas Üniversitesi'ne taşındı. Bu arada, yeni mutasyonlar bu E. coli popülasyonlarında sürekli olarak genetik çeşitlilik yarattı ve doğal seleksiyon, evrimleşmiş hücrelerin atalarını geride bırakmasına neden oldu.
Lenski, şimdi Uzun Vadeli Evrim Deneyi (LTEE) olarak bilinen bu deneyi, evrimin dinamiklerini ve tekrarlanabilirliğini araştırmak için tasarladı. Bu soruları cevaplamak için, deney düzeneğinin tasarımına ve protokollerine birkaç önemli özellik dahil etti2. Bu özelliklerden biri, model bir organizmanın dikkatli bir şekilde seçilmesiydi. Orijinal on iki popülasyonun hepsi, hemen ortak bir atayı paylaşan tek kolonilerden başladı, Escherichia coli B suşu REL606. Bu suş seçildi, çünkü laboratuar ortamlarında zaten yaygın olarak kullanılmış, tamamen aseksüel olarak çoğaltılmış ve plazmid veya bozulmamış profajlar içermemiştir 3,4 - bunların hepsi evrimini incelemeyi daha basit hale getirmektedir. Deneyi basitleştiren bir başka seçenek, büyümeden sonra her şişedeki hücrelerin yoğunluğunu sınırlamak için büyüme ortamında çok düşük bir glikoz konsantrasyonu kullanmaktı. Düşük hücre yoğunluğu kullanmak, popülasyonlar içindeki ekolojik etkileşimlerin evrim potansiyelini azaltarak (örneğin, çapraz besleme yoluyla)5 popülasyon uygunluğundaki değişiklikleri analiz etmeyi kolaylaştırmayı amaçlıyordu.
REL606, araA genindeki bir nokta mutasyonu nedeniyle ʟ-arabinozu karbon ve enerji kaynağı (Ara−) olarak kullanamaz. LTEE'ye başlamadan önce, REL607 olarak adlandırılan, restore edilmiş bir araA dizisine sahip spontan bir mutant, REL6066'dan izole edildi. REL607, ʟ-arabinoz (Ara+) üzerinde büyüyebilir. LTEE popülasyonlarının altısını başlatmak için REL606 kullanıldı ve REL607 diğer altısını başlatmak için kullanıldı. Arabinoz, LTEE sırasında kullanılan büyüme ortamında mevcut değildir, bu nedenle REL607, bu koşullar altında REL606 ile aynı şekilde davranır. Bununla birlikte, tetrazolium arabinoz (TA) agar üzerine kaplandığında, Ara− ve Ara+ hücreleri sırasıyla kırmızı ve beyaz koloniler oluşturur. İki atasal E. coli suşu ve onların torunları arasında ayrım yapmak için bu yöntem oldukça yararlıdır. LTEE popülasyonları arasındaki çapraz kontaminasyonu tespit etmek için kullanılabilir. Ayrıca, birbirleriyle rekabet ettiklerinde bir Ara-suşunun veya popülasyonunun bir Ara+ suşuna göre uygunluğunu ölçmeye yardımcı olur. Uygunluk, zıt olarak işaretlenmiş rakiplerin bir ortak kültürünün oluşturulması ve daha sonra kırmızı ve beyaz kolonilerin frekanslarının (kültürün seyreltilmelerinin TA plakalarına yayılmasıyla elde edilen) rakiplerin başlangıçta karıştırıldığı zaman ile LTEE ile aynı koşullar altında bir veya daha fazla büyüme döngüsünden sonra nasıl değiştiğini izleyerek ölçülür. Daha uygun hücre tipinin temsili her büyüme döngüsü sırasında artacaktır.
LTEE'nin bir diğer kritik özelliği, evrimleşen popülasyonların örneklerinin periyodik olarak arşivlenmesidir. Gliserol gibi bir kriyoprotektan ile karıştırıldığında, E. coli hücreleri dondurulabilir ve daha sonra canlandırılabilir7. LTEE protokolünün bir parçası olarak, her 75. günde bir (kabaca 500 nesle eşittir), yeni bir şişeye aktarılmayan her popülasyonun bir kısmı gliserol ile karıştırılır, birden fazla şişe arasında bölünür ve bir dondurucuda saklanır. Bu dondurulmuş "fosil kaydı", araştırmacıların LTEE'nin ilk çalışmalarını gerçekleştirmelerini sağladı; burada evrimleşmiş E. coli popülasyonlarını çeşitli zaman noktalarından canlandırdılar ve zindeliğin ne kadar hızlı arttığını izlemek için atalarının suşlarına karşı yarıştılar1. Uygunluk evrimi, dondurulmuş "fosil kayıtlarının" daha fazla "katmanı" korunduğu için periyodik olarak yeniden ölçülmüştür. Bu ölçümlerden elde edilen genel sonuç, aynı ortamda birçok nesil evrimden sonra bile, LTEE'de bu güne kadar uygunluğun gelişmeye devam ettiğidir 8,9,10.
LTEE'nin bu kadar uzun süre devam etmesine ne izin verdi? Orijinal sorularının sorulmasını ve cevaplanmasını sağlayan aynı özelliklerin çoğu, kötü şans, insan hatası ve dünya olaylarından kaynaklanan kaçınılmaz aksaklıklara karşı güvenlik önlemleri ve arıza emniyetleri olarak da hizmet etmiştir. Her gün, kültürler taze büyüme ortamına aktarıldığında, transferleri gerçekleştiren araştırmacı Ara− ve Ara+ popülasyonları arasında geçiş yapar. Daha sonra, popülasyonlar dondurulduğunda, herhangi bir "komşu" popülasyonun yanlışlıkla çapraz kontamine olup olmadığını veya karıştırılıp karıştırılmadığını (örneğin, beyaz koloniler sadece kırmızı koloniler oluşturması gereken bir popülasyondadır) veya yabancı mikroplarla kontamine olup olmadığını (örneğin, beklenmedik koloni morfolojileri veya hücre yoğunlukları) kontrol etmek için seçici ve gösterge agar üzerine kaplanabilirler. Bir popülasyonun tehlikeye girmesi durumunda, atası dondurucudan canlandırılabilir ve yerine ileri taşınabilir. Ara işaretleyicileri ve dondurulmuş arşiv bu nedenle hem deneysel kaynaklar hem de güvenlik önlemleri olarak ikili amaçlara hizmet etmektedir.
Tarihi çok iyi korunmuş ve kolayca erişilebilir olduğu için, LTEE örnekleri, deney başladığında mevcut olmayan teknolojiler kullanılarak incelenmiştir. Örneğin, LTEE popülasyonlarındaki mutasyonların dinamiklerini incelemek için tüm genom dizilimi kullanılmıştır 11,12,13,14,15 ve gen ekspresyonu 16,17'deki değişiklikleri incelemek için transkriptomik ve ribozomal profilleme kullanılmıştır. Genetik araçlar, uygunluk ve çeşitli fenotipler üzerindeki etkilerini anlamak için tek mutasyonlar veya birkaç evrimleşmiş mutasyonun kombinasyonları ile farklılık gösteren suşları yeniden yapılandırmak için kullanılmıştır 18,19,20,21. Dondurulmuş "fosil kayıtlarından" alınan örnekler kolayca yenilenir, böylece deney tarihinin bir kısmı veya tüm kopyaları diğer laboratuvarlara gönderilebilir. LTEE örnekleri artık Antarktika hariç tüm kıtalarda var ve deneyin kendisinden daha genç olan araştırmacılar tarafından inceleniyorlar. LTEE'nin sağlam yöntemleri ve tarihsel kayıtlarından evrimleşmiş E. coli örnekleri ve suşları, diğer soruları ve ortamları inceleyen evrim deneyleri için de başlangıç noktaları olarak hizmet etmiştir 22,23,24,25,26,27,28,29.
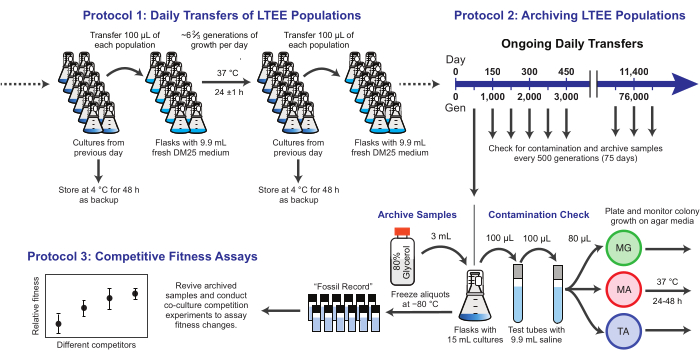
Şekil 1: LTEE prosedürlerine genel bakış. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Burada, E. coli Uzun Süreli Evrim Deneyinde kullanılan üç temel protokolü gösteriyoruz (Şekil 1). Şunları açıklıyoruz: (1) günlük transferlerin nasıl gerçekleştirileceği, (2) popülasyon örneklerinin ve klonal izolatların nasıl arşivleneceği ve (3) uygunluk farklılıklarını ölçmek için ortak kültür rekabet testlerinin nasıl yapılacağı ve analiz edileceği. Umudumuz, bu protokollerin LTEE kaynaklarının sürekli kullanımını teşvik etmesi ve yeni mikrobiyal evrim deneylerinin tasarımını bilgilendirmesidir.
Protokol
1. LTEE popülasyonlarının günlük transferleri
NOT: On iki LTEE popülasyonu, önceki günün şişelerinden alınan kültürlerin% 1'i ile taze ortam aşılanarak günlük olarak aktarılır. Bu işlemdeki adımlar Şekil 1'de özetlenmiştir. REL606 suşundan başlayan altı Ara-popülasyonu A-1 ila A-6 olarak adlandırılır ve REL607 suşundan başlayan altı Ara+ popülasyonu A + 1 ila A + 6 olarak adlandırılır. Aseptik tekniğe ve popülasyonların transferi için bir program ve düzene sıkı sıkıya bağlı kalmak, kontaminasyon ve diğer aksaklıklar riskini en aza indirir.
- LTEE transferlerinin yapılacağı yüzeyi% 70 etanol veya% 10'luk bir ağartıcı çözeltisi ile silerek dezenfekte edin. Yerel bir yukarı akım oluşturmak ve cam eşyaların yanmasını sağlamak için bir Bunsen brülörünü aydınlatın.
NOT: Kontaminasyonu önlemek için laboratuvar eldivenleri giyin. Açık bir alevin etrafında güvenlik için, yalnızca yanıcı olmayan nitril gibi bir malzemeden yapılmış eldivenlerin kullanılması çok önemlidir. - Otoklavlama ile yıkanmış ve sterilize edilmiş 20 mL borosilikat veya polipropilen beherlerle kaplı on üç adet 50 mL borosilikat Erlenmeyer şişesi hazırlayın. Şişelerde görünür döküntüler olup olmadığını kontrol edin ve tamamen temiz olmayanları değiştirin.
- Kırmızı bir işaretleyici kullanarak A-1 ile A-6 arasındaki altı şişeyi ve diğer altı şişeyi siyah bir işaretleyici kullanarak A+1 ile A+6 arasında etiketleyin. Boş kalacak kalan son şişeyi, ay/gün biçimindeki tarih ve haftanın günüyle etiketleyin.
- 13 şişenin her birini steril 10 mL serolojik pipet kullanarak 9,9 mL DM25 ortamıyla doldurun. Kapak görevi gören beheri çıkardıktan sonra ve beheri değiştirmeden önce her şişenin ağzını ateşleyin. Her şişeyi doldurmak arasında pipetin ucunu ateşe verin.
NOT: DM25 yapım talimatları çevrimiçi olarak mevcuttur30. Plastik bir serolojik pipet kullanıyorsanız, plastiğin erimesini önlemek için ucunu yakmaktan vazgeçin veya alevdeki süreyi sınırlayın. - Önceki günün LTEE şişelerini çalkalayan inkübatörden çıkarın.
- Bulanıklığını ve rengini değerlendirmek, şişe bütünlüğünü kontrol etmek ve yabancı maddenin varlığını aramak için her şişeyi ışığa tutarak inceleyin.
NOT: Çıplak gözle, tüm Ara− ve Ara+ kültürleri, ortamdaki sitrat üzerindeki büyüme nedeniyle diğerlerinden ~ 10 kat daha bulanık olacak olan A−3 hariç, boşluğa kıyasla biraz bulanık görünecektir. Birçok dış mikrobiyal kirletici de sitrat üzerinde büyüyebilir, bu nedenle A-3 dışındaki popülasyonlarda artan bulanıklık muhtemelen kontaminasyona işaret eder. Bir aktarımdan önce LTEE kültürlerinin görüntüleri için Temsilci Sonuçları bölümüne bakın. - İSTEĞE BAĞLI: Boş alanın 1 mL'sini ve her kültürün 1 mL'sini 1 cm'lik plastik küvetlere pipetleyerek ve cihazı boşalttıktan sonra bir spektrofotometre kullanarak 600 nm'de (OD600) optik yoğunluk ölçümleri alarak her LTEE kültürünün beklenen bulanıklığa sahip olduğunu doğrulayın.
NOT: Bu ekstra adım, LTEE ile çalışmaya yeni başlayan ve bulanıklığı gözle yargılama konusunda emin olmayan araştırmacıların yanı sıra şüpheli anomalileri belgelemek ve araştırmak için de yararlı olabilir. OD600 değerleri beklendiği gibi olduğunda yayılmaya devam edecek hücre popülasyonlarını kirletme riskini en aza indirmek için yalnızca günün normal yeni şişelere transferlerini tamamladıktan sonra (aşağıdaki adımlar) önceki günün şişelerinden OD600'ü ölçmek için numune alın. LTEE kültürleri için tipik OD600 değerleri için Temsili Sonuçlar bölümüne bakın. - Steril filtre ucuna sahip bir P200 mikropipetleyici kullanarak, her LTEE şişesinden 100 μL kültürü taze DM25 içeren ilgili şişeye aktarın. A−1 ile başlayın, ardından A+1'i aktarın. Bundan sonra, − ve + popülasyonları arasında dönüşümlü olarak devam edin. Hangi kültürlerin aktarıldığını takip etmek için, şişeleri pipetledikten sonra sola veya onlara kaydırın.
NOT: Ara− ve Ara+ popülasyonları arasındaki transferlerin ve değişimlerin katı sırası, çapraz kontaminasyon ve karışımların önlenmesine ve tespit edilmesine yardımcı olur. Sıkı aseptik tekniklere uyun: Her transfer için taze bir pipet ucu kullanın, kapağı açtıktan hemen sonra ve tekrar açmadan önce şişelerin ağızlarını ateşe verin ve mikropipettörün namlusunu ve ejektörünü her transfer arasında% 70 etanol ile nemlendirilmiş tüy bırakmayan bir kağıtla silin. Mikropipetleyicileri dezenfekte etmek için asla çamaşır suyu kullanılmamalıdır, çünkü eser miktarda bile kültürleri öldürebilir. - Yeni aşılanmış şişeleri 37 ° C'de 24 ± 1 saat boyunca 1 inç çapında 120 rpm yörüngesel sallanma ile inkübe edin.
- Önceki güne ait kültürleri 4 °C'de saklayın. Bu yedekleme kültürlerini iki gün boyunca saklayın. Şu anda üç gün önce 4 ° C'de kaydedilen eski kültürleri atın.
NOT: Önceki iki günün kültürleri, gerekirse herhangi bir sorun veya kaza meydana gelirse veya aktarımdan önce önceki günün kültürlerinde kontaminasyon tespit edilirse (örneğin, garip renklenme veya beklenmedik partiküller) denemeyi yeniden başlatmak için iki eksiksiz yedekleme seti sağlar. - Aktarımı yapan araştırmacının saatini, tarihini, transfer numarasını, adını veya baş harflerini, kültürlerin uygun olup olmadığını ve diğer ilgili bilgileri transfer günlüğü defterine girin. Aşağıdaki durumlardan herhangi biri meydana gelirse 1.12-1.14 adımlarına geçin: (1) önceki güne ait boşluk kirlenmiş, (2) bir şişe veya kapağı çatlamış veya kırılmış, (3) bir şişe yabancı madde içeriyor, (4) bir şişe transferler sırasında devriliyor veya düşürülüyor veya (5) bu şişelerden devam etmeyi şüpheli kılan başka bir olay veya gözlem var.
- Önceki günün LTEE kültürleriyle ilgili herhangi bir sorun, kaza veya kontaminasyon şüphesi varsa, onlardan transfer yapmayın. Bunun yerine, daha sonra inceleme ve daha fazla karakterizasyon için on iki kültürün tamamını 4 ° C'de saklayın.
- Bir gün önce aktarılan ve 4 °C'de saklanan yedek kültürleri içeren şişeleri alın. Oda sıcaklığına ısınmak için tezgahın üzerine yerleştirin. Hücreleri yeniden askıya almak için her şişeyi yavaşça döndürün.
- Yedek şişelerden taze ortam içeren yeni şişe grubuna aktarın ve denemeye 1.6-1.11 adımlarında açıklandığı gibi normal şekilde devam edin. Aktarım günlüğüne yedekleme kültürlerinin kullanıldığını not edin ve bir gün öncekiyle aynı aktarım numarasını kaydedin.
NOT: Yalnızca bir popülasyonun şişesinde bir sorun belirtilmiş olsa bile, on iki popülasyonun tümünü yedek şişelerden aktarın, böylece tüm popülasyonlarda geçen nesillerin sayısı fazda kalır. 4 °C'de depolanan yedek şişelerde kontaminasyon tespit edilirse, etkilenen LTEE popülasyonları, popülasyon örnekleri için 3.1-3.2 adımlarında açıklanan prosedür kullanılarak dondurulmuş stoklardan yeniden başlatılmalıdır. LTEE için transfer numarası, yeniden canlanmayı takiben DM25'teki ilk kültürlerin büyümesine kadar artırılmamalıdır.
2. LTEE popülasyonlarının arşivlenmesi
NOT: LTEE popülasyonlarının örnekleri her 75 transferde bir dondurulur. Popülasyonlar, 100 kat transfer seyreltmesini takiben her gün ~ 6 2/3 nesil büyür, bu nedenle bu süre ~ 500 nesle karşılık gelir. Arşivleme sırasında, LTEE popülasyonları kontaminasyonu kontrol etmek için farklı agar ortamlarına da kaplanır. İsteğe bağlı olarak, temsili klonlar bu plakalardan seçilebilir ve şu anda arşivlenebilir. Bu adımlar Şekil 1'de özetlenmiştir.
- Planlanan donmadan önceki gün veya birkaç gün önce, üç tip agar plakası hazırlayın: Minimal Glikoz (MG), Minimal Arabinoz (MA) ve Tetrazolium Arabinoz (TA). Her agar türünden on iki tabak ve birkaç ekstra yapın. Ayrıca en az 250 mL% 0.85 (w / v) steril salin ve% 50 mL% 80 (v / v) steril gliserol hazırlayın.
NOT: Tüm medya ve çözümler için tarifler çevrimiçi olarak mevcuttur30. LTEE'nin normal arşivleme programı için 500'ün katı olan bir nesle ulaşmasından önceki gün, son dondurmadan bu yana 74. gün artı sorunlar tespit edildiğinde veya şüphelenildiğinde 4 ° C yedek şişelerden yapılan aktarımlar nedeniyle eklenen günlerdir. - İSTEĞE BAĞLI: LTEE popülasyonlarından klonal izolatların arşivlenmesi durumunda ek malzemeler hazırlayın: Her popülasyondan üç klon izole etmek için 72 MG plaka, 80 mL% 80 (v / v) gliserol ve 370 mL DM1000 gerekir.
- Planlanan dondurmadan önceki gün günlük LTEE transferlerinin 1.2. adımını gerçekleştirirken fazladan on iki şişeden oluşan bir set hazırlayın. Ek şişelerin altısını xA−1 ile xA−6 arasında kırmızı bir işaretleyici kullanarak ve diğer altı xA+1 ile xA+6 arasında siyah bir işaretleyici kullanarak etiketleyin.
NOT: "x", arşivleme için fazladan şişe setinin kullanılacağını gösterir ve bunları LLEE'nin günlük transferlerine paralel olarak devam etmek için kullanılacak diğer şişe setinden ayırır. - Günlük LTEE transferlerinin 1.4. adımını gerçekleştirirken arşivleme için kullanılacak ek şişelerin her birini 25 mL serolojik pipet kullanarak 14,85 mL DM25 ile doldurun.
- Normal LTEE aktarımını 1.5-1.11 adımlarında açıklandığı gibi tamamlayın. Ardından, adım 1.8 için talimatları tekrarlayın, ancak bu kez önceki günün LTEE kültürlerinin her birinden 150 μL'yi, arşivleme için kullanılacak 14.85 mL taze DM25'in ek şişelerine aktarın.
NOT: Bu ve sonraki tüm adımlarda, bu yönergeleri izleyerek kontaminasyondan ve karışıklıklardan kaçının. A-1 popülasyonu ile başlayın, sonra A + 1'i aktarın ve ardından alternatif olarak - ve + popülasyonlarına devam edin. Mikropipettörün namlusunu ve ejektörünü tüy bırakmayan bir kağıtla silin, popülasyonları değiştirirken %70 etanol ile nemlendirin. Hangi aktarımların tamamlandığını takip etmek için şişeleri ve test tüplerini pipetledikten sonra tepsilerine veya raflarına kaydırın. - On iki LTEE kültürü ve adım 1.9'da açıklandığı gibi 1 inç çap üzerinde 120 rpm yörünge sallama ile 24 ± 1 saat boyunca 37 ° C'de arşivleme için on iki şişe setini inkübe edin.
- LTEE popülasyonlarının kaplanması için malzemeleri, donma gününde LTEE transferlerinin gerçekleştirilmesinden en az bir saat önce hazırlayın.
- On iki MG, on iki MA ve on iki TA agar plakası seçin. Belirgin bir kontaminasyon olmadığından emin olmak için her birini görsel olarak inceleyin.
- On iki LTEE popülasyonunun her biri için her bir plaka türünden birini etiketleyin (A-1 ila A + 6).
NOT: Plakaları etiketlerken, petri kabının alt kısmının kenarlarına yazın. Bu, kolonileri agarın altından incelemek veya fotoğraflamak istediğinde onları gizlememek için önemlidir. Kapaklara yazmayın, çünkü bunlar karıştırılabilir. - Agar plakalarını adım 2.10'da kullanmadan önce ısıtmak için en az 20 dakika boyunca 37 ° C'lik bir inkübatöre yerleştirin.
- 9.9 mL salin içeren 24 test tüpü hazırlayın. Onları her biri iki tüpten oluşan on iki set halinde düzenleyin.
- On iki test tüpü setinin her birini plakalarla aynı şekilde etiketleyin, LTEE popülasyon tanımlayıcısının altına bir "1" veya "2" ekleyerek bu popülasyonun seyreltmelerini yapmak için kullanılacakları sırayı belirtin.
- LTEE'nin günlük transferlerine her zamanki gibi devam edecek şişeleri kullanarak 1.1-1.11 arasındaki adımları uygulayın. Adım 1.5 sırasında, arşivleme için ekstra kültürleri içeren on iki şişeyi de sallama inkübatöründen çıkarın.
- On iki ilave şişenin her birinden kültürün 100 μL'lik pipeti, bu LTEE popülasyonu için çiftteki ilk tuzlu su test tüpüne arşivlenir. Tüpleri bu 100 kat seyreltmelerle iyice vorteksleyin. Ardından, her birinden karşılık gelen ikinci tuzlu su tüpüne 100 μL pipet yapın. Son 10.000 katlı kültür seyreltmelerini iyice vorteks.
- 10.000 kat kültür seyreltmesi içeren tüplerin her birinden, bu popülasyon için etiketli TA, MG ve MA plakalarına 80 μL pipet verin. Tercih edildiği gibi steril bir yayma çubuğu veya steril yayılma boncukları kullanarak sıvıyı agar yüzeyine eşit şekilde yayın. On iki popülasyonun tümü üç medya türünün hepsine kaplanana kadar tekrarlayın.
- Gerekirse, agar üzerinde sıvı görünmeyene kadar plakaların kurumasını bekleyin. Plakaları baş aşağı (agar tarafı yukarı bakacak şekilde) 37 ° C'ye ayarlanmış bir yerçekimi konveksiyon inkübatörüne yerleştirin.
NOT: Kuluçka plakalarının baş aşağı inkübasyonu, agarın kurumasını önler ve yoğuşmanın agar yüzeyine damlamasını önler. İnkübasyon sırasında hücrelerin agar yüzeyinde sıvı halinde hareketi, kolonileri bulaştırabilir ve yanlış koloni sayımları verebilir. - Arşivleme için ayrılmış on iki ekstra şişenin her birine 3 mL steril% 80 (v / v) gliserol ekleyin. Dönerek ve hafifçe girdap yaparak iyice karıştırın.
- Karışımı her bir şişeden, numune için benzersiz bir tanımlayıcı ile etiketlenmiş steril kriyovyallere, numunenin ait olduğu LTEE popülasyonuna, dondurulduğu nesle, karışık (popülasyon) bir numune olduğuna ve tarihe dağıtın. Bir büyük şişeye 6 mL ve altı küçük şişenin her birine 1,25 mL pipet yapın.
NOT: Büyük şişe çalışma stoğudur. Küçük bir şişe, çalışma stoğunun tükenmesi veya kirlenmesi durumunda bir yedektir. Diğer beş küçük şişe, diğer laboratuvarlara gönderilebilecek kopyalardır. - Doldurulmuş şişeleri −80 °C'de dondurun.
- 24 saat ve 48 saatlik inkübasyondan sonra TA, MG ve MA plakalarındaki kolonilerin büyümesini ve morfolojilerini inceleyin ve belgeleyin.
NOT: REL606 ve REL607 ataları ve on iki LTEE popülasyonunun her biri tarafından 76.000 kuşakta kaplandıklarında oluşturulan kolonilerin görüntüleri ve açıklamaları için Temsili Sonuçlar bölümüne bakın. - İSTEĞE BAĞLI: Klonal izolatları arşivlerken aşağıdaki adımları uygulayın.
- MG plakalarından her LTEE popülasyonu için üç klonal izolat (koloni) seçin, her birini ayrı ayrı yeni bir MG plakasına çizin ve bu plakaları 37 ° C'de 16-24 saat boyunca inkübe edin.
NOT: Farklı morfolojilere sahip koloniler varsa, LTEC'deki standart uygulama, önce en yaygın türü seçerek, ardından azınlık tiplerinden başka koloniler seçerek maksimum çeşitlilik için örnekleme yapmaktır. Ayrıca, hücreleri yaymadan önce petri kabının alt tarafındaki noktaları işaretleyerek ve daha sonra büyümeden sonra her bir işarete en yakın izole koloniyi seçerek rastgele bir örnekleme stratejisi de kullanılabilir. - Ertesi gün, her plakadan yeni bir MG plakasına temsili bir koloni çizin ve bu plakaları 37 ° C'de 16-24 saat boyunca inkübe edin.
- Ertesi gün, her MG plakasından izole edilmiş bir koloniyi, 10 mL taze DM1000 içeren bir şişeye aşılayın. Ayrıca, ortam kontaminasyonunu test etmek için aşılanmamış bir boşluk görevi görmesi için ek bir şişeyi 10 mL DM1000 ile doldurun.
- Şişeleri 37 ° C'de 16-24 saat boyunca 120 rpm yörüngesel sallayarak 1 inç çapında inkübe edin.
- Kuluçkadan sonra, her şişeye 2 mL steril% 80 (v / v) gliserol ekleyin ve karıştırmak için girdap yapın.
- Her şişeden 1,25 mL alikotları, her klon, LTEE popülasyonu ve menşe üretimi, klonal bir numune olduğu ve tarihi için benzersiz bir tanımlayıcı ile etiketlenmiş küçük, steril şişelere dağıtın.
- Doldurulmuş şişeleri −80 °C'de dondurun.
- MG plakalarından her LTEE popülasyonu için üç klonal izolat (koloni) seçin, her birini ayrı ayrı yeni bir MG plakasına çizin ve bu plakaları 37 ° C'de 16-24 saat boyunca inkübe edin.
3. Rekabetçi uygunluk testleri
NOT: LTEE'de, üreme uygunluğu, farklı bakterilerin günlük transferlerle aynı koşullar altında bir veya daha fazla 24 saatlik kültür döngüsü boyunca elde ettiği nispi iki katına çıkma sayısı açısından ölçülür. Spesifik olarak, bir rakibin diğerine göreceli uygunluğu, bir ortak kültürde kafa kafaya rekabet ettiklerinde gerçekleşen iki katına çıkma oranlarının oranıdır. Bir çiftteki her rakip, daha önce LTEE'nin dondurulmuş "fosil kayıtlarının" bir parçası olarak arşivlenmiş tam bir popülasyon veya klonal bir izolat olabilir. Alternatif olarak, rakiplerden biri veya her ikisi de, etkilerini test etmek için belirli mutasyonları eklemek veya kaldırmak için genetik olarak değiştirilmiş bir klon olabilir. İki yarışmacının zıt Ara+/Ara− durumlarına sahip olması gerekir, çünkü bu genetik belirteç bu tahlil sırasında onları ayırt etmek için kullanılır. Bir yarışma testi için genel iş akışı Şekil 2'de gösterilmiştir. Ortak kültürleme aşamasının süresi, neredeyse eşit olarak eşleşen rakipler arasındaki farklılıkları test ederken uygunluk tahminlerinin hassasiyetini artırmak için bir ila üç (veya daha fazla) gün arasında uzatılabilir. Bu protokolün diğer kritik hususları ve olası değişiklikleri için Disussion'a bakınız.
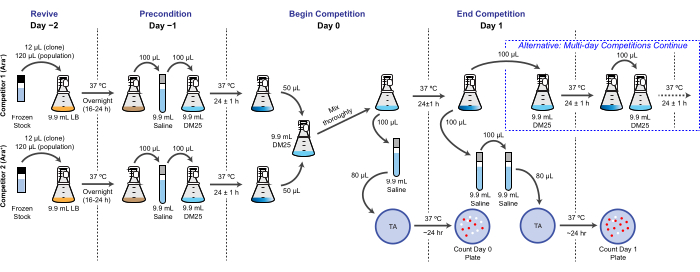
Şekil 2: Rekabet testi akış şeması. Bir günlük yarışma testi için tam prosedür gösterilmiştir. Üç günlük prosedür, 1. Gün ve 2. Gün'deki alternatif yolla, bir günlük yarışmanın 1. Günü için resmedildiği gibi 3. Gün'de kaplanana kadar devam eder. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
- Malzemeleri hazırlama
- Kaç rakip LTEE suşu ve/veya popülasyonunun kullanılacağına ve her bir rakip çifti için kaç tane mükerrer rekabet testinin yapılacağına karar verin. Gerekli malzemeleri aşağıdaki adımlarda açıklandığı gibi hazırlayın.
NOT: Tüm medya ve çözümler için tarifler çevrimiçi olarak mevcuttur30. Bir yarışma deneyinin tüm günleri için gerekli olan şişeler ve test tüpleri, önceden veya kullanılacakları günlerde gerektiğinde doldurulabilir. Şişeler ve test tüpleri önceden doldurulursa, buharlaşmayı en aza indirmek için karanlıkta oda sıcaklığında saklayın. TA plakalarının, ne zaman kullanılacaklarından en az iki gün önce hazırlanmaları gerekir, böylece kültür seyreltmelerinin yayılmasına izin vermek için döküldükten sonra yeterince kuruyabilirler. Pipetleme hataları, kontamine plakalar veya diğer küçük aksilikler olduğunda deneyin devam edebilmesi için her zaman birkaç ekstra şişe, test tüpü ve TA plakası hazırlayın. - Canlanma günü için (Gün −2), rakip olarak kullanılacak E. coli suşu veya popülasyonu başına 9,9 mL DM1000 veya Lysogeny Broth (LB) ile 20 mL'lik bir beher ile kaplanmış bir steril 50 mL Erlenmeyer şişesini doldurun. Aşılanmamış bir boşluk olarak hizmet etmek için bir şişeyi daha aynı ortamdan 9,9 mL ile doldurun.
- Ön koşullandırma günü için (Gün −1), bir test tüpünü rakip başına 9,9 mL% 0,85 (w / v) steril salin, bir çift rakip arasında çoğaltma testi başına 9,9 mL DM25 içeren iki şişe ve boş bir alan için 9,9 mL DM25 içeren bir şişe daha doldurun.
- Yarışmanın başladığı gün için (0. Gün), bir şişeyi 9.9 mL DM25 ile doldurun, bir test tüpünü 9.9 mL% 0.85 (w / v) steril salin ile doldurun ve yarışma testi kopyası başına bir TA plakası hazırlayın. Boş olarak kullanmak için bir şişeyi daha 9,9 mL DM25 ile doldurun.
- ALTERNATİF: İlkini geçen çok günlük bir yarışmanın her günü için, bir şişeyi yarışma başına 9,9 mL DM25 ile doldurun ve bir şişeyi daha boş bir alana 9,9 mL DM25 ile doldurun.
- Yarışmanın son günü için (örneğin, 1. Gün veya 3. Gün), iki test tüpünü 9.9 mL% 0.85 (w / v) steril salin ile doldurun ve yarışma çoğaltması başına bir TA plakası hazırlayın.
- Kaç rakip LTEE suşu ve/veya popülasyonunun kullanılacağına ve her bir rakip çifti için kaç tane mükerrer rekabet testinin yapılacağına karar verin. Gerekli malzemeleri aşağıdaki adımlarda açıklandığı gibi hazırlayın.
- Gün −2: DM1000 veya LB'de rakipleri ayrı ayrı canlandırın
- Rakiplerin her biri için, 9,9 mL DM1000 veya LB ile doldurulmuş bir şişeyi etiketleyin. kontaminasyonu test etmek için aşılanmamış bir boşluk olarak hizmet etmek üzere aynı ortam partisinden 9,9 mL ile doldurulmuş ek bir şişeyi etiketleyin.
NOT: Dondurulmuş stoklar, kriyokorunmuş hücrelerin daha düzgün ve öngörülebilir geri kazanımı için LB veya DM1000'de yeniden canlandırılır. Kriyoprotektan olarak kullanılan gliserol E. coli tarafından metabolize edilebilir, bu da DM25'te numuneler canlandırılırsa beklenenden daha yüksek hücre yoğunluklarına yol açacaktır. LB ve DM1000, bu komplikasyonun ihmal edilebilir hale geldiği kadar yüksek hücre yoğunluklarına büyümeyi destekler. - Rakip suşların donmuş stoklarını içeren kriyovyalleri -80 ° C dondurucudan çıkarın. Şişeleri kullanırken bir buz kovasında soğutulmuş halde saklayın.
- Her dondurulmuş stok çözüldükten sonra, E. coli hücrelerini yeniden askıya almak için iyice vorteks yapın. Bir klonu canlandırıyorsanız, taze ortam içeren şişeyi 12 μL dondurulmuş stokla aşılayın. Bir popülasyonu canlandırıyorsanız, şişeyi 120 μL dondurulmuş stokla aşılayın.
NOT: Dondurulmuş stokun 120 μL hacmi popülasyonlar için kullanılır, böylece yeniden canlanan hücre sayısı, LTEE popülasyonunun% 1'i yeni bir şişeye aktarıldığında günlük darboğazla yaklaşık olarak aynıdır. Dondurulmuş stokların birden çok kez çözülmesi ve vortekslenmesi, hücreleri strese sokabilir ve zamanla stokların yaşayabilirliğini azaltabilir. Belirli bir LTEE popülasyonu veya klonu yarışmalarda birden çok kez kullanılacaksa, stokun birden fazla kopyasını yeniden büyütmek ve dondurmak iyi bir uygulamadır, böylece hiç kimse çözülmez ve birçok kez yeniden dondurulmaz. - Canlanma şişelerini ve boşluğu, 1 inç çapında 120 rpm yörüngesel sallanma ile gece boyunca (16-24 saat) 37 ° C'de inkübe edin.
- Rakiplerin her biri için, 9,9 mL DM1000 veya LB ile doldurulmuş bir şişeyi etiketleyin. kontaminasyonu test etmek için aşılanmamış bir boşluk olarak hizmet etmek üzere aynı ortam partisinden 9,9 mL ile doldurulmuş ek bir şişeyi etiketleyin.
- Gün −1: DM25'te yarışmacıları ayrı ayrı ön koşullandırın
- Her rakip için, 9.9 mL salin ile doldurulmuş bir test tüpünü etiketleyin. Bir çift rakip arasındaki her bir yinelenen rekabet testi için, her biri çoğaltma numarası ve rakiplerden birinin adı ile 9,9 mL DM25 ile doldurulmuş iki adet 50 mL şişeyi etiketleyin. Boş olarak kullanılmak üzere 9,9 mL DM25 ile doldurulmuş ek bir şişeyi etiketleyin.
- Yeniden canlanan rakiplerin kültürlerini içeren şişeleri inkübatörden çıkarın. Büyüdüklerini ve belirgin bir kontaminasyon olmadığını doğrulamak için bulanıklıklarını gözle inceleyin.
- Her bir şişeden 100 μL pipet, bu rakip için tuzlu su test tüpüne konmuştur.
NOT: Bu adım, kültürü 100 kat seyreltir, çünkü LB ve DM1000'de hücrelerin yoğunluğu, LTEE'de kullanılan DM25 ortamında olduğundan çok daha yüksektir (bkz. - Seyreltilmiş kültürden 100 μL'yi taze DM25 içeren bir şişeye pipetlemeden hemen önce her bir seyreltme tüpünü iyice vorteksleyin. Bu ön koşullandırma şişelerinden ikisini, her bir çoğaltma testi için, yarışmacıların her biri için bir tane olmak üzere aşılayın.
- Ön koşullandırma şişelerini ve boşluğu 37 ° C'de 24 ± 1 saat boyunca 1 inç çapında 120 rpm yörüngesel sallanma ile inkübe edin.
- 0. Gün: İlk sayımlar için rakipleri ve plakayı karıştırarak yarışmaya başlayın
- Her yarışma testi için replika, 9.9 mL DM25 ile doldurulmuş bir şişe ve 9.9 mL salin ile doldurulmuş bir test tüpü etiketleyin. Şişeleri ve tüpleri, her bir rakip çiftini ve yarışma testinin yinelenen sayısını benzersiz bir şekilde tanımlayacak şekilde etiketleyin. Boş olarak kullanılmak üzere 9,9 mL DM25 ile doldurulmuş ek bir şişeyi etiketleyin.
- Ön koşullandırma şişelerini inkübatörden çıkarın. Büyüdüklerini ve belirgin bir kontaminasyon olmadığını doğrulamak için bulanıklıklarını gözle inceleyin.
- Ara− rakibinin 50 μL'sini taze DM25 ile doldurulmuş ilk replika yarışma şişesine aktarın. Hemen Ara+ yarışmacısının 50 μL'sini aynı yarışma şişesine aktarın ve hafifçe döndürerek karıştırın.
- Tüm rakip çiftlerinin tüm kopyaları için adım 3.4.3'ü tekrarlayın.
NOT: Yarışma şişeleri artık DM25'te yetiştirilen E. coli kültürlerinin toplam 100 kat seyreltilmesine sahiptir, bu da her günlük transferden sonra LTEE deneyimindeki aynı durum hücreleridir. Transferlerin ve karıştırmanın gerçekleştirilme sırası önemlidir. Her iki rakibi de hemen her bir şişeye birbiri ardına ekleyin, böylece ikisi de taze ortamda büyümeye başlamaz. Örneğin, Ara− kültürlerini tüm yarışma şişelerine eklemeyin ve sonra geri dönüp tüm Ara+ suşlarını ekleyin. - Her yeni aşılanmış yarışma şişesinden 100 μL'lik pipet, bu rekabet testi için etiketlenmiş salin test tüpüne çoğaltılır, böylece bu tüplerin her biri, birleştirilen önceden koşullandırılmış DM25 kültürlerinin toplam 10.000 kat seyreltilmesini içerir.
- Yarışma şişelerini yerleştirin ve çalkalayan inkübatöre boşaltın. Yarışma şişelerini 37 ° C'de 24 ± 1 saat boyunca 1 inç çapında 120 rpm yörünge sallama ile inkübe edin.
- Aynı gün, yarışma şişelerini inkübatöre yerleştirdikten hemen sonra, her bir test tüpünü adım 3.4.5'ten itibaren iyice vorteksleyin ve bu 10.000 kat seyreltmenin 80 μL'sini adım 2.10'da açıklandığı gibi TA plakalarına yayın. Her plakanın alt tarafının yan tarafını, karıştırılan suş çifti, çoğaltma numarası ve her bir rakibin ilk temsilini belirlemek için kullanılacağını belirtmek için "Gün 0" ile etiketleyin.
- TA plakalarını, hem Ara− hem de Ara+ rakiplerinin kolonileri görünür ve ayırt edilebilir olana kadar 37 ° C'de bir yerçekimi konveksiyon inkübatöründe baş aşağı inkübe edin. Genel olarak, bu 16-24 saat içinde gerçekleşir, ancak bazı evrimleşmiş suşlar için daha uzun sürebilir. Her plakadaki Ara− (kırmızı) ve Ara+ (beyaz) kolonilerinin sayılarını sayın vesonuçları kaydedin.
NOT: TA plakalarındaki Ara- ve Ara+ kolonilerinin renkleri arasındaki farklar, plakalar 4 °C'de saklansa bile, zamanla daha az belirgin hale gelir, bu nedenle inkübatörden çıkarıldıktan sonra mümkün olduğunca çabuk sayılmaları gerekir. Ara− ve Ara+ hücreleri tarafından oluşturulan kolonilerin tipik görünümlerini gösteren TA plakalarının görüntüleri Temsili Sonuçlara dahil edilmiştir. Bu bölüm aynı zamanda ortak "kenar durum" kolonilerinin görüntülerini de içerir (örneğin, farklı koloni türlerinin çakışması veya büyümesi) ve bunların nasıl sayılacağını açıklar. Rakiplerden herhangi biri tarafından TA plakaları üzerinde oluşturulan kolonilerin büyüme hızları ve morfolojileri daha önce karakterize edilmemişse, rakiplerin hala birbirlerinden ayrı olduğu 0. Günde, ön koşullandırma şişelerinden tuzlu suda 10.000 kat seyreltmenin 80 μL'sini yayın. Daha sonra, inkübasyondan sonra bu kontrol plakalarındaki kolonileri 37 ° C'de 16-24 saat veya daha uzun süre inceleyin.
- ALTERNATİF: 1. ve 2. Günler: Üç günlük yarışmaya devam edin
- Her yarışma testi için 9,9 mL DM25 ile doldurulmuş bir şişeyi etiketleyin. Şişeleri, her bir rakip çiftini, çoğaltma numarasını ve yarışma testinin gününü benzersiz bir şekilde tanımlayacak şekilde etiketleyin. Boş olarak kullanılmak üzere 9,9 mL DM25 ile doldurulmuş ek bir şişeyi etiketleyin.
- Önceki günkü yarışma şişelerini inkübatörden çıkarın. Beklenen büyümeyi doğrulamak ve kontaminasyonu tespit etmek için bulanıklıklarını gözle inceleyin.
- Her yarışma şişesinden 100 μL'yi, yarışmanın bir sonraki günü için karşılık gelen taze ortam şişesine aktarın.
- Yeni yarışma şişelerini yerleştirin ve çalkalayan inkübatöre boşaltın. Bunları 24 ± 1 saat boyunca 37 ° C'de, 1 inç çapında 120 rpm yörüngesel sallanma ile inkübe edin.
- Devam etmeden önce yarışmanın 2. Gününde 3.5.1-3.5.4 arasındaki adımları tekrarlayın.
- 1. veya 3. Gün: Final sayımları için yarışmayı ve tabağı bitirin
- Her yarışma şişesi için, 9.9 mL salin ile doldurulmuş iki test tüpü hazırlayın. Bunları, her bir rakip çiftini, çoğaltma sayısını ve birinci veya ikinci seyreltme için olup olmadıklarını benzersiz bir şekilde tanımlayacak şekilde etiketleyin.
- Yarışma şişelerini inkübatörden çıkarın. Büyüdüklerini ve belirgin bir kontaminasyon olmadığını tespit etmek için bulanıklıklarını gözle inceleyin.
- Her yarışma şişesinden 100 μL pipet, bu çoğaltma için ilk tuzlu su tüpüne yerleştirilir. Elde edilen tüpler, DM25 kültürlerinin 100 kat seyreltisini içerir.
- İyice karıştırmak için her 100 katlı seyreltme tüpünü vorteks edin ve bu çoğaltma için ikinci tuzlu su tüpüne 100 μL pipet yapın. Elde edilen tüpler, DM25 kültürlerinin 10.000 kat seyreltisini içerir.
- 10.000 kat seyreltme içeren her test tüpünü iyice vorteksleyin ve adım 2.10'da açıklandığı gibi 80 μL'sini bir TA plakasına yayın. Her plakanın alt tarafının kenarını, karıştırılan suş çifti, çoğaltma sayısı ve bir günlük yarışma için "Gün 1" veya üç günlük bir yarışma için "Gün 3" ile etiketleyerek her yarışmacının nihai temsilini belirlemek için kullanılacağını belirtin.
- TA plakalarını 37 ° C'de inkübe edin ve adım 3.4.8'de açıklandığı gibi büyümeden sonra Ara− ve Ara+ kolonilerini sayın.
NOT: Tüm transferler ve kaplama adımları boyunca her yarışma testinin tekrarlanan sayısını takip edin. Hangi son ve ilk sayımların farklı replika tahliller arasında karşılık geldiğini karıştırmak - aynı iki rakip her birinde karıştırılmış olsa bile - yanlış uygunluk tahminlerine neden olacaktır.
- Hesaplama ve arsa uygunluğu
- Göreli uygunluğu hesaplamak ve çizmek için Excel kullanıyorsanız, XLS elektronik tablosunu (Ek Dosya 1) indirin. R kullanıyorsanız, fitnessR paketi31'i yükleyin ve virgülle ayrılmış değerler (CSV) şablonunu (Ek Dosya 2) indirin veya vinyetindeki yönergeleri izleyerek bu dosyanın yeni bir kopyasını oluşturun.
- İndirilen dosyadaki belirtilen hücrede veya sütunda yapılan yarışma testleri için 100'lük bir "transfer seyreltmesi" girin. Yarışmacıların "transfer sayısı" olarak birlikte kültürlendiği günlük büyüme döngülerinin toplam sayısını girin (örneğin, üç günlük bir yarışma için 3).
- Her bir rakip çiftinin adını, referans suşu "rakip1" ve test suşu veya popülasyonu "rakip2" olarak olacak şekilde belirlenen hücrelere veya sütunlara girin.
- Her yarışma tahlili çoğaltması için, indirilen dosyanın belirlenmiş sütunlarına ilgili ilk ve son koloni sayılarını girin.
- Excel elektronik tablosu kullanılıyorsa, artık bu tahminde ortalama göreli uygunluk değerini ve %95 güven sınırlarını görüntüler. Farklı rakip kombinasyonlarının sonuçlarını başka bir sayfaya kopyalayın ve sonuçları özetleyen bir grafik oluşturun. Verileri analiz etmek için R kullanıyorsanız bu hesaplamaları yapmak, hesaplanan değerleri içeren bir CSV dosyası çıktısı almak ve sonuçları çizmek için fitnessR paketinin vinyetindeki yönergeleri izleyin.
Sonuçlar
LTEE kültürlerinin görünümü ve bulanıklığı
DM25'teki düşük glikoz konsantrasyonu nedeniyle, tamamen büyümüş LTEE popülasyonlarının bulanıklığı, on iki şişenin sadece on birinde zar zor görülebilir. LTEE kültürlerini normal büyüme ve kontaminasyon belirtileri açısından gözle incelerken (adım 1.6), LTEE popülasyonu içeren her şişe boşlukla yan yana karşılaştırılmalıdır (Şekil 3A). Bunun istisnası, sitratı ek bir karbon ve enerji kaynağı olarak kullanmak üzere evrimleşen ve bu nedenle daha yüksek bir hücre yoğunluğu32'ye ulaşan A-3 popülasyonudur. REL606 ve REL607 ata suşlarının DM25 kültürlerinin bulanıklığı, tipik bir evrimleşmiş popülasyonunkine benzerdir (Şekil 3B). LTEE suşları ve popülasyonları, daha yüksek glikoz konsantrasyonu ve LB'de çok daha yüksek bir yoğunluk nedeniyle DM1000'de daha yüksek bir yoğunluğa büyür (Şekil 3B). A-3 LTEE popülasyonunun DM25 kültürlerinin yoğunluğu, DM25 ve DM1000'deki REL606 kültürlerinin yoğunlukları arasında orta düzeydedir (Şekil 3C).

Şekil 3: LTEE kültürlerinin ortaya çıkışı. (A) Deneyin 76.253 1/3 nesle ulaştığı gün DM25'teki 24 saatlik büyümeden sonra on iki LTEE popülasyonunu içeren şişeler, boşluğun yanında resmedilmiştir. (B) DM25, DM1000 ve LB'de 24 saat boyunca yetiştirilen REL606 ve REL607 atalarının kültürlerini içeren şişeler, ortam boşluklarının yanında resmedilmiştir. (C) DM25'teki A-3 popülasyon şişesinin bulanıklığının DM25 ve DM1000'deki REL606 atasıyla nasıl karşılaştırıldığını gösteren aynı şişelerin yan yana resimlerine yakınlaştırılmıştır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
DM25'te (adım 1.7) yetiştirilen kültürlerin 600 nm'deki (OD600) optik yoğunluklarının spektrofotometre okumaları, hem LTEE popülasyonları (Şekil 4A) hem de ataları (Şekil 4B) için bu görsel gözlemlerle eşleşmektedir. Bu okumalar, kontaminasyon veya bir hatadan şüphelenildiğinde büyümeyi nicel olarak karşılaştırmak ve belgelemek için kullanılabilir. 76.000 ila 76.500 nesil arasındaki LTEE popülasyonlarının ölçümleri için, sitrat üzerinde büyümek üzere evrimleşen popülasyon olan A-3'ün OD600'ünün ortalama 0.223 olduğunu bulduk (0.218-0.227,% 95 güven aralığı). Diğer on bir popülasyonun OD600'ü ortalama 0.0252 idi (0.0239-0.0265,% 95 güven aralığı). On bir normal popülasyon arasında OD600 okumalarında hafif ama anlamlı farklılıklar vardı (F 10,88 = 5.1035, p = 7.5×10−6). LTEE popülasyonları yaklaşık 5-6 saatlik inkübasyondan sonra durağan faza ulaşır. Sabah transfer edilirlerse, büyüme aynı günün öğleden sonrasının ortasından geç saatlere kadar görülebilir. Birçok mikrop türü sitrat üzerinde aerobik olarak büyüyebilir. Bu nedenle, A-3 dışındaki popülasyonlarda artan bulanıklık, muhtemelen dış kontaminasyonun bir işaretidir.
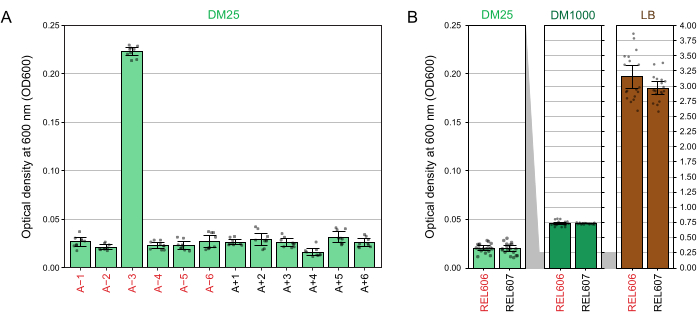
Şekil 4: LTEE kültürlerinin bulanıklığı. (A) Deneyin 76.000 ila 76.500 nesli arasındaki üç farklı günde 24 saatlik büyüme döngüsünden sonra on iki LTEE popülasyonunun 600 nm'sinde (OD600) optik yoğunluk. Üç farklı günün her birinde üç adet 1-mL alikotun OD600 değerleri nokta olarak çizilir. Aynı güne ait boşluğun üç farklı alikotunun ortalama OD600 değeri bu değerlerden çıkarıldı. Doldurulan çubuklar ortalamaları gösterir. Hata çubukları %95 güven sınırlarıdır. (B) DM25, DM1000 ve LB'deki REL606 ve REL607 atalarının kültürlerinin OD600'ü. Her koşul ve gerinim için iki ayrı kültürün üç farklı gününün her birinde üç adet 1-mL alikotun OD600 değerleri noktalar olarak çizilir. Aynı güne ait boşluğun üç farklı alikotunun ortalama OD600 değeri bu değerlerden çıkarıldı. Doldurulmuş çubuklar ortalamaları gösterir ve hata çubukları %95 güven sınırlarıdır. Paneller arasındaki gri gölgeli alanlar, OD600 ekseninin DM25 paneli ile DM1000 ve LB panelleri arasında nasıl yeniden ölçeklendirildiğini gösterir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
LTEE kolonilerinin büyümesi ve morfolojisi
Popülasyonları farklı ortamlara kaplayarak kontaminasyon açısından kontrol ederken (adım 2.15), REL606 ve REL607 ataları ve tüm evrimleşmiş popülasyonlar, minimal glikoz (MG) agar plakaları üzerinde yarı saydam ve biraz düzensiz kenarları olan beyaz koloniler oluşturur (Şekil 5A). MG agar'ın bileşimi, daha yüksek bir glikoz konsantrasyonu hariç, günlük LTEE transferlerinde kullanılan DM25 ile aynıdır, bu nedenle evrimleşmiş LTEE popülasyonları genellikle MG üzerinde atalardan daha büyük koloniler oluşturur. DM25'teki daha yüksek hücre yoğunluğu nedeniyle, A-3 popülasyonu, diğer popülasyonlarla aynı hacim kaplanırsa, birkaç kat daha fazla koloniye sahip olacaktır ve bu, kolonilerin boyutunu sınırlayabilir. En yaygın kirletici mikrop türleri, MG üzerinde keskin beyaz, opak ve mükemmel dairesel koloniler oluşturur.
Minimal arabinoz (MA) agarında, REL607 atası ve Ara + popülasyonları tipik olarak hafif yarı saydam beyaz koloniler oluşturur. Bu tipik büyüme paterni, Ara+ popülasyonları için, arabinoz üzerinde büyümede bir kusur geliştiren ve artık MA'da koloniler oluşturmayan A + 6 hariç, 76.000 nesil boyunca devam etmiştir (Şekil 5B). DM25'teki LTEE transferleri sırasında arabinoz üzerinde büyümeyi sürdürmek için bir seçim yoktur, bu nedenle diğer Ara + popülasyonları da deney devam ettikçe MA agar plakalarında koloni oluşturmayı bırakabilir. A-3 hariç, Ara-popülasyonları MA agar üzerinde koloni oluşturmaz, ancak yakından incelendiğinde agardaki iz besinler nedeniyle mikrokoloniler ortaya çıkabilir. A-3 popülasyonu, MA'da çok sayıda küçük koloni oluşturur, çünkü bu hücreler bu ortamda da bulunan sitrat üzerinde büyüyebilir. MA'daki kontaminant koloniler nadirdir.
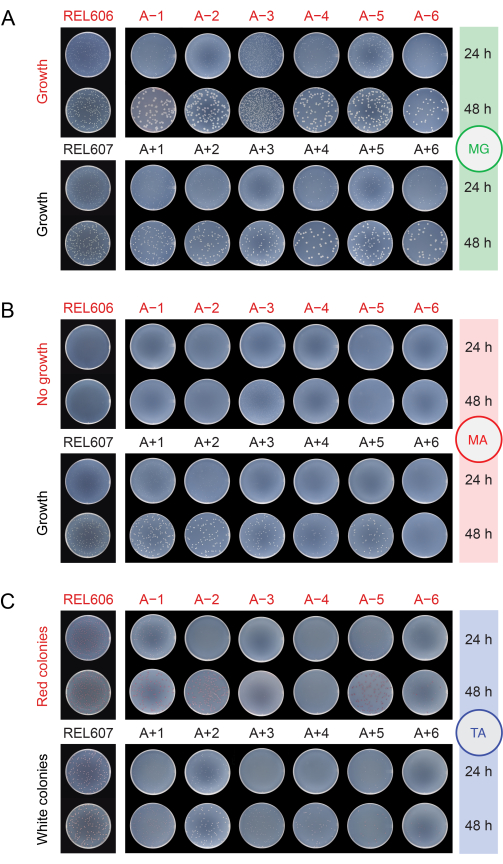
Şekil 5: Kontaminasyonu tespit etmek için LTEE popülasyonlarının kaplanması. Deneyin 76.026 2/3 nesline ulaştığı gün REL606 ve REL607 atalarının ve on iki LTEE popülasyonunun seyreltilmesi, (A) MG, (B) MA ve (C) TA agar plakalarına kaplandı ve 24 saat ve 48 saat sonra fotoğraflandı. Tüm kültürler için aynı seyreltmeler yapıldı, ancak daha yüksek hücre yoğunluklarını biraz hesaba katmak için LTEE popülasyonları protokolünde tarif edildiği gibi atalar için yarı yarıya daha fazla hacim kaplandı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tetrazolium arabinoz (TA) agarında, REL606 atasının ve tüm Ara-popülasyonlarının kırmızı koloniler oluşturması beklenirken, REL607 atası ve tüm Ara+ popülasyonları genellikle beyaz (açık pembe veya şeftali tonlarını içerebilir) koloniler oluşturmalıdır (Şekil 5C). LTEE ataları, 16-24 saat içinde TA agar'da Ara− ve Ara+ olarak kolayca tanımlanabilen sağlam koloniler oluşturur. Başlangıçta, bu fark Ara− ve Ara+ popülasyonları arasındaki çapraz kontaminasyonu tespit etmek için kullanılabilir. Bununla birlikte, TA agar, günlük transferlerde kullanılan kimyasal olarak tanımlanmış DM25 ortamından daha karmaşık bir besin bileşimine sahiptir ve LTEE'deki E. coli'nin bu koşullar altında sağlam bir şekilde büyüme yeteneğini sürdürmesi için evrimsel bir baskı olmamıştır. Sonuç olarak, bazı evrimleşmiş LTEE popülasyonları şimdi TA plakalarında zayıf büyüme sergilemekte, koloniler oluşturmak için 48 saat sürmekte veya hiç güvenilir bir şekilde büyümemektedir. Evrimleşmiş LTEE popülasyonları tarafından TA üzerinde oluşturulan kolonilerin renkleri ve morfolojileri de atalara göre değişmiş ve birbirlerinden ayrılmışlardır. Birkaç anormal koloninin varlığı her zaman kontaminasyonun bir göstergesi değildir. LTEE suşlarının Ara belirteç durumunu, özellikle Ara+ 'dan Ara- 'ya değiştiren spontan mutasyonlar meydana gelebilir, çünkü arabinoz kullanımını etkileyen fonksiyon kaybı mutasyonlarının daha yüksek olasılığı, araA aktivitesini geri kazandıran reversiyon mutasyonlarına karşı daha yüksektir. Ara belirteci durumlarını değiştiren mutasyonlar, hipermutasyon geliştirmiş popülasyonlarda daha yaygındır (A-1, A-2, A-3, A-4, A + 3 ve A + 6)13. TA agar'da, diğer türlerin kirletici mikropları genellikle (ancak her zaman değil), herhangi bir LTEE suşu veya popülasyonu tarafından oluşturulanlardan farklı olan farklı beyaz sınırlarla çevrili kırmızı merkezlere sahip küçük, mükemmel dairesel koloniler oluşturur.
Ortak kültür yarışması sonuçları
İki LTEE atasının tüm Ara− ve Ara+ çiftleri (sırasıyla REL606 ve REL607) ile 20.000 kuşakta arşivlenen A−5 ve A+5 popülasyon örnekleri (sırasıyla REL8597 ve REL8604) arasındaki yarışmalar, farklı Ara belirteç durumlarına sahip kolonilerin TA agar'da nasıl ayırt edilebileceğini ve sayılabileceğini göstermektedir (adım 3.4.8 ve 3.6.6) (Şekil 6). DM1000'de canlanma ile başlayan bir günlük ve üç günlük tahlillerden önce ve sonra her bir rakip çifti için altı kopya şişe için koloniler sayıldı (Tablo 1). Aynı seyreltme ve hacim kaplaması için gözlemlenen toplam koloni sayısı, rakiplerin karıştırıldığı ile değişir, çünkü evrimleşmiş LTEE popülasyonlarının kültürleri, DM25'teki ata suşlarının kültürlerinden daha düşük hücre yoğunluklarına ulaşır. Bu fark, deneyin ilk birkaç bin nesli boyunca tüm LTEE popülasyonlarında meydana gelen artan hücre boyutunun evriminin bir sonucudur 8,33.
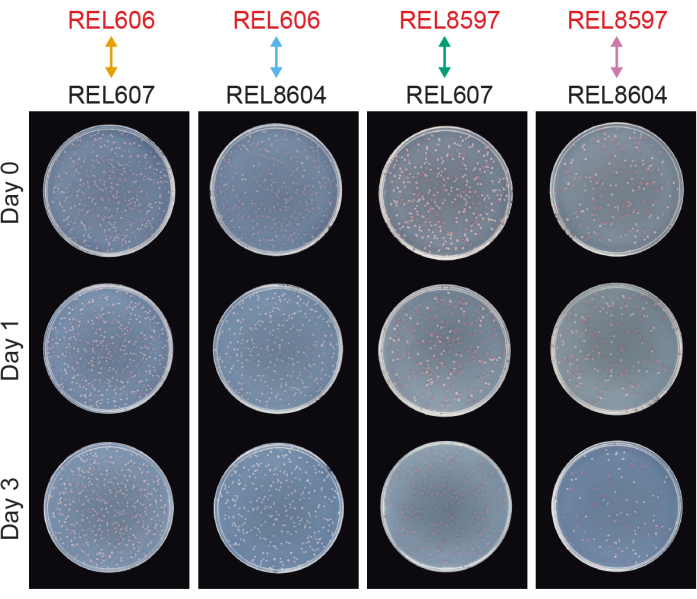
Şekil 6: TA agar plakaları üzerine kaplanmış yarışma tahlilleri. Rekabet testlerinden TA agar plakalarına örnekler. REL606 ve REL607, LTEE'nin sırasıyla Ara ve Ara + atalarıdır. REL8597 ve REL8604, LTEE'nin donmuş "fosil kayıtlarından" sırasıyla 20.000 nesil A-5 ve A + 5 popülasyonlarıdır. Her bir suş çifti arasındaki bir replika tahliline karşılık gelen TA plakaları, yarışmanın 0. Günü, 1. Günü ve 3. Günü için gösterilir. Plakalar, 37 ° C'de 24 saatlik büyümeden sonra fotoğraflandı. REL606 ve REL8597 rakiplerinin hücreleri Ara'dır ve kırmızı koloniler oluşturur. REL607 ve REL8604 rakiplerinin hücreleri Ara+ 'dır ve beyaz koloniler oluşturur. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tipik bir rekabet TA plakasındaki kolonilerin çoğu, farklı tiplerde başlangıçta dairesel kolonilerin kaç tanesinin birlikte büyüdüğünü saymanın kolay olduğu şekillerde iyi ayrılacak veya örtüşecektir (Şekil 7A). Bununla birlikte, iki rengin bir karışımı olan atipik bir koloninin veya büyümenin nasıl sayılacağının açık olmadığı bazı durumlar ortaya çıkabilir. İlk olarak, beyaz bir Ara+ kolonisi ve kırmızı bir Ara-kolonisi üst üste bindiğinde, Ara+ kolonisi aşırı büyüme ve Ara-kolonisini sarma eğilimindedir. Bu durumda, daha büyük Ara+ kolonisindeki küçük bir kırmızı yama veya yarı saydam "boşluk" bir Ara-kolonisi olarak sayılmalıdır (Şekil 7B). İkincisi, kendiliğinden Ara+ mutantları zaman zaman Ara-kolonilerinde ortaya çıkacaktır. Bu mutantlar tipik olarak kırmızı bir koloninin içinden daha hızlı yayılan beyaz sektörler (papillalar) olarak görünürler, çünkü ek bir besin maddesi olarak arabinoza eriştiklerinde daha hızlı büyürler (Şekil 7C). Bu beyaz sektörlü koloniler bir Ara-kolonisi olarak sayılır ve Ara+ kolonisi sayılmaz. Bu durum, plakalar 48 saat veya daha uzun süre inkübe edilirse daha yaygın hale gelir. Üçüncüsü, bazen yarı saydam pembemsi koloniler gözlenir (Şekil 7D). Bunlar Ara- rakibi tarafından oluşturulur. Son olarak, kırmızının biraz farklı bir tonu olan iç kısımlara sahip az sayıda dairesel koloni, bazen agarın hazırlanması sırasında birkaç dış mikrobiyal hücre tarafından kontamine olduklarında veya yüzeylerine kültür seyreltmeleri yayarken TA plakaları üzerinde büyürler (Şekil 7E). Bu kirletici koloniler sayılmamalıdır. Bir rekabet kültürünün kontaminasyonundan şüpheleniliyorsa, TA plakalarından herhangi birinde birçok atipik koloni olduğu için, bu kopya hariç tutulmalıdır.
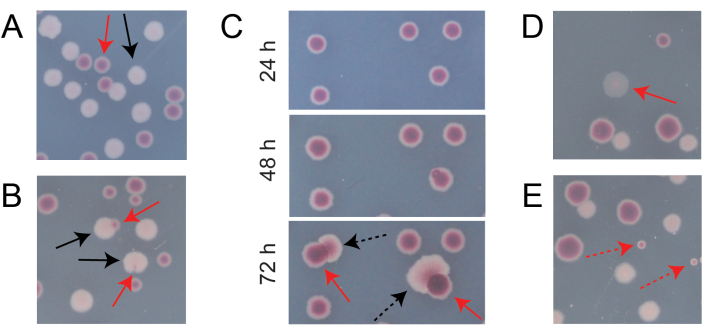
Şekil 7: TA agar üzerindeki Ara− ve Ara+ kolonilerini sayarken karşılaşılan kenar durumları. Her panelde, sayılması gereken bazı Ara− ve Ara+ kolonileri sırasıyla düz kırmızı ve siyah oklarla işaretlenmiştir. Sayılmaması gereken koloniler, göründükleri türe karşılık gelen kesikli oklarla gösterilir. Tüm fotoğraflar 24 saatlik inkübasyondan sonra çekildi, panel C. (A) Normal Ara− ve Ara+ kolonilerinin örnekleri. (B) Ara+ kolonilerinin yakınlarda aşırı büyüdüğü örnekler, beyaz koloninin dışında sadece şeffaf bir boşluk olarak zar zor görülebilen bir koloni de dahil olmak üzere. Bu vakaların her birini, her türden bir tane olmak üzere iki koloni olarak sayın. (C) Ara+ mutant sektörlerine yol açan Ara-koloni örnekleri. Her vakayı sadece tek bir Ara-kolonisi olarak sayın. Ortaya çıkan beyaz sektör (papilla), koloni içinde ortaya çıkan bir Ara+ mutantından kaynaklanmaktadır. Aynı koloni alanı, 24 saat, 48 saat ve 72 saatlik büyümenin ardından gösterilmiştir. (D) Yarı saydam pembe koloni örneği. Ara− olarak sayın. (E) E. coli olmayan bir mikrobun dışarıdan kontaminasyonu ile oluşan koloni örnekleri. Bunlar kırmızı ama daha küçüktür ve belirgin bir beyaz sınırla mükemmel daireseldir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Excel elektronik tablosunu (Ek Dosya 1) kullanarak veya CSV şablonuna (Ek Dosya 2) girilen koloni sayımlarında R'deki fitnessR paket işlevlerini çalıştırarak bu yarışmalardan koloni sayılarını analiz etmek, iki atanın testin hassasiyeti içindeki uygunlukları açısından ayırt edilemez olduğunu, hem 20.000 nesil A-5 hem de A + 5 popülasyonlarının atalardan önemli ölçüde daha uygun olduğunu, ve her iki evrimleşmiş popülasyonun da diğerinden anlamlı derecede daha uygun olmadığı (Welch'in t-testleri, p > 0.05) (Şekil 8). Göreceli uygunluk tahmininin hassasiyeti, üç günlük yarışmalarda, yakından eşleşen çiftlerden biri için bir günlük yarışmalara kıyasla iyileşir (REL606 vs. REL607). Bu ölçümlerin hassasiyeti, istenirse, daha fazla büyüme döngüsüne sahip daha uzun yarışmalar yapılarak daha da artırılabilir. Bununla birlikte, çok günlük yarışmalardan elde edilen sonuçlar, bir yarışmacı ek rekabet günlerinden sonra diğerine göre o kadar bol hale geldiğinde, iki suşun oranı doğru bir şekilde belirlenemediği için bilgilendirici değildir, çünkü sayılacak daha az uygun tipte koloni vardır veya hiç yoktur. Bu, ataların evrimleşmiş 20.000 nesil popülasyonuna karşı üç günlük yarışmaları için geçerlidir (REL606'ya karşı REL8604 ve REL607'ye karşı REL8597) (Şekil 6 ve Tablo 1).
Tablo 1: Koloni, rekabetçi uygunluk testlerinden sayılır. İki Ara− ve iki Ara+ yarışmacısının tüm ikili kombinasyonları için altı kopya içeren bir günlük ve üç günlük yarışma testleri yapıldı. REL606 ve REL607, LTEE'nin sırasıyla Ara ve Ara + atalarıdır. REL8597 ve REL8604, LTEE'nin donmuş "fosil kayıtlarından" sırasıyla 20.000 nesil A-5 ve A + 5 popülasyonlarıdır. Bu Tabloyu indirmek için lütfen tıklayınız.
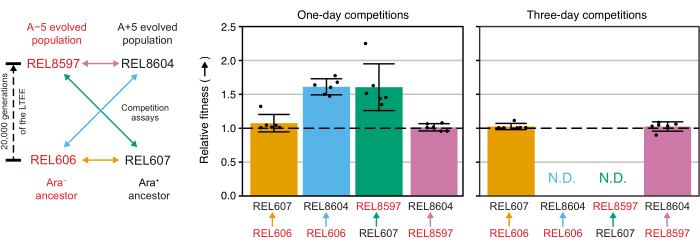
Şekil 8: Rekabet testleri kullanılarak ölçülen göreceli uygunluk. LTEE ataları ile 20.000 nesil A-5 ve A + 5 LTEE popülasyonları arasındaki bir ve üç günlük rekabet testlerinin sonuçları. Soldaki diyagram, dört çift yarışmayı renk kodlu çift başlı oklar olarak göstermektedir. İki Ara− (kırmızı etiket) ve iki Ara+ (siyah etiket) rakibinin her kombinasyonu altı kat çoğaltma ile test edildi. Tablo 1'deki koloni sayımları, fitnessR paketi31 kullanılarak R'de analiz edildi ve sonuçlar ggplot2 paketi (sürüm 3.4.0)34 kullanılarak çizildi. Uygunluk, etiketteki okun okun geldiği rakibe göre gittiği rakip olarak görüntülenir (örneğin, REL606'ya göre REL8604). Her yarışma testi replikası için koloni sayımlarından tahmin edilen göreli uygunluk değerleri (puan), rakip çifti için ortalama göreli uygunluk değerleri (diyagramla aynı renk kodlamasıyla doldurulmuş çubuklar) ve% 95 güven aralıkları (hata çubukları) gösterilir. Atalar ve evrimleşmiş popülasyonlar arasındaki üç günlük yarışmalar için göreceli uygunluk değerleri belirlenemedi (N.D.) çünkü 3. Gün plakalarında ataların sıfır veya çok az kolonisi vardı (bakınız Tablo 1). Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Ek Dosya 1. Göreli uygunluğu hesaplamak için Excel elektronik tablo dosyası. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2. fitnessR paketini kullanarak R'deki göreli uygunluğu hesaplamak için virgülle ayrılmış değerler giriş dosyası şablonu. Bu Dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
LTEE'nin ve yöntemlerinin uzun vadeli esnekliği
E. coli Uzun Vadeli Evrim Deneyi (LTEE) şimdi dördüncü on yılında. Herhangi bir süredeki mikrobiyal evrim deneyi için, tekrarlanabilir bir ortam sağlamak, kontaminasyondan kaçınmak, numuneleri arşivlemek ve uygunluğu doğru bir şekilde ölçmek kritik öneme sahiptir. LTEC, homojen bir ortam yaratan iyi çalkalanmış şişelerin kullanımı ve düşük hücre yoğunluğunu destekleyen kimyasal olarak tanımlanmış bir büyüme ortamı da dahil olmak üzere bu hedeflere ulaşmak için zaman içinde test edilmiş birkaç strateji göstermektedir. Dahası, LTEC, evrim ortamında hem kolayca taranan hem de seçici olarak nötr olan bir fenotip (koloni rengi) veren genetik bir belirteçte farklılık gösteren ata suşlarını kullanır. Bu deneysel tasarım özelliği, iç ve dış kontaminasyonu tanımlamak için bir araç sağlar ve uygunluğun ölçülmesini kolaylaştırır. Bununla birlikte, LTEE tarafından 1988'den beri kullanılan tüm prosedürlerin ve önlemlerin eşit derecede sağlam olduğu kanıtlanmamıştır. LTEE başladığında güvenilir olan bazı yöntemler, E. coli popülasyonları geliştikçe daha az etkili hale gelmiştir. Neyse ki, bu sorunlu yöntemler artık deneyin başlangıcından bu yana geliştirilen teknolojiler kullanılarak artırılabilir veya değiştirilebilir.
Kontaminasyonu algılama
Kontaminasyonun tespiti LTEE için kritik öneme sahiptir. Kontaminasyon iki tür olabilir: LTEE popülasyonları arasında (çapraz kontaminasyon) ve çevreden gelen mikroplarla (dış kontaminasyon). Çoğunlukla, aseptik tekniklerin dikkatli kullanımı ve medya hazırlığı ve günlük transferler sırasında yakın dikkat, her iki tür kontaminasyonu da önler, ancak bunlar gerçekleşir. Deneyin başlarında, çapraz kontaminasyon örneklerini tespit etmek için TA agar üzerine kaplama yapılabilir, çünkü transferler her zaman Ara− ve Ara+ popülasyonları arasında değişmiştir. Bu E. coli'nin belirli bakteriyofajlara duyarlılığının ve direncinin parmak izinin, LTEE popülasyonlarını, onları kirletebilecek yaygın olarak kullanılan E. coli laboratuvar suşlarından ayırt edebilecek bir tasarım özelliği olması amaçlanmıştır4. Bununla birlikte, bu genetik belirteçler deney ilerledikçe güvenilmez hale gelmiştir (örneğin, bazı popülasyonlar artık TA agar üzerinde koloniler oluşturmamaktadır)10,35. Neyse ki, popülasyonlar, deney sırasında ayrı evrimsel tarihler yaşadıkları için genetik olarak farklılaştılar, bu da şimdi çapraz kontaminasyonu tespit etmek için kullanılabilecek yeni genetik belirteçler yarattı. Örneğin, her popülasyon pykF ve nadR genlerinde 14,36,37 mutasyonlarının benzersiz bir kombinasyonunu geliştirmiştir. Bazen PCR'yi yükseltir ve Sanger, olağandışı morfolojilere veya renklere sahip kolonilerin çapraz kontaminasyondan kaynaklanıp kaynaklanmadığını test etmek için bu iki geni sıralar. Tüm genom ve tüm popülasyon dizilemesinin maliyetleri düşmeye devam ettikçe, LTEE popülasyonlarının rutin dizilimi yakında mümkün olabilir, böylece kontaminasyon belirtileri açısından onları izlemek için yeni fırsatlar sunar.
Rekabetçi uygunluğu ölçme
LTEE'nin orijinal yöntemlerini aştığı bir başka durum, evrimleşmiş E. coli'nin uygunluğunun, deneysel ortamda, burada açıklanan protokolü kullanarak bugünün popülasyonlarının atalarına göre uygunluğunu artık doğrudan ölçemeyecek kadar artmış olmasıdır. Evrimleşmiş popülasyonlar ataları o kadar geride bırakıyor ki, bir günlük bir rekabetten sonra sayılacak çok az veya hiç ata kolonisi kalmıyor. Bu büyük uygunluk farkıyla başa çıkmak için bir yaklaşım, suşların eşit olmayan başlangıç oranlarını kullanmak, daha az uygun olan rakibe (örneğin, 90 μL atası ve 10 μL evrimleşmiş rakip) doğru karıştırılan başlangıç hacimlerini ağırlıklandırmaktır. İkinci bir yaklaşım, LTEE atasından daha yüksek bir uygunluğa sahip evrimleşmiş bir Ara-klonunu tanımlamak, MA agar üzerinde seçilerek spontan bir Ara+ revertant mutantını izole etmek ve daha sonra bir rekabet testi 6,38 kullanarak revertant suşunun ebeveyni ile aynı uygunluğa sahip olduğunu doğrulamaktır. Bu yeni Ara−/Ara+ çifti daha sonra REL606/REL607 yerine bir dizi ortak rakip suş olarak kullanılabilir. İdeal olarak, ortak bir rakip olarak seçilen evrimleşmiş Ara-klonu (ve onun Ara+ revertant'ı), bir deneydeki tüm ilgi alanlarına göre ara uygunluğa sahip olacaktır. LTEE'nin ilk 50.000 nesli boyunca, bu iki yaklaşım (eşit olmayan başlangıç oranları veya ortak bir rakip kullanarak), tipik yaklaşım39'a kıyasla anlamlı derecede farklı uygunluk ölçümleri üretmedi.
Rekabet protokolündeki bu değişiklikler, her zaman doğru olmayabilecek bazı basitleştirici varsayımlar yapar. Birincisi, fitness ölçümlerinin geçişli olmasıdır. Yani, her biri iki popülasyonu ortak bir rakip suşa karşı ayrı ayrı rekabet edersek, o zaman iki popülasyonun birbirine göreceli uygunluğunu çıkarabiliriz. Bu ilişkinin LTEE40 için çoğunlukla doğru olduğu bulunmuştur, ancak diğer deneyler41 için geçerli değildir. Bu tutarsızlığın bir nedeni, frekansa bağlı negatif uygunluk etkilerinin evrimi olabilir. Bu durum, LTEE'nin A-2 popülasyonundan iki farklı farklı soydan izole edilen suşlar birbirleriyle rekabet ettiğinde ortaya çıkar19,42. Her birinin, birlikte yaşamalarını stabilize eden çapraz beslenme nedeniyle nadir olduğunda bir avantajı vardır. Farklı mutasyon kümelerine sahip soyların uzun süreli bir arada varlığını gösteren sıralama verileri, benzer etkileşimlerin diğer LTEE popülasyonlarında da ortaya çıkmış olabileceğini düşündürmektedir14,43, ancak uygunluk tahminlerini gözle görülür şekilde değiştirecek kadar güçlü olup olmadıkları açık değildir. Son olarak, LTEE32'nin A-3 popülasyonunda sitrat üzerindeki aerobik büyümenin evrimi, bu hücrelerin uygunluğunun artık sitrat kullanamayan hücrelere karşı rekabet ettiklerinde "özel" bir kaynağın kullanımını içerdiği anlamına gelir, bu da bu sonuçların yorumlanmasını zorlaştırır. Bu istisnalara rağmen, düşük glikoz konsantrasyonunun ve iyi çalkalanmış bir ortamın kullanılması, LTEE suşları ve popülasyonları arasında uygunluk karşılaştırmaları yapmayı şüphesiz basitleştirmiştir.
Daha sonraki nesillerde, LTEE popülasyonlarının bazıları artık TA agar üzerinde koloniler oluşturmaz, bu da modifiye protokolleri bile kullanarak rekabet deneyleri yapmayı zorlaştırır veya imkansız hale getirir10. Koloni büyümesi gerektirmeyen alternatif yöntemler, bir amplikon44'te iki alternatif alel içeren okumaların oranını saymak için yeni nesil dizileme kullanan FREQ-seq gibi iki rakibin göreceli temsilini belirlemek için potansiyel olarak kullanılabilir. Bu yöntem veya benzeri bir yöntem potansiyel olarak Ara alelleriyle veya pykF ve nadR'dekiler gibi yeni evrimleşmiş mutasyonlarla atasal diziye karşı kullanılabilir. Diğer nötr belirteç türlerini tanıtan genetik modifikasyonların gerçekleştirilmesi, göreceli uygunluğu ölçmek için de kullanılabilir. Örneğin, LTEE yan deneylerinde hücrelerin kromozomlarına floresan protein genleri yerleştirilmiştir, böylece rakipler akış sitometrisi45 kullanılarak sayılabilir. Aynı yarışma şişesinde ikiden fazla suşu karıştırma olasılığını ortaya çıkaran bir başka yaklaşım, PCR ile güçlendirilebilen ve farklı rakiplerin genomlarına dizilebilen barkodlar eklemektir. Bu yaklaşım, evrim deneylerinde soy takibi için kullanılmıştır46. Hem akış sitometrisi hem de barkod dizileme, koloni sayımına karşı iki suşun çok daha aşırı oranlarını doğru bir şekilde ölçebilir (çünkü bir agar plakasında sayılabilen < 500'e karşı > 10.000 hücre / genom sorgulayabilirler), bu nedenle bu yöntemleri kullanmak, ortak bir rakibe göre ölçülebilen uygunluk farklılıkları açısından dinamik aralığı artırmayı da vaat eder.
Uzun süreli mikrobiyal evrim deneyleri için alternatif tasarımlar
Tüm erdemlerine rağmen, LTEE mükemmel değildir. Tasarımının bazı yönleri, emek yoğun ve insan hatasına duyarlı hale getirir. Örneğin, her gün bir araştırmacı laboratuvara gelmeli ve deneye devam etmek için Erlenmeyer şişeleri arasında pipet yapmalıdır. Rekabet deneyleri, steril cam eşya, medya, inkübatör alanı ve koloni sayımı gereksinimlerinin, az sayıda rakip bile mütevazı bir çoğaltma ile test edildiğinde hızla arttığı göz önüne alındığında, göz korkutucu lojistik engeller de oluşturabilir. Sık sık, 96 kuyucuklu mikroplakalar üzerinde çalışan pipetleme robotları veya kemostatlar veya türbidostatlar gibi sürekli kültür sistemleri gibi laboratuvar otomasyon sistemlerinden neden yararlanmadığımız sorulur. Cevap basit: LTEE, bir anlamda, kendi uzun tarihinin tutsağıdır. 50 mL Erlenmeyer şişelerinde belirli bir hızda sallanan 10 mL kültürlerden sapmaya cesaret edemeyiz, çünkü bu deneyi temelden değiştirme riski taşır. Bu popülasyonların on yıllardır adapte oldukları çevrenin ince yönleri (örneğin, havalandırma miktarı), mikroplakalarda veya sürekli kültür sistemlerinde değiştirilecektir. Her transferdeki popülasyon darboğazı da farklı olabilir (örneğin mikroplakalarda daha küçük), evrimsel dinamikleri değiştirebilir. Kısacası, burada açıklanan yöntemlerden sapmak, LTEE'yi farklı bir deney haline getirecek veya en azından evrimsel yörüngeleri bozacak bir süreksizlik getirme riskini taşıyacaktır.
Yeni evrim deneyleri tasarlayan araştırmacılar, mikrobiyal popülasyonları yaymanın bu diğer yollarını göz önünde bulundurmalı, aynı zamanda potansiyel yararlarının ve dezavantajlarının farkında olmalıdır. Mikro kuyu plakalarındaki popülasyonları aktarmak için pipetleme robotlarının kullanılması bazı yönlerden lojistik olarak daha basittir ve bu şekilde çoğaltılabilen çok sayıda replika popülasyonu nedeniyle oldukça güçlü olabilir47,48,49. Bununla birlikte, mevcut kurulumların çoğunda otomatik transferler tamamen steril koşullar altında gerçekleşmez, bu da dış kontaminasyon olasılığını artırır. Kirlenmeyi önlemek için, büyüme ortamı genellikle evrimi etkileyen çevrenin bir özelliği haline gelen antibiyotiklerle desteklenir. Mikro kuyucuk plakalarındaki transferler de çapraz kontaminasyon olaylarına daha yatkındır. Son olarak, mikro kuyu plakalarının ortamı - özellikle sarsılmazlarsa - duvar büyümesi, kümelenme ve bir kuyuda birden fazla niş oluşturarak evrimi karmaşıklaştırabilecek diğer fenomenleri seçme eğilimindedir. Küçük kuyularda popülasyon boyutlarını büyük tutmak için zengin medya veya yüksek konsantrasyonlarda besin maddelerinin kullanılmasının bu karmaşıklıkları daha da kötüleştirmesi muhtemeldir. Bu tür etkileşimler ortaya çıkarsa, zindeliği ölçmeyi ve yorumlamayı çok daha zor hale getirebilirler.
Mikrobiyal evrim için sürekli kültür sistemleri, taze ortamın sürekli olarak pompalandığı ve kültürün pompalandığı kemostatları ve kültürlerin hücreleri sürekli büyüme durumunda tutmak için otomatik algılama ve pompalama yoluyla periyodik olarak seyreltildiği türbidostatları içerir. Bu sistemler, mikrobiyal fizyolojiyi ve evrimi modellemek istendiğinde çok faydalıdır, çünkü mikropları her zaman besin maddelerine sahip bir ortamda tutarak büyüme ve açlık arasında geçiş yapmalarını önlerler50. Optik yoğunluk,O2 tüketimi, pH ve bir kültürün ortamının ve büyümesinin diğer yönlerinin gerçek zamanlı ölçümlerini yapan sensörler bile eklenebilir. Bununla birlikte, mevcut sürekli kültür sistemleri ya pahalı ekipman alımları ya da özel kurulumlar oluşturmak için özel uzmanlık gerektirir51,52,53,54. Ayrıca, hücrelerin kültür odasına yapışarak seyreltmeden kaçtığı duvar büyümesi, periyodik olarak sterilize edilmedikçe sürekli kültür sistemlerinde evrimsel dinamikleri bozar. Bu kısıtlamalar nedeniyle, bugüne kadar çoğu kemostat ve türbidostat evrim deneyi sınırlı bir süreye sahip olmuştur ve / veya seri transfer evrimi deneylerine kıyasla nispeten az sayıda bağımsız olarak gelişen popülasyonu içermektedir.
Son
LTEE için burada gösterdiğimiz yöntemler, eşsiz tarihsel kayıtlarını incelemek ve bu E. coli popülasyonlarının açık uçlu evrimini sürdürmek için kritik öneme sahiptir. Ayrıca, laboratuvar otomasyonundan yararlanabilecek veya LTEE'den kasıtlı olarak çıkarılan doğal ortamlarda bulunan karmaşıklığın çeşitli unsurlarını geri ekleyebilecek yeni evrim deneylerini düşünen diğerleri için bir başlangıç noktası sağlarlar. 1988'den bu yana, deneysel evrim bir alan olarak gelişmiştir. Bu süre zarfında, dünyanın dört bir yanındaki laboratuvarlardaki araştırmacılar, evrimi incelemek, yaratıcı deneysel tasarımlar sunarak yenilik yapmak ve yeni teknolojileri kullanarak sonuçları izlemek için bu yaklaşımın muazzam esnekliğini gösterdiler. LTEE'nin yöntemleri bir bitiş noktasını temsil etmemektedir, ancak gelecekte bu alan için ilham vermeye ve bir temel oluşturmaya devam edeceklerini umuyoruz.
Açıklamalar
Hiçbir çıkar çatışması beyan edilmedi.
Teşekkürler
Richard Lenski'ye ve özellikle Neerja Hajela da dahil olmak üzere E. coli ile Uzun Vadeli Evrim Deneyi'nin sürdürülmesine katkıda bulunan ve katkıda bulunan birçok araştırmacıya teşekkür ederiz. LTEE şu anda Ulusal Bilim Vakfı (DEB-1951307) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | T8877 | |
| 20 mL Glass Beaker | Sigma-Aldrich | CLS100020 | |
| 50 mL Erlenmeyer Flasks | Sigma-Aldrich | CLS498050 | |
| Agar | Sigma-Aldrich | A1296 | |
| Ammonium Sulfate | Sigma-Aldrich | AX1385 | |
| Antifoam | Sigma-Aldrich | A5757 | |
| Arabinose | Sigma-Aldrich | A3256 | |
| Freezer Box (2") | VWR | 82007-142 | |
| Freezer Box (3") | VWR | 82007-144 | |
| Freezer Box Cell Divider (49-place) | VWR | 82007-150 | |
| Freezer Box Cell Divider (81-place) | VWR | 82007-154 | |
| Freezer Vials (1/2-Dram) | VWR | 66009-816 | |
| Freezer Vials (2-Dram) | VWR | 66010-560 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Glycerol | Fisher Scientific | G33 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Metal Tray | Winco | SPJP-202 | |
| Petri Dish | Fisher Scientific | FB0875712 | |
| Potassium Phosphate Dibasic Trihydrate | Sigma-Aldrich | P5504 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5379 | |
| Sodium Chloride | Sigma-Aldrich | M7506 | |
| Sodium Citrate Tribasic Dihydrate | Sigma-Aldrich | C7254 | |
| Test Tube Cap (18mm) | VWR | 10200-142 | |
| Test Tube Rack (18mm, steel) | Adamas-Beta | N/A | Test Tube Racks Stainless Steel Grid Arrangement 72 Holes (17-19 mm) |
| Test Tubes (18 x 150 mm) | VWR | 47729-583 | |
| Thiamine, Hydrochloride | Millipore | 5871 | |
| Tryptone | Gibco | 211705 | |
| Yeast Extract | Gibco | 212750 |
Referanslar
- Lenski, R. E., Rose, M. R., Simpson, S. C., Tadler, S. C. Long-term experimental evolution in Escherichia coli. I. Adaptation and divergence during 2,000 generations. The American Naturalist. 138 (6), 1315-1341 (1991).
- Fox, J. W., Lenski, R. E. From here to eternity-the theory and practice of a really long experiment. PLoS Biology. 13 (6), e1002185 (2015).
- Daegelen, P., Studier, F. W., Lenski, R. E., Cure, S., Kim, J. F. Tracing ancestors and relatives of Escherichia coli B, and the derivation of B strains REL606 and BL21(DE3). Journal of Molecular Biology. 394 (4), 634-643 (2009).
- Studier, F. W., Daegelen, P., Lenski, R. E., Maslov, S., Kim, J. F. Understanding the differences between genome sequences of Escherichia coli B strains REL606 and BL21(DE3) and comparison of the E. coli B and K-12 genomes. Journal of Molecular Biology. 394 (4), 653-680 (2009).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nature Reviews Genetics. 14 (12), 827-839 (2013).
- Lenski, R. E. Experimental studies of pleiotropy and epistasis in Escherichia coli. II. Compensation for maladaptive pleiotropic effects associated with resistance to virus T4. Evolution. 42 (3), 425-432 (1988).
- Calcott, P. H., Gargett, A. M. Mutagenicity of freezing and thawing. FEMS Microbiology Letters. 10 (2), 151-155 (1981).
- Lenski, R. E., Travisano, M. Dynamics of adaptation and diversification: a 10,000-generation experiment with bacterial populations. Proceedings of the National Academy of Sciences of the United States of America. 91 (15), 6808-6814 (1994).
- Wiser, M. J., Ribeck, N., Lenski, R. E. Long-term dynamics of adaptation in asexual populations. Science. 342 (6164), 1364-1367 (2013).
- Lenski, R. E., et al. Sustained fitness gains and variability in fitness trajectories in the long-term evolution experiment with Escherichia coli. Proceedings of the Royal Society B: Biological Sciences. 282 (1821), 20152292 (2015).
- Barrick, J. E., et al. Genome evolution and adaptation in a long-term experiment with Escherichia coli. Nature. 461 (7268), 1243-1247 (2009).
- Blount, Z. D., Barrick, J. E., Davidson, C. J., Lenski, R. E. Genomic analysis of a key innovation in an experimental Escherichia coli population. Nature. 489 (7417), 513-518 (2012).
- Tenaillon, O., et al. Tempo and mode of genome evolution in a 50,000-generation experiment. Nature. 536 (7615), 165-170 (2016).
- Good, B. H., McDonald, M. J., Barrick, J. E., Lenski, R. E., Desai, M. M. The dynamics of molecular evolution over 60,000 generations. Nature. 551 (7678), 45-50 (2017).
- Consuegra, J., et al. Insertion-sequence-mediated mutations both promote and constrain evolvability during a long-term experiment with bacteria. Nature Communications. 12 (1), 980-980 (2021).
- Cooper, T. F., Rozen, D. E., Lenski, R. E. Parallel changes in gene expression after 20,000 generations of evolution in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 100 (3), 1072-1077 (2003).
- Favate, J. S., Liang, S., Cope, A. L., Yadavalli, S. S., Shah, P. The landscape of transcriptional and translational changes over 22 years of bacterial adaptation. eLife. 11, e81979 (2022).
- Khan, A. I., Dinh, D. M., Schneider, D., Lenski, R. E., Cooper, T. F. Negative epistasis between beneficial mutations in an evolving bacterial population. Science. 332 (6034), 1193-1196 (2011).
- Plucain, J., et al. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli. Science. 343 (6177), 1366-1369 (2014).
- Quandt, E. M., Deatherage, D. E., Ellington, A. D., Georgiou, G., Barrick, J. E. Recursive genomewide recombination and sequencing reveals a key refinement step in the evolution of a metabolic innovation in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2217-2222 (2014).
- Leon, D., D'Alton, S., Quandt, E. M., Barrick, J. E. Innovation in an E. coli evolution experiment is contingent on maintaining adaptive potential until competition subsides. PLoS Genetics. 14 (4), e1007348 (2018).
- Bennett, A. F., Lenski, R. E., Mittler, J. E. Evolutionary adaptation to temperature. I. Fitness responses of Escherichia coli to changes in its thermal environment. Evolution. 46 (1), 16-30 (1992).
- Kibota, T. T., Lynch, M. Estimate of the genomic mutation rate deleterious to overall fitness in E. coli. Nature. 381 (6584), 694-696 (1996).
- Friesen, M. L., Saxer, G., Travisano, M., Doebeli, M. Experimental evidence for sympatric ecological diversification due to frequency-dependent competition in Escherichia coli. Evolution. 58 (2), 245-260 (2004).
- Cooper, T. F. Recombination speeds adaptation by reducing competition between beneficial mutations in populations of Escherichia coli. PLoS Biology. 5 (9), e225 (2007).
- Cooper, T. F., Lenski, R. E. Experimental evolution with E. coli in diverse resource environments. I. Fluctuating environments promote divergence of replicate populations. BMC Evolutionary Biology. 10, 11 (2010).
- Quan, S., et al. Adaptive evolution of the lactose utilization network in experimentally evolved populations of Escherichia coli. PLoS Genetics. 8 (1), e1002444 (2012).
- Deatherage, D. E., Kepner, J. L., Bennett, A. F., Lenski, R. E., Barrick, J. E. Specificity of genome evolution in experimental populations of Escherichia coli evolved at different temperatures. Proceedings of the National Academy of Sciences of the United States of America. 114 (10), E1904-E1912 (2017).
- Izutsu, M., Lake, D. M., Matson, Z. W. D., Dodson, J. P., Lenski, R. E. Effects of periodic bottlenecks on the dynamics of adaptive evolution in microbial populations. BioRixv. , 4457 (2021).
- Chavarria-Palma, J. E., Blount, Z. D., Barrick, J. E. . LTEE Media Recipes. , (2022).
- Barrick, J. E., Lake, D. M. fitnessR: fitnessR-v1.0.0. barricklab. , (2023).
- Blount, Z. D., Borland, C. Z., Lenski, R. E. Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 105 (23), 7899-7906 (2008).
- Grant, N. A., Magid, A. A., Franklin, J., Dufour, Y., Lenski, R. E. Changes in cell size and shape during 50,000 generations of experimental evolution with Escherichia coli. Journal of Bacteriology. 203 (10), 22 (2021).
- Wickham, H. . ggplot2: Elegant Graphics for Data Analysis. , (2016).
- Meyer, J. R., et al. Parallel changes in host resistance to viral infection during 45,000 generations of relaxed selection. Evolution. 64 (10), 3024-3034 (2010).
- Woods, R., Schneider, D., Winkworth, C. L., Riley, M. A., Lenski, R. E. Tests of parallel molecular evolution in a long-term experiment with Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 103 (24), 9107-9712 (2006).
- . LTEE-Ecoli: genomics resources for the Long-Term Evolution Experiment with Escherichia coli Available from: https://github.com/barricklab/LTEE-Ecoli (2022)
- Izutsu, M., Lenski, R. E. Experimental test of the contributions of initial variation and new mutations to adaptive evolution in a novel environment. Frontiers in Ecology and Evolution. 10, 958406 (2022).
- Wiser, M. J., Lenski, R. E. A comparison of methods to measure fitness in Escherichia coli. PLoS One. 10 (5), 0126210 (2015).
- de Visser, J. A. G. M., Lenski, R. E. Long-term experimental evolution in Escherichia coli. XI. Rejection of non-transitive interactions as cause of declining rate of adaptation. BMC Evolutionary Biology. 2 (1), 19 (2002).
- Paquin, C. E., Adams, J. Relative fitness can decrease in evolving asexual populations of S. cerevisiae. Nature. 306 (5941), 368-371 (1983).
- Rozen, D. E., Lenski, R. E. Long-Term Experimental Evolution in Escherichia coli. VIII. Dynamics of a balanced polymorphism. The American Naturalist. 155 (1), 24-35 (2000).
- Quandt, E. M., Gollihar, J., Blount, Z. D., Ellington, A. D., Georgiou, G., Barrick, J. E. Fine-tuning citrate synthase flux potentiates and refines metabolic innovation in the Lenski evolution experiment. eLife. 4, e09696 (2015).
- Chubiz, L. M., Lee, M. -. C., Delaney, N. F., Marx, C. J. FREQ-Seq: a rapid, cost-effective, sequencing-based method to determine allele frequencies directly from mixed populations. PLoS One. 7 (10), e47959 (2012).
- Gallet, R., Cooper, T. F., Elena, S. F., Lenormand, T. Measuring selection coefficients below 10-3: method, questions, and prospects. Genetics. 190 (1), 175-186 (2012).
- Levy, S. F., et al. Quantitative evolutionary dynamics using high-resolution lineage tracking. Nature. 519 (7542), 181-186 (2015).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic variation and the fate of beneficial mutations in asexual populations. Genetics. 188 (3), 647-661 (2011).
- Frenkel, E. M., et al. Crowded growth leads to the spontaneous evolution of semistable coexistence in laboratory yeast populations. Proceedings of the National Academy of Sciences. 112 (36), 11306-11311 (2015).
- Jordt, H., et al. Coevolution of host-plasmid pairs facilitates the emergence of novel multidrug resistance. Nature Ecology and Evolution. 4 (6), 863-869 (2020).
- Gresham, D., Dunham, M. J. The enduring utility of continuous culturing in experimental evolution. Genomics. 104 (6), 399-405 (2014).
- Miller, A. W., Befort, C., Kerr, E. O., Dunham, M. J. Design and use of multiplexed chemostat arrays). Journal of Visualized Experiments. (72), e50262 (2013).
- Toprak, E., et al. Building a morbidostat: an automated continuous-culture device for studying bacterial drug resistance under dynamically sustained drug inhibition. Nature Protocols. 8 (3), 555-567 (2013).
- Wong, B. G., Mancuso, C. P., Kiriakov, S., Bashor, C. J., Khalil, A. S. Precise, automated control of conditions for high-throughput growth of yeast and bacteria with eVOLVER. Nature Biotechnology. 36 (7), 614-623 (2018).
- Ekkers, D. M., Branco Dos Santos, F., Mallon, C. A., Bruggeman, F., Van Doorn, G. S. The omnistat: A flexible continuous-culture system for prolonged experimental evolution. Methods in Ecology and Evolution. 11 (8), 932-942 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır