Method Article
Transferts quotidiens, archivage des populations et mesure de la valeur adaptative dans l’expérience d’évolution à long terme avec Escherichia coli
Dans cet article
Résumé
Ce protocole décrit comment maintenir l’expérience d’évolution à long terme d’Escherichia coli (LTEE) en effectuant ses transferts quotidiens et ses gels périodiques et comment mener des tests de compétition pour mesurer les améliorations de la condition physique chez les bactéries évoluées. Ces procédures peuvent servir de modèle aux chercheurs qui commencent leurs propres expériences d’évolution microbienne.
Résumé
L’expérience d’évolution à long terme (LTEE) a suivi douze populations d’Escherichia coli alors qu’elles s’adaptaient à un environnement de laboratoire simple depuis plus de 35 ans et 77 000 générations bactériennes. La configuration et les procédures utilisées dans le LTEE incarnent des méthodes fiables et reproductibles pour étudier l’évolution microbienne. Dans ce protocole, nous décrivons d’abord comment les populations LTEE sont transférées vers un milieu frais et cultivées chaque jour. Ensuite, nous décrivons comment les populations LTEE sont régulièrement vérifiées pour détecter d’éventuels signes de contamination et archivées pour fournir un « enregistrement fossile » congelé permanent pour une étude ultérieure. Les multiples mesures de protection incluses dans ces procédures sont conçues pour prévenir la contamination, détecter divers problèmes lorsqu’ils surviennent et se remettre des perturbations sans retarder sensiblement les progrès de l’expérience. L’une des façons de surveiller le rythme global et la nature des changements évolutifs dans le LTEE consiste à mesurer la capacité compétitive des populations et des souches issues de l’expérience. Nous décrivons comment les tests de compétition de co-culture sont menés et fournissons à la fois une feuille de calcul et un package R (fitnessR) pour calculer la valeur adaptative relative à partir des résultats. Au cours de la LTEE, les comportements de certaines populations ont changé de manière intéressante, et les nouvelles technologies telles que le séquençage du génome entier ont fourni des voies supplémentaires pour étudier l’évolution des populations. Nous terminons en discutant de la façon dont les procédures LTEE originales ont été mises à jour pour tenir compte de ces changements ou en tirer parti. Ce protocole sera utile pour les chercheurs qui utilisent le LTEE comme système modèle pour étudier les liens entre l’évolution et la génétique, la biologie moléculaire, la biologie des systèmes et l’écologie. Plus largement, le LTEE fournit un modèle éprouvé pour ceux qui commencent leurs propres expériences d’évolution avec de nouveaux microbes, environnements et questions.
Introduction
En février 1988, Richard Lenski a inoculé douze flacons contenant un milieu de croissance limité en glucose défini avec des cultures clonales d’Escherichia coli à l’Université de Californie, Irvine1. Le lendemain, il a transféré 1 % de la culture de chaque fiole dans un ensemble de nouvelles fioles contenant un milieu de croissance frais. Cette dilution 1:100 a permis aux populations bactériennes de se multiplier par 100 avant d’épuiser le glucose disponible, ce qui correspond à environ 62/3 générations de divisions cellulaires. Cette procédure a été répétée le lendemain et l’a été tous les jours depuis, avec quelques interruptions. Ces transferts quotidiens se sont poursuivis, même si l’expérience a été déplacée, d’abord à l’Université d’État du Michigan en 1992, puis à l’Université du Texas à Austin en 2022. Pendant ce temps, de nouvelles mutations ont continuellement généré une variation génétique dans ces populations d’E. coli et la sélection naturelle a conduit les cellules évoluées à surpasser leurs ancêtres.
Lenski a conçu cette expérience, maintenant connue sous le nom de Long-Term Evolution Experiment (LTEE), pour étudier la dynamique et la répétabilité de l’évolution. Afin de répondre à ces questions, il a inclus plusieurs caractéristiques importantes dans la conception de l’installation expérimentale et de ses protocoles2. L’une de ces caractéristiques était le choix judicieux d’un organisme modèle. Les douze populations originales ont toutes été créées à partir de colonies uniques qui partageaient un ancêtre commun immédiat, la souche REL606 d’Escherichia coli B. Cette souche a été choisie parce qu’elle avait déjà été couramment utilisée en laboratoire, reproduite de manière complètement asexuée et ne contenait ni plasmides ni prophages intacts 3,4 – ce qui simplifie l’étude de son évolution. Un autre choix qui a simplifié l’expérience a été d’utiliser une très faible concentration de glucose dans le milieu de croissance pour limiter la densité des cellules dans chaque flacon après la croissance. L’utilisation d’une faible densité cellulaire visait à faciliter l’analyse des changements dans la valeur adaptative de la population en réduisant le potentiel d’évolution des interactions écologiques au sein des populations (p. ex. par alimentation croisée)5.
REL606 ne peut pas utiliser ʟ-arabinose comme source de carbone et d’énergie (Ara−) en raison d’une mutation ponctuelle dans le gène araA . Avant de commencer le LTEE, un mutant spontané avec une séquence araA restaurée, désigné REL607, a été isolé de REL6066. REL607 est capable de se développer sur ʟ-arabinose (Ara+). REL606 a été utilisé pour démarrer six des populations LTEE, et REL607 a été utilisé pour démarrer les six autres. L’arabinose n’est pas présent dans le milieu de croissance utilisé pendant le LTEE, donc REL607 se comporte de la même manière que REL606 dans ces conditions. Cependant, lorsqu’elles sont plaquées sur gélose tétrazolium arabinose (TA), les cellules Ara− et Ara+ forment respectivement des colonies rouges et blanches. Cette méthode de discrimination entre les deux souches ancestrales d’E. coli et leurs descendants est très utile. Il peut être utilisé pour détecter la contamination croisée entre les populations LTEE. Il aide également à mesurer la valeur adaptative d’une souche ou d’une population Ara− par rapport à une souche Ara+ lorsqu’elles sont en compétition les unes contre les autres. La valeur adaptative est mesurée en mettant en place une co-culture de concurrents marqués de manière opposée, puis en surveillant comment les fréquences des colonies rouges et blanches (obtenues en étalant des dilutions de la culture sur des plaques TA) changent entre le moment où les concurrents sont initialement mélangés et après un ou plusieurs cycles de croissance dans les mêmes conditions que le LTEE. La représentation du type de cellule le plus apte augmentera au cours de chaque cycle de croissance.
Une autre caractéristique essentielle du LTEE est que des échantillons des populations en évolution sont archivés périodiquement. Lorsqu’elles sont mélangées à un cryoprotecteur tel que le glycérol, les cellules d’E. coli peuvent être congelées et ensuite ranimées7. Dans le cadre du protocole LTEE, tous les 75 jours (ce qui équivaut à environ 500 générations), une partie de chaque population qui n’a pas été transférée dans un nouveau flacon est mélangée avec du glycérol, répartie entre plusieurs flacons et stockée dans un congélateur. Ce « registre fossile » congelé a permis aux chercheurs d’effectuer les premières études du LTEE, dans lesquelles ils ont relancé les populations évoluées d’E. coli à partir de divers points temporels et les ont comparées aux souches ancestrales pour suivre la rapidité avec laquelle la condition physique augmentait1. L’évolution de la condition physique a été remesurée périodiquement à mesure que davantage de « strates » des « archives fossiles » gelées ont été préservées. La conclusion générale de ces mesures est que la condition physique continue de s’améliorer dans le LTEE à ce jour, même après tant de générations d’évolution dans le même environnement 8,9,10.
Qu’est-ce qui a permis au LTEE de continuer si longtemps? Bon nombre des caractéristiques qui ont permis de poser et de répondre à ses questions initiales ont également servi de mesures de sécurité et de sécurité contre les perturbations inévitables dues à la malchance, à l’erreur humaine et aux événements mondiaux. Chaque jour, lorsque les cultures sont transférées dans un milieu de croissance frais, le chercheur effectuant les transferts alterne entre les populations Ara− et Ara+. Ensuite, lorsque les populations sont congelées, elles peuvent être plaquées sur une gélose sélective et indicatrice pour vérifier si des populations « voisines » ont été accidentellement contaminées ou mélangées (p. ex., les colonies blanches font partie d’une population qui ne devrait former que des colonies rouges) ou contaminées par des microbes étrangers (p. ex., morphologies de colonies ou densités cellulaires inattendues). Dans le cas où une population a été compromise, son ancêtre peut être ranimé du congélateur et reporté à sa place. Les marqueurs Ara et les archives congelées servent donc à la fois de ressources expérimentales et de mesures de sécurité.
Parce que son histoire est si bien préservée et facilement accessible, les échantillons LTEE ont été étudiés en utilisant des technologies qui n’existaient pas lorsque l’expérience a commencé. Par exemple, le séquençage du génome entier a été utilisé pour examiner la dynamique des mutations dans les populations LTEE 11,12,13,14,15, et la transcriptomique et le profilage ribosomique ont été utilisés pour examiner les changements dans l’expression génique 16,17. Des outils génétiques ont été utilisés pour reconstruire des souches qui diffèrent par des mutations uniques ou des combinaisons de plusieurs mutations évoluées afin de comprendre leurs effets sur la condition physique et divers phénotypes 18,19,20,21. Les échantillons des « archives fossiles » congelées sont facilement reconstitués afin que des parties ou des copies entières de l’histoire de l’expérience puissent être expédiées à d’autres laboratoires. Les échantillons LTEE existent maintenant sur tous les continents sauf l’Antarctique, et ils sont étudiés par des chercheurs qui sont plus jeunes que l’expérience elle-même. Les méthodes robustes du LTEE et des échantillons et souches évolués d’E. coli de ses archives historiques ont également servi de points de départ pour des expériences d’évolution examinant d’autres questions et environnements 22,23,24,25,26,27,28,29.
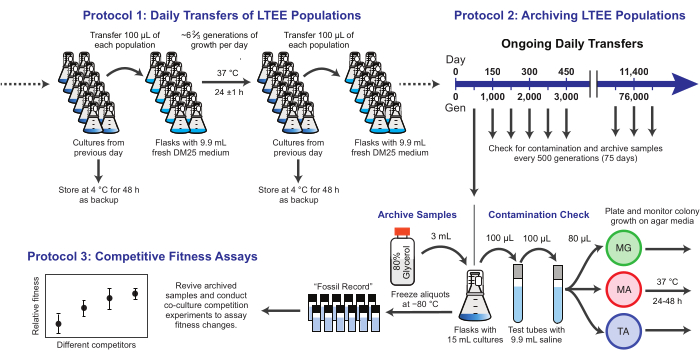
Figure 1 : Vue d’ensemble des procédures LTEE. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Ici, nous démontrons trois protocoles de base utilisés dans l’expérience d’évolution à long terme d’E. coli (Figure 1). Nous décrivons: (1) comment effectuer les transferts quotidiens, (2) comment archiver les échantillons de population et les isolats clonaux, et (3) comment effectuer et analyser les tests de compétition de co-culture pour mesurer les différences de condition physique. Nous espérons que ces protocoles favoriseront l’utilisation continue des ressources LTEE et éclaireront la conception de nouvelles expériences d’évolution microbienne.
Protocole
1. Transferts quotidiens des populations LTEE
REMARQUE : Les douze populations de LTEE sont transférées quotidiennement en inoculant du milieu frais 1 % des cultures provenant des flacons de la veille. Les étapes de ce processus sont résumées à la figure 1. Les six populations d’Ara− issues de la souche REL606 sont désignées A−1 à A−6, et les six populations d’Ara+ issues de la souche REL607 sont désignées A+1 à A+6. Le strict respect de la technique aseptique ainsi que d’un calendrier et d’un ordre de transfert des populations minimise les risques de contamination et d’autres perturbations.
- Désinfectez la surface sur laquelle les transferts LTEE seront effectués en l’essuyant avec de l’éthanol à 70 % ou une solution d’eau de Javel à 10 %. Allumez un brûleur Bunsen pour créer un courant ascendant local et permettre l’enflammement de la verrerie.
REMARQUE : Portez des gants de laboratoire pour prévenir la contamination. Pour la sécurité autour d’une flamme nue, il est essentiel de n’utiliser que des gants faits d’un matériau comme le nitrile qui n’est pas inflammable. - Préparer treize flacons d’erlenmeyer borosilicaté de 50 ml coiffés de béchers en borosilicate ou en polypropylène de 20 ml qui ont été lavés et stérilisés à l’autoclavage. Vérifiez que les flacons ne contiennent pas de débris visibles et remplacez ceux qui ne sont pas parfaitement propres.
- Étiquetez six flacons A−1 à A−6 à l’aide d’un marqueur rouge et les six autres flacons A+1 à A+6 à l’aide d’un marqueur noir. Étiqueter la dernière fiole restante, qui sera vierge, avec la date au format mois/jour et le jour de la semaine.
- Remplir chacune des 13 fioles avec 9,9 mL de milieu DM25 à l’aide d’une pipette sérologique stérile de 10 mL. Flammer l’embouchure de chaque fiole après avoir retiré le bécher servant de couvercle et avant de replacer le bécher. Allumer la pointe de la pipette entre le remplissage de chaque fiole.
REMARQUE: Les instructions pour faire DM25 sont disponibles en ligne30. Si vous utilisez une pipette sérologique en plastique, évitez de flamber son embout ou limitez le temps passé dans la flamme pour éviter de faire fondre le plastique. - Retirez les flacons LTEE de la veille de l’incubateur à secousses.
- Examiner chaque fiole en la tenant à la lumière pour évaluer sa turbidité et sa couleur, vérifier l’intégrité de la fiole et rechercher la présence de corps étrangers.
NOTE: À l’œil nu, toutes les cultures Ara− et Ara+ auront l’air légèrement troubles par rapport au blanc, à l’exception de A−3, qui sera ~10 fois plus trouble que les autres en raison de la croissance sur citrate dans le milieu. De nombreux contaminants microbiens extérieurs peuvent également se développer sur le citrate, de sorte qu’une turbidité accrue dans les populations autres que A−3 indique probablement une contamination. Voir la section Résultats représentatifs pour des images des cultures LTEE avant un transfert. - FACULTATIF : Confirmer que chaque culture LTEE présente la turbidité prévue en pipetant 1 mL de l’ébauche et 1 mL de chaque culture dans des cuvettes en plastique de 1 cm et en prenant des lectures de densité optique à 600 nm (OD600) à l’aide d’un spectrophotomètre après avoir occulté l’instrument.
REMARQUE : Cette étape supplémentaire peut être utile pour les chercheurs qui débutent dans le travail avec le LTEE et qui ne sont pas certains de juger de la turbidité à l’œil, ainsi que pour documenter et enquêter sur les anomalies soupçonnées. Prélever des échantillons pour mesurer l’OD600 des flacons de la veille seulement après avoir terminé les transferts normaux de la journée dans de nouveaux flacons (étapes suivantes) afin de minimiser le risque de contamination des populations cellulaires qui continueront à se propager si les valeurs OD600 sont conformes aux prévisions. Voir la section Résultats représentatifs pour connaître les valeurs OD600 typiques pour les cultures LTEE. - À l’aide d’un micropipeteur P200 muni d’un embout filtrant stérile, transférer 100 μL de culture de chaque fiole LTEE dans la fiole correspondante contenant du DM25 frais. Commencez par A−1, puis transférez A+1. Après cela, continuez à alterner entre les populations − et +. Pour savoir quelles cultures ont été transférées, déplacez les flacons vers la gauche après avoir pipeté depuis ou vers elles.
REMARQUE : L’ordre strict des transferts et de l’alternance entre les populations Ara− et Ara+ aide à prévenir et à détecter la contamination croisée et les mélanges. Observez une technique d’asepsie stricte : utilisez une pointe de pipette fraîche pour chaque transfert, enflammez la bouche des flacons immédiatement après le débouchage et avant le rebouchuchon, et essuyez le canon et l’éjecteur du micropipettor avec une lingette en papier non pelucheuse imbibée d’éthanol à 70% entre chaque transfert. L’eau de Javel ne doit jamais être utilisée pour désinfecter les micropipettes, car même des traces peuvent tuer les cultures. - Incuber les flacons nouvellement inoculés à 37 °C pendant 24 ± 1 h avec une agitation orbitale de 120 tr/min sur un diamètre de 1 pouce.
- Conservez les cultures de la veille à 4 °C. Conservez ces cultures de sauvegarde pendant deux jours. Jetez les cultures plus anciennes qui ont été conservées à 4 °C trois jours auparavant à ce moment-là.
NOTE: Les cultures des deux jours précédents fournissent deux ensembles complets de sauvegardes permettant de recommencer l’expérience, si nécessaire, en cas de problème ou d’accident, ou si une contamination des cultures de la veille est découverte avant le transfert (par exemple, coloration étrange ou particules inattendues). - Inscrivez l’heure, la date, le numéro de transfert, le nom ou les initiales du chercheur qui a effectué les transferts, si les cultures étaient acceptables ou non, et toute autre information pertinente dans le carnet de notes du registre des transferts. Passez aux étapes 1.12-1.14 si l’une des situations suivantes se produit: (1) l’ébauche de la veille est contaminée, (2) une fiole ou son couvercle est fissuré ou cassé, (3) une fiole contient des matières étrangères, (4) une fiole est renversée ou lâchée pendant les transferts, ou (5) il y a tout autre événement ou observation qui rend la poursuite de ces flacons discutable.
- S’il y a des problèmes, des accidents ou des soupçons de contamination avec les cultures LTEE de la veille, ne les transférez pas. Au lieu de cela, conservez l’ensemble des douze cultures à 4 ° C pour un examen ultérieur et une caractérisation plus approfondie.
- Récupérez les flacons contenant les cultures de sauvegarde qui ont été transférés de la veille et stockés à 4 °C. Placez-les sur la paillasse pour les réchauffer à température ambiante. Remuer doucement chaque fiole pour remettre les cellules en suspension.
- Transférer des flacons de secours vers le nouveau jeu de flacons contenant du milieu frais et poursuivre l’expérience normalement comme décrit aux étapes 1.6-1.11. Notez dans le journal de transfert que les cultures de sauvegarde ont été utilisées et enregistrez le même numéro de transfert que la veille.
REMARQUE : Même si un problème est constaté dans le flacon d’une seule population, transférer les douze populations à partir des flacons de secours afin que le nombre de générations écoulées dans toutes les populations reste en phase. Si une contamination est constatée dans les flacons de secours entreposés à 4 °C, les populations LTEE touchées doivent être redémarrées à partir des stocks congelés en utilisant la procédure décrite aux étapes 3.1 à 3.2 pour les échantillons de population. Le nombre de transferts pour le LTEE ne devrait pas être incrémenté avant la croissance des premières cultures en DM25 après la renaissance.
2. Archivage des populations LTEE
REMARQUE : Les échantillons des populations LTEE sont congelés tous les 75 transferts. Les populations augmentent ~6 2/3 générations chaque jour après la dilution par transfert de 100 fois, donc cette période correspond à ~500 générations. Lors de l’archivage, les populations LTEE sont également plaquées sur différents types de supports gélose pour vérifier la contamination. En option, des clones représentatifs peuvent être choisis à partir de ces plaques et archivés à ce stade. Ces étapes sont résumées à la figure 1.
- La veille de la congélation prévue ou quelques jours avant, préparez trois types de plaques de gélose : Glucose minimal (MG), Arabinose minimal (MA) et Tétrazolium Arabinose (TA). Faites douze assiettes de chaque type d’agar, plus quelques extras. Préparez également au moins 250 mL de solution saline stérile à 0,85 % (p/v) et 50 mL de glycérol stérile à 80 % (v/v).
REMARQUE: Des recettes pour tous les supports et solutions sont disponibles en ligne30. Le jour avant que le LTEE atteigne une génération qui est un multiple de 500 pour le calendrier d’archivage régulier est le 74e jour depuis le dernier gel plus tous les jours qui ont été ajoutés en raison de transferts des flacons de secours à 4 °C lorsque des problèmes ont été détectés ou suspectés. - FACULTATIF : Si vous archivez des isolats clonaux des populations LTEE, préparez des fournitures supplémentaires : l’isolement de trois clones de chaque population nécessite 72 plaques de MG, 80 mL de glycérol à 80 % (v/v) et 370 mL de DM1000.
- Préparez un jeu supplémentaire de douze flacons lors de l’exécution de l’étape 1.2 des transferts LTEE quotidiens la veille du gel prévu. Étiquetez six des flacons supplémentaires xA−1 à xA−6 à l’aide d’un marqueur rouge, et les six autres xA+1 à xA+6 à l’aide d’un marqueur noir.
REMARQUE: Le « x » indique que le jeu supplémentaire de flacons sera utilisé pour l’archivage et les différencie de l’autre jeu de flacons qui sera utilisé pour continuer les transferts quotidiens du LTEE en parallèle. - Remplissez chacun des flacons supplémentaires qui seront utilisés pour l’archivage avec 14,85 ml de DM25 à l’aide d’une pipette sérologique de 25 ml lors de l’exécution de l’étape 1.4 des transferts LTEE quotidiens.
- Effectuez le transfert LTEE normal comme décrit aux étapes 1.5 à 1.11. Répétez ensuite les instructions de l’étape 1.8, mais cette fois, transférez 150 μL de chacune des cultures LTEE de la veille vers les flacons supplémentaires de 14,85 ml de DM25 frais qui seront utilisés pour l’archivage.
REMARQUE : Dans cette étape et dans toutes les étapes suivantes, évitez la contamination et les confusions en suivant ces directives. Commencez par la population A−1, puis transférez A+1, puis continuez à alterner les populations − et +. Essuyez le canon et l’éjecteur de la micropipette avec une lingette en papier non pelucheuse imbibée d’éthanol à 70 % lors du changement de population. Déplacer les flacons et les tubes à essai dans leurs plateaux ou racks après avoir pipeté depuis ou vers eux pour garder une trace des transferts qui ont été effectués. - Incuber l’ensemble de douze flacons pour archivage à 37 °C pendant 24 ± 1 h avec une orbitale de 120 tr/min en secouant sur un diamètre de 1 pouce à côté des douze cultures LTEE et de l’ébauche comme décrit à l’étape 1.9.
- Préparer les fournitures pour le placage des populations LTEE au moins une heure avant que les transferts LTEE ne soient effectués le jour du gel.
- Sélectionnez douze plaques de gélose MG, douze MA et douze TA. Inspectez visuellement chacun d’eux pour vous assurer qu’il n’a pas de contamination évidente.
- Étiqueter une de chaque type de plaque pour chacune des douze populations LTEE (A−1 à A+6).
REMARQUE: Lorsque vous étiquetez les assiettes, écrivez sur les côtés du fond de la boîte de Pétri. Ceci est important pour ne pas obscurcir les colonies lorsque l’on veut les examiner ou les photographier sous l’agar-agar. N’écrivez pas sur les couvercles, car ils peuvent être mélangés. - Placer les plaques de gélose dans un incubateur à 37 °C pendant au moins 20 minutes pour les réchauffer avant de les utiliser à l’étape 2.10.
- Préparer 24 tubes à essai contenant 9,9 mL de solution saline. Disposez-les en douze jeux de deux tubes chacun.
- Étiqueter chacun des deux ensembles de douze tubes à essai de la même manière que les plaques, en ajoutant un « 1 » ou un « 2 » sous l’identificateur de population LTEE pour indiquer l’ordre dans lequel ils seront utilisés pour effectuer les dilutions de cette population.
- Effectuez les étapes 1.1-1.11 à l’aide des flacons qui poursuivront les transferts quotidiens du LTEE comme d’habitude. Au cours de l’étape 1.5, retirez également les douze flacons contenant les cultures supplémentaires pour l’archivage de l’incubateur à agiter.
- Pipeter 100 μL de la culture de chacun des douze flacons supplémentaires pour l’archivage dans le premier tube à essai de solution saline de la paire pour cette population LTEE. Vortex les tubes avec ces dilutions 100 fois à fond. Ensuite, pipeter 100 μL de chacun d’eux au deuxième tube de solution saline correspondant. Vortex les 10 000 dernières dilutions de culture à fond.
- Pipeter 80 μL de chacun des tubes contenant une dilution de culture de 10 000 fois sur les plaques marquées TA, MG et MA pour cette population. Étaler le liquide uniformément sur la surface de la gélose à l’aide d’une tige d’étalement stérile ou de billes d’étalement stériles, selon votre préférence. Répéter jusqu’à ce que les douze populations aient été plaquées sur les trois types de milieux.
- Si nécessaire, laisser sécher les assiettes jusqu’à ce qu’aucun liquide ne soit visible sur l’agar-agar. Placer les plaques à l’envers (avec la gélose vers le haut) dans un incubateur à convection par gravité réglé à 37 °C.
REMARQUE: L’incubation des plaques à l’envers empêche la gélose de sécher et empêche la condensation de s’égoutter sur la surface de la gélose. Le mouvement des cellules dans le liquide sur la surface de la gélose pendant l’incubation peut frottir les colonies et donner un nombre incorrect de colonies. - Ajouter 3 mL de glycérol stérile à 80 % (v/v) à chacune des douze fioles supplémentaires destinées à l’archivage. Bien mélanger en tourbillonnant et en tourbillonnant doucement.
- Distribuer le mélange de chaque fiole à des cryoflacons stériles qui ont été étiquetés avec un identificateur unique pour l’échantillon, la population LTEE à laquelle l’échantillon appartient, la génération à laquelle il a été congelé, qu’il s’agit d’un échantillon mixte (population) et la date. Pipeter 6 mL dans un grand flacon et 1,25 mL dans chacun des six petits flacons.
NOTE: Le grand flacon est le stock de travail. Un petit flacon est une sauvegarde au cas où le stock de travail serait épuisé ou contaminé. Les cinq autres petits flacons sont des copies qui peuvent être envoyées à d’autres laboratoires. - Congeler les flacons remplis à −80 °C.
- Examiner et documenter la croissance et la morphologie des colonies sur les plaques TA, MG et MA après 24 h et 48 h d’incubation.
NOTE: Voir la section Résultats représentatifs pour les images et les descriptions des colonies formées par les ancêtres REL606 et REL607 et chacune des douze populations LTEE lorsqu’elles ont été plaquées à 76 000 générations. - FACULTATIF : Effectuez les étapes suivantes lors de l’archivage des isolats clonaux.
- Prélever trois isolats clonaux (colonies) pour chaque population LTEE dans les plaques MG, les strier séparément sur une nouvelle plaque MG et incuber ces plaques pendant 16-24 h à 37 °C.
NOTE: Si des colonies avec des morphologies différentes sont présentes, la pratique courante dans le LTEE est d’échantillonner pour une diversité maximale en choisissant d’abord le type le plus commun, puis en sélectionnant d’autres colonies parmi les types minoritaires. On peut également utiliser une stratégie d’échantillonnage aléatoire en marquant des points sur la face inférieure du fond de la boîte de Pétri avant d’étaler les cellules, puis en choisissant la colonie isolée la plus proche de chaque marque après la croissance. - Le lendemain, étaler une colonie représentative de chaque plaque sur une nouvelle plaque MG et incuber ces plaques pendant 16-24 h à 37 °C.
- Le lendemain, inoculer une colonie isolée de chaque plaque de MG dans une fiole contenant 10 mL de DM1000 frais. De plus, remplir une fiole supplémentaire avec 10 ml de DM1000 pour servir d’ébauche non inoculée pour tester la contamination du milieu.
- Incuber les flacons à 37 °C pendant 16-24 h avec une agitation orbitale de 120 rpm sur un diamètre de 1 pouce.
- Après l’incubation, ajouter 2 mL de glycérol stérile à 80 % (v/v) dans chaque fiole et agiter pour mélanger.
- Distribuer 1,25 mL d’aliquotes de chaque fiole dans de petits flacons stériles étiquetés avec un identificateur unique pour chaque clone, sa population LTEE et sa génération d’origine, qu’il s’agit d’un échantillon clonal et la date.
- Congeler les flacons remplis à −80 °C.
- Prélever trois isolats clonaux (colonies) pour chaque population LTEE dans les plaques MG, les strier séparément sur une nouvelle plaque MG et incuber ces plaques pendant 16-24 h à 37 °C.
3. Tests de condition physique compétitifs
REMARQUE : Dans le LTEE, la capacité de reproduction est quantifiée en fonction du nombre relatif de doublements que différentes bactéries réalisent au cours d’un ou de plusieurs cycles de culture de 24 h dans les mêmes conditions que les transferts quotidiens. Plus précisément, l’adéquation relative d’un concurrent à un autre est le ratio de leurs taux de doublement réalisés lorsqu’ils s’affrontent dans une co-culture. Chaque concurrent d’une paire peut être une population complète ou un isolat clonal qui a été précédemment archivé dans le cadre du « registre fossile » congelé du LTEE. Alternativement, l’un ou les deux concurrents peuvent être un clone qui a été génétiquement modifié pour ajouter ou supprimer des mutations spécifiques afin de tester leurs effets. Les deux concurrents doivent avoir des états opposés Ara+/Ara− car ce marqueur génétique est utilisé pour les différencier lors de ce test. Le flux de travail global d’un essai de compétition est illustré à la figure 2. La durée de la phase de co-culture peut être prolongée d’un à trois jours (ou plus) pour améliorer la précision des estimations de la condition physique lors de l’essai des différences entre les concurrents qui sont presque égales. Voir la Disussion pour d’autres considérations critiques et des modifications possibles de ce protocole.
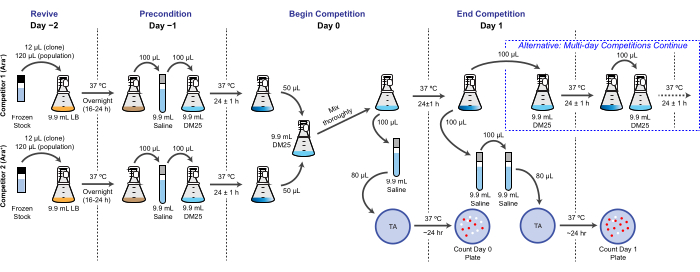
Figure 2 : Organigramme de l’essai de compétition. La procédure complète pour un essai de compétition d’une journée est montrée. La procédure de trois jours se poursuit avec la voie alternative le jour 1 et le jour 2 jusqu’au placage le jour 3 de la même manière que celle illustrée pour le jour 1 de la compétition d’un jour. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Préparer les fournitures
- Décidez combien de souches et/ou de populations LTEE concurrentes seront utilisées et combien de tests de compétition répétés seront effectués pour chaque paire de concurrents. Préparez les fournitures nécessaires comme décrit dans les étapes suivantes.
REMARQUE: Des recettes pour tous les supports et solutions sont disponibles en ligne30. Les flacons et les tubes à essai requis pour tous les jours d’une expérience de compétition peuvent être remplis à l’avance ou au besoin les jours où ils seront utilisés. Si les flacons et les tubes à essai sont remplis à l’avance, entreposez-les à température ambiante dans l’obscurité pour minimiser l’évaporation. Les plaques d’AT doivent être préparées au moins deux jours avant leur utilisation afin qu’elles puissent sécher suffisamment après avoir été coulées pour permettre la propagation des dilutions de culture. Préparez toujours quelques flacons, tubes à essai et plaques d’assistance supplémentaires afin qu’une expérience puisse se poursuivre s’il y a des erreurs de pipetage, des plaques contaminées ou d’autres incidents mineurs. - Pour le jour de la reprise (jour −2), remplir une fiole d’erlenmeyer stérile de 50 ml recouverte d’un bécher de 20 ml avec 9,9 ml de bouillon DM1000 ou lysogène (LB) par souche ou population d’E. coli qui sera utilisée comme concurrent. Remplir une autre fiole avec 9,9 mL du même milieu pour servir d’ébauche non inoculée.
- Pour le jour de préconditionnement (jour −1), remplir un tube à essai avec 9,9 mL de solution saline stérile à 0,85 % (p/v) par concurrent, deux flacons avec 9,9 mL de DM25 par essai répété entre une paire de concurrents, et un autre flacon avec 9,9 mL de DM25 pour un essai à blanc.
- Pour le jour où la compétition commence (jour 0), remplir une fiole avec 9,9 mL de DM25, remplir un tube à essai avec 9,9 mL de solution saline stérile à 0,85 % (p/v) et préparer une plaque d’AT par répétition d’essai de compétition. Remplir une fiole de plus avec 9,9 ml de DM25 pour servir d’ébauche.
- ALTERNATIVE : Pour chaque jour d’une compétition de plusieurs jours au-delà du premier, remplir une fiole de 9,9 mL de DM25 par répétition de compétition et remplir une autre fiole avec 9,9 mL de DM25 pour un blanc.
- Pour le dernier jour de la compétition (p. ex ., Jour 1 ou Jour 3), remplir deux tubes à essai avec 9,9 mL de solution saline stérile à 0,85 % (p/v) et préparer une plaque d’AT par répétition de compétition.
- Décidez combien de souches et/ou de populations LTEE concurrentes seront utilisées et combien de tests de compétition répétés seront effectués pour chaque paire de concurrents. Préparez les fournitures nécessaires comme décrit dans les étapes suivantes.
- Jour −2: Relancer les concurrents séparément en DM1000 ou LB
- Pour chacun des concurrents, étiqueter une fiole remplie de 9,9 mL de DM1000 ou de LB. Étiqueter une fiole supplémentaire remplie de 9,9 mL provenant du même lot de milieu pour servir d’ébauche non inoculée pour tester la contamination.
NOTE: Les stocks congelés sont relancés en LB ou DM1000 pour une récupération plus uniforme et prévisible des cellules cryoconservées. Le glycérol utilisé comme cryoprotecteur peut être métabolisé par E. coli, ce qui entraînera des densités cellulaires plus élevées que prévu si les échantillons sont réactivés dans DM25. LB et DM1000 soutiennent la croissance à des densités cellulaires si élevées que cette complication devient négligeable. - Sortez du congélateur les cryoflacons contenant les stocks congelés des souches concurrentes à −80 °C. Gardez les flacons au frais dans un seau à glace pendant leur utilisation.
- Une fois que chaque bouillon congelé a décongelé, le vortex à fond pour remettre en suspension les cellules d’E. coli. En cas de réactivation d’un clone, inoculer 12 μL de bouillon congelé dans la fiole contenant le milieu frais. En cas de réactivation d’une population, inoculer la fiole avec 120 μL de bouillon congelé.
NOTA : Le volume de 120 μL du stock congelé est utilisé pour les populations de sorte que le nombre de cellules qui sont ranimées est approximativement le même que le goulot d’étranglement quotidien lorsque 1 % de la population LTEE est transférée dans une nouvelle fiole. La décongélation et le vortex répétés des stocks congelés peuvent stresser les cellules et réduire la viabilité des stocks au fil du temps. Si une population LTEE ou un clone donné doit être utilisé dans des compétitions plusieurs fois, il est recommandé de repousser et de congeler plusieurs copies du stock afin qu’aucun d’entre eux ne soit décongelé et recongelé plusieurs fois. - Incuber les flacons de relance et l’ébauche à 37 °C pendant la nuit (16-24 h) avec une agitation orbitale de 120 tr/min sur un diamètre de 1 pouce.
- Pour chacun des concurrents, étiqueter une fiole remplie de 9,9 mL de DM1000 ou de LB. Étiqueter une fiole supplémentaire remplie de 9,9 mL provenant du même lot de milieu pour servir d’ébauche non inoculée pour tester la contamination.
- Jour −1 : Préconditionner les concurrents séparément en DM25
- Pour chaque concurrent, étiqueter un tube à essai rempli de 9,9 ml de solution saline. Pour chaque essai de compétition de répétition entre deux concurrents, étiqueter deux flacons de 50 ml remplis de 9,9 ml de DM25, chacun portant le numéro de réplication et le nom de l’un des concurrents. Étiqueter une fiole supplémentaire remplie de 9,9 ml de DM25 pour servir de flan.
- Sortez de l’incubateur les flacons contenant les cultures des concurrents ressuscités. Examinez leur turbidité à l’œil nu pour confirmer qu’ils se sont développés et qu’il n’y a pas de contamination évidente.
- Pipeter 100 μL de chaque fiole dans le tube à essai de solution saline pour ce concurrent.
REMARQUE: Cette étape dilue la culture 100 fois, ce qui est nécessaire car la densité des cellules est beaucoup plus élevée en LB et DM1000 que dans l’environnement DM25 utilisé dans le LTEE (voir Résultats représentatifs). - Bien vorter chaque tube de dilution juste avant de pipeter 100 μL de la culture diluée dans une fiole contenant du DM25 frais. Inoculer deux de ces flacons de préconditionnement pour chaque essai de répétition, un pour chacun des concurrents.
- Incuber les flacons de préconditionnement et l’ébauche à 37 °C pendant 24 ± 1 h avec une agitation orbitale de 120 tr/min sur un diamètre de 1 pouce.
- Jour 0: Commencez la compétition en mélangeant les concurrents et l’assiette pour les dénombrements initiaux
- Pour chaque essai de compétition, étiqueter une fiole remplie de 9,9 mL de DM25 et une éprouvette remplie de 9,9 mL de solution saline. Étiquetez les flacons et les tubes de manière à identifier de manière unique chaque paire de concurrents et le numéro de réplique du test de compétition. Étiqueter une fiole supplémentaire remplie de 9,9 ml de DM25 pour servir de flan.
- Sortez les flacons de préconditionnement de l’incubateur. Examinez leur turbidité à l’œil nu pour confirmer qu’ils se sont développés et qu’il n’y a pas de contamination évidente.
- Transvaser 50 μL du concurrent Ara− dans la première fiole de compétition répliquée remplie de DM25 frais. Immédiatement, transférer 50 μL du concurrent Ara+ dans le même ballon de compétition et mélanger en remuant doucement.
- Répétez l’étape 3.4.3 pour toutes les répliques de toutes les paires de concurrents.
REMARQUE: Les flacons de compétition ont maintenant une dilution globale de 100 fois des cultures d’E. coli cultivées en DM25, les mêmes cellules de condition dans l’expérience LTEE après chaque transfert quotidien. L’ordre d’exécution des transferts et du mélange est important. Ajouter les deux concurrents à chaque fiole immédiatement l’un après l’autre afin qu’aucun des deux ne prenne une longueur d’avance dans le milieu frais. Par exemple, n’ajoutez pas les cultures Ara− à tous les flacons de compétition, puis revenez en arrière et ajoutez toutes les souches Ara+ . - Introduire à la pipette 100 μL de chaque fiole de compétition nouvellement inoculée dans le tube à essai de solution saline étiqueté pour cet essai de compétition de manière à ce que chacun de ces tubes contienne une dilution globale de 10 000 fois des cultures DM25 préconditionnées qui ont été combinées.
- Placez les flacons de compétition et les ébauches dans l’incubateur à secousses. Incuber les flacons de compétition à 37 °C pendant 24 ± 1 h avec une agitation orbitale de 120 tr/min sur un diamètre de 1 pouce.
- Le même jour, immédiatement après avoir placé les flacons de compétition dans l’incubateur, faire tourbillonner soigneusement chaque tube à essai de l’étape 3.4.5 et étaler 80 μL de ces dilutions de 10 000 fois sur des plaques TA comme décrit à l’étape 2.10. Étiquetez le côté du fond de chaque plaque avec la paire de souches qui ont été mélangées, le numéro de répétition et le « Jour 0 » pour indiquer qu’il sera utilisé pour déterminer la représentation initiale de chaque concurrent.
- Incuber les plaques TA à l’envers dans un incubateur à convection gravitaire à 37 °C jusqu’à ce que les colonies des concurrents Ara− et Ara+ soient visibles et distinguables. Généralement, cela se produit dans les 16-24 heures, mais cela peut prendre plus de temps pour certaines souches évoluées. Comptez le nombre de colonies d’Ara− (rouge) et d’Ara+ (blanc) sur chaque plaque etnotez les résultats.
NOTE: Les différences entre les couleurs des colonies Ara- et Ara+ sur les plaques TA deviennent moins nettes avec le temps, même lorsque les plaques sont stockées à 4 ° C, de sorte qu’elles doivent être comptées le plus rapidement possible une fois qu’elles sont retirées de l’incubateur. Des images de plaques TA montrant les apparences typiques des colonies formées par les cellules Ara− et Ara+ sont incluses dans les résultats représentatifs. Cette section contient également des images de colonies courantes de « cas limites » (p. ex., chevauchement ou excroissance de différents types de colonies) et explique comment les compter. Si les taux de croissance et les morphologies des colonies formées sur les plaques TA par l’un des concurrents n’ont pas été caractérisés auparavant, étaler 80 μL d’une dilution de 10 000 fois dans une solution saline à partir des fioles de préconditionnement le jour 0, lorsque les concurrents sont encore séparés les uns des autres. Ensuite, examiner les colonies sur ces plaques de contrôle après incubation à 37 °C pendant 16-24 h ou plus.
- ALTERNATIVE : Jours 1 et 2 : Poursuite de la compétition de trois jours
- Pour chaque essai de compétition, étiqueter une fiole remplie de 9,9 mL de DM25. Étiquetez les flacons de manière à identifier de manière unique chaque paire de concurrents, le numéro de répétition et le jour du test de compétition. Étiqueter une fiole supplémentaire remplie de 9,9 ml de DM25 pour servir de flan.
- Sortez les flacons de compétition de la veille de l’incubateur. Examiner leur turbidité à l’œil nu pour vérifier la croissance prévue et détecter la contamination.
- Transvaser 100 μL de chaque fiole de compétition dans la fiole de milieu frais correspondante pour le lendemain de la compétition.
- Placez les nouveaux flacons de compétition et les flans dans l’incubateur à secousses. Incuber à 37 °C pendant 24 ± 1 h avec une agitation orbitale de 120 tr/min sur un diamètre de 1 pouce.
- Répétez les étapes 3.5.1-3.5.4 le jour 2 de la compétition avant de continuer.
- Jour 1 ou 3 : Terminer la compétition et plaquer pour le décompte final
- Pour chaque fiole de compétition, préparer deux tubes à essai remplis de 9,9 ml de solution saline. Étiquetez-les de manière à identifier de manière unique chaque paire de concurrents, le numéro de répétition et s’ils sont pour la première ou la deuxième dilution.
- Sortez les flacons de compétition de l’incubateur. Examinez leur turbidité à l’œil nu pour détecter qu’ils ont grandi et qu’il n’y avait pas de contamination évidente.
- Introduire à la pipette 100 μL de chaque fiole de compétition dans le premier tube de solution saline pour cette réplique. Les tubes résultants contiennent des dilutions 100 fois des cultures DM25.
- Vortex chaque tube de dilution de 100 fois pour bien le mélanger et pipeter 100 μL dans le deuxième tube de solution saline pour cette répétition. Les tubes résultants contiennent des dilutions 10 000 fois des cultures DM25.
- Vortex chaque tube à essai contenant une dilution de 10 000 fois à fond et étaler 80 μL de celui-ci sur une plaque TA comme décrit à l’étape 2.10. Étiquetez le côté du fond de chaque assiette avec la paire de souches qui ont été mélangées, le numéro de répétition et « Jour 1 » pour une compétition d’une journée ou « Jour 3 » pour une compétition de trois jours pour indiquer qu’il sera utilisé pour déterminer la représentation finale de chaque concurrent.
- Incuber les plaques TA à 37 °C et compter les colonies d’Ara− et d’Ara+ après la croissance, comme décrit à l’étape 3.4.8.
REMARQUE: Gardez une trace du numéro de répétition de chaque essai de compétition tout au long de tous les transferts et étapes de placage. La confusion entre les nombres final et initial qui correspondent entre différents tests répétés – même lorsque les deux mêmes concurrents ont été mélangés dans chacun d’eux – entraînera des estimations incorrectes de la condition physique.
- Calcul et aptitude de la parcelle
- Si vous utilisez Excel pour calculer et tracer la valeur adaptative relative, téléchargez la feuille de calcul XLS (fichier supplémentaire 1). Si vous utilisez R, installez le package fitnessR31 et téléchargez le modèle de valeurs séparées par des virgules (CSV) (fichier supplémentaire 2) ou générez une nouvelle copie de ce fichier en suivant les instructions de sa vignette.
- Entrez une « dilution de transfert » de 100 pour les essais de compétition effectués dans la cellule ou la colonne désignée du fichier téléchargé. Inscrivez le nombre total de cycles de croissance quotidiens au cours desquels les concurrents ont été co-cultivés comme le « nombre de transferts » (p. ex., 3 pour une compétition de trois jours).
- Inscrivez les noms de chaque paire de concurrents dans les cellules ou colonnes désignées avec la souche de référence comme « concurrent1 » et la souche ou la population d’essai comme « concurrent2 ».
- Pour chaque essai de compétition, entrez le nombre initial et final de colonies respectives dans les colonnes désignées du fichier téléchargé.
- Si vous utilisez la feuille de calcul Excel, elle affichera désormais la valeur relative moyenne de la condition physique et les limites de confiance de 95 % sur cette estimation. Copiez les résultats pour différentes combinaisons de concurrents dans une autre feuille et créez un graphique qui résume les résultats. Si vous utilisez R pour analyser les données, suivez les instructions de la vignette du package fitnessR pour effectuer ces calculs, générer un fichier CSV avec les valeurs calculées et tracer les résultats.
Résultats
Apparence et turbidité des cultures LTEE
En raison de la faible concentration de glucose dans le DM25, la turbidité des populations LTEE adultes n’est à peine visible que dans onze des douze flacons. Lors de l’examen des cultures LTEE à l’œil nu pour détecter une croissance normale et des signes de contamination (étape 1.6), chaque fiole contenant une population de LTEE doit être comparée côte à côte à l’essai blanc (figure 3A). L’exception est la population A−3, qui a évolué pour utiliser le citrate comme source supplémentaire de carbone et d’énergie et atteint donc une densité cellulaire plus élevée32. La turbidité des cultures DM25 des souches ancêtres REL606 et REL607 est semblable à celle d’une population évoluée typique (figure 3B). Les souches et les populations LTEE atteignent une densité plus élevée dans DM1000 en raison de la concentration plus élevée de glucose et une densité beaucoup plus élevée dans LB (Figure 3B). La densité des cultures DM25 de la population LTEE A−3 est intermédiaire entre les densités de cultures de REL606 dans DM25 et DM1000 (Figure 3C).

Figure 3 : Apparition des cultures LTEE. (A) Des flacons contenant les douze populations LTEE après 24 h de croissance en DM25 le jour où l’expérience a atteint 76 253 1/3 générations sont représentés à côté de l’blanc. (B) Des flacons contenant des cultures des ancêtres REL606 et REL607 cultivés pendant 24 heures en DM25, DM1000 et LB sont représentés à côté de blancs de support. (C) Zoom sur les images des mêmes flacons côte à côte montrant comment la turbidité du flacon de population A−3 dans DM25 se compare à l’ancêtre REL606 dans DM25 et DM1000. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Les lectures spectrophotométriques des densités optiques à 600 nm (OD600) de cultures cultivées en DM25 (étape 1.7) correspondent à ces observations visuelles pour les populations LTEE (figure 4A) et leurs ancêtres (figure 4B). Ces lectures peuvent être utilisées pour comparer quantitativement et documenter la croissance lorsqu’une contamination ou une erreur est soupçonnée. Pour les mesures des populations LTEE entre 76 000 et 76 500 générations, nous avons constaté que l’OD600 de A−3, la population qui a évolué pour croître sur le citrate, était de 0,223 en moyenne (0,218-0,227, intervalle de confiance à 95%). L’OD600 des onze autres populations était de 0,0252 en moyenne (0,0239-0,0265, intervalle de confiance à 95 %). Il y avait une variation légère, mais significative, des lectures de OD600 parmi les onze populations normales (F 10,88 = 5,1035, p = 7,5×10−6). Les populations LTEE atteignent la phase stationnaire après environ 5-6 heures d’incubation. S’ils sont transférés le matin, la croissance sera visible du milieu à la fin de l’après-midi du même jour. De nombreuses espèces de microbes sont capables de se développer aérobiement sur le citrate. Par conséquent, une turbidité accrue dans les populations autres que A−3 est probablement un signe de contamination extérieure.
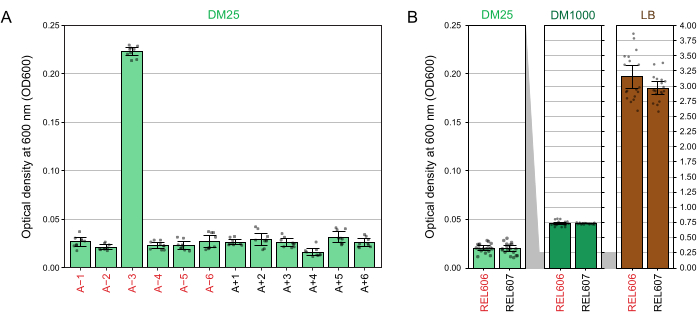
Figure 4 : Turbidité des cultures de LTEE. (A) Densité optique à 600 nm (OD600) des douze populations de LTEE après le cycle de croissance de 24 h sur trois jours différents entre 76 000 et 76 500 générations de l’expérience. Les valeurs OD600 de trois aliquotes de 1 mL pour chacun des trois jours différents sont tracées sous forme de points. La valeur moyenne de OD600 de trois aliquotes différentes de l’essai à blanc du même jour a été soustraite de ces valeurs. Les barres remplies affichent des moyennes. Les barres d’erreur sont des limites de confiance de 95 %. (B) OD600 des cultures des ancêtres REL606 et REL607 en DM25, DM1000 et LB. Les valeurs OD600 de trois aliquotes de 1 mL sur chacun des trois jours différents de deux cultures distinctes pour chaque condition et souche sont tracées sous forme de points. La valeur moyenne de OD600 de trois aliquotes différentes de l’essai à blanc du même jour a été soustraite de ces valeurs. Les barres remplies affichent des moyennes et les barres d’erreur sont des limites de confiance de 95 %. Les zones grisées entre les panneaux montrent comment l’axe OD600 est redimensionné entre le panneau DM25 et les panneaux DM1000 et LB. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Croissance et morphologie des colonies LTEE
Lors de la vérification de la contamination des populations en les plaquant sur différents milieux (étape 2.15), les ancêtres REL606 et REL607 et toutes les populations évoluées forment des colonies blanches avec des bords translucides et quelque peu irréguliers sur des plaques de gélose au glucose minimal (MG) (Figure 5A). La composition de la gélose MG est la même que celle du DM25 utilisé dans les transferts LTEE quotidiens, sauf avec une concentration plus élevée de glucose, de sorte que les populations LTEE évoluées forment souvent des colonies plus grandes sur MG que les ancêtres. En raison de sa densité cellulaire plus élevée en DM25, la population A−3 aura plusieurs fois plus de colonies si le même volume est plaqué pour elle que pour les autres populations, ce qui peut limiter la taille des colonies. Les types les plus courants de microbes contaminants forment des colonies blanches, opaques et parfaitement circulaires sur MG.
Sur la gélose arabinose minimale (MA), l’ancêtre REL607 et les populations Ara+ forment généralement des colonies blanches légèrement translucides. Ce schéma de croissance typique a persisté pour les populations d’Ara+ pendant 76 000 générations, à l’exception de A+6, qui a développé un défaut de croissance sur l’arabinose et ne forme plus de colonies sur MA (Figure 5B). Il n’y a pas de sélection pour maintenir la croissance sur l’arabinose pendant les transferts LTEE dans DM25, de sorte que d’autres populations d’Ara+ peuvent également éventuellement cesser de former des colonies sur des plaques de gélose MA au fur et à mesure que l’expérience se poursuit. À l’exception de A−3, les populations d’Ara− ne forment pas de colonies sur gélose MA, bien qu’un examen attentif puisse révéler des microcolonies dues à des oligo-éléments dans la gélose. La population A−3 forme de nombreuses petites colonies sur MA, car ces cellules peuvent se développer sur le citrate qui est également présent dans ce milieu. Les colonies de contaminants sur l’AM sont rares.
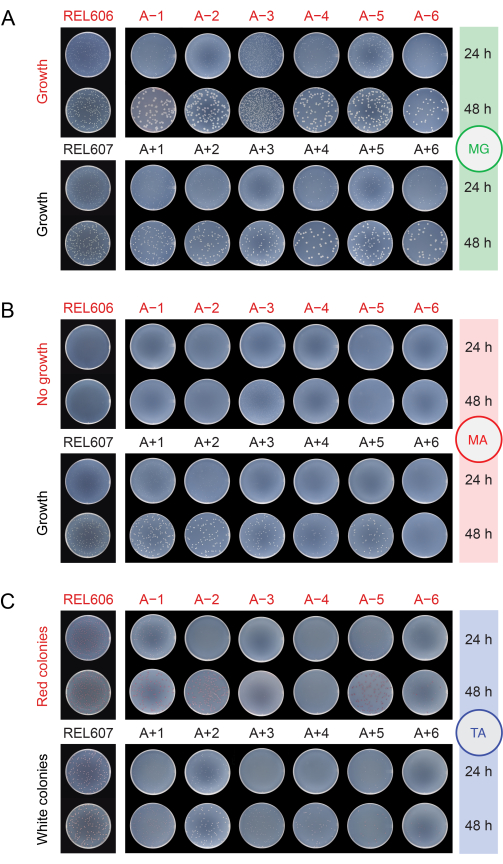
Figure 5 : Collage des populations d’EELT pour détecter la contamination. Les dilutions des ancêtres REL606 et REL607 et des douze populations LTEE le jour où l’expérience a atteint 76 026 générations 2/3 ont été plaquées sur des plaques de gélose (A) MG, (B) MA et (C) TA et photographiées après 24 h et 48 h. Les mêmes dilutions ont été faites pour toutes les cultures, mais deux fois moins de volume a été plaqué pour les ancêtres que ce qui est décrit dans le protocole pour les populations LTEE, pour expliquer quelque peu leurs densités cellulaires plus élevées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Sur la gélose tétrazolium arabinose (TA), l’ancêtre REL606 et toutes les populations d’Ara− devraient former des colonies rouges, tandis que l’ancêtre REL607 et toutes les populations d’Ara+ devraient généralement former des colonies blanches (qui peuvent inclure des nuances rose clair ou pêche) (Figure 5C). Les ancêtres LTEE forment des colonies robustes, qui sont facilement identifiables comme Ara− et Ara+ sur gélose TA dans les 16-24 heures. À l’origine, cette différence pouvait être utilisée pour détecter la contamination croisée entre les populations Ara− et Ara+ . Cependant, la gélose TA a une composition nutritive plus complexe que le milieu DM25 chimiquement défini utilisé dans les transferts quotidiens, et il n’y a pas eu de pression évolutive pour E. coli dans le LTEE pour maintenir une capacité de croissance robuste dans ces conditions. Par conséquent, certaines populations LTEE évoluées présentent maintenant une faible croissance sur les plaques TA, prenant 48 heures pour former des colonies ou ne se développant pas du tout. Les couleurs et les morphologies des colonies formées sur TA par les populations LTEE évoluées ont également changé par rapport aux ancêtres et divergé les unes des autres. La présence de quelques colonies aberrantes n’est pas toujours un signe de contamination. Des mutations spontanées peuvent se produire qui changent l’état de marqueur Ara des souches LTEE, en particulier de Ara+ à Ara− en raison de la probabilité plus élevée de mutations de perte de fonction affectant l’utilisation de l’arabinose par rapport aux mutations de réversion qui restaurent l’activité araA. Les mutations changeant les états marqueurs Ara sont plus fréquentes dans les populations qui ont développé une hypermutation (A-1, A-2, A-3, A-4, A+3 et A+6)13. Sur la gélose TA, les microbes contaminants d’autres espèces forment souvent (mais pas toujours) de petites colonies parfaitement circulaires avec des centres rouges entourés de frontières blanches distinctes qui sont différentes de celles formées par des souches ou des populations LTEE.
Résultats du concours de coculture
Les compétitions entre toutes les paires Ara− et Ara+ des deux ancêtres LTEE (REL606 et REL607, respectivement) et les échantillons de population A−5 et A+5 archivés à 20 000 générations (REL8597 et REL8604, respectivement) montrent comment les colonies avec différents états marqueurs Ara peuvent être différenciées et comptées sur gélose TA (étapes 3.4.8 et 3.6.6) (Figure 6). Les colonies ont été comptées pour six flacons répliqués pour chaque paire de concurrents avant et après les essais d’un jour et de trois jours qui ont commencé par la renaissance dans DM1000 (tableau 1). Le nombre total de colonies observées pour la même dilution et le même plaqué volumique varie avec les concurrents mélangés parce que les cultures des populations LTEE évoluées atteignent des densités cellulaires inférieures à celles des cultures des souches ancêtres en DM25. Cette différence est une conséquence de l’évolution de l’augmentation de la taille des cellules, qui s’est produite dans toutes les populations LTEE au cours des premiers milliers de générations de l’expérience 8,33.
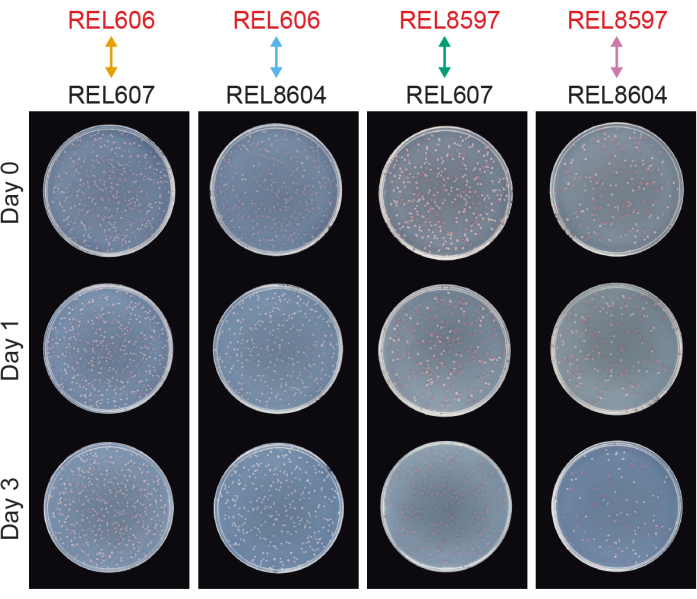
Figure 6 : Essais de compétition plaqués sur des plaques de gélose TA. Exemples de plaques de gélose TA provenant d’essais de compétition. REL606 et REL607 sont les ancêtres Ara− et Ara+ du LTEE, respectivement. REL8597 et REL8604 sont les 20 000 populations de génération A-5 et A+5, respectivement, à partir des « archives fossiles » congelées du LTEE. Les plaques TA correspondant à un essai de réplication entre chaque paire de souches sont présentées pour les jours 0, 1 et 3 de la compétition. Les plaques ont été photographiées après 24 h de croissance à 37°C. Les cellules des concurrents REL606 et REL8597 sont Ara− et forment des colonies rouges. Les cellules des concurrents REL607 et REL8604 sont Ara+ et forment des colonies blanches. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La plupart des colonies sur une plaque TA de compétition typique seront bien séparées ou se chevaucheront de manière à ce qu’il soit facile de compter le nombre de colonies initialement circulaires de différents types qui ont grandi ensemble (figure 7A). Cependant, certaines situations peuvent survenir dans lesquelles il n’est pas évident de compter une colonie atypique ou une croissance qui est un mélange des deux couleurs. Premièrement, lorsqu’une colonie d’Ara+ blanche et une colonie d’Ara− rouge se chevauchent, la colonie d’Ara+ a tendance à envahir et à envelopper la colonie d’Ara−. Dans cette situation, il faut compter une petite tache rouge ou un « espace » translucide dans la plus grande colonie d’Ara+ comme une colonie d’Ara− (Figure 7B). Deuxièmement, des mutants Ara+ spontanés apparaîtront occasionnellement dans les colonies d’Ara−. Ces mutants apparaissent généralement comme des secteurs blancs (papilles) se propageant plus rapidement à l’intérieur d’une colonie rouge parce qu’ils se développent plus rapidement une fois qu’ils ont accès à l’arabinose comme nutriment supplémentaire (Figure 7C). Ces colonies à secteur blanc sont comptées comme une colonie Ara− et aucune colonie Ara+. Cette situation devient plus fréquente si les plaques sont incubées pendant 48 heures ou plus. Troisièmement, des colonies rosâtres parfois translucides sont observées (Figure 7D). Ceux-ci sont formés par le concurrent Ara-. Enfin, un petit nombre de colonies circulaires dont l’intérieur est légèrement différent de rouge se développent parfois sur des plaques d’AT lorsqu’elles sont contaminées par quelques cellules microbiennes extérieures lors de la préparation de la gélose ou lors de l’épandage de dilutions de culture sur leurs surfaces (figure 7E). Ces colonies de contaminants ne doivent pas être comptées. Si l’on soupçonne une contamination d’une culture de compétition parce qu’il y a beaucoup de colonies atypiques sur l’une de ses plaques TA, cette réplication doit être exclue.
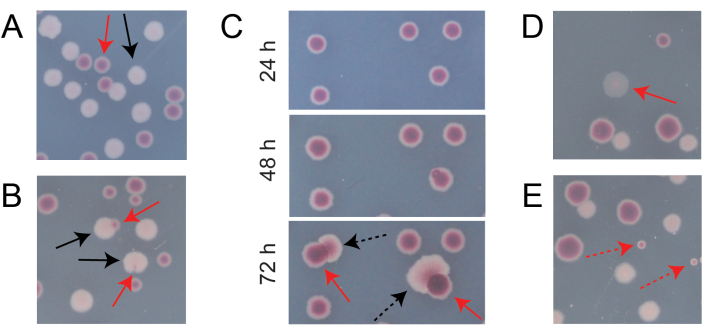
Figure 7 : Cas limites rencontrés lors du comptage des colonies d’Ara− et d’Ara+ sur gélose TA. Dans chaque panneau, certaines colonies d’Ara− et d’Ara+ qui devraient être comptées sont marquées de flèches rouges et noires, respectivement. Les colonies qui ne doivent pas être comptées sont indiquées par des flèches pointillées correspondant au type qu’elles semblent être. Toutes les photos ont été prises après 24 h d’incubation sauf dans le panneau C. (A) Exemples de colonies normales d’Ara− et d’Ara+. (B) Exemples de colonies Ara+ envahissant les colonies Ara− voisines, dont une qui n’est qu’à peine visible sous la forme d’une brèche transparente à l’extérieur de la colonie blanche. Comptez chacun de ces cas comme deux colonies, une de chaque type. (C) Exemples de colonies Ara− donnant naissance à des secteurs mutants Ara+. Comptez chaque cas comme une seule colonie d’Ara−. Le secteur blanc (papille) qui apparaît est dû à un mutant Ara+ apparaissant au sein de la colonie. Le même champ de colonies est montré après 24 h, 48 h et 72 h de croissance. (D) Exemple de colonie rose translucide. Comptez-le comme Ara−. (E) Exemples de colonies formées par contamination extérieure par un microbe qui n’est pas E. coli. Ceux-ci sont rouges mais plus petits et parfaitement circulaires avec une limite blanche distincte. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’analyse du nombre de colonies de ces compétitions à l’aide de la feuille de calcul Excel (fichier supplémentaire 1) ou en exécutant les fonctions du package fitnessR dans R sur les nombres de colonies entrés dans le modèle CSV (fichier supplémentaire 2) montre que les deux ancêtres sont indiscernables en termes de valeur adaptative avec la précision du test, que les populations A-5 et A+5 de 20 000 générations sont significativement plus aptes que les ancêtres, et qu’aucune des deux populations évoluées n’est significativement plus apte que l’autre (tests t de Welch, p > 0,05) (figure 8). La précision de l’estimation de la condition physique relative s’améliore dans les compétitions de trois jours par rapport aux compétitions d’une journée pour l’une des paires étroitement appariées (REL606 vs REL607). La précision de ces mesures pourrait être encore augmentée en effectuant des compétitions plus longues avec plus de cycles de croissance, si vous le souhaitez. Cependant, les résultats des compétitions de plusieurs jours ne sont pas informatifs une fois qu’un concurrent devient si abondant par rapport à l’autre après les jours de compétition supplémentaires que le rapport des deux souches ne peut pas être déterminé avec précision parce qu’il y a très peu ou pas de colonies du type moins apte à compter. C’est le cas des compétitions de trois jours des ancêtres contre les populations évoluées de 20 000 générations (REL606 vs REL8604 et REL607 vs REL8597) (Figure 6 et Tableau 1).
Tableau 1 : Nombre de colonies à partir des tests de condition physique compétitifs. Des essais de compétition d’un jour et de trois jours avec six répétitions ont été effectués pour toutes les combinaisons par paires de deux concurrents Ara− et des deux concurrents Ara+ . REL606 et REL607 sont les ancêtres Ara− et Ara+ du LTEE, respectivement. REL8597 et REL8604 sont les populations A-5 et A+5 de 20 000 générations, respectivement, à partir des « archives fossiles » gelées du LTEE. Veuillez cliquer ici pour télécharger ce tableau.
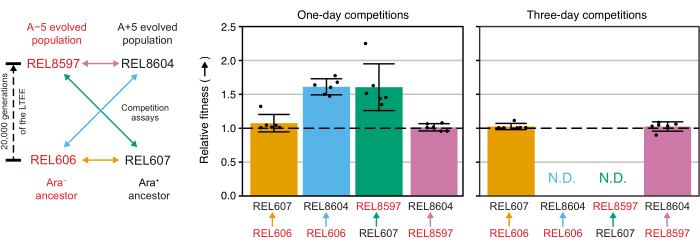
Figure 8 : Aptitude relative mesurée à l’aide d’essais de compétition. Résultats des tests de compétition d’un et de trois jours entre les ancêtres LTEE et les populations LTEE de 20 000 générations A-5 et A+5. Le diagramme de gauche montre les quatre compétitions par paires sous forme de flèches à deux têtes codées par couleur. Chaque combinaison des deux concurrents Ara− (étiquettes rouges) et Ara+ (étiquettes noires) a été testée avec une réplication en six fois. Le nombre de colonies du tableau 1 a été analysé dans R à l’aide du package fitnessR31, et les résultats ont été tracés à l’aide du package ggplot2 (version 3.4.0)34. La condition physique est affichée comme le concurrent vers lequel la flèche sur l’étiquette se dirige par rapport au concurrent d’où provient la flèche (par exemple, REL8604 par rapport à REL606). Les valeurs de valeur adaptative relative estimées à partir du nombre de colonies pour chaque répétition d’essai de compétition (points), les valeurs moyennes de valeur adaptative relative pour la paire de concurrents (barres remplies du même code couleur que le diagramme) et les intervalles de confiance à 95 % (barres d’erreur) sont indiqués. Les valeurs relatives de la condition physique n’ont pas pu être déterminées (s.o.) pour les compétitions de trois jours entre les ancêtres et les populations évoluées parce qu’il n’y avait nulle ou très peu de colonies des ancêtres sur les plaques du jour 3 (voir le tableau 1). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Fichier supplémentaire 1. Fichier de feuille de calcul Excel pour calculer la condition physique relative. Veuillez cliquer ici pour télécharger ce fichier.
Dossier supplémentaire 2. Modèle de fichier d’entrée de valeurs séparées par des virgules pour calculer l’aptitude relative dans R à l’aide du package fitnessR. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Résilience à long terme du LTEE et de ses méthodes
L’expérience d’évolution à long terme (LTEE) d’E. coli en est maintenant à sa quatrième décennie . Pour une expérience d’évolution microbienne de toute durée, il est essentiel de maintenir un environnement reproductible, d’éviter la contamination, d’archiver les échantillons et de mesurer avec précision la condition physique. Le LTEE démontre plusieurs stratégies éprouvées pour atteindre ces objectifs, y compris l’utilisation de flacons bien secoués qui créent un environnement homogène et un milieu de croissance chimiquement défini qui soutient une faible densité cellulaire. De plus, le LTEE utilise des souches ancêtres qui diffèrent par un marqueur génétique qui donne un phénotype (couleur de colonie) qui est à la fois facilement dépisté et sélectivement neutre dans l’environnement d’évolution. Cette caractéristique de conception expérimentale fournit un moyen d’identifier la contamination interne et externe et facilite la mesure de l’aptitude. Cependant, les procédures et les mesures de protection utilisées par la LTEE depuis 1988 ne se sont pas toutes révélées aussi robustes. Certaines méthodes qui étaient fiables lorsque le LTEE a commencé sont devenues moins efficaces à mesure que les populations d’E. coli ont évolué. Heureusement, ces méthodes problématiques peuvent maintenant être augmentées ou remplacées à l’aide de technologies développées depuis le début de l’expérience.
Détection de la contamination
La détection de la contamination est essentielle pour le LTEE. La contamination peut être de deux types : entre les populations LTEE (contamination croisée) et avec les microbes de l’environnement (contamination extérieure). Pour la plupart, l’utilisation prudente de techniques aseptiques et une attention particulière lors de la préparation des milieux et des transferts quotidiens préviennent les deux types de contamination, mais ils se produisent. Au début de l’expérience, le placage sur gélose TA pourrait être utilisé pour détecter les cas de contamination croisée parce que les transferts ont toujours alterné entre les populations Ara− et Ara+. L’empreinte digitale de la sensibilité et de la résistance de ces E. coli à certains bactériophages devait également être une caractéristique de conception qui pourrait différencier les populations LTEE des souches de laboratoire d’E. coli couramment utilisées qui pourraient les contaminer4. Cependant, ces marqueurs génétiques sont devenus peu fiables au fur et à mesure que l’expérience progressait (p. ex., certaines populations ne forment plus de colonies sur gélose TA)10,35. Heureusement, les populations ont divergé génétiquement car elles ont connu des histoires évolutives distinctes au cours de l’expérience, ce qui a créé de nouveaux marqueurs génétiques qui peuvent maintenant être utilisés pour détecter la contamination croisée. Par exemple, chaque population a développé une combinaison unique de mutations dans les gènes pykF et nadR 14,36,37. Parfois, la PCR amplifie et séquençons Sanger ces deux gènes pour tester si les colonies avec des morphologies ou des couleurs inhabituelles sont dues à une contamination croisée. Alors que les coûts du séquençage du génome entier et de la population entière continuent de baisser, le séquençage de routine des populations LTEE pourrait bientôt être possible, offrant ainsi de nouvelles possibilités de les surveiller pour détecter les signes de contamination.
Mesurer la condition physique compétitive
Un autre cas dans lequel le LTEE a dépassé ses méthodes originales est que la valeur adaptative de l’E. coli évolué a augmenté dans l’environnement expérimental à un tel point que l’on ne peut plus mesurer directement la valeur adaptative des populations d’aujourd’hui par rapport à leurs ancêtres en utilisant le protocole décrit ici. Les populations évoluées surpassent les ancêtres à un point tel qu’il ne reste que peu ou pas de colonies d’ancêtres à compter après une compétition d’une journée. Une approche pour faire face à cette grande différence de condition physique consiste à utiliser des rapports de départ inégaux des souches, en pondérant les volumes initiaux qui sont mélangés en fonction du concurrent moins apte (p. ex., ancêtre 90 μL et concurrent évolué de 10 μL). Une deuxième approche consiste à identifier un clone Ara− évolué qui a une valeur adaptative supérieure à celle de l’ancêtre LTEE, à isoler un mutant réversible Ara+ spontané de celui-ci par sélection sur gélose MA, puis à vérifier que la souche réversible a la même aptitude que son parent en utilisant un essai de compétition 6,38. Cette nouvelle paire Ara−/Ara+ peut ensuite être utilisée comme un ensemble de souches concurrentes communes au lieu de REL606/REL607. Idéalement, le clone Ara− évolué choisi comme concurrent commun (et son réversible Ara+) aura une aptitude intermédiaire par rapport à toutes les souches d’intérêt dans une expérience. Au cours des 50 000 premières générations du LTEE, ces deux approches (utilisant des ratios de départ inégaux ou un concurrent commun) n’ont pas produit de mesures de la condition physique significativement différentes de l’approche typique39.
Ces modifications apportées au protocole de compétition font certaines hypothèses simplificatrices qui ne sont pas toujours vraies. La première est que les mesures de la condition physique sont transitives. Autrement dit, si nous sommes en concurrence séparément entre deux populations et une souche concurrente commune, nous pouvons déduire l’adéquation relative des deux populations l’une à l’autre. Cette relation s’est avérée vraie pour le LTEE40, pour la plupart, mais ce n’est pas le cas pour d’autres expériences41. L’une des raisons de cet écart peut être l’évolution des effets négatifs de la condition physique dépendants de la fréquence. Cette situation se produit lorsque des souches isolées de deux lignées divergentes différentes de la population A−2 du LTEE sont en compétition l’une contre l’autre19,42. Chacun a un avantage lorsqu’il est rare, en raison de l’alimentation croisée, ce qui stabilise leur coexistence. Les données de séquençage montrant la coexistence à long terme de lignées avec différents ensembles de mutations suggèrent que des interactions similaires peuvent également être apparues dans d’autres populations LTEE14,43, bien qu’il ne soit pas clair si elles sont assez fortes pour modifier sensiblement les estimations de la valeur adaptative. Enfin, l’évolution de la croissance aérobie sur le citrate dans la population A−3 du LTEE32 signifie que la valeur adaptative de ces cellules intègre désormais l’utilisation d’une ressource « privée » lorsqu’elles sont en compétition avec des cellules qui ne peuvent pas utiliser de citrate, ce qui complique l’interprétation de ces résultats. Malgré ces exceptions, l’utilisation d’une faible concentration de glucose et d’un environnement bien secoué a sans aucun doute simplifié les comparaisons de condition physique entre les souches et les populations LTEE.
Aux générations suivantes, certaines populations LTEE ne forment plus de colonies sur gélose TA, ce qui rend difficile, voire impossible, la réalisation d’expériences de compétition utilisant même des protocoles modifiés10. D’autres méthodes qui ne nécessitent pas de croissance de colonies peuvent potentiellement être utilisées pour déterminer la représentation relative de deux concurrents, comme FREQ-seq qui utilise le séquençage de nouvelle génération pour compter la proportion de lectures contenant deux allèles alternatifs dans un amplicon44. Cette méthode ou une méthode similaire pourrait potentiellement être utilisée avec les allèles Ara ou avec des mutations nouvellement évoluées, telles que celles de pykF et nadR, par rapport à la séquence ancestrale. L’exécution de modifications génétiques qui introduisent d’autres types de marqueurs neutres peut également être utilisée pour mesurer l’aptitude relative. Par exemple, des gènes de protéines fluorescentes ont été insérés dans les chromosomes de cellules dans des expériences de ramification LTEE afin que les concurrents puissent être comptés en utilisant la cytométrie de flux45. Une autre approche, qui ouvre la possibilité de mélanger ensemble plus de deux souches dans le même flacon de compétition, consiste à insérer des codes-barres amplifiés par PCR et séquencés dans les génomes de différents concurrents. Cette approche a été utilisée pour le traçage de la lignée dans les expériences d’évolution46. La cytométrie en flux et le séquençage par code-barres peuvent mesurer avec précision des ratios beaucoup plus extrêmes de deux souches par rapport au comptage des colonies (car ils peuvent interroger > 10 000 cellules / génomes par rapport aux 500 < qui peuvent être comptés sur une plaque de gélose), de sorte que l’utilisation de ces méthodes promet également d’augmenter la plage dynamique en termes de différences de fitness qui peuvent être mesurées par rapport à un concurrent commun.
Modèles alternatifs pour les expériences d’évolution microbienne à long terme
Malgré toutes ses vertus, le LTEE n’est pas parfait. Certains aspects de sa conception le rendent laborieux et sensible à l’erreur humaine. Par exemple, chaque jour, un chercheur doit venir au laboratoire et pipette entre les flacons d’Erlenmeyer pour poursuivre l’expérience. Les expériences de compétition peuvent également poser des obstacles logistiques de taille, étant donné que les exigences en matière de verrerie stérile, de supports, d’espace d’incubateur et de comptage des colonies augmentent rapidement lorsque même un petit nombre de concurrents sont testés avec une réplication modeste. On nous demande souvent pourquoi nous ne tirons pas parti des systèmes d’automatisation de laboratoire, tels que les robots de pipetage qui fonctionnent sur des microplaques à 96 puits, ou des systèmes de culture continue, tels que les chimiostats ou les turbidostats. La réponse est simple : le LTEE est, en un sens, prisonnier de sa propre longue histoire. Nous n’osons pas nous écarter des cultures de 10 ml secouant à une vitesse spécifique dans des flacons d’erlenmeyer de 50 mL, car cela risquerait de changer fondamentalement l’expérience. Les aspects subtils de l’environnement auxquels ces populations s’adaptent depuis des décennies (p. ex., la quantité d’aération) seraient modifiés dans les microplaques ou les systèmes de culture continue. Le goulot d’étranglement de la population à chaque transfert peut également être différent (plus petit dans les microplaques, par exemple), modifiant la dynamique évolutive. En bref, s’écarter des méthodes décrites ici ferait du LTEE une expérience différente, ou à tout le moins risquerait d’introduire une discontinuité qui perturberait les trajectoires évolutives.
Les chercheurs qui conçoivent de nouvelles expériences d’évolution devraient envisager ces autres façons de propager les populations microbiennes, tout en étant conscients de leurs avantages et inconvénients potentiels. L’utilisation de robots de pipetage pour transférer des populations dans des plaques de micropuits est plus simple sur le plan logistique à certains égards et peut s’avérer très puissante en raison du nombre élevé de populations répliquées qui peuvent être propagées de cette manière47,48,49. Cependant, les transferts automatisés dans la plupart des configurations actuelles n’ont pas lieu dans des conditions complètement stériles, ce qui augmente la probabilité de contamination extérieure. Pour éviter la contamination, le milieu de croissance est souvent complété par des antibiotiques, qui deviennent une caractéristique de l’environnement qui affecte l’évolution. Les transferts dans les plaques de micropuits sont également plus sujets aux événements de contamination croisée. Enfin, l’environnement des plaques de micropuits – en particulier si elles ne sont pas secouées – a tendance à sélectionner pour la croissance des murs, l’agrégation et d’autres phénomènes qui peuvent compliquer l’évolution en créant plusieurs niches dans un puits. L’utilisation de milieux riches ou de fortes concentrations de nutriments pour maintenir la taille des populations dans de petits puits est susceptible d’exacerber ces complexités. Si de telles interactions se produisent, elles peuvent rendre la mesure et l’interprétation de la condition physique beaucoup plus difficiles.
Les systèmes de culture continue pour l’évolution microbienne comprennent les chimiostats, dans lesquels le milieu frais est constamment pompé et la culture est pompée, et les turbidostatiques, dans lesquels les cultures sont périodiquement diluées par détection et pompage automatisés pour maintenir les cellules dans un état de croissance constante. Ces systèmes sont très utiles lorsque l’on veut modéliser la physiologie et l’évolution microbiennes, car ils évitent que les microbes fassent la transition entre la croissance et la famine en les maintenant dans un environnement qui contient toujours des nutriments50. On peut même ajouter des capteurs qui effectuent des mesures en temps réel de la densité optique, de la consommation d’O2, du pH et d’autres aspects de l’environnement et de la croissance d’une culture. Cependant, les systèmes de culture continue actuels nécessitent soit des achats d’équipement coûteux, soit une expertise spécialisée pour construire des configurations personnalisées51,52,53,54. En outre, la croissance des parois, dans laquelle les cellules échappent à la dilution en adhérant à la chambre de culture, perturbe la dynamique évolutive dans les systèmes de culture continue à moins qu’ils ne soient stérilisés périodiquement. En raison de ces contraintes, la plupart des expériences d’évolution du chémostat et du turbidostat à ce jour ont été de durée limitée et/ou ont impliqué relativement peu de populations évoluant indépendamment par rapport aux expériences d’évolution par transfert en série.
Conclusion
Les méthodes que nous démontrons ici pour le LTEE sont essentielles pour étudier son dossier historique unique et poursuivre l’évolution ouverte de ces populations d’E. coli. Ils fournissent également un point de départ pour d’autres qui envisagent de nouvelles expériences d’évolution qui pourraient tirer parti de l’automatisation des laboratoires ou ajouter divers éléments de la complexité trouvés dans les environnements naturels qui ont été délibérément omis du LTEE. Depuis 1988, l’évolution expérimentale a prospéré en tant que domaine. Pendant ce temps, les chercheurs des laboratoires du monde entier ont démontré l’immense flexibilité de cette approche pour étudier l’évolution, innover en introduisant des modèles expérimentaux créatifs et en surveillant les résultats à l’aide de nouvelles technologies. Les méthodes du LTEE ne représentent pas un point final, mais nous espérons qu’elles continueront d’inspirer et de fournir une base pour le domaine dans un avenir lointain.
Déclarations de divulgation
Aucun conflit d’intérêts déclaré.
Remerciements
Nous remercions Richard Lenski et les nombreux chercheurs qui ont étudié et contribué au maintien de l’expérience d’évolution à long terme avec E. coli, y compris en particulier Neerja Hajela. Le LTEE est actuellement soutenu par la National Science Foundation (DEB-1951307).
matériels
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride (TTC) | Sigma-Aldrich | T8877 | |
| 20 mL Glass Beaker | Sigma-Aldrich | CLS100020 | |
| 50 mL Erlenmeyer Flasks | Sigma-Aldrich | CLS498050 | |
| Agar | Sigma-Aldrich | A1296 | |
| Ammonium Sulfate | Sigma-Aldrich | AX1385 | |
| Antifoam | Sigma-Aldrich | A5757 | |
| Arabinose | Sigma-Aldrich | A3256 | |
| Freezer Box (2") | VWR | 82007-142 | |
| Freezer Box (3") | VWR | 82007-144 | |
| Freezer Box Cell Divider (49-place) | VWR | 82007-150 | |
| Freezer Box Cell Divider (81-place) | VWR | 82007-154 | |
| Freezer Vials (1/2-Dram) | VWR | 66009-816 | |
| Freezer Vials (2-Dram) | VWR | 66010-560 | |
| Glucose | Sigma-Aldrich | G8270 | |
| Glycerol | Fisher Scientific | G33 | |
| Magnesium Sulfate | Sigma-Aldrich | M7506 | |
| Metal Tray | Winco | SPJP-202 | |
| Petri Dish | Fisher Scientific | FB0875712 | |
| Potassium Phosphate Dibasic Trihydrate | Sigma-Aldrich | P5504 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | P5379 | |
| Sodium Chloride | Sigma-Aldrich | M7506 | |
| Sodium Citrate Tribasic Dihydrate | Sigma-Aldrich | C7254 | |
| Test Tube Cap (18mm) | VWR | 10200-142 | |
| Test Tube Rack (18mm, steel) | Adamas-Beta | N/A | Test Tube Racks Stainless Steel Grid Arrangement 72 Holes (17-19 mm) |
| Test Tubes (18 x 150 mm) | VWR | 47729-583 | |
| Thiamine, Hydrochloride | Millipore | 5871 | |
| Tryptone | Gibco | 211705 | |
| Yeast Extract | Gibco | 212750 |
Références
- Lenski, R. E., Rose, M. R., Simpson, S. C., Tadler, S. C. Long-term experimental evolution in Escherichia coli. I. Adaptation and divergence during 2,000 generations. The American Naturalist. 138 (6), 1315-1341 (1991).
- Fox, J. W., Lenski, R. E. From here to eternity-the theory and practice of a really long experiment. PLoS Biology. 13 (6), e1002185 (2015).
- Daegelen, P., Studier, F. W., Lenski, R. E., Cure, S., Kim, J. F. Tracing ancestors and relatives of Escherichia coli B, and the derivation of B strains REL606 and BL21(DE3). Journal of Molecular Biology. 394 (4), 634-643 (2009).
- Studier, F. W., Daegelen, P., Lenski, R. E., Maslov, S., Kim, J. F. Understanding the differences between genome sequences of Escherichia coli B strains REL606 and BL21(DE3) and comparison of the E. coli B and K-12 genomes. Journal of Molecular Biology. 394 (4), 653-680 (2009).
- Barrick, J. E., Lenski, R. E. Genome dynamics during experimental evolution. Nature Reviews Genetics. 14 (12), 827-839 (2013).
- Lenski, R. E. Experimental studies of pleiotropy and epistasis in Escherichia coli. II. Compensation for maladaptive pleiotropic effects associated with resistance to virus T4. Evolution. 42 (3), 425-432 (1988).
- Calcott, P. H., Gargett, A. M. Mutagenicity of freezing and thawing. FEMS Microbiology Letters. 10 (2), 151-155 (1981).
- Lenski, R. E., Travisano, M. Dynamics of adaptation and diversification: a 10,000-generation experiment with bacterial populations. Proceedings of the National Academy of Sciences of the United States of America. 91 (15), 6808-6814 (1994).
- Wiser, M. J., Ribeck, N., Lenski, R. E. Long-term dynamics of adaptation in asexual populations. Science. 342 (6164), 1364-1367 (2013).
- Lenski, R. E., et al. Sustained fitness gains and variability in fitness trajectories in the long-term evolution experiment with Escherichia coli. Proceedings of the Royal Society B: Biological Sciences. 282 (1821), 20152292 (2015).
- Barrick, J. E., et al. Genome evolution and adaptation in a long-term experiment with Escherichia coli. Nature. 461 (7268), 1243-1247 (2009).
- Blount, Z. D., Barrick, J. E., Davidson, C. J., Lenski, R. E. Genomic analysis of a key innovation in an experimental Escherichia coli population. Nature. 489 (7417), 513-518 (2012).
- Tenaillon, O., et al. Tempo and mode of genome evolution in a 50,000-generation experiment. Nature. 536 (7615), 165-170 (2016).
- Good, B. H., McDonald, M. J., Barrick, J. E., Lenski, R. E., Desai, M. M. The dynamics of molecular evolution over 60,000 generations. Nature. 551 (7678), 45-50 (2017).
- Consuegra, J., et al. Insertion-sequence-mediated mutations both promote and constrain evolvability during a long-term experiment with bacteria. Nature Communications. 12 (1), 980-980 (2021).
- Cooper, T. F., Rozen, D. E., Lenski, R. E. Parallel changes in gene expression after 20,000 generations of evolution in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 100 (3), 1072-1077 (2003).
- Favate, J. S., Liang, S., Cope, A. L., Yadavalli, S. S., Shah, P. The landscape of transcriptional and translational changes over 22 years of bacterial adaptation. eLife. 11, e81979 (2022).
- Khan, A. I., Dinh, D. M., Schneider, D., Lenski, R. E., Cooper, T. F. Negative epistasis between beneficial mutations in an evolving bacterial population. Science. 332 (6034), 1193-1196 (2011).
- Plucain, J., et al. Epistasis and allele specificity in the emergence of a stable polymorphism in Escherichia coli. Science. 343 (6177), 1366-1369 (2014).
- Quandt, E. M., Deatherage, D. E., Ellington, A. D., Georgiou, G., Barrick, J. E. Recursive genomewide recombination and sequencing reveals a key refinement step in the evolution of a metabolic innovation in Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 111 (6), 2217-2222 (2014).
- Leon, D., D'Alton, S., Quandt, E. M., Barrick, J. E. Innovation in an E. coli evolution experiment is contingent on maintaining adaptive potential until competition subsides. PLoS Genetics. 14 (4), e1007348 (2018).
- Bennett, A. F., Lenski, R. E., Mittler, J. E. Evolutionary adaptation to temperature. I. Fitness responses of Escherichia coli to changes in its thermal environment. Evolution. 46 (1), 16-30 (1992).
- Kibota, T. T., Lynch, M. Estimate of the genomic mutation rate deleterious to overall fitness in E. coli. Nature. 381 (6584), 694-696 (1996).
- Friesen, M. L., Saxer, G., Travisano, M., Doebeli, M. Experimental evidence for sympatric ecological diversification due to frequency-dependent competition in Escherichia coli. Evolution. 58 (2), 245-260 (2004).
- Cooper, T. F. Recombination speeds adaptation by reducing competition between beneficial mutations in populations of Escherichia coli. PLoS Biology. 5 (9), e225 (2007).
- Cooper, T. F., Lenski, R. E. Experimental evolution with E. coli in diverse resource environments. I. Fluctuating environments promote divergence of replicate populations. BMC Evolutionary Biology. 10, 11 (2010).
- Quan, S., et al. Adaptive evolution of the lactose utilization network in experimentally evolved populations of Escherichia coli. PLoS Genetics. 8 (1), e1002444 (2012).
- Deatherage, D. E., Kepner, J. L., Bennett, A. F., Lenski, R. E., Barrick, J. E. Specificity of genome evolution in experimental populations of Escherichia coli evolved at different temperatures. Proceedings of the National Academy of Sciences of the United States of America. 114 (10), E1904-E1912 (2017).
- Izutsu, M., Lake, D. M., Matson, Z. W. D., Dodson, J. P., Lenski, R. E. Effects of periodic bottlenecks on the dynamics of adaptive evolution in microbial populations. BioRixv. , 4457 (2021).
- Chavarria-Palma, J. E., Blount, Z. D., Barrick, J. E. . LTEE Media Recipes. , (2022).
- Barrick, J. E., Lake, D. M. fitnessR: fitnessR-v1.0.0. barricklab. , (2023).
- Blount, Z. D., Borland, C. Z., Lenski, R. E. Historical contingency and the evolution of a key innovation in an experimental population of Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 105 (23), 7899-7906 (2008).
- Grant, N. A., Magid, A. A., Franklin, J., Dufour, Y., Lenski, R. E. Changes in cell size and shape during 50,000 generations of experimental evolution with Escherichia coli. Journal of Bacteriology. 203 (10), 22 (2021).
- Wickham, H. . ggplot2: Elegant Graphics for Data Analysis. , (2016).
- Meyer, J. R., et al. Parallel changes in host resistance to viral infection during 45,000 generations of relaxed selection. Evolution. 64 (10), 3024-3034 (2010).
- Woods, R., Schneider, D., Winkworth, C. L., Riley, M. A., Lenski, R. E. Tests of parallel molecular evolution in a long-term experiment with Escherichia coli. Proceedings of the National Academy of Sciences of the United States of America. 103 (24), 9107-9712 (2006).
- . LTEE-Ecoli: genomics resources for the Long-Term Evolution Experiment with Escherichia coli Available from: https://github.com/barricklab/LTEE-Ecoli (2022)
- Izutsu, M., Lenski, R. E. Experimental test of the contributions of initial variation and new mutations to adaptive evolution in a novel environment. Frontiers in Ecology and Evolution. 10, 958406 (2022).
- Wiser, M. J., Lenski, R. E. A comparison of methods to measure fitness in Escherichia coli. PLoS One. 10 (5), 0126210 (2015).
- de Visser, J. A. G. M., Lenski, R. E. Long-term experimental evolution in Escherichia coli. XI. Rejection of non-transitive interactions as cause of declining rate of adaptation. BMC Evolutionary Biology. 2 (1), 19 (2002).
- Paquin, C. E., Adams, J. Relative fitness can decrease in evolving asexual populations of S. cerevisiae. Nature. 306 (5941), 368-371 (1983).
- Rozen, D. E., Lenski, R. E. Long-Term Experimental Evolution in Escherichia coli. VIII. Dynamics of a balanced polymorphism. The American Naturalist. 155 (1), 24-35 (2000).
- Quandt, E. M., Gollihar, J., Blount, Z. D., Ellington, A. D., Georgiou, G., Barrick, J. E. Fine-tuning citrate synthase flux potentiates and refines metabolic innovation in the Lenski evolution experiment. eLife. 4, e09696 (2015).
- Chubiz, L. M., Lee, M. -. C., Delaney, N. F., Marx, C. J. FREQ-Seq: a rapid, cost-effective, sequencing-based method to determine allele frequencies directly from mixed populations. PLoS One. 7 (10), e47959 (2012).
- Gallet, R., Cooper, T. F., Elena, S. F., Lenormand, T. Measuring selection coefficients below 10-3: method, questions, and prospects. Genetics. 190 (1), 175-186 (2012).
- Levy, S. F., et al. Quantitative evolutionary dynamics using high-resolution lineage tracking. Nature. 519 (7542), 181-186 (2015).
- Lang, G. I., Botstein, D., Desai, M. M. Genetic variation and the fate of beneficial mutations in asexual populations. Genetics. 188 (3), 647-661 (2011).
- Frenkel, E. M., et al. Crowded growth leads to the spontaneous evolution of semistable coexistence in laboratory yeast populations. Proceedings of the National Academy of Sciences. 112 (36), 11306-11311 (2015).
- Jordt, H., et al. Coevolution of host-plasmid pairs facilitates the emergence of novel multidrug resistance. Nature Ecology and Evolution. 4 (6), 863-869 (2020).
- Gresham, D., Dunham, M. J. The enduring utility of continuous culturing in experimental evolution. Genomics. 104 (6), 399-405 (2014).
- Miller, A. W., Befort, C., Kerr, E. O., Dunham, M. J. Design and use of multiplexed chemostat arrays). Journal of Visualized Experiments. (72), e50262 (2013).
- Toprak, E., et al. Building a morbidostat: an automated continuous-culture device for studying bacterial drug resistance under dynamically sustained drug inhibition. Nature Protocols. 8 (3), 555-567 (2013).
- Wong, B. G., Mancuso, C. P., Kiriakov, S., Bashor, C. J., Khalil, A. S. Precise, automated control of conditions for high-throughput growth of yeast and bacteria with eVOLVER. Nature Biotechnology. 36 (7), 614-623 (2018).
- Ekkers, D. M., Branco Dos Santos, F., Mallon, C. A., Bruggeman, F., Van Doorn, G. S. The omnistat: A flexible continuous-culture system for prolonged experimental evolution. Methods in Ecology and Evolution. 11 (8), 932-942 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon