Method Article
小鼠心肌缺血再灌注后冠状动脉血流储备的动态评估
摘要
本方案描述了一种改良的胸骨旁长轴视图,用于快速准确地定位左前降支。这种方法旨在更简单、更人性化,同时便于检查小鼠心肌缺血再灌注后冠状动脉血流储备的动态变化。
摘要
心肌缺血后,即使上游动脉的血流已成功完全恢复,也往往心肌灌注不足。这种现象被称为"无回流现象",归因于冠状动脉微血管功能障碍,并与不良的临床结果有关。在临床实践中,冠状动脉血流储备 (CFR) 的减少经常被用作冠状动脉疾病的指标。CFR 定义为由药理学或代谢因素诱导的峰值流速与静息流速之比。
该协议的重点是使用脉搏波多普勒测量评估缺血再灌注 (IR) 前后 CFR 的动态变化。在这项研究中,正常小鼠表现出在异氟烷刺激下将冠状动脉血流峰值速度提高到静息值两倍的能力。然而,在缺血再灌注后,与术前基线相比,1 小时的 CFR 显着降低。随着时间的推移,病死率逐渐恢复,但仍低于正常水平。尽管保留了收缩功能,但早期发现微血管功能障碍至关重要,建立实用指南可以帮助医生完成这项任务,同时也有助于研究心血管疾病随时间推移的进展。
引言
冠心病是全球主要死亡原因之一1.即使在心肌缺血后通过初次经皮冠状动脉介入治疗 (PCI) 重新打开致病冠状动脉,冠状动脉微血管灌注通常仍然减少。此外,不能保证供应心肌1 的下游毛细血管中会再灌注。这种现象被称为"无回流现象",与临床进展和预后不良有关。因此,在成功的再灌注治疗后实现足够的微血管回流对于心肌挽救至关重要。因此,血运重建后微血管功能的早期评估对于临床实践至关重要。
可以使用各种技术,例如侵入性冠状动脉内温度/压力导丝来评估微循环阻力 (IMR) 和充血性微血管阻力 (HMR)、非侵入性心血管磁共振 (CMR)、单光子发射计算机断层扫描 (SPECT) 和正电子发射断层扫描 (PET) 来评估微血管功能2.然而,这些方法要么是侵入性的,要么是半侵入性的,价格昂贵,而且往往不容易获得,限制了它们的临床实用性。另一方面,通过经胸多普勒超声心动图评估冠状动脉血流储备 (CFR) 提供了一种无创、相对简单且具有成本效益的方法,而不会像其他方法那样使患者暴露于电离辐射3。
尽管以前的研究已经采用经胸多普勒超声心动图来测量小鼠和大鼠的 CFR,但操作者在定位平台、小鼠和探头之间的复杂角度方面仍然存在挑战。该协议通过提供一种更简单的方法来定位左前降支 (LAD) 冠状动脉并使用改良的胸骨旁长轴 (PLAX) 视图快速测量 CFR,从而克服了这个问题。
此外,在致病灶远端的梗死相关动脉 (IRA) 中获得的 CFR 与心肌对比超声心动图 (MCE) 评估的灌注状态有很强的相关性4。它还被确定为急性心肌梗死 (AMI) 后活力和左心室 (LV) 功能恢复的预测标志物5。此外,病死率已被确定为全因死亡率和不良心血管结局的可靠标志物 6,7。以前的报告描述了使用超声心动图评估心肌梗死大鼠模型中的 CFR8。然而,缺血再灌注早期的 CFR 尚未得到深入研究。因此,本研究为诊断微血管功能障碍和通过动态试验评估缺血再灌注在再灌注早期IR小鼠中的治疗效果提供了参考价值。
研究方案
所有实验均经北京大学动物护理与使用专业委员会批准。本研究采用8-12周龄雄性C57小鼠。这些动物是从商业来源获得的(见 材料表)。
1. 动物准备
- 使用脱毛膏从心前区去除毛发(参见 材料表)。然后,按照步骤 2 继续采集超声图像。
2. 红外线手术前的超声成像
- 通过将小鼠放入异氟烷诱导室(参见 材料表)来麻醉小鼠,并以1.5-2.0L / min O2 流量以1.5%的浓度开始异氟烷递送。
- 将麻醉小鼠置于生理监测平台(超声系统的成像平台,见 材料表)上仰卧位。在生理监测台的铜片上涂上少量导电凝胶,并用低粘性胶带固定小鼠爪子,以获得心电图和呼吸的生理信息。使用内置的加热平台将体温保持在 37-38 °C。
注意: 将气麻醉机的控制开关从腔室切换到面罩,并在此期间保持麻醉剂量恒定在 1.5%。此时小鼠的心率应约为350-450次/分钟。 - 在成像之前,将眼科兽医软膏涂抹在眼睛上,以防止干燥。
- 使用40 MHz线性探头9 (例如,用于小鼠的MS550探头)进行经胸超声心动图(图1A)。
注意: 超声波机配备 MS550 探头。 - 大量涂抹超声透射凝胶(参见 材料表)以确保最佳图像质量。
- 调整探头和平台的位置以形成改良的胸骨旁长轴(PLAX)视图9 (图1A),以B模式检查左前降支(LAD)。简而言之,使用胸骨旁长轴视图对心脏进行成像,平台横向对齐,并在探头和平台之间形成小角度。
- 在 B 模式下找到合适的心脏部分,并在触摸屏上激活 彩色多普勒 (图 1B)。LAD(白色箭头)可以在左心室壁内识别(图1B)。实时红色表示血流方向(即血流朝向探头)。
注意:通过调整 x 轴,彩色多普勒允许在此图像窗口中可视化完整的 LAD(从主动脉窦到远端分支部位)。 - 轻轻移动探头以找到正确的位置,减少肺静脉血流的影响。
注意:为减少肺静脉血流的影响,请稍微调整探头并将 LAD 与肺静脉区分开来。LAD 在左心室壁中运行,而肺静脉则引流到左心房。使用彩色多普勒找到 LAD,并使用 B 模式选择合适的部分。 - 在彩色多普勒模式下可视化 LAD 后,按下 脉冲波 (PW) 按钮并切换到 PW 模式。将黄色指示线放在冠状动脉上,确保其与血流方向平行。然后按 保存剪辑 按钮记录基线数据。
- 将异氟烷浓度增加至3%,等待30秒。确保流速随时间逐渐增加。经常按下" 保存剪辑 "按钮以捕获最高血流速度。
注意:异氟醚刺激使心脏更加努力地工作,导致心脏和LAD可能的运动。在PW模式下捕获图像或电影存储图像后,单击 PW模式 以确保黄色指示线位于LAD上。如果发生移位,将黄色指示线稍微调整到血流点,然后继续记录。这个过程需要快速掌握和切换。 - 收集冠状动脉血流图像后,关闭麻醉剂并将探头调整到正常的 PLAX 视图。等待小鼠心率缓慢增加至约 500 bpm,然后通过将探头切换到胸骨旁短轴切片 (PSAX) 来测量小鼠心脏功能。
- 完成超声心动图成像后,将动物从平台上移开,并让它在家中笼子中恢复。取出凝胶,让动物干燥以防止体温过低。
- 使用 Peak Vel 和 LV 函数 工具分别从图像中获取舒张期峰值速度和心脏收缩功能。
- 计算 CFR 为最大流量时舒张峰值冠状动脉流速 (CFV) 与基线时舒张峰值 CFV 的比率。
3.心肌缺血再灌注程序
注意:初始测量是基线,然后对同一只动物进行手术。
- 用戊巴比妥钠(60mg / kg)麻醉小鼠,并给予镇痛药卡洛芬(5mg / kg,皮下注射)。在整个手术过程中使用预热的加热垫 (37 °C)。通过没有对脚趾捏合和眨眼反射的退出反射来确保适当的麻醉深度。将鼠标仰卧在加热垫上,将眼药膏涂抹在眼睛上,以防止眼睛干燥。进行气管插管进行机械通气:在去除颈部毛发前后,用 3 次交替的 betadine 或氯己定擦洗和 70% 酒精对该区域进行消毒。找到气管并轻轻插入导管。然后,将小鼠连接到呼吸机(吸气潮气量为250μL,120次呼吸/ 分钟)(参见 材料表)。
- 用 3 次交替的 betadine 或氯己定和 70% 酒精擦洗剂对心前区皮肤进行消毒。通过在第四个肋间隙进行左胸切开术10 来暴露心脏。
- 使用 5-0 丝线缝合线(参见 材料表)用滑结结结扎左前降支 (LAD),插入左心耳根部下方 1-2 mm。确保缝合方向平行于左心耳的下边缘。 通过 缺血性心肌的局部颜色变暗,目视确认所有小鼠的缺血。
- 闭塞 LAD 动脉 30 分钟11.30分钟后,松开结扎线,并通过观察先前变色的心肌区域变红1-2分钟来验证再灌注。
- 冠状动脉闭塞/再灌注后,分层闭合胸部,让小鼠恢复约半小时11。
4. 红外手术后的超声成像
- 按照第 2 节中概述的步骤,分别在再灌注后 1 小时、3 小时、5 小时、8 小时、24 小时和 48 小时再次测量 CFR。将这些测量值与缺血再灌注 (IR) 程序之前获得的 CFR 值进行比较。
5. 统计分析
- 使用适当的统计分析软件进行统计分析(参见 材料表)。
注意:对于配对样本之间的连续变量的比较,如果数据呈正态分布,则使用配对 t 检验 。对于非正态分布数据或当不满足正态性假设时,请使用弗里德曼方差分析。将 p < 0.05 视为具有统计学意义。
结果
本研究利用雄性 C57 小鼠 (BW ~18-20 g) 表征 CFR 的动态变化。采用修改后的 PLAX 图像来评估 LAD 的冠状动脉血流特性(图 1A、B)。CFR 计算为 3% 异氟烷诱导的最大血管舒张期间的最大流速与 1.5% 异氟烷浓度基线时的最大流速之比12,13。所有测量和计算均在连续三个心动周期内重复进行,并取平均值,代表性结果如图 2 所示。
在IR手术前,测量基线CFR,小鼠的正常CFR值接近2.14±0.43。然而,在IR手术后,与IR手术前相比,再灌注1小时时CFR显着降低(1.18±0.14比2.14±0.43)(图3A)。这种减少表明,即使在打开罪魁祸首血管后,微循环也没有立即恢复。随着再灌注时间的延长,CFR值始终保持在低水平,3 h时的值为1.21 ± 0.20,5 h时为1.39 ± 0.33,8 h时为1.44 ± 0.38,24 h时为1.34 ± 0.36,再灌注后48 h时为1.48 ± 0.47,表明灌注不足可能持续至少两天(图3A)。此外,1 h、3 h、5 h、8 h、24 h 和 48 h 的 CFR 值之间没有统计学意义。
还监测小鼠的心脏功能,观察到当小鼠的CFR显着降低时,左心室心脏功能没有显着变化(图3B)。
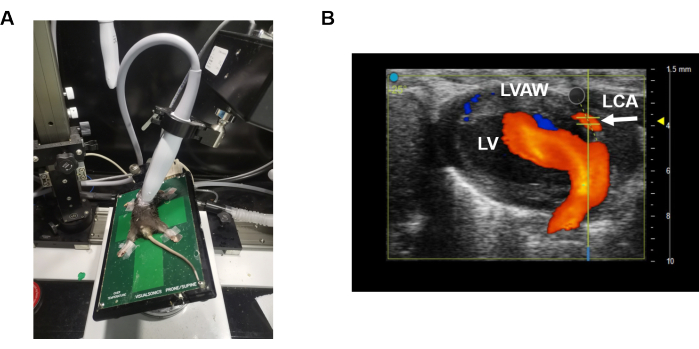
图 1:改良的胸骨旁长轴视图。 (A) 说明了在获取 LAD 冠状动脉速度时探头和平台的定位。(B) 显示了脉搏波速度传感器在 LAD 冠状动脉上的位置。蓝色表示远离超声探头的运动,而橙色表示朝向超声探头的运动。 请点击这里查看此图的较大版本.
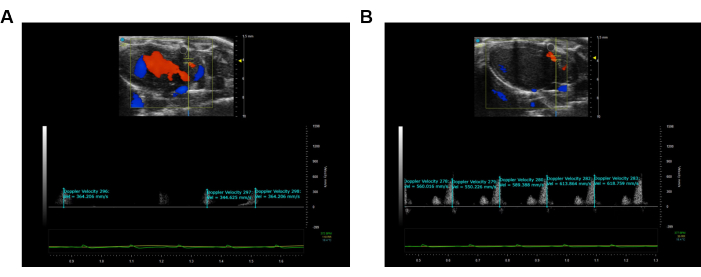
图 2:LAD 脉搏波速度成像的可视化和记录。 (A) LAD 冠状动脉静止状态下的脉搏波图像。(B) LAD 冠状动脉的最大充血冠状动脉脉搏波图像。蓝色表示远离超声探头的运动,而橙色表示朝向超声探头的运动。 请点击这里查看此图的较大版本.
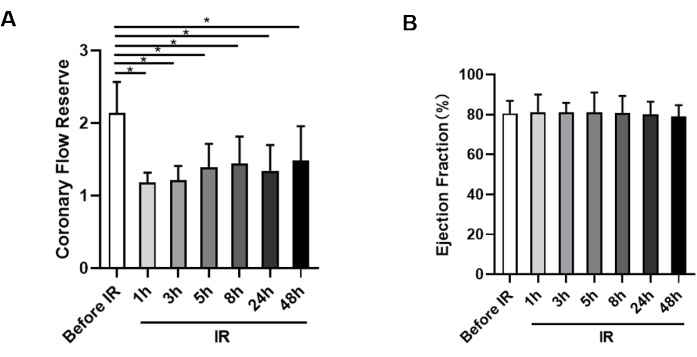
图 3:冠状动脉血流储备和射血分数的测量。 (A) 动物缺血前和再灌注后 1 h、3 h、5 h、8 h、24 h 和 48 小时的 CFR 统计分析 (n = 9)。(B) 评估每个时间点每组的射血分数 (n = 9)。*P < 0.05;数据以平均数表示± SD,使用配对 t 检验和 Friedman 方差分析进行分析。 请点击这里查看此图的较大版本.
讨论
本研究提出了一种方案,该方案使用改良的胸骨旁长轴视图来动态评估缺血再灌注后的 CFR。主要发现表明 IR 小鼠的 CFR 显着降低,在再灌注后 1 小时观察到最显着的降低。然而,心脏功能在48小时内没有受到影响。
CFR 可作为心肌血液供应的指标,为评估冠状动脉狭窄和冠状动脉微血管循环提供了一种无创方法。临床研究表明,较低的 CFR 值与较差的预后相关 14,15,16,并且 CFR 临界值 1.75 已被确定为风险分层的最佳值 14。最近的一项荟萃分析进一步表明,病死率每降低 0.1 个单位,死亡风险就会增加 16%,这表明病死率代表了一系列风险,较低的水平使患者容易获得较差的临床结果17。在这项研究中,CFR 显示出随着再灌注时间的延长而增加的趋势,但仍低于手术前,强调了不仅在通过 PCI 打开罪魁祸首血管后立即监测患者,而且在 48 小时监测患者的重要性。此外,CFR 可作为冠状动脉微血管功能障碍的衡量标准,整合了局灶性、弥漫性和小血管疾病对心肌组织灌注的血流动力学效应18。因此,CFR是诊断冠状动脉微血管疾病的重要无创技术。由于 LAD 的 CFR 是死亡率的强大且独立的指标 6,7,本研究旨在为临床决策提供参考值。此外,在医疗保健成本控制的环境中,使用超声波机器可能会减少对冠状动脉造影术的需求。通过适当的培训和升级技术,可以根据个体患者的需求定制风险分层。
修改后的 PLAX 视图为科研人员提供了更大的便利和时间节省。该技术的不断改进将促进其在其他冠状动脉微血管疾病中的广泛应用。该协议的关键步骤包括可视化冠状动脉和获得高质量的 PW 速度图像。随着麻醉剂浓度的增加,血流速度逐渐增加,因此建议连续捕获以避免错过最大血流速度。由于增加麻醉剂浓度会改变心率,因此建议在测量过程中短暂返回彩色多普勒模式,以确保测量前后的定位一致。
必须承认局限性,包括 CFR 超声测量固有的局限性。 由于冠状动脉的曲率,无法完全显示整个动脉,导致只能在一个节段进行测量。操作人员必须以测量冠状动脉的起点为目标,以尽可能准确地确定冠状动脉血流速度的最大点。此外,理想情况下,CFR 应根据冠状动脉血流量的变化来确定,但本研究使用血流速度而不是血流量,忽略了血管直径的影响。然而,先前的研究表明,CFR 和 CFVR(冠状动脉流速储备)之间存在很强的相关性19。对冠状动脉微血管功能的进一步研究可能有助于理解缺血的复杂改变,并增强我们对冠状动脉微血管功能障碍的理解。
披露声明
作者声明,他们没有已知的相互竞争的商业或财务关系,这些关系可能会影响本文所报告的工作。
致谢
国家自然科学基金(批准号:82270352)、北京市研究型病房建设临床研究项目(2022-YJXBF-04-03)、国家高水平医院临床研究基金(2022-NHLHCRF-YSPY-01)、首都健康改善与研究基金(No.2022-1-4062)、国家重点临床专业学科建设计划(批准号:2020-QTL-009)和中华医学会心科学分会基金(No.CSCF2021B02)。
材料
| Name | Company | Catalog Number | Comments |
| 5-0 silk suture | Ningbo MEDICAL Needle Co., Ltd. | 210322 | |
| C57 mice | Peking University Health Science Center Department of Laboratory Animal Science | ||
| Depilating agent | Nair | NAR-255-1 | |
| Electrode gel | Cofoe | ||
| High Frequency Ultrasound | FUJIFILM VisualSonics, Inc. | Vevo3100 | |
| Isoflurane | REWARD | R510-22-10 | |
| Linear array high frequency transducer | FUJIFILM VisualSonics, Inc. | MS550 | |
| Rodent Ventilator | Shanghai Alcott Biotech | ALC-V9 | |
| Small Animal Anesthesia Machine | REWARD | R530 | |
| SPSS | IBM Corp, Armonk, NY, USA | version 23.0 | statistical analysis software |
| Ultrasound Gel | Cofoe | ||
| Vevo Lab Software | FUJIFILM VisualSonics, Inc. | Verison 5.7.0 |
参考文献
- O'Farrell, F. M., Mastitskaya, S., Hammond-Haley, M., Freitas, F., Wah, W. R., Attwell, D. Capillary pericytes mediate coronary no-reflow after myocardial ischaemia. Elife. 6, e29280 (2017).
- Dimitrow, P. P. Transthoracic Doppler echocardiography-noninvasive diagnostic window for coronary flow reserve assessment. Cardiovascular ultrasound. 1, 4 (2003).
- Picano, E. Stress echocardiography: a historical perspective. The American Journal of Medicine. 114 (2), 126-130 (2003).
- Lim, D. S., Kim, Y. H., Lee, H. S. Coronary flow reserve is reflective of myocardial perfusion status in acute anterior myocardial infarction. Catheterization and Cardiovascular Interventions: Official Journal of The Society For Cardiac Angiography & Interventions. 51 (3), 281-286 (2000).
- Feldman, L. J., Himbert, D., Juliard, J. M. Reperfusion syndrome: relationship of coronary blood flow reserve to left ventricular function and infarct size. Journal of the American College of Cardiology. 35 (5), 1162-1169 (2000).
- Cortigiani, L., et al. Coronary flow reserve during dipyridamole stress echocardiography predicts mortality. JACC Cardiovascular imaging. 5 (11), 1079-1085 (2012).
- Han, B., Wei, M. Proximal coronary hemodynamic changes evaluated by intracardiac echocardiography during myocardial ischemia and reperfusion in a canine model. Echocardiography (Mount Kisco, NY). 25 (3), 312-320 (2008).
- Kelm, N. Q., Beare, J. E., LeBlanc, A. J. Evaluation of coronary flow reserve after myocardial ischemia reperfusion in rats. Journal of Visualized Experiments. 148, e59406 (2019).
- Batra, A., Warren, C. M., Ke, Y. Deletion of P21-activated kinase-1 induces age-dependent increased visceral adiposity and cardiac dysfunction in female mice. Molecular and Cellular Biochemistry. 476 (3), 1337-1349 (2021).
- Lv, B., Zhou, J., He, S. Induction of myocardial infarction and myocardial ischemia-reperfusion injury in mice. Journal of Visualized Experiments. 179, e63257 (2022).
- Huang, G., Lu, X., Duan, Z. PCSK9 knockdown can improve myocardial ischemia/reperfusion injury by inhibiting autophagy. Cardiovascular Toxicology. 22 (12), 951-961 (2022).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: a Doppler ultrasound study of the left coronary artery in mice. Ultrasound in Medicine & Biology. 42 (4), 999-1009 (2016).
- Chowdhury, S. A. K., Rosas, P. C. Echocardiographic characterization of left ventricular structure, function, and coronary flow in neonate mice. Journal of Visualized Experiments. 182, e63539 (2022).
- Sadauskiene, E., Zakarkaite, D., Ryliskyte, L. Non-invasive evaluation of myocardial reperfusion by transthoracic Doppler echocardiography and single-photon emission computed tomography in patients with anterior acute myocardial infarction . Cardiovascular Ultrasound. 9, 16 (2011).
- Bax, M., de Winter, R. J., Schotborgh, C. E. Short- and long-term recovery of left ventricular function predicted at the time of primary percutaneous coronary intervention in anterior myocardial infarction. Journal of the American College of Cardiology. 43 (4), 534-541 (2004).
- Lee, S., Otsuji, Y., Minagoe, S. Noninvasive evaluation of coronary reperfusion by transthoracic Doppler echocardiography in patients with anterior acute myocardial infarction before coronary intervention. Circulation. 108 (22), 2763-2768 (2003).
- Kelshiker, M. A., Seligman, H., Howard, J. P. Coronary flow reserve and cardiovascular outcomes: a systematic review and meta-analysis. European Heart Journal. 43 (16), 1582-1593 (2022).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Wikström, J., Grönros, J., Gan, L. M. Adenosine induces dilation of epicardial coronary arteries in mice: relationship between coronary flow velocity reserve and coronary flow reserve in vivo using transthoracic echocardiography. Ultrasound in Medicine & Biology. 34 (7), 1053-1062 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。