Method Article
생쥐의 심근 허혈 재관류 후 관상 동맥 흐름 예비력의 동적 평가
요약
본 프로토콜은 좌측 전방 하행 동맥의 신속하고 정확한 국소화를 위해 수정된 흉골 주위 장축 보기를 설명합니다. 이 접근법은 마우스에서 심근 허혈 재관류 후 관상 동맥 유동 예비력의 동적 변화를 검사하는 동시에 더 간단하고 사용자 친화적으로 설계되었습니다.
초록
심장 허혈 후에는 상류 동맥의 흐름이 성공적이고 완전히 복원되었음에도 불구하고 심근 관류가 충분하지 않은 경우가 많습니다. "no-reflow 현상"으로 알려진 이 현상은 관상동맥 미세혈관 기능 장애에 기인하며 좋지 않은 임상 결과와 관련이 있습니다. 임상에서 관상동맥 유동 예비력(CFR)의 감소는 관상동맥 질환의 지표로 자주 사용됩니다. CFR은 약리학적 또는 대사적 요인에 의해 유도된 최대 유속에 대한 휴지 유속의 비율로 정의됩니다.
이 프로토콜은 맥파 도플러 측정을 사용하여 허혈-재관류(IR) 전후의 CFR의 동적 변화를 평가하는 데 중점을 두었습니다. 이 연구에서 정상 마우스는 관상 동맥 혈류의 최대 속도를 이소플루란 자극 하에서 휴지 값보다 최대 2배 더 높게 증가시키는 능력을 보여주었습니다. 그러나 허혈-재관류 후 1시간에서의 CFR은 수술 전 기준선에 비해 유의하게 감소했습니다. 시간이 지남에 따라 CFR은 점진적인 회복세를 보였지만 여전히 정상 수준보다 낮았습니다. 수축기 기능의 보존에도 불구하고 미세혈관 기능 장애의 조기 발견이 중요하며, 실용적인 가이드를 수립하는 것은 의사가 이 작업을 수행하는 데 도움이 될 수 있을 뿐만 아니라 시간이 지남에 따라 심혈관 질환 진행에 대한 연구를 용이하게 할 수 있습니다.
서문
관상 동맥 심장 질환은 전 세계적으로 주요 사망 원인 중 하나입니다1. 심장 허혈 후 원발성 경피적 관상동맥 중재술(PCI)을 통해 원인인 관상동맥을 다시 열더라도 관상동맥 미세혈관 관류는 종종 감소된 상태로 남아 있습니다. 또한, 심근1에 공급하는 하류 모세혈관에서의 재관류는 보장되지 않는다. "no-reflow 현상"으로 알려진 이 현상은 임상 진행 및 나쁜 예후와 관련이 있습니다. 결과적으로, 성공적인 재관류 요법 후 적절한 미세혈관 리플로우를 달성하는 것이 심근 구제에 매우 중요합니다. 따라서 혈관재생술 후 미세혈관 기능의 조기 평가는 임상 실습에 매우 중요합니다.
미세혈관 기능을 평가하기 위해 미세순환저항(IMR) 및 충혈성 미세혈관저항성(HMR), 비침습적 심혈관 자기 공명(CMR), 단일광자 방출 컴퓨터 단층촬영(SPECT) 및 양전자 방출 단층촬영(PET)과 같은 다양한 기술을 사용할 수 있다. 그러나 이러한 방법은 침습적 또는 반침습적이며 비용이 많이 들고 쉽게 구할 수 없는 경우가 많아 임상적 유용성이 제한됩니다. 반면에, 경흉부 도플러 심초음파에 의한 관상동맥 혈류 예비력(CFR)을 평가하는 것은 다른 방법에서 볼 수 있듯이 환자를 전리 방사선에 노출시키지 않고 비침습적이고 비교적 간단하며 비용 효율적인 접근 방식을 제공한다3.
이전 연구에서는 경흉부 도플러 심초음파를 사용하여 생쥐와 랫드의 CFR을 측정했지만, 작업자가 플랫폼, 생쥐 및 프로브 사이의 복잡한 각도를 찾는 데 어려움이 남아 있습니다. 이 프로토콜은 좌측 전방 하행 동맥(LAD) 관상 동맥을 찾고 수정된 흉골 주위 장축(PLAX) 보기를 사용하여 CFR을 빠르게 측정할 수 있는 더 쉬운 방법을 제공함으로써 이 문제를 극복합니다.
또한, 원인 병변의 원위부에 있는 경색 관련 동맥(IRA)에서 얻은 CFR은 심근 조영제 심초음파(MCE)4로 평가한 관류 상태와 강한 상관관계를 보였습니다. 또한 급성 심근경색(AMI) 후 생존력 및 좌심실(LV) 기능 회복에 대한 예측 마커로 확인되었습니다5. 또한 CFR은 모든 원인으로 인한 사망률 및 심혈관 질환 부작용에 대한 신뢰할 수 있는 지표로 확립되었습니다 6,7. 이전 보고서에서는 심근경색의 랫트 모델에서 CFR을 평가하기 위해 심장초음파를 사용하는 방법을 설명했다8. 그럼에도 불구하고, 허혈 재관류의 초기 단계에서의 CFR은 철저하게 연구되지 않았습니다. 따라서 본 연구는 재관류 초기 단계에서 IR 마우스를 대상으로 동적 시험을 통해 미세혈관 역기능을 진단하고 허혈 재관류의 치료 효과를 평가하기 위한 참고 값을 제공한다.
프로토콜
모든 실험은 북경 대학의 동물 보호 및 사용 위원회의 승인을 받았습니다. 본 연구에는 8-12주 된 수컷 C57 마우스가 사용되었습니다. 동물은 상업적인 출처에서 얻었다( 재료 표 참조).
1. 동물 준비
- 제모 크림을 사용하여 흉부 부위의 털을 제거합니다( 재료 표 참조). 그런 다음 2단계에 따라 초음파 이미지 획득을 진행합니다.
2. IR 수술 전 초음파 영상 촬영
- 마우스를 이소플루란 유도 챔버( 재료 표 참조)에 넣어 마취하고 1.5-2.0 L/minO2 흐름으로 1.5% 농도로 이소플루란 전달을 시작합니다.
- 마취된 마우스를 생리학적 모니터링 플랫폼(초음파 시스템의 이미징 플랫폼, 재료 표 참조)에서 누운 자세로 놓습니다. 생리학적 모니터링 테이블의 구리 시트에 소량의 전도성 젤을 바르고 쥐 발을 저접착 테이프로 고정하여 ECG 및 호흡에 대한 생리학적 정보를 얻습니다. 내장된 보온 플랫폼을 사용하여 체온을 37-38°C로 유지하십시오.
알림: 가스 마취 기계의 제어 스위치를 챔버에서 마스크로 전환하고 이 시간 동안 마취량을 1.5%로 일정하게 유지하십시오. 이 시점에서 쥐의 심박수는 약 350-450회/분이어야 합니다. - 건조함을 방지하기 위해 촬영하기 전에 눈에 안과 수의사 연고를 바르십시오.
- 40MHz 선형 프로브(예: 마우스용 MS550 프로브)를 사용하여 경흉부 심초음파를 수행합니다(예: 마우스용 MS550 프로브)(그림 1A).
알림: 초음파 기계에는 MS550 프로브가 장착되어 있습니다. - 최적의 이미지 품질을 보장하기 위해 초음파 투과 젤( 재료 표 참조)을 충분히 바르십시오.
- 프로브와 플랫폼의 위치를 조정하여 수정된 PLAX(parasternal long-axis) 보기9 (그림 1A)를 형성하여 B 모드에서 왼쪽 전방 하행 동맥(LAD)을 검사합니다. 간단히 말해서, 플랫폼이 측면으로 정렬되고 프로브와 플랫폼 사이에 작은 각도로 배치된 상태에서 흉골 주위 장축 보기를 사용하여 심장을 이미지화합니다.
- B 모드에서 적절한 심장 부분을 찾아 터치스크린에서 컬러 도플러 를 활성화합니다(그림 1B). LAD(흰색 화살표)는 좌심실 벽 내에서 식별할 수 있습니다(그림 1B). 실시간 빨간색은 혈류의 방향을 나타냅니다(즉, 혈류가 프로브를 향하고 있음).
참고: x축을 조정함으로써 Color Doppler는 이 이미지 창 내에서 전체 LAD(대동맥 부비동에서 원위 분기 부위까지)를 시각화할 수 있습니다. - 프로브를 약간 움직여 올바른 위치를 찾고 폐정맥 혈류의 영향을 줄입니다.
알림: 폐정맥 혈류의 영향을 줄이려면 프로브를 약간 조정하고 LAD를 폐정맥과 구별하십시오. LAD는 좌심실 벽을 흐르고 폐 정맥은 좌심방으로 배출됩니다. 컬러 도플러를 사용하여 LAD를 찾고 B-Mode를 사용하여 적절한 섹션을 선택합니다. - 컬러 도플러 모드에서 LAD를 시각화한 후 Pulse Wave (PW) 버튼을 누르고 PW 모드로 전환합니다. 관상 동맥에 노란색 표시선을 배치하여 흐름 방향과 평행이 되도록 합니다. 그런 다음 클립 저장 버튼을 눌러 기준선 데이터를 기록합니다.
- 이소플루란 농도를 3%로 높이고 30초 동안 기다립니다. 시간이 지남에 따라 유속이 점차 증가하는지 확인하십시오. Save Clip 버튼을 자주 누르면 가장 높은 혈류 속도를 캡처할 수 있습니다.
알림: 이소플루란 자극은 심장이 더 열심히 일하게 하여 심장과 LAD의 움직임을 가능하게 합니다. PW 모드의 이미지가 캡처되거나 시네마가 저장되면 PW 모드를 클릭하여 노란색 표시선이 LAD에 있는지 확인합니다. 변위가 발생하면 노란색 표시선을 혈류 지점까지 약간 조정하고 녹음을 계속하십시오. 이 프로세스에는 빠른 숙달과 전환이 필요합니다. - 관상 동맥 혈류 이미지를 수집한 후 마취제를 끄고 프로브를 일반 PLAX 보기로 조정합니다. 마우스 심박수가 약 500bpm으로 천천히 증가할 때까지 기다린 다음 프로브를 PSAX(parasternal short-axis section)로 전환하여 마우스 심장 기능을 측정합니다.
- 심장 초음파 영상이 완료되면 플랫폼에서 동물을 제거하고 홈 케이지에서 회복할 수 있도록 합니다. 저체온증을 방지하기 위해 젤을 제거하고 동물을 말리십시오.
- Peak Vel 및 LV function 도구를 사용하여 이미지에서 각각 최대 이완기 속도와 심장 수축기 기능을 얻습니다.
- 기준선에서 최대 유량에서 이완기 최대 관상 동맥 유속(CFV)과 이완기 최대 유속(CFV)의 비율로 CFR을 계산합니다.
3. 심근 허혈 - 재관류 절차
참고: 초기 측정은 기준선이었고 그런 다음 동일한 동물에 대해 수술을 수행했습니다.
- 펜토바르비탈나트륨(60mg/kg)으로 마우스를 마취하고 진통제인 카프로펜(5mg/kg, 피하 주사)을 투여한다. 수술 과정 내내 예열된 가열 패드(37°C)를 사용하십시오. 발가락 꼬집기 및 깜박임 반사에 대한 철수 반사가 없어 적절한 마취 깊이를 보장합니다. 발열 패드에 마우스를 앙와놓고 눈이 건조해지는 것을 방지하기 위해 눈에 안과 연고를 바릅니다. 기계적 환기를 위한 기관내 삽관 수행: 목털을 제거하기 전과 후에 베타딘 또는 클로르헥시딘과 70% 알코올을 번갈아 3회 번갈아 문지르며 해당 부위를 소독합니다. 기관을 찾아 카테터를 부드럽게 삽입합니다. 그런 다음 마우스를 인공호흡기에 연결합니다(분당 120회 호흡에서 250μL의 흡기 일회 호흡량)( 재료 표 참조).
- 베타딘 또는 클로르헥시딘과 70% 알코올을 번갈아 가며 3회 문질러 흉부 부위의 피부를 소독합니다. 네 번째 늑간 공간에서 좌측 흉곽 절개술10 을 수행하여 심장을 노출시킵니다.
- 5-0 실크 봉합사( 재료 표 참조)를 사용하여 슬립매듭으로 좌측 전방 하행 동맥(LAD)을 결찰하고 좌심방 부속기의 뿌리 아래 1-2mm를 삽입합니다. 스티칭 방향이 왼쪽 심방 부속기의 아래쪽 가장자리와 평행한지 확인합니다. 허혈성 심근의 국소 색상 어둡게를 통해 모든 마우스의 허혈을 육안으로 확인합니다.
- 30분 동안 LAD 동맥을 폐색합니다11. 30분 후 합자를 풀고 이전에 변색된 심장 근육 부위가 1-2분 동안 붉어지는 것을 관찰하여 재관류를 확인합니다.
- 관상동맥 폐색/재관류 후 흉부를 여러 겹으로 닫고 마우스가 약 30분 동안 회복할 수 있도록 합니다11.
4. IR 수술 후 초음파 영상
- 섹션 1에 설명된 단계에 따라 재관류 후 5시간, 5시간, 8시간, 24시간, 48시간에 각각 CFR을 다시 측정합니다. 이 측정값을 허혈-재관류(IR) 절차 전에 얻은 CFR 값과 비교합니다.
5. 통계 분석
- 적절한 통계 분석 소프트웨어를 사용하여 통계 분석을 수행합니다( 재료 표 참조).
참고: 쌍을 이루는 표본 간의 계량형 변수를 비교하려면 데이터가 정규 분포를 따르는 경우 쌍체 t-검정 을 활용하십시오. 정규 분포를 따르지 않는 데이터의 경우 또는 정규성에 대한 가정이 충족되지 않는 경우 Friedman의 분산 분석을 사용하십시오. p < 0.05를 통계적으로 유의한 것으로 간주합니다.
결과
이 연구는 CFR의 동적 변화를 특성화하기 위해 수컷 C57 마우스(BW ~18-20g)를 활용했습니다. LAD의 관상동맥 흐름 특성을 평가하기 위해 수정된 PLAX 이미지가 사용되었습니다(그림 1A,B). CFR은 3% 이소플루란에 의해 유도된 최대 혈관 확장 중 최대 유속에 대한 최대 유속에 대한 1.5% 이소플루란 농도12,13의 기준선에서 최대 유속의 비율로 계산되었습니다. 모든 측정 및 계산은 3회 연속 심장 주기에 걸쳐 반복되고 평균화되었으며 대표적인 결과는 그림 2에 나와 있습니다.
IR 수술 전에 기준선 CFR을 측정한 결과, 마우스의 CFR 값은 2.14 ± 0.43에 가까운 정상 CFR이었습니다. 그러나 적외선 수술 후 CFR은 적외선 수술 전과 비교하여 재관류 1시간 시점에 유의하게 감소했습니다(1.18 ± 0.14 대 2.14 ± 0.43)(그림 3A). 이러한 감소는 범인 용기를 연 후에도 미세 순환이 즉시 복원되지 않았음을 나타냅니다. 재관류 시간이 길어짐에 따라 CFR 값은 3시간에 1.21 ± 0.20, 5시간에 1.39 ± 0.33, 8시간에 1.44 ± 0.38, 24시간에 1.34 ± 0.36, 재관류 후 48시간에 1.48 ± 0.47로 일관되게 낮은 수준으로 유지되었으며, 이는 저관류가 최소 2일 동안 지속될 수 있음을 시사합니다(그림 3A). 또한, 1시간, 3시간, 5시간, 8시간, 24시간, 48시간에서 CFR 값 사이에는 통계적 유의성이 없었다.
생쥐의 심장 기능도 모니터링한 결과, 생쥐의 CFR이 현저히 감소했을 때 좌심실 심장 기능에는 큰 변화가 없는 것으로 관찰되었습니다(그림 3B).
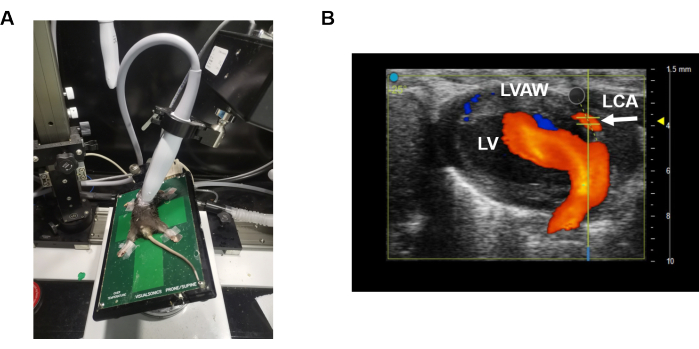
그림 1: 수정된 parasternal long-axis view. (A)는 LAD의 관상동맥 속도를 구하는 동안 프로브와 플랫폼의 위치를 보여줍니다. (B)는 LAD 관상동맥에 대한 맥파 속도 센서의 배치를 보여줍니다. 파란색은 초음파 프로브에서 멀어지는 움직임을 나타내고 주황색은 초음파 프로브를 향한 움직임을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
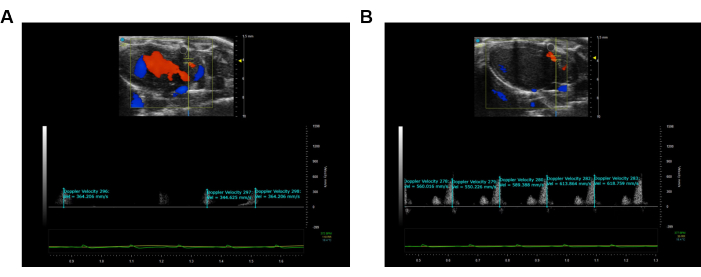
그림 2: LAD의 Pulse Wave Velocity 이미징의 시각화 및 기록. (A) LAD 관상동맥의 휴식 상태 동안의 맥파 이미지. (B) LAD 관상동맥의 최대 충혈 관상동맥 맥파 이미지. 파란색은 초음파 프로브에서 멀어지는 움직임을 나타내고 주황색은 초음파 프로브를 향한 움직임을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
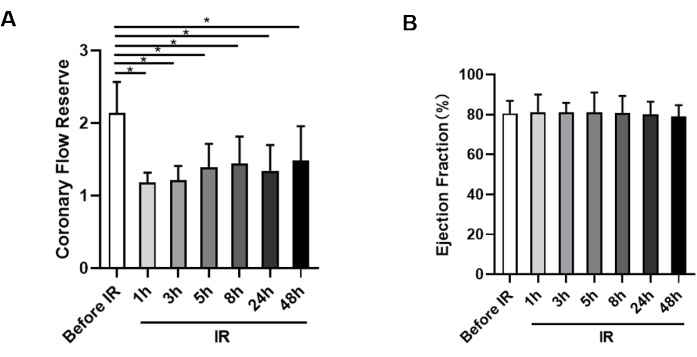
그림 3: 관상동맥 유동 예비율 및 박출률 측정. (A) 허혈 전과 재관류 후 1시간, 3시간, 5시간, 8시간, 24시간, 48시간 각각 동물에서 CFR의 통계적 분석(n=9). (B) 각 시점(n = 9)에서 각 그룹의 박출률 평가. *p < 0.05; 평균 ± SD로 제시된 데이터는 쌍체 t-검정 및 Friedman의 분산 분석으로 분석되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 연구는 허혈 재관류 후 CFR을 동적으로 평가하기 위해 수정된 흉골 주위 장축 보기를 사용하는 프로토콜을 제시합니다. 주요 발견은 IR 마우스에서 CFR이 크게 감소했음을 나타내며, 가장 뚜렷한 감소는 재관류 후 1시간에서 관찰되었습니다. 그러나 심장 기능은 48시간 이내에 영향을 받지 않았습니다.
CFR은 심근 혈액 공급의 지표 역할을 하며, 관상동맥 협착증과 관상동맥 미세혈관 순환을 모두 평가하기 위한 비침습적 접근법을 제공합니다. 임상연구에 따르면 CFR 값이 낮을수록 예후가 악화되는 것으로 나타났으며14,15,16 CFR 컷오프 값 1.75는 위험 계층화에 최적인 것으로 확인되었다 14. 최근의 메타 분석에 따르면 CFR이 0.1 단위 감소할 때마다 사망 위험이 16% 증가하는 것으로 나타났으며, 이는 CFR이 위험의 연속체를 나타내며 수치가 낮을수록 환자는 더 나쁜 임상 결과를 보이는 경향이 있음을 나타냅니다17. 이번 연구에서 CFR은 재관류 시간이 길어질수록 증가하는 경향을 보였으나 시술 전보다 낮은 수준을 유지했으며, PCI를 통해 범인 혈관을 연 직후뿐만 아니라 48시간에도 환자를 모니터링하는 것이 중요하다는 점을 강조했다. 또한, CFR은 관상동맥 미세혈관 기능 장애의 척도 역할을 하며, 심근 조직 관류에 대한 국소, 미만성 및 소혈관 질환의 혈역학적 효과를 통합합니다18. 따라서 CFR은 관상동맥 미세혈관 질환을 진단하기 위한 중요한 비침습적 기법입니다. LAD에 대한 CFR은 사망률에 대한 강력하고 독립적인 지표이기때문에 6,7, 이 연구는 임상적 결정을 위한 참조 값을 제공하는 것을 목표로 합니다. 또한, 초음파 기계의 사용은 의료 비용 억제 환경에서 관상 동맥 조영술의 필요성을 잠재적으로 줄일 수 있습니다. 기술을 적절하게 교육하고 업그레이드함으로써 위험 계층화를 개별 환자의 요구에 맞게 조정할 수 있습니다.
수정된 PLAX 보기는 과학 연구자에게 더 큰 편의성과 시간 절약을 제공합니다. 이 기술의 지속적인 개선은 다른 관상 동맥 미세혈관 질환에 대한 광범위한 적용을 용이하게 할 것입니다. 이 프로토콜의 주요 단계에는 관상 동맥을 시각화하고 고품질 PW 속도 이미지를 얻는 것이 포함됩니다. 마취 농도가 증가함에 따라 혈류 속도가 점차 증가하므로 최대 혈류 속도를 놓치지 않도록 연속 캡처하는 것이 좋습니다. 마취 농도를 높이면 심박수가 변경될 수 있으므로 측정 전후에 일관된 위치를 보장하기 위해 측정 중 잠시 컬러 도플러 모드로 돌아가는 것이 좋습니다.
CFR의 초음파 측정에 내재된 한계를 포함하여 제한 사항을 인정하는 것이 중요합니다. 관상 동맥의 만곡으로 인해 전체 동맥을 완전히 표시할 수 없어 한 부분에서만 측정할 수 있습니다. 작업자는 관상 동맥의 시작 부분을 측정하여 가능한 한 정확하게 최대 관상 동맥 혈류 속도 지점을 식별하는 것을 목표로 해야 합니다. 또한, CFR은 관상동맥 혈류량의 변화에 기초하여 결정하는 것이 이상적이지만, 본 연구는 혈관 직경의 영향을 간과하고 혈류량 대신 혈류량을 사용하였다. 그러나 이전 연구에서는 CFR과 CFVR(관상동맥 유속 예비력) 사이에 강한 상관관계가 있음을 입증했습니다19. 관상동맥 미세혈관 기능에 대한 추가 연구는 허혈의 복잡한 변화를 이해하는 데 도움이 될 수 있으며 관상동맥 미세혈관 기능 장애에 대한 이해를 향상시킬 수 있습니다.
공개
저자들은 이 논문에 보고된 작업에 영향을 미칠 수 있는 경쟁적인 상업적 또는 재정적 관계를 알지 못한다고 선언합니다.
감사의 말
이 연구는 중국국립자연과학재단(National Natural Science Foundation of China, 보조금 번호 82270352), 베이징 연구구 건설 임상연구프로젝트(Beijing Research Ward Construction Clinical Research Project, 2022-YJXBF-04-03), 국가고등병원임상연구기금(National High Level Hospital Clinical Research Funding, 2022-NHLHCRF-YSPY-01), Capital's Founds for Health Improvement and Research(제2022-1-4062호), 국가중점임상전문분야 구축 프로그램(National Key Clinical Specialty Discipline Construction Program, 보조금 번호: 2020-QTL-009), 중국심장학회 재단(Chinese Society of Cardiology's Foundation, No. CSCF2021B02).
자료
| Name | Company | Catalog Number | Comments |
| 5-0 silk suture | Ningbo MEDICAL Needle Co., Ltd. | 210322 | |
| C57 mice | Peking University Health Science Center Department of Laboratory Animal Science | ||
| Depilating agent | Nair | NAR-255-1 | |
| Electrode gel | Cofoe | ||
| High Frequency Ultrasound | FUJIFILM VisualSonics, Inc. | Vevo3100 | |
| Isoflurane | REWARD | R510-22-10 | |
| Linear array high frequency transducer | FUJIFILM VisualSonics, Inc. | MS550 | |
| Rodent Ventilator | Shanghai Alcott Biotech | ALC-V9 | |
| Small Animal Anesthesia Machine | REWARD | R530 | |
| SPSS | IBM Corp, Armonk, NY, USA | version 23.0 | statistical analysis software |
| Ultrasound Gel | Cofoe | ||
| Vevo Lab Software | FUJIFILM VisualSonics, Inc. | Verison 5.7.0 |
참고문헌
- O'Farrell, F. M., Mastitskaya, S., Hammond-Haley, M., Freitas, F., Wah, W. R., Attwell, D. Capillary pericytes mediate coronary no-reflow after myocardial ischaemia. Elife. 6, e29280 (2017).
- Dimitrow, P. P. Transthoracic Doppler echocardiography-noninvasive diagnostic window for coronary flow reserve assessment. Cardiovascular ultrasound. 1, 4 (2003).
- Picano, E. Stress echocardiography: a historical perspective. The American Journal of Medicine. 114 (2), 126-130 (2003).
- Lim, D. S., Kim, Y. H., Lee, H. S. Coronary flow reserve is reflective of myocardial perfusion status in acute anterior myocardial infarction. Catheterization and Cardiovascular Interventions: Official Journal of The Society For Cardiac Angiography & Interventions. 51 (3), 281-286 (2000).
- Feldman, L. J., Himbert, D., Juliard, J. M. Reperfusion syndrome: relationship of coronary blood flow reserve to left ventricular function and infarct size. Journal of the American College of Cardiology. 35 (5), 1162-1169 (2000).
- Cortigiani, L., et al. Coronary flow reserve during dipyridamole stress echocardiography predicts mortality. JACC Cardiovascular imaging. 5 (11), 1079-1085 (2012).
- Han, B., Wei, M. Proximal coronary hemodynamic changes evaluated by intracardiac echocardiography during myocardial ischemia and reperfusion in a canine model. Echocardiography (Mount Kisco, NY). 25 (3), 312-320 (2008).
- Kelm, N. Q., Beare, J. E., LeBlanc, A. J. Evaluation of coronary flow reserve after myocardial ischemia reperfusion in rats. Journal of Visualized Experiments. 148, e59406 (2019).
- Batra, A., Warren, C. M., Ke, Y. Deletion of P21-activated kinase-1 induces age-dependent increased visceral adiposity and cardiac dysfunction in female mice. Molecular and Cellular Biochemistry. 476 (3), 1337-1349 (2021).
- Lv, B., Zhou, J., He, S. Induction of myocardial infarction and myocardial ischemia-reperfusion injury in mice. Journal of Visualized Experiments. 179, e63257 (2022).
- Huang, G., Lu, X., Duan, Z. PCSK9 knockdown can improve myocardial ischemia/reperfusion injury by inhibiting autophagy. Cardiovascular Toxicology. 22 (12), 951-961 (2022).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: a Doppler ultrasound study of the left coronary artery in mice. Ultrasound in Medicine & Biology. 42 (4), 999-1009 (2016).
- Chowdhury, S. A. K., Rosas, P. C. Echocardiographic characterization of left ventricular structure, function, and coronary flow in neonate mice. Journal of Visualized Experiments. 182, e63539 (2022).
- Sadauskiene, E., Zakarkaite, D., Ryliskyte, L. Non-invasive evaluation of myocardial reperfusion by transthoracic Doppler echocardiography and single-photon emission computed tomography in patients with anterior acute myocardial infarction . Cardiovascular Ultrasound. 9, 16 (2011).
- Bax, M., de Winter, R. J., Schotborgh, C. E. Short- and long-term recovery of left ventricular function predicted at the time of primary percutaneous coronary intervention in anterior myocardial infarction. Journal of the American College of Cardiology. 43 (4), 534-541 (2004).
- Lee, S., Otsuji, Y., Minagoe, S. Noninvasive evaluation of coronary reperfusion by transthoracic Doppler echocardiography in patients with anterior acute myocardial infarction before coronary intervention. Circulation. 108 (22), 2763-2768 (2003).
- Kelshiker, M. A., Seligman, H., Howard, J. P. Coronary flow reserve and cardiovascular outcomes: a systematic review and meta-analysis. European Heart Journal. 43 (16), 1582-1593 (2022).
- Taqueti, V. R., Di Carli, M. F. Coronary microvascular disease pathogenic mechanisms and therapeutic options: JACC state-of-the-art review. Journal of the American College of Cardiology. 72 (21), 2625-2641 (2018).
- Wikström, J., Grönros, J., Gan, L. M. Adenosine induces dilation of epicardial coronary arteries in mice: relationship between coronary flow velocity reserve and coronary flow reserve in vivo using transthoracic echocardiography. Ultrasound in Medicine & Biology. 34 (7), 1053-1062 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유