需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
人工晶状体的自动压缩测试
摘要
我们提出了一种使用压缩测试表征人工晶状体有效弹性模量的自动化方法。
摘要
人工晶状体的生物力学特性对于其作为可变功率光学元件的功能至关重要。这些特性随着人类晶状体年龄的增长而发生巨大变化,导致近视力丧失,称为老花眼。然而,这些变化的机制仍然未知。晶状体压缩提供了一种相对简单的方法,用于定性地评估晶状体的生物力学刚度,并且当与适当的分析技术相结合时,可以帮助量化生物力学特性。迄今为止,已经进行了各种镜片压缩测试,包括手动和自动,但这些方法应用生物力学测试的关键方面不一致,例如预处理、加载速率和测量间隔时间。本文描述了一种全自动镜头压缩测试,其中电动载物台与相机同步,以在整个预编程的加载协议中捕获镜头的力、位移和形状。然后可以从这些数据中计算出特征弹性模量。虽然这里使用猪镜片进行演示,但该方法适用于任何物种的镜片压缩。
引言
晶状体是眼睛中发现的透明且灵活的器官,它可以通过改变屈光度来聚焦在不同的距离上。这种能力被称为适应。由于睫状肌的收缩和松弛,屈光力会改变。当睫状肌收缩时,晶状体增厚并向前移动,增加其屈光力1,2。屈光率的增加使镜头能够聚焦在附近的物体上。随着人类年龄的增长,晶状体会变得更硬,这种适应能力会逐渐丧失;这种情况被称为老花眼。变硬的机制仍然未知,至少部分原因是与晶状体的生物力学表征相关的困难。
已经采用了多种方法来估计晶状体刚度和生物力学性能。这些方法包括透镜旋转3,4,5,声学方法6,7,8,光学方法,如布里渊显微镜9,压痕10,11和压缩12,13。压缩是最容易获得的实验技术,因为它可以使用简单的仪器(例如,玻璃盖玻片14,15)或单个电动载物台进行。我们之前已经展示了如何从压缩测试中严格估计晶状体的生物力学特性16.这个过程在技术上具有挑战性,需要专门的软件,而对相对刚度测量感兴趣的镜头研究人员不容易使用。因此,在本研究中,我们专注于在考虑透镜尺寸的同时估计透镜弹性模量的可用方法。弹性模量是与其变形性相关的固有材料特性:高弹性模量对应于较硬的材料。
该测试本身是平行板压缩测试,因此可以在合适的商业机械测试系统上进行。在这里,构建了一个由电机、线性平台、运动控制器、称重传感器和放大器组成的定制仪器。这些都是使用定制软件控制的,该软件还定期记录时间、位置和负载。猪镜片不适应,但易于获得且价格低廉17.开发了以下方法来逐步压缩眼睛晶状体并量化其弹性模量。这种方法可以很容易地复制,并且在晶状体刚度的研究中很有用。
研究方案
猪的眼睛是从当地的屠宰场获得的。不需要伦理委员会的批准。
1.晶状体解剖(图1)
- 从猪眼中去除所有周围组织,从巩膜中去除多余的肉,直到只剩下视神经。使用弯曲的镊子和小解剖剪刀完成此过程。在解剖过程中使用神经作为锚来固定眼睛。
- 使用手术刀在角膜缘做一个短的圆周切口,然后在赤道处再做一个切口。
注意: 按此顺序执行此步骤以避免损坏镜头和胶囊。 - 将显微剪刀插入角膜缘处的切口,并用细钝头镊子提起角膜,同时绕角膜圆周切割,取出角膜。
- 使用钝头镊子抬起去除虹膜,然后用微型剪刀剪掉。
- 将解剖剪刀插入赤道切口,然后围绕整个赤道圆周切割,直到巩膜一分为二。
- 切口完成后,切除巩膜的后部。用镊子轻轻取出玻璃体,留下最少的残留物,以免损坏晶状体。如果需要,切开玻璃体,使后体远离晶状体和前节。
- 使用显微剪刀从前到后在巩膜上做一个经向切口。
- 从穿过巩膜的新经线切口开始,使用显微剪刀将小带从晶状体上切开。利用晶状体的重量或解剖盘的边缘,在将晶状体和巩膜稍微分开时轻轻拉伸小带,让显微剪刀在小晶状体和睫状体之间、穿过小带和圆锥体周围切割。如果操作正确,这将隔离镜头而不会损坏镜头胶囊。
- 如果需要,使用镊子取出胶囊,在赤道处刺穿胶囊,然后用两把镊子剥离胶囊。
- 将镜头放入磷酸盐缓冲盐水 (PBS) 中。在进行机械测试之前,目视检查镜头是否有任何损坏。
2. 带/不带透镜囊的镜头压缩(图 2)
注意:除步骤 2.1 和 2.4 外,此处的所有步骤均由计算机控制。
- 获得或构建具有 50 克力容量称重传感器的平行板压缩装置,能够测量 1 μm 量级的位移。
- 对电动载物台进行编程并加载单元以执行下面描述的加载方案(例如, 补充文件 1)。
- 用 PBS 几乎填充一个 1 5/8 英寸 x 1 5/8 英寸的方形盒子,并将其放在压缩平台上。
- 将上板降低到与下板接触的位置,以确定运动的下限和绝对间隙高度。
- 将上板抬高 ~15 毫米。
- 将镜头放在盒子的中心,注意赤道平面是水平的。
- 降低靠近镜头上表面但不与镜片上表面接触的上板。
- 使用接触阈值为 3 mN 的力反馈启动运动以移动上板与镜头接触。
- 在确定接触、记录时间、上板相对于下板的位置以及 500 Hz 的力后开始数据记录。
- 应用预处理负载,其中镜头以 1%/s 的速率压缩其初始高度的 2.5% 三次,然后压缩 5% 三次,然后压缩 7.5% 三次。
- 预处理后保持上板位置恒定1分钟。
- 以 1%/s 的速率施加 15% 的压缩,然后以相同的速率卸载。
- 继续卸载运动,直到上板从底板上移动了另外 2% 的卸载透镜厚度,以确保透镜与上板脱粘。
3. 透镜模量的估算
- 根据仪器在接触点的间隙估计镜头的厚度。或者,使用图像分析来测量测试前拍摄的照片的厚度。
- 使用赫兹模型计算弹性模量 E ,用于平行板之间球体的压缩(公式 [1]; 补充文件2)。
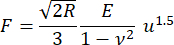 (一)
(一)
其中 R 是接触点的曲率半径(假设等于透镜厚度的一半); F 是称重传感器报告的压缩力;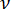 是泊松比(假设等于0.5,对应于不可压缩材料); u 是上级从接触点向下接近。请注意,弹性模量和泊松比是材料属性,分别表示透镜的固有刚度和透镜的相对压缩性。
是泊松比(假设等于0.5,对应于不可压缩材料); u 是上级从接触点向下接近。请注意,弹性模量和泊松比是材料属性,分别表示透镜的固有刚度和透镜的相对压缩性。
注意:这种方法忽略了晶状体胶囊的任何作用,但大致考虑了晶状体的尺寸,允许物种之间的比较。
结果
压缩六个猪晶状体,首先在胶囊完好无损的情况下,然后在小心地取出胶囊后。封装镜片的厚度值分别为 7.65 ± 0.43 mm,解封镜片的厚度值分别为 6.69 ± 0.29 mm(平均值±标准差)。典型的加载历史记录如 图 3 所示。赫兹模型很好地拟合了由此产生的力-位移曲线(即,它们的力与升至1.5次方的位移成正比; 图4)。封装和解封膜透镜都是如此。
讨论
镜片压缩是一种用于估计镜片刚度的通用方法。上述程序允许比较不同物种和不同尺寸的镜片。所有变形都根据透镜尺寸进行归一化,弹性模量的计算大致考虑透镜尺寸。有效模量远高于之前报道的猪透镜4、7、11、19 的模量,至少部分原因是使用了厚度而不是曲率半径:猪透镜的极曲半径明显大于厚...
披露声明
作者没有利益冲突需要声明。
致谢
由美国国立卫生研究院资助 R01 EY035278 (MR) 支持。
材料
| Name | Company | Catalog Number | Comments |
| Curved Medium Point General Purpose Forceps | Fisherbrand | 16-100-110 | |
| Galil COM Libraries | Galil Motion Control | ||
| High Precision Scalpel Handle | Fisherbrand | 12-000-164 | |
| Linear Stage | McMaster-Carr | 6734K4 0.125" | |
| Load Cell | FUTEK | LSB200-FSH03869 | |
| Load Cell Amplifier | FUTEK | IAA300-FSH03931 | |
| MATLAB | The Mathworks, Inc. | ||
| Microprobe | Surgical Design | 22-079-740 | |
| Miniature Self Opening Precision Scissors | Excelta | 63042-004 | |
| Motion Controller | Galil Motion Control | DMC-31012 | |
| Motor | Galil Motion Control | BLM-N23-50-1000-B | |
| Straight Hemastats | Fine Science | NC9247203 | stainless steel, 14cm |
参考文献
- Gullstrand, A. Helmholtz's treatise on physiological optics. translated edn. The Optical Society of America. , (1924).
- Helmholtz, H. Uber die akkommodation des auges. Arch Ophthalmol. 1, 1-74 (1855).
- Burd, H. J., Wilde, G. S., Judge, S. J. An improved spinning lens test to determine the stiffness of the human lens. Exp Eye Res. 92 (1), 28-39 (2011).
- Reilly, M. A., Martius, P., Kumar, S., Burd, H. J., Stachs, O. The mechanical response of the porcine lens to a spinning test. Z Med Phys. 26 (2), 127-135 (2016).
- Fisher, R. F. The elastic constants of the human lens. J Physiol. 212 (1), 147-180 (1971).
- Erpelding, T. N., Hollman, K. W., O'Donnell, M. Spatially mapping the elastic properties of the lens using bubble-based acoustic radiation force. IEEE Ultrasonics Symp. 1, 613-616 (2005).
- Erpelding, T. N., Hollman, K. W., O'Donnell, M. Mapping age-related elasticity changes in porcine lenses using bubble-based acoustic radiation force. Exp Eye Res. 84 (2), 332-341 (2007).
- Yoon, S., Aglyamov, S., Karpiouk, A., Emelianov, S. A high pulse repetition frequency ultrasound system for the ex vivo measurement of mechanical properties of crystalline lenses with laser-induced microbubbles interrogated by acoustic radiation force. Phys Med Biol. 57 (15), 4871-4884 (2012).
- Scarcelli, G., Kim, P., Yun, S. H. In vivo measurement of age-related stiffening in the crystalline lens by Brillouin optical microscopy. Biophys J. 101 (6), 1539-1545 (2011).
- Weeber, H. A., Gabriele, E., Wolfgang, P. Stiffness gradient in the crystalline lens. Graefes Arch Clin Exp Ophthalmol. 245 (9), 1357-1366 (2007).
- Reilly, M. A., Ravi, N. Microindentation of the young porcine ocular lens. J Biomech Eng. 131 (4), 044502 (2009).
- Gu, S., et al. Connexin 50 and AQP0 are essential in maintaining organization and integrity of lens fibers. Invest Ophthalmol Vis Sci. 60 (12), 4021-4032 (2019).
- Sharma, P. K., Busscher, H. J., Terwee, T., Koopmans, S. A., van Kooten, T. G. A comparative study on the viscoelastic properties of human and animal lenses. Exp Eye Res. 93 (5), 681-688 (2011).
- Cheng, C., Gokhin, D. S., Nowak, R. B., Fowler, V. M. Sequential application of glass coverslips to assess the compressive stiffness of the mouse lens: strain and morphometric analyses. J Vis Exp. (111), e53986 (2016).
- Baradia, H., Negin, N., Adrian, G. Mouse lens stiffness measurements. Exp Eye Res. 91 (2), 300-307 (2010).
- Reilly, M. A., Cleaver, A. Inverse elastographic method for analyzing the ocular lens compression test. J Innov Opt Health Sci. 10 (06), 1742009 (2017).
- Hahn, J., et al. Measurement of ex vivo porcine lens shape during simulated accommodation, before and after fs-laser treatment. Invest Ophthalmol Vis Sci. 56 (9), 5332-5343 (2015).
- Parreno, J., Cheng, C., Nowak, R. B., Fowler, V. M. The effects of mechanical strain on mouse eye lens capsule and cellular microstructure. Mol Biol Cell. 29 (16), 1963-1974 (2018).
- Yoon, S., Aglyamov, S., Karpiouk, A., Emelianov, S. The mechanical properties of ex vivo bovine and porcine crystalline lenses: age-related changes and location-dependent variations. Ultrasound Med Biol. 39 (6), 1120-1127 (2013).
- Reilly, M. A., Hamilton, P., Gavin, P., Nathan, R. Comparison of the behavior of natural and refilled porcine lenses in a robotic lens stretcher. Exp Eye Res. 88 (3), 483-494 (2009).
- Mekonnen, T., et al. The lens capsule significantly affects the viscoelastic properties of the lens as quantified by optical coherence elastography. Front Bioeng Biotechnol. 11, 1134086 (2023).
- Wilde, G. S., Burd, H. J., Judge, S. J. Shear modulus data for the human lens determined from a spinning lens test. Exp Eye Res. 97 (1), 36-48 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。