Method Article
使用斑马鱼振动惊吓反应筛查系统评估化学品的毒性
摘要
我们描述了筛选系统的工作流程和数据分析,用于基于斑马鱼胚胎振动惊吓反应评估化合物毒性。该系统记录斑马鱼胚胎在暴露于振动刺激时的运动,并允许对一般毒性/致死性和神经肌肉毒性进行综合评估。
摘要
我们开发了一个简单的筛选系统,用于评估斑马鱼胚胎的神经肌肉和一般毒性。模块化系统由电动换能器组成,可以在其上方放置带有胚胎的组织培养皿。可以组合多个这样的扬声器-组织培养皿对。由电动换能器产生的振动刺激在胚胎中诱导特征性惊吓和逃逸反应。皮带驱动的线性驱动器依次将摄像机放置在每个扬声器上方,以记录胚胎的运动。通过这种方式,可以可视化和量化由于化合物的致死性或神经肌肉毒性引起的惊吓反应的改变。我们介绍了使用该系统进行化合物筛选的工作流程示例,包括胚胎和治疗溶液的制备、记录系统的操作以及数据分析以计算测定中活性化合物的基准浓度值。基于市售简单组件的模块化组件使该系统既经济又灵活地适应特定实验室设置和筛选目的的需求。
引言
近年来,斑马鱼已成为评价化合物效应的广受欢迎的模式生物,涵盖从药物开发到环境毒理学的研究领域1。作为脊椎动物,斑马鱼的基因组成和整体生理机能在许多方面与人类相同2,3。因此,在该模型中获得的结果通常与人类健康直接相关。目前处于临床试验阶段的几种候选药物已在使用斑马鱼4 的化合物筛选中鉴定出来。
毒性评估是使用斑马鱼胚胎阶段进行测试的一个主要应用。经济合作与发展组织(OECD)在环境毒性测试中使用斑马鱼的各种测试指南5,6。斑马鱼胚胎体积小,发育迅速,非常适合中高通量规模的筛选方法1,3,4。此类筛查针对的毒理学终点包括胚胎畸形和致死率7、内分泌紊乱8、器官毒性9 和指示神经毒性的行为评估10,11。行为测定是可能的,因为斑马鱼胚胎根据其发育阶段对不同刺激表现出各种类型的运动反应。例如,受精后 1 天 (dpf) 胚胎表现出自发的尾巴盘绕12,并以典型的运动序列响应一系列光脉冲,即所谓的光电机响应 (PMR)10。孵化后,通常发生在受精后 48-72 小时左右 (hpf),自由游泳的刺五加胚胎 13 从 4 dpf14 左右开始逐渐对振动刺激产生惊吓和逃逸反应。这些反应的特征在于向与刺激方向相反的方向(所谓的C-弯曲或C-start)的独特弯曲,随后是较小的反向弯曲和游泳行为14,15,16,17。值得注意的是,胚胎行为由使用各种神经递质系统的神经回路控制,从而可以探测针对这些系统的化合物效应。例如,PMR 测定揭示了干扰胆碱能、肾上腺素能和多巴胺能信号传导的化合物的影响 10,而惊吓反应涉及胆碱能、谷氨酸能和甘氨酸能神经元16,18。此外,损害肌肉或神经-肌肉界面的化合物也会影响这些行为,对内耳/侧线毛细胞有毒的化合物也会影响这些行为19,20。因此,观察斑马鱼对刺激的反应运动行为是评估神经毒性的合适方法,也是评估耳毒性和肌毒性的合适方法。对运动行为进行评分也可以作为一般毒性/致死性评估的代理,因为死胚胎不会移动。因此,胚胎运动行为代表了一级毒性筛选方法的综合读数,该方法表明了一种设置中的致死性和神经肌肉化合物效应。鉴于刺五加胚胎已经能够代谢化合物,该方法还可以检测代谢转化产物7,21,22的影响。重要的是,根据一些动物保护立法,斑马鱼胚胎不被视为受保护的生命阶段,直到 120 hpf13 之后的自由喂养阶段。因此,它们被认为是动物毒性测试的替代品。

图 1:振动惊吓响应系统设置。 (A) 系统概述。将暴露于测试化合物的胚胎板放置在电动换能器阵列(“扬声器”)上。通过皮带驱动的线性驱动器将相机依次移动到目标换能器上方的记录位置。(B) 顶部插入组织培养皿的换能器/扬声器的详细视图。板由 4000-5000 勒克斯的 LED 灯片从下方照亮。在给予刺激时,扬声器旁边的 LED 灯会亮起。(C)相机在刺激胚胎时记录的视频的静止图像。(D) 配置文件的屏幕截图。(E) 录音软件界面截图。 请点击这里查看此图的较大版本.
在这里,我们描述了一种测试方案,用于评估复合对振动惊吓响应的影响,该测试使用基于电动换能器产生的振动刺激的内部构建简单测试装置,并结合组织培养皿23中几个自由移动的胚胎的自动视频记录。该系统是模块化的,允许并行从多个组织培养皿进行顺序记录。在目前使用的设置中,五个电动换能器向包含20个胚胎的组织培养皿提供振动刺激(500 Hz,持续时间1 ms)(图1)。这些板以 4000-5000 勒克斯的光亮度从下方用 LED 灯片照亮。每个换能器旁边的 LED 灯指示施加刺激的时间,示波器指示施加刺激的波形和频率(有关详细信息,请参见 参考文献 23)。胚胎的行为由高速摄像机(材料表)以每秒 1000 帧 (fps) 的速度记录,该摄像机通过皮带驱动的线性驱动器移动到目标扬声器上方。需要这种记录速度才能可靠地解决惊吓反应。该系统为当前的商业系统提供了一种低成本、可单独适应的替代方案。下面详述的精确工作流程目前在精确毒理学倡议24 的框架内执行,以确定从用一组选定毒物处理的斑马鱼胚胎中采集组学数据的合适暴露条件。
研究方案
所有斑马鱼的饲养和处理均符合德国动物保护标准,并得到德国卡尔斯鲁厄州巴登-符腾堡州政府的批准(Aktenzeichen 35-9185.64/BH KIT)。
1. 制备待测化学品的储备溶液
- 在玻璃小瓶(或化学等分试样)上标明化合物名称/缩写、原液浓度和制备日期。例如,CdCl2_2.5 g·L-1_210813。
- 在室温(RT)下以2000× g 离心化学等分试样1分钟。
- 在通风橱下,在对0.001g敏感的秤上称量化合物(如有必要),并将其转移到标记的小瓶中。如果化合物是液体,请使用移液管和塑料移液器吸头将其添加到小瓶中。
注:例如,对于 图2所示结果示例中使用的甲磺酸三卡因原液,将400mg称量到标记的小瓶中。 - 使用移液管和塑料移液器吸头加入溶剂(例如,无菌纯水或二甲基亚砜(DMSO),具体取决于化合物的物理化学性质)。如果可能,水是首选溶剂。
注:例如,对于三卡因原液,制备了 100 mL 水中的 15.3 mM 溶液。 - 密封小瓶,轻轻摇晃,检查是否有沉淀。
- 使用移液器和塑料移液器吸头在玻璃瓶中制备稀释的储备溶液(如有必要)。
注意:例如,三卡因原液不需要进一步稀释。 - 将储备溶液储存在-20°C直至使用。
- 将剩余的化学等分试样储存在与以前相同的条件下。
- 在实验室笔记本中记录库存等分试样信息。
2. 收集和饲养斑马鱼胚胎
- 在10cm组织培养皿中从群体交配的自然产卵中收集卵裂阶段(2-8细胞阶段)的胚胎。
- 选择一批质量合适的鸡蛋:未受精/死卵少于10%。
- 清洁餐具(去除未受精的卵、碎屑、鳞片等)。
- 将每 10 cm 组织培养皿 60 个胚胎放入 15 mL E3 培养基(5 mM NaCl、0.17 mM KCl、0.33 mM CaCl2、0.33 mM MgSO4)25 中。
- 将盘子放入湿润的腔室中,铺上浸有水的纸巾。
- 在28.5°C的培养箱中将胚胎培养至72hpf。
3. 准备待测化学品的工作稀释
- 从-20°C冰箱中取出储备溶液,使其解冻。
- 如果化合物溶解度足够高,则在玻璃瓶中的E3培养基中制备连续稀释液,每次重复1mL,浓度。确保浓度比所需的暴露浓度高 10 倍。这避免了在暴露开始时必须更换胚胎的整个培养基。在溶解度低的情况下,直接以所需的暴露浓度制备系列稀释液,每次重复10 mL。
- 检查降水(如有必要)。如果溶液已经沉淀,请记录下来,然后进一步稀释以达到下一个最高浓度。再次检查降水。重复直到没有降水。
- 检查暴露溶液的pH值。如果超出pH 7.0-8.5范围,则记录下来,并在含有5mM HEPES/pH 7.4的E3中制备溶液,用HCl或NaOH调节pH值。
- 根据当地法规处理未使用的暴露介质。
4. 将胚胎暴露在待测化学物质中
- 用 72 hpf 的胚胎检查培养皿中是否有死亡/未孵化的胚胎并将它们取出。如果一批胚胎含有超过 5% 的未孵化卵,请取出该批。
- 将每 6 cm 组织培养皿 10 个胚胎放入 9 mL E3 培养基(暴露板)中。
- 用化合物名称、暴露浓度和重复数标记曝光板。例如,“CdCl2 1 mg·L-1 01“。如果需要,包括足够的仅限 E3 的板和溶剂对照板(参见第 5 节)。
- 向每个板中加入 1 mL 暴露溶液,从最低浓度开始,然后旋转板。对于溶解度低的化合物,用暴露溶液替换整个 10 mL 板(参见步骤 3.2。
- 记录将复合溶液添加到胚胎中的时间顺序。
- 将板在28.5°C的培养箱中的加湿室中孵育48小时,直至达到120hpf。
5. 进行振动惊吓测定
注意:按照步骤4.5中记录的相同顺序分析板。每次运行都应包括一个 E3 控制板。
- 打开电脑和振动装置(蓝色LED灯应亮)。
- 在电子表格中准备配置文件,如 图 1D 所示,并作为 补充文件 1 附上。记录 5 个板位置(复合、浓缩、重复)中每个位置的暴露信息。
- 打开常规用户界面 (GUI) 程序(位于 https://git.scc.kit.edu/xk4962/vibration-startle-assay-kit ,项目 ID 43215。
- 通过在 GUI 程序中选择不同的位置并观察相机移动来检查相机运动。
- 从培养箱中取出要测量的样品板。将样品板放在5个位置(见 图1A,“扬声器”),让胚胎沉降几分钟。
- 点击 记录;将打开一个窗口以选择配置文件。
- 选择在步骤 5.2 中为此运行准备的相应配置文件。
- 检查样品描述是否与每个位置 (1-5) 上的样品相对应。
- 测量将自动进行(10 秒/位置)。当程序施加声脉冲时,LED 亮起。记录 10 秒/位置可以获取足够的数据来估计施加刺激前后的游泳速度和行进距离,并防止习惯随后的刺激。
- 录制完成后,相机返回位置 1,软件开始压缩文件。在此期间,用需要测量的下一组样品替换样品。
- 转到步骤 5.2。以记录下一次运行。
- 测量完所有板后,收集曝光溶液。使用筛子保留胚胎。
- 在冰/异丙醇(5%)浴中快速冷却胚胎。
- 根据当地法规处理暴露溶液和死胚胎。
6. 数据分析
- 使用 VirtualDub (1.10.4) 打开视频数据。
- 直观地对响应声脉冲的胚胎数量进行评分(当控制 LED 亮起时)。
- 在电子表格中输入数据。根据 补充文件2中提供的模板记录化合物名称,重复,化合物的浓度和不动胚胎的百分比,其中包括 图2C所示的示例数据集。
注意:该模板具有灵活的结构,主要允许应用其他生物体和终点的数据。它描述了每个浓度的响应,还提供了终点描述以及后续浓度响应建模中生成的参数的定义。 - 使用 KNIME 工作流程(KNIME 分析 4.626)和嵌入式 R 脚本(R 版本 3.6、R-packages plotrix、drc 和 bmd 27,28)进行基准浓度 (BMC) 分析。
注:原则上,评估也可以直接在R中进行。但是,为了方便起见,并允许将评估作为基于Web的服务,分析已在符合KNIME服务器的工作流程中组织。KNIME 工作流程的输出在 补充文件 3 中提供。有关KNIME工作流生成的统计参数的详细信息,请参阅此模板。 表 1 显示了估计拟合优度的统计参数和接受确定的 BMC 值的阈值。KNIME 工作流程本身可通过 GitHub (https://github.com/precisiontox/range-finding-drc) 获得。浓度响应使用 4 参数对数逻辑模型进行建模。其中两个曲线拟合参数可以固定。通常,在百分比数据的情况下,会将最大值固定为 100。如果没有观察到背景效应,最小值可以固定为 0%。
结果
图2A 显示了48个未经处理的野生型胚胎(AB2O2菌株)中不动胚胎的百分比。平均而言,14.33%的未经处理的野生型胚胎对振动刺激没有反应。在4个离合器中,不动幼虫的百分比达到50%,但75%的离合器的不动幼虫百分比低于20%。
图 2B,C 显示了使用振动惊吓测定工作流程对运动的复合影响的基准浓度/剂量 (BMC/BMD29,30) 的典型计算示例,目前在 PrecisionTox 联盟24 中执行。BMC10、BMC25 和 BMC50 值对应于 10%、25% 和 50% 的胚胎分别表现出高于背景的不动水平的浓度。该计算仅包括完全不动的胚胎,不包括那些仍然表现出部分反应的胚胎,例如只有C形弯曲而没有随后的逃逸游泳或仅尾部运动(图2B)。胚胎暴露于8浓度的钠通道抑制剂甲烷磺酸三卡因,其常用于鱼类麻醉31。数据表明,响应振动刺激的背景水平约为 25% 的不动性。从 1% 三卡因开始,运动性降低,然后在 2.5% 以上停止。KNIME 工作流程计算 BMC50 为 164.9 μM,相当于 1.07% 的三卡因和 75% 的不动性水平(图 2C)。小的 95% 置信区间(由曲线中的灰色阴影表示)表明该测定中运动值具有稳健的重现性。
图 2D 显示了次优检测运行示例,其数据不应用于 BMC 计算。显示了五个 E3 处理的对照组,它们具有来自同一离合器的不同胚胎(AB2O2 [野生型菌株] 重复 1-5)。只有第一组表现出接近正常的反应,显示出大约 25% 的不动性,这与文献值32 和此处描述的测定中获得的一致,如图 2A 所示,而所有其他组都表现出减少和/或不完整的行为反应(例如,仅显示 C 形弯曲而没有游泳活动,或运动开始时没有明显的 C 形弯曲)。当胚胎发育不正常并且由于发育迟缓而处于不成熟状态时,可能会发生这种反应,这会影响惊吓反应的稳健性14,33。
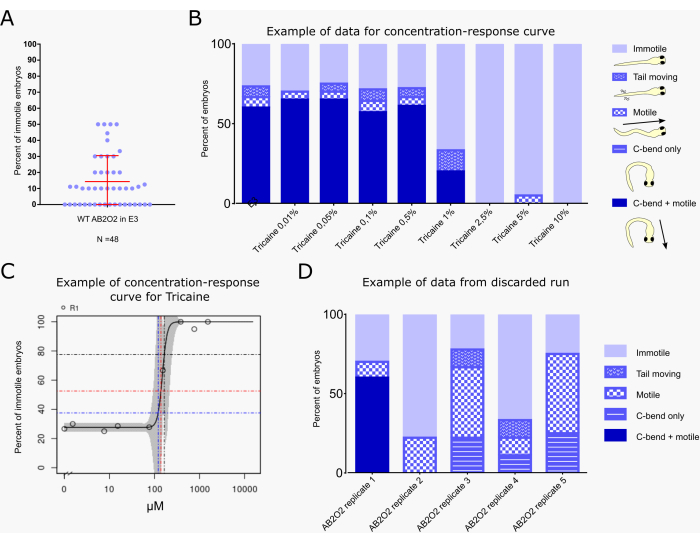
图 2:典型结果示例,包括基准剂量计算。 (A) 48 个离合器(n = 10 个离合器)野生型未处理幼虫的声音脉冲后无反应胚胎的百分比。平均值 (14.33%) 和标准差 (±16.19%) 以红色表示。(B) 评估用 E3 培养基中指定浓度的三卡因处理或单独使用 E3 作为对照处理的胚胎的惊吓反应行为(每种情况 n=20)。行为根据图表右侧指示的配色方案和卡通进行分类,每个胚胎仅分配到以下类别之一:“不动”:胚胎不显示任何运动;“尾巴移动”:胚胎表现出尾巴运动,但既没有C弯曲也没有游泳行为;“运动”:胚胎表现出游泳运动,但对振动刺激没有C型弯曲;“仅 C 型弯曲”:胚胎显示 C 型弯曲,但不能逃脱游泳;“C-弯曲+运动”:胚胎表现出典型的C-弯曲行为,然后逃跑游泳(典型的完全惊吓反应)。不同的行为显示为每次治疗的胚胎总数的百分比。(C) KNIME 工作流程生成的 BMC 计算图,指示每个治疗浓度的“不动”胚胎的百分比。蓝线、红线和黑线表示 BMC10、BMC25 和 BMC50 值,即 10%、25% 和 50% 的胚胎分别表现出高于背景的不动水平的浓度。(D) 废弃检测运行示例。图中显示了五个E3处理的对照运行,其中包含来自同一离合器的不同AB 2 O 2野生型胚胎(重复1-5)。只有重复 1 显示出几乎正常的反应,而其余运行的胚胎没有表现出典型的 C 弯曲 + 逃逸游泳反应。 请点击这里查看此图的较大版本.
表 1:用于估计拟合优度的统计参数和接受已确定的 BMC 值的阈值。请按此下载此表格。
表2:一系列振动惊吓反应测定系统的特性。请按此下载此表格。
补充文件1:配置文件的Excel模板。 请按此下载此文件。
补充文件 2:带有示例数据集的 KNIME 输入模板。请点击此处下载此文件。
补充文件 3:KNIME 输出文件示例。请点击此处下载此文件。
讨论
我们介绍了使用定制的斑马鱼胚胎振动惊吓测定设置进行化合物评估的工作流程和数据分析。该工作流程可生成可靠的数据,从而可以计算指定化合物毒性的典型参数,例如基准浓度/剂量 (BMC/BMD)。该装置的模块化设计可以适应不同的吞吐量和空间需求。由于该系统由低成本的基础组件制成,经过相对简单的设置,它为现有的商业系统提供了一种廉价的替代方案,这些系统通常同时设计用于多种检测类型,依赖于专有软件,并且仍然相对昂贵。
这些商业系统和其他定制系统都允许评估多孔板(例如,12 孔34、16 孔32、35、24 孔20、33、36、48 孔 37、96 孔38、39、40、41、42 甚至 384 孔 [作为 4x96 孔]43),但井中的空间限制使得对逃逸响应的某些数据参数(例如,行进距离)的分析更具挑战性。此外,在其中一些设置中,成像仅限于板孔的子集,从而降低了通量36,39。在培养皿中对胚胎进行成像可以更好地评估逃逸反应参数,并能够同时记录多个胚胎的行为(例如,在6厘米的培养皿中多达30个胚胎)。通常,基于培养皿的成像仅限于每次运行一个培养皿 44,45,46,47,48(例外情况是在 6 个培养皿上并行成像,每个培养皿 49 有一个幼虫,或在 2 个分割培养皿50 中对 4 个幼虫进行成像),这个缺点可以通过并行设计来解决,例如在我们的例子中。我们在表2中总结了本研究中使用的系统的一些特征以及其他商业和定制解决方案:20,32,33,34,35,36,37,38,39,40,41,42,43, 44,45,46,47,48,49,50,
51,52.
该方法的一个优点是可以同时捕获致死率和行为变化的读数,这可以提高毒性评估的性能。例如,虽然斑马鱼胚胎急性毒性试验(FET)5 已被证明可以很好地预测成年鱼急性毒性试验53 中的毒性,但通过包括行为读数54,其预测准确性得到了提高。其原因是鱼胚胎中观察到的神经活性化合物引起的死亡率较低,可能是由于缺乏呼吸衰竭综合征导致幼鱼或成年鱼的毒性增强。然而,神经活动可以通过行为评估来识别。此外,行为读数还可以捕获肌毒性和耳毒性作用以及其他对生理学的更微妙的毒性作用,这些作用是亚致命的,但会影响生物体的行为表现。
在进行测定时,确保正确处理化合物以及使用同质发育的斑马鱼胚胎批次至关重要。因此,使用玻璃瓶进行化合物储存应最大限度地减少由于对塑料材料的吸光度而导致的化学品,特别是疏水性化合物浓度的下降。对于对“塑料”聚苯乙烯具有高吸收潜力的化合物,也可以使用玻璃板进行孵育。在用于收集和去除死胚胎的组织培养皿中清洁卵子是确保标准发育的关键步骤。正常的发育速度很重要,因为发育迟缓可能会影响评估行为所依据的神经网络的成熟度14,33。此外,为了能够比较复合效应,鸡蛋应该来自同一菌株,因为据报道不同的菌株呈现不同的行为特征38,55,56,57。在暴露期间,重要的是在加湿室中孵育胚胎,以避免E3培养基过度蒸发,从而改变测试的浓度。
E3对照应纳入每次运行,以确定测试系列中使用的特定批次胚胎的基线反应水平。通常,我们沿着每组 5 个测量值运行一个对照板。如图 2D 所示,这种方法还允许检测由于发育延迟或其他原因(例如遗传背景效应)而导致响应次优的批次。如果意外地对刺激缺乏反应,还要注意潜在的换能器故障。通常,惊吓反应表现出 S 形浓度响应行为,允许使用对数逻辑模型进行曲线拟合。然而,在极少数情况下,可能必须采用其他模型,例如高斯模型或Cedergreen模型。它们在 R 包 drc 和 bdm27,28 中可用。
对振动刺激缺乏反应可能仅表明胚胎死亡或由于一般细胞毒性而严重受损的生命功能,但也可能反映出针对刺激感知、整合和运动输出的神经回路的更特异性的毒性。其他可能的复合效应是对神经肌肉界面或肌肉结构和功能的干扰。为了区分这些可能性,需要进一步的检测。例如,肌肉的结构完整性可以用双折射测定58,59来评估,转基因系可用于评估肌肉和神经功能60,61的扰动。然而,录制的视频数据已经允许对胚胎的形态和行为反应进行更详细的分析,从而可以提供第一个额外的信息。是只有 C 弯受损,还是所有运动受损?是否仍然存在神经肌肉活动的残余物,如尾巴运动微弱或颤抖所表明的那样?这种行为的改变是否伴随着形态的变化,例如水肿或身体弯曲增加?此外,还可以评估 C 弯前的潜伏时间或逃逸响应期间的行进距离等参数(例如,参见参考文献 44)。
此处描述的筛选方案允许快速和稳健的化合物毒性评估,并具有特异性检测非致命性神经毒性、耳毒性和肌毒性化合物的附加值。提供的分析工作流程易于实施,并提供可靠的读数。振动惊吓测定中使用的刺激协议的修改也已用于解决对惊吓行为更复杂方面的复合效应,例如前脉冲抑制 (PPI)39,44 和习惯化32,33,并且可以适应本研究中使用的基于电动力换能器的刺激设置。
基于惊吓反应的筛选系统的主要应用是评估化学筛选中的化合物效应,这与人类毒性评估和药物开发都相关 1,4,62。同时,通过测试水生生物的早期生命阶段,获得的结果与生态毒理学风险评估直接相关63,64。此外,惊吓反应系统可用于遗传筛选65、66、67、68、69中的行为表型。我们易于实施和适应性强的系统为打算在这些不同应用领域开展自己的特定筛选项目的小型实验室提供了经济实惠的设置。
披露声明
我们没有什么可披露的。
致谢
我们感谢IBCS-BIP鱼类设施和筛选中心的支持人员的出色技术援助。这项工作已获得欧盟地平线 2020 研究和创新计划的资助,根据第 965406 号赠款协议 (PrecisionTox)。这一结果仅反映了作者的观点,欧洲联盟不对其中所载信息的任何使用负责。
材料
| Name | Company | Catalog Number | Comments |
| Fine test sieves, Brass frame, pore size 250 μm | Sigma-Aldrich | Z289744-1EA | Or comparable material |
| High-speed camera | XIMEA | MQ013MG-ON USB 3 | |
| Laboratory Bottles, Narrow Neck, with Screw Cap | VWR | 215-3261 | Reference number for 50 mL, available up to 20 L. Or comparable material |
| Pipette tip, working volume: 10 µL | SARSTEDT | 70.3010.210 | Or comparable material |
| Pipette tip, working volume: 1000 µL | SARSTEDT | 70.3050.100 | Or comparable material |
| Pipette tip, working volume: 20 µL | SARSTEDT | 70.3020.210 | Or comparable material |
| Pipette tip, working volume: 200 µL | SARSTEDT | 70.3030.100 | Or comparable material |
| Serological pipette 10 mL | SARSTEDT | 86.1254.001 | Or comparable material |
| Serological pipette 25 mL | SARSTEDT | 86.1685.001 | Or comparable material |
| Serological pipette 5 mL | SARSTEDT | 86.1253.001 | Or comparable material |
| Tissue culture dish 60,0 mm/15,0 mm vented (Polystyrene) | Greiner bio-one | 628102 | Or comparable material |
| Tissue culture dish 100, suspension (Polystyrene) | SARSTEDT | 83.3902.500 | Or comparable material |
| Transfer pipette 6 mL | SARSTEDT | 86.1175 | Or comparable material |
| Tube 15 mL 120 mm x 17 mm PP | SARSTEDT | 62.554.502 | Or comparable material |
| Tube 50 mL 114mm x 28 mm PP | SARSTEDT | 62.5472.54 | Or comparable material |
参考文献
- MacRae, C. A., Peterson, R. T. Zebrafish as a mainstream model for in vivo systems pharmacology and toxicology. Annu Rev Pharmacol Toxicol. 63, 43-64 (2023).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Choi, T. Y., Choi, T. I., Lee, Y. R., Choe, S. K., Kim, C. H. Zebrafish as an animal model for biomedical research. Exp Mol Med. 53 (3), 310-317 (2021).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: from preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- OECD. Test No. 236: Fish embryo acute toxicity (FET) Test. OECD Guidelines for the Testing of Chemicals, Section 2. , OECD Publishing, Paris. (2013).
- OECD. Test No. 250: EASZY assay - Detection of endocrine active substances, acting through estrogen receptors, using transgenic tg(cyp19a1b:GFP) zebrafish embryos. OECD Guidelines for the Testing of Chemicals, Section 2. , OECD Publishing, Paris. (2021).
- Braunbeck, T., et al. The fish embryo test (FET): origin, applications, and future. Environ Sci Pollut Res Int. 22 (21), 16247-16261 (2015).
- Weger, B. D., Weger, M., Nusser, M., Brenner-Weiss, G., Dickmeis, T. A Chemical screening system for glucocorticoid stress hormone signaling in an intact vertebrate. ACS Chem Biol. 7 (7), 1178-1183 (2012).
- Pandey, G., Westhoff, J. H., Schaefer, F., Gehrig, J. A Smart imaging workflow for organ-specific screening in a cystic kidney zebrafish disease model. International Journal of Molecular Sciences. 20 (6), 1290(2019).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nat Chem Biol. 6 (3), 231-237 (2010).
- Zhang, K., Liang, J., Brun, N. R., Zhao, Y., Werdich, A. A. Rapid zebrafish behavioral profiling assay accelerates the identification of environmental neurodevelopmental toxicants. Environ Sci Technol. 55 (3), 1919-1929 (2021).
- Ogungbemi, A. O., Teixido, E., Massei, R., Scholz, S., Kuster, E. Optimization of the spontaneous tail coiling test for fast assessment of neurotoxic effects in the zebrafish embryo using an automated workflow in KNIME(R). Neurotoxicol Teratol. 81, 106918(2020).
- Strahle, U., et al. Zebrafish embryos as an alternative to animal experiments--a commentary on the definition of the onset of protected life stages in animal welfare regulations. Reprod Toxicol. 33 (2), 128-132 (2012).
- Kimmel, C. B., Patterson, J., Kimmel, R. O. The development and behavioral characteristics of the startle response in the zebra fish. Dev Psychobiol. 7 (1), 47-60 (1974).
- Eaton, R. C., Bombardieri, R. A., Meyer, D. L. The mauthner-initiated startle response in teleost fish. Journal of Experimental Biology. 66 (1), 65-81 (1977).
- Berg, E. M., Bjornfors, E. R., Pallucchi, I., Picton, L. D., El Manira, A. Principles governing locomotion in vertebrates: Lessons from zebrafish. Front Neural Circuits. 12, 73(2018).
- Lopez-Schier, H. Neuroplasticity in the acoustic startle reflex in larval zebrafish. Curr Opin Neurobiol. 54, 134-139 (2019).
- Hale, M. E., Katz, H. R., Peek, M. Y., Fremont, R. T. Neural circuits that drive startle behavior, with a focus on the Mauthner cells and spiral fiber neurons of fishes. J Neurogenet. 30 (2), 89-100 (2016).
- Behra, M., Etard, C., Cousin, X., Strahle, U. The use of zebrafish mutants to identify secondary target effects of acetylcholine esterase inhibitors. Toxicol Sci. 77 (2), 325-333 (2004).
- Buck, L. M., Winter, M. J., Redfern, W. S., Whitfield, T. T. Ototoxin-induced cellular damage in neuromasts disrupts lateral line function in larval zebrafish. Hear Res. 284 (1-2), 67-81 (2012).
- van Wijk, R. C., Krekels, E. H. J., Hankemeier, T., Spaink, H. P., vander Graaf, P. H. Systems pharmacology of hepatic metabolism in zebrafish larvae. Drug Discovery Today: Disease Models. 22, 27-34 (2016).
- Loerracher, A. K., Braunbeck, T. Cytochrome P450-dependent biotransformation capacities in embryonic, juvenile and adult stages of zebrafish (Danio rerio)-a state-of-the-art review. Arch Toxicol. 95 (7), 2299-2334 (2021).
- Marcato, D. Design and Development of Imaging Platforms for Phenotypic Characterization of Early Zebrafish. , Karlsruhe Institute of Technology. https://publikationen.bibliothek.kit.edu/1000085054 (2018).
- PrecisionTox Consortium. The precision toxicology initiative. Toxicol Lett. 383, 33-42 (2023).
- Nüsslein-Volhard, C. Zebrafish - A Practical Approach. , Oxford University Press, Oxford. (2002).
- Preisach, C. hristine, Burkhardt, H. ans, Schmidt-Thieme, L. ars, Decker, R. einhold Data Analysis, Machine Learning and Applications. , Springer Berlin, Heidelberg. (2008).
- Ritz, C., Baty, F., Streibig, J. C., Gerhard, D. Dose-response analysis using R. PLoS ONE. 10 (12), e0146021(2015).
- Jensen, S. M., Kluxen, F. M., Streibig, J. C., Cedergreen, N., Ritz, C. bmd: an R package for benchmark dose estimation. Peerj. 8, e10557(2020).
- Committee, E. S., et al. Guidance on the use of the benchmark dose approach in risk assessment. EFSA J. 20 (10), e07584(2022).
- Haber, L. T., et al. Benchmark dose (BMD) modeling: current practice, issues, and challenges. Crit Rev Toxicol. 48 (5), 387-415 (2018).
- Carter, K. M., Woodley, C. M., Brown, R. S. A review of tricaine methanesulfonate for anesthesia of fish. Reviews in Fish Biology and Fisheries. 21 (1), 51-59 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci U S A. 108 (37), 15468-15473 (2011).
- Roberts, A. C., et al. Habituation of the C-start response in larval zebrafish exhibits several distinct phases and sensitivity to NMDA receptor blockade. PLoS One. 6 (12), e29132(2011).
- Marquez-Legorreta, E., et al. Brain-wide visual habituation networks in wild type and fmr1 zebrafish. Nat Commun. 13 (1), 895(2022).
- Panlilio, J. M., Aluru, N., Hahn, M. E. Developmental neurotoxicity of the harmful algal bloom toxin domoic acid: Cellular and molecular mechanisms underlying altered behavior in the zebrafish model. Environ Health Perspect. 128 (11), 117002(2020).
- Zeddies, D. G., Fay, R. R. Development of the acoustically evoked behavioral response in zebrafish to pure tones. J Exp Biol. 208 (Pt 7), 1363-1372 (2005).
- Levitz, J., et al. Optical control of metabotropic glutamate receptors. Nat Neurosci. 16 (4), 507-516 (2013).
- Best, J. D., et al. Non-associative learning in larval zebrafish. Neuropsychopharmacology. 33 (5), 1206-1215 (2008).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. J Exp Biol. 216 (Pt 18), 3504-3513 (2013).
- Liu, F., et al. Solute carrier family 26 member a2 (slc26a2) regulates otic development and hair cell survival in zebrafish. PLoS One. 10 (9), e0136832(2015).
- Singh, C., Oikonomou, G., Prober, D. A. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. Elife. 4, e07000(2015).
- Joo, W., Vivian, M. D., Graham, B. J., Soucy, E. R., Thyme, S. B. A customizable low-cost system for massively parallel zebrafish behavioral phenotyping. Front Behav Neurosci. 14, 606900(2020).
- Tucker Edmister, S., et al. Novel use of FDA-approved drugs identified by cluster analysis of behavioral profiles. Sci Rep. 12 (1), 6120(2022).
- Burgess, H. A., Granato, M. Sensorimotor gating in larval zebrafish. J Neurosci. 27 (18), 4984-4994 (2007).
- Marsden, K. C., Granato, M. In Vivo Ca(2+) Imaging Reveals that Decreased Dendritic Excitability Drives Startle Habituation. Cell Rep. 13 (9), 1733-1740 (2015).
- Chatterjee, P., et al. Otoferlin deficiency in zebrafish results in defects in balance and hearing: rescue of the balance and hearing phenotype with full-length and truncated forms of mouse otoferlin. Mol Cell Biol. 35 (6), 1043-1054 (2015).
- Wang, C., et al. Evaluation of the hair cell regeneration in zebrafish larvae by measuring and quantifying the startle responses. Neural Plast. 2017, 8283075(2017).
- Xu, L., Guan, N. N., Huang, C. X., Hua, Y., Song, J. A neuronal circuit that generates the temporal motor sequence for the defensive response in zebrafish larvae. Curr Biol. 31 (15), 3343-3357.e4 (2021).
- Hecker, A., Schulze, W., Oster, J., Richter, D. O., Schuster, S. Removing a single neuron in a vertebrate brain forever abolishes an essential behavior. Proc Natl Acad Sci U S A. 117 (6), 3254-3260 (2020).
- Weber, D. N. Dose-dependent effects of developmental mercury exposure on C-start escape responses of larval zebrafish Danio rerio. Journal of Fish Biology. 69 (1), 75-94 (2006).
- Santistevan, N. J., et al. cacna2d3, a voltage-gated calcium channel subunit, functions in vertebrate habituation learning and the startle sensitivity threshold. PLoS One. 17 (7), e0270903(2022).
- Thyme, S. B., et al. Phenotypic landscape of schizophrenia-associated genes defines candidates and their shared functions. Cell. 177 (2), 478-491.e20 (2019).
- OECD. Test No. 203: Fish, Acute Toxicity Test. OECD Guidelines for the Testing of Chemicals, Section 2. , OECD Publishing. Paris. (2019).
- Kluver, N., et al. Fish embryo toxicity test: identification of compounds with weak toxicity and analysis of behavioral effects to improve prediction of acute toxicity for neurotoxic compounds. Environ Sci Technol. 49 (11), 7002-7011 (2015).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hear Res. 341, 220-231 (2016).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLoS One. 12 (4), e0175420(2017).
- van den Bos, R., et al. Early life exposure to cortisol in zebrafish (Danio rerio): similarities and differences in behaviour and physiology between larvae of the AB and TL strains. Behavl Pharmacol. 30 (2-3), 260-271 (2019).
- Felsenfeld, A. L., Walker, C., Westerfield, M., Kimmel, C., Streisinger, G. Mutations affecting skeletal-muscle myofibril structure in the zebrafish. Development. 108 (3), 443-459 (1990).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Biophys Res Commun. 423 (4), 785-788 (2012).
- Shahid, M., et al. Zebrafish biosensor for toxicant induced muscle hyperactivity. Sci Rep. 6, 23768(2016).
- Winter, M. J., et al. Functional brain imaging in larval zebrafish for characterising the effects of seizurogenic compounds acting via a range of pharmacological mechanisms. Br J Pharmacol. 178 (13), 2671-2689 (2021).
- Vorhees, C. V., Williams, M. T., Hawkey, A. B., Levin, E. D. Translating neurobehavioral toxicity across species from zebrafish to rats to humans: Implications for risk assessment. Front Toxicol. 3, 629229(2021).
- Scholz, S., et al. The zebrafish embryo model in environmental risk assessment--applications beyond acute toxicity testing. Environ Sci Pollut Res Int. 15 (5), 394-404 (2008).
- Dutra Costa, B. P., Aquino Moura, L., Gomes Pinto, S. A., Lima-Maximino, M., Maximino, C. Zebrafish models in neural and behavioral toxicology across the life stages. Fishes. 5 (3), 23(2020).
- Wolman, M. A., et al. A genome-wide screen identifies PAPP-AA-mediated IGFR signaling as a novel regulator of habituation learning. Neuron. 85 (6), 1200-1211 (2015).
- Marsden, K. C., et al. A Cyfip2-dependent excitatory interneuron pathway establishes the innate startle threshold. Cell Rep. 23 (3), 878-887 (2018).
- Jain, R. A., et al. A forward genetic screen in zebrafish identifies the g-protein-coupled receptor CaSR as a modulator of sensorimotor decision making. Curr Biol. 28 (9), 1357-1369.e5 (2018).
- Nelson, J. C., et al. Acute regulation of habituation learning via posttranslational palmitoylation. Curr Biol. 30 (14), 2729-2738.e4 (2020).
- Meserve, J. H., et al. A forward genetic screen identifies Dolk as a regulator of startle magnitude through the potassium channel subunit Kv1.1. PLoS Genet. 17 (6), e1008943(2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。