Method Article
제브라피시 진동 놀람 반응 스크리닝 시스템을 사용한 화학물질의 독성 평가
요약
제브라피시 배아 진동 놀람 반응을 기반으로 화합물 독성을 평가하기 위한 스크리닝 시스템의 워크플로우 및 데이터 분석에 대해 설명합니다. 이 시스템은 진동 자극에 노출된 제브라피시 배아의 움직임을 기록하고 일반 독성/치사율 및 신경근 독성을 통합적으로 평가할 수 있습니다.
초록
우리는 제브라피시 배아의 신경근 및 일반 독성을 평가하기 위한 간단한 스크리닝 시스템을 개발했습니다. 모듈식 시스템은 배아가 있는 조직 배양 접시를 배치할 수 있는 전기역학적 변환기로 구성됩니다. 이러한 여러 스피커-조직 배양 접시 쌍을 결합할 수 있습니다. 전기역학적 변환기에 의해 생성된 진동 자극은 배아에서 특징적인 놀람 및 탈출 반응을 유도합니다. 벨트 구동식 리니어 드라이브는 각 스피커 위에 카메라를 순차적으로 배치하여 배아의 움직임을 기록합니다. 이러한 방식으로, 화합물의 치사율 또는 신경근 독성으로 인한 놀람 반응의 변화를 시각화하고 정량화할 수 있습니다. 배아 및 처리 용액 준비, 기록 시스템 작동, 분석에서 활성 화합물의 벤치마크 농도 값을 계산하기 위한 데이터 분석을 포함하여 이 시스템을 사용한 화합물 스크리닝 워크플로우의 예를 제시합니다. 상업적으로 이용 가능한 간단한 구성 요소를 기반으로 하는 모듈식 어셈블리는 이 시스템을 경제적이고 특정 실험실 설정 및 스크리닝 목적의 요구 사항에 유연하게 적용할 수 있도록 합니다.
서문
최근 몇 년 동안 제브라피시는 약물 개발에서 환경 독성학에 이르기까지 연구 분야를 포괄하는 화합물 효과 평가를 위한 매우 인기 있는 모델 유기체가 되었습니다1. 척추동물인 제브라피쉬는 유전적 구성과 전반적인 생리학의 많은 측면을 인간과 공유합니다 2,3. 따라서 이 모델에서 얻은 결과는 종종 인간의 건강과 직접적인 관련이 있습니다. 현재 임상시험 중인 여러 약물 후보가 제브라피시4를 사용한 화합물 스크리닝에서 확인되었습니다.
독성 평가는 제브라피시 배아 단계를 사용한 테스트가 중요한 주요 응용 분야 중 하나입니다. 경제협력개발기구(OECD)는 환경 독성 시험에서 제브라피시를 사용하기 위한 다양한 시험 가이드라인을 가지고 있다 5,6. 제브라피시 배아의 크기가 작고 발달이 빠르기 때문에 중처리량 규모에서 고처리량 척도의 스크리닝 접근법에 매우 적합합니다 1,3,4. 이러한 스크리닝에 의해 표적이 되는 독성학적 종점에는 배아 기형 및 치사율7, 내분비 교란8, 장기 독성9 및 신경 독성을 나타내는 행동 평가가 포함된다10,11. 행동 분석이 가능한 이유는 제브라피시 배아가 발달 단계에 따라 다양한 자극에 대해 다양한 유형의 운동 반응을 보이기 때문입니다. 예를 들어, 수정 후 1일(dpf) 배아는 자발적인 꼬리 감기(spontaneous tail coiling)12를 나타내고, 소위 광운동 반응(photomotor response, PMR)10이라고 불리는 전형적인 일련의 움직임으로 일련의 광 펄스에 반응한다. 전형적으로 수정 후 약 48-72시간 후에 발생하는 부화 후, 자유롭게 헤엄치는 가시오갈피배아(eleutheroembryos)13는 약 4 dpf14부터 진동 자극에 대한 놀람 및 탈출 반응을 점진적으로 발달시킨다. 이러한 반응은 자극의 방향과 반대 방향으로의 뚜렷한 굴곡(소위 C-벤드 또는 C-스타트)을 특징으로 하며, 그 다음에는 더 작은 카운터 벤드와 수영 행동(14,15,16,17)이 뒤따른다. 특히, 배아 행동은 다양한 신경 전달 물질 시스템을 사용하는 신경 회로에 의해 제어되므로 이러한 시스템을 표적으로 하는 화합물 효과를 조사할 수 있습니다. 예를 들어, PMR 분석은 콜린성, 아드레날린성 및 도파민성 신호전달(10)을 방해하는 화합물의 효과를 밝혀냈으며, 놀람 반응은 콜린성, 글루타민성 및 글리시닌성 뉴런을 포함한다16,18. 또한, 근육 또는 신경-근육 계면을 손상시키는 화합물도 내이/측선 유모 세포에 독성이 있는 화합물과 마찬가지로 이러한 행동에 영향을 미칩니다19,20. 따라서 자극에 반응하는 제브라피쉬의 운동 행동을 관찰하는 것은 신경 독성뿐만 아니라 이독성 및 근독성을 동등하게 평가하는 데 적합한 수단입니다. 운동 행동 점수는 죽은 배아가 움직이지 않기 때문에 일반적인 독성/치사율 평가의 대용물로도 사용됩니다. 따라서 배아 운동 행동은 1단계 독성 스크리닝 접근법에 대한 통합적 판독을 나타내며, 이는 한 번의 설정에서 치명적 및 신경근 복합 효과를 나타냅니다. 가시오갈피배아가 이미 화합물을 대사할 수 있다는 점을 감안할 때, 이 접근법은 또한 대사 형질전환 산물(metabolic transformation product)의 효과를 검출할 수 있다 7,21,22. 중요한 것은, 제브라피시 배아는 120 hpf13 이후 자유 수유 단계까지 일부 동물 보호법에 따라 보호되는 생애 단계로 간주되지 않는다는 것입니다. 따라서 동물 독성 시험의 대안으로 간주됩니다.

그림 1: 진동 놀람 응답 시스템 설정. (A) 시스템 개요. 테스트 화합물에 노출된 배아가 있는 플레이트는 전기역학적 변환기 어레이("라우드 스피커")에 배치됩니다. 카메라는 벨트 구동 리니어 드라이브에 의해 타겟 트랜스듀서 위의 녹화 위치로 순차적으로 이동합니다. (B) 상세 view 상단에 조직 배양 접시가 삽입된 변환기/확성기. 플레이트는 4000-5000lux의 LED 라이트 시트에 의해 아래에서 조명됩니다. 자극이 주어지는 동안 스피커 옆의 LED 조명이 켜집니다. (C) 배아를 자극할 때 카메라로 녹화한 비디오의 정지 이미지. (D) 구성 파일의 스크린샷. (E) 녹음 소프트웨어 인터페이스의 스크린샷. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
여기에서, 우리는 조직 배양 접시(23)에서 자유롭게 움직이는 여러 배아의 자동화된 비디오 기록과 결합된 전기역학적 변환기에 의해 생성된 진동 자극에 기초한 자체 제작 간단한 테스트 장치를 사용하여 진동 놀람 반응에 대한 복합 효과를 평가하기 위한 테스트 프로토콜을 설명합니다. 이 시스템은 모듈식이며 여러 조직 배양 접시에서 병렬로 순차적으로 기록할 수 있습니다. 현재 사용되는 설정에서 5개의 전기역학적 변환기는 20개의 배아가 포함된 조직 배양 접시에 진동 자극(500Hz, 지속 시간 1ms)을 제공합니다(그림 1). 플레이트는 LED 조명 시트로 4000-5000lux에서 아래에서 조명됩니다. 각 변환기 옆에 있는 LED 표시등은 자극 적용 기간을 나타내고 오실로스코프는 적용된 자극의 파형과 주파수를 나타냅니다(자세한 내용은 참조 23 참조). 배아의 행동은 초당 1000프레임(fps)으로 고속 카메라(Table of Materials)에 의해 기록되며, 이 카메라는 벨트 구동 선형 드라이브에 의해 대상 스피커 위로 이동합니다. 이 기록 속도는 놀람 반응을 안정적으로 해결하는 데 필요합니다. 이 시스템은 현재 상용 시스템에 대한 저비용의 개별 조정 가능한 대안을 제공합니다. 아래에 자세히 설명된 정확한 워크플로우는 현재 정밀 독성학 이니셔티브24 의 프레임워크에서 수행되어 선택된 독성 물질 세트로 처리된 제브라피시 배아에서 OMICS 데이터 수집에 적합한 노출 조건을 결정합니다.
프로토콜
모든 제브라피시 사육 및 취급은 독일 동물 보호 기준에 따라 수행되었으며 독일 바덴뷔르템베르크 주정부, Regierungspräsidium Karlsruhe(Aktenzeichen 35-9185.64/BH KIT)의 승인을 받았습니다.
1. 시험할 화학물질의 원액 준비
- 유리 바이알(또는 화학 부분 표본)에 화합물 이름/약어, 재고 농도 및 준비 날짜로 라벨을 붙입니다. 예를 들어, CdCl2_2.5g· L-1_210813입니다.
- 실온(RT)에서 1분 동안 2000 x g 에서 화학 부분 표본을 원심분리합니다.
- 흄 후드 아래에서 0.001g에 민감한 저울에서 화합물의 무게를 측정하고(필요한 경우) 라벨이 부착된 바이알로 옮깁니다. 화합물이 액체인 경우 피펫과 플라스틱 피펫 팁을 사용하여 바이알에 추가합니다.
참고: 예를 들어, 그림 2에 표시된 결과 예에 사용된 트리카인 메탄설포네이트 스톡의 경우 400mg을 라벨링된 바이알에 칭량했습니다. - 피펫과 플라스틱 피펫 팁을 사용하여 용매(예: 화합물의 물리화학적 특성에 따라 멸균 순수 또는 디메틸 설폭사이드(DMSO))를 추가합니다. 가능하면 물이 선호되는 용매입니다.
참고: 예를 들어, 트리카인 스톡의 경우, 100mL의 물에 15.3mM 용액을 준비하였다. - 바이알을 밀봉하고 부드럽게 흔든 다음 침전물을 확인합니다.
- 피펫과 플라스틱 피펫 팁을 사용하여 유리 바이알에 희석된 원액(필요한 경우)을 준비합니다.
참고: 예를 들어, 트리카인 스톡에 대해 더 이상의 희석이 필요하지 않았습니다. - 사용할 때까지 원액을 -20°C에서 보관하십시오.
- 남은 화학 부분 표본은 이전과 동일한 조건으로 보관하십시오.
- 실험실 노트북에 재고 부분 표본 정보를 기록합니다.
2. 제브라피시 배아 채취 및 사육
- 10cm 조직 배양 접시에서 그룹 짝짓기의 자연 산란에서 분열 단계(2-8 세포 단계)의 배아를 수집합니다.
- 적절한 품질의 배치를 선택하십시오 : 수정되지 않은 / 죽은 계란이 10 % 미만입니다.
- 접시를 청소하십시오(수정되지 않은 계란, 부스러기, 비늘 등을 제거하십시오).
- 10cm 조직 배양 접시당 60개의 배아를 15mL의 E3 배지(5mM NaCl, 0.17mM KCl, 0.33mM CaCl2, 0.33mM MgSO4)에 넣습니다.25.
- 물에 적신 종이 타월을 깔아 준비한 가습 챔버에 접시를 놓습니다.
- 28.5°C의 인큐베이터에서 72hpf까지 배아를 키웁니다.
3. 테스트 할 화학 물질의 작업 희석 준비
- -20°C 냉동실에서 원액을 꺼내 해동합니다.
- 화합물 용해도가 충분히 높으면 유리병에 담긴 E3 배지에서 농도당 반복당 1mL의 연속 희석액을 준비합니다. 농도가 원하는 노출 농도보다 10배 높은지 확인하십시오. 이렇게 하면 노출 시작 시 배아의 전체 배지를 변경할 필요가 없습니다. 용해도가 낮은 경우 원하는 노출 농도(농도당 반복 횟수당 10mL)에서 직접 연속 희석액을 준비합니다.
- 강수량을 확인하십시오 (필요한 경우). 용액이 침전된 경우 이를 기록한 다음 다음으로 높은 농도를 얻기 위해 더 희석합니다. 강수량을 다시 확인하십시오. 강수량이 없을 때까지 반복합니다.
- 노출 용액의 pH를 확인하십시오. pH 7.0-8.5 범위를 벗어나면 이를 기록하고 HCl 또는 NaOH로 pH를 조정하여 3mM HEPES/pH 5를 포함하는 E7.4 용액을 준비합니다.
- 사용하지 않은 노출 매체는 현지 규정에 따라 폐기하십시오.
4. 테스트할 화학 물질에 배아 노출
- 72hpf의 오래된 배아가 있는 접시에 죽은/부화되지 않은 배아가 있는지 확인하고 제거합니다. 배아 배치에 부화되지 않은 알이 5% 이상 포함되어 있으면 배치를 제거하십시오.
- 6cm 조직 배양 접시당 배아 10개를 E3 배지(노출판) 9mL에 넣습니다.
- 노출판에 화합물 이름, 노출 농도 및 반복 횟수를 라벨링합니다. 예를 들어, "CdCl2 1mg· L-1 01"입니다. 필요한 경우 충분한 E3 전용 플레이트와 용매 제어 플레이트를 포함합니다(섹션 5 참조).
- 가장 낮은 농도부터 시작하여 각 플레이트에 1mL의 노출 용액을 추가하고 플레이트를 휘젓습니다. 용해도가 낮은 화합물의 경우 플레이트의 전체 10mL를 노출 용액으로 교체합니다(3.2단계 참조).
- 배아에 화합물 용액이 첨가된 시간적 순서를 기록합니다.
- 플레이트를 28.5°C의 인큐베이터에서 120hpf에 도달할 때까지 48시간 동안 가습 챔버에서 배양합니다.
5. 진동 깜짝 분석 수행
알림: 4.5단계에 기록된 것과 동일한 순서로 플레이트를 분석합니다. 각 실행에는 E3 컨트롤 플레이트가 포함되어야 합니다.
- 컴퓨터와 진동 장치를 켭니다(파란색 LED 표시등이 켜져 있어야 함).
- 그림 1D와 같이 스프레드시트에 구성 파일을 준비하고 보충 파일 1로 첨부합니다. 5개의 플레이트 위치(화합물, 농도, 반복) 각각에 대한 노출 정보를 기록합니다.
- 일반 사용자 인터페이스(GUI) 프로그램(프로젝트 ID 43215 https://git.scc.kit.edu/xk4962/vibration-startle-assay-kit 에서 사용 가능)을 엽니다.
- GUI 프로그램에서 다른 위치를 선택하고 카메라 움직임을 관찰하여 카메라 움직임을 확인합니다.
- 인큐베이터에서 측정할 샘플 플레이트를 꺼냅니다. s를 놓으십시오.amp5개 위치( 그림 1A, "확성기" 참조)에 플레이트를 놓고 배아를 몇 분 동안 가라앉힙니다.
- Record( 기록)를 클릭합니다. 구성 파일을 선택할 수 있는 창이 열립니다.
- 이 실행을 위해 5.2단계에서 준비한 적절한 구성 파일을 선택합니다.
- 샘플 설명이 s와 일치하는지 확인하십시오.amp각 위치(1-5)의 les.
- 측정은 자동으로 수행됩니다(10초/위치). 프로그램에 의해 사운드 펄스가 적용되면 LED가 켜집니다. 10초/위치에 대한 기록은 자극이 가해지기 전과 후에 수영 속도와 이동 거리를 추정하기에 충분한 데이터를 획득하고 후속 자극에 대한 습관화를 방지할 수 있습니다.
- 녹화가 완료되면 카메라가 위치 1로 돌아가고 소프트웨어가 파일 압축을 시작합니다. 이 시간 동안 샘플을 측정해야 하는 다음 세트로 교체합니다.
- 5.2단계로 이동합니다. 다음 실행을 기록합니다.
- 모든 플레이트가 측정되면 노출 용액을 수집합니다. 체를 사용하여 배아를 유지합니다.
- 얼음/이소프로판올(5%) 욕조에서 급속 냉각하여 배아를 안락사시킵니다.
- 노출 용액과 죽은 배아는 현지 규정에 따라 폐기하십시오.
6. 데이터 분석
- VirtualDub(1.10.4)로 비디오 데이터를 엽니다.
- 소리 펄스에 반응하는 배아의 수를 시각적으로 채점합니다(제어 LED가 켜져 있을 때).
- 스프레드시트에 데이터를 입력합니다. 그림 2C에 표시된 예제 데이터 세트를 포함하는 보충 파일 2에 제공된 템플릿에 따라 화합물 이름, 반복, 화합물의 농도 및 운동성 배아의 백분율을 기록합니다.
참고: 템플릿은 유연한 구조를 가지고 있으며 주로 다른 유기체 및 종말점의 데이터에 대한 적용을 허용합니다. 각 농도에 대한 반응을 설명하고 종말점에 대한 설명과 후속 농도-반응 모델링에서 생성된 파라미터의 정의도 제공합니다. - 포함된 R 스크립트(R 버전 3.6., R-packages plotrix, drc 및 bmd27,28)와 함께 KNIME 워크플로(KNIME 분석 4.626)를 사용하여 벤치마크 농도(BMC) 분석을 수행합니다.
참고: 원칙적으로 평가는 R에서 직접 수행할 수도 있습니다. 그러나 편의를 위해 웹 기반 서비스로 평가할 수 있도록 분석은 KNIME 서버 호환 워크플로로 구성되었습니다. KNIME 워크플로의 출력은 보충 파일 3에 제공됩니다. KNIME 워크플로에서 생성된 통계 매개 변수에 대한 자세한 내용은 이 템플릿을 참조하십시오. 적합도를 추정하기 위한 통계 매개변수와 결정된 BMC 값을 수용하기 위한 임계값이 표 1에 나와 있습니다. KNIME 워크플로 자체는 GitHub(https://github.com/precisiontox/range-finding-drc)를 통해 사용할 수 있습니다. 농도-반응은 4-모수 로그 로지스틱 모형을 사용하여 모형화됩니다. 곡선 피팅 파라미터 중 두 개를 고정할 수 있습니다. 일반적으로 백분율 데이터의 경우 최대값을 100으로 고정합니다. 배경 효과가 관찰되지 않는 경우 최소값을 0%로 고정할 수 있습니다.
결과
그림 2A 는 처리되지 않은 야생형 배아(AB2O2 균주) 48개 무리에서 운동성 배아의 비율을 보여줍니다. 평균적으로, 처리되지 않은 야생형 배아의 14.33%는 진동 자극에 반응하지 않습니다. 4개의 클러치에서 움직이지 않는 유충의 비율은 50%에 달했지만, 클러치의 75%는 움직이지 않는 유충의 비율이 20% 미만이었습니다.
그림 2B,C는 현재 PrecisionTox 컨소시엄(24) 내에서 수행되고 있는 진동 놀람 분석 워크플로우를 사용하여 운동성에 대한 복합 효과에 대한 벤치마크 농도/선량(BMC/BMD 29,30)의 일반적인 계산 예를 보여줍니다. BMC10, BMC25 및 BMC50 값은 각각 배아의 10%, 25% 및 50%가 배경보다 높은 운동성 수준을 나타내는 농도에 해당합니다. 완전히 움직이지 않는 배아만 이 계산에 포함되며, 후속 탈출 수영 없이 C-벤드만 있거나 꼬리 움직임만 있는 것과 같이 여전히 부분적인 반응을 보이는 배아는 포함되지 않습니다(그림 2B). 배아는 어류 마취에 자주 사용되는 나트륨 채널 억제제인 트리카인 메탄설포네이트(tricaine methanesulfonate)의 8가지 농도에 노출되었다31. 데이터는 진동 자극에 대한 반응으로 약 25%의 부운동성의 배경 수준을 나타냅니다. 1% 트리카인에서 시작하여 운동성이 감소한 다음 2.5% 이상에서 멈춥니다. KNIME 워크플로우는 BMC50을 164.9μM로 계산하며, 이는 1.07%의 트리카인과 75%의 부운동성 수준에 해당합니다(그림 2C). 작은 95% 신뢰 구간(곡선의 회색 음영으로 표시)은 이 분석에서 운동성 값의 강력한 재현성을 나타냅니다.
그림 2D는 BMC 계산에 데이터를 사용해서는 안 되는 최적이 아닌 분석 실행의 예를 보여줍니다. 동일한 클러치에서 파생된 서로 다른 배아를 가진 5개의 E3 처리된 대조군이 표시됩니다(AB2O2 [야생형 균주] 복제 1-5). 첫 번째 그룹만이 거의 정상에 가까운 반응을 보이며, 그림 2A에 표시된 바와 같이 문헌 값32 및 여기에 설명된 분석에서 얻은 것과 일치하는 약 25%의 운동성을 보이는 반면, 다른 모든 그룹은 감소 및/또는 불완전한 행동 반응(예: 수영 활동이 뒤따르지 않는 C-굽힘만 보임, 또는 처음에 명확한 C-굽힘이 없는 운동성)을 보여줍니다. 이러한 반응은 배아가 제대로 발달하지 못하고 발달 지연으로 인해 미성숙한 상태에 있을 때 발생할 수 있으며, 이는 놀람 반응의 견고성에 영향을 미친다(14,33).
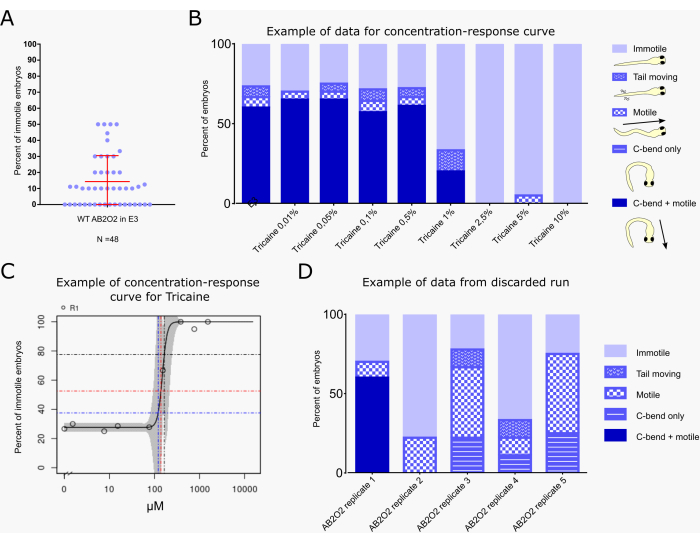
그림 2: 벤치마크 용량 계산을 포함한 일반적인 결과의 예. (A) 48 클러치에 대한 야생형 미처리 유충에 대한 사운드 펄스 후 반응하지 않는 배아의 비율(클러치당 n = 10). 평균(14.33%)과 표준 편차(±16.19%)는 빨간색으로 표시됩니다. (B) E3 배지에서 표시된 농도의 트리카인으로 처리하거나 E3 단독으로 대조군으로 처리한 배아(조건당 n=20)의 놀람 반응 행동 평가. 행동은 색 구성표와 그래프 오른쪽에 표시된 만화에 따라 분류되며 각 배아는 다음 클래스 중 하나에만 할당됩니다. "운동성": 배아는 움직임을 보이지 않습니다. "꼬리 이동": 배아는 꼬리의 움직임을 보이지만 C-벤드나 수영 행동은 보이지 않습니다. "운동성": 배아는 수영 움직임을 보이지만 진동 자극에 반응하여 C-굽힘은 없습니다. "C-벤드만": 배아는 C-벤드를 보이지만 수영을 피하지는 않습니다. "C-bend + 운동성": 배아는 전형적인 C-bend 행동을 보인 후 탈출 수영(전형적인 완전 놀람 반응)을 보입니다. 서로 다른 행동은 각 치료에 대한 총 배아 수의 백분율로 표시됩니다. (C) KNIME 워크플로우에 의해 생성된 BMC 계산 그래프로, 각 처리 농도에 대한 "운동성 배아" 배아의 백분율을 나타냅니다. 파란색, 빨간색 및 검은색 선은 BMC10, BMC25 및 BMC50 값, 즉 배아의 10%, 25% 및 50%가 각각 배경보다 높은 운동성 수준을 나타내는 농도를 나타냅니다. (D) 폐기된 분석 실행의 예. 동일한 클러치에서 파생된 서로 다른 AB2O2 야생형 배아를 사용한 5개의 E3 처리된 대조군이 표시됩니다(반복 1-5). 반복실험 1만 거의 정상적인 반응을 보인 반면, 나머지 실행의 배아는 전형적인 C-벤드 + 탈출 수영 반응을 나타내지 않았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 결정된 BMC 값을 수용하기 위한 적합도 및 임계값을 추정하기 위한 통계 매개변수. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 진동 놀람 반응 분석 시스템 선택의 특성. 이 표를 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 구성 파일용 Excel 템플릿입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 예제 데이터 세트가 있는 KNIME 입력 템플리트. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: KNIME 출력 파일 예. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
맞춤형 제브라피시 배아 진동 깜짝 분석 설정을 사용하여 화합물 평가를 위한 워크플로우 및 데이터 분석을 제시합니다. 워크플로우는 벤치마크 농도/선량(BMC/BMD)과 같은 복합 독성을 지정하는 일반적인 파라미터를 계산할 수 있는 강력한 데이터를 생성합니다. 설정의 모듈성을 통해 처리량 및 공간 요구 사항에 대한 다양한 요구 사항에 맞게 조정할 수 있습니다. 이 시스템은 비교적 간단한 설정에 따라 저비용 기초 구성 요소로 만들어지기 때문에 일반적으로 한 번에 여러 분석 유형을 위해 설계되고 독점 소프트웨어에 의존하며 상대적으로 비용이 많이 드는 기존 상용 시스템에 대한 저렴한 대안을 제공합니다.
이러한 상용 시스템 및 기타 맞춤형 시스템 모두 멀티웰 플레이트(예: 12-웰34, 16-웰32,35, 24-웰 20,33,36, 48-웰37, 96-웰 38,39,40,41,42 및 384-웰[4x96 웰]43)에서 단일 배아 또는 유충을 평가할 수 있습니다), 그러나 우물의 공간 제한으로 인해 탈출 응답(예: 이동 거리)의 일부 데이터 매개변수를 분석하는 것이 더 어려워집니다. 더욱이, 이러한 셋업 중 일부에서, 이미징은 플레이트의 웰의 서브세트로 제한되어, 처리량36,39를 감소시킨다. 접시에서 배아를 이미징하면 탈출 반응 매개변수를 더 잘 평가할 수 있으며 한 번에 여러 배아의 행동을 기록할 수 있습니다(예: 6cm 접시에서 최대 30개). 일반적으로 접시 기반 이미징은 실행 당 하나의 접시로 제한됩니다 44,45,46,47,48 (예외적으로 6 개의 접시에 대해 각각 하나의 유충이49 또는 4 개의 유충이 2 개의 분할 접시50에 대해 병렬로 이미징을 수행함), 우리의 경우와 같은 병렬 설계로 해결할 수있는 단점. 본 연구에서 사용된 시스템과 기타 상업용 및 맞춤형 솔루션의 몇 가지 특성을 표 2 20,32,33,34,35,36,37,38,39,40,41,42,43, 44,45,46,47,48,49,50,
51,52.
이 방법의 한 가지 장점은 치사율과 행동 변화를 모두 포착하는 판독으로, 독성 평가의 성능을 높일 수 있습니다. 예를 들어, 제브라피시 어류 배아 급성 독성 시험(FET)5 은 성체 어류 급성 독성 시험(53 )에서 독성을 꽤 잘 예측하는 것으로 나타났지만, 행동 판독값(54)을 포함시킴으로써 예측 정확도가 향상되었다. 그 이유는 어류 배아에서 볼 수 있는 신경 활성 화합물에 의해 유발된 약한 폐사율 때문이며, 아마도 어린 물고기 또는 성인 물고기에서 독성을 높이는 호흡 부전 증후군이 없기 때문일 것입니다. 그러나 신경 활동은 행동 평가로 확인할 수 있습니다. 또한 행동 판독은 근육 독성 및 이독성 효과뿐만 아니라 생리학에 대한 기타 더 미묘한 독성 효과를 포착할 수 있으며, 이는 치명적이지는 않지만 유기체의 행동 성능에 영향을 미칩니다.
분석을 수행할 때는 화합물을 적절하게 취급하고 균질하게 발달하는 제브라피시 배아 배치를 사용하는 것이 중요합니다. 따라서 화합물 보관을 위해 유리 바이알을 사용하면 플라스틱 재료에 대한 흡광성으로 인한 화학 물질, 특히 소수성 화합물의 농도 감소를 최소화해야 합니다. "플라스틱" 폴리스티렌에 대한 흡수 가능성이 높은 화합물의 경우, 유리판도 배양에 사용할 수 있습니다. 죽은 배아의 채취 및 제거에 사용되는 조직 배양 접시에서 난자를 세척하는 것은 표준 발달을 보장하기 위한 중요한 단계입니다. 발달 지연은 평가된 행동의 기초가 되는 신경망의 성숙도에 영향을 미칠 수 있기 때문에 정상적인 발달 속도가 중요하다14,33. 또한, 복합 효과의 비교를 가능하게 하기 위해서는, 상이한 균주가 상이한 행동 프로파일을 나타내는 것으로 보고되었기 때문에 동일한 균주에서 난자를 추출해야 한다 38,55,56,57. 노출되는 동안 E3 배지의 과도한 증발을 방지하기 위해 가습 챔버에서 배아를 배양하는 것이 중요하며, 이로 인해 테스트된 농도가 변경됩니다.
E3 컨트롤은 테스트 시리즈에 사용된 특정 배아 배치의 기준 응답 수준을 결정하기 위해 각 실행에 통합되어야 합니다. 일반적으로 5개의 측정 세트마다 하나의 대조군 플레이트를 실행합니다. 그림 2D에서 볼 수 있듯이 이 접근 방식을 사용하면 개발 지연 또는 유전적 배경 효과와 같은 다른 이유로 인해 최적이 아닌 반응을 보이는 배치를 검출할 수도 있습니다. 자극에 대한 예기치 않은 반응이 없는 경우 잠재적인 변환기 고장도 주의하십시오. 일반적으로 놀람 반응은 로그 로지스틱 모형을 사용하여 곡선 피팅을 허용하는 시그모이드 농도-반응 동작을 보여줍니다. 그러나 드물게 biphasic 응답이 있는 경우 Gaussian 또는 Cedergreen 모델과 같은 다른 모델을 사용해야 할 수 있습니다. R 패키지 drc 및 bdm27,28 내에서 사용할 수 있습니다.
진동 자극에 대한 반응 부족은 단순히 배아의 죽음 또는 일반적인 세포 독성으로 인한 심각한 생명 기능 손상을 나타낼 수 있지만, 자극 지각, 통합 및 운동 출력의 신경 회로를 표적으로 하는 보다 구체적인 독성을 반영할 수도 있습니다. 다른 가능한 복합 효과는 신경근 계면 또는 근육 구조 및 기능에 대한 간섭입니다. 이러한 가능성을 구별하려면 추가 분석이 필요합니다. 예를 들어, 근육의 구조적 완전성은 복굴절 분석법(58,59)으로 평가될 수 있으며, 형질전환 라인은 근육 및 신경 기능(60,61)의 섭동을 평가하기 위해 이용 가능하다. 그러나 녹화된 비디오 데이터는 이미 첫 번째 추가 정보를 제공할 수 있는 배아의 형태 및 행동 반응에 대한 보다 자세한 분석을 허용합니다. C-벤드만 손상되었나요, 아니면 모두 운동성이 손상되었나요? 약하거나 떨리는 꼬리 움직임으로 알 수 있듯이 신경근 활동의 잔재가 여전히 존재합니까? 그러한 변화된 행동은 부종이나 신체 만곡 증가와 같은 형태학적 변화와 함께 진행됩니까? 또한 C-벤드까지의 대기 시간 또는 탈출 응답 동안 이동한 거리와 같은 매개변수를 평가할 수 있습니다(예: Ref. 44 참조).
여기에 설명된 스크리닝 프로토콜을 통해 빠르고 강력한 화합물 독성 평가가 가능하며, 치명적이지 않은 신경독성, 이독성 및 근육독성 화합물을 특이적으로 검출할 수 있습니다. 제공된 분석 워크플로우는 구현하기 쉬우며 강력한 판독값을 제공합니다. 진동 놀람 분석에 사용된 자극 프로토콜의 수정은 프리펄스 억제(PPI)39,44 및 습관화(32,33)와 같은 놀람 행동의 보다 복잡한 측면에 대한 복합 효과를 해결하는 데 사용되었으며 이 연구에서 사용된 전기역학적 변환기 기반 자극 설정에 적용할 수 있습니다.
놀람 반응 기반 스크리닝 시스템의 주요 응용 분야는 화학 스크리닝의 화합물 효과 평가이며, 이는 인체 독성 평가 및 약물 개발 모두와 관련이 있습니다 1,4,62. 동시에, 수생 생물의 초기 생활 단계를 테스트함으로써 얻은 결과는 생태 독성 학적 위험 평가63,64와 직접적인 관련이 있습니다. 또한, 놀람 반응 시스템은 유전자 스크리닝(65,66,67,68,69)에서의 행동 표현형에 사용될 수 있다. 쉽게 구현할 수 있고 적응할 수 있는 당사의 시스템은 이러한 다양한 응용 분야에서 고유한 스크리닝 프로젝트를 수행하려는 소규모 실험실에 저렴한 설정을 제공합니다.
공개
우리는 공개할 것이 없습니다.
감사의 말
IBCS-BIP 어류 시설 및 스크리닝 센터의 지원 직원의 탁월한 기술 지원에 감사드립니다. 이 연구는 보조금 계약 965406(PrecisionTox)에 따라 유럽 연합의 Horizon 2020 연구 및 혁신 프로그램에서 자금을 지원받았습니다. 이 결과물은 저자의 견해만을 반영하며, 유럽 연합은 여기에 포함된 정보의 사용에 대해 책임을 지지 않습니다.
자료
| Name | Company | Catalog Number | Comments |
| Fine test sieves, Brass frame, pore size 250 μm | Sigma-Aldrich | Z289744-1EA | Or comparable material |
| High-speed camera | XIMEA | MQ013MG-ON USB 3 | |
| Laboratory Bottles, Narrow Neck, with Screw Cap | VWR | 215-3261 | Reference number for 50 mL, available up to 20 L. Or comparable material |
| Pipette tip, working volume: 10 µL | SARSTEDT | 70.3010.210 | Or comparable material |
| Pipette tip, working volume: 1000 µL | SARSTEDT | 70.3050.100 | Or comparable material |
| Pipette tip, working volume: 20 µL | SARSTEDT | 70.3020.210 | Or comparable material |
| Pipette tip, working volume: 200 µL | SARSTEDT | 70.3030.100 | Or comparable material |
| Serological pipette 10 mL | SARSTEDT | 86.1254.001 | Or comparable material |
| Serological pipette 25 mL | SARSTEDT | 86.1685.001 | Or comparable material |
| Serological pipette 5 mL | SARSTEDT | 86.1253.001 | Or comparable material |
| Tissue culture dish 60,0 mm/15,0 mm vented (Polystyrene) | Greiner bio-one | 628102 | Or comparable material |
| Tissue culture dish 100, suspension (Polystyrene) | SARSTEDT | 83.3902.500 | Or comparable material |
| Transfer pipette 6 mL | SARSTEDT | 86.1175 | Or comparable material |
| Tube 15 mL 120 mm x 17 mm PP | SARSTEDT | 62.554.502 | Or comparable material |
| Tube 50 mL 114mm x 28 mm PP | SARSTEDT | 62.5472.54 | Or comparable material |
참고문헌
- MacRae, C. A., Peterson, R. T. Zebrafish as a mainstream model for in vivo systems pharmacology and toxicology. Annu Rev Pharmacol Toxicol. 63, 43-64 (2023).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Choi, T. Y., Choi, T. I., Lee, Y. R., Choe, S. K., Kim, C. H. Zebrafish as an animal model for biomedical research. Exp Mol Med. 53 (3), 310-317 (2021).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: from preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- OECD. Test No. 236: Fish embryo acute toxicity (FET) Test. OECD Guidelines for the Testing of Chemicals, Section 2. , OECD Publishing, Paris. (2013).
- OECD. Test No. 250: EASZY assay - Detection of endocrine active substances, acting through estrogen receptors, using transgenic tg(cyp19a1b:GFP) zebrafish embryos. OECD Guidelines for the Testing of Chemicals, Section 2. , OECD Publishing, Paris. (2021).
- Braunbeck, T., et al. The fish embryo test (FET): origin, applications, and future. Environ Sci Pollut Res Int. 22 (21), 16247-16261 (2015).
- Weger, B. D., Weger, M., Nusser, M., Brenner-Weiss, G., Dickmeis, T. A Chemical screening system for glucocorticoid stress hormone signaling in an intact vertebrate. ACS Chem Biol. 7 (7), 1178-1183 (2012).
- Pandey, G., Westhoff, J. H., Schaefer, F., Gehrig, J. A Smart imaging workflow for organ-specific screening in a cystic kidney zebrafish disease model. International Journal of Molecular Sciences. 20 (6), 1290(2019).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nat Chem Biol. 6 (3), 231-237 (2010).
- Zhang, K., Liang, J., Brun, N. R., Zhao, Y., Werdich, A. A. Rapid zebrafish behavioral profiling assay accelerates the identification of environmental neurodevelopmental toxicants. Environ Sci Technol. 55 (3), 1919-1929 (2021).
- Ogungbemi, A. O., Teixido, E., Massei, R., Scholz, S., Kuster, E. Optimization of the spontaneous tail coiling test for fast assessment of neurotoxic effects in the zebrafish embryo using an automated workflow in KNIME(R). Neurotoxicol Teratol. 81, 106918(2020).
- Strahle, U., et al. Zebrafish embryos as an alternative to animal experiments--a commentary on the definition of the onset of protected life stages in animal welfare regulations. Reprod Toxicol. 33 (2), 128-132 (2012).
- Kimmel, C. B., Patterson, J., Kimmel, R. O. The development and behavioral characteristics of the startle response in the zebra fish. Dev Psychobiol. 7 (1), 47-60 (1974).
- Eaton, R. C., Bombardieri, R. A., Meyer, D. L. The mauthner-initiated startle response in teleost fish. Journal of Experimental Biology. 66 (1), 65-81 (1977).
- Berg, E. M., Bjornfors, E. R., Pallucchi, I., Picton, L. D., El Manira, A. Principles governing locomotion in vertebrates: Lessons from zebrafish. Front Neural Circuits. 12, 73(2018).
- Lopez-Schier, H. Neuroplasticity in the acoustic startle reflex in larval zebrafish. Curr Opin Neurobiol. 54, 134-139 (2019).
- Hale, M. E., Katz, H. R., Peek, M. Y., Fremont, R. T. Neural circuits that drive startle behavior, with a focus on the Mauthner cells and spiral fiber neurons of fishes. J Neurogenet. 30 (2), 89-100 (2016).
- Behra, M., Etard, C., Cousin, X., Strahle, U. The use of zebrafish mutants to identify secondary target effects of acetylcholine esterase inhibitors. Toxicol Sci. 77 (2), 325-333 (2004).
- Buck, L. M., Winter, M. J., Redfern, W. S., Whitfield, T. T. Ototoxin-induced cellular damage in neuromasts disrupts lateral line function in larval zebrafish. Hear Res. 284 (1-2), 67-81 (2012).
- van Wijk, R. C., Krekels, E. H. J., Hankemeier, T., Spaink, H. P., vander Graaf, P. H. Systems pharmacology of hepatic metabolism in zebrafish larvae. Drug Discovery Today: Disease Models. 22, 27-34 (2016).
- Loerracher, A. K., Braunbeck, T. Cytochrome P450-dependent biotransformation capacities in embryonic, juvenile and adult stages of zebrafish (Danio rerio)-a state-of-the-art review. Arch Toxicol. 95 (7), 2299-2334 (2021).
- Marcato, D. Design and Development of Imaging Platforms for Phenotypic Characterization of Early Zebrafish. , Karlsruhe Institute of Technology. https://publikationen.bibliothek.kit.edu/1000085054 (2018).
- PrecisionTox Consortium. The precision toxicology initiative. Toxicol Lett. 383, 33-42 (2023).
- Nüsslein-Volhard, C. Zebrafish - A Practical Approach. , Oxford University Press, Oxford. (2002).
- Preisach, C. hristine, Burkhardt, H. ans, Schmidt-Thieme, L. ars, Decker, R. einhold Data Analysis, Machine Learning and Applications. , Springer Berlin, Heidelberg. (2008).
- Ritz, C., Baty, F., Streibig, J. C., Gerhard, D. Dose-response analysis using R. PLoS ONE. 10 (12), e0146021(2015).
- Jensen, S. M., Kluxen, F. M., Streibig, J. C., Cedergreen, N., Ritz, C. bmd: an R package for benchmark dose estimation. Peerj. 8, e10557(2020).
- Committee, E. S., et al. Guidance on the use of the benchmark dose approach in risk assessment. EFSA J. 20 (10), e07584(2022).
- Haber, L. T., et al. Benchmark dose (BMD) modeling: current practice, issues, and challenges. Crit Rev Toxicol. 48 (5), 387-415 (2018).
- Carter, K. M., Woodley, C. M., Brown, R. S. A review of tricaine methanesulfonate for anesthesia of fish. Reviews in Fish Biology and Fisheries. 21 (1), 51-59 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci U S A. 108 (37), 15468-15473 (2011).
- Roberts, A. C., et al. Habituation of the C-start response in larval zebrafish exhibits several distinct phases and sensitivity to NMDA receptor blockade. PLoS One. 6 (12), e29132(2011).
- Marquez-Legorreta, E., et al. Brain-wide visual habituation networks in wild type and fmr1 zebrafish. Nat Commun. 13 (1), 895(2022).
- Panlilio, J. M., Aluru, N., Hahn, M. E. Developmental neurotoxicity of the harmful algal bloom toxin domoic acid: Cellular and molecular mechanisms underlying altered behavior in the zebrafish model. Environ Health Perspect. 128 (11), 117002(2020).
- Zeddies, D. G., Fay, R. R. Development of the acoustically evoked behavioral response in zebrafish to pure tones. J Exp Biol. 208 (Pt 7), 1363-1372 (2005).
- Levitz, J., et al. Optical control of metabotropic glutamate receptors. Nat Neurosci. 16 (4), 507-516 (2013).
- Best, J. D., et al. Non-associative learning in larval zebrafish. Neuropsychopharmacology. 33 (5), 1206-1215 (2008).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. J Exp Biol. 216 (Pt 18), 3504-3513 (2013).
- Liu, F., et al. Solute carrier family 26 member a2 (slc26a2) regulates otic development and hair cell survival in zebrafish. PLoS One. 10 (9), e0136832(2015).
- Singh, C., Oikonomou, G., Prober, D. A. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. Elife. 4, e07000(2015).
- Joo, W., Vivian, M. D., Graham, B. J., Soucy, E. R., Thyme, S. B. A customizable low-cost system for massively parallel zebrafish behavioral phenotyping. Front Behav Neurosci. 14, 606900(2020).
- Tucker Edmister, S., et al. Novel use of FDA-approved drugs identified by cluster analysis of behavioral profiles. Sci Rep. 12 (1), 6120(2022).
- Burgess, H. A., Granato, M. Sensorimotor gating in larval zebrafish. J Neurosci. 27 (18), 4984-4994 (2007).
- Marsden, K. C., Granato, M. In Vivo Ca(2+) Imaging Reveals that Decreased Dendritic Excitability Drives Startle Habituation. Cell Rep. 13 (9), 1733-1740 (2015).
- Chatterjee, P., et al. Otoferlin deficiency in zebrafish results in defects in balance and hearing: rescue of the balance and hearing phenotype with full-length and truncated forms of mouse otoferlin. Mol Cell Biol. 35 (6), 1043-1054 (2015).
- Wang, C., et al. Evaluation of the hair cell regeneration in zebrafish larvae by measuring and quantifying the startle responses. Neural Plast. 2017, 8283075(2017).
- Xu, L., Guan, N. N., Huang, C. X., Hua, Y., Song, J. A neuronal circuit that generates the temporal motor sequence for the defensive response in zebrafish larvae. Curr Biol. 31 (15), 3343-3357.e4 (2021).
- Hecker, A., Schulze, W., Oster, J., Richter, D. O., Schuster, S. Removing a single neuron in a vertebrate brain forever abolishes an essential behavior. Proc Natl Acad Sci U S A. 117 (6), 3254-3260 (2020).
- Weber, D. N. Dose-dependent effects of developmental mercury exposure on C-start escape responses of larval zebrafish Danio rerio. Journal of Fish Biology. 69 (1), 75-94 (2006).
- Santistevan, N. J., et al. cacna2d3, a voltage-gated calcium channel subunit, functions in vertebrate habituation learning and the startle sensitivity threshold. PLoS One. 17 (7), e0270903(2022).
- Thyme, S. B., et al. Phenotypic landscape of schizophrenia-associated genes defines candidates and their shared functions. Cell. 177 (2), 478-491.e20 (2019).
- OECD. Test No. 203: Fish, Acute Toxicity Test. OECD Guidelines for the Testing of Chemicals, Section 2. , OECD Publishing. Paris. (2019).
- Kluver, N., et al. Fish embryo toxicity test: identification of compounds with weak toxicity and analysis of behavioral effects to improve prediction of acute toxicity for neurotoxic compounds. Environ Sci Technol. 49 (11), 7002-7011 (2015).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hear Res. 341, 220-231 (2016).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLoS One. 12 (4), e0175420(2017).
- van den Bos, R., et al. Early life exposure to cortisol in zebrafish (Danio rerio): similarities and differences in behaviour and physiology between larvae of the AB and TL strains. Behavl Pharmacol. 30 (2-3), 260-271 (2019).
- Felsenfeld, A. L., Walker, C., Westerfield, M., Kimmel, C., Streisinger, G. Mutations affecting skeletal-muscle myofibril structure in the zebrafish. Development. 108 (3), 443-459 (1990).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Biophys Res Commun. 423 (4), 785-788 (2012).
- Shahid, M., et al. Zebrafish biosensor for toxicant induced muscle hyperactivity. Sci Rep. 6, 23768(2016).
- Winter, M. J., et al. Functional brain imaging in larval zebrafish for characterising the effects of seizurogenic compounds acting via a range of pharmacological mechanisms. Br J Pharmacol. 178 (13), 2671-2689 (2021).
- Vorhees, C. V., Williams, M. T., Hawkey, A. B., Levin, E. D. Translating neurobehavioral toxicity across species from zebrafish to rats to humans: Implications for risk assessment. Front Toxicol. 3, 629229(2021).
- Scholz, S., et al. The zebrafish embryo model in environmental risk assessment--applications beyond acute toxicity testing. Environ Sci Pollut Res Int. 15 (5), 394-404 (2008).
- Dutra Costa, B. P., Aquino Moura, L., Gomes Pinto, S. A., Lima-Maximino, M., Maximino, C. Zebrafish models in neural and behavioral toxicology across the life stages. Fishes. 5 (3), 23(2020).
- Wolman, M. A., et al. A genome-wide screen identifies PAPP-AA-mediated IGFR signaling as a novel regulator of habituation learning. Neuron. 85 (6), 1200-1211 (2015).
- Marsden, K. C., et al. A Cyfip2-dependent excitatory interneuron pathway establishes the innate startle threshold. Cell Rep. 23 (3), 878-887 (2018).
- Jain, R. A., et al. A forward genetic screen in zebrafish identifies the g-protein-coupled receptor CaSR as a modulator of sensorimotor decision making. Curr Biol. 28 (9), 1357-1369.e5 (2018).
- Nelson, J. C., et al. Acute regulation of habituation learning via posttranslational palmitoylation. Curr Biol. 30 (14), 2729-2738.e4 (2020).
- Meserve, J. H., et al. A forward genetic screen identifies Dolk as a regulator of startle magnitude through the potassium channel subunit Kv1.1. PLoS Genet. 17 (6), e1008943(2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유