Method Article
Bewertung der Toxizität von Chemikalien mit einem Zebrafisch-Vibrations-Startle-Response-Screening-System
In diesem Artikel
Zusammenfassung
Wir beschreiben den Arbeitsablauf und die Datenanalyse eines Screening-Systems zur Bewertung der Toxizität chemischer Verbindungen basierend auf der Vibrationsschreckreaktion des Zebrafischembryos. Das System zeichnet die Bewegungen von Zebrafischembryonen bei Exposition gegenüber einem Vibrationsreiz auf und ermöglicht eine integrierte Bewertung der allgemeinen Toxizität/Letalität und der neuromuskulären Toxizität.
Zusammenfassung
Wir haben ein einfaches Screening-System zur Bewertung der neuromuskulären und allgemeinen Toxizität in Zebrafischembryonen entwickelt. Das modulare System besteht aus elektrodynamischen Schallköpfen, über denen Gewebekulturschalen mit Embryonen platziert werden können. Mehrere solcher Lautsprecher-Gewebe-Kulturschalenpaare können kombiniert werden. Von den elektrodynamischen Wandlern erzeugte Vibrationsreize induzieren bei den Embryonen eine charakteristische Schreck- und Fluchtreaktion. Ein riemengetriebener Linearantrieb positioniert sequentiell eine Kamera über jedem Lautsprecher, um die Bewegung der Embryonen aufzuzeichnen. Auf diese Weise können Veränderungen der Schreckreaktion aufgrund von Letalität oder neuromuskulärer Toxizität chemischer Verbindungen sichtbar gemacht und quantifiziert werden. Wir präsentieren ein Beispiel für den Arbeitsablauf für das Screening chemischer Verbindungen mit diesem System, einschließlich der Präparation von Embryonen und Behandlungslösungen, des Betriebs des Aufzeichnungssystems und der Datenanalyse zur Berechnung von Benchmark-Konzentrationswerten der im Assay aktiven Verbindungen. Der modulare Aufbau auf Basis handelsüblicher einfacher Komponenten macht dieses System sowohl wirtschaftlich als auch flexibel an die Bedürfnisse der jeweiligen Laboraufbauten und Screening-Zwecke anpassbar.
Einleitung
In den letzten Jahren haben sich Zebrafische zu sehr beliebten Modellorganismen für die Bewertung chemischer Verbindungen entwickelt, die Forschungsbereiche von der Arzneimittelentwicklung bis zur Umwelttoxikologie umfassen1. Als Wirbeltiere teilen Zebrafische viele Aspekte ihres Erbguts und ihrer allgemeinen Physiologie mit dem Menschen 2,3. Daher sind die in diesem Modell erzielten Ergebnisse oft direkt für die menschliche Gesundheit relevant. Mehrere Arzneimittelkandidaten, die sich derzeit in klinischen Studien befinden, wurden in Wirkstoff-Screenings mit Zebrafischidentifiziert 4.
Die Toxizitätsbewertung ist eine wichtige Anwendung, bei der Tests mit Zebrafisch-Embryonalstadien von Interesse sind. Für die Verwendung von Zebrafischen bei Umwelttoxizitätsprüfungen gibt es verschiedene Prüfrichtlinien der Organisation für wirtschaftliche Zusammenarbeit und Entwicklung (OECD) 5,6. Die geringe Größe und die schnelle Entwicklung von Zebrafischembryonen machen sie sehr gut geeignet für Screening-Ansätze im mittleren bis hohen Durchsatzmaßstab 1,3,4. Zu den toxikologischen Endpunkten, auf die solche Screenings abzielen, gehören embryonale Missbildungen und Letalität7, endokrine Störungen8, Organtoxizität9 und Verhaltensbewertungen, die auf neuronale Toxizität hinweisen10,11. Die Verhaltenstests sind möglich, weil Zebrafischembryonen je nach Entwicklungsstadium verschiedene Arten von Bewegungsreaktionen auf unterschiedliche Reize zeigen. Zum Beispiel zeigen Embryonen 1 Tag nach der Befruchtung (dpf) eine spontane Schwanzspirale12 und reagieren auf eine Abfolge von Lichtimpulsen mit einer typischen Abfolge von Bewegungen, der sogenannten photomotorischen Reaktion (PMR)10. Nach dem Schlüpfen, das typischerweise etwa 48-72 Stunden nach der Befruchtung (hpf) erfolgt, entwickeln die frei schwimmenden Eleutheroembryonen13 allmählich Schreck- und Fluchtreaktionen auf Vibrationsreize, beginnend mit etwa 4 dpf14. Diese Reaktionen sind gekennzeichnet durch eine ausgeprägte Biegung in die entgegengesetzte Richtung des Reizes (die sogenannte C-Biegung oder C-Start), gefolgt von einer kleineren Gegenbiegung und einem kleineren Schwimmverhalten 14,15,16,17. Insbesondere werden embryonale Verhaltensweisen von neuronalen Schaltkreisen gesteuert, die verschiedene Neurotransmittersysteme verwenden, was es ermöglicht, chemische Verbindungen zu untersuchen, die auf diese Systeme abzielen. Zum Beispiel zeigte der PMR-Assay die Auswirkungen von Verbindungen, die die cholinerge, adrenerge und dopaminerge Signalgebung stören10, während die Schreckreaktion cholinerge, glutamaterge und glycinerge Neuronen betrifft16,18. Darüber hinaus beeinflussen Verbindungen, die die Muskeln oder die neuromuskuläre Schnittstelle schädigen, diese Verhaltensweisen ebenfalls, ebenso wie Verbindungen, die für die Haarzellen des Innenohrs/der Seitenlinie toxisch sind19,20. Die Beobachtung des Bewegungsverhaltens von Zebrafischen als Reaktion auf einen Reiz ist daher ein geeignetes Mittel, um nicht nur die Neurotoxizität, sondern auch die Ototoxizität und Myotoxizität zu beurteilen. Die Bewertung des Bewegungsverhaltens dient auch als Proxy für die allgemeine Toxizitäts-/Letalitätsbewertung, da sich tote Embryonen nicht bewegen. Dabei stellt das embryonale Fortbewegungsverhalten eine integrative Auswertung für einen First-Tier-Toxizitäts-Screening-Ansatz dar, der tödliche und neuromuskuläre Substanzeffekte in einem Setup anzeigt. Da die Eleutheroembryonen bereits in der Lage sind, Verbindungen zu metabolisieren, kann der Ansatz auch die Auswirkungen von metabolischen Transformationsprodukten nachweisen 7,21,22. Wichtig ist, dass Zebrafischembryonen nach einigen Tierschutzgesetzen erst im Stadium der freien Fütterung nach 120 hpf13 als geschütztes Lebensstadium angesehen werden. Daher gelten sie als Alternative zu Tiertoxizitätstests.

Abbildung 1: Einrichtung des Vibrations-Schreckreaktionssystems. (A) Überblick über das System. Platten mit Embryonen, die den Testverbindungen ausgesetzt sind, werden auf das elektrodynamische Wandlerarray ("Lautsprecher") gelegt. Die Kamera wird durch den riemengetriebenen Linearantrieb sequentiell in die Aufnahmeposition über dem Zielaufnehmer bewegt. (B) Detailansicht des Schallkopfs/Lautsprechers mit eingesetzter Gewebekulturschale oben. Die Platten werden von unten durch eine LED-Lichtfolie mit 4000-5000 Lux beleuchtet. Ein LED-Licht neben dem Lautsprecher leuchtet auf, während der Stimulus gegeben wird. (C) Standbild des Videos, das von der Kamera bei der Stimulation der Embryonen aufgenommen wurde. (D) Screenshot der Konfigurationsdatei. (E) Screenshot der Oberfläche der Aufnahmesoftware. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Hier beschreiben wir ein Testprotokoll zur Bewertung von zusammengesetzten Effekten auf die Vibrationsschreckreaktion unter Verwendung einer selbst gebauten einfachen Testvorrichtung, die auf Vibrationsreizen basiert, die von elektrodynamischen Wandlern erzeugt werden, gekoppelt mit einer automatisierten Videoaufzeichnung mehrerer frei beweglicher Embryonen in einer Gewebekulturschale23. Das System ist modular aufgebaut und ermöglicht die sequentielle Aufzeichnung von mehreren Gewebekulturschalen parallel. In dem derzeit verwendeten Aufbau geben fünf elektrodynamische Wandler einen Vibrationsreiz (500 Hz, Dauer 1 ms) an Gewebekulturschalen mit 20 Embryonen ab, die darauf platziert werden (Abbildung 1). Die Platten werden von unten mit 4000-5000 Lux mit LED-Lichtfolien beleuchtet. Ein LED-Licht neben jedem Wandler zeigt die Perioden der Stimulusanwendung an, und ein Oszilloskop zeigt Wellenformen und Frequenz des angelegten Stimulus an (Details siehe Ref. 23). Das Verhalten der Embryonen wird von einer Hochgeschwindigkeitskamera (Table of Materials) mit 1000 Bildern pro Sekunde (fps) aufgezeichnet, die durch einen riemengetriebenen Linearantrieb über den Zielsprecher bewegt wird. Diese Aufnahmegeschwindigkeit ist erforderlich, um die Schreckreaktion zuverlässig aufzulösen. Das System bietet eine kostengünstige, individuell anpassbare Alternative zu aktuellen kommerziellen Systemen. Der im Folgenden beschriebene genaue Arbeitsablauf wird derzeit im Rahmen der Präzisionstoxikologie-Initiative24 durchgeführt, um geeignete Expositionsbedingungen für die OMICS-Datenerfassung von Zebrafischembryonen zu bestimmen, die mit einem ausgewählten Satz von Giftstoffen behandelt wurden.
Protokoll
Die gesamte Zebrafischhaltung und -behandlung erfolgte in Übereinstimmung mit den deutschen Tierschutzstandards und wurde von der Regierung Baden-Württemberg, Regierungspräsidium Karlsruhe, Deutschland genehmigt (Aktenzeichen 35-9185.64/BH KIT).
1. Herstellung von Stammlösungen der zu prüfenden Chemikalien
- Beschriften Sie das Glasfläschchen (oder das chemische Aliquot) mit dem Namen der Verbindung/Abkürzung, der Stammkonzentration und dem Zubereitungsdatum. Zum Beispiel CdCl2_2,5 g· L-1_210813.
- Zentrifugieren Sie das chemische Aliquot bei 2000 x g für 1 min bei Raumtemperatur (RT).
- Unter einem Abzug wird die Verbindung (falls erforderlich) auf einer Waage mit einer Empfindlichkeit von 0,001 g gewogen und in die gekennzeichnete Durchstechflasche umgefüllt. Wenn es sich bei der Verbindung um eine Flüssigkeit handelt, geben Sie sie mit einer Pipette und einer Pipettenspitze aus Kunststoff in die Durchstechflasche.
HINWEIS: Für den Tricain-Methansulfonat-Bestand, der im Ergebnisbeispiel in Abbildung 2 verwendet wurde, wurden beispielsweise 400 mg in die beschriftete Durchstechflasche gewogen. - Fügen Sie Lösungsmittel (z. B. steriles Reinwasser oder Dimethylsulfoxid (DMSO), abhängig von den physikalisch-chemischen Eigenschaften der Verbindungen) mit einer Pipette und einer Kunststoffpipettenspitze hinzu. Wenn möglich, ist Wasser das bevorzugte Lösungsmittel.
HINWEIS: Für die Tricain-Brühe wurde beispielsweise eine 15,3 mM Lösung in 100 ml Wasser hergestellt. - Verschließen Sie die Durchstechflasche, schütteln Sie sie vorsichtig und prüfen Sie sie auf Ausfällung.
- Bereiten Sie verdünnte Stammlösungen (falls erforderlich) in Glasdurchstechflaschen mit Pipetten und Kunststoffpipettenspitzen vor.
HINWEIS: Zum Beispiel war keine weitere Verdünnung für die Tricain-Brühe erforderlich. - Lagern Sie die Stammlösung(en) bis zur Verwendung bei -20 °C.
- Lagern Sie das restliche chemische Aliquot unter den gleichen Bedingungen wie zuvor.
- Notieren Sie die aliquoten Informationen im Labornotizbuch.
2. Sammeln und Aufziehen von Zebrafischembryonen
- Embryonen in Spaltungsstadien (2-8 Zellstadien) aus dem natürlichen Laichen von Gruppenpaarungen in 10 cm großen Gewebekulturschalen sammeln.
- Wählen Sie eine Charge von geeigneter Qualität: weniger als 10% unbefruchtete/tote Eier.
- Reinigen Sie das Geschirr (entfernen Sie unbefruchtete Eier, Schmutz, Schuppen usw.).
- Legen Sie 60 Embryonen pro 10 cm Gewebekulturschale in 15 ml E3-Medium (5 mM NaCl, 0,17 mM KCl, 0,33 mM CaCl2, 0,33 mM MgSO4)25.
- Stellen Sie das Geschirr in eine befeuchtete Kammer, indem Sie mit Wasser getränkte Papiertücher auslegen.
- Embryonen bis 72 hpf in einem Inkubator bei 28,5 °C aufziehen.
3. Vorbereitung der Arbeitsverdünnung der zu prüfenden Chemikalien
- Die Stammlösung aus dem -20 °C Gefrierschrank nehmen und auftauen lassen.
- Wenn die Löslichkeit der Verbindung hoch genug ist, bereiten Sie serielle Verdünnungen in E3-Medium in Glasflaschen vor, 1 ml pro Replikat und Konzentration. Stellen Sie sicher, dass die Konzentration 10-mal höher ist als die gewünschte Expositionskonzentration. Dadurch wird vermieden, dass das gesamte Medium der Embryonen zu Beginn der Exposition gewechselt werden muss. Bei geringer Löslichkeit werden die seriellen Verdünnungen direkt bei den gewünschten Expositionskonzentrationen von 10 ml pro Replikat und Konzentration hergestellt.
- Auf Niederschlag prüfen (falls erforderlich). Wenn die Lösung ausgefällt wurde, notieren Sie dies und verdünnen Sie sie weiter, um die nächsthöhere Konzentration zu erreichen. Überprüfen Sie erneut auf Niederschlag. Wiederholen Sie den Vorgang, bis kein Niederschlag mehr fällt.
- Überprüfen Sie den pH-Wert der Expositionslösung. Wenn sie außerhalb des Bereichs von pH 7,0-8,5 liegen, notieren Sie dies und bereiten Sie die Lösungen in E3 mit 5 mM HEPES/pH 7,4 vor, wobei Sie den pH-Wert mit HCl oder NaOH einstellen.
- Entsorgen Sie unbenutzte Expositionsmedien gemäß den örtlichen Vorschriften.
4. Embryonen den zu testenden Chemikalien aussetzen
- Überprüfen Sie das Geschirr mit den 72 hpf alten Embryonen auf tote/nicht geschlüpfte Embryonen und entfernen Sie diese. Wenn eine Embryonencharge mehr als 5 % nicht geschlüpfte Eier enthält, entfernen Sie die Charge.
- Legen Sie 10 Embryonen pro 6 cm Gewebekulturschale in 9 ml E3-Medium (Expositionsplatte).
- Beschriften Sie die Expositionsplatten mit dem Namen der Verbindung, der Expositionskonzentration und der Replikatnummer. Zum Beispiel: "CdCl2 1 mg· L-1 01". Fügen Sie bei Bedarf ausreichend E3-Platten und eine Lösungsmittelkontrollplatte hinzu (siehe Abschnitt 5).
- Geben Sie 1 ml Expositionslösung auf jede Platte, beginnend mit der niedrigsten Konzentration, und schwenken Sie die Platte. Bei Verbindungen mit geringer Löslichkeit sind die gesamten 10 ml der Platte durch die Expositionslösung zu ersetzen (siehe Schritt 3.2).
- Notieren Sie die zeitliche Reihenfolge, in der den Embryonen zusammengesetzte Lösungen zugesetzt wurden.
- Inkubieren Sie die Platten in der befeuchteten Kammer in einem Inkubator bei 28,5 °C für 48 h, bis sie 120 hpf erreichen.
5. Durchführung des Vibrations-Schrecktests
HINWEIS: Analysieren Sie die Platten in der gleichen Reihenfolge wie in Schritt 4.5 beschrieben. Jeder Lauf sollte eine E3-Steuerplatte enthalten.
- Schalten Sie den Computer und das Vibrationsgerät ein (blaues LED-Licht sollte leuchten).
- Bereiten Sie die Konfigurationsdatei in einer Tabelle vor, wie in Abbildung 1D zu sehen und als Zusatzdatei 1 angehängt. Aufzeichnungsinformationen für jede der 5 Plattenpositionen (Verbindung, Konzentration, Replikat).
- Öffnen Sie das Programm für die allgemeine Benutzeroberfläche (GUI) (verfügbar unter https://git.scc.kit.edu/xk4962/vibration-startle-assay-kit, Projekt-ID 43215).
- Überprüfen Sie die Kamerabewegung, indem Sie die verschiedenen Positionen im GUI-Programm auswählen und die Kamerabewegung beobachten.
- Nehmen Sie die zu messenden Probenplatten aus dem Inkubator. Legen Sie die Probenplatten auf die 5 Positionen (siehe Abbildung 1A, "Lautsprecher") und lassen Sie die Embryonen einige Minuten ruhen.
- Klicken Sie auf Aufnehmen; Es öffnet sich ein Fenster, in dem Sie die Konfigurationsdatei auswählen können.
- Wählen Sie die entsprechende Konfigurationsdatei aus, die in Schritt 5.2 für diese Ausführung vorbereitet wurde.
- Prüfen Sie, ob die Probenbeschreibung mit den Proben an jeder Position (1-5) übereinstimmt.
- Die Messung erfolgt automatisch (10 s / Position). Wenn der Tonimpuls vom Programm angelegt wird, leuchtet eine LED auf. Die Aufzeichnung für 10 s/Position ermöglicht es, genügend Daten zu sammeln, um die Schwimmgeschwindigkeit und die zurückgelegte Strecke sowohl vor als auch nach dem Anwenden des Stimulus abzuschätzen, und verhindert die Gewöhnung an nachfolgende Reize.
- Wenn die Aufnahme abgeschlossen ist, kehrt die Kamera zu Position 1 zurück und die Software beginnt mit der Komprimierung der Dateien. Ersetzen Sie während dieser Zeit die Proben durch den nächsten Satz, der gemessen werden muss.
- Fahren Sie mit Schritt 5.2 fort. , um die nächste Ausführung aufzuzeichnen.
- Wenn alle Platten gemessen wurden, sammeln Sie die Belichtungslösungen. Verwenden Sie ein Sieb, um die Embryonen aufzubewahren.
- Euthanasieren Sie die Embryonen durch schnelles Abkühlen in einem Eis/Isopropanol (5%) Bad.
- Entsorgen Sie die Expositionslösungen und toten Embryonen gemäß den örtlichen Vorschriften.
6. Datenanalyse
- Öffnen Sie die Videodaten mit VirtualDub (1.10.4).
- Bewerten Sie visuell die Anzahl der Embryonen, die auf den Schallimpuls reagieren (wenn die Kontroll-LED leuchtet).
- Geben Sie Daten in eine Tabelle ein. Notieren Sie den Namen der Verbindung, das Replikat, die Konzentration der Verbindung und den Prozentsatz der unbeweglichen Embryonen gemäß der Vorlage in der Zusatzdatei 2, die den in Abbildung 2C gezeigten Beispieldatensatz enthält.
HINWEIS: Die Vorlage ist flexibel aufgebaut und ermöglicht grundsätzlich die Anwendung für Daten anderer Organismen und Endpunkte. Es beschreibt die Reaktionen für jede Konzentration und enthält auch Endpunktbeschreibungen sowie Definitionen der Parameter, die in der anschließenden Konzentrations-Wirkungs-Modellierung generiert werden. - Führen Sie die Benchmark-Konzentrationsanalyse (BMC) mit einem KNIME-Workflow (KNIME analytics 4.626) mit eingebetteten R-Skripten (R-Version 3.6., R-Pakete plotrix, drc und bmd27,28) durch.
HINWEIS: Grundsätzlich könnte die Bewertung auch direkt in R durchgeführt werden. Der Einfachheit halber und um die Bewertung als webbasierten Service zu ermöglichen, wurde die Analyse jedoch in einem KNIME-Server-konformen Workflow organisiert. Die Ausgabe des KNIME-Workflows wird in der Zusatzdatei 3 bereitgestellt. Weitere Informationen zu den vom KNIME-Workflow generierten statistischen Parametern finden Sie in dieser Vorlage. Die statistischen Parameter zur Schätzung der Anpassungsgüte und der Schwellenwerte für die Annahme bestimmter BMC-Werte sind in Tabelle 1 aufgeführt. Der KNIME-Workflow selbst ist über GitHub (https://github.com/precisiontox/range-finding-drc) verfügbar. Die Konzentrations-Wirkungs-Beziehung wird mit einem log-logistischen Modell mit 4 Parametern modelliert. Zwei der Kurvenanpassungsparameter können festgelegt werden. Normalerweise würde man das Maximum bei prozentualen Daten auf 100 festlegen. Falls keine Hintergrundeffekte beobachtet werden, kann das Minimum auf 0% festgelegt werden.
Ergebnisse
Abbildung 2A zeigt den Prozentsatz der unbeweglichen Embryonen in 48 Gelege unbehandelter Wildtyp-Embryonen (AB2O2-Stamm). Im Durchschnitt reagieren 14,33% der unbehandelten Wildtyp-Embryonen nicht auf den Vibrationsreiz. In 4 Gelegen erreichte der Prozentsatz der unbeweglichen Larven 50 %, aber 75 % der Gelege hatten einen Anteil an unbeweglichen Larven unter 20 %.
Abbildung 2B,C zeigt ein Beispiel für eine typische Berechnung einer Benchmark-Konzentration/-Dosis (BMC/BMD29,30) für zusammengesetzte Effekte auf die Motilität mit dem Vibrations-Startle-Assay-Arbeitsablauf, wie er derzeit im Rahmen des PrecisionTox-Konsortiumsdurchgeführt wird 24. BMC10-, BMC25- und BMC50-Werte entsprechen den Konzentrationen, bei denen 10 %, 25 % bzw. 50 % der Embryonen einen höheren Unmutsgrad aufweisen als der Hintergrund. In diese Berechnung werden nur Embryonen einbezogen, die völlig unbeweglich sind, nicht solche, die noch Teilreaktionen zeigen, wie z.B. nur eine C-Biegung ohne anschließendes Fluchtschwimmen oder nur Schwanzbewegungen (Abbildung 2B). Die Embryonen wurden 8 Konzentrationen des Natriumkanalinhibitors Tricainmethansulfonat ausgesetzt, der häufig für die Fischanästhesie verwendet wird31. Die Daten deuten auf einen Hintergrundpegel von etwa 25 % Unbeweglichkeit als Reaktion auf den Vibrationsreiz hin. Ab 1 % Tricain wird die Motilität reduziert und hört dann über 2,5 % auf. Der KNIME-Workflow berechnet den BMC50 mit 164,9 μM, was 1,07 % Tricain und einem Imkotilitätsgrad von 75 % entspricht (Abbildung 2C). Die kleinen 95%-Konfidenzintervalle (angezeigt durch die grauen Schattierungen in der Kurve) weisen auf eine robuste Reproduzierbarkeit der Motilitätswerte in diesem Assay hin.
Abbildung 2D zeigt ein Beispiel für einen suboptimalen Assay-Lauf, dessen Daten nicht für BMC-Berechnungen verwendet werden sollten. Fünf E3-behandelte Kontrollgruppen mit unterschiedlichen Embryonen, die aus demselben Gelege stammen, sind dargestellt (AB2O2 [Wildtyp-Stamm] repliziert 1-5). Nur die erste Gruppe zeigt eine nahezu normale Reaktion von etwa 25 %, die mit den Literaturwerten32 und denen des hier beschriebenen Assays übereinstimmt, wie in Abbildung 2A gezeigt, während alle anderen Gruppen reduzierte und/oder unvollständige Verhaltensreaktionen zeigen (z. B. nur eine C-Biegung, auf die keine Schwimmaktivität folgt, oder Motilität ohne klare C-Biegung zu Beginn). Eine solche Reaktion kann auftreten, wenn sich Embryonen nicht richtig entwickeln und sich aufgrund einer Entwicklungsverzögerung in einem unreifen Zustand befinden, was sich auf die Robustheit der Schreckreaktion auswirkt14,33.
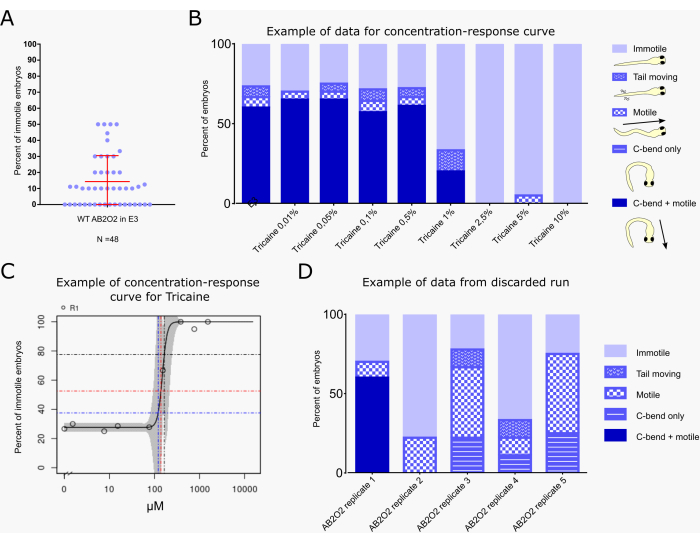
Abbildung 2: Beispiel für ein typisches Ergebnis, einschließlich der Berechnung der Benchmark-Dosis. (A) Prozentsatz der nicht ansprechenden Embryonen nach dem Schallimpuls für unbehandelte Wildtyp-Larven für 48 Gelege (n = 10 pro Gelege). Der Mittelwert (14,33 %) und die Standardabweichung (±16,19 %) sind rot dargestellt. (B) Bewertung des Schreckreaktionsverhaltens von Embryonen (n = 20 pro Zustand), die mit der angegebenen Tricainkonzentration im E3-Medium oder mit E3 allein als Kontrolle behandelt wurden. Das Verhalten wird nach dem Farbschema und den Karikaturen auf der rechten Seite der Grafik klassifiziert, wobei jeder Embryo nur einer der folgenden Klassen zugeordnet ist: "immotil": Embryo zeigt keine Bewegung; "Schwanzbewegung": Embryo zeigt Schwanzbewegungen, aber weder C-Biegung noch Schwimmverhalten; "beweglich": Embryo zeigt Schwimmbewegung, aber keine C-Biegung als Reaktion auf den Schwingungsreiz; "Nur C-Biegung": Embryo zeigt C-Biegung, aber kein Fluchtschwimmen; "C-Biegung + beweglich": Der Embryo zeigt typisches C-Beugeverhalten, gefolgt von Fluchtschwimmen (die typische vollständige Schreckreaktion). Die verschiedenen Verhaltensweisen werden als Prozentsatz der Gesamtzahl der Embryonen für jede Behandlung angezeigt. (C) BMC-Berechnungsdiagramm, das vom KNIME-Workflow generiert wird und den Prozentsatz der "unbeweglichen" Embryonen für jede Behandlungskonzentration angibt. Blaue, rote und schwarze Linien zeigen die BMC10-, BMC25- und BMC50-Werte an, d. h. die Konzentrationen, bei denen 10 %, 25 % bzw. 50 % der Embryonen eine höhere Unbeweglichkeit aufweisen als der Hintergrund. (D) Beispiel für einen verworfenen Testlauf. Es werden fünf E3-behandelte Kontrollläufe mit verschiedenen AB2O2-Wildtyp-Embryonen gezeigt, die aus demselben Gelege stammen (Replikat 1-5). Nur Replikat 1 zeigt eine nahezu normale Reaktion, während die Embryonen der verbleibenden Läufe nicht die typische C-Biegung + Fluchtschwimmen zeigen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Tabelle 1: Statistische Parameter zur Schätzung der Anpassungsgüte und Schwellenwerte für die Annahme bestimmter BMC-Werte. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Eigenschaften einer Auswahl von Schwingungs-Schreckreaktions-Assay-Systemen. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Ergänzende Datei 1: Excel-Vorlage für Konfigurationsdatei. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 2: KNIME-Eingabevorlage mit einem Beispieldatensatz. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Datei 3: Beispiel für eine KNIME-Ausgabedatei. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Wir präsentieren den Arbeitsablauf und die Datenanalyse für die Bewertung chemischer Verbindungen mit einem speziell angefertigten Zebrafisch-Embryo-Vibrations-Startle-Assay-Setup. Der Workflow generiert robuste Daten, die die Berechnung typischer Parameter ermöglichen, die die Toxizität von Verbindungen spezifizieren, wie z. B. Benchmark-Konzentration/-Dosis (BMC/BMD). Die Modularität des Aufbaus ermöglicht die Anpassung an unterschiedliche Anforderungen an Durchsatz und Platzbedarf. Da das System aus kostengünstigen Basalkomponenten besteht, bietet es nach einem relativ einfachen Aufbau eine kostengünstige Alternative zu bestehenden kommerziellen Systemen, die in der Regel für mehrere Assay-Typen gleichzeitig ausgelegt sind, auf proprietärer Software basieren und relativ teuer bleiben.
Sowohl diese kommerziellen Systeme als auch andere kundenspezifische Systeme ermöglichen die Beurteilung einzelner Embryonen oder Larven in Multiwell-Platten (z. B. 12-Well-34, 16-Well-32,35, 24-Well-20,33,36, 48-Well-37, 96-Well-38,39,40,41,42 und sogar 384-Well-Platten [als 4x96-Well]43), aber die räumliche Einschränkung in den Vertiefungen macht die Analyse einiger Datenparameter der Fluchtreaktion (z. B. zurückgelegte Entfernung) schwieriger. Darüber hinaus ist die Bildgebung in einigen dieser Aufbauten auf eine Teilmenge der Wells der Platte beschränkt, was den Durchsatz reduziert36,39. Die Bildgebung von Embryonen in Schalen ermöglicht eine bessere Beurteilung der Parameter der Fluchtreaktion und ermöglicht die Aufzeichnung des Verhaltens mehrerer Embryonen gleichzeitig (z. B. bis zu 30 in einer 6-cm-Schale). Normalerweise ist die schalenbasierte Bildgebung auf eine Schale pro Laufbeschränkt 44,45,46,47,48 (Ausnahmen führen die Bildgebung parallel an 6 Schüsseln mit je einer Larve49 oder an 4 Larven in 2 geteilten Schalen 50 durch), ein Nachteil, der durch parallele Designs wie in unserem Fall gelöst werden kann. Wir haben einige Merkmale des in dieser Studie verwendeten Systems und anderer kommerzieller und kundenspezifischer Lösungen in Tabelle 2 zusammengefasst: 20,32,33,34,35,36,37,38,39,40,41,42,43, 44,45,46,47,48,49,50,
51,52.
Ein Vorteil der Methode ist eine Auslesung, die sowohl Letalität als auch Verhaltensänderungen erfasst, was die Leistung von Toxizitätsbewertungen erhöhen kann. Während beispielsweise gezeigt wurde, dass der akute Toxizitätstest (FET)5 des Zebrafischembryos die Toxizität im akuten Toxizitätstest für erwachsene Fische53 recht gut vorhersagt, wurde seine Vorhersagegenauigkeit durch die Einbeziehung von Verhaltensmessungen54 verbessert. Der Grund dafür ist die schwache Mortalität, die durch neuroaktive Verbindungen in Fischembryonen induziert wird, wahrscheinlich aufgrund des fehlenden Atemversagenssyndroms, das eine erhöhte Toxizität bei juvenilen oder erwachsenen Fischen verursacht. Neuroaktivität kann jedoch durch Verhaltensbeurteilung identifiziert werden. Darüber hinaus können Verhaltensmessungen auch myotoxische und ototoxische Wirkungen sowie andere, subtilere toxische Wirkungen auf die Physiologie erfassen, die subletal sind, aber die Verhaltensleistung des Organismus beeinflussen.
Bei der Durchführung des Assays ist es wichtig, den richtigen Umgang mit Verbindungen sicherzustellen und eine homogen entwickelte Charge von Zebrafischembryonen zu verwenden. Daher sollte die Verwendung von Glasfläschchen für die Lagerung von Verbindungen den Rückgang der Konzentrationen von Chemikalien, insbesondere von hydrophoben Verbindungen, aufgrund der Absorption an Kunststoffmaterial minimieren. Bei Verbindungen mit hohem Absorptionspotenzial zu "plastischem" Polystyrol können auch Glasplatten für die Inkubation verwendet werden. Die Reinigung der Eizellen in den Gewebekulturschalen, die zur Entnahme und Entfernung toter Embryonen verwendet werden, ist ein entscheidender Schritt, um eine Standardentwicklung zu gewährleisten. Eine normale Entwicklungsgeschwindigkeit ist wichtig, da Entwicklungsverzögerungen die Reife neuronaler Netze beeinträchtigen können, die dem bewerteten Verhalten zugrunde liegen14,33. Um einen Vergleich der zusammengesetzten Effekte zu ermöglichen, sollten Eier vom selben Stamm stammen, da verschiedene Stämme unterschiedliche Verhaltensprofile aufweisen 38,55,56,57. Während der Exposition ist es wichtig, die Embryonen in einer befeuchteten Kammer zu inkubieren, um eine übermäßige Verdunstung des E3-Mediums zu vermeiden, die die getesteten Konzentrationen verändern würde.
E3-Kontrollen sollten in jeden Durchlauf integriert werden, um das Ausgangsansprechniveau der jeweiligen Charge von Embryonen zu bestimmen, die in der Testreihe verwendet wurden. In der Regel führen wir eine Platte mit Kontrollen entlang jedes Satzes von 5 Messungen durch. Wie in Abbildung 2D dargestellt, ermöglicht dieser Ansatz auch den Nachweis von Chargen mit suboptimalen Reaktionen aufgrund verzögerter Entwicklung oder aus anderen Gründen, wie z. B. genetischen Hintergrundeffekten. Achten Sie bei unerwarteter mangelnder Reaktion auf den Reiz auch auf einen möglichen Ausfall des Wandlers. Typischerweise zeigen die Schreckreaktionen ein sigmoidales Konzentrations-Antwort-Verhalten, das eine Kurvenanpassung unter Verwendung eines log-logistischen Modells ermöglicht. In seltenen Fällen mit biphasischen Antworten müssen jedoch möglicherweise andere Modelle verwendet werden, wie z. B. Gaußsche oder Cedergreen-Modelle. Sie sind in den R-Paketen drc und bdm27,28 erhältlich.
Die fehlende Reaktion auf den Schwingungsreiz kann einfach auf den Tod der Embryonen oder stark beeinträchtigte Lebensfunktionen aufgrund allgemeiner Zytotoxizität hinweisen, könnte aber auch eine spezifischere Toxizität widerspiegeln, die auf neuronale Schaltkreise der Reizwahrnehmung, -integration und -fortbewegung abzielt. Andere mögliche zusammengesetzte Effekte sind Interferenzen mit der neuromuskulären Schnittstelle oder mit Muskelstruktur und -funktion. Um zwischen diesen Möglichkeiten zu unterscheiden, sind weitere Assays notwendig. Beispielsweise kann die strukturelle Integrität der Muskeln mit einem Doppelbrechungstest58,59 beurteilt werden, und transgene Linien stehen zur Verfügung, um die Perurbanenz der Muskel- und Nervenfunktionzu beurteilen 60,61. Die aufgezeichneten Videodaten erlauben jedoch bereits eine detailliertere Analyse der Morphologie und der Verhaltensreaktion der Embryonen, die erste zusätzliche Informationen liefern kann. Ist nur die C-Biegung beeinträchtigt oder die gesamte Motilität? Sind noch Reste neuromuskulärer Aktivität vorhanden, die sich in schwachen oder zitternden Schwanzbewegungen zeigen? Gehen solche veränderten Verhaltensweisen mit Veränderungen in der Morphologie einher, wie z. B. Ödemen oder erhöhter Körperverkrümmung? Zusätzlich können Parameter wie die Latenzzeit bis zur C-Biegung oder die während der Fluchtreaktion zurückgelegte Strecke ausgewertet werden (siehe z.B. Ref. 44).
Das hier beschriebene Screening-Protokoll ermöglicht eine schnelle und robuste Bewertung der Toxizität von Verbindungen, mit dem zusätzlichen Nutzen, dass nicht-tödliche neurotoxische, ototoxische und myotoxische Verbindungen spezifisch nachgewiesen werden. Der bereitgestellte Analyse-Workflow ist einfach zu implementieren und bietet eine robuste Auslesung. Modifikationen der Stimulusprotokolle, die im Vibrationsschreck-Assay verwendet werden, wurden verwendet, um auch zusammengesetzte Effekte auf komplexere Aspekte des Schreckverhaltens zu untersuchen, wie z. B. Prepuls-Hemmung (PPI)39,44 und Gewöhnung32,33, und könnten an den in dieser Studie verwendeten elektrodynamischen Wandler-basierten Stimulusaufbau angepasst werden.
Eine Hauptanwendung von Startle-Response-basierten Screening-Systemen ist die Bewertung von Substanzeffekten in chemischen Screenings, die sowohl für die Bewertung der Humantoxizität als auch für die Arzneimittelentwicklung von Bedeutung ist 1,4,62. Gleichzeitig haben die erzielten Ergebnisse durch die Prüfung der frühen Lebensstadien eines Wasserorganismus eine direkte Relevanz für die ökotoxikologische Risikobewertung63,64. Darüber hinaus können Schreckreaktionssysteme für die Verhaltensphänotypisierung in genetischen Screenings verwendet werden 65,66,67,68,69. Unser einfach zu implementierendes und anpassungsfähiges System bietet kleineren Laboren, die ihre eigenen spezifischen Screening-Projekte in diesen verschiedenen Anwendungsbereichen durchführen möchten, ein erschwingliches Setup.
Offenlegungen
Wir haben nichts offenzulegen.
Danksagungen
Wir danken dem Support-Personal der IBCS-BIP-Fischanlage und des Screening-Zentrums für die hervorragende technische Unterstützung. Diese Arbeit wurde durch das Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Finanzhilfevereinbarung Nr. 965406 (PrecisionTox) finanziert. Diese Ausgabe spiegelt nur die Meinung der Autoren wider, und die Europäische Union kann nicht für die Verwendung der darin enthaltenen Informationen verantwortlich gemacht werden.
Materialien
| Name | Company | Catalog Number | Comments |
| Fine test sieves, Brass frame, pore size 250 μm | Sigma-Aldrich | Z289744-1EA | Or comparable material |
| High-speed camera | XIMEA | MQ013MG-ON USB 3 | |
| Laboratory Bottles, Narrow Neck, with Screw Cap | VWR | 215-3261 | Reference number for 50 mL, available up to 20 L. Or comparable material |
| Pipette tip, working volume: 10 µL | SARSTEDT | 70.3010.210 | Or comparable material |
| Pipette tip, working volume: 1000 µL | SARSTEDT | 70.3050.100 | Or comparable material |
| Pipette tip, working volume: 20 µL | SARSTEDT | 70.3020.210 | Or comparable material |
| Pipette tip, working volume: 200 µL | SARSTEDT | 70.3030.100 | Or comparable material |
| Serological pipette 10 mL | SARSTEDT | 86.1254.001 | Or comparable material |
| Serological pipette 25 mL | SARSTEDT | 86.1685.001 | Or comparable material |
| Serological pipette 5 mL | SARSTEDT | 86.1253.001 | Or comparable material |
| Tissue culture dish 60,0 mm/15,0 mm vented (Polystyrene) | Greiner bio-one | 628102 | Or comparable material |
| Tissue culture dish 100, suspension (Polystyrene) | SARSTEDT | 83.3902.500 | Or comparable material |
| Transfer pipette 6 mL | SARSTEDT | 86.1175 | Or comparable material |
| Tube 15 mL 120 mm x 17 mm PP | SARSTEDT | 62.554.502 | Or comparable material |
| Tube 50 mL 114mm x 28 mm PP | SARSTEDT | 62.5472.54 | Or comparable material |
Referenzen
- MacRae, C. A., Peterson, R. T. Zebrafish as a mainstream model for in vivo systems pharmacology and toxicology. Annu Rev Pharmacol Toxicol. 63, 43-64 (2023).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Choi, T. Y., Choi, T. I., Lee, Y. R., Choe, S. K., Kim, C. H. Zebrafish as an animal model for biomedical research. Exp Mol Med. 53 (3), 310-317 (2021).
- Patton, E. E., Zon, L. I., Langenau, D. M. Zebrafish disease models in drug discovery: from preclinical modelling to clinical trials. Nat Rev Drug Discov. 20 (8), 611-628 (2021).
- OECD. Test No. 236: Fish embryo acute toxicity (FET) Test. OECD Guidelines for the Testing of Chemicals, Section 2. , (2013).
- OECD. Test No. 250: EASZY assay - Detection of endocrine active substances, acting through estrogen receptors, using transgenic tg(cyp19a1b:GFP) zebrafish embryos. OECD Guidelines for the Testing of Chemicals, Section 2. , (2021).
- Braunbeck, T., et al. The fish embryo test (FET): origin, applications, and future. Environ Sci Pollut Res Int. 22 (21), 16247-16261 (2015).
- Weger, B. D., Weger, M., Nusser, M., Brenner-Weiss, G., Dickmeis, T. A Chemical screening system for glucocorticoid stress hormone signaling in an intact vertebrate. ACS Chem Biol. 7 (7), 1178-1183 (2012).
- Pandey, G., Westhoff, J. H., Schaefer, F., Gehrig, J. A Smart imaging workflow for organ-specific screening in a cystic kidney zebrafish disease model. International Journal of Molecular Sciences. 20 (6), 1290 (2019).
- Kokel, D., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nat Chem Biol. 6 (3), 231-237 (2010).
- Zhang, K., Liang, J., Brun, N. R., Zhao, Y., Werdich, A. A. Rapid zebrafish behavioral profiling assay accelerates the identification of environmental neurodevelopmental toxicants. Environ Sci Technol. 55 (3), 1919-1929 (2021).
- Ogungbemi, A. O., Teixido, E., Massei, R., Scholz, S., Kuster, E. Optimization of the spontaneous tail coiling test for fast assessment of neurotoxic effects in the zebrafish embryo using an automated workflow in KNIME(R). Neurotoxicol Teratol. 81, 106918 (2020).
- Strahle, U., et al. Zebrafish embryos as an alternative to animal experiments--a commentary on the definition of the onset of protected life stages in animal welfare regulations. Reprod Toxicol. 33 (2), 128-132 (2012).
- Kimmel, C. B., Patterson, J., Kimmel, R. O. The development and behavioral characteristics of the startle response in the zebra fish. Dev Psychobiol. 7 (1), 47-60 (1974).
- Eaton, R. C., Bombardieri, R. A., Meyer, D. L. The mauthner-initiated startle response in teleost fish. Journal of Experimental Biology. 66 (1), 65-81 (1977).
- Berg, E. M., Bjornfors, E. R., Pallucchi, I., Picton, L. D., El Manira, A. Principles governing locomotion in vertebrates: Lessons from zebrafish. Front Neural Circuits. 12, 73 (2018).
- Lopez-Schier, H. Neuroplasticity in the acoustic startle reflex in larval zebrafish. Curr Opin Neurobiol. 54, 134-139 (2019).
- Hale, M. E., Katz, H. R., Peek, M. Y., Fremont, R. T. Neural circuits that drive startle behavior, with a focus on the Mauthner cells and spiral fiber neurons of fishes. J Neurogenet. 30 (2), 89-100 (2016).
- Behra, M., Etard, C., Cousin, X., Strahle, U. The use of zebrafish mutants to identify secondary target effects of acetylcholine esterase inhibitors. Toxicol Sci. 77 (2), 325-333 (2004).
- Buck, L. M., Winter, M. J., Redfern, W. S., Whitfield, T. T. Ototoxin-induced cellular damage in neuromasts disrupts lateral line function in larval zebrafish. Hear Res. 284 (1-2), 67-81 (2012).
- van Wijk, R. C., Krekels, E. H. J., Hankemeier, T., Spaink, H. P., vander Graaf, P. H. Systems pharmacology of hepatic metabolism in zebrafish larvae. Drug Discovery Today: Disease Models. 22, 27-34 (2016).
- Loerracher, A. K., Braunbeck, T. Cytochrome P450-dependent biotransformation capacities in embryonic, juvenile and adult stages of zebrafish (Danio rerio)-a state-of-the-art review. Arch Toxicol. 95 (7), 2299-2334 (2021).
- Marcato, D. . Design and Development of Imaging Platforms for Phenotypic Characterization of Early Zebrafish. , (2018).
- PrecisionTox Consortium. The precision toxicology initiative. Toxicol Lett. 383, 33-42 (2023).
- Nüsslein-Volhard, C. . Zebrafish - A Practical Approach. , (2002).
- Berthold, M. R., Preisach, C. h. r. i. s. t. i. n. e., Burkhardt, H. a. n. s., Schmidt-Thieme, L. a. r. s., Decker, R. e. i. n. h. o. l. d., et al. . Data Analysis, Machine Learning and Applications. , (2008).
- Ritz, C., Baty, F., Streibig, J. C., Gerhard, D. Dose-response analysis using R. PLoS ONE. 10 (12), e0146021 (2015).
- Jensen, S. M., Kluxen, F. M., Streibig, J. C., Cedergreen, N., Ritz, C. bmd: an R package for benchmark dose estimation. Peerj. 8, e10557 (2020).
- Committee, E. S., et al. Guidance on the use of the benchmark dose approach in risk assessment. EFSA J. 20 (10), e07584 (2022).
- Haber, L. T., et al. Benchmark dose (BMD) modeling: current practice, issues, and challenges. Crit Rev Toxicol. 48 (5), 387-415 (2018).
- Carter, K. M., Woodley, C. M., Brown, R. S. A review of tricaine methanesulfonate for anesthesia of fish. Reviews in Fish Biology and Fisheries. 21 (1), 51-59 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci U S A. 108 (37), 15468-15473 (2011).
- Roberts, A. C., et al. Habituation of the C-start response in larval zebrafish exhibits several distinct phases and sensitivity to NMDA receptor blockade. PLoS One. 6 (12), e29132 (2011).
- Marquez-Legorreta, E., et al. Brain-wide visual habituation networks in wild type and fmr1 zebrafish. Nat Commun. 13 (1), 895 (2022).
- Panlilio, J. M., Aluru, N., Hahn, M. E. Developmental neurotoxicity of the harmful algal bloom toxin domoic acid: Cellular and molecular mechanisms underlying altered behavior in the zebrafish model. Environ Health Perspect. 128 (11), 117002 (2020).
- Zeddies, D. G., Fay, R. R. Development of the acoustically evoked behavioral response in zebrafish to pure tones. J Exp Biol. 208 (Pt 7), 1363-1372 (2005).
- Levitz, J., et al. Optical control of metabotropic glutamate receptors. Nat Neurosci. 16 (4), 507-516 (2013).
- Best, J. D., et al. Non-associative learning in larval zebrafish. Neuropsychopharmacology. 33 (5), 1206-1215 (2008).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. J Exp Biol. 216 (Pt 18), 3504-3513 (2013).
- Liu, F., et al. Solute carrier family 26 member a2 (slc26a2) regulates otic development and hair cell survival in zebrafish. PLoS One. 10 (9), e0136832 (2015).
- Singh, C., Oikonomou, G., Prober, D. A. Norepinephrine is required to promote wakefulness and for hypocretin-induced arousal in zebrafish. Elife. 4, e07000 (2015).
- Joo, W., Vivian, M. D., Graham, B. J., Soucy, E. R., Thyme, S. B. A customizable low-cost system for massively parallel zebrafish behavioral phenotyping. Front Behav Neurosci. 14, 606900 (2020).
- Tucker Edmister, S., et al. Novel use of FDA-approved drugs identified by cluster analysis of behavioral profiles. Sci Rep. 12 (1), 6120 (2022).
- Burgess, H. A., Granato, M. Sensorimotor gating in larval zebrafish. J Neurosci. 27 (18), 4984-4994 (2007).
- Marsden, K. C., Granato, M. In Vivo Ca(2+) Imaging Reveals that Decreased Dendritic Excitability Drives Startle Habituation. Cell Rep. 13 (9), 1733-1740 (2015).
- Chatterjee, P., et al. Otoferlin deficiency in zebrafish results in defects in balance and hearing: rescue of the balance and hearing phenotype with full-length and truncated forms of mouse otoferlin. Mol Cell Biol. 35 (6), 1043-1054 (2015).
- Wang, C., et al. Evaluation of the hair cell regeneration in zebrafish larvae by measuring and quantifying the startle responses. Neural Plast. 2017, 8283075 (2017).
- Xu, L., Guan, N. N., Huang, C. X., Hua, Y., Song, J. A neuronal circuit that generates the temporal motor sequence for the defensive response in zebrafish larvae. Curr Biol. 31 (15), 3343-3357.e4 (2021).
- Hecker, A., Schulze, W., Oster, J., Richter, D. O., Schuster, S. Removing a single neuron in a vertebrate brain forever abolishes an essential behavior. Proc Natl Acad Sci U S A. 117 (6), 3254-3260 (2020).
- Weber, D. N. Dose-dependent effects of developmental mercury exposure on C-start escape responses of larval zebrafish Danio rerio. Journal of Fish Biology. 69 (1), 75-94 (2006).
- Santistevan, N. J., et al. cacna2d3, a voltage-gated calcium channel subunit, functions in vertebrate habituation learning and the startle sensitivity threshold. PLoS One. 17 (7), e0270903 (2022).
- Thyme, S. B., et al. Phenotypic landscape of schizophrenia-associated genes defines candidates and their shared functions. Cell. 177 (2), 478-491.e20 (2019).
- OECD. Test No. 203: Fish, Acute Toxicity Test. OECD Guidelines for the Testing of Chemicals, Section 2. , (2019).
- Kluver, N., et al. Fish embryo toxicity test: identification of compounds with weak toxicity and analysis of behavioral effects to improve prediction of acute toxicity for neurotoxic compounds. Environ Sci Technol. 49 (11), 7002-7011 (2015).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hear Res. 341, 220-231 (2016).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLoS One. 12 (4), e0175420 (2017).
- van den Bos, R., et al. Early life exposure to cortisol in zebrafish (Danio rerio): similarities and differences in behaviour and physiology between larvae of the AB and TL strains. Behavl Pharmacol. 30 (2-3), 260-271 (2019).
- Felsenfeld, A. L., Walker, C., Westerfield, M., Kimmel, C., Streisinger, G. Mutations affecting skeletal-muscle myofibril structure in the zebrafish. Development. 108 (3), 443-459 (1990).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Biophys Res Commun. 423 (4), 785-788 (2012).
- Shahid, M., et al. Zebrafish biosensor for toxicant induced muscle hyperactivity. Sci Rep. 6, 23768 (2016).
- Winter, M. J., et al. Functional brain imaging in larval zebrafish for characterising the effects of seizurogenic compounds acting via a range of pharmacological mechanisms. Br J Pharmacol. 178 (13), 2671-2689 (2021).
- Vorhees, C. V., Williams, M. T., Hawkey, A. B., Levin, E. D. Translating neurobehavioral toxicity across species from zebrafish to rats to humans: Implications for risk assessment. Front Toxicol. 3, 629229 (2021).
- Scholz, S., et al. The zebrafish embryo model in environmental risk assessment--applications beyond acute toxicity testing. Environ Sci Pollut Res Int. 15 (5), 394-404 (2008).
- Dutra Costa, B. P., Aquino Moura, L., Gomes Pinto, S. A., Lima-Maximino, M., Maximino, C. Zebrafish models in neural and behavioral toxicology across the life stages. Fishes. 5 (3), 23 (2020).
- Wolman, M. A., et al. A genome-wide screen identifies PAPP-AA-mediated IGFR signaling as a novel regulator of habituation learning. Neuron. 85 (6), 1200-1211 (2015).
- Marsden, K. C., et al. A Cyfip2-dependent excitatory interneuron pathway establishes the innate startle threshold. Cell Rep. 23 (3), 878-887 (2018).
- Jain, R. A., et al. A forward genetic screen in zebrafish identifies the g-protein-coupled receptor CaSR as a modulator of sensorimotor decision making. Curr Biol. 28 (9), 1357-1369.e5 (2018).
- Nelson, J. C., et al. Acute regulation of habituation learning via posttranslational palmitoylation. Curr Biol. 30 (14), 2729-2738.e4 (2020).
- Meserve, J. H., et al. A forward genetic screen identifies Dolk as a regulator of startle magnitude through the potassium channel subunit Kv1.1. PLoS Genet. 17 (6), e1008943 (2021).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten