Method Article
异养酵母与光养分泌糖的蓝细菌相结合的共培养物的组装和定量
* 这些作者具有相同的贡献
摘要
该协议为共培养物的设置和定量监测提供了全面的指南,包括光合自养分泌糖的蓝细菌和异养酵母。
摘要
随着对可持续生物技术的需求不断增长,包含光养微生物和异养伙伴物种的混合联盟正在被探索作为太阳能驱动生物生产的方法。一种方法涉及使用 CO2 固定蓝藻,这些蓝藻分泌有机碳来支持共培养异养生物的新陈代谢,进而将碳转化为更高价值的商品或服务。在该协议中,提供了一种技术描述,以帮助实验人员建立将分泌蔗糖的蓝藻菌株与真菌伴侣相结合的共培养物,如模式酵母物种所代表的。该方案描述了共培养建立的关键先决条件:定义培养基组成,监测单个伴侣的生长特性,以及分析在同一生长容器中结合多个物种的混合培养物。总结了共培养监测的基本实验室技术,包括显微镜、细胞计数和单细胞流式细胞术,并提供了用于根据 FAIR(可查找、可访问、可互作、可重用)原则对原始流式细胞术标准 (FCS) 文件进行数据分析的非专有软件示例。最后,包括对尝试与分泌糖的蓝细菌和新型异养伴侣建立共培养物时经常遇到的瓶颈和陷阱的评论。该协议为试图建立一对新的共培养微生物(包括蓝细菌和异养微生物)的研究人员提供了资源。
引言
近年来,随着基因组工具和 DNA 技术的迅速发展,生物工程工作越来越能够将微生物的混合群落视为生物生产策略的可行性,而不仅仅是关注轴系培养物。相对于单一物种培养物,微生物群落具有多种潜在优势,包括专业化和分工、适应性和稳健性以及底物利用效率1。然而,多物种联盟的可预测工程因物种间相互作用中出现的高阶行为引起的不确定性而变得复杂2。跨物种信号传导和代谢物交换是分工原则的核心,但也会导致联盟参与者之间出现意想不到的协同效应和对立3。如果能够充分发挥混合微生物联盟的潜力,包括使用灵活的 2 伙伴和 3 伙伴共培养平台,则有必要在该领域进行大量开发,该平台可用于更好地“自下而上”地表征和理解微生物相互作用。
目前该领域正在使用几种主要类型的共培养平台,包括互补的营养缺陷型伴侣和分泌代谢物的微生物,这些代谢物通常对多种微生物物种有益。在后一类中,蓝藻已被改造成通过引入导致易代谢碳水化合物分泌的途径而成为增强的初级生产者,并且现在已经在各种合理设计的联盟中进行了探索。简而言之,在这种工程微生物群落中,蓝藻伙伴能够利用光和 CO2 作为主要输入,并且通过含氧光合作用过程,这些菌株可以分泌中心碳糖作为公共产品。一类此类工程蓝藻菌株是那些经过工程改造以分泌二糖蔗糖4 的菌株。这些菌株可能已经取得了成功,因为蔗糖是一种代谢物,对许多物种来说,它接近于中心碳代谢,并且还经常作为所谓的“相容溶质”过度积累,以适应各种环境非生物胁迫5。最少数量的遗传干预可以在一系列蓝藻模式生物中实现有效的蔗糖分泌4。
分泌蔗糖的蓝藻是研究合理设计的微生物群落的有用平台,因为广泛的异养物种可以代谢蔗糖作为其碳和能量的主要来源。事实上,利用一些具有蔗糖分泌能力的模型蓝藻,许多实验室已经合理设计了混合物种共培养物和联盟,其中包含一种或多种异养微生物,最终由光和 CO2 的主要输入支持,而无需补充有机碳原料4.异养菌株可以简单地存在于蓝细菌衍生的碳水化合物上,或者它们可以用于将蔗糖原料转化为更高价值的生物产品(例如,燃料、聚合物、颜料等)。除了作为可持续生物生产的潜在策略外,这种简单的共培养也可能用作研究不相关微生物物种之间紧急相互作用的平台。
本视频文章重点介绍了利用产糖蓝藻作为设计简单微生物群落的灵活平台的方法和先决条件,该群落可以通过仅补充轻和无机碳输入来保持稳定。虽然含有单一已建立微生物的培养物的构建和监测大多很简单,并且可以使用光密度 (OD) 或反向散射方法轻松实现,但一旦将两个或多个生物体混合在一个容器中,这就不可行了。主要原因是这些方法不区分不同的微生物,因此,它们仅提供培养物的整体情况,并不能解决单个生物体的生长问题。此外,蓝藻在 400-750 nm 范围内具有较宽的吸收光谱,因此测量异养生物的 OD600 会因藻蓝蛋白(在 620 nm 处吸收)而导致错误的结果。因此,提供了在实验室内建立蓝细菌-异养混合群落的特定方案,以及用于分析这些联盟随时间性能的有用通用方案。虽然这些协议侧重于模型、分泌蔗糖的蓝藻物种与一种或多种模型异养微生物的特定配对,但这项工作的目的是为可能希望设计新物种配对的研究人员提供资源,并加速建立此类培养物的优化阶段。因此,除了物种特异性协议外,还包括可用于根据读者需求定义的自定义社区调整和推广这些协议的信息和策略。
由于本文描述的共培养平台的灵活性,描述了先前在与分泌糖的蓝藻共培养中报道的许多不同异养物种的方案。例如,提供了 Synechococcus elongatus PCC 7942 与常见实验室酵母酿酒酵母共培养的分步方案。 然而,本文还包括适用于测定包含其他模式物种的共培养物性能的方案,包括 Ustilago maydis 的酵母形式。
本文重点介绍了建立蓝细菌/异养共培养所必需的一组核心方案,并对这些混合联盟随时间的性能进行基本表征。具体来说,强调了适合对不同物种进行准确普查的单细胞流式细胞术和颗粒计数方法,以及用于评估细胞形态的显微镜方法。这些协议旨在作为适应需求和可用设备的基础。重要的是,提供了对在实验室内建立和监测共培养物很重要的技术说明和其他注意事项。最后,包括使用 Python 包对原始 FCS6 文件进行数据分析的非专有替代方案示例。总之,目标是使更广泛的科学受众更容易获得基于蓝藻的共培养技术。
研究方案
注:该协议包含有关如何设置和量化分泌糖的 S. elongatus 和异养模式酵母物种的共培养物的详细说明。通常,该方案适用于任何适合遗传作的酵母物种。
1. 建立结合光养蓝细菌和异养酵母的共培养物
- 共培养的准备工作:培养基和预培养
注:使用超纯过滤水制备所有培养基和储备液。所有玻璃器皿(量杯、量筒、储存瓶和培养瓶)都应清洁和高压灭菌。无菌培养基可以在室温 (RT) 下储存。需要提供与光合自养培养要求兼容的设备。- 在计划开始共培养之前至少提前 3-4 天准备共培养基。大多数共培养基配方是常见 BG-11 培养基7 的变体,用于许多蓝藻模式物种的常规培养。该方案使用先前报道的 CoYBG-11 培养基作为示例 (8;见 表 1)。根据需要对制备的培养基进行高压灭菌(121 °C,20 分钟)或过滤灭菌(0.22 μm 孔径)。
注意:有关调整适合其他物种配对的培养基的建议,请参阅讨论部分。 - 准备分子试剂:为了诱导 cscB 表达和蔗糖输出 9,10,11,制备 1 M 异丙基-β-硫代半乳糖苷 (IPTG) 储备液。
注意:在共培养过程中使用抗生素是次优的,但如果所有菌株都带有耐药盒,则可以使用它们。在这种情况下,根据所用菌株的需要准备抗生素原液。 - 准备蓝藻预培养物:至少在共培养开始前 3 天,将细胞从生长在 BG-11 培养基中的蓝藻分泌糖菌株的预培养物中转移到含有 CoYBG-11 培养基的新鲜挡板烧瓶中(表 1)。
注意:蓝藻的多个物种和菌株现在已被修饰以分泌糖。有关撰写本文时可用的菌株的全面回顾,请参阅4。该参考文献还列出了以前报道过蓝藻共培养的异养物种(见 1.1.4)。- 测量预培养物的 OD750。使用公式 V1 = C2 x V2/C1 计算所需的预培养体积,以达到 0.3 (C1) 的目标 OD750,其中 C2 = 目标 OD,V2 = 目标体积,V1 = 所需的预培养体积。例如,当接种 30 mL 培养物 (V2) 时,要使用的液体培养物的量 x 为 V1 (mL) = (0.3 x 30)/(测得的 OD750)。
注:光密度是细胞密度的近似值,取决于生长条件和细胞形态;因此,研究人员有必要使用将光密度与绝对细胞数相关联的方法(参见第 2.1、2.2 和 2.3 节)以正确评估共培养性能。对于蓝藻,不应使用光合有效光谱(即 400-700 nm)内的光波长来确定光密度,因为它们会被叶绿素和其他色素吸收;因此,通常使用远红外波长(例如 750 nm)。 - 在适当的光培养箱中孵育稀释的培养物。典型孵化
模型蓝藻的条件如下:30 °C,150 rpm(25 mm 投掷),2% CO2 顶空,~200 μmol 光子 m-2·s-1 LED 照明,75% 湿度。
注:强烈建议补充 CO2 以优化释放的蔗糖量。 - 在设置共培养物之前,每天重复此稀释过程至少 3 天,以确保蓝藻呈指数级增长。这将有助于提高不同日期实验之间共培养性能的一致性。
- 测量预培养物的 OD750。使用公式 V1 = C2 x V2/C1 计算所需的预培养体积,以达到 0.3 (C1) 的目标 OD750,其中 C2 = 目标 OD,V2 = 目标体积,V1 = 所需的预培养体积。例如,当接种 30 mL 培养物 (V2) 时,要使用的液体培养物的量 x 为 V1 (mL) = (0.3 x 30)/(测得的 OD750)。
- 至少在共培养开始前 2 天,准备异养生物预培养物。如前所述,许多酵母种类和亚菌株以前是在与蓝藻共培养的情况下生长的 8,12,13。
- 将细胞以 1:100 稀释液 (250 μL) 从生长在丰富的培养液中生长的异养物种的液体培养物中转移(见 表 1)到 50 mL 补充有 20 g/L 蔗糖的 CoYBG-11 培养基中,装在 250 mL 带挡板的培养瓶中。
- 在与蓝藻伴侣使用的培养条件相同的温度下孵育过夜。
- 在共培养物的预期接种时间前至少 24 小时检查 OD600 ,以确保异养菌株已充分生长以满足实验需要(见 1.2):如有必要,在新鲜培养基中稀释以保持指数增长。
- 在计划开始共培养之前至少提前 3-4 天准备共培养基。大多数共培养基配方是常见 BG-11 培养基7 的变体,用于许多蓝藻模式物种的常规培养。该方案使用先前报道的 CoYBG-11 培养基作为示例 (8;见 表 1)。根据需要对制备的培养基进行高压灭菌(121 °C,20 分钟)或过滤灭菌(0.22 μm 孔径)。
- 共培养接种和维持
注:有关光养微生物和异养微生物之间接种比率的考虑,请参阅讨论部分。- 对于共培养物的接种,通过离心富集两种预培养物。
- 使用标准 C1 x V1 = C2 x V2 方程计算浓缩细胞悬液的体积,以达到两种物种所需的起始密度,其中 C1 = 富集培养物的 OD。例如,要制备起始 OD750 为 0.5(来自 1.5 OD 轴流培养物)的 25 mL 细长链球菌培养物和起始 OD600 为 0.05(来自 0.7 OD 轴流培养物)的酿酒酵母,根据上述方程式,需要 8.33 mL 细长链球菌起始培养物,1.79 mL 富集异养培养物, 和 14.88 mL CoYBG-11 培养基。
- 在 RT 下使用 13,000 x g 离心培养物 10 分钟。在无菌条件下,倒出并丢弃上清液。
注意:较小的相对离心力 (RCF;xg) 可用于沉淀 酿酒酵母 ,因为与 细长酵母 相比,它们是更大的细胞(2x-3 倍),但要注意上清液变成透明。对于蓝藻生物质的收集,也可以使用小于 13,000 x g 的样品,但需要更长的离心时间(例如,4,000 x g 可以使用 20 分钟)。 - 将蓝藻沉淀重悬于 25 mL 无菌 CoYBG-11 培养基中。使用与之前相同的离心条件,然后弃去并倒出上清液。
- 对 S. elongatus 重复此过程 2 次,对 酿酒酵母再重复 4 次。
注意:清洗蓝藻沉淀和异养生物(酿酒酵母)以去除残留的培养基成分非常重要。由于 酿酒酵母 之前一直在蔗糖存在下生长,因此增加洗涤步骤将确保去除可能的残留糖分。 - 验证 OD 后,在无菌条件下将 细长链球菌 和 酿酒酵母 的体积混合在 250 mL 带挡板的烧瓶中,并添加 CoYBG-11 至最终体积为 50 mL。从先前制备的 1 M IPTG 储备液中稀释至终浓度为 1 mM(这是为了诱导蓝藻将蔗糖输出到培养基中)。对于 50 mL 培养物,使用 1 M IPTG 储备液中的 50 μL。
注意:带挡板的培养瓶通常更好,因为它们为蓝藻提供了更好的通气和混合。 - 将上一步的烧瓶置于 200 μmol 光子·m-2·s-1 LED 照明中,在 30 °C 下补充有 2% CO2 ,并以 150 rpm(25 mm 投掷)和 75% 湿度进行轨道振荡。
注意:上述条件可能会有所不同,需要根据实验结果进行优化。 - 每 12 小时或 24 小时通过无菌采样 (1 mL) 监测培养物的生长(参见第 2 节)。可选择使用样品进行标准活细胞显微镜检查,并在合适的培养基上测定酵母细胞的集落形成单位 (CFU14),以跟踪细胞形态和适应性,并监测活异养细胞的数量以及污染。
注:不建议将 CFU 作为监测蓝藻种类精确细胞密度的方法,蓝藻种类在从液体培养基到固体培养基的培养过程中可能会承受很大的压力。因此,应选择具有适合酵母伴侣物种生长的丰富培养基的琼脂平板,例如酵母提取物蛋白胨葡萄糖 (YEPD)15。
- 对于共培养物的接种,通过离心富集两种预培养物。
| 化合物 | BG-11 (浓度 mg/L) | CoY BG-11(浓度 mg/L) |
| 钠3 | 1500 | 1500 |
| K2HPO4 | 40 | 40 |
| 硫酸镁4·7H2O | 75 | 75 |
| 氯化钙2 ·2H2O | 36 | 36 |
| 柠檬酸 | 6 | 6 |
| 柠檬酸铁铵 | 6 | 6 |
| EDTA(二钠盐) | 1 | 1 |
| 钠2一氧化碳3 | 20 | 20 |
| 痕量金属成分 | ||
| H3BO3 | 2.86 | 2.86 |
| 硫酸锌4·7H2O | 0.222 | 0.222 |
| 钴(NO3)2 ·6 小时2O | 0.0494 | 0.0494 |
| 氯化锰2·4H2O | 1.81 | 1.81 |
| 铜矿4 ·5H2O | 0.079 | 0.079 |
| 钠4·2H2O | 0.39 | 0.39 |
| 附加 | ||
| HEPPSO | 7160 | 7160 |
| 酵母氮碱 (YNB),不含氨基酸,不含硫酸铵 | – | 票价:3608、120013 元 |
| pH 8.3 滴定剂 | 许 | 许 |
| KPO3 | – | 118 |
| 蔗糖(仅适用于异养生物) | – | 13690 |
表 1:BG-11 和 CoYBG-11 的培养基组成。给定酵母-氮碱浓度,CoYBG-11 中的浓度来自已发表的资源 8,12,13。
2. 监测共培养物增长的工具和方法
注:该方案是共培养分析和监测的指南,从简单但工作密集的技术(如显微镜和计数室)到高通量应用(如粒子计数器和单细胞流式细胞术)。除了实际的共培养外,建议包括单个微生物的轴系培养物,以便进行全面分析。作为分析的一般起点,确定培养物的 OD。在本节中,详细介绍了可用于将细胞密度的相对测量值(即 OD)转换为单位体积细胞数的绝对值的不同方法。OD750 测量通常用于确定蓝藻培养物的细胞密度(由于吸收了 400-700 nm 波长),而 OD600 用于异养生物。两种测量值都提供任意单位的近似指导值。请注意,不同工具之间的值可能会有很大差异。
- 使用计数室进行显微定量
注意:计数室(即 Neubauer(改进型)/血细胞计数器)是一种简单且廉价的方法,用于确定由细胞组成的共培养物的组成,这些细胞可以很容易地从形态学上区分, i.e.、按其单元格形状 (图 1A).它由一个厚玻璃显微镜载玻片和一个盖玻片组成。如果盖玻片正确放置在载玻片顶部,它会创建两个带有雕刻网格的精确体积室 (图 1B-D).通过计数网格的定义面积,可以计算悬浮液的细胞浓度。计数室有不同的深度可供选择。根据泡孔厚度,应选择合适的腔室深度。对于真菌细胞,例如 U. maydis 或 S. cerevisiae, 0.1 毫米的深度效果很好。这个腔室深度对于较小的细胞(如蓝藻)来说太大了,并且细胞漂浮在腔室中。深度为 0.02 mm 的腔室适用于蓝藻以及蓝藻和真菌的共培养。- 确保计数室和盖玻片没有灰尘和细胞。
注意:建议在使用前直接用 70% (v/v) 乙醇和无绒纸巾清洁。 - 要正确放置盖玻片,请用一点压力将其滑到两个支撑杆上,但要小心以免破损。
注意:此应用需要特定的厚盖玻片(请参阅腔室手册)。由于盖板玻璃在组装过程中有时会破裂,因此最好手头有替代品。 - 当盖玻片正确定位后,观察两个玻璃表面之间的所谓牛顿环(图 1B),并且盖玻片不再滑动。
注意:在组装之前轻轻地吹一口气盖玻片通常会改善结果。 - 充分混合细胞悬液,将几微升(~2-10 μL,取决于腔室深度)的细胞悬液涂抹到腔室边缘,并通过毛细管力使其完全填充。使用适当稀释的细胞悬液以实现可靠的计数,例如,每个大方块产生 20 至 200 个细胞(图 1D,红色矩形)。
- 使用合适的(例如,10 倍)光学显微镜物镜(明场或相差模式)并专注于计数室网格线。方向由网格提供。开始计算适合给定单元格大小的方块中的单元格。
注意:使用技术辅助工具,例如手持式计数器或适当的智能手机应用程序进行计数(例如,通用的“事物计数器”或提供极其有用的功能的专用血细胞计数器应用程序)。定义对位于网格边框上的单元格进行计数的规则,以避免重复计数。例如,可以计算位于每个正方形的上边框和左边框上的单元格,同时排除位于右边框和下边框上的单元格。存在其他规则16.如果使用荧光显微镜,还可以根据细胞的自发荧光或荧光标志物来区分细胞。 - 例如,在对角落中的所有四个大方块进行计数后,确定每种细胞类型的平均值。有了这些平均值,所用正方形的面积和给定腔室的深度(请查阅制造商的信息),计算细胞浓度(参见 代表性结果)。
注意:根据细胞大小,可以使用不同的方块进行计数。对于酵母和蓝藻细胞,角落中的四个大方块工作良好(图 1D,红色矩形)。 - 使用后,根据样品的要求清洁腔室(例如,适当灭活转基因生物)。
- 确保计数室和盖玻片没有灰尘和细胞。
- 使用粒子计数器进行定量
注:根据共培养中细胞的特性,可以应用粒子计数器来确定伴侣的细胞数量。为了该方法的适用性,细胞的大小需要有很大差异;例如,可以区分细菌和酵母细胞。需要包括联盟的单个微生物的轴系培养物,以便解释结果。含有相似大小或超过 2 个伴侣的细胞的共培养物应使用第 2.1 节或第 2.3 节中描述的方法进行分析。- 准备
- 将培养物的 OD 调整至 0.1,并用等渗测量缓冲液(请参阅设备手册)将样品稀释 1,000 倍,总体积为 10 mL。准备所有样品的技术一式三份。
- 为实验选择合适的毛细管孔径。
注意:孔径应在共培养物中最小细胞的范围内,但也应包括较大的细胞。不要太小,因为细胞聚集可能会堵塞毛孔,这可能是由于细胞分裂而发生的。可用的孔径不同。例如,45 μm 的毛细管开始检测直径为 0.7 μm 的细胞(U. maydis 和 S. cerevisiae 3.5 μm-5.5 μm,S. elongatus/集胞藻 属 ~1-2.5 μm)。
- 在粒子计数器中定量细胞
- 启动设备。最后,进行自检以进行质量控制(请参阅特定设备的手册)。
- 将样品装入样品杯中,盖紧盖子,然后通过稍微倾斜杯子混合样品。
注意: 尽量避免起泡和气泡。每次测量始终使用一个杯子。杯子可以多次清洁和重复使用。如果有任何无法去除的残留物,请丢弃杯子。如果样品在杯中停留时间较长,请在测量前再次混合。 - 记录范围为 0-30 μm,因为细胞聚集体可能大于单个细胞。
注:首先,使用共培养伙伴的每种轴系培养物来了解细胞的大小,并确定它们是否可以通过大小来区分。 - 评估后,以相同的方式确定共培养物的组成。
- 准备
- 使用单细胞流式细胞术进行联盟定量
注:单细胞流式细胞术是一种高通量方法,可用于确定共培养中单个伴侣的细胞数量,因为可以通过大小/它们的光散射特性或/和荧光来区分伴侣。重要的是,对于方法建立,需要共培养伴侣的轴系培养物来分析它们在细胞仪中的特性并相应地调整群体门。对于携带荧光报告基因的菌株,需要没有荧光报告基因的菌株作为阴性对照。基本熟悉细胞仪应用将有助于成功实施以下方案17,18,19,20,21.在这个例子中,分析了 3 种微生物的人工混合物(见 代表性结果): Synechocystis (表达胞质报告荧光团 mVenus)和两种酵母 S. cerevisiae 和 U. maydis.为了精确判别 S. cerevisiae 和 U. maydis,荧光标记物以细胞质绿色荧光蛋白 (GFP) 的形式引入 (U. maydis eGFP) 和红色荧光蛋白 (RFP) mKate2 (S. cerevisiae mKate2) 使用基本分子克隆技术。如果可能,应首选具有报告基因基因组整合的菌株,以避免需要连续选择压力。- 样品制备
- 测量要分析的给定生长阶段培养物的 OD。
- 将样品的 OD 调整到适合测量的范围。使用新鲜培养基(最终体积:至少 500 μL),蓝藻使用大约 0.05-0.5 的 OD750 ,酵母的 OD600 为 0.2-1.5。对于共培养物,目标是 OD750 在 ~0.1 和 0.5 之间,并记录稀释因子。对于计算,应用步骤 1.1.3.1 中提供的公式。这将确保在 10 μL/min 的流速(相当于 6,000 - 60,000 个细胞/μL)下,细胞计数保持在 1,000 - 10,000 个细胞/s 的范围内。
注:对于稀释,可以使用没有自发荧光和颗粒的培养基或缓冲液(例如 BG-11)。小心含有复杂成分(如酵母抽提物)的培养基,这些成分可能在测量中显示为颗粒。 - 将 300 μL 每个样品池悬液转移到 96 孔板(标准圆孔、透明、平底)中的单个孔中。
注:或者,如果使用半自动样品模式而不是读板器模式,则将 0.5-2 mL 转移到荧光激活细胞分选 (FACS) 管中。
- 细胞术测量
- 启动细胞仪并根据制造商的说明执行启动程序和质量控制 (QC)。
- 加载(板装载器或半自动采样)并运行样品。从对照样品开始,使用每个共培养伙伴的轴系培养物,根据它们的特性鉴定每个物种,然后再将它们分离到共培养样品中。
- 与样品相关的荧光和散射通道(例如,前向散射 [FSC] 或侧向散射 [SSC] 高度 [-H] 或面积 [-A])的开放点图和/或直方图。
- 寻找所需的细胞群并调整阈值以排除培养基中的技术噪音和小颗粒。
注:建议在 FSC-H over FSC 宽度或 FSC-H over SSC-H 点图中搜索细胞群,并将细菌等小细胞(通常为 1-3 μm)的刻度从线性调整为对数。在 FSC-H 或 SSC-H 通道中设置阈值。对于直径小于 1 μm 的细胞,在 405 nm 的紫色激光中使用紫色 SSC (VSSC) 以获得更好的分辨率。 - 手动将每个感兴趣通道的增益调整到 25-2,500 的范围。调整增益,使阴性对照(例如,没有荧光标记)在 1 x 102-1 x 103 的范围内,阳性对照(例如,有荧光标记)在 1 x 105-1 x 106 的范围内,以获得最佳分离并保持在 1 x 101-1 x 107 的范围内。
注:QC 的标准增益也可以作为良好的参考。 - 要测定样品中的细胞浓度,请使用记录功能记录定义的样品体积(例如,以 10 μL/min 的流速记录 10 μL)。然后,将该体积测量的单个细胞计数除以记录的体积,得到每个群体的每 μL 细胞计数。
注:在计算培养物/样品中的细胞浓度时,请牢记初始稀释因子。
- 细胞群的门控/选择
注:无论用于运行测量的设备如何,都可以在细胞仪作软件或商业分析软件中进行分析和设门,如下所示22.此外,使用非专有软件分析流式细胞术数据可以通过各种开源工具(如 FlowCytometryTools)高效完成23 或 FlowKit,使用 FlowUtils24 packages 中。本着开放科学的精神,该协议共享了一个示例 JupyterNotebook,展示了使用这些包进行基本数据探索。当然,替代软件同样适用于进行流式细胞术生物信息学25.- 通过在点图中围绕细胞群绘制门或在直方图中的峰周围设置分隔线或线段来选择某些细胞群(图 4)。
注意:该程序的自动门功能可以用作参考。 - 根据光谱红色区域中光养生物体(主要由叶绿素引起)的自发荧光分离光养生物和异养生物的信号。示例:使用 APC-H 通道的直方图(激发 (ex.)在 638 nm,发射 (em.) 在 660/10 nm)并在右峰(光养 = 叶绿素自发荧光阳性群体)和左峰/s(异养 = 叶绿素自发荧光阴性群体)之间设置垂直分界线(图 4A)。
注:荧光标记也可用于区分同一培养物中的两个(或多个)光养伴侣(例如, 集胞藻的 mVenus)。 - 根据它们的荧光标记物或散射特性(如果可能,FSC、SSC)分离两种异养生物。
注:基于散射特性的分离仅适用于细胞具有不同的细胞大小或形态,例如,导致散射发生可见变化的情况(例如, 集胞藻:直径为 ~1.5-3 μm 的球形细胞与长度为 10 μm 且直径约为 1-2 μm 的 U. maydis 细长细胞26)。 - 示例:使用 FITC-H 通道的直方图(例如:488 nm,em.:525/40 nm)仅显示“异养”群体,以区分含有 GFP 的异养细胞(例如, U. maydis eGFP)和没有 GFP 的异养细胞(例如, 酿酒酵母 RFP/mKate2)(图 4B)。或者,使用仅显示“异养”群体的 PC5.5-H 通道的直方图(例如:561 nm,em.:710/50 nm)来区分含有 RFP 的异养细胞(例如, 酿酒酵母 RFP/mKate2)和没有 RFP 的细胞(例如, U. maydis GFP)(图 4C)。
注:请记住,在测量过程中,两种(或多种)不同的细胞类型可能会“粘”在一起。这些“双峰”或“多峰”可以很容易地在两种荧光标记物的点图中检测到(例如,APC-H 超过 FITC-H,以识别光养生物和 GFP 标记的异养伴侣的双峰)。 - 对于 Python 中的基本数据分析,请按照此 Jupyter (https://git.rwth-aachen.de/computational-life-science/cytoflow) 中的说明进行作。
注意:此笔记本支持三个数据分析步骤。i) 导入数据:导入 FCS 文件。ii) 执行质量控制:检查数据完整性和事件数量。iii) 可视化数据:使用直方图、散点图和密度图等图表来可视化数据。此外,还显示了如何执行门控以分离重现 图 4 的目标群体的过程。
为了便于在长期项目中分析共培养物,建议研究人员使用上述方法对细胞数进行计数并创建标准曲线以将 OD 值与绝对细胞计数进行比较。光密度是一种相对测量值,可能因物种、菌株、生长条件和光谱仪而异。因此,生成“内部”标准曲线对于将 OD 值准确转换为细胞数是必要的。
- 通过在点图中围绕细胞群绘制门或在直方图中的峰周围设置分隔线或线段来选择某些细胞群(图 4)。
- 样品制备
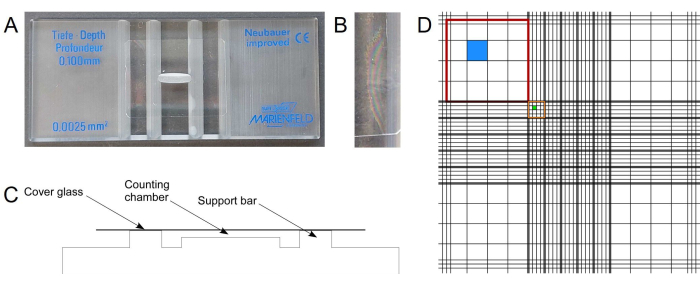
图 1:形态学上可区分细胞的显微定量。 (A) Neubauer 计数室。(B) 牛顿环表示特殊盖玻片的正确位置。(C) 腔室结构的示意图,其中中心腔具有用于细胞计数的确定体积。(D) 所描绘的 Neubauer 计数室的网格由九个尺寸为 1 mm2 (红色)的大方块组成。角落的 4 个大方块进一步分为 16 个方块(蓝色)。中央大方块分为 25 组方块,尺寸为 0.04 毫米2 (橙色)。每个组方块由 16 个最小的方块 (绿色) 组成。该数字是根据公开可用的制造商信息生成的。 请单击此处查看此图的较大版本。
结果
光养 S. elongatus 和异养酵母共培养物的建立
我们之前已经报道了细长聚球藻 PCC 7942 与酿酒酵母多种亚菌株共培养的详细结果。有关与该蓝细菌/酵母对共培养结果的全面描述,请参见8。为了简洁和准确,此处不再复制这些结果。简而言之,先前的结果表明许多对于建立长期蓝细菌-酵母共培养物很重要的考虑因素。最令人担忧的是,酵母在蓝藻提供唯一形式的固定碳的条件下的生存能力在很大程度上取决于酵母菌株利用蔗糖的效率。经过进化或工程改造以更有效地代谢蔗糖27,28 的酿酒酵母菌株更有可能在过渡到共培养生长模式的过渡中存活下来,获得更高的细胞密度,并在长期(数天至数周)蓝藻共培养实验中表现出更高的稳健性8。接种共培养物的初始阶段对于酵母活力尤为重要,这可能是由于培养物稀释、更换培养基组成和/或提取更浓缩的碳源的压力。因此,在共培养开始时努力从更丰富的生长培养基过渡到最低碳可用性可以提高实验性能和一致性(参见步骤 1.2.1.1)。此外,酿酒酵母在接种到细长酵母的密集培养物中时表现出与高氧一致的应激反应,这与作为含氧光合作用主要副产物的 O2 的形成一致。因此,防止蓝藻伴侣过度生长和/或交替的“昼/夜”光照周期的努力可以大大延长酿酒酵母在长期共培养中的活力。有关共培养物中相对于轴系对照样品的常见现象的附加摘要,请参阅讨论部分。
使用不同的方法监测共培养物的生长
在下一节中,描述了使用三种不同方法对 集胞藻 和两种酵母 S. cerevisiae 和 U. maydis 的人工混合三方联盟进行示例性定量。对于混合物,测定单个培养物的 OD750 (用于蓝藻)和 OD600 (用于异养生物)并将其调整至 OD 0.1。使用光密度以 1:1:1 的比例混合单一培养物(这与细胞计数不同,见上文)。为了便于在细胞仪中区分酵母菌,组成型产生细胞质 mKate2 的转基因 酿酒酵母 FY1679-O1B29 报告菌株(基因型:URA3Δ/pTDH3::mKate2;菌株: 酿酒酵母 mKate230)和组成型产生 eGFP 的 U. maydis 菌株 AB3331 (基因型:pep4Δ/pRpl40::egfp;菌株: U. maydis eGFP32) 被使用。值得注意的是,蓝藻菌株配备了一个复制质粒,可促进黄色荧光蛋白版本 mVenus (Synechocystis sp.PCC 6803 pSHDY-Pcpc560-mVenus,菌株 集胞藻 ,类似于33),此外,由于光合机制的存在,表现出典型的强自发荧光。
使用计数室进行显微定量: 在所使用的三种微生物的人工混合物中,所有细胞类型都可以很容易地在显微镜下区分(图 2A): 集胞藻 和 酿酒酵母 由球形细胞表示,但它们的直径差异很大(集胞藻:直径约为 1.5-3 μm, 酿酒酵母:直径约为 3-6 μm),而 U. maydis 细胞具有细长的雪茄形形态和至少 10 μm 的长度(图 2A).这些清晰的形态特征允许对混合物中的每个伴侣进行精确定量。作为一个说明性的例子,在四个大方块中分别计数 37、18、36 和 21 个 酿酒酵母 细胞(图 2B)。平均值为 28 个单元格。由于所用血细胞计数器的大正方形面积为 1 mm2 ,腔室深度为 0.02 mm,因此每 0.02 μL 有 28 个细胞。这相当于 1,400 个细胞/μL,相当于 1.4 x 106 个细胞/mL。对其他细胞类型进行计数,并相应地测定浓度(图 2C, 表 2)。
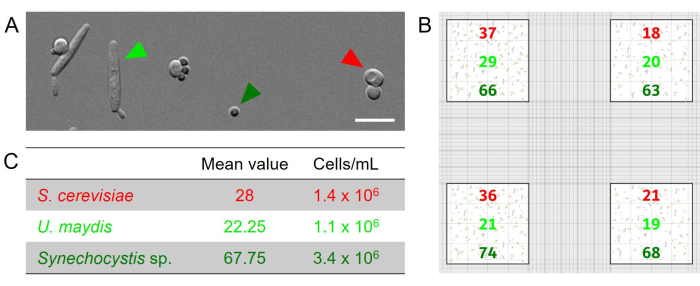
图 2:由 集胞藻 和酵母酿酒酵母 和 U. maydis 组成的三方联盟的显微定量。 (A) 指定微生物的人工组合混合物的显微差分对比 (DIC) 图像。所有物种都可以通过它们的形态很容易区分。比例尺:10 μm。(B) 基于 OD 为 0.1 的轴系培养物的指定菌株的人工组装混合物的示例计数结果。分析了网格边缘的四个大方块( 图 1D 中的红色标记)。(C) 使用以下公式将四个方块中计数的不同细胞的平均值用于计算悬浮液中细胞的浓度:平均值/(腔室深度 [0.02 mm] x 计数方块的大小 [1 mm2] x 1,000)。 请单击此处查看此图的较大版本。
使用粒子计数器进行定量: 粒子计数器根据颗粒的大小确定悬浮液中的颗粒数量。在示例数据集中,使用了具有 45 μm 毛细管的粒子计数器。由于 酿酒酵母 和 U. maydis 细胞显示出相似的尺寸,因此无法在粒子计数器中区分它们,而较小的 集胞藻 细胞可以清楚地分离。因此,对单个培养物的分析显示,在相同位置出现峰,即两种酵母的 3 至 6 μm(图 3A)。在测量过程中,施加负压,导致细胞进入毛细管。这会短暂地改变电阻,以便设备可以根据变化确定颗粒大小。在混合培养物中,可以检测到两个不同的峰,一个与较小的蓝藻细胞相关,另一个代表两种酵母种类的联合部分(图 3B)。重要的是,除了反映活细胞的峰外,在大约 1 μm 处还检测到其他峰(图 3),对应于细胞碎片和更小的颗粒。以大于预期直径出现的信号可能是由细胞聚集引起的。值得注意的是,峰的形状反映了细胞的均一性:尖峰显示细胞非常均匀,这不太可能进行共培养。在共培养物中,如果共培养物的伙伴在大小上明显不同,则预计会看到一个非常宽的峰值甚至两个峰值。对于异养真菌的轴系培养物,峰可能是中等宽峰。
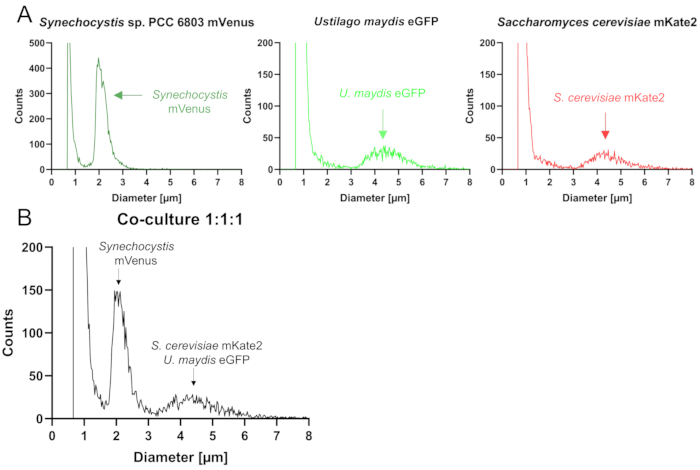
图 3:使用粒子计数器对由 Synechocystis mVenus 和酵母酿酒 酵母 mKate2 和 U. maydis eGFP 组成的三方联盟进行定量。 (A) 如图所示,三种菌株的轴系培养物分析的可视化输出(具有 45 μm 毛细管的细胞计数器)。(B) 用于使用相同条件分析人工三方联盟的示例性可视化输出文件。粒子计数器不支持区分两种酵母菌,这两种酵母菌都由第二个峰表示。 请单击此处查看此图的较大版本。
使用单细胞细胞术进行定量:使用单细胞流式细胞仪,可以根据其(自动)荧光和光散射特性轻松区分不同的细胞群。光养细胞(集胞藻)可以根据在 APC-H 通道中测量的光合色素的红色自发荧光与异养细胞(U. maydis 和 S. cerevisiae)区分开来(图 4A)。基于光养细胞和异养细胞的初始分离,可以根据它们的荧光标志物 FITC-H 通道中的 eGFP 和 PC5.5 通道中的 mKate2 来区分两个异养群体(图 4B,C)。在显示所有三个种群(FSC-H 和 FSC-Width)的散射特性的点图中,也可以区分种群,只有种群的一些微小重叠(图 4D)。
使用该方法,以 10 μL/min 的流速分析 10 μL 稀释样品,可在 1 分钟内定量约 70,000 个细胞。这些细胞中大约 60% 可以分配到 集胞藻 (4.23 x 106 个细胞/mL),而其余 40% 平均分布在梅 芽 孢杆菌 (1.35 x 106 个细胞/mL) 和 酿酒酵母 (1.36 x 106 个细胞/mL,图 4E, 表 2) 之间。
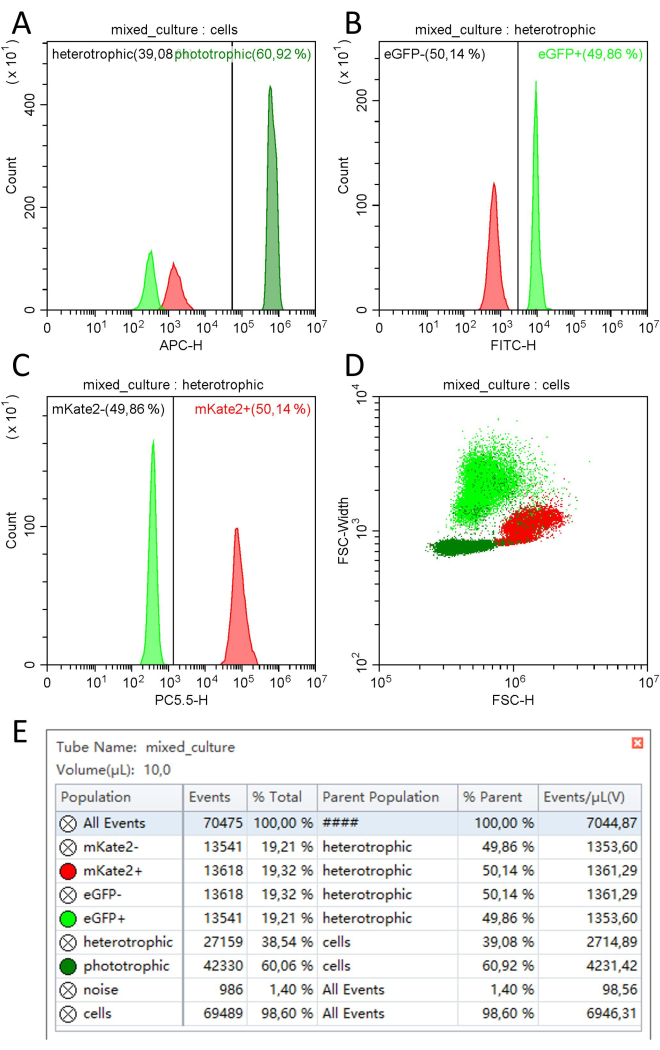
图 4:使用单细胞流式细胞术对由蓝藻 Synechocystis mVenus 和酵母 U. maydis eGFP 和酿酒酵母 mKate2 组成的三方联盟进行定量。 在细胞仪 (A) 上以 1/3 OD750 / 1/3 OD600 / 1/3 OD600 的比例测量集胞藻(深绿色)、U. maydis eGFP(浅绿色)和酿酒酵母 mKate2(红色)的混合培养物后获得的示例图,显示 APC-H 通道中事件计数和荧光的直方图(例如:638 nm, em.:660/10 nM)用于根据自发荧光区分光养和异养细胞的所有细胞。(B) 用于根据绿色荧光特性区分梅迪斯硅杆杆菌 eGFP 和酿酒酵母 mKate2 细胞的所有异养细胞的 FITC-H 通道(例如:488 nm,em.:525/40 nm)中事件计数和荧光的直方图。(C) 用于根据红色荧光特性区分梅迪斯硅茄 eGFP 和酿酒酵母 mKate2 细胞的所有异养细胞的 PC5.5-H 通道(例如:561 nm,em.:710/50 nm)中的事件计数和荧光的直方图。(D) FSC-H 通道上 FSC-Width 散射信号的点图,用于识别没有荧光特性的细胞群。(E) 种群统计,包括相关荧光通道的事件计数、百分比、算术平均值和标准差 (SD)。在 10 μL 体积和 10 μL/min 的流速下测定细胞总量及其大小和荧光。请单击此处查看此图的较大版本。
为了比较可视化不同定量方法的输出,测定的细胞数显示在以下两个表中(表 2 和 表 3)。使用先前描述的三种方法测定的细胞的最终浓度在所有方法的相似范围内。细胞仪提供最高的样品量,其次是粒子计数器和显微镜定量,两种方法之间的样品量减少了大约一个数量级。
| 共培养 1:1:1 | 光度计 | 细胞仪 | 粒子计数器 | 显微镜计数室 | ||||
| 生物 | 外径750/600 | 细胞计数 | 细胞/mL | 细胞计数 | 细胞/mL | 细胞计数 | 细胞/mL | |
| 酿酒酵母 mKate2 | 0.0333 | 13,618 | 1.36 x 106 | 1,546* | 2.58 x 106* | 112 | 1.40 x 106 | |
| Ustilago maydis eGFP | 0.0333 | 13,541 | 1.35 x 106 | 89 | 1.11 x 106 | |||
| 集胞藻 属 PCC 6803 mVenus | 0.0333 | 42,330 | 4.23 x 106 | 3,094 | 5.16 x 106 | 271 | 3.39 x 106 | |
表 2:不同定量方法的比较:人工混合培养。 请注意,使用粒子计数器 (*) 无法区分 U. maydis 和 S. cerevisiae 。
| 单一文化 | 光度计 | 细胞仪 | 粒子计数器 | 显微镜计数室 | ||||
| 生物 | 外径750/600 | 细胞计数 | 细胞/mL | 细胞计数 | 细胞/mL | 细胞计数 | 细胞/mL | |
| 酿酒酵母 mKate2 | 0.1 | 38,936 | 3.89 x 106 | 1,928 | 3.21 x 106 | 403 | 4.03 x 106 | |
| Ustilago maydis eGFP | 0.1 | 36,927 | 3.69 x 106 | 2,465 | 4.11 x 106 | 307 | 3.07 x 106 | |
| 集胞藻 属 PCC 6803 mVenus | 0.1 | 127,864 | 1.28 x 107 | 8,186 | 1.36 x 107 | 428 | 1.07 x 107 | |
表 3:不同定量方法的比较:使用单一/轴系培养物进行校准。
讨论
几十年来,许多微生物模型已经确定了在实验室环境中处理单个轴系培养物中的微生物。然而,尽管自然界中的主要生命形式是微生物群落,但两个或多个伙伴在一个培养容器中的组合还不太成熟,并且现有知识和方法的差距带来了挑战。预测群落中细胞的行为也更加困难,因为细胞之间会出现紧急相互作用和代谢物交换,强烈影响共培养物的命运34,35。因此,共培养物的建立并非易事,包括生长培养基定义、常见生长条件的鉴定、痕量代谢物/信号的种间交换以及随时间推移产生的共培养物组成。过去几年在光养、分泌糖的蓝藻与异养伙伴组装方面的进展现在允许推断出第一规则和方法,这些规则和方法可以为设计新的共培养对提供有用的指导。基于这些知识,在本方案的第一部分中,提供了组装含有蔗糖分泌蓝细菌和一种或多种酵母的共培养物的分步指南。
首次尝试在不相关的微生物之间建立共培养时,一个关键的考虑因素是满足两个或多个物种的所有营养需求的共同生长培养基的组成。由于空间限制,在此处为此流程提供完全详细的协议是不可行的,在某些情况下,这可能还需要高度自定义,但以下概述了要牢记的重要注意事项。一种简单的初始方法包括将典型的蓝藻生长培养基(例如,BG11;见表 1)与为感兴趣的异养物种组成的任何已建立的最小培养基进行比较。用异养最小培养基中包含的任何缺失成分补充标准蓝藻培养基是初始测试的良好起点 8,36。请记住,由于最少培养基通常补充有用于异养生长的重要有机碳源(例如,1%-4% 葡萄糖),因此它们通常设计为支持比初始共培养实验中可能达到的更高的异养细胞密度。同样,一些常见的培养基成分也可以作为有机碳源,独立于蓝藻伴侣(例如柠檬酸盐)提供的光合产物,这可能会使蓝细菌/异养生物共培养物的后续分析复杂化。因此,在设计共培养基时,可能没有必要用缺失元素的全浓度来补充最低蓝藻培养基。例如,许多生物体对不同形式的环境氮(例如 N2、硝酸盐、亚硝酸盐、尿素)的利用效率各不相同,并且可能完全无法利用一些氧化程度更高的氮源。同样,许多微生物可能需要补充必需维生素(例如维生素 B12)、辅助因子或必需氨基酸,因为它们缺乏直接合成这些化合物的完整生物合成途径。由于这些原因,最实用的做法是简单地将蓝藻伴侣的已建立的最小培养基(例如,BG11)与异养生物的明确定义的最低培养基(例如,合成定义的 [SD])“合并”。重复去除/减少多余成分的后续循环可用于优化培养基并减少可能抑制伴侣之一生长的任何化合物的丰度。一个有用的起点是在中性或微碱性 pH 值下缓冲培养基,因为这些往往是大多数蓝藻模型物种所青睐的条件。
此时,当提供过量的蔗糖时,在新的共培养基中对负载异养菌的生长进行初步测试通常是有帮助的。当然,在选择潜在的异养生物时,重要的是要选择能够分解蓝藻伙伴提供的有机碳主要来源的异养生物。这里需要注意的是,蔗糖作为许多工程蓝细菌/异养培养物中供应的主要碳水化合物4,并不是像葡萄糖那样被异养微生物普遍利用的碳水化合物:专用的蔗糖转运蛋白必须由异养物种编码,或者可能需要细胞外转化酶才能将蔗糖转化为果糖和葡萄糖,而果糖和葡萄糖通常被高亲和力转运蛋白识别8.研究混合微生物群落的多个实验室通常报告的一个重要观察结果是,光养伙伴和异养伙伴之间出现了更高阶的协同作用和拮抗作用 4,8,13。例如,其他天然分泌的代谢物(例如,有机酸、还原形式的氮)或辅助因子(例如,铁载体)在相同培养基中培养时,相对于轴系对照,可以使一个或两个伙伴的更高生长速率。相反,据报道,潜在有害的代谢副产物,例如通过光合水分解使培养基高氧化,会导致一个或两个伙伴的物种间生长抑制8。因此,轴控可以提供有用的基准,但由于这些新兴特性,共培养性能可能与预期不同。
根据异养伙伴和 S. elongatus 排泄蔗糖的能力(基于诱导水平,使用的 IPTG 浓度),应测试两种生物体的不同比例。培养物的成功主要取决于 S. elongatus 维持异养伙伴生长的能力(即,它能否产生足够的碳源)。虽然异养菌株的过度生长通常受到共培养基组成中缺乏有机碳的限制,但蓝细菌可以超过异养菌,这可能导致紧急抑制相互作用(例如,高氧条件 8,13)。当尝试最初确定蓝细菌:酵母的适当细胞密度比率时,一个好的近似规则是蓝细菌伴侣可以支持伴随的异养细胞的相等细胞体积。由于真核酵母的细胞体积往往比模型分泌蔗糖的蓝细菌大得多,这可能意味着在稳态下蓝细菌细胞的密度会高得多(例如,酿酒酵母的 50-100 倍)。因此,在与研究人员特定的实验室和物种条件建立新的共培养物时,一个好的起点是计算蓝细菌和酵母的平均细胞体积(基于已公布的值;例如,参见B10NUMB3R537)以估计体积比率。初始培养瓶可以用这种细胞比例接种。为了探索解决方案空间,研究人员可能希望保持蓝藻的浓度恒定(例如,OD750 = 0.3),同时根据研究人员可用的光养培养空间允许的通量,以增量将酵母细胞的浓度向上或向下改变大约一个数量级。当然,这个体积“经验法则”取决于光养伙伴能够分泌可被异养伙伴利用的有机光合产物(例如蔗糖)的速率。一旦确定了共培养条件,仔细监测双方随时间推移的生长性能将提供有关理想物种比例的宝贵数据,特别是如果早期共培养可以维持数天到数周,从而使研究人员能够确定共培养接近结束时达到的稳态比率。在后续实验中为每个伙伴物种选择初始接种密度时,可以利用此信息来帮助培养物更快地达到自我确定的理想物种比例。
在协议的第二部分,提供了共培养分析的详细说明。共培养物的可靠定量是其成功实施的关键:向光性、分泌碳的伴侣的生长(或至少代谢活性)对于维持异养生物至关重要。虽然用于接种培养物的蓝细菌:异养菌的比例可能并不总是优化的关键,但由于长期共培养物趋于稳定比例,因此整合方法以通过培养稀释或封装一个或多个物种来检查任一伴侣的无限制生长可能很重要 36,38,39,40.如上所述,蓝藻伴侣的副产物在高浓度(例如 O2)下可能对异养生物具有抑制作用,并且异养代谢的一些产物也可能对蓝藻健康有害。大多数已发表的共培养物利用的异养生物比大多数模型蓝藻物种具有更快的生长速度;因此,异养生长速率往往受到蓝细菌产生的有机碳供应的限制。尽管如此,确定物种丰度动态随时间的变化对于阐明稳定性失败和优化长期培养中稳健的共培养物至关重要。
提供了使用计数室、粒子计数器和单细胞流式细胞术进行定量的方案。所有技术都是表征共培养物的宝贵工具,但是,具有不同的先决条件、优点和局限性。计数室非常广泛地适用于共培养定量,前提是培养物中的所有伴侣都可以通过其细胞形状或其他特性进行视觉区分。最大的优点是该设备的价格低廉,因此基本上每个实验室都可以实现。除了有关不同伴侣的共培养组成和比例的信息外,还可以获得细胞形态和适应性的印记,并可以检测潜在的污染物。然而,计数室的应用也非常耗时,工作量大,并且只能支持低吞吐量。
粒子计数仪和单细胞流式细胞术都具有高通量和方便、省时的处理等巨大优势。虽然细胞计数仪依赖于共培养物中伴侣细胞大小的明显差异,但单细胞细胞术也可以区分荧光标记,从而能够根据不同的荧光标记物量化具有两个以上相同大小的成员甚至同一生物体的两个不同突变体的共培养物。在提供的 集胞藻 与 酿酒酵母 和 U. maydis 人工组装的示例中,使用细胞内荧光报告基因 mKate2 和 eGFP 来区分这两种酵母。相同的荧光报告基因也可用于区分同一生物体(例如 酿酒酵母)的两种转基因菌株,这些菌株不能仅根据它们的光散射特性进行分离。已经实施了类似的策略来跟踪合成细菌联盟41。根据细胞类型、联盟中合作伙伴的数量及其潜在的自发荧光范围,荧光标记物的选择需要特别注意,以避免光谱质量重叠,特别是考虑到蓝细菌的自发荧光特性。42
我们在这里倡导如何在科学数据的存储、管理和共享方面遵守 FAIR 指导原则。FAIR 是 Findable、Accessible、Interoperable 和 Reusable43 的首字母缩写词。随着这些原则得到更广泛的接受,它们有望改变生物研究的格局,促进一种更加开放、协作和高效的数据管理和使用方法。虽然可以通过将数据存入注释研究上下文 (ARC) 44 来确保可访问性的关键组成部分,但使用开放获取软件实现数据处理步骤的复制也很重要。原始 FCS 文件存储有关流式细胞术实验的数据和元数据(有关激光器和检测器的信息,包括波长、滤光片等)45。它们可以在允许进行复杂数据分析的专有软件之外加载和读取,例如,有许多软件包可用于在 Python 环境中处理原始数据。开发的软件包演示了如何使用 Python23 中的许多可用软件包之一在专有软件之外加载、读取和可视化包含细胞术数据的原始 .fcs 文件。使用上述开放软件无需与专有软件相关的昂贵许可费用,提供对数据处理(例如转换、补偿、门控)的完全控制,并且还允许将众多工具集成到一个地方。
将单细胞细胞术与细胞分选仪结合使用的一个有价值的额外好处是,还可以通过 FACS 收集不同类型的细胞。这对于应用任何组学技术来详细了解共培养物中的物种相互作用(如 RNASeq 或代谢组学)都非常有价值。这些设备的明显缺点是价格高,因此此类机器的可负担性和可用性可能是某些实验室的明显限制。
有趣的是,对财团中三个合作伙伴提出的定量方法的直接比较表明,不同技术之间的一致性非常好,表明基于 OD 测量组装的混合物可以通过所有描述的方法进行可靠的量化。有趣的是,蓝藻的总数大约是两种酵母种类数量的 3-4 倍,这种现象可能是由于它们的细胞大小较小。这一观察结果非常符合常识,即 OD 不会在没有校准的情况下提供有关实际细胞数的信息46。然而,酵母的计数水平相当(表 2 和 表 3)。此外,与单一培养物的定量分析的比较表明,所有三种方法都是区分细胞类型的可靠工具,但未分离两种酵母种类的粒子计数器除外。
从本质上讲,单细胞细胞术应用显然是监测共培养物组成的最强大工具,每秒可计数 1,000-10,000 个细胞。如果伙伴的数量增加到两个以上,或者如果伙伴的形状和/或直径相似,则尤其如此。值得注意的是,有很多替代方案可以监控共培养物。例如,可以通过荧光测定法或微型生物反应器连续跟踪共培养物中荧光标记微生物的生长47。然而,这些通常仅限于两个伙伴的共培养,并且需要仔细的实验设计,例如,在荧光标记物的选择方面。扩增子测序(16S rRNA 测序)和其他下一代测序技术与复杂的生物信息学相结合是表征合成群落的另一种选择 48,49,50。这些技术适用于高通量方法,可以解决长期培养、进化问题或与多种微生物伙伴的突变跟踪中已建立的相互作用。
综上所述,设计合理的简单微生物共培养物提供了一种强大的“自下而上”的方法,用于询问物种间动态,这在主导自然界的多物种群落中可能更难接近 51,52,53。在此,提供了一种简化的方案,科学界可以很容易地适应该方案,用于建立和分析新的蓝细菌和异养伴侣对。很明显,需要进行大量研究,以利用可能从人工微生物共培养中获得的潜在基本见解,并确定合成设计的微生物群落是否能够与文献中通常赋予它们的潜力相匹配,用于生物技术应用。
披露声明
作者没有什么可披露的。
致谢
这项工作由 Deutsche Forschungsgemeinschaft(DFG,德国研究基金会)- SFB1535 - 项目 ID 458090666(项目 B03 到 KS、AM 和 IA)和主要研究仪器 INST 208/808-1 资助。DCD 目前正在作为 SFB1535 的墨卡托研究员访问杜塞尔多夫 HHU。美国国家科学基金会奖 #1845463 和 #2334680 为 EJK 提供了额外的支持。
材料
| Name | Company | Catalog Number | Comments |
| 10x Ph1 objective | Carl Zeiss AG | 46 04 01-9904 | |
| 525/40 nm Bandpass Filter | Beckman Coulter, Inc. | A01-1-0051 | FITC filter (in 488 nm laser) |
| 660/10 nm Bandpass Filter | Beckman Coulter, Inc. | A01-1-0055 | APC channel (in 638 nm laser) |
| 710/50 nm Bandpass Filter | Beckman Coulter, Inc. | B71092 | PC5.5 channel (in 561 nm laser) |
| Accuvettes for Multisizer 4e | Beckman Coulter, Inc. | A35473 | Sample cups with lids |
| Aperture tube 30 μM for Multisizer 4e | Beckman Coulter, Inc. | C92760 | Capillary |
| Autoclave | Lab Associates | EQM-ARBP | for sterilisation of material |
| Baffled flasks ROTILABO®, Straight neck, 250 ml | Carl Roth GmbH + Co. KG | LY95.1 | |
| BG11 / CoYBG11 components | different suppliers | see Table 1 | |
| Bottle top sterile filter | Sigmaaldrich | Z222593 | to sterile media if you dont want to use autoclave |
| Capillary 45 µm | Omni Life Science | OLS 5651738 | |
| CASY Cell Counter Model TTC | Schaerfe Systems | ||
| CASY cups | Omni Life Science | OLS 5651794 | |
| CASYclean | Omni Life Science | OLS 5651786 | Cleaning solution |
| CASYton solution | Omni Life Science | OLS 5651808 | Isotonic solution |
| Centrifuge tubes (50 mL) | Sigmaaldrich | CLS430828 | |
| CO2 | BOC | 270182-L | to supply cyanobacteria axenic cultures and co-cultures |
| CONTRAD® 70 | Beckman Coulter, Inc. | 81911 | Deep clean solution |
| Cover glass 20 × 26 x 0.4 mm | VWR International GmbH | 631-1190 | Cover glass for counting chamber |
| Cuvettes | Sarstedt | 67.742 | |
| Cyanobacteria BG-11 Freshwater Solution | Merck KGaA | C3061 | |
| CytExpert Software v. 2.6 | Beckman Coulter, Inc. | Cytometer application software | |
| CytoFLEX Sheath Fluid | Beckman Coulter, Inc. | B51503 | Sheat fluid |
| Cytometer CytoFLEX S | Beckman Coulter, Inc. | BE51180 | |
| DxH Cleaner for Multisizer 4e | Beckman Coulter, Inc. | 628022 | Cleaning solution |
| Eppendorf tube centrifuge (small) | Labstac | CEN16-15 | to centrifuge less than 2mL of culture |
| Ethanol | Carl Roth GmbH + Co. KG | K928.1 | |
| FACS tubes | Beckman Coulter, Inc. | 2523749 | tubes for semi-automatic mode |
| FlowClean Cleaning Agent, 500ml | Beckman Coulter, Inc. | C48093 | Daily clean solution |
| Graduated cylinders | Sigmaaldrich | Z131121 | for preparation of media |
| HEPPSO | Merck KGaA | R426725 | |
| Infors MultiTron photoincubator | Infors AG | white LED light | |
| IPTG | Merck KGaA | I6758 | Prepare aliquots, store at -20°C, thaw and keep on ice |
| Isoton II for Multisizer 4e | Beckman Coulter, Inc. | 8448011 | Isotonic solution |
| Kaluza v. 2.2 | Beckman Coulter, Inc. | B16406 | Cytometry data analysis software |
| KimWipes | VWR International GmbH | 115-2221 | Lint-free tissues |
| KOH | Merck KGaA | 221473 | |
| KPO3 | Noah Chemicals | 7790-53-6 | |
| Measuring beakers | VWR | 213-3747 | |
| Micro test plate, 96 well, slip-on lid, flat base, PS, transparent | SARSTEDT AG & Co. KG | 82.1581.001 | |
| Microscope base | Carl Zeiss AG | 47 09 18-9902/16 | |
| Microsope head | Carl Zeiss AG | 47 30 14 | |
| Milli-Q water purification system | Merck Millipore | C85358 | |
| Mulitisizer 4e particle counter | Beckman Coulter, Inc. | B23005 | Alternative to the CASY Cell Counter |
| Neubauer improved, depth 0.02 mm | Assistent Germany | Counting chamber | |
| Neubauer improved, depth 0.1 mm | Paul Marienfeld GmbH & Co. KG | 640010 | Counting chamber |
| Ready to Use Daily QC Fluorospheres | Beckman Coulter, Inc. | C65719 | Reference for QC |
| SCHOTT bottles | Dutscher | 90347 | for storage |
| Specord®200 Plus Spectrophotometer | Analytic Jena GmbH | OD600/750 | |
| Sucrose | Merck KGaA | 84100 | |
| Table top centrifuge (big) | Labstac | CEN18-06R | collect culture biomass |
| Yeast Nitrogen Base, without amino acids, without ammonium sulfate | Thermo Fisher Scientific Inc. | 11743014 |
参考文献
- Roell, G. W., Zha, J., Carr, R. R., Koffas, M. A., Fong, S. S., Tang, Y. J. Engineering microbial consortia by division of labor. Microb Cell Factories. 18 (1), 35 (2019).
- Grandel, N. E., Reyes Gamas, K., Bennett, M. R. Control of synthetic microbial consortia in time, space, and composition. Trends Microbiol. 29 (12), 1095-1105 (2021).
- Weiland-Bräuer, N. Friends or Foes-Microbial Interactions in Nature. Biology. 10 (6), (2021).
- Santos-Merino, M., Yun, L., Ducat, D. C. Cyanobacteria as cell factories for the photosynthetic production of sucrose. Front Microbiol. 14, 1126032 (2023).
- Klähn, S., Hagemann, M. Compatible solute biosynthesis in cyanobacteria. Environ Microbiol. 13 (3), 551-562 (2011).
- Dean, P. N., Bagwell, C. B., Lindmo, T., Murphy, R. F., Salzman, G. C. Introduction to flow cytometry data file standard. Cytometry. 11 (3), 321-322 (1990).
- Rippka, R., Stanier, R. Y., Deruelles, J., Herdman, M., Waterbury, J. B. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria. Microbiology. 111 (1), 1-61 (1979).
- Hays, S. G., Yan, L. L. W., Silver, P. A., Ducat, D. C. Synthetic photosynthetic consortia define interactions leading to robustness and photoproduction. J Biol Eng. 11, 4 (2017).
- Ducat, D. C., Avelar-Rivas, J. A., Way, J. C., Silver, P. A. Rerouting carbon flux to enhance photosynthetic productivity. Appl Environ Microbiol. 78 (8), 2660-2668 (2012).
- Thiel, K., et al. Redirecting photosynthetic electron flux in the cyanobacterium Synechocystis sp. PCC 6803 by the deletion of flavodiiron protein Flv3. Microb Cell Factories. 18 (1), 189 (2019).
- Song, K., Tan, X., Liang, Y., Lu, X. The potential of Synechococcus elongatus UTEX 2973 for sugar feedstock production. Appl Microbiol Biotechnol. 100 (18), 7865-7875 (2016).
- Feng, J., et al. Generation and comprehensive analysis of Synechococcus elongatus-Aspergillus nidulans co-culture system for polyketide production. Biotechnol Biofuels Bioprod. 16 (1), 32 (2023).
- Li, T., et al. Mimicking lichens: incorporation of yeast strains together with sucrose-secreting cyanobacteria improves survival, growth, ROS removal, and lipid production in a stable mutualistic co-culture production platform. Biotechnol Biofuels. 10, 55 (2017).
- JoVE Science Education Database. Microbiology. Growth Curves: Generating Growth Curves Using Colony Forming Units and Optical Density Measurements. , (2023).
- . . Yeast Extract-Peptone-Dextrose (YEPD). (9), (2015).
- Zhang, M., et al. Improvement of cell counting method for Neubauer counting chamber. J Clin Lab Anal. 34 (1), e23024 (2020).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies. Eu J Immunol. 47 (10), 1584-1797 (2017).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eu J Immunol. 51 (12), 2708-3145 (2021).
- Shapiro, H. M. . Practical Flow Cytometry. , (2003).
- Tung, J. W., et al. Modern flow cytometry: a practical approach. Clin Lab Med. 27 (3), 453-468 (2007).
- JoVE Science Education Database. . Flow Cytometry. , (2023).
- Cheung, M., Campbell, J. J., Whitby, L., Thomas, R. J., Braybrook, J., Petzing, J. Current trends in flow cytometry automated data analysis software. Cytometry A. 99 (10), 1007-1021 (2021).
- . FlowCytometryTools: Version 0.4.5 Available from: https://pypi.org/project/FlowCytometryTools/ (2021)
- White, S., et al. FlowKit: A Python Toolkit for Integrated Manual and Automated Cytometry Analysis Workflows. Front Immunol. 12, 768541 (2021).
- O'Neill, K., Aghaeepour, N., Spidlen, J., Brinkman, R. Flow cytometry bioinformatics. PLoS Comput Biol. 9 (12), e1003365 (2013).
- Klement, T., Milker, S., Jäger, G., Grande, P. M., Domínguez de María, P., Büchs, P. Biomass pretreatment affects Ustilago maydis in producing itaconic acid. Microb Cell Factories. 11, 43 (2012).
- Koschwanez, J. H., Foster, K. R., Murray, A. W. Sucrose utilization in budding yeast as a model for the origin of undifferentiated multicellularity. PLoS Biol. 9 (8), e1001122 (2011).
- Koschwanez, J. H., Foster, K. R., Murray, A. W. Improved use of a public good selects for the evolution of undifferentiated multicellularity. ELife. 2, e00367 (2013).
- Winston, F., Dollard, C., Ricupero-Hovasse, S. L. Construction of a set of convenient Saccharomyces cerevisiae strains that are isogenic to S288C. Yeast. 11 (1), 53-55 (1995).
- Shcherbo, D., et al. Far-red fluorescent tags for protein imaging in living tissues. Biochem J. 418 (3), 567-574 (2009).
- Brachmann, A., Weinzierl, G., Kämper, J., Kahmann, R. Identification of genes in the bW/bE regulatory cascade in Ustilago maydis. Mol Microbiol. 42 (4), 1047-1063 (2001).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173 (1 Spec), 33-38 (1996).
- Behle, A., Saake, P., Germann, A. T., Dienst, D., Axmann, I. M. Comparative dose-response analysis of inducible promoters in cyanobacteria. ACS Synth Biol. 9 (4), 843-855 (2020).
- Lindemann, S. R., et al. Engineering microbial consortia for controllable outputs. ISME J. 10 (9), 2077-2084 (2016).
- Duncker, K. E., Holmes, Z. A., You, L. Engineered microbial consortia: strategies and applications. Microb Cell Factories. 20 (1), 211 (2021).
- Fedeson, D. T., Saake, P., Calero, P., Nikel, P. I., Ducat, D. C. Biotransformation of 2,4-dinitrotoluene in a phototrophic co-culture of engineered Synechococcus elongatus and Pseudomonas putida. Microb Biotechnol. 13 (4), 997-1011 (2020).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers-the database of key numbers in molecular and cell biology. Nucleic Acids Res. 38 (suppl_1), D750-D753 (2009).
- Tóth, G. S., et al. Photosynthetically produced sucrose by immobilized Synechocystis sp. PCC 6803 drives biotransformation in E. coli. Biotechnol Biofuels Bioprod. 15 (1), 146 (2022).
- Weiss, T. L., Young, E. J., Ducat, D. C. A synthetic, light-driven consortium of cyanobacteria and heterotrophic bacteria enables stable polyhydroxybutyrate production. Metabol Eng. 44, 236-245 (2017).
- Zhang, L., Chen, L., Diao, J., Song, X., Shi, M., Zhang, W. Construction and analysis of an artificial consortium based on the fast-growing cyanobacterium Synechococcus elongatus UTEX 2973 to produce the platform chemical 3-hydroxypropionic acid from CO2. Biotechnol Biofuels. 13, 82 (2020).
- Jorrin, B., et al. Stable, fluorescent markers for tracking synthetic communities and assembly dynamics. Microbiome. 12 (1), 81 (2024).
- Yokoo, R., et al. Live-cell imaging of cyanobacteria. Photosynth Res. 126, 36-46 (2015).
- Wilkinson, M. D., et al. The FAIR guiding principles for scientific data management and stewardship. Sci Data. 3, 160018 (2016).
- Venn, B., et al. Fostering the democratization of research data by using the Annotated Research Context (ARC) as practical implementation. E-Science-Tage 2021: Share Your Research Data. , (2021).
- Ortolani, C. The Cytometric File. Flow Cytometry Today: Everything You Need to Know about Flow Cytometry. , (2022).
- Beal, J., et al. Robust estimation of bacterial cell count from optical density. Communi Biol. 3 (1), 512 (2020).
- Funke, M., et al. Microfluidic biolector-microfluidic bioprocess control in microtiter plates. Biotechnol Bioeng. 107 (3), 497-505 (2010).
- Zhang, P., Spaepen, S., Bai, Y., Hacquard, S., Garrido-Oter, R. Rbec: a tool for analysis of amplicon sequencing data from synthetic microbial communities. ISME Commun. 1 (1), 73 (2021).
- Ezzamouri, B., Shoaie, S., Ledesma-Amaro, R. Synergies of systems biology and synthetic biology in human microbiome studies. Front Microbiol. 12, 681982 (2021).
- Zaramela, L. S., Tjuanta, M., Moyne, O., Neal, M., Zengler, K. synDNA-a synthetic DNA spike-in method for absolute quantification of shotgun metagenomic sequencing. mSystems. 7 (6), e0044722 (2022).
- Bittihn, P., Din, M. O., Tsimring, L. S., Hasty, J. Rational engineering of synthetic microbial systems: from single cells to consortia. Curr Opin Microbiol. 45, 92-99 (2018).
- San León, D., Nogales, J. Toward merging bottom-up and top-down model-based designing of synthetic microbial communities. Curr Opin Microbiol. 69, 102169 (2022).
- Fedeson, D. T., Ducat, D. C. . Symbiotic Interactions of Phototrophic Microbes: Engineering Synthetic Consortia for Biotechnology. Role of Microbial Communities for Sustainability. , (2021).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。