Method Article
Сборка и количественное определение сокультур, сочетающих гетеротрофные дрожжи с фототрофными сахаросекретящими цианобактериями
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол содержит исчерпывающие рекомендации по настройке и количественному мониторингу кокультур, включая фотоавтотрофные сахаросекретящие цианобактерии и гетеротрофные дрожжи.
Аннотация
В связи с растущим спросом на устойчивые биотехнологии смешанные консорциумы, содержащие фототрофные микробы и гетеротрофные виды-партнеры, изучаются в качестве метода биопроизводства с использованием солнечной энергии. Один из подходов включает в себя использование цианобактерий, фиксирующихCO2, которые выделяют органический углерод для поддержки метаболизма совместно культивируемого гетеротрофа, который, в свою очередь, преобразует углерод в товары или услуги с более высокой стоимостью. В настоящем протоколе приводится техническое описание, помогающее экспериментатору в создании кокультуры, сочетающей секретирующий сахарозу штамм цианобактерий с грибковым партнером (партнерами), представленным модельными видами дрожжей. В протоколе описаны ключевые предпосылки для создания кокультур: определение состава среды, мониторинг характеристик роста отдельных партнеров и анализ смешанных культур с несколькими видами, объединенных в одном сосуде для выращивания. Обобщены основные лабораторные методы мониторинга кокультур, включая микроскопию, клеточный счетчик и проточную цитометрию одиночных клеток, а также приведены примеры непатентованного программного обеспечения, используемого для анализа данных файлов стандарта необработанной проточной цитометрии (FCS) в соответствии с принципами FAIR (Findable, Accessible, Interoperable, Reusable). Наконец, в книгу включены комментарии о узких местах и подводных камнях, часто возникающих при попытке создания совместной культуры с сахаросекретящими цианобактериями и новым гетеротрофным партнером. Этот протокол предоставляет ресурс для исследователей, пытающихся создать новую пару совместно культивируемых микробов, которая включает цианобактерию и гетеротрофный микроб.
Введение
С быстрым распространением геномных инструментов и технологий ДНК в последние годы биоинженерные усилия все чаще рассматривают смешанные сообщества микробов как жизнеспособные для стратегий биопроизводства, а не сосредотачиваются исключительно на аксенических культурах. Микробные консорциумы обладают множеством потенциальных преимуществ по сравнению с одновидовыми культурами, включая специализацию и разделение труда, адаптивность и надежность, а такжеэффективность использования субстрата. Однако предсказуемая инженерия многовидовых консорциумов осложняется неопределенностями, вызванными поведением более высокого порядка, возникающим в результате межвидовых взаимодействий2. Межвидовая передача сигналов и обмен метаболитами лежат в основе принципа разделения труда, но также приводят к неожиданным синергиям и антагонизмам между участниками консорциумов. Для полной реализации потенциала смешанных микробных консорциумов необходимо значительное развитие в этой области, включая использование гибких платформ для совместного культивирования с 2 и 3 партнерами, которые могут быть использованы для лучшей характеристики и понимания микробной интерактивности «снизу вверх».
В настоящее время в этой области используется несколько доминирующих типов платформ совместного культивирования, в том числе комплементарные ауксотрофные партнеры и микробы, которые выделяют метаболиты, которые в целом полезны для широкого спектра видов микроорганизмов. В последней категории цианобактерии были спроектированы таким образом, чтобы стать усиленными первичными продуцентами за счет внедрения путей, ведущих к секреции легко усваиваемых углеводов, и в настоящее время исследуются в различных рационально разработанных консорциумах. Вкратце, в таких сконструированных микробных сообществах цианобактериальный партнер способен использовать свет иCO2 в качестве основных входов, и в процессе кислородного фотосинтеза эти штаммы могут выделять центральные углеродные сахара в качестве общественного блага. Одним из классов таких сконструированных штаммов цианобактерий являются те, которые были сконструированы для секреции дисахарида сахарозы4. Такие штаммы, вероятно, пользуются своим успехом, потому что сахароза является метаболитом, который близок к центральному метаболизму углерода у многих видов, а также часто гипераккумулируется в виде так называемого «совместимого растворенного вещества» для адаптации к различным экологическим абиотическим стрессам. Минимальное количество генетических вмешательств может привести к эффективной секреции сахарозы в ряде модельных цианобактериальных организмов4.
Секретирующие сахарозу цианобактерии являются полезной платформой для исследования рационально спроектированных микробных консорциумов, поскольку широкий спектр гетеротрофных видов может метаболизировать сахарозу в качестве доминирующего источника углерода и энергии. Действительно, используя несколько модельных цианобактерий, обладающих способностью секретировать сахарозу, многие лаборатории рационально разработали смешанные культуры и консорциумы, которые содержат один или несколько гетеротрофных микробов и которые в конечном итоге поддерживаются за счет первичного поступления света иCO2 без добавок к минеральному углеродному сырью.. Гетеротрофные штаммы могут просто существовать на углеводах, полученных из цианобактерий, или они могут быть использованы для преобразования сахарозного сырья в более ценные биопродукты (например, топливо, полимеры, пигменты и т.д.). Помимо того, что такие упрощенные совместные культуры являются потенциальной стратегией устойчивого биопроизводства, они также могут быть полезны в качестве платформы для исследования возникающих взаимодействий между неродственными видами микроорганизмов.
В этой видеостатье основное внимание уделяется методологиям и предпосылкам использования цианобактерий, производящих сахар, в качестве гибкой платформы для создания простых микробных консорциумов, которые могут быть стабильными, дополняя только легкий и неорганический углерод. В то время как настройка и мониторинг культур, содержащих отдельные укоренившиеся микроорганизмы, в основном просты и могут быть легко достигнуты с помощью метода оптической плотности (OD) или обратного рассеяния, это невозможно сделать после объединения двух или более организмов в одном сосуде. Основная причина заключается в том, что эти методы не делают различий между различными микроорганизмами, следовательно, они дают только общую картину культуры и не решают проблему роста отдельных организмов. Кроме того, цианобактерии имеют широкий спектр поглощения в диапазоне 400-750 нм, поэтому измерение наружного диаметра600 гетеротрофа привело бы к ложным результатам из-за фикоцианина (который поглощается с длиной волны 620 нм). В связи с этим в настоящее время разрабатываются специальные протоколы для создания цианобактериально-гетеротрофных смешанных сообществ в лаборатории, а также полезные общие протоколы для анализа деятельности этих консорциумов с течением времени. В то время как протоколы сосредоточены на конкретном спаривании модельных видов цианобактерий, секретирующих сахарозу, с одним или несколькими модельными гетеротрофными микробами, цель данной работы состоит в том, чтобы предоставить ресурс для исследователей, которые могут захотеть разработать новые спаривания видов, и ускорить фазу оптимизации для создания таких культур. Таким образом, в дополнение к видоспецифичным протоколам включается информация и стратегии, которые могут быть использованы для адаптации и обобщения этих протоколов для пользовательских сообществ, как это определено потребностями читателя.
Из-за гибкости описанной здесь платформы совместного культивирования описаны протоколы для ряда различных гетеротрофных видов, о которых ранее сообщалось при совместном культивировании с сахар-секретирующими цианобактериями. Например, приведен пошаговый протокол совместного культивирования Synechococcus elongatus PCC 7942 с распространенными лабораторными дрожжами Saccharomyces cerevisiae . Тем не менее, статья также включает протоколы, которые подходят для оценки производительности сокультур, содержащих другие модельные виды, включая дрожжевую форму Ustilago maydis.
Статья посвящена основному набору протоколов, необходимых для установления цианобактериальной/гетеротрофной кокультуры и выполнения базовой характеристики производительности этих смешанных консорциумов с течением времени. В частности, особое внимание уделяется методам проточной цитометрии и подсчета частиц, подходящим для точной переписи различных видов, а также микроскопическим подходам для оценки морфологии клеток. Эти протоколы призваны служить основой для адаптации к потребностям и имеющемуся оборудованию. Важно отметить, что в нем содержатся технические примечания и другие соображения, которые важны для установления и мониторинга совместных культур в лаборатории. Наконец, включены примеры непроприетарных альтернатив для анализа данных необработанных файлов FCS6 с использованием пакетов Python. Таким образом, цель состоит в том, чтобы сделать методы совместного культивирования на основе цианобактерий более доступными для более широкой научной аудитории.
протокол
ПРИМЕЧАНИЕ: Этот протокол содержит подробные инструкции по настройке и количественному определению сокультур сахаросекретящих видов S. elongatus и гетеротрофных модельных видов дрожжей. В целом, протокол применим к любым видам дрожжей, поддающимся генетическим манипуляциям.
1. Создание кокультур, сочетающих фототрофные цианобактерии и гетеротрофные дрожжи
- Подготовка к совместному выращиванию: среда и предварительное выращивание
ПРИМЕЧАНИЕ: Приготовьте все среды и исходные растворы, используя ультрачистую фильтрованную воду. Вся стеклянная посуда (мерные стаканы, мерные цилиндры, бутылки для хранения и колбы для выращивания) должна быть очищена и автоклавирована. Стерильные носители можно хранить при комнатной температуре (ОТ). Должно быть в наличии устройство, совместимое с требованиями фотоавтотрофного выращивания.- Приготовьте среду для совместного культивирования не менее чем за 3-4 дня до предполагаемого начала совместного культивирования. Большинство рецептов сокультураемых сред являются вариациями обычной среды BG-117 , используемой для рутинного культивирования многих модельных видов цианобактерий. В этом протоколе в качестве примера используется ранее описанная среда CoYBG-11 (8; таблицу 1). Автоклав (121 °C, 20 мин) или фильтр стерилизуют (размер пор 0,22 мкм) подготовленную среду, в зависимости от необходимости.
ПРИМЕЧАНИЕ: Смотрите раздел «Обсуждение» для предложений по адаптации среды, подходящей для спаривания других видов. - Получение молекулярных реагентов: Для индукции экспрессии cscB и экспорта сахарозы 9,10,11 необходимо подготовить 1 М запас изопропил-β-тиогалактозида (IPTG).
ПРИМЕЧАНИЕ: Использование антибиотиков во время совместного культивирования является неоптимальным, но если все штаммы имеют кассеты с резистентностью, их можно использовать. В этом случае подготовьте запасы антибиотиков в соответствии с потребностями используемых штаммов. - Приготовьте предварительную культуру цианобактерий: Не менее чем за 3 дня до начала совместной культуры перенесите клетки из предкультуры сахар-секретирующего штамма цианобактерий, растущего в среде BG-11, в свежую колбу, содержащую средуCoY BG-11 (Таблица 1).
Примечание: В настоящее время несколько видов и штаммов цианобактерий модифицированы для выделения сахаров. Всесторонний обзор штаммов, доступных на момент написания этой статьи, см.в разделе 4. В данной ссылке также перечислены гетеротрофные виды (см. 1.1.4), для которых ранее сообщалось о совместном культивировании цианобактерий.- Измерьте внешний диаметр750 для прекультуры. Рассчитайте необходимый объем прекультуры для достижения целевого наружного диаметра750 0,3 (С1) с использованием уравнения V1 = C2 x V2/C1 , где C2 = целевой наружный диаметр, V2 = целевой объем и V1 = требуемый объем предкультуры. Например, при инокуляции культуры объемом 30 мл (V2) количество x используемой жидкой культуры равно V1 (мл) = (0,3 x 30)/(измеренный наружный диаметр750).
ПРИМЕЧАНИЕ: Оптическая плотность является приближением плотности клеток и зависит от условий роста и морфологии клетки; Таким образом, исследователям необходимо использовать методы корреляции оптической плотности с абсолютным числом клеток (см. разделы 2.1, 2.2 и 2.3) для правильной оценки эффективности кокультуры. Для цианобактерий длины волн света в пределах фотосинтетически активного спектра (т.е. 400-700 нм) не следует использовать для определения оптической плотности, поскольку они поглощаются хлорофиллом и другими пигментами; Поэтому обычно используются дальние красные длины волн (например, 750 нм). - Инкубируйте разведенную культуру в соответствующем фотоинкубаторе. Типичная инкубация
условия для цианобактерий модели: 30 °C, 150 об/мин (ход 25 мм), свободное пространство 2% CO2 , ~200 μмоль фотонов m-2·s-1 светодиодного освещения, 75% влажности.
ПРИМЕЧАНИЕ: Добавки сCO2 настоятельно рекомендуются для оптимизации количества выделяемой сахарозы. - Повторяйте этот процесс разведения каждый день в течение не менее 3 дней перед формированием совместного культивирования, чтобы убедиться, что цианобактерии находятся в экспоненциальном росте. Это поможет улучшить согласованность в производительности совместной культуры между экспериментами на разные дни.
- Измерьте внешний диаметр750 для прекультуры. Рассчитайте необходимый объем прекультуры для достижения целевого наружного диаметра750 0,3 (С1) с использованием уравнения V1 = C2 x V2/C1 , где C2 = целевой наружный диаметр, V2 = целевой объем и V1 = требуемый объем предкультуры. Например, при инокуляции культуры объемом 30 мл (V2) количество x используемой жидкой культуры равно V1 (мл) = (0,3 x 30)/(измеренный наружный диаметр750).
- Не менее чем за 2 дня до начала совместной культуры подготовьте гетеротрофную предкультуру. Как уже отмечалось, ряд видов и субштаммов дрожжей ранее выращивался в совместной культуре с цианобактериями 8,12,13.
- Переведите клетки в соотношении 1:100 (250 мкл) из жидкой культуры гетеротрофных видов, выращиваемых в богатом бульоне для культивирования (см. таблицу 1), в 50 мл средыCoY BG-11 с добавлением 20 г/л сахарозы в колбе объемом 250 мл.
- Инкубируйте в течение ночи при той же температуре, что и условия культивирования, используемые для партнера цианобактерий.
- Проверьте наружный диаметр600 не менее чем за 24 ч до предполагаемого времени инокуляции ко-культуры, чтобы убедиться, что гетеротрофный штамм достаточно вырос для экспериментальных нужд (см. 1.2): при необходимости разведите в свежей среде для поддержания экспоненциального роста.
- Приготовьте среду для совместного культивирования не менее чем за 3-4 дня до предполагаемого начала совместного культивирования. Большинство рецептов сокультураемых сред являются вариациями обычной среды BG-117 , используемой для рутинного культивирования многих модельных видов цианобактерий. В этом протоколе в качестве примера используется ранее описанная среда CoYBG-11 (8; таблицу 1). Автоклав (121 °C, 20 мин) или фильтр стерилизуют (размер пор 0,22 мкм) подготовленную среду, в зависимости от необходимости.
- Кокультуральная инокуляция и обслуживание
ПРИМЕЧАНИЕ: Смотрите раздел «Обсуждение» для рассмотрения вопроса о соотношении инокуляции между фото- и гетеротрофными микроорганизмами.- Для инокуляции сокультуры обогатите обе прекультуры центрифугированием.
- Рассчитайте объем концентрированной клеточной суспензии для достижения желаемой начальной плотности для обоих видов с использованием стандартного уравнения C1 x V1 = C2 x V2 , где C1 = OD обогащенной культуры. Например, для получения культуры S. elongatus объемом 25 мл с начальным наружным диаметром750 0,5 (из аксенической культуры с 1,5 OD) и S. cerevisiae с начальным наружным диаметром600 0,05 (из аксенической культуры с наружным диаметром 0,7), основанной на приведенном выше уравнении, необходимо 8,33 мл исходной культуры S. elongatus , 1,79 мл обогащенной гетеротрофной культуры, и 14,88 мл средыCoY BG-11 .
- Центрифугируйте культуры с использованием 13 000 x g в течение 10 минут при RT. В стерильных условиях сцедите и выбросьте надосадочную жидкость.
Примечание: Меньшая относительная центробежная сила (RCF; xg) может быть использована для гранулирования S. cerevisiae , поскольку они являются более крупными клетками (в 2-3 раза) по сравнению с S. elongatus, но следите за тем, чтобы надосадочная жидкость стала прозрачной. Для сбора биомассы цианобактерий также можно использовать менее 13000 х г , но для центрифугирования потребуется больше времени (например, 4 000 х г можно использовать в течение 20 минут). - Ресуспендируйте гранулу цианобактерий в 25 мл стерильной средыCoY BG-11 . Используйте те же условия центрифугирования, что и раньше, после этого выбросьте и сцедите надосадочную жидкость.
- Повторите этот процесс дважды для S. elongatus и еще 4 раза для S. cerevisiae.
ПРИМЕЧАНИЕ: Важно промыть гранулы цианобактерий и гетеротрофа (S. cerevisiae) для удаления остаточных компонентов среды. Поскольку ранее S. cerevisiae росла в присутствии сахарозы, увеличение количества этапов промывки гарантирует, что возможный остаточный сахар будет удален. - После того, как OD будет проверен, объедините объемы S. elongatus и S. cerevisiae в колбе объемом 250 мл в стерильных условиях и добавьте CoYBG-11 к конечному объему 50 мл. Разбавьте из ранее приготовленного 1 М запаса ИПТГ до конечной концентрации 1 мМ (это необходимо для того, чтобы побудить цианобактерии экспортировать сахарозу в среду). Для посева объемом 50 мл используйте 50 мкл из 1 М материала IPTG.
ПРИМЕЧАНИЕ: Колбы с перегородками обычно лучше, потому что они обеспечивают лучшую аэрацию и перемешивание для цианобактерий. - Поместите колбу с предыдущего шага на 200 μмоль фотонов·м-2·с-1 Светодиодное освещение с добавлением 2%СО2 при 30 °С с орбитальной тряской при 150 об/мин (ход 25 мм) и влажности 75%.
ПРИМЕЧАНИЕ: Вышеупомянутые условия могут варьироваться и должны быть оптимизированы в зависимости от результатов эксперимента. - Контролируйте рост культуры путем стерильного отбора проб (1 мл) каждые 12 или 24 ч (см. раздел 2). При необходимости используйте образцы для выполнения стандартной микроскопии живых клеток и определения колониеобразующих единиц (КОЕ14) дрожжевых клеток на подходящей среде для отслеживания морфологии и приспособленности клеток, а также для мониторинга количества живых гетеротрофных клеток, а также для мониторинга загрязнения.
ПРИМЕЧАНИЕ: КОЕ не рекомендуется использовать в качестве метода точного контроля плотности клеток цианобактерий, которые могут испытывать значительный стресс при переходе от культивирования в жидкой к твердой среде. Поэтому следует выбирать агаровые планшеты с подходящей богатой средой для роста дрожжевых партнеров, таких как пептона декстроза дрожжевого экстракта (YEPD)15.
- Для инокуляции сокультуры обогатите обе прекультуры центрифугированием.
| Химическое соединение | BG-11 (концентрация мг/л) | CoY BG-11 (концентрация мг/л) |
| НаНО3 | 1500 | 1500 |
| К2ГПО4 | 40 | 40 |
| MgSO4,7H 2O | 75 | 75 |
| CaCl2 · 2Ч2О | 36 | 36 |
| Лимонная кислота | 6 | 6 |
| Цитрат железа и аммония | 6 | 6 |
| ЭДТА (динатриевая соль) | 1 | 1 |
| Д/о2СО3 | 20 | 20 |
| Состав микропримесей металлов | ||
| Н3БО3 | 2.86 | 2.86 |
| ZnSO4·7H2O | 0.222 | 0.222 |
| Co(NO3)2 · 6Ч2О | 0.0494 | 0.0494 |
| MnCl2,4H 2O | 1.81 | 1.81 |
| CuSO4 · 5Ч2О | 0.079 | 0.079 |
| НаМоО4.2Ч 2О | 0.39 | 0.39 |
| Дополнительный | ||
| ХЕППСО | 7160 | 7160 |
| Дрожжевая азотистая основа (YNB), без аминокислот, без сульфата аммония | – | 3608, 120013 |
| Титрующий агент pH 8,3 | КО | КО |
| КПО3 | – | 118 |
| Сахароза (только для гетеротрофов) | – | 13690 |
Таблица 1: Состав среды BG-11 и CoYBG-11. Данные о концентрациях дрожжево-азотных оснований в CoYBG-11 получены из литературных источников 8,12,13.
2. Инструменты и методология мониторинга роста сокультур
ПРИМЕЧАНИЕ: Этот протокол является руководством для анализа и мониторинга совместного культивирования, от простых, но трудоемких методов, таких как микроскопия и счетные камеры, до высокопроизводительных приложений, таких как счетчики частиц и проточная цитометрия одиночных клеток. Помимо собственно совместного культивирования, целесообразно включать аксенические культуры отдельных микроорганизмов для проведения всестороннего анализа. В качестве общей отправной точки для аналитики определите OD культур. В этом разделе подробно описаны различные методологии, которые могут быть использованы для преобразования относительных показателей плотности клеток (т.е. OD) в абсолютные значения количества клеток на объем. Измерение OD750 часто используется для определения клеточной плотности культур цианобактерий (из-за поглощения длин волн 400-700 нм), в то время как OD600 используется для гетеротрофных организмов. Оба измерения дают приблизительные ориентировочные значения с условными единицами измерения. Обратите внимание, что значения могут сильно отличаться в зависимости от инструмента.
- Микроскопическое количественное определение с помощью счетных камер
Счетные камеры (т.е. Нейбауэровские (улучшенные)/гемоцитометры) являются простым и недорогим средством для определения состава сокультур, состоящих из клеток, которые можно легко различить морфологически. i.e., по форме их ячеек (Рисунок 1А). Он состоит из предметного стекла микроскопа из толстого стекла и покровного стекла. Если защитное стекло правильно расположено в верхней части предметного стекла, оно создает две прецизионные объемные камеры с выгравированными сетками (Рисунок 1B-Д). Подсчитав определенную площадь сетки, можно рассчитать концентрацию клеток суспензии. Счетные камеры выпускаются с разной глубиной. В зависимости от толщины ячейки следует выбирать подходящую глубину камеры. Для грибковых клеток, таких как U. maydis или S. cerevisiae, Хорошо подходит глубина 0,1 мм. Эта глубина камеры слишком велика для более мелких клеток, таких как цианобактерии, и клетки плавают в камере. Камера глубиной 0,02 мм подходит как для цианобактерий, так и для сокультур цианобактерий и грибов.- Убедитесь, что счетная камера и защитное стекло не содержат пыли и ячеек.
ПРИМЕЧАНИЕ: Непосредственно перед использованием рекомендуется чистить 70% (v/v) этанолом и безворсовыми салфетками. - Чтобы правильно расположить защитное стекло, наденьте его на две опорные планки с небольшим давлением, но будьте осторожны, чтобы не разбиться.
ПРИМЕЧАНИЕ: Для этого применения требуется специальное толстое покровное стекло (см. руководство по камере). Так как покровное стекло иногда разбивается во время сборки, хорошо иметь под рукой запасные части. - Когда покровное стекло расположено правильно, обратите внимание на так называемые кольца Ньютона (рис. 1B) между двумя поверхностями стекла и следите за тем, чтобы покровное стекло больше не скользило.
ПРИМЕЧАНИЕ: Мягкое дыхание на покровное стекло перед сборкой часто улучшает результат. - Тщательно перемешайте клеточную суспензию и нанесите несколько микролитров (~2-10 μл в зависимости от глубины камеры) клеточной суспензии на край камеры и дайте ей полностью заполниться с помощью капиллярной силы. Используйте соответствующее разведение клеточной суспензии для обеспечения надежного подсчета, например, в результате от 20 до 200 клеток на большой квадрат (рис. 1D, красный прямоугольник).
- Используйте подходящий (например, 10-кратный) объектив светового микроскопа (режим светлого поля или фазового контраста) и сосредоточьтесь на линиях сетки счетной камеры. Ориентация обеспечивается сеткой. Начните подсчитывать ячейки в квадратах, подходящих для данного размера ячеек.
ПРИМЕЧАНИЕ: Используйте технические средства, такие как ручной счетчик или соответствующее приложение для смартфона для подсчета (например, общий «счетчик вещей» или специализированные приложения для гемоцитометра, предоставляющие чрезвычайно полезные функции). Определите правило подсчета ячеек, расположенных на границах сетки, чтобы избежать двойного подсчета. Например, ячейки, расположенные на верхней и левой границах каждого квадрата, могут быть подсчитаны, исключая ячейки на правой и нижней границах. Существуют альтернативные правила16. Если используется флуоресцентный микроскоп, клетки также можно различить на основе их автофлуоресценции или флуоресцентных маркеров. - Подсчитав, например, все четыре больших квадрата в углах, определите среднее значение для каждого типа ячеек. Используя эти средние значения, площадь используемого квадрата и глубину данной камеры (см. информацию производителя), рассчитайте концентрации элементов (см. Репрезентативные результаты).
ПРИМЕЧАНИЕ: В зависимости от размера ячейки, для подсчета можно использовать разные квадраты. Для дрожжевых и цианобактериальных клеток хорошо работают четыре больших квадрата в углах (рисунок 1D, красный прямоугольник). - После использования очистите камеру с учетом требований образцов (например, соответствующим образом инактивируйте генетически модифицированные организмы).
- Убедитесь, что счетная камера и защитное стекло не содержат пыли и ячеек.
- Количественная оценка с помощью счетчиков частиц
Примечание: В зависимости от характеристик клеток в сокультуре, для определения количества клеток партнеров может быть применен счетчик частиц. Для применимости этого метода клетки должны сильно отличаться по своим размерам; Например, может быть достигнута дискриминация бактериальных и дрожжевых клеток. Аксенические культуры отдельных микроорганизмов консорциума должны быть включены для интерпретации результатов. Кокультуры, содержащие клетки с одинаковыми размерами или более чем 2 партнерами, должны быть проанализированы с помощью методики, описанной в разделах 2.1 или 2.3.- Препараты
- Отрегулируйте внешний диаметр культуры до 0,1 и разбавьте образец в 1000 раз изотоническим измерительным буфером (см. инструкцию к прибору) в общем объеме 10 мл. Подготовьте технические тройки всех образцов.
- Выберите подходящий размер пор капилляра для проведения эксперимента.
Примечание: Размер пор должен быть в пределах диапазона самых маленьких клеток в кокультуре, но он также должен включать более крупные клетки. Не делайте слишком маленьких, потому что поры могут закупориваться из-за агрегации клеток, что может произойти из-за деления клеток. Доступные размеры пор различаются. Капилляр размером 45 мкм, например, начинает обнаруживать клетки диаметром 0,7 мкм (U. maydis и S. cerevisiae 3,5 мкм-5,5 мкм, S. elongatus/Synechocystis sp. ~1-2,5 мкм).
- Количественное определение клеток в счетчике частиц
- Запустите устройство. В конце концов, проведите самопроверку для контроля качества (обратитесь к руководству к конкретному устройству).
- Загрузите образцы в чашки для образцов, закройте крышку и перемешайте образец, слегка наклонив чашку.
ПРИМЕЧАНИЕ: Старайтесь избегать образования пены и пузырей. Всегда используйте одну чашку для каждого измерения. Чашки можно чистить и использовать повторно несколько раз. Выбросьте стаканчики, если есть остатки, которые не могут быть удалены. Если образец остается в чашке в течение более длительного времени, перемешайте его еще раз перед измерением. - Запись в диапазоне от 0 до 30 мкм из-за того, что агрегаты ячеек могут быть больше, чем отдельные клетки.
Примечание: Во-первых, используйте каждую из аксенических культур партнеров по совместной культуре, чтобы получить представление о размере клеток и определить, можно ли их отличить по размеру. - После оценки определите состав сокультуры таким же образом.
- Препараты
- Количественная оценка консорциума с помощью проточной цитометрии одиночных клеток
Примечание: Проточная цитометрия одиночных клеток является высокопроизводительным методом, который может быть использован для определения количества клеток отдельных партнеров в сокультуре, учитывая, что партнеры могут быть дискриминированы по размеру/их светорассеивающим свойствам и/или флуоресценции. Важно отметить, что для создания метода необходимы аксенические культуры партнеров по сокультуре, чтобы проанализировать их свойства в цитометре и соответствующим образом скорректировать популяционные ворота. Для штаммов, несущих флуоресцентный репортер, штаммы без флуоресцентного репортера необходимы в качестве отрицательного контроля. Базовое знакомство с приложениями цитометра будет способствовать успешной реализации приведенного ниже протокола17,18,19,20,21. В данном примере анализируется искусственная смесь из 3 микроорганизмов (см. Репрезентативные результаты): Synechocystis (экспрессирующий цитозольный репортерный флуорофор, mVenus) и две дрожжи S. cerevisiae и U. maydis. Для точного различения S. cerevisiae и U. maydisвведены флуоресцентные маркеры в виде цитоплазматического зеленого флуоресцентного белка (GFP) (U. maydis eGFP) и красный флуоресцентный белок (RFP) mKate2 (S. cerevisiae mKate2) с использованием основных методов молекулярного клонирования. По возможности следует отдавать предпочтение штаммам с геномной интеграцией репортеров, чтобы избежать необходимости непрерывного давления отбора.- Подготовка образцов
- Измерьте внешний диаметр культур на данной стадии роста, подлежащей анализу.
- Отрегулируйте внешний диаметр образцов до диапазона, подходящего для измерения. Используйте приблизительный внешний диаметр750 0,05-0,5 для цианобактерий и внешний диаметр600 0,2-1,5 для дрожжей с использованием свежей питательной среды (конечный объем: не менее 500 μл). Для сокультур стремитесь к OD750 в диапазоне от ~0,1 до 0,5 и записывайте коэффициент разбавления. Для расчета примените формулу, приведенную в шаге 1.1.3.1. Это гарантирует, что количество клеток будет оставаться в диапазоне 1 000 - 10 000 клеток/с при расходе 10 мкл/мин (что эквивалентно 6 000 - 60 000 клеток/мкл).
ПРИМЕЧАНИЕ: Для разбавления можно использовать среду или буфер без автофлуоресценции и частиц (например, BG-11). Будьте осторожны с фильтрующими материалами, содержащими сложные ингредиенты, такие как дрожжевой экстракт, которые могут проявиться в виде частиц при измерении. - Перенесите 300 μл суспензии каждой ячейки образца в отдельную лунку в 96-луночной пластине (стандартная круглая лунка, прозрачное, плоское дно).
ПРИМЕЧАНИЕ: В качестве альтернативы можно перенести 0,5-2 мл в пробирку для сортировки клеток, активируемых флуоресценцией (FACS), если вместо режима считывателя планшетов используется полуавтоматический режим отбора образцов.
- Измерение цитометрии
- Запустите цитометр и выполните программу запуска и контроля качества (QC) в соответствии с инструкциями производителя.
- Загрузите (загрузчик пластин или полуавтоматический отбор проб) и запустите образцы. Начните с контрольных образцов с использованием аксенических культур каждого партнера по совместной культуре, чтобы идентифицировать каждый вид на основе их свойств, прежде чем стремиться к их разделению в образце для совместной культуры.
- Открытые точечные графики и/или гистограммы для каналов флуоресценции и рассеяния (например, прямого рассеяния [FSC] или бокового рассеяния [SSC] высоты [-H] или площади [-A]), относящихся к образцам.
- Найдите требуемую популяцию клеток и отрегулируйте пороговое значение, чтобы исключить технический шум и мелкие частицы из среды.
ПРИМЕЧАНИЕ: Рекомендуется искать популяцию клеток на точечной диаграмме FSC-H по ширине FSC или FSC-H по точечной диаграмме SSC-H и корректировать масштаб от линейного до логарифмического для мелких клеток, таких как бактерии (обычно 1-3 мкм). Установите пороговое значение в канале FSC-H или SSC-H. Для ячеек диаметром менее 1 мкм используйте фиолетовый SSC (VSSC) в фиолетовом лазере с длиной волны 405 нм для лучшего разрешения. - Отрегулируйте усиление для каждого интересующего канала вручную в диапазоне 25-2,500. Отрегулируйте усиление таким образом, чтобы отрицательный контроль (например, без флуоресцентного маркера) находился в диапазоне 1 x 102-1 x 103 , а положительный контроль (например, с флуоресцентным маркером) находился в диапазоне 1 x 105-1 x 106 , чтобы получить наилучшее разделение и оставаться в диапазоне 1 x 101-1 x 107.
ПРИМЕЧАНИЕ: Стандартные выигрыши от контроля качества также могут быть сохранены в качестве хорошего ориентира. - Чтобы определить концентрацию клеток в образце, запишите определенный объем образца с помощью функции записи (например, 10 мкл при расходе 10 мкл/мин). Позже разделите количество отдельных клеток, измеренное для этого объема, на записанный объем, чтобы получить количество клеток на мкл для каждой популяции.
ПРИМЕЧАНИЕ: Учитывайте начальный коэффициент разведения при расчете концентрации клеток в культуре/образце.
- Гейтирование/отбор клеточных популяций
ПРИМЕЧАНИЕ: Независимо от устройства, используемого для проведения измерений, анализ и стробирование могут быть выполнены в операционном программном обеспечении цитометра или коммерческом программном обеспечении для анализа, как показано ниже22. Кроме того, анализ данных проточной цитометрии с использованием непатентованного программного обеспечения может быть эффективно выполнен с помощью различных инструментов с открытым исходным кодом, таких как FlowCytometryTools23 или FlowKit, используя FlowUtils24 пакетах на Python. В духе открытой науки, этот протокол использует образцовый JupyterNotebook, демонстрирующий использование этих пакетов для исследования основных данных. Конечно, альтернативное программное обеспечение может в равной степени подойти для выполнения проточной цитометрии, биоинформатики25.- Выберите определенные популяции клеток, нарисовав вокруг них вентили на точечной диаграмме или установив разделители или линейные сегменты вокруг пиков на гистограмме (рис. 4).
ПРИМЕЧАНИЕ: Функция автоматического гейта программы может быть использована в качестве справочной. - Разделяйте сигналы для фото- и гетеротрофных организмов на основе автофлуоресценции фототрофного организма (в основном вызванной хлорофиллом) в красной области спектра. Пример: Используйте гистограмму канала APC-H (возбуждение (ex.) на длине волны 638 нм, излучение (em.) на длине волны 660/10 нм) и установите вертикальный разделитель между правым пиком (фототрофный = популяция автофлуоресценции хлорофилла) и левым пиком/пиками (гетеротрофный = популяция автофлуоресценции хлорофилла отрицательная) (рисунок 4A).
Флуоресцентные маркеры также могут быть использованы для различения двух (или более) фототрофных партнеров в одной и той же культуре (например, mVenus для Synechocystis). - Разделите два гетеротрофных организма на основе их флуоресцентных маркеров или рассеивающих свойств (FSC, SSC, если это возможно).
Примечание: Разделение на основе свойств рассеяния применимо только в том случае, если клетки имеют, например, разный размер или морфологию клеток, что приводит к видимым изменениям в рассеянии (например, Synechocystis: сферические клетки диаметром ~1,5-3 мкм против удлиненных клеток U. maydis длиной 10 мкм и диаметром около 1-2 мкм). - Пример: Используйте гистограмму канала FITC-H (например: 488 нм, em.: 525/40 нм), отображающую только «гетеротрофную» популяцию, чтобы различать гетеротрофные клетки, содержащие GFP (например, U. maydis eGFP), и те, которые не содержат GFP (например, S. cerevisiae RFP/mKate2) (рис. 4B). В качестве альтернативы используйте гистограмму канала PC5.5-H (например: 561 нм, em.: 710/50 нм), отображающую только «гетеротрофную» популяцию, чтобы различать гетеротрофные клетки, содержащие RFP (например, S. cerevisiae RFP/mKate2), и те, которые не содержат RFP (например, U. maydis GFP) (рис. 4C).
ПРИМЕЧАНИЕ: Имейте в виду, что два (или более) разных типа клеток могут «слипаться» во время измерения. Эти «дублеты» или «мультиплеты» могут быть легко обнаружены на точечных графиках обоих флуоресцентных маркеров (например, APC-H поверх FITC-H для идентификации дублетов фототрофа и гетеротрофного партнера, меченного GFP). - Для базового анализа данных в Python следуйте инструкциям в этом Jupyter (https://git.rwth-aachen.de/computational-life-science/cytoflow).
ПРИМЕЧАНИЕ: Эта записная книжка поддерживает три этапа анализа данных. i) Импорт данных: Импорт файлов FCS. ii) Выполнение контроля качества: проверка целостности данных и количества событий. iii) Визуализация данных: Используйте такие графики, как гистограммы, точечные диаграммы и графики плотности для визуализации данных. Кроме того, показана процедура выполнения стробирования для изоляции представляющих интерес популяций, воспроизводящих рисунок 4 .
Чтобы облегчить анализ сокультур в долгосрочных проектах, исследователю рекомендуется использовать вышеуказанные методы для подсчета количества клеток и создания стандартных кривых для сравнения значений OD с абсолютным количеством клеток. Оптическая плотность — это относительное измерение, которое может варьироваться в зависимости от вида, штамма, условий роста и спектрометра. Таким образом, генерация «внутренних» стандартных кривых необходима для точного преобразования значений наружного диаметра в номера ячеек.
- Выберите определенные популяции клеток, нарисовав вокруг них вентили на точечной диаграмме или установив разделители или линейные сегменты вокруг пиков на гистограмме (рис. 4).
- Подготовка образцов
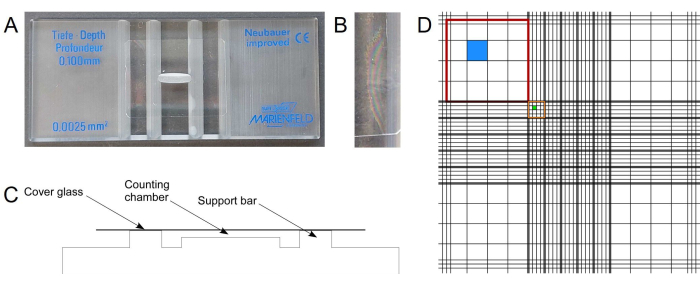
Рисунок 1: Микроскопическое количественное определение морфологически различимых клеток. (A) Счетная камера Нейбауэра. (B) Кольца Ньютона указывают на правильное положение специального покровного стекла. (В) Схематическое изображение архитектуры камеры с центральной полостью определенного объема для подсчета клеток. (D) Сетка изображенной счетной камеры Нейбауэра состоит из девяти больших квадратов размером 1мм2 (красного цвета). Четыре больших квадрата по углам в свою очередь разделены на 16 квадратов (синего цвета). Центральный большой квадрат разделен на 25 групповых квадратов размером 0,04мм2 (оранжевого цвета). Каждый групповой квадрат состоит из 16 самых маленьких квадратов (зеленого цвета). Показатель был сформирован на основе общедоступной информации о производителях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Создание сокультур фототрофного S. elongatus и гетеротрофных дрожжей
Ранее мы сообщали о подробных результатах совместного культивирования Synechococcus elongatus PCC 7942 с различными субштаммами S. cerevisiae. Подробное описание результатов совместного культивирования с этой парой цианобактерий/дрожжей см.в разделе 8. Для краткости и точности эти результаты здесь не воспроизводятся. Вкратце, предыдущие результаты указывают на ряд соображений, которые важны для создания долгосрочных цианобактериально-дрожжевых кокультур. В первую очередь необходимо отметить, что способность дрожжей выживать в условиях, где цианобактерии являются единственными формами фиксированного углерода, в значительной степени зависит от эффективности, с которой штамм дрожжей может использовать сахарозу. Штаммы S. cerevisiae, которые были эволюционированы или сконструированы для более эффективного метаболизма сахарозы27,28, с большей вероятностью выживали при переходе в режим совместного выращивания, достигали более высокой плотности клеток и демонстрировали более высокую устойчивость в долгосрочных (от нескольких дней до недель) экспериментах по совместному культивированию цианобактерий8. Начальная фаза инокуляции сокультуры была особенно важна для жизнеспособности дрожжей, вероятно, из-за стрессов разбавления культуры, изменения состава среды и/или изъятия более концентрированного источника углерода. Таким образом, усилия по облегчению перехода от более богатой питательной среды к минимальному доступу углерода при инициировании совместной культуры могут повысить эффективность и согласованность экспериментов (см. шаг 1.2.1.1). Кроме того, S. cerevisiae проявляли стрессовые реакции, соответствующие гипероксии, при инокуляции в плотные культуры S. elongatus, что согласуется собразованием О2 в качестве основного побочного продукта кислородного фотосинтеза. Таким образом, усилия по предотвращению чрезмерного роста партнера цианобактерий и/или чередование световых циклов «день/ночь» могут существенно продлить жизнеспособность S. cerevisiae в долгосрочных кокультурах. В разделе «Обсуждение» приведена дополнительная информация о явлениях, распространенных в других культурах по сравнению с аксеническими контрольными образцами.
Мониторинг роста сокультур с использованием различных методологий
В следующем разделе описана примерная количественная оценка искусственно смешанного трехстороннего консорциума Synechocystis и двух дрожжей S. cerevisiae и U. maydis с использованием трех различных методов. Для смеси определяли OD750 (для цианобактерий) и OD600 (для гетеротрофов) отдельных культур и корректировали до OD 0,1. Отдельные культуры смешивали в соотношении 1:1:1 с использованием оптической плотности (которая отличается от подсчета клеток, см. выше). Чтобы облегчить дискриминацию дрожжей в цитометре, репортерные штаммы генетически модифицированных S. cerevisiae FY1679-O1B29 конститутивно продуцируют цитоплазматический mKate2 (генотип: URA3Δ/pTDH3::mKate2; штамм: S. cerevisiae mKate230) и штамм U. maydis AB3331 , конститутивно продуцирующие eGFP (генотип: pep4Δ/pRpl40::egfp; штамм: U. maydis eGFP32). Следует отметить, что штамм цианобактерий был снабжен репликативной плазмидой, способствующей конститутивной, сильной экспрессии желтой флуоресцентной белковой версии mVenus (Synechocystis sp. PCC 6803 pSHDY-Pcpc560-mVenus, штамм Synechocystis mVenus, аналогичный33) и, кроме того, проявляет типичную сильную автофлуоресценцию из-за наличия фотосинтетического механизма.
Микроскопическое количественное определение с использованием счетных камер: Все типы клеток в используемой искусственной смеси трех микроорганизмов могут быть легко различимы под микроскопом (рис. 2А): Synechocystis и S. cerevisiae представлены сферическими клетками, которые, однако, сильно различаются по своему диаметру (Synechocystis: ок. 1,5-3 мкм, S. cerevisiae: ок. 3-6 мкм), в то время как клетки U. maydis имеют удлиненную, сигарообразную морфологию и длину не менее 10 мкм (Рис. 2А.). Эти четкие морфологические признаки позволяют точно количественно оценить каждого партнера в смеси. В качестве иллюстративного примера, 37, 18, 36 и 21 клетка S. cerevisiae подсчитываются в четырех больших квадратах соответственно (рис. 2B). Среднее значение составляет 28 ячеек. Так как большой квадрат используемого гемоцитометра имеет площадь 1мм2 и глубина камеры составила 0,02 мм, то получается 28 клеток на 0,02 мкл. Это соответствует 1 400 ячейкам/л, что эквивалентно 1,4 x 106 ячейкам/мл. Подсчитывали другие типы клеток, и соответственно определяли их концентрации (рис. 2C, табл. 2).
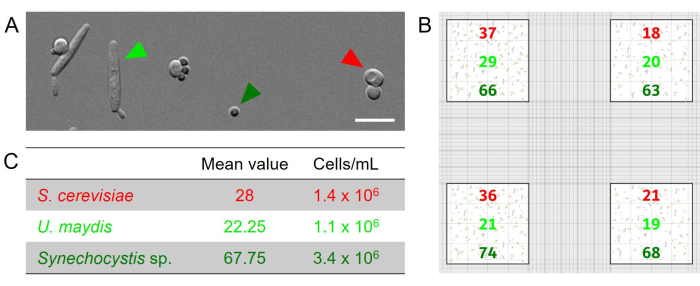
Рисунок 2: Микроскопическое количественное определение трехстороннего консорциума, состоящего из Synechocystis и дрожжей S. cerevisiae и U. maydis. (А) Микроскопическое дифференциально-контрастное (ДВС) изображение искусственно объединенной смеси указанных микроорганизмов. Все виды можно легко отличить по их морфологии. Масштабная линейка: 10 мкм. (B) Примерные результаты подсчета для искусственно собранной смеси указанных штаммов на основе аксенических культур с OD 0,1. Были проанализированы четыре больших квадрата по краям сетки (красная отметка на рисунке 1D). (C) Среднее значение различных клеток, подсчитанных в четырех квадратах, было использовано для расчета концентрации клеток в суспензии с использованием следующего уравнения: Среднее значение/(глубина камеры [0,02 мм] x размер подсчитанного квадрата [1 мм2] x 1 000). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Количественная оценка с помощью счетчиков частиц: Счетчики частиц определяют количество частиц в суспензии в зависимости от их размера. В примере набора данных использовался счетчик частиц с капилляром 45 мкм. Поскольку клетки S. cerevisiae и U. maydis имеют схожие размеры, их невозможно различить в счетчике частиц, в то время как более мелкие клетки Synechocystis могут быть четко разделены. Таким образом, анализ отдельных культур показывает пики в идентичных положениях, относящихся к 3-6 мкм для двух дрожжей (рис. 3А). Во время измерения применяется отрицательное давление, которое вызывает попадание клеток в капилляр. При этом электрическое сопротивление изменяется на короткое время, чтобы устройство могло определить размер частиц на основе изменения. В смешанной культуре могут быть обнаружены два отчетливых пика, один из которых связан с более мелкими клетками цианобактерий, а другой представляет собой совместную фракцию двух видов дрожжей (рисунок 3B). Важно отметить, что в дополнение к пикам, отражающим живые клетки, были обнаружены дополнительные пики на расстоянии около 1 мкм (рис. 3), соответствующие клеточному мусору и более мелким частицам. Сигналы, которые появляются при больших диаметрах, чем ожидалось, могут быть вызваны агрегациями клеток. Следует отметить, что форма пиков отражает однородность клеток: острый пик показывает очень однородные клетки, что маловероятно для совместной культуры. В сокультуре ожидается очень широкий пик или даже два пика, если партнеры по сокультуре явно различаются по размеру. Для аксенических культур гетеротрофных грибов пик может быть средним по ширине.
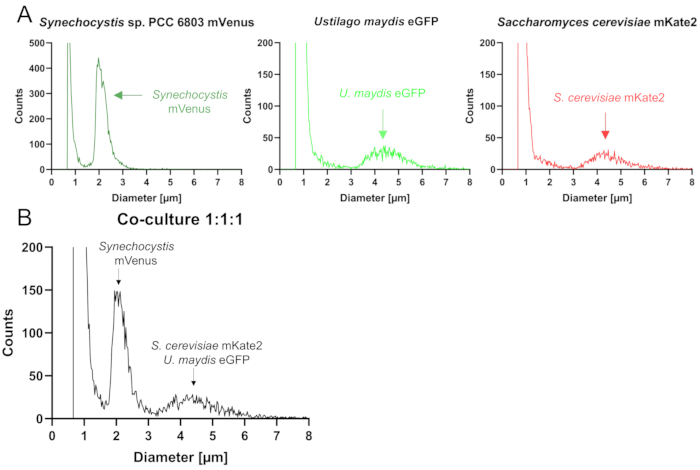
Рисунок 3: Количественная оценка трехстороннего консорциума, состоящего из Synechocystis mVenus и дрожжей S. cerevisiae mKate2 и U. maydis eGFP с использованием счетчика частиц. (A) Визуальный вывод анализов аксенических культур трех штаммов, как показано на графиках (счетчик клеток с капиллярами 45 мкм). (B) Примерный визуальный выходной файл для анализа искусственного трехстороннего консорциума с использованием идентичных условий. Счетчик частиц не поддерживает дискриминацию двух видов дрожжей, которые оба представлены вторым пиком. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Количественное определение с помощью одноклеточной цитометрии: С помощью проточного цитометра для отдельных клеток можно легко различить различные клеточные популяции на основе их свойств (авто-) флуоресценции и светорассеяния. Фототрофные клетки (Synechocystis) могут быть дифференцированы от гетеротрофных клеток (U. maydis и S. cerevisiae) на основе красной автофлуоресценции фотосинтетических пигментов, которая измеряется в канале APC-H (рис. 4A). Основываясь на этом первоначальном разделении фототрофных и гетеротрофных клеток, две гетеротрофные популяции могут быть выделены на основе их флуоресцентных маркеров eGFP в канале FITC-H и mKate2 в канале PC5.5 (рис. 4B, C). На точечной диаграмме, показывающей свойства рассеяния всех трех популяций (FSC-H и FSC-Width), популяции также могут быть различимы лишь с некоторыми незначительными перекрытиями популяций (рис. 4D).
С помощью этого метода 10 мкл разбавленных образцов анализировали со скоростью потока 10 мкл/мин, что позволило количественно оценить примерно 70 000 клеток за 1 мин. Примерно 60% этих клеток можно было отнести к Synechocystis (4,23 x 106 клеток/мл), в то время как остальные 40% были равномерно распределены между U. maydis (1,35 x 106 клеток/мл) и S. cerevisiae (1,36 x 106 клеток/мл, рисунок 4E, таблица 2).
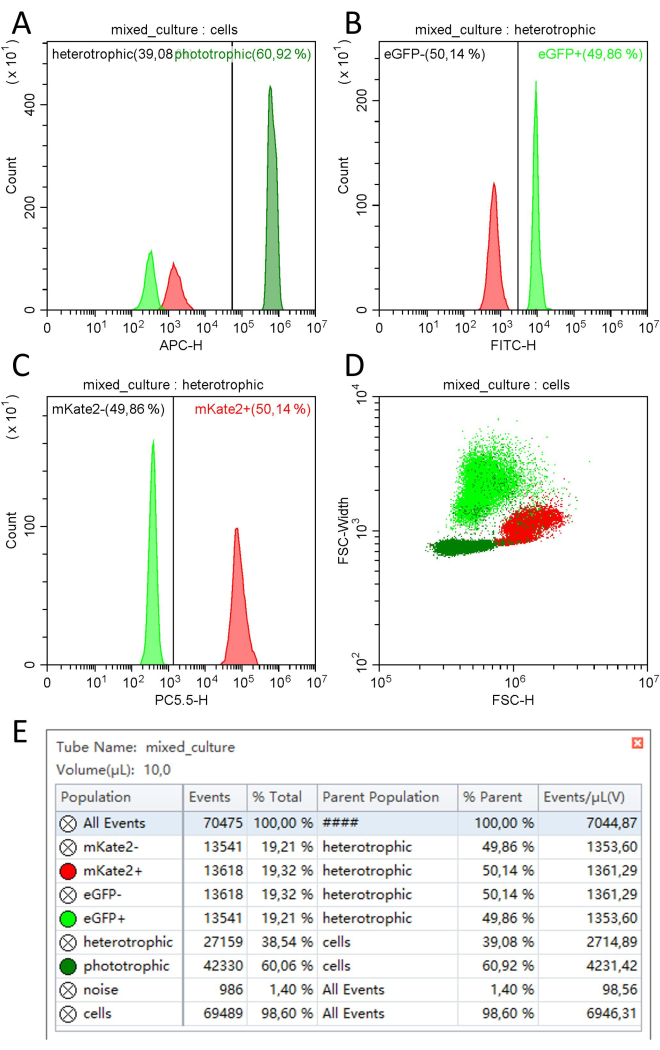
Рисунок 4: Количественная оценка трехстороннего консорциума, состоящего из цианобактерии Synechocystis mVenus и дрожжей U. maydis eGFP и S. cerevisiae mKate2 с использованием проточной цитометрии одиночных клеток. Примеры графиков, полученных после измерения смешанной культуры Synechocystis mVenus (темно-зеленый), U. maydis eGFP (светло-зеленый) и S. cerevisiae mKate2 (красный) в соотношении 1/3 OD750 / 1/3 OD600 на цитометре (А) с отображением гистограммы количества событий и флуоресценции в канале APC-H (например: 638 нм, em.: 660/10 нм) всех клеток, используемых для дифференцировки фототрофных и гетеротрофных клеток на основе их автофлуоресценции. (B) Гистограмма количества событий и флуоресценции в канале FITC-H (например: 488 нм, em.: 525/40 нм) всех гетеротрофных клеток, используемых для дифференцировки клеток U. maydis eGFP и S. cerevisiae mKate2 на основе их зеленых флуоресцентных свойств. (C) Гистограмма количества событий и флуоресценции в канале PC5.5-H (например: 561 нм, em.: 710/50 нм) всех гетеротрофных клеток, использованных для дифференцировки клеток U. maydis eGFP и S. cerevisiae mKate2 на основе их красных флуоресцентных свойств. (D) Точечная диаграмма сигналов рассеяния в FSC-Width по каналу FSC-H, используемая для идентификации клеточных популяций без флуоресцентных свойств. (E) Статистические данные о населении, включая количество событий, проценты, средние арифметические действия и стандартные отклонения (SD) соответствующих флуоресцентных каналов. Общее количество ячеек, а также их размер и флуоресценция были определены в объеме 10 мкл со скоростью потока 10 мкл/мин. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Для сравнительной визуализации результатов различных методов количественной оценки определенные номера ячеек представлены в следующих двух таблицах (Таблица 2 и Таблица 3). Конечные концентрации клеток, определенные с помощью трех ранее описанных методов, находятся в аналогичном диапазоне для всех методов. Цитометр обеспечивает максимальный размер образца, за ним следует счетчик частиц и микроскопическое количественное определение, с уменьшением примерно на один порядок между методами.
| Сокультура 1:1:1 | Фотометр | Цитометр | Счетчик частиц | Счетная камера для микроскопии | ||||
| Организм | Внешний диаметр750/600 | Количество клеток | ячейк/мл | Количество клеток | ячейк/мл | Количество клеток | ячейк/мл | |
| Saccharomyces cerevisiae mKate2 | 0.0333 | 13,618 | 1,36 х 106 | 1,546* | 2,58 х 106* | 112 | 1,40 х 106 | |
| Ustilago maydis eGFP | 0.0333 | 13,541 | 1,35 х 106 | 89 | 1,11 х 106 | |||
| PCC 6803 mVenus | 0.0333 | 42,330 | 4.23 х 106 | 3,094 | 5,16 х 106 | 271 | 3,39 х 106 | |
Таблица 2: Сравнение различных методов количественной оценки: Искусственная смешанная культура. Обратите внимание, что U. maydis и S. cerevisiae не могут быть различимы с помощью счетчика частиц (*).
| Единая культура | Фотометр | Цитометр | Счетчик частиц | Счетная камера для микроскопии | ||||
| Организм | Внешний диаметр750/600 | Количество клеток | ячейк/мл | Количество клеток | ячейк/мл | Количество клеток | ячейк/мл | |
| Saccharomyces cerevisiae mKate2 | 0.1 | 38,936 | 3,89 х 106 | 1,928 | 3,21 х 106 | 403 | 4,03 х 106 | |
| Ustilago maydis eGFP | 0.1 | 36,927 | 3,69 х 106 | 2,465 | 4.11 х 106 | 307 | 3.07 х 106 | |
| PCC 6803 mVenus | 0.1 | 127,864 | 1,28 х 107 | 8,186 | 1,36 х 107 | 428 | 1,07 х 107 | |
Таблица 3: Сравнение различных методов количественной оценки: калибровка с одиночными/аксеническими культурами.
Обсуждение
Работа с микроорганизмами в одиночных аксенических культурах в лабораторных условиях была отлажена на протяжении десятилетий для многих микробных моделей. Тем не менее, несмотря на то, что преобладающей формой жизни в природе являются микробные сообщества, комбинация двух или более партнеров в одном сосуде для выращивания менее устоялась, и проблемы возникают из-за пробелов в существующих знаниях и методологии. Кроме того, сложнее предсказать поведение клеток в сообществе, так как между клетками возникают эмерджентные взаимодействия и обмен метаболитами, что сильно влияет на судьбу совместной культуры34,35. Следовательно, создание кокультур не является тривиальным, в том числе на уровне определения питательных сред, определения общих условий роста, межвидового обмена следовыми метаболитами/сигналами и результирующего состава ко-культур с течением времени. Успехи, достигнутые в последние годы в сборке фототрофных, секретирующих сахар цианобактерий с гетеротрофными партнерами, позволяют вывести первые правила и методологию, которые могут стать полезным руководством для разработки новых пар совместного культивирования. Основываясь на этих знаниях, в первой части настоящего протокола приводится пошаговое руководство по сборке сокультур, содержащих цианобактерию, секрецию сахарозы, и одну или несколько дрожжей.
Одним из важнейших соображений при первой попытке установить кокультуру между неродственными микробами является состав общей питательной среды, которая удовлетворяет всем потребностям в питательных веществах для двух или более видов. Из-за ограниченного объема здесь невозможно предоставить полностью подробный протокол для этого процесса, который также может потребовать высокой степени настройки в некоторых случаях, но вместо этого ниже изложены важные соображения, которые следует иметь в виду. Один из простых исходных подходов включает сравнение типичной среды роста цианобактерий (например, BG11; см. таблицу 1) с любой установленной минимальной средой, состоящей из гетеротрофных видов, представляющих интерес. Добавление в стандартную цианобактериальную среду любых недостающих компонентов, содержащихся в гетеротрофной минимальной среде, является хорошей отправной точкой для первоначального тестирования 8,36. Имейте в виду, что, поскольку минимальные среды часто дополняются значительным органическим источником углерода для гетеротрофного роста (например, 1%-4% глюкозы), они часто предназначены для поддержки более высокой плотности гетеротрофных клеток, чем это может быть достигнуто в первоначальных экспериментах по совместному культивированию. Аналогичным образом, некоторые общие компоненты среды могут также выступать в качестве источника органического углерода независимо от фотосинтеза, обеспечиваемого партнером цианобактерий (например, цитратом), что может усложнить последующий анализ цианобактерий/гетеротрофных сокультур. Таким образом, при проектировании среды для совместного культивирования может не быть необходимости дополнять минимальную цианобактериальную среду полной концентрацией недостающих элементов. Например, многие организмы различаются по эффективности использования различных форм азота окружающей среды (например, N2, нитратов, нитритов, мочевины) и могут быть совершенно неспособны использовать некоторые из более окисленных источников азота. Аналогичным образом, многие микробы могут нуждаться в добавках незаменимых витаминов (например, витаминаВ12), кофакторов или незаменимых аминокислот, поскольку у них отсутствуют полные биосинтетические пути для прямого синтеза этих соединений. По этим причинам наиболее практичным может быть начать с простого «слияния» установленной минимальной среды партнера цианобактерии (например, BG11) вместе с четко определенной минимальной средой гетеротрофа (например, синтетической определенной средой [SD]). Более поздние циклы повторного удаления/восстановления избыточных компонентов могут быть использованы для оптимизации среды и уменьшения содержания любых соединений, которые могут препятствовать росту одного из партнеров. Полезной отправной точкой является буферизация среды при нейтральном или слегка базовом pH, поскольку эти условия, как правило, являются предпочтительными для большинства модельных видов цианобактерий.
На этом этапе часто бывает полезно провести предварительные испытания роста поддерживаемого гетеротрофа в новой среде для совместной культуры при поступлении избытка сахарозы. Конечно, при выборе потенциального гетеротрофа важно выбрать тот, который способен катаболизировать первичный источник (источники) органического углерода, который будет поставляться партнером цианобактерий. Здесь полезно отметить, что сахароза, как доминирующий углевод, поставляемый во многих модифицированных цианобактериальных/гетеротрофных культурах, не является углеводом, который так же универсально используется гетеротрофными микробами, как глюкоза: специализированные транспортеры сахарозы должны кодироваться гетеротрофными видами, или могут потребоваться внеклеточные инвертазы для превращения сахарозы во фруктозу и глюкозу, которые часто распознаютсятранспортерами с более высоким сродством.. Важным наблюдением, о котором обычно сообщают многочисленные лаборатории, изучающие смешанные микробные сообщества, является то, что между фототрофными и гетеротрофными партнерами возникают синергии и антагонизмы более высокого порядка 4,8,13. Например, другие естественно секретируемые метаболиты (например, органические кислоты, восстановленные формы азота) или кофакторы (например, сидерофоры) могут обеспечить более высокие темпы роста одного или обоих партнеров при культивировании в одной и той же среде по сравнению с аксеническим контролем. И наоборот, потенциально вредные побочные продукты метаболизма, такие как гипероксигенация среды путем фотосинтетического расщепления воды, как сообщается, вызывают межвидовое ингибирование роста у одного илиобоих партнеров. Таким образом, аксенические элементы управления могут служить полезным эталоном, но производительность совместной культуры может отличаться от ожиданий из-за этих новых свойств.
В зависимости от гетеротрофного партнера и способности S. elongatus выделять сахарозу (исходя из уровня индукции, используемой концентрации IPTG) следует тестировать различные соотношения обоих организмов. Успех культур зависит в первую очередь от способности S. elongatus поддерживать рост гетеротрофного партнера (т.е. может ли он производить достаточное количество углерода). В то время как чрезмерный рост гетеротрофного штамма обычно ограничивается недостатком органического углерода, содержащегося в составе кокультуральной среды, цианобактерии могут опережать гетеротрофы, что может привести к возникающим ингибирующим взаимодействиям (например, гипероксические условия 8,13). При попытке первоначально определить подходящие соотношения плотности клеток для цианобактерии: дрожжи, хорошим приблизительным правилом является то, что партнер цианобактерии может поддерживать равный объем клеток сопровождающих гетеротрофных клеток. Поскольку эукариотические дрожжи, как правило, имеют значительно больший объем клеток, чем модельные цианобактерии, секретирующие сахарозу, это, вероятно, может означать, что плотность клеток цианобактерий будет значительно выше (например, в 50-100 раз для S. cerevisiae) в стационарном состоянии. Таким образом, хорошей отправной точкой при создании новой совместной культуры с лабораторными и видовыми условиями, специфичными для исследователя, будет расчет среднего объема клеток как для цианобактерии, так и для дрожжей (на основе опубликованных значений; см., например, B10NUMB3R537) для оценки объемного соотношения. Исходные колбы могут быть засеяны таким соотношением ячеек. Чтобы исследовать пространство раствора, исследователь может захотеть поддерживать концентрацию цианобактерий постоянной (например, OD750 = 0,3), варьируя концентрацию дрожжевых клеток вверх или вниз примерно на порядок с шагом в зависимости от пропускной способности, допускаемой доступным пространством для фототрофного культивирования. Конечно, это объемное «эмпирическое правило» зависит от скорости, с которой фототрофный партнер способен выделять органические фотосинтезаторы (например, сахарозу), которые могут быть использованы гетеротрофным партнером. После того, как условия совместного культивирования будут установлены, тщательный мониторинг показателей роста обоих партнеров с течением времени даст ценные данные об идеальных соотношениях видов, особенно если ранние совместные культуры могут сохраняться в течение нескольких дней или недель, тем самым позволяя исследователю определить устойчивое соотношение, достигнутое ближе к концу совместного культивирования. Эта информация может быть использована при выборе начальной плотности инокуляции для каждого вида-партнера в последующих экспериментах, чтобы помочь культуре быстрее достичь самостоятельно определенного идеального соотношения видов.
Во второй части протокола приведены подробные инструкции по анализу кокультуры. Надежная количественная оценка сокультур является ключом к их успешной реализации: рост (или, по крайней мере, метаболическая активность) фототропного, секретирующего углерод партнера имеет важное значение для поддержания гетеротрофов. В то время как соотношение цианобактерий и гетеротрофов, используемое для инокуляции культуры, не всегда может быть критическим для оптимизации, поскольку долгосрочные сокультуры имеют тенденцию к сближению в сторону стабильных пропорций, может быть важно интегрировать методы для проверки неограниченного роста любого из партнеров путем разбавления культуры или инкапсуляции одного или нескольких видов 36,38,39,40. Как упоминалось выше, побочные продукты партнера цианобактерий могут быть ингибиторными для гетеротрофа в высоких концентрациях (например,О2), а некоторые продукты гетеротрофного метаболизма также могут быть вредными для здоровья цианобактерий. В большинстве опубликованных совместных культур используются гетеротрофы, которые имеют более высокую скорость роста, чем большинство модельных видов цианобактерий; Таким образом, скорость гетеротрофного роста имеет тенденцию ограничиваться поступлением органического углерода, производимого цианобактерией. Тем не менее, определение динамики численности видов с течением времени является критически важным значением для выяснения сбоев в стабильности и оптимизации устойчивых сокультур при долгосрочном культивировании.
Приведены протоколы количественного определения с использованием счетных камер, счетчиков частиц и проточной цитометрии отдельных клеток. Все методы являются ценными инструментами для характеристики сокультур, однако, с различными предпосылками, преимуществами и ограничениями. Счетные камеры очень широко применимы для количественного определения сокультур, при условии, что все партнеры в культуре могут быть визуально различимы по форме клеток или другим свойствам. Большим преимуществом является низкая цена этого устройства, так что оно в принципе достижимо для любой лаборатории. Помимо информации о составе и соотношении различных партнеров, можно получить представление о морфологии и приспособленности клетки, а также обнаружить потенциальные контаминанты. Тем не менее, применение счетной камеры также занимает очень много времени, сопряжено с высокой рабочей нагрузкой и может поддерживать только низкую пропускную способность.
Как счетчики частиц, так и проточная цитометрия с отдельными клетками обеспечивают огромные преимущества в виде высокой производительности и удобства и экономии времени. В то время как клеточный счетчик основан на четких различиях в размерах клеток партнеров в сокультуре, одноклеточная цитометрия также может различать флуоресцентные метки, что приводит к возможности количественной оценки сокультур с более чем двумя членами одного и того же размера или даже двумя разными мутантами одного и того же организма на основе различных флуоресцентных маркеров. В приведенном примере искусственной сборки Synechocystis с S. cerevisiae и U. maydis для различения двух дрожжей были использованы внутриклеточные флуоресцентные репортеры mKate2 и eGFP. Те же флуоресцентные репортеры могут быть также использованы для различения двух генетически модифицированных штаммов одного и того же организма (например, S. cerevisiae), которые не могут быть разделены только на основании их светорассеивающих свойств. Аналогичные стратегии были реализованы для отслеживания консорциумов синтетических бактерий41. В зависимости от типа клеток, количества партнеров в консорциуме и их потенциального диапазона автофлуоресценции, выбор флуоресцентных маркеров требует особого внимания, чтобы избежать перекрытия спектральных качеств, особенно учитывая автофлуоресцентные свойства цианобактерий. 42
В этой статье мы выступаем за то, как придерживаться руководящих принципов FAIR в отношении хранения, управления и обмена научными данными. FAIR — это аббревиатура, которая расшифровывается как Findable, Accessible, Interoperable, and Reusable43. По мере того, как эти принципы получают все более широкое признание, они обещают преобразовать ландшафт биологических исследований, продвигая более открытый, совместный и эффективный подход к управлению данными и их использованию. В то время как важнейшие компоненты доступности могут быть обеспечены путем размещения данных в аннотированном исследовательском контексте (ARC)44, важно обеспечить воспроизведение этапов обработки данных с помощью программного обеспечения с открытым доступом. В необработанных файлах FCS хранятся как данные, так и метаданные (информация о лазерах и детекторах, включая длины волн, фильтры и т.д.) об экспериментах по проточной цитометрии45. Они могут быть загружены и прочитаны вне проприетарного программного обеспечения, которое позволяет проводить сложный анализ данных, например, доступно несколько пакетов для работы с необработанными данными в среде Python. Разработанный пакет демонстрирует, как загружать, читать и визуализировать необработанные файлы .fcs, содержащие данные цитометрии, вне проприетарного программного обеспечения с помощью одного из многих доступных пакетов на Python23. Использование открытого программного обеспечения, подобного описанному выше, устраняет необходимость в дорогостоящих лицензионных сборах, связанных с проприетарным программным обеспечением, обеспечивает полный контроль над обработкой данных (например, преобразованием, компенсацией, гейтингом) и дополнительно позволяет интегрировать множество инструментов в одном месте.
Ценным дополнительным преимуществом использования цитометрии одиночных клеток в сочетании с сортировщиком клеток является возможность также собирать клетки определенного типа с помощью FACS. Это может быть чрезвычайно ценным для применения любых -омических технологий для детального понимания взаимодействия видов в рамках совместной культуры, таких как RNASeq или метаболомика. Явным недостатком этих устройств является их высокая цена, поэтому доступность и доступность таких устройств может быть очевидным ограничением в некоторых лабораториях.
Интересно, что прямое сравнение представленных методов количественной оценки трех партнеров в консорциуме выявило очень хорошее соответствие между различными методами, что указывает на то, что смесь, которая была собрана на основе измерений OD, надежно количественно определена всеми описанными методами. Интересно, что общее количество цианобактерий было примерно в 3-4 раза выше, чем количество двух видов дрожжей, что, вероятно, связано с меньшим размером их клеток. Это наблюдение согласуется с общеизвестным мнением о том, что ОР не предоставляют информацию о фактических номерах клеток без калибровки46. Дрожжи, однако, показали сопоставимый уровень (Таблица 2 и Таблица 3). Кроме того, сравнение с количественной оценкой отдельных культур показывает, что все три метода являются надежными инструментами для различения типов клеток, за исключением счетчика частиц, который не разделял два вида дрожжей.
По сути, приложения для цитометрии одиночных клеток, безусловно, являются самым мощным инструментом для мониторинга состава кокультур, позволяя подсчитывать 1000-10000 клеток в секунду. Это особенно верно, если количество партнеров увеличивается до более чем двух или если партнеры похожи по форме и/или диаметру. Примечательно, что существует множество альтернатив, которые позволяют осуществлять мониторинг сокультур. Рост флуоресцентно меченых микробов в кокультурах может, например, непрерывно отслеживаться с помощью флуориметрии или микробиореакторов47. Однако они часто ограничиваются совместной культурой двух партнеров и требуют тщательного планирования эксперимента, например, при выборе флуоресцентных маркеров. Ампликонное секвенирование (секвенирование 16S рРНК) и другие методы секвенирования нового поколения в сочетании со сложной биоинформатикой являются еще одним вариантом характеристики синтетических сообществ 48,49,50. Эти методы подходят для подходов с высокой пропускной способностью и могут решать устоявшиеся взаимодействия в долгосрочном культивировании, эволюционные вопросы или отслеживание мутаций с несколькими микробными партнерами.
Взятые вместе, упрощенные микробные культуры, которые спроектированы рационально, обеспечивают мощный подход «снизу вверх» для исследования межвидовой динамики, к которой может быть сложнее подойти в рамках многовидовых сообществ, доминирующих в мире природы 51,52,53. В настоящем документе представлен оптимизированный протокол, который может быть легко адаптирован научным сообществом для установления и анализа новых пар цианобактерий и гетеротрофных партнеров. Очевидно, что необходимо провести много исследований, чтобы извлечь выгоду из потенциальных фундаментальных открытий, которые могут быть получены от искусственных микробных культур, а также определить, могут ли синтетически спроектированные микробные консорциумы соответствовать потенциалу, часто приписываемому им в литературе для биотехнологических приложений.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа финансировалась Deutsche Forschungsgemeinschaft (DFG, Немецкое научно-исследовательское общество) - SFB1535 - Project ID 458090666 (проект B03 to KS, AM и IA) и Major Research Instrumentation INST 208/808-1. В настоящее время DCD посещает HHU Düsseldorf в качестве стипендиата Меркатора SFB1535. Дополнительную поддержку EJK оказали награды Национального научного фонда #1845463 и #2334680.
Материалы
| Name | Company | Catalog Number | Comments |
| 10x Ph1 objective | Carl Zeiss AG | 46 04 01-9904 | |
| 525/40 nm Bandpass Filter | Beckman Coulter, Inc. | A01-1-0051 | FITC filter (in 488 nm laser) |
| 660/10 nm Bandpass Filter | Beckman Coulter, Inc. | A01-1-0055 | APC channel (in 638 nm laser) |
| 710/50 nm Bandpass Filter | Beckman Coulter, Inc. | B71092 | PC5.5 channel (in 561 nm laser) |
| Accuvettes for Multisizer 4e | Beckman Coulter, Inc. | A35473 | Sample cups with lids |
| Aperture tube 30 μM for Multisizer 4e | Beckman Coulter, Inc. | C92760 | Capillary |
| Autoclave | Lab Associates | EQM-ARBP | for sterilisation of material |
| Baffled flasks ROTILABO®, Straight neck, 250 ml | Carl Roth GmbH + Co. KG | LY95.1 | |
| BG11 / CoYBG11 components | different suppliers | see Table 1 | |
| Bottle top sterile filter | Sigmaaldrich | Z222593 | to sterile media if you dont want to use autoclave |
| Capillary 45 µm | Omni Life Science | OLS 5651738 | |
| CASY Cell Counter Model TTC | Schaerfe Systems | ||
| CASY cups | Omni Life Science | OLS 5651794 | |
| CASYclean | Omni Life Science | OLS 5651786 | Cleaning solution |
| CASYton solution | Omni Life Science | OLS 5651808 | Isotonic solution |
| Centrifuge tubes (50 mL) | Sigmaaldrich | CLS430828 | |
| CO2 | BOC | 270182-L | to supply cyanobacteria axenic cultures and co-cultures |
| CONTRAD® 70 | Beckman Coulter, Inc. | 81911 | Deep clean solution |
| Cover glass 20 × 26 x 0.4 mm | VWR International GmbH | 631-1190 | Cover glass for counting chamber |
| Cuvettes | Sarstedt | 67.742 | |
| Cyanobacteria BG-11 Freshwater Solution | Merck KGaA | C3061 | |
| CytExpert Software v. 2.6 | Beckman Coulter, Inc. | Cytometer application software | |
| CytoFLEX Sheath Fluid | Beckman Coulter, Inc. | B51503 | Sheat fluid |
| Cytometer CytoFLEX S | Beckman Coulter, Inc. | BE51180 | |
| DxH Cleaner for Multisizer 4e | Beckman Coulter, Inc. | 628022 | Cleaning solution |
| Eppendorf tube centrifuge (small) | Labstac | CEN16-15 | to centrifuge less than 2mL of culture |
| Ethanol | Carl Roth GmbH + Co. KG | K928.1 | |
| FACS tubes | Beckman Coulter, Inc. | 2523749 | tubes for semi-automatic mode |
| FlowClean Cleaning Agent, 500ml | Beckman Coulter, Inc. | C48093 | Daily clean solution |
| Graduated cylinders | Sigmaaldrich | Z131121 | for preparation of media |
| HEPPSO | Merck KGaA | R426725 | |
| Infors MultiTron photoincubator | Infors AG | white LED light | |
| IPTG | Merck KGaA | I6758 | Prepare aliquots, store at -20°C, thaw and keep on ice |
| Isoton II for Multisizer 4e | Beckman Coulter, Inc. | 8448011 | Isotonic solution |
| Kaluza v. 2.2 | Beckman Coulter, Inc. | B16406 | Cytometry data analysis software |
| KimWipes | VWR International GmbH | 115-2221 | Lint-free tissues |
| KOH | Merck KGaA | 221473 | |
| KPO3 | Noah Chemicals | 7790-53-6 | |
| Measuring beakers | VWR | 213-3747 | |
| Micro test plate, 96 well, slip-on lid, flat base, PS, transparent | SARSTEDT AG & Co. KG | 82.1581.001 | |
| Microscope base | Carl Zeiss AG | 47 09 18-9902/16 | |
| Microsope head | Carl Zeiss AG | 47 30 14 | |
| Milli-Q water purification system | Merck Millipore | C85358 | |
| Mulitisizer 4e particle counter | Beckman Coulter, Inc. | B23005 | Alternative to the CASY Cell Counter |
| Neubauer improved, depth 0.02 mm | Assistent Germany | Counting chamber | |
| Neubauer improved, depth 0.1 mm | Paul Marienfeld GmbH & Co. KG | 640010 | Counting chamber |
| Ready to Use Daily QC Fluorospheres | Beckman Coulter, Inc. | C65719 | Reference for QC |
| SCHOTT bottles | Dutscher | 90347 | for storage |
| Specord®200 Plus Spectrophotometer | Analytic Jena GmbH | OD600/750 | |
| Sucrose | Merck KGaA | 84100 | |
| Table top centrifuge (big) | Labstac | CEN18-06R | collect culture biomass |
| Yeast Nitrogen Base, without amino acids, without ammonium sulfate | Thermo Fisher Scientific Inc. | 11743014 |
Ссылки
- Roell, G. W., Zha, J., Carr, R. R., Koffas, M. A., Fong, S. S., Tang, Y. J. Engineering microbial consortia by division of labor. Microb Cell Factories. 18 (1), 35 (2019).
- Grandel, N. E., Reyes Gamas, K., Bennett, M. R. Control of synthetic microbial consortia in time, space, and composition. Trends Microbiol. 29 (12), 1095-1105 (2021).
- Weiland-Bräuer, N. Friends or Foes-Microbial Interactions in Nature. Biology. 10 (6), (2021).
- Santos-Merino, M., Yun, L., Ducat, D. C. Cyanobacteria as cell factories for the photosynthetic production of sucrose. Front Microbiol. 14, 1126032 (2023).
- Klähn, S., Hagemann, M. Compatible solute biosynthesis in cyanobacteria. Environ Microbiol. 13 (3), 551-562 (2011).
- Dean, P. N., Bagwell, C. B., Lindmo, T., Murphy, R. F., Salzman, G. C. Introduction to flow cytometry data file standard. Cytometry. 11 (3), 321-322 (1990).
- Rippka, R., Stanier, R. Y., Deruelles, J., Herdman, M., Waterbury, J. B. Generic assignments, strain histories and properties of pure cultures of Cyanobacteria. Microbiology. 111 (1), 1-61 (1979).
- Hays, S. G., Yan, L. L. W., Silver, P. A., Ducat, D. C. Synthetic photosynthetic consortia define interactions leading to robustness and photoproduction. J Biol Eng. 11, 4 (2017).
- Ducat, D. C., Avelar-Rivas, J. A., Way, J. C., Silver, P. A. Rerouting carbon flux to enhance photosynthetic productivity. Appl Environ Microbiol. 78 (8), 2660-2668 (2012).
- Thiel, K., et al. Redirecting photosynthetic electron flux in the cyanobacterium Synechocystis sp. PCC 6803 by the deletion of flavodiiron protein Flv3. Microb Cell Factories. 18 (1), 189 (2019).
- Song, K., Tan, X., Liang, Y., Lu, X. The potential of Synechococcus elongatus UTEX 2973 for sugar feedstock production. Appl Microbiol Biotechnol. 100 (18), 7865-7875 (2016).
- Feng, J., et al. Generation and comprehensive analysis of Synechococcus elongatus-Aspergillus nidulans co-culture system for polyketide production. Biotechnol Biofuels Bioprod. 16 (1), 32 (2023).
- Li, T., et al. Mimicking lichens: incorporation of yeast strains together with sucrose-secreting cyanobacteria improves survival, growth, ROS removal, and lipid production in a stable mutualistic co-culture production platform. Biotechnol Biofuels. 10, 55 (2017).
- JoVE Science Education Database. Microbiology. Growth Curves: Generating Growth Curves Using Colony Forming Units and Optical Density Measurements. , (2023).
- . . Yeast Extract-Peptone-Dextrose (YEPD). (9), (2015).
- Zhang, M., et al. Improvement of cell counting method for Neubauer counting chamber. J Clin Lab Anal. 34 (1), e23024 (2020).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies. Eu J Immunol. 47 (10), 1584-1797 (2017).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eu J Immunol. 51 (12), 2708-3145 (2021).
- Shapiro, H. M. . Practical Flow Cytometry. , (2003).
- Tung, J. W., et al. Modern flow cytometry: a practical approach. Clin Lab Med. 27 (3), 453-468 (2007).
- JoVE Science Education Database. . Flow Cytometry. , (2023).
- Cheung, M., Campbell, J. J., Whitby, L., Thomas, R. J., Braybrook, J., Petzing, J. Current trends in flow cytometry automated data analysis software. Cytometry A. 99 (10), 1007-1021 (2021).
- . FlowCytometryTools: Version 0.4.5 Available from: https://pypi.org/project/FlowCytometryTools/ (2021)
- White, S., et al. FlowKit: A Python Toolkit for Integrated Manual and Automated Cytometry Analysis Workflows. Front Immunol. 12, 768541 (2021).
- O'Neill, K., Aghaeepour, N., Spidlen, J., Brinkman, R. Flow cytometry bioinformatics. PLoS Comput Biol. 9 (12), e1003365 (2013).
- Klement, T., Milker, S., Jäger, G., Grande, P. M., Domínguez de María, P., Büchs, P. Biomass pretreatment affects Ustilago maydis in producing itaconic acid. Microb Cell Factories. 11, 43 (2012).
- Koschwanez, J. H., Foster, K. R., Murray, A. W. Sucrose utilization in budding yeast as a model for the origin of undifferentiated multicellularity. PLoS Biol. 9 (8), e1001122 (2011).
- Koschwanez, J. H., Foster, K. R., Murray, A. W. Improved use of a public good selects for the evolution of undifferentiated multicellularity. ELife. 2, e00367 (2013).
- Winston, F., Dollard, C., Ricupero-Hovasse, S. L. Construction of a set of convenient Saccharomyces cerevisiae strains that are isogenic to S288C. Yeast. 11 (1), 53-55 (1995).
- Shcherbo, D., et al. Far-red fluorescent tags for protein imaging in living tissues. Biochem J. 418 (3), 567-574 (2009).
- Brachmann, A., Weinzierl, G., Kämper, J., Kahmann, R. Identification of genes in the bW/bE regulatory cascade in Ustilago maydis. Mol Microbiol. 42 (4), 1047-1063 (2001).
- Cormack, B. P., Valdivia, R. H., Falkow, S. FACS-optimized mutants of the green fluorescent protein (GFP). Gene. 173 (1 Spec), 33-38 (1996).
- Behle, A., Saake, P., Germann, A. T., Dienst, D., Axmann, I. M. Comparative dose-response analysis of inducible promoters in cyanobacteria. ACS Synth Biol. 9 (4), 843-855 (2020).
- Lindemann, S. R., et al. Engineering microbial consortia for controllable outputs. ISME J. 10 (9), 2077-2084 (2016).
- Duncker, K. E., Holmes, Z. A., You, L. Engineered microbial consortia: strategies and applications. Microb Cell Factories. 20 (1), 211 (2021).
- Fedeson, D. T., Saake, P., Calero, P., Nikel, P. I., Ducat, D. C. Biotransformation of 2,4-dinitrotoluene in a phototrophic co-culture of engineered Synechococcus elongatus and Pseudomonas putida. Microb Biotechnol. 13 (4), 997-1011 (2020).
- Milo, R., Jorgensen, P., Moran, U., Weber, G., Springer, M. BioNumbers-the database of key numbers in molecular and cell biology. Nucleic Acids Res. 38 (suppl_1), D750-D753 (2009).
- Tóth, G. S., et al. Photosynthetically produced sucrose by immobilized Synechocystis sp. PCC 6803 drives biotransformation in E. coli. Biotechnol Biofuels Bioprod. 15 (1), 146 (2022).
- Weiss, T. L., Young, E. J., Ducat, D. C. A synthetic, light-driven consortium of cyanobacteria and heterotrophic bacteria enables stable polyhydroxybutyrate production. Metabol Eng. 44, 236-245 (2017).
- Zhang, L., Chen, L., Diao, J., Song, X., Shi, M., Zhang, W. Construction and analysis of an artificial consortium based on the fast-growing cyanobacterium Synechococcus elongatus UTEX 2973 to produce the platform chemical 3-hydroxypropionic acid from CO2. Biotechnol Biofuels. 13, 82 (2020).
- Jorrin, B., et al. Stable, fluorescent markers for tracking synthetic communities and assembly dynamics. Microbiome. 12 (1), 81 (2024).
- Yokoo, R., et al. Live-cell imaging of cyanobacteria. Photosynth Res. 126, 36-46 (2015).
- Wilkinson, M. D., et al. The FAIR guiding principles for scientific data management and stewardship. Sci Data. 3, 160018 (2016).
- Venn, B., et al. Fostering the democratization of research data by using the Annotated Research Context (ARC) as practical implementation. E-Science-Tage 2021: Share Your Research Data. , (2021).
- Ortolani, C. The Cytometric File. Flow Cytometry Today: Everything You Need to Know about Flow Cytometry. , (2022).
- Beal, J., et al. Robust estimation of bacterial cell count from optical density. Communi Biol. 3 (1), 512 (2020).
- Funke, M., et al. Microfluidic biolector-microfluidic bioprocess control in microtiter plates. Biotechnol Bioeng. 107 (3), 497-505 (2010).
- Zhang, P., Spaepen, S., Bai, Y., Hacquard, S., Garrido-Oter, R. Rbec: a tool for analysis of amplicon sequencing data from synthetic microbial communities. ISME Commun. 1 (1), 73 (2021).
- Ezzamouri, B., Shoaie, S., Ledesma-Amaro, R. Synergies of systems biology and synthetic biology in human microbiome studies. Front Microbiol. 12, 681982 (2021).
- Zaramela, L. S., Tjuanta, M., Moyne, O., Neal, M., Zengler, K. synDNA-a synthetic DNA spike-in method for absolute quantification of shotgun metagenomic sequencing. mSystems. 7 (6), e0044722 (2022).
- Bittihn, P., Din, M. O., Tsimring, L. S., Hasty, J. Rational engineering of synthetic microbial systems: from single cells to consortia. Curr Opin Microbiol. 45, 92-99 (2018).
- San León, D., Nogales, J. Toward merging bottom-up and top-down model-based designing of synthetic microbial communities. Curr Opin Microbiol. 69, 102169 (2022).
- Fedeson, D. T., Ducat, D. C. . Symbiotic Interactions of Phototrophic Microbes: Engineering Synthetic Consortia for Biotechnology. Role of Microbial Communities for Sustainability. , (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены