生长曲线:使用菌落成形单位和光学密度测量生成生长曲线
Overview
资料来源:安德鲁·范阿尔斯特1,瑞安农M.勒维克1,纳塔利娅·马丁1,维克多·迪丽塔1
1密歇根州立大学微生物学和分子遗传学系,美国密歇根州东兰辛分校
生长曲线提供了有关细菌生长动力学和细胞生理学的宝贵信息。它们使我们能够确定细菌在可变生长条件下的反应,并为给定细菌定义最佳生长参数。原型增长曲线通过四个增长阶段前进:滞后、指数、静止和死亡 (1)。

图1:细菌生长曲线。在批量培养中生长的细菌通过四个生长阶段:滞后、指数、静止和死亡。滞后期是细菌达到能够快速细胞生长和分裂的生理状态的时间段。指数阶段是细胞生长和分裂速度最快的阶段,在此期间,DNA复制、RNA转录和蛋白质生产均以恒定、快速的速度发生。固定阶段的特点是由于营养限制和/或有毒中间积累,细菌生长减慢和停滞。死亡期是细胞溶血由于严重营养限制而发生的阶段。
滞后期是细菌达到能够快速细胞生长和分裂的生理状态的时间段。出现这种滞后的原因是细菌需要时间来适应新的环境。一旦必要的细胞成分在滞后阶段产生,细菌进入指数增长阶段,DNA复制、RNA转录和蛋白质生产都发生
Procedure
1. 设置
- 所需的实验室材料:液体介质、凝固琼脂介质、Erlenmeyer烧瓶、15 mL试管、磷酸盐缓冲盐水(PBS)、细菌细胞扩散器、70%乙醇和分光光度计。所有溶液和玻璃器皿在使用前都必须消毒。
- 使用 70% 乙醇进行消毒,为工作站做好准备。在 Bunsen 燃烧器附近工作,以防止介质污染。
- 使用细菌时,应使用适当的个人防护设备和无菌技术。使用细菌培养物时,需要实验室外套和手套。
- 缓冲剂、溶液和试剂的配方
- 磷酸盐缓冲盐水 (PBS) (8)。
- 卢里亚-贝尔塔尼兄弟 (LB) (9)。
2. 议定书
- 媒体准备
- 识别生长介质,用于培养细菌,并在单独的可高压灭菌瓶中制备液体肉汤和固体琼脂(1.5% w/v琼脂)培养基。在这里,LB肉汤和LB琼脂为大肠杆菌的生长做好了准备。
- 在设置为 12
Results
Application and Summary
References
- R. E. Buchanan. 1918. Life Phases in a Bacterial Culture. J Infect Dis 23:109-125.
- CAMPBELL A. 1957. Synchronization of cell division. Bacteriol Rev 21:263-72.
- Wang P, Robert L, Pelletier J, Dang WL, Taddei F, Wright A, Jun S. 2010. Robust growth of Escherichia coli. Curr Biol 20:1099-103.
- Goldman E, Green LH. 2015. Practical Handbook of Microbiology, Third Edition. CRC Press.
- Ben-David A, Davidson CE. 2014. Estimation method for serial dilution experiments. J Microbiol Methods 107:214-221.
- Koch AL. 1968. Theory of the angular dependence of light scattered by bacteria and similar-sized biological objects. J Theor Biol 18:133-156.
- Sezonov G, Joseleau-Petit D, D'Ari R. 2007. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol 189:8746-9.
Tags
跳至...
此集合中的视频:

Now Playing
生长曲线:使用菌落成形单位和光学密度测量生成生长曲线
Microbiology
297.8K Views

创建维诺格拉茨基柱:在沉积物样本中丰富微生物物种的方法
Microbiology
129.9K Views

连续稀释和电镀:微生物枚举
Microbiology
317.0K Views

富集培养:在选择性和微分介质上培养有氧和厌氧微生物
Microbiology
132.2K Views

纯培养和条纹电镀:从混合样品中分离单一细菌菌落
Microbiology
166.4K Views

16S rRNA测序:基于PCR的技术,用于识别细菌物种
Microbiology
189.6K Views

抗生素敏感性测试:Epsilo计测试,以确定两种抗生素的MIC值,并评估抗生素协同效应
Microbiology
93.9K Views

显微镜和染色:革兰克、胶囊和内孔染色
Microbiology
364.0K Views

斑块测定:确定病毒性皮石为斑块形成单位(PFU)的方法
Microbiology
186.5K Views

使用自适应氯化钙程序对大肠杆菌细胞的转化
Microbiology
87.1K Views

结合:将阿霉素耐药性从捐赠者转移到受体大肠杆菌的方法
Microbiology
38.4K Views

噬菌体转导:将氨基青霉素耐药性从捐赠者转移到受体大肠杆菌的方法
Microbiology
29.1K Views
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。
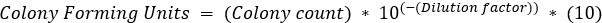
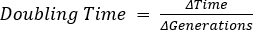
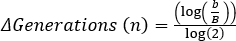 ,其中b = t2的细菌数,B = t1的细菌数,n = 代数的细菌数。 派生自:
,其中b = t2的细菌数,B = t1的细菌数,n = 代数的细菌数。 派生自: