Curvas de crescimento: gerando curvas de crescimento usando unidades formadoras de colônias e medições de densidade óptica
Visão Geral
Fonte: Andrew J. Van Alst1, Rhiannon M. LeVeque1, Natalia Martin1, e Victor J. DiRita1
1 Departamento de Microbiologia e Genética Molecular, Michigan State University, East Lansing, Michigan, Estados Unidos da América
As curvas de crescimento fornecem informações valiosas sobre cinética de crescimento bacteriano e fisiologia celular. Eles nos permitem determinar como as bactérias respondem em condições variáveis de crescimento, bem como definir parâmetros ideais de crescimento para uma determinada bactéria. Uma curva de crescimento arquetípico progride através de quatro estágios de crescimento: defasagem, exponencial, estacionária e morte (1).

Figura 1: Curva de crescimento bacteriano. Bactérias cultivadas em crescimento cultural em lote através de quatro fases de crescimento: defasagem, exponencial, estacionária e morte. A fase de defasagem é o período de tempo que leva para as bactérias chegarem a um estado fisiológico capaz de rápido crescimento celular e divisão. A fase exponencial é o estágio de crescimento e divisão celular mais rápido durante o qual a replicação do DNA, transcrição de RNA e produção de proteínas ocorrem em uma taxa constante e rápida. A fase estacionária é caracterizada por uma desaceleração e planalto do crescimento bacteriano devido à limitação de nutrientes e/ou acúmulo intermediário tóxico. A fase de morte é o estágio durante o qual a lise celular ocorre como resultado de uma severa limitação de nutrientes.
A fase de defasagem é o período de tempo que leva para as bactérias chegarem a um estado fisiológico capaz de rápido crescimento celular e divisão. Essa defasagem ocorre porque leva tempo para as bactérias se adaptarem ao seu novo ambiente. Uma vez que os componentes celulares necessários são gerados em fase de defasagem, as bactérias entram na fase exponencial de crescimento onde a replicação do DNA, transcrição de RNA e produção de proteínas ocorrem em uma taxa constante e rápida (2). A taxa de rápido crescimento celular e divisão durante a fase exponencial é calculada como o tempo de geração, ou o tempo de duplicação, e é a taxa mais rápida na qual as bactérias podem se replicar sob as condições determinadas (1). O tempo de duplicação pode ser usado para comparar diferentes condições de crescimento para determinar qual é mais favorável para o crescimento bacteriano. A fase de crescimento exponencial é a condição de crescimento mais reprodutível, pois a fisiologia celular bacteriana é consistente em toda a população (3). A fase estacionária segue a fase exponencial onde o crescimento celular planalto. A fase estacionária é provocada devido ao esgotamento de nutrientes e/ou ao acúmulo de intermediários tóxicos. As células bacterianas continuam a sobreviver nesta fase, embora a taxa de replicação e divisão celular seja drasticamente reduzida. A fase final é a morte, onde o esgotamento severo de nutrientes leva ao lise das células. Características da curva de crescimento que fornecem mais informações incluem a duração da fase de lag, o tempo de duplicação e a densidade celular máxima alcançada.
A quantificação de bactérias na cultura em lote pode ser determinada utilizando unidades formadoras de colônias e medidas de densidade óptica. A enumeração por unidades formadoras de colônias (UFC) fornece uma medição direta da contagem de células bacterianas. A unidade padrão de medida para a UFC é o número de bactérias culturaáveis presentes por 1 mL de cultura (UFC/mL) determinado por técnicas de diluição serial e revestimento de spread. Para cada ponto de tempo, é realizada uma série de diluição de 1:10 da cultura do lote e 100 μl de cada diluição é espalhada banhada por meio de um espalhador de células.
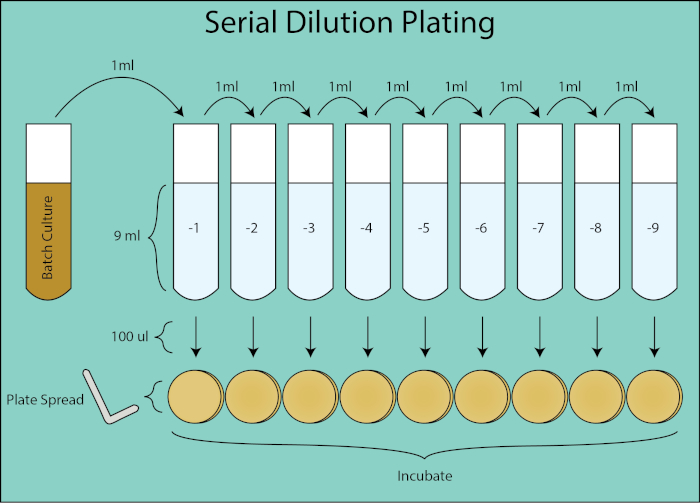
Figura 2. Esquema de revestimento de diluição serial. Fluxo geral para diluição de revestimento da cultura de lote. A cultura do lote é diluída em série 1:10 transferindo 1 mL da diluição anterior para o tubo subsequente contendo PBS de 9ml. A partir de cada tubo de diluição, 100 μl é espalhado banhado por meio de um espalhador de placa que é uma diluição adicional de 1:10, pois é 1/10do volume de 1 mL no cálculo da UFC/mL. As placas são incubadas e enumeradas assim que colônias clonais crescem nas placas.
As placas são então incubadas durante a noite e colônias clonais enumeradas. A placa de diluição que cresceu 30-300 colônias é usada para calcular a UFC/mL para o ponto de tempo dado (4, 5). A variação estocástica na contagem de colônias abaixo de 30 estão sujeitas a maior erro no cálculo da UFC/mL e colônias de contagem superiores a 300 podem ser subestimadas devido à aglomeração e sobreposição de colônias. Utilizando o fator de diluição para a placa dada, a UFC da cultura do lote pode ser calculada para cada ponto de tempo.
A densidade óptica dá uma aproximação instantânea da contagem de células bacterianas medida usando um espectrofotômetro. A densidade óptica é uma medida de absorção de partículas de luz que passam por 1cm de cultura e detectadas por um sensor de fotodiodo (6). A densidade óptica de uma cultura é medida em relação a uma mídia em branco e aumenta à medida que a densidade bacteriana aumenta. Para células bacterianas, um comprimento de onda de 600 nm (OD600) é normalmente usado ao medir a densidade óptica (4). Ao gerar uma curva padrão que relaciona unidades de formação de colônias e densidade óptica, a medição da densidade óptica pode ser usada para aproximar prontamente a contagem de células bacterianas de uma cultura de lote. No entanto, essa relação começa a se deteriorar já em 0,3 OD600 à medida que as células começam a mudar de forma e acumular produtos extracelulares na mídia, influenciando a leitura da densidade óptica no que se refere à UFC (7). Este erro torna-se mais pronunciado durante as fases estacionárias e de morte.
Aqui, Escherichia coli é cultivada em caldo luria-bertani (LB) a 37°C ao longo de 30 horas (7). Tanto as curvas de crescimento da UFC/mL quanto da densidade óptica foram geradas, bem como a curva padrão que relaciona a densidade óptica à UFC.
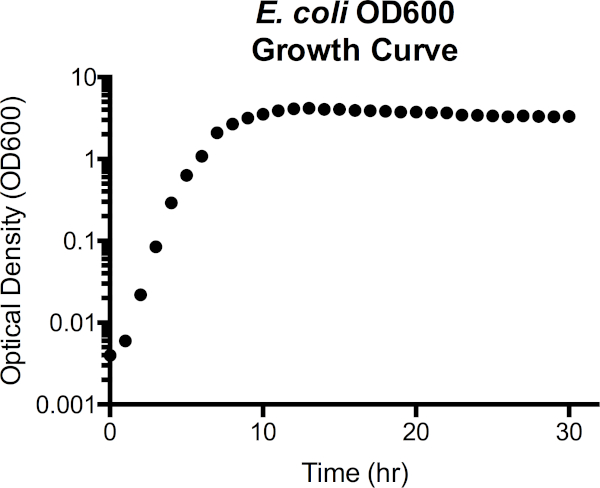
Figura 3. Escherichia coli densidade óptica a 600 nm comprimento de onda (OD600) curva de crescimento. Os valores de densidade óptica foram retirados diretamente do espectotômetro após o em branco com mídia LB estéril. Os valores OD600 superiores a 1,0 foram diluídos 1:10 combinando cultura de 100 μl com 900 μl de LB fresco, novamente medido, e depois multiplicado por 10 para obter o valor OD600. Este passo é dado à medida que a precisão na medição do espectotômetro é reduzida a alta densidade celular. A partir da curva, a fase de defasagem se estende para cerca de 1h de crescimento, passa para fase exponencial de 2h às 7h, então começa a planar, entrando em fase estacionária. A fase da morte não é uma transição acentuada, no entanto, como a densidade óptica gradualmente começa a diminuir após 15h.

Figura 4. Curva de crescimento da colônia Escherichia coli por mililitro (CFU/mL). Os valores de UFC/mL para cada ponto de tempo foram calculados a partir da placa de diluição que continha 30-300 colônias. A partir da curva, a fase de lag se estende para cerca de 2h de crescimento, passa para fase exponencial das 2h às 7h, então começa a planar, entrando em fase estacionária. A fase de morte não é uma transição acentuada, no entanto, como a UFC/mL gradualmente começa a diminuir após 15h de um pico de 2 x 109 para aproximadamente 5 x 108 às 30 horas.
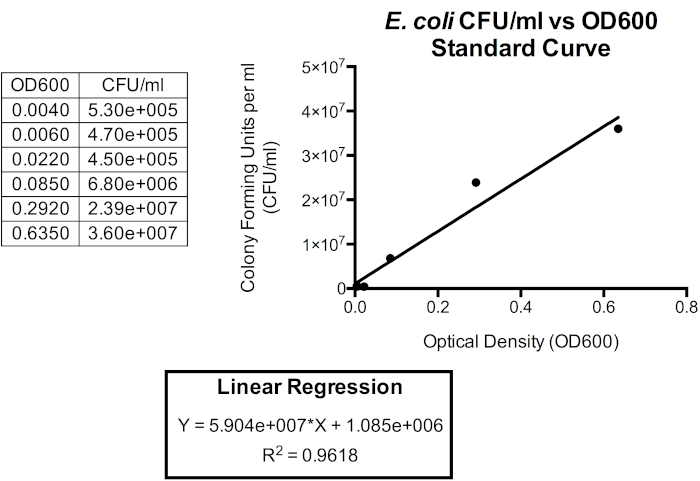
Figura 5. Curva de padronização para CFU/mL versus OD600. Uma regressão linear pode ser usada para relacionar essas unidades para que a densidade óptica possa ser usada para aproximar a densidade celular bacteriana. A densidade óptica pode ser usada para fornecer e aproximação instantânea da UFC/mL da cultura do lote. Aqui, apenas os primeiros seis pontos de tempo são traçados à medida que a relação entre OD600 e CFU/mL é menos precisa além de 1.0 OD600 à medida que a forma celular e os produtos extracelulares começam a se acumular à medida que as bactérias entram em fase estacionária, que ocorre pouco depois de atingir 1,0 OD600. Mudanças na forma celular e produtos extracelulares na mídia influenciam a leitura da densidade óptica e, portanto, a relação entre densidade óptica e o número de bactérias na cultura também é impactada.
O tempo de duplicação também foi determinado em 15 minutos e 19 segundos. A partir desse dado, a capacidade de crescimento da LB para E. coli pode ser visualizada e ser usada para comparação entre diferentes mídias ou bactérias.
Procedimento
1. Configuração
- Materiais de laboratório necessários: mídia líquida, mídia de ágar solidificada, frascos de Erlenmeyer, tubos de ensaio de 15 mL, soro fisiológico tamponado de fosfato (PBS), espalhador de células bacterianas, 70% de etanol e um espectotógrafo. Todas as soluções e vidros devem ser esterilizados antes do uso.
- Prepare a estação de trabalho esterilizando com 70% de etanol. Trabalhe perto de um queimador bunsen para evitar a contaminação da mídia.
- Ao trabalhar co
Resultados
Parcelas de colônias formando unidades e densidade óptica são duas maneiras de visualizar a cinética de crescimento. Ao determinar a relação entre CFU/mL e OD600, o lote de densidade óptica também fornece uma estimativa de UFC/mL ao longo do tempo. Condições que resultam no menor tempo de duplicação são consideradas ideais para o crescimento das bactérias dadas.
Aplicação e Resumo
Curvas de crescimento são valiosas para entender a cinética de crescimento e fisiologia das bactérias. Eles nos permitem determinar como as bactérias respondem em condições variáveis de crescimento, bem como definir os parâmetros de crescimento ideais para uma determinada bactéria. As unidades formadoras de colônias e as parcelas de densidade óptica contêm informações valiosas que retratam a duração da fase de defasagem, a densidade celular máxima atingida e permitem o cálculo do tempo de duplicação b...
Referências
- R. E. Buchanan. 1918. Life Phases in a Bacterial Culture. J Infect Dis 23:109-125.
- CAMPBELL A. 1957. Synchronization of cell division. Bacteriol Rev 21:263-72.
- Wang P, Robert L, Pelletier J, Dang WL, Taddei F, Wright A, Jun S. 2010. Robust growth of Escherichia coli. Curr Biol 20:1099-103.
- Goldman E, Green LH. 2015. Practical Handbook of Microbiology, Third Edition. CRC Press.
- Ben-David A, Davidson CE. 2014. Estimation method for serial dilution experiments. J Microbiol Methods 107:214-221.
- Koch AL. 1968. Theory of the angular dependence of light scattered by bacteria and similar-sized biological objects. J Theor Biol 18:133-156.
- Sezonov G, Joseleau-Petit D, D'Ari R. 2007. Escherichia coli physiology in Luria-Bertani broth. J Bacteriol 189:8746-9.
Pular para...
Vídeos desta coleção:

Now Playing
Curvas de crescimento: gerando curvas de crescimento usando unidades formadoras de colônias e medições de densidade óptica
Microbiology
296.1K Visualizações

Criando uma coluna de Winogradsky: um método para enriquecer as espécies microbianas em uma amostra de sedimento
Microbiology
129.4K Visualizações

Diluições em série e plaqueamento: enumeração microbiana
Microbiology
316.2K Visualizações

Culturas de enriquecimento: cultivo de micróbios aeróbicos e anaeróbicos em meios seletivos e diferenciais
Microbiology
132.1K Visualizações

Culturas puras e semeadura por esgotamento: isolamento de colônias bacterianas únicas de uma amostra mista
Microbiology
166.2K Visualizações

Sequenciamento de rRNA 16S: uma técnica baseada em PCR para identificar espécies bacterianas
Microbiology
189.0K Visualizações

Teste de sucetibilidade a antibióticos: testes de epsilômetro para determinar valores de MIC de dois antibióticos e avaliar a sinergia de antibióticos
Microbiology
93.8K Visualizações

Microscopia e Coloração: Coloração de Gram, Cápsula e Endósporo
Microbiology
363.4K Visualizações

Ensaio de placa: um método para determinar o título viral como unidades formadoras de placa (PFU)
Microbiology
186.2K Visualizações

Transformação de células de E. coli usando um protocolo adaptado de cloreto de cálcio
Microbiology
86.8K Visualizações

Conjugação: um método para transferir a resistência à ampicilina da E. coli doadora para a receptora
Microbiology
38.2K Visualizações

Transdução fágica: um método para transferir a resistência à ampicilina da E. coli doadora para a receptora
Microbiology
29.1K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
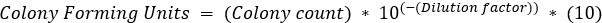
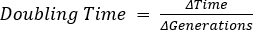
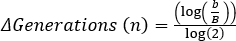 , onde b = número de bactérias em t2, B = número de bactérias em t1, e n = número de gerações. Derivado de:
, onde b = número de bactérias em t2, B = número de bactérias em t1, e n = número de gerações. Derivado de: