Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Quer Aorten-Verengung in Mäuse
In diesem Artikel
Zusammenfassung
Quer Aorta Verengung (TAC) in der Maus ist eine häufig verwendete experimentelle Modell zugrunde liegenden Mechanismen der Herzhypertrophie und Herzinsuffizienz Entwicklung zu studieren. Hier beschreiben wir Verfahren zur Einengung der Aorta zu einem reproduzierbaren Grad der Herzhypertrophie in Mäusen zu erzeugen.
Zusammenfassung
Quer Aorta Verengung (TAC) in der Maus ist eine häufig verwendete experimentelle Modell für Drucküberlastung-induzierte Herzhypertrophie und Herzinsuffizienz.
Protokoll
Teil 1: Vorbereitung der OP-Feld
- Die OP-Feld ist mit 75% igem Alkohol desinfiziert.
- Stellen Sie sicher, das Heizkissen ist und mit der richtigen Temperatur. Eine empfohlene System ist ein Gaymar Umwälzpumpe angeschlossen, eine Therapie Pad, das bei 37 ° C beträgt ± 1 ° C. Es ist wichtig, die normale Körpertemperatur während der Operation zu erhalten, als ein rasches Absinken der Herzfrequenz zu vermeiden.
- Chirurgische Werkzeuge sind in einem heißen Perle Sterilisator vor der Operation sterilisiert. Für dieses Verfahren benötigen Sie die folgenden chirurgischen Instrumenten: stumpfe Schere, natürlich gebogenen Pinzette X 2, Fein 45 ° abgewinkelte Pinzette X 2, gewinkelt Frühjahr Schere, Brust Retraktor und Nadelhalter.
- Cotton Applikatoren sollte auf der Hand im Falle von Blutungen werden.
Teil 2: Herstellung und Intubation der Mäuse
- Mäuse sind in einer Induktion Kammer narkotisiert mit 2% Isofluran gemischt mit 0,5 -1,0 L / min 100% O 2.
- Haarschneidemaschinen werden verwendet, um das Fell vom Halsausschnitt bis Mitte Brusthöhe rasieren.
- Die Maus ist in Rückenlage auf einem Heizkissen gelegt, um die Körpertemperatur aufrecht zu erhalten.
- Ein Gummiband wird über das Tier s Frontzähne platziert, um den Hals zu verlängern. Mit einer gebogenen Pinzette in der einen Hand, die Zunge sanft auf die Seite manipuliert. Mit der anderen Hand, ist endotracheale Intubation erfolgt mit PE 90 Rohre. Der Endotrachealtubus wird dann zu einem Harvard Volumen-und wieder eingeschaltet Nagetier Ventilator Radfahren auf 125-150 Atemzüge / Minute und einem Atemzugvolumen von 0,1-0.3ml verbunden. 1,0 l / min 100% O 2 - Während des chirurgischen Eingriffs, wird die Narkose bei 1,5-2% Isofluran mit 0,5 gepflegt. Richtig Niveau der Anästhesie wird durch Druck auf die Maus Nagelbett (toe-Pinch-Reflex) verifiziert.
- Die OP-Feld ist mit betadine Lösung von 70% igem Alkohol desinfiziert gefolgt. Dieser Vorgang wird dreimal wiederholt.
- Um zu verhindern Kontamination des OP-Feldes während der Operation, ist ein steriles Tuch über der Maus platziert und nur der Betrieb Feld ausgesetzt.
- Eine Reihe von sterilen Handschuhen wird für jede einzelne Maus.
Teil 3: Ligation des Transverse Aorta
- Teilweise Thorakotomie auf der zweiten Rippe wird unter einem Operationsmikroskop durchgeführt und das Brustbein eingefahren mit einer Brust Retraktor.
- Feine Spitze 45 ° abgewinkelt Pinzette werden verwendet, um sanft trennen die Thymus-und Fettgewebe aus dem Aortenbogen.
- Nach der Identifizierung der Quer-Aorta, ist ein kleines Stück einer 6,0 Seidennaht zwischen Innominate und linken Arteria carotis (Abbildung 1) platziert.
- Zwei lose Äste sind rund um die transversale Aorta gebunden und ein kleines Stück von einem 27 ½ gauge stumpfe Nadel wird parallel zu den Quer-Aorta platziert. Der erste Knoten ist schnell gegen die Nadel gebunden, gefolgt von der zweiten und die Nadel sofort entfernt werden, um eine Verengung von 0,4 mm im Durchmesser liefern. In sham Kontrollmäuse, ist das gesamte Verfahren identisch, außer für die Unterbindung der Aorta.
- Die Brust-Haken wird entfernt und der Abfluss des Beatmungsgerätes abgeklemmt für 2 Sekunden, um wieder aufblasen der Lunge.
- Der Brustkorb wird geschlossen mit einem 6,0 Prolene Naht mit einer unterbrochenen Naht Muster.
- Die Haut wird geschlossen mit einem 6,0 Prolene Naht mit einer fortlaufenden Naht Muster.
Teil 4: Post-operative Wiederherstellung
- Für die postoperative Analgesie ist die Maus mit Buprenorphin (0,1 mg / kg) intraperitoneal injiziert. Wenn es Anzeichen einer Dehydrierung nach der Operation sind, ist steriler Kochsalzlösung intraperitoneal gegeben.
- Anästhesie wird schrittweise auf die Aus-Position abgesenkt und der Tubus entfernt werden, wenn Anzeichen von Spontanatmung auftreten.
- Die Maus ist die Bauchlage bewegt und man ließ sie auf einem Heizkissen erholen.
Teil 5: Bestätigung der erfolgreichen Ligation der Transverse Aorta
- Eine Woche nach TAC ist die Maus wieder betäubt, um den Grad der Druck Überlastung durch Unterbindung der Aorta quer induzierte bestimmen. 1,0 l / min 100% O 2 und die Körpertemperatur auf 37 ° C ± 1 ° C - Wie oben beschrieben, ist die Anästhesie bei 1,5-2% Isofluran mit 0,5 gepflegt
- Ein 20 MHz-Doppler-Sonde befindet sich auf der linken und rechten Seite des Halses in einem 45 ° Winkel aufgestellt, um Strömungsgeschwindigkeiten zu erkennen. Ein Computer-based-Doppler-Signal-Prozessor (Indus Instruments, Houston, TX) wurde verwendet, um anzuzeigen und zu speichern Doppler-Signale. 5
- Je nach dem Grad der Drucküberlastung für die experimentelle Protokoll benötigt, werden nur Mäuse mit einer rechten Carotis (RC) / linken Halsschlagader (LC) Flow-Verhältnis in einem bestimmten Bereich für die weitere Analyse mit einbezogen. Zum Beispiel führt ein gewisses Maß an Druck Überlastung zu einem Verhältnis von 5-8, wobei eine engere Einschnürung resulting in schweren Drucküberlastung führt zu einem Verhältnis von 8-10 (Abbildung 5.3A). Ein Schein-Tier (betrieben, aber nicht ligiert), jedoch wird erwartet, dass ein Verhältnis von ~ 1 (Abbildung 5.3b) zu haben.
6: Repräsentative Ergebnisse
Die typischen chirurgischen Überleben nach TAC in Wildtyp-Mäusen ist etwa 80-90%. Erfolgreiche chirurgische Ligatur der Aorta quer zu einer Doppler Strömungsgeschwindigkeit Verhältnis zwischen rechten und linken Halsschlagader (RC / LC) von 5-10 (Abbildung 1) führen. Im Vergleich zu scheinoperierten Mäusen (Abbildung 2a), sind Mäuse mit Drucküberlastung erwartet Herzhypertrophie innerhalb von 1-2 Wochen und Dilatation entwickeln sich nach 6-8 Wochen, je nach der Dichtigkeit der Einschnürung (Abbildung 2B). Sterblichkeit im ersten Monat nach TAC ist in der Regel gering (<20%) in Wildtyp-Mäusen, obwohl genetisch veränderten Mäusen unterschiedliche Überlebensraten aufweisen können. 6,7
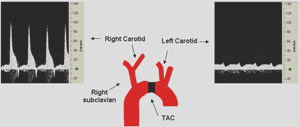
Abbildung 1. Bestätigung der Transverse Aorta Ligation mittels Doppler-Geschwindigkeitsmessung. Representative Dopplergeschwindigkeit Signale der rechten Seite (RC) und linken Halsschlagader (LC) Arterien 6 Tage post-TAC. Diese Aufnahmen zeigen eine erfolgreiche Ligation mit einem RC / LC Flow-Verhältnis von ~ 6,8.
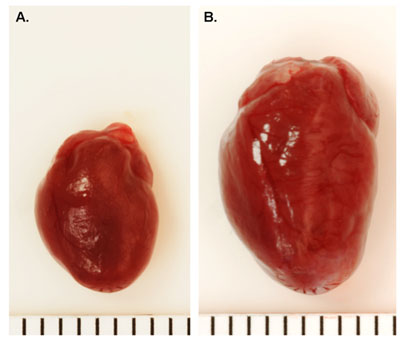
Abbildung 2. Vertreter von ganzem Herzen Images Nach TAC. A. Sham-betrieben Wildtyp-Maus Herzen. B. Wildtyp-Maus Herz 16 Wochen post-TAC. Jede Zeile = 1mm.
Diskussion
TAC, die die menschliche Aortenstenose imitiert, ist eine gängige Methode, um Herzhypertrophie und Herzinsuffizienz in Mäusen zu induzieren. Alternative Standorte für Aorten-Verengung sind die aufsteigenden und abdominalen Aorta. Aufsteigende Aorta Verengung bietet eine extreme und schnellere Überlastung des linken Ventrikels (LV). Im Gegensatz dazu lässt Bauchaorta Verengung intakte einen größeren Teil des Kreislaufs als Mittel der möglichen Entschädigung. 8 Darum, TAC oft ist das bevorzugte Modell,...
Danksagungen
XHTW ist ein WM Keck Foundation Distinguished Young Scholar in der medizinischen Forschung, und wird auch von NIH / NHLBI gewährt R01-HL089598 und R01-R01HL091947 und Muscular Dystrophy Association Grant # 69238 unterstützt. RJvO ist der Empfänger den Zeitraum 2008-2010 American Physiological Society Postdoctoral Fellowship in Physiologische Genomik. Diese Arbeit ist auch zum Teil durch die Fondation Leducq Alliance for CaMKII Signaling in Herz unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Gaymar T/pump | Harvard Apparatus | Model TP-500 | Circulating water pump |
| Temp. therapy pads | Harvard Apparatus | 60-3414 | |
| Hot bead sterilizer | Fine Science Tools | 18000-45 | |
| Blunt scissors | Roboz Surgical Instruments Co. | RS-5980 | |
| Angled spring scissors | Roboz Surgical Instruments Co. | RS-5668 | |
| Chest retractor | Fine Science Tools | 17002-02 | |
| Course curved forceps | Roboz Surgical Instruments Co. | RS-5138 | |
| Dumont fine 45° angled forceps | Fine Science Tools | 11253-25 | |
| Needle holder | Fine Science Tools | 12565-14 | |
| Electric shaver | GE Healthcare | For shaving mouse fur | |
| PE 90 tubing | BD Biosciences | 427420 | For intubation |
| MiniVent (ventilator) | Harvard Apparatus | Type 845 | |
| Betadine | Fisher Scientific | 19-027132 | May be purchased at medical supply store |
| Sterile gloves | Mckesson | 20-1565 | |
| Stereo microscope | Unico | ZM186 | |
| 6-0 silk suture | Fine Science Tools | 18020-60 | |
| 27 ½ gauge needle | BD Biosciences | 305109 | |
| 6-0 prolene suture | Mckesson | 3286 | |
| Buprenorphine | Institutional Animal Facility |
Referenzen
- Rockman, H. A., Ross, R. S., Harris, A. N., Knowlton, K. U., Steinhelper, M. E., Field, L. J., Ross, J., Chein, K. R. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy. Proc. Natl. Acad. Sci. USA. 88, 8277-8281 (1991).
- Heineke, J., Molkentin, J. D. Regulation of cardiac hypertrophy by intracellular signaling pathways. Nat. Rev. Mol. Cell. Biol. 7, 589-600 (2006).
- Hartley, C. J., Reddy, A. K., Madala, S., Michael, L. H., Entman, M. L., Taffett, G. E. Doppler estimation of reduced coronary flow reserve in mice with pressure overload cardiac hypertrophy. Ultrasound Med. Biol. 34, 892-901 (2008).
- Reddy, A. K., Taffett, G. E., Li, Y. -. H., Lim, S. -. W., Pham, T. T., Pocius, J. S., Entman, M. L., Michael, L. H., Hartley, C. J. Doppler signal processing for use in mice: applications. IEEE Trans. Biomed. Eng. 52, 1771-1783 (2005).
- Li, Y. -. H., Reddy, A. K., Ochoa, L. N., Pham, T. T., Hartley, C. J., Micheal, L. H., Entman, M. L., Taffett, G. E. Effect of age on peripheral vascular response to transverse aortic banding in mice. J. Gerontol. 58A, 895-899 (2003).
- Bourajjaj, M., Armand, A. S., Martins, d. a. C. o. s. t. a., Weijts, P. A., Nagel, B. V. a. n. d. e. r., Heeneman, R., Wehrens, S., Windt, X. H. D. e., J, L. NFATc2 is a necessary mediator of calcineurin-dependent cardiac hypertrophy and heart failure. J. Biol. Chem. 28, 22295-22303 (2008).
- Oort, R. J. v. a. n., Respress, J. L., Li, N., Reynolds, C., Almeida, A. C. D. e., Skapura, D. G., Windt, L. J. D. e., Wehrens, X. H. Accelerated development of pressure overload induced cardiac hypertrophy and dysfunction in an RyR2-R176Q knockin mouse model. Hypertension. 55, (2010).
- Tarnavski, O., McMullen, J. R., Schinke, M., Nie, Q., Kong, S., Izumo, S. Mouse cardiac surgery: comprehensive techniques for the generation of mouse models of human diseases and their application for genomic studies. Physiol Genomics. 16, 349-360 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten