Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Constriction aortique transverse chez la souris
Dans cet article
Résumé
Constriction aortique transverse (TAC) chez la souris est un modèle couramment utilisé expérimental pour étudier les mécanismes qui sous-tendent l'hypertrophie cardiaque et le développement d'insuffisance cardiaque. Ici, nous décrivons les procédures de la constriction de l'aorte afin de créer un diplôme reproductible de l'hypertrophie cardiaque chez la souris.
Résumé
Constriction aortique transverse (TAC) chez la souris est un modèle couramment utilisé pour la pression de surcharge expérimentale induite par l'hypertrophie cardiaque et l'insuffisance cardiaque.
Protocole
Partie 1: Préparation du champ opératoire
- Le champ opératoire est désinfecté avec de l'alcool isopropylique à 75%.
- Assurez-vous que le coussin chauffant est en marche et à la bonne température. Un système recommandé est une pompe à eau circulant Gaymar connecté à un pad thérapie qui est maintenue à 37 ° C ± 1 ° C. Il est important de maintenir la température normale du corps pendant la chirurgie pour éviter une diminution rapide de la fréquence cardiaque.
- Outils chirurgicaux sont stérilisés dans un stérilisateur à billes chaudes avant la chirurgie. Pour cette procédure, vous aurez besoin des instruments chirurgicaux suivants: ciseaux émoussés, bien sûr courbes pince X 2, fin 45 ° pince à angle X 2, ciseaux à ressort coudé, écarteur thoracique et porte-aiguille.
- Applicateurs de coton devrait être à portée de main en cas de saignement.
Partie 2: Préparation et l'intubation des souris
- Les souris sont anesthésiées dans une chambre d'induction avec 2% d'isoflurane mélangé avec 0,5 à 1,0 L / min à 100% d'O 2.
- Tondeuses à cheveux sont utilisés pour raser le poil de l'encolure au niveau de la poitrine mi.
- La souris est placée dans une position couchée au sommet d'un coussin chauffant afin de maintenir la température du corps.
- Une bande de caoutchouc est placé sur les dents de devant de l'animal de proroger le cou. En utilisant des pinces courbes dans une main, la langue est délicatement manipulé sur le côté. Avec l'autre main, l'intubation endotrachéale est réalisée en utilisant PE 90 tubes. Le tube endotrachéal est ensuite relié à un volume de Harvard-vélo vélo ventilateur rongeurs à 125-150 respirations / minute et un volume courant de 0,1-0.3ml. Lors de la procédure chirurgicale, l'anesthésie est maintenue à 1,5-2% d'isoflurane à 0,5 - 1,0 L / min à 100% d'O 2. Niveau correct de l'anesthésie est vérifiée en appliquant une pression sur le lit de l'ongle de la souris (tep-pincement réflexe).
- Le champ opératoire est désinfecté avec une solution Betadine suivie par 70% d'alcool. Cette procédure est répétée trois fois.
- Pour éviter la contamination du champ opératoire pendant l'opération, d'un champ stérile est placé sur la souris ne laissant que le champ d'opération exposés.
- Une paire de gants stériles sont utilisés pour chaque souris individuelle.
Partie 3: La ligature de l'aorte transverse
- Thoracotomie partielle de la deuxième côte est réalisée sous un microscope chirurgical et le sternum rétracté à l'aide d'un écarteur thoracique.
- Pointe fine pince à angle de 45 ° sont utilisés pour séparer les tissus délicatement le thymus et la graisse de la crosse aortique.
- Après identification de l'aorte transverse, un petit morceau d'une suture de soie 6.0 est placé entre les artères innominée et la carotide gauche (figure 1).
- Deux nœuds lâches sont attachés autour de l'aorte transverse et un petit morceau d'une aiguille de calibre 27 ½ émoussée est placée parallèlement à l'aorte transverse. Le premier nœud est rapidement lié contre l'aiguille, suivie par la deuxième et l'aiguille rapidement retirés afin d'obtenir une constriction des 0.4mm de diamètre. Chez les souris de contrôle imposture, toute la procédure est identique sauf pour la ligature de l'aorte.
- L'écarteur thoracique est enlevé et la sortie de l'arrêt ventilateur pincé pendant 2 secondes pour regonfler les poumons.
- La cage thoracique est fermée à l'aide d'une suture Prolène 6.0 avec un modèle de suture interrompue.
- La peau est fermée à l'aide d'une suture Prolène 6.0 avec un modèle de surjet.
Partie 4: récupération post-opératoire
- Pour l'analgésie postopératoire, la souris est injecté avec la buprénorphine (0,1 mg / kg) par voie intrapéritonéale. S'il ya des signes de déshydratation après une chirurgie, une solution saline stérile est donné par voie intrapéritonéale.
- L'anesthésie est progressivement abaissé à la position OFF et la sonde endotrachéale retiré lorsque des signes de respiration spontanée se produire.
- La souris est déplacé à la position couchée et a permis de récupérer sur un coussin chauffant.
Partie 5: Confirmation de la ligature réussie de l'aorte transverse
- Une semaine après le TAC, la souris est à nouveau anesthésié afin de déterminer le degré de surcharge de pression induite par ligature de l'aorte transverse. Comme décrit ci-dessus, l'anesthésie est maintenue à 1,5-2% d'isoflurane à 0,5 - 1,0 L / min à 100% d'O 2 et la température corporelle à 37 ° C ± 1 ° C.
- A 20 MHz Doppler sonde est placée sur les côtés gauche et droit du cou à un angle de 45 ° afin de détecter les vitesses d'écoulement. Un ordinateur basé sur le processeur de signal Doppler (Indus Instruments, Houston, TX) a été utilisé pour afficher et de stocker des signaux Doppler. 5
- Selon le degré de surcharge de pression nécessaire pour que le protocole expérimental, les souris seulement avec un carotide droite (CR) / carotide gauche (LC) rapport de débit dans une certaine plage sont inclus pour analyse ultérieure. Par exemple, un degré modéré de surcharge de pression conduit à un ratio de 5-8, alors qu'un resultin serré la constrictiong dans la surcharge de pression sévères conduit à un ratio de 8-10 (Figure 5.3a). Un animal factice (mais pas exploités ligaturé), cependant, on s'attend à avoir un ratio de ~ 1 (figure 5.3B).
6: Résultats Représentant
La survie typiques chirurgicales suivantes TAC souris de type sauvage est d'environ 80-90%. Succès ligature chirurgicale de l'aorte transverse mènera à un ratio Doppler vitesse d'écoulement entre l'artère carotide droite et à gauche (RC / LC) de 5-10 (figure 1). Comparé à une opération fictive souris (figure 2A), souris avec la surcharge de pression sont appelés à développer une hypertrophie cardiaque dans les 1-2 semaines, et la dilatation cardiaque après 6-8 semaines, selon l'étanchéité de la constriction (figure 2B). La mortalité durant le premier mois après TAC est généralement faible (<20%) dans les souris de type sauvage, bien que les souris génétiquement modifiées peuvent présenter différents taux de survie 6,7.
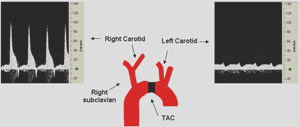
Figure 1. Confirmation de la ligature des aorte transverse en utilisant la mesure de vitesse Doppler. Signaux représentant la vitesse Doppler de la droite (RC) et carotide gauche (LC) artères 6 jours après l'ATC. Ces enregistrements montrent une ligature réussie, avec un ratio de débit RC / LC de ~ 6,8.
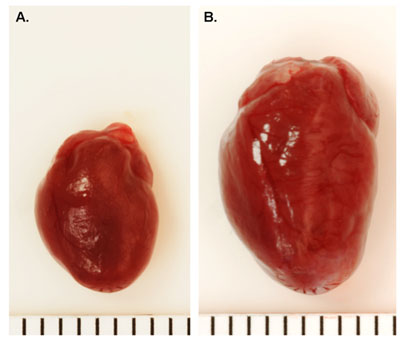
Figure 2. Représentant Images cœur Après TAC. A, B. Sham-exploité cœur sauvage de souris de type.. Sauvage coeur de souris de type 16 semaines post-TAC. Chaque ligne = 1mm.
Discussion
TAC, qui imite une sténose aortique humaine, est une méthode commune pour induire une hypertrophie cardiaque et l'insuffisance cardiaque chez la souris. Sites alternatifs pour la constriction aortique comprennent l'aorte ascendante et de l'abdomen. Croissant constriction aortique fournit une surcharge extrême et plus rapide sur le ventricule gauche (VG). En revanche, la constriction aortique abdominal laisse intacte une grande partie de la circulation comme moyen de compensation possible. 8 C'est...
Remerciements
XHTW est un WM Keck Foundation Distinguished Scholar jeunes en recherche médicale, et est également soutenu par le NIH / NHLBI subventions R01 et R01-HL089598-R01HL091947 et Muscular Dystrophy Association subvention no 69238. RJvO est le récipiendaire de la bourse américaine 2008-2010 Physiological Society postdoctorale en génomique physiologique. Ce travail est également soutenu en partie par l'Alliance pour la Fondation Leducq CaMKII Signalisation Cœur.
matériels
| Name | Company | Catalog Number | Comments |
| Gaymar T/pump | Harvard Apparatus | Model TP-500 | Circulating water pump |
| Temp. therapy pads | Harvard Apparatus | 60-3414 | |
| Hot bead sterilizer | Fine Science Tools | 18000-45 | |
| Blunt scissors | Roboz Surgical Instruments Co. | RS-5980 | |
| Angled spring scissors | Roboz Surgical Instruments Co. | RS-5668 | |
| Chest retractor | Fine Science Tools | 17002-02 | |
| Course curved forceps | Roboz Surgical Instruments Co. | RS-5138 | |
| Dumont fine 45° angled forceps | Fine Science Tools | 11253-25 | |
| Needle holder | Fine Science Tools | 12565-14 | |
| Electric shaver | GE Healthcare | For shaving mouse fur | |
| PE 90 tubing | BD Biosciences | 427420 | For intubation |
| MiniVent (ventilator) | Harvard Apparatus | Type 845 | |
| Betadine | Fisher Scientific | 19-027132 | May be purchased at medical supply store |
| Sterile gloves | Mckesson | 20-1565 | |
| Stereo microscope | Unico | ZM186 | |
| 6-0 silk suture | Fine Science Tools | 18020-60 | |
| 27 ½ gauge needle | BD Biosciences | 305109 | |
| 6-0 prolene suture | Mckesson | 3286 | |
| Buprenorphine | Institutional Animal Facility |
Références
- Rockman, H. A., Ross, R. S., Harris, A. N., Knowlton, K. U., Steinhelper, M. E., Field, L. J., Ross, J., Chein, K. R. Segregation of atrial-specific and inducible expression of an atrial natriuretic factor transgene in an in vivo murine model of cardiac hypertrophy. Proc. Natl. Acad. Sci. USA. 88, 8277-8281 (1991).
- Heineke, J., Molkentin, J. D. Regulation of cardiac hypertrophy by intracellular signaling pathways. Nat. Rev. Mol. Cell. Biol. 7, 589-600 (2006).
- Hartley, C. J., Reddy, A. K., Madala, S., Michael, L. H., Entman, M. L., Taffett, G. E. Doppler estimation of reduced coronary flow reserve in mice with pressure overload cardiac hypertrophy. Ultrasound Med. Biol. 34, 892-901 (2008).
- Reddy, A. K., Taffett, G. E., Li, Y. -. H., Lim, S. -. W., Pham, T. T., Pocius, J. S., Entman, M. L., Michael, L. H., Hartley, C. J. Doppler signal processing for use in mice: applications. IEEE Trans. Biomed. Eng. 52, 1771-1783 (2005).
- Li, Y. -. H., Reddy, A. K., Ochoa, L. N., Pham, T. T., Hartley, C. J., Micheal, L. H., Entman, M. L., Taffett, G. E. Effect of age on peripheral vascular response to transverse aortic banding in mice. J. Gerontol. 58A, 895-899 (2003).
- Bourajjaj, M., Armand, A. S., Martins, d. a. C. o. s. t. a., Weijts, P. A., Nagel, B. V. a. n. d. e. r., Heeneman, R., Wehrens, S., Windt, X. H. D. e., J, L. NFATc2 is a necessary mediator of calcineurin-dependent cardiac hypertrophy and heart failure. J. Biol. Chem. 28, 22295-22303 (2008).
- Oort, R. J. v. a. n., Respress, J. L., Li, N., Reynolds, C., Almeida, A. C. D. e., Skapura, D. G., Windt, L. J. D. e., Wehrens, X. H. Accelerated development of pressure overload induced cardiac hypertrophy and dysfunction in an RyR2-R176Q knockin mouse model. Hypertension. 55, (2010).
- Tarnavski, O., McMullen, J. R., Schinke, M., Nie, Q., Kong, S., Izumo, S. Mouse cardiac surgery: comprehensive techniques for the generation of mouse models of human diseases and their application for genomic studies. Physiol Genomics. 16, 349-360 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon