Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
In utero Elektroporation gefolgt von primären neuronalen Kultur für ein Studium Gene Function in Subset von kortikalen Neuronen
In diesem Artikel
Zusammenfassung
In utero Elektroporation ist eine wertvolle Methode zur Transfektion von neuronalen Vorläuferzellen in vivo. Abhängig von der Platzierung der Elektroden und der Entwicklungspsychologie Zeitpunkt der Elektroporation können bestimmte Teilmengen von kortikalen Zellen ausgerichtet werden. Gezielte Zellen können dann in vivo oder in vitro für die Auswirkungen der genetischen Veränderung untersucht werden.
Zusammenfassung
In-vitro-Studie der primären neuronalen Kulturen ermöglicht quantitative Analysen von Neuriten. Um zu untersuchen, wie genetische Veränderungen neuronaler Prozess Auswuchs, shRNA-oder cDNA-Konstrukte können in primären Neuronen über chemische Transfektion oder virale Transduktion eingeführt werden beeinträchtigt. Doch mit primären kortikalen Zellen sind eine heterogene Pool von Zelltypen (glutamatergen Neuronen aus verschiedenen Schichten, hemmenden Neuronen, Gliazellen) transfiziert mit diesen Methoden. Die Verwendung von in utero Elektroporation DNA-Konstrukte in der embryonalen Nagetier Kortex vorstellen können für bestimmte Untergruppen von Zellen gezielt zu: Während die Elektroporation von frühen embryonalen Kortex Ziele tiefen Schichten der Hirnrinde, Ziele Elektroporation am späten embryonalen Zeitpunkten mehr oberflächlichen Schichten. Darüber hinaus Differential Platzierung der Elektroden über die Köpfe der einzelnen Embryonen Ergebnisse in der Ausrichtung der dorsal-medial gegen ventral-lateralen Regionen des Kortex. Nach der Elektroporation können transfizierte Zellen aus zerlegt werden, dissoziiert und vernickelt in vitro für die quantitative Analyse von Neuriten. Hier bieten wir Ihnen eine Schritt-für-Schritt-Methode zur quantitativen Messung neuronaler Prozess Auswuchs in Teilmengen von kortikalen Zellen.
Das grundlegende Protokoll für die in utero Elektroporation wurde im Detail in zwei anderen JoVE Artikel aus dem Kriegstein Labor 1, 2 beschrieben. Wir geben einen Überblick über unser Protokoll für in utero Elektroporation, die sich auf die wichtigsten Details, durch eine Beschreibung unseres Protokoll, das in utero Elektroporation gilt für die Untersuchung von Genfunktionen in neuronalen Prozess Auswuchs gefolgt.
Protokoll
Das grundlegende Protokoll für die in utero Elektroporation wurde im Detail in einem anderen JoVE Artikel aus der Kriegstein Labor 1, 2 beschrieben. Diese Technik wurde ursprünglich in den Osumi lab 3 beschrieben und unser Protokoll basiert auf einer im LoTurco Lab 4 entwickelt wurde. Wir geben einen Überblick über die unser Protokoll für in utero Elektroporation von Ratte Embryonen, die sich auf die wichtigsten Details, durch eine Beschreibung unseres Protokoll, das in utero Elektroporation gilt für die Untersuchung von Genfunktionen in neuronalen Prozess Auswuchs gefolgt.
1. In utero Elektroporation
- Vorbereitung DNA und Laden Nadeln
Der erste Schritt in utero electroporations ist Ihr Experiment Design zu bestimmen, welche DNA-Konstrukte, die Sie injizieren. Diese Methode ist nützlich für beide misexpressing oder umzuwerfen Gene von Interesse. Wenn Sie auf misexpressing oder Überexpression eines Gens planen, sollten Sie sich auf einen Promotor, der aktiv ist in neuronalen Vorläuferzellen zu verwenden. Wir empfehlen die CAGGS Promotor, die von dem Huhn beta-Aktin-Promotor und dem CMV-Enhancer 5 besteht. Da nur ein kleiner Teil der Zellen transfiziert werden mit in utero Elektroporation, ist es wichtig, ein Plasmid kodierend für ein fluoreszierendes Protein wie GFP enthalten, so dass Sie die Zellen, die erfolgreich elektroporiert wurden, können folgen. Für die Plasmid-Kodierung GFP, empfehlen wir die Vorbereitung der DNA in einer Konzentration von 0,5 pg pro Mikroliter. Für shRNA Konstrukte, haben wir festgestellt, dass 0,5 bis 1,0 pg pro Mikroliter führt zu einer effizienten niederzuschlagen Ihrer Gen von Interesse. Für die Überexpression oder misexpression wir zwischen 1,0 und 3,0 pg pro Mikroliter verwenden, abhängig von der Größe des Gens und die Höhe der Expression, dass das Experiment fordert. DNAs werden unter Verwendung eines Qiagen Endotoxin-freie prep Kit und verdünnt in 1 x PBS. Wir spritzen ca. 0,5-1,0 mL pro embryonalen Gehirn, ja, für einen Wurf von Tieren bereiten wir 10 ul DNA-Gemisch für die Injektion. Wir fügen 1 ul Fast Green an die DNA, so dass wir die injizierte DNA folgen können.
Pulling Nadeln in die richtige Form ist ein wichtiger Schritt. Walantus et al. Verwendet ein anderes System für die Bereitstellung der DNA und damit ihre Nadel prep ist auch leicht andere dann unser 1,2. Die Einstellungen, die Sie benutzen, um Ihre Nadeln ziehen wird über die Marke von Nadel-Abzieher, dass Sie abhängig sind. Wir verwenden Modell 750 von David Kopf. Die Einstellungen, die wir verwenden, sind: Heat 1: 9,0, Heat 2: 0, Soleniod: 0, Filament Größe 3,0 mm, Heizung Proximity: 3 mm, Zeit: 10 sec. Einmal gezogen, schneiden wir unsere Nadeln mit einer Rasierklinge in einem ~ 45 Grad-Winkel, so dass der Abstand von der größten Teil der Öffnung an der Spitze 11 mm ist. Wir laden Sie dann die DNA von dem hinteren Ende der Nadel. Wir füllen dann den verbleibenden Platz in der Nadel mit Maisöl. Für die DNA-Injektion, verwenden wir ein Picospritzer III. Abhängig von der genauen Fase, dass für jede Nadel geschnitten wird, setzen wir die Picospritzer 4,0 bis 6,0. Wir verwenden ein Fußpedal, um die unter Druck stehende Luft, die die DNA verdrängt von der Nadel zu liefern. - Vorbereitung Tiere für die Chirurgie
Wir verwenden pathogenfreien Sprague Dawley Ratten ausschließlich für diese Operationen. Mehrere andere Labore verwenden Mäusen unterschiedlicher Genotypen als auch. Hier beschreiben wir zeigen unsere Protokoll für die Elektroporation von E15 Rattenembryonen, aber in utero Elektroporation wird routinemäßig bei Ratten im Alter zwischen E13 und E18 durchgeführt. Während frühzeitig Elektroporation Ziele tiefen Schichten der Hirnrinde, Ziel später electroporations mehr oberflächlichen Schichten.
Tiere sind eine präoperative Dosis von Buprenorphin (0,05-0,1 mg / kg) gegeben, bevor die Operation beginnt. Es gibt mehrere Optionen für die Betäubung des Tieres. Walantus et al. Nutzt isofuorane Einatmen, während wir routinemäßig intraperitoneale Injektion von Ketamin (40-80 mg / kg) und Xylazin (5-10 mg / kg) 1,2. Ein Zeh Prise sollte immer durchgeführt, um sicherzustellen, dass die Tiere völlig betäubt und nicht mehr reagiert werden. Die Tiere sind auf einem Heizkissen während des chirurgischen Eingriffs gehalten.
Das Tier das Fell ist in der Region Einschnitt rasiert, gewaschen und dreimal mit Ethanol dreimal mit Jod gefolgt. Ein Schnitt in der Haut nur lateral der Mittellinie, gefolgt von einem Einschnitt in den Muskel. Die Uterushörner sind sehr sorgfältig ausgesetzt. Sie sind vorsichtig aus der Leibeshöhle mit den Fingerspitzen gehänselt. Keep Embryonen hydratisiert mit sterilem PBS, während sie außerhalb der Körperhöhle werden. - Injektion von DNA und Elektroporation
Beim ersten Start der Durchführung dieser Operationen, ist der schwierigste Teil immer mit, wo Sie brauchen, um die DNA zu injizieren, so dass Sie die Seitenventrikel füllen vertraut, und gewöhnungsbedürftig, wie tief Sie spritzen die Nadel, um die richtige Region getroffen. Die Embryonen werden sanft mit den Fingerspitzen so manipuliert, dass sie ident kannIfy wo der Kopf ist, und wenn man genau hinschaut, wird in der Lage sein, die Mittellinie Naht zu sehen. Dies dient als allgemeine Wahrzeichen, die Sie verwenden, um festzustellen, wo die lateralen Ventrikel befindet, kann. Wir injizieren die DNA durch die Gebärmutterwand und in den lateralen Ventrikel. Wir verwenden ein Fußpedal, um die Injektion des DNA-Steuerung - mehrere Impulse von DNA durchgeführt werden, bis die Seitenventrikel mit dem DNA / Farbstoff-Gemisch gefüllt ist. Wir haben dann statt Paddle-Elektroden auf beiden Seiten des Kopfes des Embryos und eine andere Fußpedal, den Puls über den Kopf des Embryos liefern. Die Platzierung der Elektroden ist entscheidend dafür, in welcher Region der Großhirnrinde ist elektroporiert. Da die DNA negativ geladen ist, wird die DNA in Richtung der positiven Elektrode, wenn eine Ladung über die Paddel ist gebannt zu reisen. Abhängig von der exakten Platzierung der Elektroden werden verschiedene Untergruppen von Zellen ausgerichtet werden. Wir routinemäßig statt der positiven Elektrode in der Nähe der dorsal-medialen Positionen in das Großhirn. Doch die LoTurco Labor schön gezeigt, dass, wenn Sie die Elektroden in mehr ventralen seitlichen Bereiche des Großhirns Stelle können Sie die Zellen des kortikalen-striatalen Grenze und traf Zellen des lateralen kortikalen Strom 6 Ziel. Jeder Embryo kann elektroporiert werden, und verschiedene Kombinationen von DNA-Konstrukte können in jedem Embryo verwendet werden. - Naht-und post-operative Betreuung
Nach Elektroporation von Tieren alle Embryonen, die Uterushörner sorgfältig in die Leibeshöhle zurück, und sowohl die Muskelschicht und die Haut vernäht. Die Technik dafür ist in Walantus et al 1,2 skizziert. Die Tiere werden kontinuierlich, bis sie wieder aus der Narkose überwacht, und die analgetische Buprenorphin (0,05-0,1 mg / kg) wird alle 8-12 Stunden verabreicht.
2. Die Kultivierung elektroporiertem kortikalen Neuronen
- Harvesting elektroporiert Gehirn und seziert elektroporiert Region
Für die in vivo-Analysen nach in utero Elektroporation, Tiere können zu jedem Zeitpunkt von 24 Stunden nach der Elektroporation zu früh nach der Geburt bis zum Erwachsenenalter geerntet. Allerdings, wenn Kultivierung primärer Neuronen ernten wir 24 Stunden nach der Elektroporation bei E16. Zu diesem Zeitpunkt sind die Elektroporation Embryonen zum Ausdruck nachweisbaren Mengen von GFP.
Die Tiere werden eingeschläfert unter Verwendung von Kohlendioxid beim Einatmen und schnellen Enthauptung. Die Embryonen werden aus der Gebärmutter präpariert und in HBSS mit zweiwertigen Kationen, die Verfolgung von Embryonen mit dem DNA-Plasmide wurden durch Elektroporation. Es ist wichtig, gefiltert HBSS, sterilen Röhrchen und Platten, und autoklaviert Tools für die Präparation zu verwenden. Die Rinden werden und seziert die Hirnhäute entfernt mit Hilfe eines Mikroskops in eine Kapuze. Diese Rinden werden dann unter einem Binokular mit einer Kapazität von GFP visualisieren beobachtet. GFP positive Regionen der Hirnrinde werden identifiziert, und wir ue ein Paar vanna Schere zum Ausschneiden der GFP positive Regionen der Hirnrinde. Diese Stücke sind in HBSS ohne zweiwertige Kationen in einem 15 ml konischen Röhrchen gegeben. - Distanziert und Galvanisieren Neuronen
Sobald alle GFP positive Regionen seziert werden, ist HBSS mit 0,25% Trypsin abgelöst, und bei 37 Grad für 5 Minuten. Trypsin ist entfernt, ersetzt mit plating Medien (DMEM + 5% FBS + Penn / Strep + Glutamin) gut vermischt und 5-7 mal, um die Zellen zu distanzieren. Volumes verwendet, auf die Menge an Gewebe vorhanden abhängen. Dissoziierten Zellen werden dann auf CC2 beschichtete Kammer-Objektträgern ausgestrichen. Für Zwei-Kammer-Objektträger, Platte wir 200,000-350,000 Zellen pro Kammer in einem Volumen von 1,5 ml Plating Medien. Nach 4 Stunden ist plating Medien abgesaugt und durch 1,5 ml Neuronale Kulturmedien (Neurobasal media + B27 ergänzen + Glutamax + Gentamycin) pro Kammer.
3. Analyse neuronaler Prozess Outgrowth
- Fixierung und Immunfärbung Kulturen
Um kurzfristig Wirkungsforschung der genetischen Manipulation dieser Zellen zu messen, ernten wir die primären Neuronen nach drei Tagen in vitro. Wenn primären Neuronen länger für weitere Analysen kultiviert werden, sollte die Hälfte der Medien jeder ersetzt werden drei Tage. Für die Befestigung Kulturen, absaugen wir die Medien aus den Kammern, und befestigen Sie die Neuronen in 4% paraformaldhyde für 15 Minuten. Nach der Fixierung werden die Zellen zweimal in PBS gewaschen und dann in Blocking-Lösung (2% Esel-Serum mit 0,1% Triton X-100 in PBS) für 1 Stunde. Gesetzt Die Zellen werden dann in Primärantikörper für 1 Stunde inkubiert. Für Analysen der neuronalen Prozess Auswuchs, nutzen wir Anti-beta tubululin Antikörper an Neuronen zu identifizieren - beta II Tubulin-Immunfärbung Etiketten der neruonal Zellkörper, Dendriten und Axone. Die Zellen werden dann dreimal in PBS für 5 Minuten gewaschen und anschließend in Cy3-anti-Maus für 1 Stunde inkubiert, gefolgt von drei weiteren PBS gewaschen, Gegenfärbung Kerne mit DAPI und Montage. - Mess-neurite Länge
Bilder von GFP positive, beta-Tubulin-III positive Neuronen sind auf einem Zeiss Axioskop mit einer MC100 Kamera-System erworben. Mehrere Variablen in dieser GFP-positiven Zellen einschließlich der Länge aller Neuriten, Länge des längsten Neuriten untersucht werden können, Verzweigung von Neuriten, die Größe der Zelle soma, etc. Wir haben diese Methode verwendet, um neuronale Prozess Auswuchs auf knock down oder Überexpression von Genen zu analysieren in Bezug auf die Entwicklung des Nervensystems und Neurodegeneration, mit einem Schwerpunkt auf neuronalen Prozess Länge. Um neuronale Prozesse Auswuchs zu messen, verwenden wir AxioVision LE 4.4 Software (Fa. Zeiss). Innerhalb dieser Software gibt es eine Option, die "Skizze" Werkzeug auswählen. Mit diesem Tool können Sie Ihre Computer-Maus, um die Länge der einzelnen neuronalen Prozess zu verfolgen. Es ist entscheidend, um das Ziel, dass Sie in Ordnung sind, um ein genaues Maß für Ihre Neuriten bekommen definieren. Für diese Analysen verwenden wir typischerweise eine 20x-Objektiv.
4. Repräsentative Ergebnisse
Wir haben festgestellt, dass Sprague Dawley Wurfgröße zwischen 6 und 14 Embryonen reicht. Wir in der Regel elektroporieren alle Embryonen. Jeder Embryo kann mit einer unterschiedlichen Kombination von DNAs elektroporiert werden. Allerdings haben wir in der Regel elektroporieren mindestens vier Gehirne mit den gleichen Zustand und Pool dieser Gehirne vor distanziert und Galvanisieren.
Wir haben festgestellt, dass mit dieser Technik etwa 75% der Elektroporation Gehirn auf die gewünschte Region des Kortex ausgerichtet sind, ob dieser dorsalen medialen oder ventralen lateralen Kortex (Abbildung 1). Darüber hinaus haben wir früh electroporations bei E13-14 Ziel-tiefe Schicht Neuronen wie Tbr1 positive Schicht VI Neuronen gefunden, während später electroporations Ziel CTIP2 positive, TBR1 negativen Schicht V-Zellen, und noch später electroporations Ziel Brn2 positive Schicht II / III-Zellen. Eine ausgezeichnete Beschreibung der verschiedenen Marker und Erklärung der neuronalen Subtyp Spezifikation in der Hirnrinde in einen Artikel gefunden, durch Moleneaux et al 7. Abbildung 2 zeigt koronalen Abschnitte des Gehirns entweder Embryonaltag 15,5 oder 17,5 elektroporiert und geerntet postnatalen Tag 5. Rot dargestellt ist Oct6 Immunfärbung. Sie können für Marker in Kultur immunostain zu bestätigen, was Zellschicht Populationen Sie gezielt. Wir haben festgestellt, dass man erwarten, dass die gleichen Zellschicht Population von Zellen in jeder Embryo aus dem gleichen Wurf Ziel (in anderen Worten hängt die Ausrichtung auf die embryonale Zeitpunkt eher dann auf anderen technischen Varianten).
In Kultur kann der prozentuale Anteil der Zellen, die GFP-positiv sind sehr vielseitig, je nachdem wie konservativ Sie sind, wenn sezieren die GFP positiven Bereich (Abb. 3). Aber auch wenn wir sehr konservativ sind und sezieren nur die GFP positive Patch von Zellen, den höchsten Anteil, die wir beobachten ist 5-10% - obwohl Sie sezieren die Region der Großhirnrinde, das war elektroporiert sind, werden die Zellen in nur einer Schicht werden angestrebt. Diese geringe Transfektionseffizienz effciency ist hilfreich bei der Ermittlung, welche Prozesse die electoporated Zelle, die Sie analysieren gehören. Plating-Zellen bei dieser höheren Dichte trägt mit heathier Kulturen, jedoch ist es schwierig zu erkennen, welche Prozess gehört die Zellkörper in die GFP-negativen Zellen (Abbildung 3).
Wenn Sie Probleme sehen alle die feinen Prozesse der elektroporierten Zellen haben, können Sie entweder eine Erhöhung der Konzentration von GFP DNA, dass Sie Elektroporation, um die Expression von GFP zu erhöhen, oder Sie können die dissoziierten Zellen immunostain mit einem Anti-GFP-Antikörper (Fa. Invitrogen ) zusammen mit einem Cy2 sekundären Antikörper.

Abbildung 1. E15.5 Sprague-Dawley Ratten wurden mit GFP-Plasmid elektroporiert und geerntet drei Tage später. Basierend auf der Platzierung der Elektroden werden verschiedene Regionen des Kortex ausgerichtet sein. AF zeigen GFP-Fluoreszenz in ganzen Gehirn.
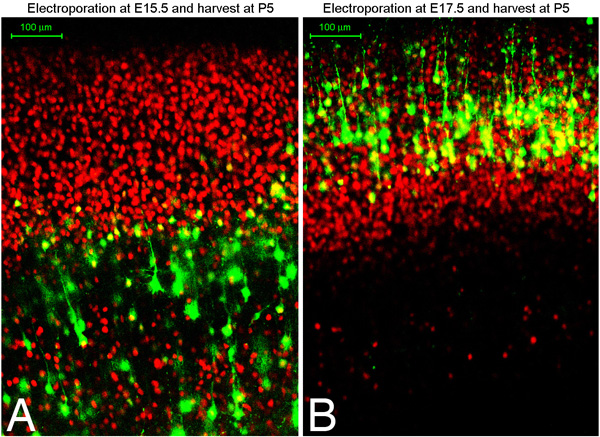
Abbildung 2. E15.5 (A) oder E17.5 (B) Sprague-Dawley Ratten wurden mit GFP-Plasmid und die Ernte bei postnatalen Tag 5 elektroporiert. Die Gehirne wurden fixiert, geschnitten koronal mit einem Vibratom (100 micron Abschnitte) und immunhistochemisch für Oct6 (rot). A und B zeigen konfokale Bilder von immungefärbt Abschnitten.
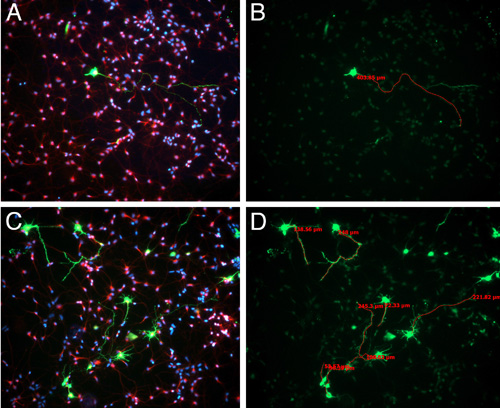
Abbildung 3. E15.5 Sprague-Dawley Ratten wurden mit GFP-Plasmid elektroporiert. 24 Stunden nach der Elektroporation wurden Gehirne entnommen und GFP-positive, elektroporiert Regionen wurden seziert und distanziert, wie in dem Video beschrieben. Nach 3 Tagen in vitro wurden die Zellen fixiert und BIII-Tubulin (rot) immungefärbt und Kernfärbung mit DAPI (blau) (A, C). Die Länge des längsten Neuriten wurde mit der Software AxioVision(B, D).
Diskussion
In-vitro-Studie der primären neuronalen Kulturen ermöglichen quantitative Analysen von Neuriten. Um zu untersuchen, wie genetische Veränderungen neuronaler Prozess Auswuchs beeinflussen können shRNA oder misexpression Konstrukte in primären Neuronen über chemische Transfektion oder virale Transduktion eingeführt werden. Doch mit primären kortikalen Zellen sind eine heterogene Pool von Zelltypen (glutamatergen Neuronen aus verschiedenen Schichten, hemmenden Neuronen, Gliazellen) transfiziert mit diesen M...
Offenlegungen
Danksagungen
Die Autoren bedanken sich bei Joseph LoTurco und Dennis Selkoe für hilfreiche Diskussionen über diese Technik zu danken. Die Autoren danken den Spendern der American Health Assistance Foundation, für die Unterstützung dieser Forschung.
Materialien
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Cortical Neuron Preparation | ||||
| Dissection Media: | ||||
| 10X Hanks' Balanced Salt Solution (HBSS) (Ca+2 /Mg +2 free) | Gibco | 14185-052 | ||
| 10X Hanks' Balanced Salt Solution (HBSS) (with Ca+2 /Mg +2 ) | Gibco | 14065-056 | ||
| 1M HEPES pH 7.4 | Gibco | 15630-080 | ||
| Dishes and Vials: | ||||
| 100 x 15 mm Petri Dishes | Fisherbrand | 08-757-12 | ||
| 60 x 15 mm Petri Dishes | BD Falcon | 351007 | ||
| 15 mL conical vial | Sarstedt | 62-547-205 | ||
| 50 mL conical vial | Sarstedt | 62-554-205 | ||
| Dissection Tools: | ||||
| Scissors | Fine Science Tools | 91402-12 | ||
| Standard Forceps | Fine Science Tools | 11000-12 | ||
| Curved Forceps | Fine Science Tools | 11273-20 | ||
| Fine Forceps | Fine Science Tools | 11255-20 | ||
| Vannas spring scissors | Fine Science Tools | 15000-00 | ||
| Miscellaneous: | ||||
| .25% Trypsin-EDTA | Gibco | 25200 | ||
| Reichert Bright-Line Hemacytometer | Hausser Scientific | 1490 | ||
| Hand-Held Tally Counter | Sigma | Z169021 | ||
| Plating Medium: | ||||
| Dulbecco's Modified Eagle Medium (D-MEM) | Gibco | 11960-051 | ||
| Fetal Bovine Serum | Sigma | F4135 | ||
| Penicillin-Streptomycin | Gibco | 15140 | ||
| L-glutamine | Gibco | 25030 | ||
| Growth Medium: | ||||
| NEUROBASAL Medium | Gibco | 21103-049 | ||
| B-27 Serum-Free Supplement | Gibco | 17504-044 | ||
| GlutaMAX -I Supplement | Gibco | 35050-061 | ||
| Gentamicin Reagent Solution | Gibco | 15750-060 | ||
| Immunostaining: | ||||
| Fixative, Washes, and Blocking Buffer: | ||||
| Paraformaldehyde | Sigma | P6148 | ||
| Phosphate Buffered Saline | Sigma | P4417 | ||
| Triton X-100 | Sigma | T9284 | ||
| Donkey Serum | Jackson Immuno | 017-000-121 | ||
| Antibodies: | ||||
| beta-III tubulin antibody | Chemicon | MAB1637 | ||
| MAP2 antibody | Chemicon | AB15452 | ||
| Donkey Cy3 anti-mouse | Jackson Immuno | 715-166-151 | ||
| Donkey Cy2 anti-chicken | Jackson Immuno | 703-226-155 | ||
| DAPI | Gibco | D3571 | ||
| Slide Preparation: | ||||
| CC2 Coated Two-Chamber Slides | Lab-Tek | 154852 | ||
| Fluorescent Mounting Media | KPL | 71-00-16 | ||
| 24 x 60 mm Micro Cover Glasses | VWR | 48393-106 | ||
| Clear nail polish | Electron Microscopy Sciences | 72180 | ||
| Electroporation: | ||||
| Ketamine | Henry Schein | 995-2949 | ||
| Xylazine | Henry Schein | 4015809TV | ||
| buprenorphine | Henry Schein | 1118217 | ||
| Picospritzer III | Parker | |||
| BTX square wave electroporator | Fisher | BTXECM830 | ||
| Tweezertrodes, 7 mm, platinum | Harvard Apparatus | 450488 |
Referenzen
- Walantus, W., Castaneda, D., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E15 mouse embryos. J Vis Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J Vis Exp. , (2007).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70 (4-5), 155-1562 (2002).
- Bai, J., Ramos, R. L., Ackman, J. B., Thomas, A. M., Lee, R. V., LoTurco, J. J. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nat Neurosci. , 1277-1283 (2003).
- Okada, A., Lansford, R., Weimann, J. M., Fraser, S. E., McConnell, S. K. Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein. Exp Neurol. 156 (2), 394-406 (1999).
- Bai, J., Ramos, R. L., Paramasivam, M., Siddiqi, F., Ackman, J. B., LoTurco, J. J. The role of DCX and LIS1 in migration through the lateral cortical stream of developing forebrain. Dev Neurosci. , 144-156 (2008).
- Molyneaux, B. J., Arlotta, P., Menezes, J. R., Macklis, J. D. Neuronal subtype specification in the cerebral cortex. Nat Rev Neurosci. , 427-437 (2007).
- Young-Pearse, T. L., Bai, J., Chang, R., Zheng, J. B., Loturco, J. J., Selkoe, D. J. A Critical Function for -Amyloid Precursor Protein in Neuronal Migration Revealed by In Utero RNA Interference. J Neurosci. 27, 14459-14469 (2007).
- Young-Pearse, T. L., Chen, A. C., Chang, R., Marquez, C., Selkoe, D. J. Secreted APP regulates the function of full-length APP in neurite outgrowth through interaction with integrin beta1. Neural Develop. 3, 15-15 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten