É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
No útero Eletroporação seguido por Cultura Neuronal primário para estudar a função do gene no subconjunto dos neurônios corticais
Neste Artigo
Resumo
Na eletroporação utero é um método valioso para transfecting células progenitoras neuronal in vivo. Dependendo da colocação dos eletrodos e do ponto no tempo de desenvolvimento de eletroporação, certos subgrupos de células corticais podem ser alvo. Células-alvo podem então ser analisados in vivo ou in vitro para efeitos da alteração genética.
Resumo
Estudo in vitro de culturas primárias neuronais permite análises quantitativas de crescimento de neuritos. A fim de estudar como as alterações genéticas afetam conseqüência processo neuronal, ou construções shRNA cDNA pode ser introduzida em neurônios primários via transfecção química ou transdução viral. No entanto, com células corticais primárias, uma piscina heterogêneo de tipos de células (neurônios glutamatérgicos de diferentes camadas, os neurônios inibitórios, células da glia) são transfectadas com estes métodos. O uso da eletroporação no utero para introduzir DNA construções no córtex roedores embrionárias permite a determinados subconjuntos de células a ser alvo: enquanto eletroporação dos primeiros alvos do córtex embrionário camadas profundas do córtex, eletroporação na tarde timepoints embrionárias alvos camadas mais superficiais. Além disso, a colocação de eletrodos diferenciais entre as cabeças dos resultados individuais de embriões na segmentação de regiões dorsal-medial ventral contra-lateral do córtex. Após a eletroporação, as células transfectadas podem ser dissecados, dissociados, e banhado in vitro para a análise quantitativa do crescimento de neuritos. Aqui, nós fornecemos um método passo-a-passo para medir quantitativamente conseqüência processo neuronal em subconjuntos de células corticais.
O protocolo básico para eletroporação no útero tem sido descrito em detalhes em dois artigos JOVE outros do laboratório Kriegstein 1, 2. Nós iremos fornecer uma visão geral do nosso protocolo para a utero eletroporação, focando os detalhes mais importantes, seguido por uma descrição do nosso protocolo que se aplica em eletroporação utero ao estudo da função do gene em conseqüência processo neuronal.
Protocolo
O protocolo básico para eletroporação no útero tem sido descrito em detalhe em outro artigo JOVE do laboratório Kriegstein 1, 2. Esta técnica foi descrita originalmente no laboratório Osumi 3 e nosso protocolo é baseado em uma desenvolvido no laboratório Loturco 4. Nós iremos fornecer uma visão geral do protocolo no nosso eletroporação útero de embriões de ratos, focando os detalhes mais importantes, seguido por uma descrição do nosso protocolo que se aplica em eletroporação utero ao estudo da função do gene em conseqüência processo neuronal.
1. Em Eletroporação utero
- Preparando-se agulhas de DNA e de carga
O primeiro passo no electroporations útero é a concepção de seu experimento para determinar o DNA construções que você quer injetar. Este método é útil tanto para misexpressing ou derrubando genes de interesse. Se você está pensando em misexpressing ou superexpressão de um gene, não se esqueça de usar um promotor que atua em células precursoras neuronais. Recomendamos o promotor CAGGS, que consiste do frango promotor beta-actina eo enhancer CMV 5. Uma vez que apenas um pequeno subconjunto de células são transfectadas usando em eletroporação utero, é fundamental a inclusão de um plasmídeo uma proteína fluorescente GFP, como de modo que você pode seguir as células que foram sucesso electroporated. Para a GFP plasmídeo, recomendamos preparar o DNA em uma concentração de 0,5 mg por microlitro. Para construções shRNA, descobrimos que 0,5-1,0 mg por mL em resultados eficientes knock down de seu gene de interesse. Para superexpressão ou misexpression, usamos entre 1,0 e 3,0 mg por microlitro, dependendo do tamanho do gene e do nível de expressão que o experimento exige. DNAs são preparados usando um kit Qiagen prep-endotoxina livre, e diluído em 1 x PBS. Nós injetar cerca de 0,5-1,0 mL por cérebro embrionário, assim, para uma ninhada de animais nos preparamos 10 L da mistura de DNA para a injecção. Nós adicionamos 1 mL de verde rápido até o DNA para que possamos seguir o DNA injetado.
Puxar agulhas para a forma correta é uma etapa crítica. Walantus et al. Usa um sistema diferente para entregar o DNA e assim a sua preparação agulha também é diferente slighly 1,2 então a nossa. As configurações que você usa para puxar o seu agulhas vai depender do tipo de agulha extrator que você tem. Usamos Modelo 750 de David Kopf. As configurações que usamos são: Heat 1: 9,0, Heat 2: 0, Soleniod: 0, Filament tamanho 3,0 mm, Proximity Aquecedor: 3 mm, Tempo: 10 seg. Uma vez puxado, nós cortamos as nossas agulhas com uma lâmina de barbear em um ângulo de ~ 45 graus de tal forma que a distância entre a maior parte da abertura para a ponta é de 11 mm. Em seguida, carregar o DNA a partir do back-end da agulha. Em seguida, preencher o espaço restante na agulha com óleo de milho. Para a injecção de DNA, usamos um Picospritzer III. Dependendo do bisel exato em que é cortado para cada agulha, vamos definir o Picospritzer 4,0-6,0. Nós usamos um pedal para entregar o ar pressurizado que expele o DNA da agulha. - Preparar os animais para a cirurgia
Usamos isentos de agentes patogénicos ratos Sprague Dawley exclusivamente para essas cirurgias. Vários outros laboratórios usam ratos de diferentes genótipos também. Aqui, descrevemos mostrar o nosso protocolo de eletroporação do E15 embriões de ratos, mas no útero eletroporação é rotineiramente realizados em ratos com idades entre E13 e E18. Enquanto eletroporação fase inicial alvos camadas profundas do córtex, electroporations fase posterior alvo as camadas mais superficiais.
Animais recebem uma dose pré-operatória de buprenorfina (0,05-0,1 mg / kg) antes da cirurgia começa. Existem várias opções para anestesiar o animal. Walantus et al. Isofuorane utiliza inalação, enquanto que rotineiramente usam injeção intraperitoneal de cetamina (40-80 mg / kg) e xilazina (50-10 mg / kg) 1,2. Uma pitada pés devem ser sempre realizados para assegurar que os animais são completamente anestesiados e sem resposta. Animais são mantidos em uma almofada aquecida durante todo o procedimento cirúrgico.
Pele do animal é raspada na região da incisão, e lavadas três vezes com etanol seguido por três vezes com iodo. É feita uma incisão na pele imediatamente lateral à linha média, seguido por uma incisão no músculo. Os cornos uterinos são expostos com muito cuidado. Eles são suavemente arreliado para fora da cavidade do corpo com o dedo. Manter embriões hidratados com PBS estéril, enquanto eles estão fora da cavidade do corpo. - DNA injetáveis e eletroporação
Quando você começa a realizar estas cirurgias, a parte mais difícil é se familiarizar com o local onde você precisa injetar o DNA para que você preencha os ventrículos laterais, e se acostumando com o quão profundo você injetar a agulha, a fim de atingir a região correta. Embriões são manipulados suavemente com os dedos para que você possa identverificam onde está a cabeça, e se você olhar atentamente você será capaz de ver a sutura mediana. Isto serve como um marco geral que você pode usar para determinar onde o ventrículo lateral está localizado. Nós injetar o DNA através da parede uterina e para o ventrículo lateral. Nós usamos um footpedal para controlar a injeção do DNA - pulsos múltiplos de DNA são realizados até o ventrículo lateral é preenchida com o DNA / mistura de corantes. Em seguida, coloque os eletrodos pá de cada lado da cabeça do embrião e usar outro footpedal para entregar o pulso do outro lado da cabeça do embrião. A colocação dos eletrodos é fundamental para determinar qual a região do córtex é electroporated. Uma vez que o DNA é negativamente carregado, o DNA vai viajar em direção ao eletrodo positivo, quando uma carga é dissipada através da pás. Dependendo da localização exata dos eletrodos, subconjuntos diferentes de células serão o alvo. Rotineiramente, coloque o eletrodo positivo perto as posições dorso-medial em todo o cérebro. No entanto, o laboratório Loturco bela mostrou que se você colocar os eletrodos em mais ventral regiões laterais do cérebro você pode direcionar as células das células córtico-estriatal de fronteira e hit do fluxo cortical lateral 6. Cada embrião pode ser electroporated, e diferentes combinações de construções de DNA pode ser usado em cada embrião. - Sutura e cuidados pós-operatórios
Após a eletroporação de todos os embriões, os cornos uterinos são cuidadosamente voltou para a cavidade do corpo, e ambos a camada muscular ea pele são suturadas. A técnica para isso é descrito na Walantus et al 1,2. Os animais são monitorados continuamente, até que se recupera da anestesia, ea buprenorfina analgésico (0,05-0,1 mg / kg) é administrado a cada 8-12 horas.
2. Cultura Electroporated neurônios corticais
- Colheita cérebros electroporated e dissecando região electroporated
Para análise in vivo seguintes eletroporação utero, os animais podem ser colhidas em qualquer ponto do tempo a partir de 24 horas após a eletroporação para logo após o nascimento à idade adulta. No entanto, quando os neurônios cultura primária colhemos 24 horas após a eletroporação em E16. Neste momento, os embriões electroporated estão expressando níveis detectáveis de GFP.
Os animais são sacrificados por inalação de dióxido de carbono usando a decapitação e rápida. Embriões são dissecados fora do útero e colocado em HBSS com cátions bivalentes, mantendo a par de que os embriões foram electroporated com que plasmídeos DNA. É fundamental usar HBSS filtrado, tubos estéreis e placas, e ferramentas de autoclavado para dissecção. Os córtices são dissecados e as meninges removidas usando um microscópio em uma capa. Estes são, então, córtices observado sob um microscópio de dissecação com a capacidade de visualizar GFP. GFP positivas regiões do córtex são identificados, e nós ue um par de Vanna tesoura para cortar as regiões GFP positivos a partir do córtex. Estas peças são colocadas em HBSS sem cátions divalentes em um tubo de 15 ml. - Dissociar e revestimento neurônios
Uma vez que todas as regiões GFP positivos são dissecados, HBSS é substituído com tripsina 0,25%, e incubadas a 37 graus por 5 minutos. Tripsina é removido, substituído por placas de mídia (DMEM + 5% de SFB + Penn / strep glutamina +), e triturado 5-7 vezes a dissociar as células. Volumes utilizados dependem da quantidade de tecido presente. Células dissociadas são então semeadas em CC2 slides câmara revestido. Por dois slides de câmara, de placas nós 200,000-350,000 células por câmara em um volume de 1,5 mL dos meios de comunicação em placas. Após 4 horas, a mídia chapeamento é aspirado e substituído por 1,5 mL meio de cultura Neuronal (Neurobasal media + B27 + suplemento Glutamax + gentamicina) por câmara.
3. Analisando conseqüência Processo Neuronal
- Fixação e imunocoloração culturas
, A fim de medida de curto prazo effecs de manipulação genética dessas células, colhemos os neurônios primários depois de três dias in vitro. Se neurônios primários estão a ser cultivadas mais tempo para análises adicionais, a metade dos media deve ser substituído a cada três dias. Para a fixação de culturas, que aspire a media das câmaras, e corrigir os neurônios em paraformaldhyde 4% por 15 minutos. Fixação seguintes, as células são lavadas duas vezes em PBS e depois colocar em solução de bloqueio (soro burro 2% com 0,1% Triton X-100 em PBS) por uma hora. Células são então incubados em anticorpo primário por 1 hora. Para as análises de conseqüência processo neuronal, usamos anti-beta tubululin anticorpos para identificar neurônios - beta tubulina imunocoloração II rotula a neruonal célula do corpo, dendritos e axônios. Células são então lavadas três vezes em PBS por cinco minutos, e depois incubadas em Cy3 anti-mouse para uma hora, seguido por mais três lavagens PBS, contracoloração núcleos com DAPI e montagem. - Medição necomprimento urite
Imagens da GFP positivos, os neurônios beta-tubulina III positivas são adquiridas em um Axioskop Zeiss com um sistema de câmera MC100. Diversas variáveis podem ser examinados nestas células GFP positivas incluindo o comprimento de todas as neurites, comprimento da maior neurite, a ramificação de neurites, o tamanho da soma das células, etc Temos utilizado este método para analisar processo de crescimento neuronal sobre derrubar ou superexpressão de genes relacionadas com o neurodesenvolvimento e neurodegeneração, com foco na duração do processo neuronal. Para medir conseqüência de processos neuronais, usamos Axiovision LE 4,4 software (de Zeiss). Dentro deste software, há uma opção para selecionar o "esboço" da ferramenta. Usando esta ferramenta, você pode usar o mouse do computador para rastrear a duração de cada processo neuronal. É fundamental definir o objetivo que você está usando a fim de obter uma medida precisa do seu neurites. Por essas análises, geralmente usamos um objetivo 20x.
4. Resultados representante
Descobrimos que o tamanho da leitegada Sprague Dawley varia entre 6 e 14 embriões. Nós geralmente electroporate todos os embriões. Cada embrião pode ser electroporated com uma combinação diferente de DNAs. Porém, nós normalmente electroporate pelo menos quatro cérebros com a mesma condição e piscina estes cérebros antes de dissociar e revestimento.
Descobrimos que com esta técnica cerca de 75% dos cérebros electroporated são direcionados para a região desejada do córtex, seja córtex medial dorsal ou ventral lateral (Figura 1). Além disso, temos encontrado electroporations cedo, E13-14 neurônios alvo camada profunda como a camada de neurônios Tbr1 positiva VI, enquanto electroporations mais tarde alvo CTIP2 positivo, TBR1 células V negativo camada, e ainda mais tarde alvo electroporations Brn2 positiva camada II / III células. Uma excelente descrição de marcadores diferentes e explicação de especificação subtipo de neurônios no córtex no encontrei um artigo por Moleneaux et al 7. A Figura 2 mostra cortes coronais do cérebro electroporated em cada dia embrionário 15,5 ou 17,5 e colhida no dia pós-natal 5. Mostrado em vermelho é imunomarcação para Oct6. Você pode immunostain para marcadores na cultura para confirmar o que as populações camada de células que você escolheu. Nós descobrimos que você pode esperar para a população-alvo mesma camada das células em cada embrião da mesma ninhada (em outras palavras, o direcionamento depende da timepoint embrionárias em vez de em outras variações técnicas).
Na cultura, a porcentagem de células que são GFP positivas pode variar amplamente, dependendo de como você é conservador quando dissecando a região GFP positivos (Figura 3). No entanto, mesmo quando somos muito conservadores e dissecar apenas corrigir o GFP positivas de células, a porcentagem mais alta que observamos é 5-10% - embora você seja dissecar a região do córtex que foi electroporated, células em apenas uma camada irá ser alvo. Este efciência transfecção baixa é útil na identificação de processos que pertencem à célula electoporated que você está analisando. Células chapeamento neste densidade mais alta contribui para que as culturas heathier, no entanto, é difícil discernir qual o processo pertence a qual corpo celular nas células GFP negativo (Figura 3).
Se você tiver problemas para ver todos os processos de multa de células electroporated, você pode aumentar a concentração de DNA GFP que você está electroporating para aumentar a expressão da GFP, ou você pode immunostain as células dissociadas usando um anticorpo anti-GFP (da Invitrogen ), juntamente com um anticorpo Cy2 secundário.

Figura 1. E15.5 Sprague-Dawley foram electroporated com GFP plasmídeo e colhida três dias depois. Com base na colocação dos eletrodos, diferentes regiões do córtex serão o alvo. AF mostram GFP fluorescência em cérebros inteiros.
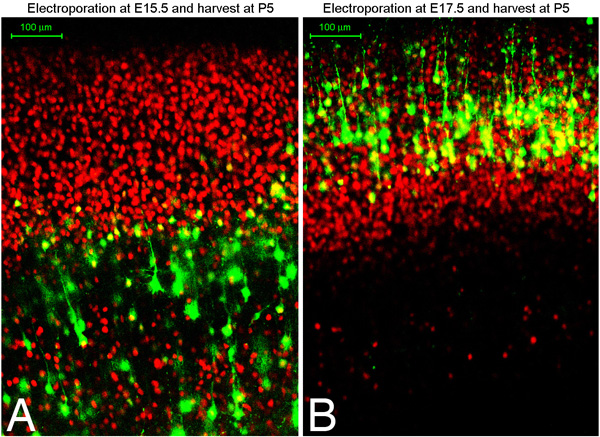
Figura 2. E15.5 (A) ou E17.5 (B) Sprague-Dawley foram electroporated com GFP plasmídeo e colheita no dia pós-natal 5. Cérebros foram fixados, seccionados coronalmente usando um vibratome (100 seções micron), e histoquímica para Oct6 (vermelho). A e B mostram imagens confocal de seções imunocoradas.
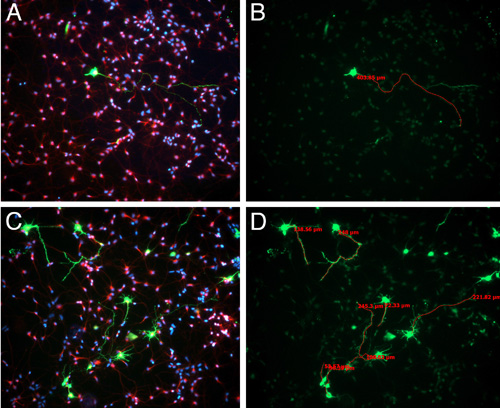
Figura 3. E15.5 Sprague-Dawley foram electroporated com GFP plasmídeo. 24 horas após a eletroporação, os cérebros foram colhidas e GFP-positivo, regiões electroporated foram dissecados e dissociadas, como descrito no vídeo. Depois de três dias in vitro, as células foram fixadas e histoquímica para BIII-tubulina (vermelho) e coloração núcleos com DAPI (azul) (A, C). O comprimento da maior neurite foi medida utilizando software Axiovision(B, D).
Discussão
Estudo in vitro de culturas primárias neuronais permitem análises quantitativas de crescimento de neuritos. A fim de estudar como as alterações genéticas afetam conseqüência processo neuronal, construções ou shRNA misexpression pode ser introduzida em neurônios primários via transfecção química ou transdução viral. No entanto, com células corticais primárias, uma piscina heterogêneo de tipos de células (neurônios glutamatérgicos de diferentes camadas, os neurônios inibitórios, c...
Divulgações
Agradecimentos
Os autores gostariam de agradecer a Joseph Loturco e Dennis Selkoe para discussões úteis sobre esta técnica. Os autores agradecem os doadores da Fundação Americana de Assistência à Saúde, para apoio a esta pesquisa.
Materiais
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Cortical Neuron Preparation | ||||
| Dissection Media: | ||||
| 10X Hanks' Balanced Salt Solution (HBSS) (Ca+2 /Mg +2 free) | Gibco | 14185-052 | ||
| 10X Hanks' Balanced Salt Solution (HBSS) (with Ca+2 /Mg +2 ) | Gibco | 14065-056 | ||
| 1M HEPES pH 7.4 | Gibco | 15630-080 | ||
| Dishes and Vials: | ||||
| 100 x 15 mm Petri Dishes | Fisherbrand | 08-757-12 | ||
| 60 x 15 mm Petri Dishes | BD Falcon | 351007 | ||
| 15 mL conical vial | Sarstedt | 62-547-205 | ||
| 50 mL conical vial | Sarstedt | 62-554-205 | ||
| Dissection Tools: | ||||
| Scissors | Fine Science Tools | 91402-12 | ||
| Standard Forceps | Fine Science Tools | 11000-12 | ||
| Curved Forceps | Fine Science Tools | 11273-20 | ||
| Fine Forceps | Fine Science Tools | 11255-20 | ||
| Vannas spring scissors | Fine Science Tools | 15000-00 | ||
| Miscellaneous: | ||||
| .25% Trypsin-EDTA | Gibco | 25200 | ||
| Reichert Bright-Line Hemacytometer | Hausser Scientific | 1490 | ||
| Hand-Held Tally Counter | Sigma | Z169021 | ||
| Plating Medium: | ||||
| Dulbecco's Modified Eagle Medium (D-MEM) | Gibco | 11960-051 | ||
| Fetal Bovine Serum | Sigma | F4135 | ||
| Penicillin-Streptomycin | Gibco | 15140 | ||
| L-glutamine | Gibco | 25030 | ||
| Growth Medium: | ||||
| NEUROBASAL Medium | Gibco | 21103-049 | ||
| B-27 Serum-Free Supplement | Gibco | 17504-044 | ||
| GlutaMAX -I Supplement | Gibco | 35050-061 | ||
| Gentamicin Reagent Solution | Gibco | 15750-060 | ||
| Immunostaining: | ||||
| Fixative, Washes, and Blocking Buffer: | ||||
| Paraformaldehyde | Sigma | P6148 | ||
| Phosphate Buffered Saline | Sigma | P4417 | ||
| Triton X-100 | Sigma | T9284 | ||
| Donkey Serum | Jackson Immuno | 017-000-121 | ||
| Antibodies: | ||||
| beta-III tubulin antibody | Chemicon | MAB1637 | ||
| MAP2 antibody | Chemicon | AB15452 | ||
| Donkey Cy3 anti-mouse | Jackson Immuno | 715-166-151 | ||
| Donkey Cy2 anti-chicken | Jackson Immuno | 703-226-155 | ||
| DAPI | Gibco | D3571 | ||
| Slide Preparation: | ||||
| CC2 Coated Two-Chamber Slides | Lab-Tek | 154852 | ||
| Fluorescent Mounting Media | KPL | 71-00-16 | ||
| 24 x 60 mm Micro Cover Glasses | VWR | 48393-106 | ||
| Clear nail polish | Electron Microscopy Sciences | 72180 | ||
| Electroporation: | ||||
| Ketamine | Henry Schein | 995-2949 | ||
| Xylazine | Henry Schein | 4015809TV | ||
| buprenorphine | Henry Schein | 1118217 | ||
| Picospritzer III | Parker | |||
| BTX square wave electroporator | Fisher | BTXECM830 | ||
| Tweezertrodes, 7 mm, platinum | Harvard Apparatus | 450488 |
Referências
- Walantus, W., Castaneda, D., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E15 mouse embryos. J Vis Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J Vis Exp. , (2007).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70 (4-5), 155-1562 (2002).
- Bai, J., Ramos, R. L., Ackman, J. B., Thomas, A. M., Lee, R. V., LoTurco, J. J. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nat Neurosci. , 1277-1283 (2003).
- Okada, A., Lansford, R., Weimann, J. M., Fraser, S. E., McConnell, S. K. Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein. Exp Neurol. 156 (2), 394-406 (1999).
- Bai, J., Ramos, R. L., Paramasivam, M., Siddiqi, F., Ackman, J. B., LoTurco, J. J. The role of DCX and LIS1 in migration through the lateral cortical stream of developing forebrain. Dev Neurosci. , 144-156 (2008).
- Molyneaux, B. J., Arlotta, P., Menezes, J. R., Macklis, J. D. Neuronal subtype specification in the cerebral cortex. Nat Rev Neurosci. , 427-437 (2007).
- Young-Pearse, T. L., Bai, J., Chang, R., Zheng, J. B., Loturco, J. J., Selkoe, D. J. A Critical Function for -Amyloid Precursor Protein in Neuronal Migration Revealed by In Utero RNA Interference. J Neurosci. 27, 14459-14469 (2007).
- Young-Pearse, T. L., Chen, A. C., Chang, R., Marquez, C., Selkoe, D. J. Secreted APP regulates the function of full-length APP in neurite outgrowth through interaction with integrin beta1. Neural Develop. 3, 15-15 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados