JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
utero에서 Electroporation은 두피 뉴런의 하위 집합의 유전자 기능을 학습에 대한 기본의 연결을 문화 뒤에
요약
utero의 electroporation에서 생체내에의 연결 전구 세포를 transfecting위한 가치있는 방법입니다. 전극과 electroporation의 발달 timepoint의 위치에 따라, 피질 세포의 특정 하위 집합을 타겟팅할 수 있습니다. 타겟 세포는 다음 생체내 또는 유전 변경의 효과에 대한 체외에서 분석할 수 있습니다.
초록
기본의 연결을 문화의 체외 연구에서 neurite 가지의 양적 분석을 허용합니다. 유전자 변경은 프로세스의 연결 가지, shRNA 또는 cDNA 구조는 화학 transfection 또는 바이러스성 전달을 통해 기본 뉴런에 도입 수있는 영향을 미치는지 연구하기 위해. 그러나, 기본 대뇌 피질의 세포와 세포 유형 (다른 레이어, 억제 신경, glial 세포에서 glutamatergic 뉴런)의 이질적인 수영장은 이러한 방법을 사용 transfected 있습니다. 배아 쥐 대뇌 피질의 DNA 구조를 소개 utero의 electroporation에의 사용 대상으로 세포의 특정 하위 집합을 허용 : 피질의 초기 배아 피질 대상 깊은 레이어 electroporation은 늦은 배아 timepoints에 electroporation은 더 많은 외면적인 레이어를 대상으로하면서. 또한, 피질의 지느러미 - 중간 대 복부 - 가로 영역의 대상에서 개별 배아 결과의 머리를 통해 전극의 차등 배치. electroporation 다음, transfected 세포는 밖으로 해부 dissociated와 neurite 가지의 정량 분석을 위해 체외에서 도금 수 있습니다. 여기, 우리는 양적 대뇌 피질 세포의 하위 집합에의 연결 프로세스 가지를 측정하기위한 단계별 방법을 제공합니다.
utero의 electroporation에 대한 기본적인 프로토콜은 Kriegstein 연구실 1, 2에서 두 개의 다른 조브 기사에 자세히 설명되어있다. 우리의 연결 프로세스 가지의 유전자 기능 연구에 utero의 electroporation에 적용의 프로토콜에 대한 설명 다음에 가장 중요한 세부 사항에 초점을 utero의 electroporation에 우리의 프로토콜의 개요를, 제공할 것입니다.
프로토콜
utero의 electroporation에 대한 기본적인 프로토콜은 Kriegstein 연구실 1, 2에서 다른 조브 문서에서 자세히 설명되었습니다. 이 기법은 원래 오스미 연구실 3 설명한 및 프로토콜 LoTurco 실험실 4 개발 하나를 발견을 기반으로합니다. 우리의 연결 프로세스 가지의 유전자 기능 연구에 utero의 electroporation에 적용되는 우리의 프로토콜에 대한 설명 다음에 가장 중요한 세부 사항에 초점을 쥐 배아의 utero의 electroporation에 대한 우리의 프로토콜의 개요를, 제공할 것입니다.
1. utero의 Electroporation에
- DNA와 로딩 바늘을 준비
utero의 electroporations에 대한 첫 번째 단계는 DNA가 당신이 주입하려는 구조 결정 실험을 디자인하는 것입니다. 이 방법은 misexpressing 또는 관심 유전자를 쓰러뜨린 모두 유용합니다. 이 misexpressing 또는 overexpressing 유전자에 계획하는 경우의 연결을 전구체 세포 활성 프로 모터를 사용해야합니다. 우리는 닭고기 베타 굴지의 모터와 CMV 향상제 5 구성되어 CAGGS의 발기인을 권장합니다. 세포의 단지 작은 하위 집합이 utero의 electroporation에 사용 transfected 있기 때문에 당신이 성공적으로 electroporated되었습니다 그 세포를 추적할 수 있도록, 그것은 같은 GFP로 플라스미드 인코딩 형광 단백질을 포함하는 것이 중요합니다. 플라스미드 인코딩 GFP 위해, 우리는 microliter 당 0.5 μg의 농도에서 DNA를 준비하는 것이 좋습니다. shRNA의 구성을 위해서는 효율에 μL 결과 당 0.5-1.0 μG 관심의 유전자의 허물고 것으로 나타났습니다. overexpression 또는 misexpression 위해, 우리는 유전자의 크기와 실험이 요구되는 표현의 수준에 따라 1.0 microliter 당 3.0 μG 사이에 사용합니다. DNAs은 Qiagen 내독소없는 준비 키트를 사용 준비, 1 X PBS에 희석하고 있습니다. 우리는 사출을위한 DNA 혼합물의 10 μL를 준비 동물의 쓰레기에 대해, 그래서 배아 두뇌 당 약 0.5-1.0 μL를 주입. 우리가 주입된 DNA를 수행 할 수 있도록 우리는 DNA와 빠른 그린 1 μL를 추가합니다.
올바른 모양 바늘을 당기는 것은 중요한 단계입니다. Walantus 외가. DNA를 전달하기위한 다른 시스템을 사용하고 있으므로 자신의 바늘 준비도 slighly 다른 그러면 우리 1,2입니다. 당신의 바늘을 끌어하는 데 사용하는 설정을 가진 바늘 풀러의 브랜드에 따라 달라집니다. 우리는 데이비드 Kopf의 모델 750을 사용합니다. 우리가 사용하는 설정은 다음과 같습니다 열 1 : 9.0, 열 2 : 0, Soleniod : 0, 필라멘트 크기 3.0 mm, 히터 근접 : 3mm, 시간 : 10 초. 일단 뽑아, 우리는 팁에 대한 개방의 가장 핵심적인 부분에서 거리는 11mm입니다 예 ~ 45도 각도에서 면도날과 함께 바늘을 잘라. 우리는 다음 바늘의 백 엔드에서 DNA를로드합니다. 그러면 옥수수 기름으로 주사 바늘에 남아있는 공간을 채우십시오. DNA의 주입을 위해, 우리는 Picospritzer III를 사용합니다. 각 바늘 절단 정확한 베벨에 따라, 우리는 4.0에서 6.0 Picospritzer을 설정합니다. 우리는 바늘의 DNA 퇴학 가압 공기를 제공하기 위해 발 페달을 사용합니다. - 수술 동물을 준비
우리는이 수술 전용 병원체가없는 스프 라그 돌리 쥐를 사용합니다. 여러 다른 연구소들도 genotypes 변화의 생쥐를 사용합니다. 여기, 우리는 E15 쥐 배아의 electroporation을위한 프로토콜을 보여주 설명하지만, utero의 electroporation은 일상적 E13와 E18 세 사이의 쥐에서 수행됩니다. 초기 단계의 electroporation은 피질의 깊은 계층을 대상으로하지만, 나중에 무대 electroporations 더 표면 레이어를 타겟팅할 수 있습니다.
수술이 시작되기 전에 동물 buprenorphine (0.05-0.1 MG / kg)의 사전 수술 약을 주어집니다. 동물을 anesthetizing위한 여러 옵션이 있습니다. 우리가 일상적으로 마취제 (40-80 MG / kg)과 xylazine (MG / kg 5-10) 1,2의 intraperitoneal 주사를 사용하는 동안 Walantus 외가., isofuorane 흡입을 활용합니다. 발가락 핀치는 항상 동물이 완전히 anesthetized 및 응답되는 것을 보장하기 위해 수행되어야합니다. 동물은 수술을 통해 온수 패드에 보관됩니다.
동물의 모피는 절개의 지역에 면도하고, 요오드와 세 번 다음 에탄올로 세 번 씻어입니다. 절개는 근육의 절개 다음, 정중선 단 측면 피부에 이루어집니다. 자궁 뿔은 매우 신중하게 노출됩니다. 그들은 부드럽게 귀하의 손끝을 사용하여 뱃속에서 조롱하고 있습니다. 그들이 밖 뱃속의하는 동안 멸균 PBS와 배아는 수산화 유지. - 주입 DNA와 electroporation
먼저이 수술을 시작할 때, 가장 어려운 부분은 측면 심실을 채울 수 있도록 당신이 DNA를 주입을 필요로하는 곳에 익숙한지고, 그리고 정확한 지역을 공격하기 위해 바늘을 얼마나 깊이를 삽입하는 데 사용지고. 당신은 답하라 수 있도록 태아도 부드럽게 손끝과 조작머리가 어디 쓸어하고 당신이 자세히 본다면 당신은 정중선 봉합을 볼 수있을 것입니다. 이것은 측면 뇌실의 위치를 결정하는 데 사용할 수있는 일반적인 랜드마크 역할을합니다. 우리는 자궁 벽을 통해 측면 뇌실에 DNA를 주입. 측면 뇌실이 DNA / 염료 혼합물로 가득 때까지 DNA의 여러 펄스가 수행됩니다 - 우리는 DNA의 주입을 제어하는 footpedal을 사용합니다. 우리는 다음 배아의 머리 양쪽에 패들 전극을 배치하고 배아의 머리를 통해 펄스를 제공하는 다른 footpedal를 사용합니다. 전극의 위치는 electroporated입니다 피질의 어느 지역 결정 중요합니다. DNA가 부정 청구 있기 때문에, DNA는 요금이 충격기를 통해 무너 뜨 리신있는 긍정적인 전극쪽으로 여행을합니다. 전극의 정확한 위치에 따라 세포의 다른 하위 집합이 타겟이 될 것입니다. 우리는 뇌를 통해 지느러미 - 중간 위치 근처에 긍정적인 전극을 일상적으로 놓으십시오. 그러나, LoTurco 실험실 아름답게 당신이 뇌를보다 복부 측면 지역에 전극을 배치하면 당신은 측면 피질 스트림 6 피질 - striatal 경계를 누르십 세포의 세포를 대상으로 수 것으로 나타났다. 각각의 배아는 electroporated 수 있으며, DNA 구조의 다른 조합은 각 배아에서 사용할 수 있습니다. - Suturing 후 수술 치료
모든 배아의 electroporation에 따라, 자궁 뿔을는 신중하게 뱃속에 반환되며, 근육 계층과 피부 모두 봉합하고 있습니다. 이에 대한 기술은 Walantus 외 1,2에 설명되어 있습니다. 그들은 마취에서 회복까지 동물은 지속적으로 모니터링되며, 진통 buprenorphine (0.05-0.1 MG / kg)은 모든 8~12시간을 관리합니다.
2. Culturing 대뇌 피질의 뉴런을 Electroporated
- electroporated 머리를 수확하고 electroporated 지역 해부
utero의 electroporation에 다음과 같은 생체내 분석의 경우, 동물은 성체로 출생 후 초기에 electroporation 다음 24시간에서 언제 시점에서 수확한 수 있습니다. 그러나, 언제 culturing 기본 뉴런 우리는 E16에 electroporation 다음 24 시간 수확. 이때 electroporated 배아는 GFP의 감지 수준을 표현하고 있습니다.
동물은 이산화탄소 흡입 및 신속한 잘린을 사용하여 euthanized 있습니다. 태아는 자궁 밖으로 해부와 이가의 양이온과 HBSS에 배치, 태아가 어떤의 DNA plasmids과 electroporated되었습니다 추적하는 유지하고 있습니다. 그것은 필터링 HBSS, 무균 튜브 및 접시, 그리고 해부에 대한 autoclaved 도구를 사용하는 것이 중요합니다. cortices는 밖으로 해부하고 meninges는 모자에 현미경을 사용하여 제거됩니다. 이러한 cortices 그런 다음 GFP를 시각화하는 능력과 해부 현미경으로 관찰됩니다. 피질의 GFP 긍정적인 영역은 확인하고, 우리는 도대체 피질에서 GFP 긍정적인 영역을 잘라 바나 가위입니다. 이 작품은 15 ML 원뿔 관에 이가의 양이온없이 HBSS에 배치됩니다. - 뉴런을 Dissociating 및 도금
모든 GFP 긍정적인 지역을 해부되면, HBSS는 0.25 %의 트립신으로 교체하고, 5 분 37도에서 incubated입니다. 트립신은 삭제 도금 미디어 (DMEM + 5% FBS + 펜 / strep + 글루타민), 그리고 세포 분열시키다하는 triturated 5-7 시간으로 바뀝니다. 볼륨 조직 현재의 양을 따라 달라집니다를 사용합니다. Dissociated 전지는 다음 CC2 코팅 챔버 슬라이드에 도금입니다. 도금 미디어 1.5 ML의 볼륨을 두 개의 챔버 슬라이드 위해, 우리는 플레이트 챔버 당 200,000-350,000 세포를. 사시간 후, 도금 미디어 aspirated이며 챔버 당 1.5 ML의 연결을 문화 미디어 (Neurobasal 미디어 + B27 보충 + glutamax + gentamycin)로 교체.
3. 의 연결 프로세스 가지 분석
- 문화를 고정하고 immunostaining
이러한 세포의 유전자 조작의 단기 effecs를 측정하기 위해, 우리는 체외에서 사흘 뒤에 기본 뉴런을 수확. 기본 뉴런 추가 분석을 위해 더 이상 양식 수있다면, 미디어의 절반 세 일마다 교체해야합니다. 문화 고정을 위해, 우리는 실에서 미디어를 대기음, 15 분 4 % paraformaldhyde에있는 뉴런을 수정. 다음 고정은 세포는 PBS로 두 번 씻어 후 차단 용액 (2 %의 당나귀 혈청 0.1 % 트리톤 PBS에서 X - 100) 1 시간.에 배치되어있는 전지는 다음 1 시간 동안 일차 항체에 incubated 수 있습니다. 의 연결 프로세스 가지의 분석을 위해, 우리는 뉴런을 식별하는 안티 - 베타 tubululin 항체를 사용하여 - 베타 II의 tubulin의 immunostaining은 neruonal 세포 기관, dendrites과 axons을 표시합니다. 전지는 다음 5 분 동안 PBS로 세 번 씻어 다음 DAPI로 핵 counterstaining 및 장착 세 PBS의 세척, 다음, 1 시간 동안 Cy3 - 방지 마우스 incubated 수 있습니다. - 측정 NEurite 길이
GFP 양성, 베타 - III tubulin의 긍정적인 뉴런의 이미지는 MC100 카메라 시스템 자이스 혈구 Axioskop에 인수됩니다. 여러 변수가 neurites의 분기, 모든 neurites의 길이, 가장 긴 neurite의 길이를 포함하여 이런 GFP 양성 세포 검사 수있는, 휴대 소마의 크기 등 우리는 아래로 노크 또는 유전자의 overexpression시의 연결 프로세스 가지를 분석하기 위해이 방법을 사용했을 의 연결 프로세스의 길이에 초점을 맞추고, neurodevelopment 및 neurodegeneration에 관한. 의 연결 프로세스의 가지를 측정하기 위해, 우리는 Axiovision LE 4.4 소프트웨어 (자이스 혈구에서)을 사용합니다. 이 소프트웨어 내에서 "개요"도구를 선택하는 옵션이 있습니다. 이 도구를 사용하여, 각각의 연결 프로세스의 길이를 추적하는 컴퓨터의 마우스를 사용할 수 있습니다. 그것은 당신이 당신의 neurites의 정확한 측정을 위해 사용하는 목적을 정의하는 데 중요합니다. 이러한 분석을 위해, 우리는 보통 20x 목적을 사용합니다.
4. 대표 결과
우리는 스프 라그 돌리 쓰레기의 크기가 6 14 태아 사이의 범위 것으로 나타났습니다. 우리는 일반적으로 태아의 모든 electroporate. 각각의 배아는 DNAs의 다른 조합 electroporated 수 있습니다. 그러나, 우리는 일반적으로 dissociating 및 도금 전에 동일한 상태와 수영장이 머리로 최소한 네 머리를 electroporate.
우리는이 기술을 electroporated 두뇌의 약 75 % 그 지느러미 중간 또는 복부 측면 피질 (그림 1) 수 있는지 여부, 피질의 원하는 지역 타겟으로하는 것으로 나타났습니다. 또한, 우리는 Tbr1 긍정적인 계층 VI의 뉴런과 같은 E13 - 14 대상 깊은 계층 뉴런에서 조기 electroporations을 발견하면서 나중에 electroporations 긍정적인 목표 CTIP2, TBR1 부정적인 레이어 V 세포, 그리고 여전히 나중에 electroporations 대상 Brn2 긍정적인 레이어 II / III 세포 해야지. 의 피질에의 연결을 subtype 사양의 다른 마커와 설명 훌륭한 설명 Moleneaux 외 7 기사를 발견했습니다. 그림 2는 15.5 또는 17.5 배아 일 중 하나에서 electroporated 및 출생 후의 일 5 수확 두뇌의 코로나 부분을 보여줍니다. 빨간색으로 표시 Oct6 위해 immunostaining입니다. 당신이 타겟으로 어떤 세포 계층 집단 확인하기 위해 문화의 표식에 대한 immunostain 수 있습니다. 우리는 당신 같은 쓰레기의 모든 배아에서 세포의 동일한 셀 계층 인구를 대상으로 기대할 수 것으로 나타났습니다 (즉, 타겟팅은 오히려 그 다른 기술 변화에 배아 timepoint에 따라 다릅니다.)
문화, 긍정적인 GFP 아르 세포의 %가 널리 GFP 긍정적인 영역 (그림 3)을 해부 때 얼마나 보수에 따라 다양합니다. 그러나, 우리는 매우 보수적이며 세포에만 GFP 긍정적인 패치, 우리는 5-10 %입니다 관찰되는 가장 높은 비율을 해부하다 경우에도 - 당신이 electroporated했습니다 피질의 영역을 해부 있지만, 하나의 레이어에있는 세포 것입니다 대상 수 있습니다. 이 낮은 transfection의 effciency는 프로세스가 분석하고있는 electoporated 세포에 속해있는 식별에 도움이됩니다. 이 높은 밀도로 도금 세포가 heathier 문화를 가지고에 기여하지만, 그것은 프로세스가 속해있는 분별하기 어려운입니다 GFP 부정적인 세포 (그림 3)에있는 세포 기관.
문제가 electroporated 세포의 미세 프로세스를 모두 표시가있는 경우 (Invitrogen에서 둘 다 GFP의 표현을 높일 electroporating되는 GFP의 DNA의 농도를 증가하거나 방지 GFP 항체를 사용하여 dissociated 세포 immunostain 수 ) Cy2 차 항체와 함께.

그림 1. E15.5 스프 라그 - 돌리 쥐가 플라스미드 GFP와 electroporated 세 일 후에 수확했다. 전극의 위치에 따라, 피질의 다른 영역은 타겟이 될 것입니다. 전체 두뇌의 AF 표시 GFP 형광.
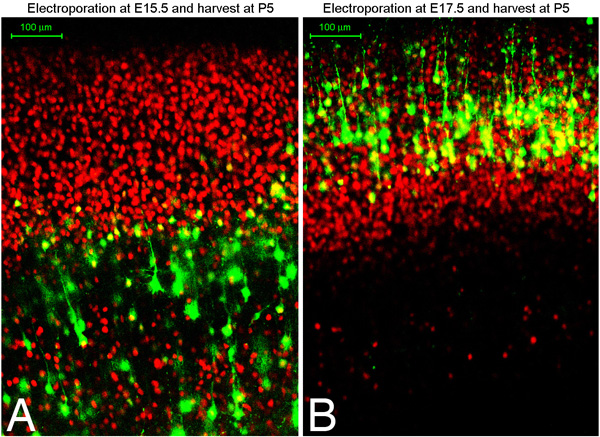
그림 2. E15.5 (A) 또는 E17.5 (B) 스프 라그 - 돌리 쥐는 출생 후의 일 5 GFP 플라스미드와 수확과 함께 electroporated되었습니다. 두뇌는 coronally vibratome를 (100 미크론 섹션)을 사용하여, sectioned 고정 및 Oct6 (적색)에 대한 immunostained되었습니다. A와 B는 immunostained 섹션의 공촛점 이미지를 보여줍니다.
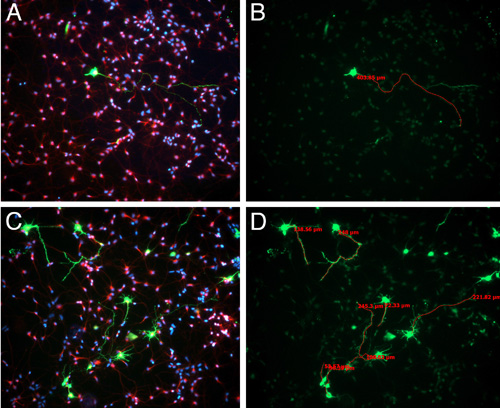
그림 3. E15.5 스프 라그 - 돌리 쥐가 플라스미드 GFP와 electroporated되었습니다. electroporation 다음 24시간은 두뇌가 수확되었으며 GFP 양성, electroporated 지역은 동영상에 설명한 바와 같이, 해부 및 dissociated했다. 체외 3 일 후에, 세포는 고정 및 immunostained 빌 - tubulin (적색) 및 DAPI (블루) (A, C)과 핵 염색법했다. 가장 긴 neurite의 길이 Axiovision 소프트웨어를 사용하여 측정되었다(B, D).
토론
기본의 연결을 문화의 체외 연구에서 neurite 가지의 양적 분석을 위해 수 있습니다. 유전자 변경은 프로세스의 연결을 가지 영향을 미치는지 연구하기 위해, shRNA 또는 misexpression 구조는 화학 transfection 또는 바이러스성 전달을 통해 기본 뉴런에 소개하실 수 있습니다. 그러나, 기본 대뇌 피질의 세포와 세포 유형 (다른 레이어, 억제 신경, glial 세포에서 glutamatergic 뉴런)의 이질적인 수영장은 ?...
공개
감사의 말
저자는이 기술에 대한 유용한 토론 요셉 LoTurco과 데니스 Selkoe 감사하고 싶습니다. 저자는이 연구의 지원, 미국의 건강 보조 재단의 기부자 감사합니다.
자료
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Cortical Neuron Preparation | ||||
| Dissection Media: | ||||
| 10X Hanks' Balanced Salt Solution (HBSS) (Ca+2 /Mg +2 free) | Gibco | 14185-052 | ||
| 10X Hanks' Balanced Salt Solution (HBSS) (with Ca+2 /Mg +2 ) | Gibco | 14065-056 | ||
| 1M HEPES pH 7.4 | Gibco | 15630-080 | ||
| Dishes and Vials: | ||||
| 100 x 15 mm Petri Dishes | Fisherbrand | 08-757-12 | ||
| 60 x 15 mm Petri Dishes | BD Falcon | 351007 | ||
| 15 mL conical vial | Sarstedt | 62-547-205 | ||
| 50 mL conical vial | Sarstedt | 62-554-205 | ||
| Dissection Tools: | ||||
| Scissors | Fine Science Tools | 91402-12 | ||
| Standard Forceps | Fine Science Tools | 11000-12 | ||
| Curved Forceps | Fine Science Tools | 11273-20 | ||
| Fine Forceps | Fine Science Tools | 11255-20 | ||
| Vannas spring scissors | Fine Science Tools | 15000-00 | ||
| Miscellaneous: | ||||
| .25% Trypsin-EDTA | Gibco | 25200 | ||
| Reichert Bright-Line Hemacytometer | Hausser Scientific | 1490 | ||
| Hand-Held Tally Counter | Sigma | Z169021 | ||
| Plating Medium: | ||||
| Dulbecco's Modified Eagle Medium (D-MEM) | Gibco | 11960-051 | ||
| Fetal Bovine Serum | Sigma | F4135 | ||
| Penicillin-Streptomycin | Gibco | 15140 | ||
| L-glutamine | Gibco | 25030 | ||
| Growth Medium: | ||||
| NEUROBASAL Medium | Gibco | 21103-049 | ||
| B-27 Serum-Free Supplement | Gibco | 17504-044 | ||
| GlutaMAX -I Supplement | Gibco | 35050-061 | ||
| Gentamicin Reagent Solution | Gibco | 15750-060 | ||
| Immunostaining: | ||||
| Fixative, Washes, and Blocking Buffer: | ||||
| Paraformaldehyde | Sigma | P6148 | ||
| Phosphate Buffered Saline | Sigma | P4417 | ||
| Triton X-100 | Sigma | T9284 | ||
| Donkey Serum | Jackson Immuno | 017-000-121 | ||
| Antibodies: | ||||
| beta-III tubulin antibody | Chemicon | MAB1637 | ||
| MAP2 antibody | Chemicon | AB15452 | ||
| Donkey Cy3 anti-mouse | Jackson Immuno | 715-166-151 | ||
| Donkey Cy2 anti-chicken | Jackson Immuno | 703-226-155 | ||
| DAPI | Gibco | D3571 | ||
| Slide Preparation: | ||||
| CC2 Coated Two-Chamber Slides | Lab-Tek | 154852 | ||
| Fluorescent Mounting Media | KPL | 71-00-16 | ||
| 24 x 60 mm Micro Cover Glasses | VWR | 48393-106 | ||
| Clear nail polish | Electron Microscopy Sciences | 72180 | ||
| Electroporation: | ||||
| Ketamine | Henry Schein | 995-2949 | ||
| Xylazine | Henry Schein | 4015809TV | ||
| buprenorphine | Henry Schein | 1118217 | ||
| Picospritzer III | Parker | |||
| BTX square wave electroporator | Fisher | BTXECM830 | ||
| Tweezertrodes, 7 mm, platinum | Harvard Apparatus | 450488 |
참고문헌
- Walantus, W., Castaneda, D., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E15 mouse embryos. J Vis Exp. , (2007).
- Walantus, W., Elias, L., Kriegstein, A. In utero intraventricular injection and electroporation of E16 rat embryos. J Vis Exp. , (2007).
- Takahashi, M., Sato, K., Nomura, T., Osumi, N. Manipulating gene expressions by electroporation in the developing brain of mammalian embryos. Differentiation. 70 (4-5), 155-1562 (2002).
- Bai, J., Ramos, R. L., Ackman, J. B., Thomas, A. M., Lee, R. V., LoTurco, J. J. RNAi reveals doublecortin is required for radial migration in rat neocortex. Nat Neurosci. , 1277-1283 (2003).
- Okada, A., Lansford, R., Weimann, J. M., Fraser, S. E., McConnell, S. K. Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein. Exp Neurol. 156 (2), 394-406 (1999).
- Bai, J., Ramos, R. L., Paramasivam, M., Siddiqi, F., Ackman, J. B., LoTurco, J. J. The role of DCX and LIS1 in migration through the lateral cortical stream of developing forebrain. Dev Neurosci. , 144-156 (2008).
- Molyneaux, B. J., Arlotta, P., Menezes, J. R., Macklis, J. D. Neuronal subtype specification in the cerebral cortex. Nat Rev Neurosci. , 427-437 (2007).
- Young-Pearse, T. L., Bai, J., Chang, R., Zheng, J. B., Loturco, J. J., Selkoe, D. J. A Critical Function for -Amyloid Precursor Protein in Neuronal Migration Revealed by In Utero RNA Interference. J Neurosci. 27, 14459-14469 (2007).
- Young-Pearse, T. L., Chen, A. C., Chang, R., Marquez, C., Selkoe, D. J. Secreted APP regulates the function of full-length APP in neurite outgrowth through interaction with integrin beta1. Neural Develop. 3, 15-15 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유