Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Ex vivo Expansion von Tumor-reaktiven T-Zellen mittels Bryostatin 1/Ionomycin und der Gemeinsamen gamma-Kette Zytokine Formulation
In diesem Artikel
Zusammenfassung
Ein effizientes Protokoll für die Ex vivo Ausbau der Tumor-reaktiven T-Zellen aus Tumor-drainierenden Lymphknoten oder anderen sekundären lymphatischen Gewebe des tumortragenden Gastgeber beschrieben. Dieses Protokoll selektiv erweitert tumor-spezifische T-Zellen für den Einsatz in adoptiven Immuntherapie von Brustkrebs.
Zusammenfassung
Es wurde berichtet, dass Brustkrebs-Patientinnen bereits bestehende Immunantworten gegen ihren Tumoren 1,2 haben. Allerdings scheitern solche Immunantwort auf einen vollständigen Schutz gegen die Entwicklung oder Wiederauftreten von Brustkrebs bieten. Zur Lösung dieses Problems durch die Erhöhung der Häufigkeit von Tumor-reaktiven T-Zellen hat adoptiven Immuntherapie eingesetzt. Eine Vielzahl von Protokollen für die Expansion von Tumor-spezifischen T-Zellen verwendet wurden. Diese Protokolle sind jedoch die Verwendung von Tumor-Antigenen ex vivo für die Aktivierung von Antigen-spezifischen T-Zellen beschränkt. Vor kurzem haben gemeinsame gamma-Kette Zytokine wie IL-2, IL-7, IL-15 und IL-21 wurden allein oder in Kombination zur Verbesserung der Anti-Tumor-Immunantwort 3 verwendet. Es ist jedoch nicht klar, was Formulierung am besten für die Expansion von Tumor-reaktiven T-Zellen. Hier präsentieren wir ein Protokoll für die selektive Aktivierung und Expansion von Tumor-reaktiven T-Zellen aus dem FVBN202 transgenen Mausmodell der HER-2/neu positiven Mammakarzinoms für den Einsatz in adoptiven T-Zell-Therapie von Brustkrebs. Das Protokoll umfasst die Aktivierung von T-Zellen mit bryostatin-1/ionomycin (B / I) und IL-2 in Abwesenheit von Tumor-Antigenen für 16 Stunden. B / I Aktivierung imitiert intrazelluläre Signale, die sich in T-Zell-Aktivierung durch die Erhöhung Proteinkinase C Aktivität und den intrazellulären Kalzium-, bzw. 4. Dieses Protokoll ausdrücklich aktiviert tumor-spezifische T-Zellen, während das Töten irrelevant T-Zellen. Die B / I-aktivierten T-Zellen werden mit IL-7 und IL-15 für 24 Stunden kultiviert und anschließend mit IL-2 gepulst. Nach 24 Stunden, T-Zellen werden gewaschen, halbiert und mit kultivierten IL-7 + IL-15 für weitere 4 Tage. Tumor-Spezifität und anti-Tumor-Wirksamkeit des ex vivo expandierten T-Zellen bestimmt.
Protokoll
1. Isolierung von Lymphozyten 5
- Isolieren Tumor-drainierenden Lymphknoten oder Milz von tumortragenden FVBN202 transgenen Mäusen und bereiten einzelne Zellsuspension in eiskaltem RPMI1640 mit 10% FBS. B / I-Aktivierung in 50-ml-Polypropylen-konische Gefäße führt zu einer größeren T-Zell-Ausbeute auf Polystyrol-Röhrchen verglichen. Ketamin und Xylazin injiziert ip für die Anästhesie. Genickbruch ist als eine Methode der Euthanasie verwendet.
- Kultur der Zellen (10 6 Zellen / ml) in Vollmedium mit 15% FBS mit Bryostatin-1 (5 nM) und Ionomycin (1 pM) zusammen mit 80 U / ml IL-2 (PeproTech) für 16 h.
- Waschen Sie die Zellen dreimal mit warmem Medium (37 ° C) und die Kultur bei 10 6 Zellen / ml in komplettem Medium mit IL-7 (10 ng / ml) und IL-15 (10 ng / mL) (PeproTech) für 24 h .
- Pulse der Zellen mit IL-2 (40 U / mL) für 24 h.
- Split der Zellen und Kultur sie mit IL-7 und IL-15 (10 ng / mL) für 4 Tage. Ändern Sie mittel-und spaltete die Zellen, wenn jeder benötigt 2 Tage.
2. Bestimmen Sie falten Expansion von T-Zellen durch Zellzahlen und Durchflusszytometrie Analyse 5
- Die Zellzahlen mittels Lichtmikroskopie
- Bereiten Sie entsprechende Zelle Verdünnung (1:100) in Trypanblau und fügen einige ul auf Hämozytometer
- Count 9 Felder und bestimmen gesamte Zellzahl, indem Zellzahl, die Anzahl der Kammern mit dem Verdünnungsfaktor multipliziert. Die Ergebnisse präsentieren Anzahl x 10 4 Zellen / ml.
- Bestimmen Anteil der CD8 + und CD4 + T-Zellen in der expandierten Zellen mittels Durchflusszytometrie
- Block nicht-spezifische Bindung von Antikörpern an Fc-Rezeptoren durch Kultivierung der Zellen mit anti-CD16/CD32 Antikörper (Biolegend) für 20 min auf Eis und dann waschen Sie die Zellen zweimal mit 2 ml eiskaltem PBS mit 1% Natriumazid .
- Stain die Zellen durch Kultivierung mit FITC-CD4 und PE-CD8-Antikörper für 20 min auf Eis und dann waschen Sie die Zellen zweimal mit 2 ml eiskaltem PBS mit 1% FBS und 0,1% Natriumazid ergänzt.
- Fix die Zellen mit 1% Paraformaldehyd und laufen Proben auf einem Beckman Coulter FC 500 und analysieren mit Summit Version 4.3 Software.
3. Bestimmen Tumor-Spezifität der ex vivo expandierte T-Zellen
- Kultur der ex vivo expandierten Lymphozyten in Vollmedium bei einem Verhältnis von 10:1 mit bestrahlten neu positive MMC Tumorzellen (15.000 rad) für 24 h. 5
- Ernte Überstände und bei -80 ° C bis zur Verwendung. 5,6
- Detect IFN-γ mit einem Maus-IFN-γ ELISA-Set (BD Pharmingen) nach dem Protokoll des Herstellers. 5,6
4. Bestimmen Sie Anti-Tumor-Funktion des ex vivo expandierte T Cells 5,6
- Inkubieren T-Zellen mit Tumorzellen in einem 10:1 Effektor: Target-Verhältnis für 48 Stunden in Vollmedium bei 3 ml Vollmedium (RPMI-1640 ergänzt mit 100U / ml Penicillin, 100 &mgr; g / ml Streptomycin, 10% FBS, Glutamin und β - Mercaptoethanol) und 20U / ml IL-2 (PeproTech) in 6-Well Kulturschalen 37 ° C / 5% CO 2.
- Führen Sie drei Farb-Antikörper-Färbung für neu (anti-c-Erb2/c-neu, Klon-4, Calbiochem) von PE-anti-Maus IgG, Annexin V-FITC und Propidiumiodid (PI) nach dem Protokoll des Herstellers (BD Pharmingen), gefolgt
- Gate auf neu positive Tumorzellen und zu analysieren Lebensfähigkeit (Annexin V-/PI-) der Tumorzellen
5. Mausmodell für Brustkrebs
FVBN202 transgenen weiblichen Mäusen (Charles River Laboratories) für die Quelle von tumor-reaktiven T-Zellen verwendet werden. Diese Mäuse überexprimieren ein nicht aktiviertes Ratte neu Transgen unter der Kontrolle eines MMTV-Promotor und als Folge entwickeln spontane Mammakarzinom zwischen 4-10 Monaten ab 7 Jahren. Diese Mäuse entwickeln prämalignen Mamma Hyperplasie ähnlich duktales Carcinoma in situ (DCIS) vor der Entwicklung des spontanen carcinoma8. Spontane tumortragenden Mäusen als Spender von T-Zellen verwendet.
6. Repräsentative Ergebnisse:
Die Aktivierung von T-Zellen mit B / I für 16 Stunden Ergebnisse bei der Abtötung von naiven T-Zellen, die nicht sensibilisiert mit dem Tumor in vivo. Nach dem B / I-Selektivität von tumor-reaktiven T-Zellen, die sie erweitern bis zu 2,8-fache innerhalb eines 6-Tages-Kultur mit der gamma-Kette Zytokine (Abbildung 1). Beide CD8 + und CD4 + T-Zellen sind ebenfalls mit der gamma-Kette Zytokine (Abbildung 2) erweitert. Die ex vivo expandierten T-Zellen zeigen eine hohe Reaktionsfähigkeit gegen die Tumoren, die Spender Mäuse sensibilisiert wurden, als durch die Produktion von IFN-γ in Gegenwart von neu positive Maus Mammakarzinom (MMC) Tumorzellen (Abbildung 3) ausgewertet. Die ex vivo expandierten T-Zellen kann die Apoptose in den neu positive MMC Tumor cel induzierenls, so dass die Lebensfähigkeit der Tumorzellen Tropfen von 92% auf 61% innerhalb von 48 Stunden (Abbildung 4).
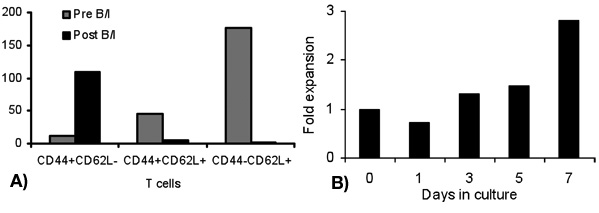
Abbildung 1. Falten Expansion von Lymphozyten zu verschiedenen Zeitpunkten nach B / I-Aktivierung (Tag 1) und ex vivo Expansion mit der gamma-Kette Zytokine (Tage 3, 5 und 7)
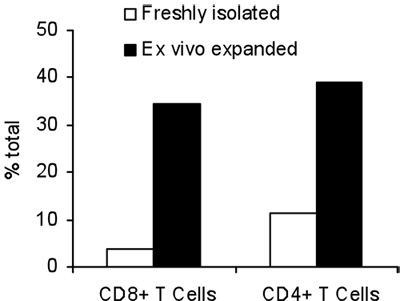
Abbildung 2. Gesamter CD4 + und CD8 + T-Zellen vor und nach einer 7-Tage-Expansion mit der gamma-Kette Zytokine.
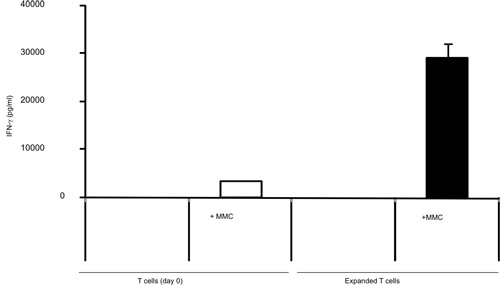
Abbildung 3. Tumor-stimulierten IFN-γ Produktion von T-Zellen aus tumortragenden Mäusen vor und nach einer 7-tägigen Expansion mit der gamma-Kette Zytokine isoliert, mit IFN-γ ELISA
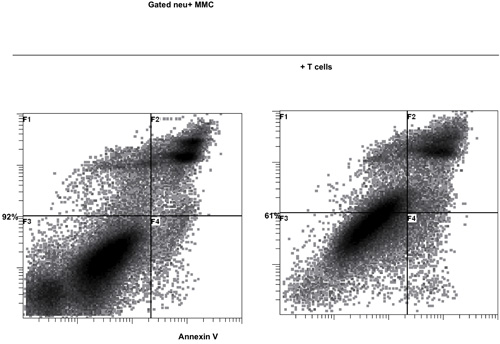
Abbildung 4. Zytotoxische Funktion der ex vivo expandierten T-Zellen mit der gamma-Kette Zytokine gegen neu positive Maus Mammakarzinom (MMC) Tumorzellen
Diskussion
Selektiver Ausbau von Tumor-reaktiven T-Zellen mit Effektorfunktionen Anti-Tumor-Funktion kann durch das vorgeschlagene Protokoll mit B erreicht werden / I Aktivierung und ex vivo Expansion mit der gamma-Kette Zytokine IL-2, IL-7 und IL-15. Während IL-2 ist ein T-Zell-Wachstumsfaktor, der die Differenzierung und Expansion von Antigen-spezifischen T-Zellen unterstützt, können IL-7 inhibiert die Apoptose von T-Zellen und unterstützen ihre Lebensfähigkeit während der Expansion. IL-15 unterstützt Memory T-Ze...
Offenlegungen
Danksagungen
Diese Arbeit wurde vom NIH R01 CA104757 Grant (MH Manjili) unterstützt. Wir danken für die Unterstützung der VCU Massey Cancer Center und dem Commonwealth Foundation for Cancer Research.
Materialien
| Name | Company | Catalog Number | Comments |
| Bryostatin 1 | Sigma-Aldrich | B7431-10ug | |
| Ionomycin | Calbiochem | 407950 | |
| Mouse IL-7 | PeproTech Inc | 217-17 | |
| Mouse IL-15 | PeproTech Inc | 210-15 | |
| Human IL-2 | PeproTech Inc | 200-02 | |
| RPMI1640 | Invitrogen | 11875 | |
| FBS | Gemini Bio Products | 100-106 | |
| Penicillin/Streptomycin | Cellgro | 30-002-CI | |
| L- glutamine | Invitrogen | 25030081 | |
| β- mercapt–thanol | Sigma-Aldrich | M7522 | |
| anti-CD16/32 antibody | Biolegend | 101302 | |
| Annexin V-FITC Apoptosis Detection Kit | BD Biosciences | 556547 | |
| FITC-CD4 | Biolegend | 100406 | |
| PE-CD8 | Biolegend | 100708 | |
| anti-c-Erb2/c–Neu | Calbiochem | OP16 | |
| PE- anti mouse IgG | Biolegend | 405307 | |
| formaldehyde | Polysciences, Inc. | 04018 | |
| Hemocytometer | Hycor | 87144 | |
| Light microscope | VWR international | V200073 | |
| Mouse IFN-γ ELISA set | BD Biosciences | 555138 | |
| Cell culture flasks | Greiner Bio-One | 658175 |
Referenzen
- Goodell, V., Waisman, J., Salazar, L. G., de la Rosa, C., Link, J., Coveler, A. L., Childs, J. S., Fintak, P. A., Higgins, D. M., Disis, M. L. Level of HER-2/neu protein expression in breast cancer may affect the development of endogenous HER-2/neu-specific immunity. Mol Cancer Ther. 7, 449-454 (2008).
- Disis, M. L., Knutson, K. L., Schiffman, K., Rinn, K., McNeel, D. G. Pre-existent immunity to the HER-2/neu oncogenic protein in patients with HER-2/neu overexpressing breast and ovarian cancer. Breast Cancer Res Treat. 62, 245-252 (2000).
- Liu, S., Riley, J., Rosenberg, S., Parkhurst, M. Comparison of common gamma-chain cytokines, interleukin-2, interleukin-7, and interleukin-15 for the in vitro generation of human tumor-reactive T lymphocytes for adoptive cell transfer therapy. J. Immunother. 29, 284-293 (2006).
- Bear, H. D., Roberts, J., Cornell, D., Tombes, M. B., Kyle, B. Adoptive immunotherapy of cancer with pharmacologically activated lymph node lymphocytes: a pilot clinical trial. Cancer Immunol Immunother. 5, 269-274 (2001).
- Morales, J. K., Kmieciak, M., Graham, L., Feldmesser, M., Bear, H. D., Manjili, M. H. Adoptive transfer of HER2/neu-specific T cells expanded with alternating gamma chain cytokines mediate tumor regression when combined with the depletion of myeloid-derived suppressor cells. Cancer Immunol Immunother. 58, 941-953 (2009).
- Cha, E., Graham, L., Manjili, M. H., Bear, H. D., Guy, C. T., Webster, M. A., Schaller, M., Parsons, T. J., Cardiff, R. D. IL-7 + IL-15 are superior to IL-2 for the ex vivo expansion of 4T1 mammary carcinoma-specific T cells with greater efficacy against tumors in vivo. Breast Cancer Res Treat. 89, 10578-10582 (2009).
- Kmieciak, M., Morales, J. K., Morales, J., Bolesta, E., Grimes, M., Manjili, M. H. Danger signals and nonself entity of tumor antigen are both required for eliciting effective immune responses against HER-2/neu positive mammary carcinoma: implications for vaccine design. Cancer Immunol Immunother. 57, 1391-1398 (2008).
- Stern, J. B., Smith, K. A. Interleukin-2 induction of T-cell G1 progression and c-myb expression. Science. 233, 203-206 (1986).
- Kittipatarin, C., Khaled, A. R. ex vivo expansion of memory CD8 T cells from lymph nodes or spleen through in vitro culture with interleukin-7. J Immunol Methods. 344, 45-57 (2009).
- Kokaji, A. I., Hockley, D. L., Kane, K. P. IL-15 transpresentation augments CD8+ T cell activation and is required for optimal recall responses by central memory CD8+ T cells. J Immunol. 180, 4391-4401 (2008).
- Le, H. K., Graham, L., Miller, C. H., Kmieciak, M., Manjili, M. H., Bear, H. D. Incubation of antigen-sensitized T lymphocytes activated with bryostatin 1 + ionomycin in IL-7 + IL-15 increases yield of cells capable of inducing regression of melanoma metastases compared to culture in IL-2. Cancer Immunol Immunother. 58, 1565-1576 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten