Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Expansion ex vivo des cellules tumorales T-réactive par le moyen de 1/Ionomycin Bryostatine et la chaîne gamma commune cytokines Formulation
Dans cet article
Résumé
Un protocole efficace pour la Ex vivo Extension de cellules T réactives tumeur des ganglions lymphatiques drainant la tumeur ou d'autres tissus lymphoïdes secondaires porteurs de tumeurs hôtes est décrite. Ce protocole étend sélectivement les cellules T spécifiques de la tumeur pour une utilisation en immunothérapie adoptive du cancer du sein.
Résumé
Il a été rapporté que les patients du cancer du sein ont pré-existante des réponses immunitaires contre leurs tumeurs 1,2. Cependant, ces réponses immunitaires ne parviennent pas à fournir une protection complète contre le développement ou la réapparition du cancer du sein. Pour surmonter ce problème en augmentant la fréquence des cellules T réactives tumeurs, immunothérapie adoptive a été employé. Une variété de protocoles ont été utilisés pour l'expansion des cellules T spécifiques de la tumeur. Ces protocoles, cependant, sont limités à l'utilisation d'antigènes tumoraux ex vivo pour l'activation des cellules T spécifiques de l'antigène. Très récemment, la chaîne gamma commune des cytokines comme l'IL-2, IL-7, l'IL-15 et IL-21 ont été utilisés seuls ou en association pour l'amélioration de l'anti-tumorale des réponses immunitaires 3. Toutefois, il n'est pas clair ce que la formulation serait le mieux pour l'expansion des cellules T réactives tumeur. Nous présentons ici un protocole pour l'activation sélective et l'expansion de la tumeur des cellules T réactives à partir du modèle de souris transgénique FVBN202 de carcinome mammaire HER-2/neu positifs pour une utilisation en thérapie cellulaire adoptive T du cancer du sein. Le protocole inclut l'activation des cellules T avec bryostatin-1/ionomycin (B / I) et l'IL-2 en l'absence d'antigènes tumoraux pour les 16 heures. B / Je activation imite signaux intracellulaires qui aboutissent à l'activation des cellules T en augmentant la protéine kinase C et de l'activité intracellulaire de calcium, respectivement 4. Ce protocole active spécifiquement les cellules T spécifiques de la tumeur tout en tuant les cellules T non pertinentes. Les cellules B / I-T activées sont cultivées avec de l'IL-7 et IL-15 pendant 24 heures puis pulsé avec de l'IL-2. Après 24 heures, les cellules T sont lavés, split, et cultivé avec de l'IL-7 + IL-15 pour les 4 jours supplémentaires. L'efficacité de tumeur spécificité et anti-tumorale des cellules T ex vivo élargi est déterminé.
Protocole
1. Isolement des lymphocytes 5
- Isoler les ganglions lymphatiques drainant la tumeur ou de rates de porteurs de tumeurs FVBN202 souris transgéniques et de préparer la suspension cellulaire unique glacée RPMI1640 complété avec 10% de FBS. B / I d'activation dans 50 ml résultats polypropylène tubes coniques en un rendement de plus de cellules T par rapport à des tubes en polystyrène. Kétamine et de xylazine sont injectés ip pour l'anesthésie. La dislocation cervicale est utilisée comme une méthode d'euthanasie.
- Culture des cellules (10 6 cellules / mL) dans un milieu complet contenant 15% de FBS avec bryostatine-1 (5 nM) et de l'ionomycine (1 uM) avec 80 U / ml d'IL-2 (Peprotech) pendant 16 h.
- Laver les cellules trois fois avec du milieu chaud (37 ° C) et la culture à 10 6 cellules / ml dans un milieu complet avec de l'IL-7 (10 ng / ml) et de l'IL-15 (10 ng / ml) (Peprotech) pendant 24 h .
- Impulsion des cellules avec de l'IL-2 (40 U / ml) pendant 24 h.
- Fractionner les cellules et la culture entre eux avec de l'IL-7 et IL-15 (10 ng / ml) pour 4 jours de plus. Changement moyen et fractionner les cellules si nécessaire tous les 2 jours.
2. Déterminer l'expansion des cellules T Pliez dénombrement des cellules et cytométrie en flux 5
- Numération des cellules par microscopie optique
- Préparer une dilution appropriée de cellules (1:100) dans le bleu trypan et ajouter quelques uL sur hématimètre
- Chef 9 places et de déterminer le nombre total de cellules en divisant numération cellulaire au nombre de chambres, multiplié par le facteur de dilution. Les résultats seront présents un nombre x 10 4 cellules / mL.
- Déterminer la proportion de cellules CD8 + et cellules T CD4 + dans les cellules élargi par cytométrie en flux
- Bloc de fixation non spécifique des anticorps aux récepteurs Fc par culture des cellules avec des anticorps anti-CD16/CD32 (Biolegend) pendant 20 min sur la glace, puis laver les cellules deux fois avec 2 ml de PBS glacé complété par de l'azide de sodium à 1% .
- Colorer les cellules en culture avec FITC-CD4 et CD8-PE pendant 20 min sur la glace, puis laver les cellules deux fois avec 2 ml de PBS glacé supplémenté avec 1% de FBS et de l'azide de sodium à 0,1%.
- Fixer les cellules avec du paraformaldéhyde à 1% et exécuter des échantillons sur un FC 500 de Beckman Coulter et d'analyser en utilisant la version 4.3 du logiciel du Sommet.
3. Déterminer Tumor-spécificité de l'ex vivo élargi cellules T
- Culture de l'ex vivo les lymphocytes élargi dans un milieu complet à un ratio 10:1 avec irradiés neu positifs cellules tumorales MMC (15 000 rad) pendant 24 h. 5
- Surnageants récolte et conserver à -80 ° C jusqu'à leur utilisation. 5,6
- Détecter l'IFN-γ en utilisant une souris IFN-γ ELISA Set (BD Pharmingen) selon le protocole du fabricant 5,6.
4. Déterminer la fonction anti-tumorale des cellules T ex vivo élargi 5,6
- Incuber les cellules T avec des cellules tumorales dans un effecteur 10h01: ratios cibles pendant 48 heures dans un milieu complet à 3 mL de milieu complet (RPMI-1640 complété par 100U / mL de pénicilline, 100 pg / ml de streptomycine, 10% de FBS, la glutamine et β - mercaptoéthanol) et 20U / mL d'IL-2 (Peprotech) dans 6 boîtes de culture ainsi 37 ° C CO / 5% 2.
- Effectuer trois coloration des anticorps couleur pour neu (anti-c-Erb2/c-neu, clone-4, Calbiochem), suivie par PE anti-IgG de souris, l'annexine V-FITC et l'iodure de propidium (PI) selon le protocole du fabricant (BD Pharmingen)
- La viabilité porte sur les cellules tumorales positives neu et d'analyser (annexine V-/PI-) des cellules tumorales
5. Modèle murin de cancer du sein
FVBN202 souris transgéniques femelles (Charles River Laboratories) peut être utilisé pour la source de cellules T réactives tumeur. Ces souris surexprimant une non activé chez le rat neu transgène sous le contrôle du promoteur MMTV et par conséquent développer des carcinomes mammaires spontanées entre 4-10 mois d'âge 7. Ces souris développent précancéreuses hyperplasie mammaire semblable à un carcinome canalaire in situ (CCIS) avant le développement de carcinoma8 spontanée. Spontanée souris porteuses de tumeurs sont utilisés comme donneurs des cellules T.
6. Les résultats représentatifs:
L'activation des cellules T avec B / I pour les résultats heures 16 en tuant des cellules T naïves qui ne sont pas sensibilisés à la tumeur in vivo. Après la sélectivité B / I des lymphocytes T tumoraux réactive ils étendent jusqu'à 2,8 fois dans une culture de 6 jours avec les cytokines chaîne gamma (figure 1). Les deux CD8 + et cellules T CD4 + sont également élargi avec les cytokines chaîne gamma (figure 2). L'ex vivo des cellules T-élargi montrent une grande réactivité contre les tumeurs que les souris ont été sensibilisées aux donateurs, tel qu'évalué par la production d'IFN-γ, en présence d'un carcinome mammaire de neu souris positives (MMC) des cellules tumorales (figure 3). L'expansion ex vivo des cellules T peut induire l'apoptose dans les tumeurs neu cel positifs MMCls tels que la viabilité des cellules tumorales baisses de 92% à 61% dans les 48 heures (figure 4).
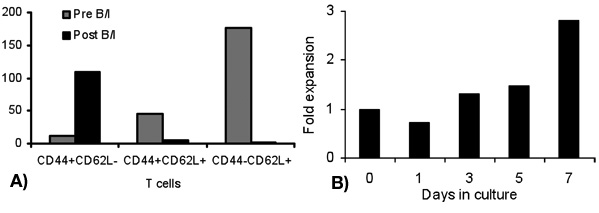
Figure 1. Pliez l'expansion des lymphocytes à différents moments suivants B / I d'activation (jour 1) et l'expansion ex vivo avec des cytokines chaîne gamma (jours 3, 5 et 7)
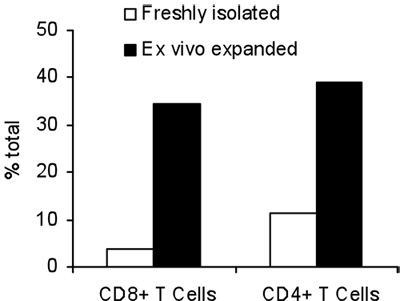
Figure 2. Pourcentage total de lymphocytes CD4 + et CD8 + T avant et après une expansion de 7 jours avec les cytokines chaîne gamma.
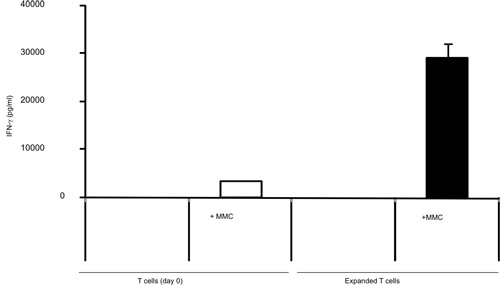
Figure 3. Tumorale stimulée par la production d'IFN-γ par les lymphocytes T isolés de souris porteuses de tumeurs avant et après une expansion de 7 jours avec les cytokines chaîne gamma, IFN-γ en utilisant ELISA
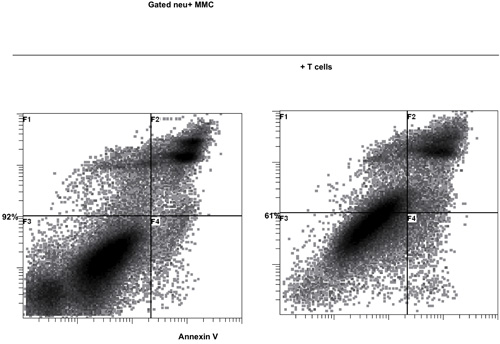
Figure 4. Fonction cytotoxique de l'expansion ex vivo des cellules T avec les cytokines chaîne gamma contre le carcinome mammaire de neu souris positives (MMC) des cellules tumorales
Discussion
L'expansion sélective des cellules T tumeur réactive avec effecteur la fonction anti-tumorale peut être réalisé en utilisant le protocole proposé B / I d'activation et l'expansion ex vivo avec des cytokines chaîne gamma IL-2, IL-7 et IL-15. Alors que l'IL-2 est un facteur de croissance des cellules T qui peuvent soutenir la différenciation et l'expansion des cellules T spécifiques de l'antigène, l'IL-7 peut inhiber l'apoptose des cellules T et le soutien de leur viabili...
Déclarations de divulgation
Remerciements
Ce travail a été soutenu par des subventions du NIH R01 CA104757 (MH Manjili). Nous tenons à souligner l'appui de la VCU Massey Cancer Center et la Fondation du Commonwealth pour la recherche sur le cancer.
matériels
| Name | Company | Catalog Number | Comments |
| Bryostatin 1 | Sigma-Aldrich | B7431-10ug | |
| Ionomycin | Calbiochem | 407950 | |
| Mouse IL-7 | PeproTech Inc | 217-17 | |
| Mouse IL-15 | PeproTech Inc | 210-15 | |
| Human IL-2 | PeproTech Inc | 200-02 | |
| RPMI1640 | Invitrogen | 11875 | |
| FBS | Gemini Bio Products | 100-106 | |
| Penicillin/Streptomycin | Cellgro | 30-002-CI | |
| L- glutamine | Invitrogen | 25030081 | |
| β- mercapt–thanol | Sigma-Aldrich | M7522 | |
| anti-CD16/32 antibody | Biolegend | 101302 | |
| Annexin V-FITC Apoptosis Detection Kit | BD Biosciences | 556547 | |
| FITC-CD4 | Biolegend | 100406 | |
| PE-CD8 | Biolegend | 100708 | |
| anti-c-Erb2/c–Neu | Calbiochem | OP16 | |
| PE- anti mouse IgG | Biolegend | 405307 | |
| formaldehyde | Polysciences, Inc. | 04018 | |
| Hemocytometer | Hycor | 87144 | |
| Light microscope | VWR international | V200073 | |
| Mouse IFN-γ ELISA set | BD Biosciences | 555138 | |
| Cell culture flasks | Greiner Bio-One | 658175 |
Références
- Goodell, V., Waisman, J., Salazar, L. G., de la Rosa, C., Link, J., Coveler, A. L., Childs, J. S., Fintak, P. A., Higgins, D. M., Disis, M. L. Level of HER-2/neu protein expression in breast cancer may affect the development of endogenous HER-2/neu-specific immunity. Mol Cancer Ther. 7, 449-454 (2008).
- Disis, M. L., Knutson, K. L., Schiffman, K., Rinn, K., McNeel, D. G. Pre-existent immunity to the HER-2/neu oncogenic protein in patients with HER-2/neu overexpressing breast and ovarian cancer. Breast Cancer Res Treat. 62, 245-252 (2000).
- Liu, S., Riley, J., Rosenberg, S., Parkhurst, M. Comparison of common gamma-chain cytokines, interleukin-2, interleukin-7, and interleukin-15 for the in vitro generation of human tumor-reactive T lymphocytes for adoptive cell transfer therapy. J. Immunother. 29, 284-293 (2006).
- Bear, H. D., Roberts, J., Cornell, D., Tombes, M. B., Kyle, B. Adoptive immunotherapy of cancer with pharmacologically activated lymph node lymphocytes: a pilot clinical trial. Cancer Immunol Immunother. 5, 269-274 (2001).
- Morales, J. K., Kmieciak, M., Graham, L., Feldmesser, M., Bear, H. D., Manjili, M. H. Adoptive transfer of HER2/neu-specific T cells expanded with alternating gamma chain cytokines mediate tumor regression when combined with the depletion of myeloid-derived suppressor cells. Cancer Immunol Immunother. 58, 941-953 (2009).
- Cha, E., Graham, L., Manjili, M. H., Bear, H. D., Guy, C. T., Webster, M. A., Schaller, M., Parsons, T. J., Cardiff, R. D. IL-7 + IL-15 are superior to IL-2 for the ex vivo expansion of 4T1 mammary carcinoma-specific T cells with greater efficacy against tumors in vivo. Breast Cancer Res Treat. 89, 10578-10582 (2009).
- Kmieciak, M., Morales, J. K., Morales, J., Bolesta, E., Grimes, M., Manjili, M. H. Danger signals and nonself entity of tumor antigen are both required for eliciting effective immune responses against HER-2/neu positive mammary carcinoma: implications for vaccine design. Cancer Immunol Immunother. 57, 1391-1398 (2008).
- Stern, J. B., Smith, K. A. Interleukin-2 induction of T-cell G1 progression and c-myb expression. Science. 233, 203-206 (1986).
- Kittipatarin, C., Khaled, A. R. ex vivo expansion of memory CD8 T cells from lymph nodes or spleen through in vitro culture with interleukin-7. J Immunol Methods. 344, 45-57 (2009).
- Kokaji, A. I., Hockley, D. L., Kane, K. P. IL-15 transpresentation augments CD8+ T cell activation and is required for optimal recall responses by central memory CD8+ T cells. J Immunol. 180, 4391-4401 (2008).
- Le, H. K., Graham, L., Miller, C. H., Kmieciak, M., Manjili, M. H., Bear, H. D. Incubation of antigen-sensitized T lymphocytes activated with bryostatin 1 + ionomycin in IL-7 + IL-15 increases yield of cells capable of inducing regression of melanoma metastases compared to culture in IL-2. Cancer Immunol Immunother. 58, 1565-1576 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon